Барорецепторный рефлекс. Роль барорецепторов в регуляции артериального давления
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
АД поддерживается на необходимом рабочем уровне с помощью рефлекторных контролирующих механизмов, функционирующих на основании принципа обратной связи.
Барорецепторный рефлекс. Один из хорошо известных нервных механизмов контроля АД — барорецепторный рефлекс. Барорецепторы имеются в стенке почти всех крупных артерий в области грудной клетки и шеи, особенно много барорецепторов в каротидном синусе и в стенке дуги аорты. Барорецепторы каротидного синуса (см. рис 25-10) и дуги аорты не реагируют на АД в пределах от 0 до 60-80 мм рт.ст. Рост давления выше этого уровня вызывает ответную реакцию, которая прогрессивно возрастает и достигает максимума при АД около 180 мм рт.ст. Нормальное АД (его систолический уровень) колеблется в пределах 110-120 мм рт.ст. Небольшие отклонения от этого уровня усиливают возбуждение барорецепторов. Барорецепторы отвечают на изменения АД очень быстро: частота импульсации возрастает во время систолы и так же быстро уменьшается во время диастолы, что происходит в течение долей секунды. Таким образом, барорецепторы более чувствительны к изменениям давления, чем к его стабильному уровню.
Усиленная импульсация от барорецепторов, вызванная подъёмом АД, поступает в продолговатый мозг,тормозит сосудосуживающий центр продолговатого мозга и возбуждает центр блуждающего нерва. В результате происходит расширение просвета артериол, уменьшается частота и сила сердечных сокращений. Другими словами, возбуждение барорецепторов рефлекторно приводит к снижению АД за счёт уменьшения периферического сопротивления и сердечного выброса.
Низкое АД оказывает противоположное действие, что приводит к его рефлекторному повышению до нормального уровня. Снижение давления в области каротидного синуса и дуги аорты инактивирует барорецепторы, и они перестают оказывать тормозящее влияние на сосудодвигательный центр. В итоге последний активируется и вызывает повышение АД.
Ортостатический коллапс. Барорецепторный рефлекс принимает участие в поддержании АД при смене горизонтального положения на вертикальное. Сразу после принятия вертикального положения АД в голове и верхней части туловища снижается, что может вызвать потерю сознания (что и происходит в ряде случаев при недостаточности барорецепторного рефлекса — это состояние называют ортостатическим обмороком). Падение давления в области барорецепторов немедленно активирует рефлекс, возбуждающий симпатическую систему и минимизирующий уменьшение давления в верхней части туловища и голове.
Хеморецепторы каротидного синуса и аорты. Хеморецепторы — хемочувствительные клетки, реагирующие на недостаток кислорода, избыток углекислого газа и водородных ионов — расположены в каротидных тельцах и в аортальных тельцах. Хеморецепторные нервные волокна от телец вместе с барорецепторными волокнами идут в сосудодвигательный центр продолговатого мозга. При уменьшении АД ниже критического уровня хеморецепторы стимулируются, поскольку снижение кровотока уменьшает содержание O2и увеличивает концентрацию CO2и H + . Таким образом, импульсация от хеморецепторов возбуждает сосудодвигательный центр и способствуют повышению АД.
Рефлексы с лёгочной артерии и предсердий. В стенке обоих предсердий и лёгочной артерии имеются рецепторы растяжения (рецепторы низкого давления). Рецепторы низкого давления воспринимают изменения объёма, происходящие одновременно с изменениями АД. Возбуждение этих рецепторов вызывает рефлексы параллельно с барорецепторными рефлексами.
Рефлексы с предсердий, активирующие почки. Растяжение предсердий вызывает рефлекторное расширение афферентных (приносящих) артериол в клубочках почек. Одновременно сигнал поступает из предсердия в гипоталамус, уменьшая секрецию АДГ. Комбинация двух эффектов — увеличения клубочковой фильтрации и уменьшения реабсорбции жидкости — способствует уменьшению объёма крови и возвращению его к нормальному уровню.
Рефлекс с предсердий, контролирующий ЧСС. Увеличение давления в правом предсердии вызывает рефлекторное увеличение ЧСС (рефлекс Бейнбриджа). Рецепторы растяжения предсердия, вызывающие рефлекс Бейнбриджа, передают афферентные сигналы через блуждающий нерв в продолговатый мозг. Затем возбуждение возвращается обратно к сердцу по симпатическим путям, увеличивая частоту и силу сокращений сердца. Этот рефлекс препятствует переполнению кровью вен, предсердий и лёгких.
Непосредственные влияния на сосудодвигательный центр. Если кровообращение в области ствола мозга уменьшается, вызывая ишемию мозга, то возбудимость нейронов сосудодвигательного центра значительно возрастает, приводя к максимальному подъёму системного АД. Этот эффект вызывается локальным накоплением CO2, молочной кислоты и других кислых веществ и их возбуждающим действием на симпатический отдел сосудодвигательного центра. Ишемический ответ ЦНС на кровообращение необычайно велик: в течение 10 мин среднее АД иногда может подняться до 250 мм рт.ст. Ишемический ответ ЦНС — один из самых мощных активаторов симпатической сосудосуживающей системы. Этот механизм возникает при падении АД до 60 мм рт.ст. и ниже, что бывает при большой кровопотере, циркуляторном шоке, коллапсе. Это реакция спасительной контрольной системы давления, предохраняющая дальнейшее падение АД до летального уровня.
РефлексКушинга(реакция Кушинга) — ишемическая реакция ЦНС в ответ на повышение внутричерепного давления. Если внутричерепное давление повышается и становится равным АД, то в полости черепа сдавливаются артерии и возникает ишемия. Ишемия вызывает повышение АД, и кровь снова поступает в мозг, преодолевая сдавливающее действие повышенного внутричерепного давления. Одновременно с повышением давления ритм сердца и частота дыхания становятся реже из-за возбуждения центра блуждающего нерва.
Участие артериального барорецепторного рефлекса в долговременной регуляции артериального давления
В экспериментах на лабораторных крысах - самцах линии Wistar - показано, что у крыс с интактным барорецепторным рефлексом после наложения зажима на левую почечную артерию артериальная гипертензия развилась менее, чем у половины животных. Выявлена обратная корреляция между степенью повышения артериального давления и исходной величиной барорецепторного рефлекса. У крыс с предварительно нарушенным барорецепторным рефлексом вазоренальная артериальная гипертензия развилась у всех животных. Высказывается предположение, что интактный барорецепторный рефлекс препятствует развитию артериальной гипертензии, и этот факт противоречит утверждению о том, что барорецепторный рефлекс не принимает участия в долговременной регуляции артериального давления.
Ключевые слова
Об авторах
ФГУ «Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова Росмедтехнологий» (ФГУ ФЦСКиЭ)
Россия
Список литературы
1. Cowley A.W. Letter to the editor comment baroreceptor denervation hypertension? // Circ. Res. - 1981. - Vol. 48. - P. 587-589.
3. Cowley A.W., Liard J.F., Guyton A.C. Role of baroreceptor reflex in daily control of arterial blood pressure and other variables in dogs // Circ. Res. - 1973. - Vol. 32, № 5. - P. 564-576.
5. Guyton A.C., Coleman T.G., Cowley A.W. et al. Systems analysis of arterial pressure regulation and hypertension // Ann. Biomed. Eng. - 1972. - Vol. 1, № 2. - P. 254-281.
7. Guyton A.C. Dominant role of the kidneys and accessory role of whole-body autoregulation in the pathogenesis of hypertension // Am. J. Hypertens. - 1989. - Vol. 2, № 7. - P. 575-585.
9. Еремеев В.С., Цырлин В.А. Нейрогенная гипертензия: история и современное состояние проблемы // Артериальная гипертензия. - 1995. - Т. 1. - C. 50-56.
11. Вальдман А.В., Алмазов В.А., Цырлин В.А. Барорецепторные рефлексы. - Л.: Наука, 1988. - 140 с.
13. Цырлин В.А. Организация и супрабульбарный контроль дуги барорецепторного рефлекса // Успехи физиол. наук. - 1986. - Т. 17, № 4. - С. 24-37.
15. Гавриков К.Е. Автоматическая система для регистрации и анализа артериального давления и периода сердечных сокращений у бодрствующих животных // Физиол. журн. СССР. - 1991. - Т. 77. - С. 102-105.
17. Smyth H.S., Sleight P.S., Pickering G.W. Reflex regulation of arterial pressure during sleep in man // Circul. Res. - 1969. - Vol. 24. - P. 109-121.
19. McCubbin J.W., Green J.H., Page J.H. Baroreceptor function in chronic renal hypertension // Circ. Res. - 1956. - Vol. 4. - P. 205-210.
21. Edmunds M.E., Russel G.I., Burton P.R., Swales J.D. Baroreceptor-heart rate reflex function before and after surgical reversal of two-kidney, one clip hypertension in the rat // Circ. Res. - 1990. - Vol. 66, № 6. - P. 1673-1680.
23. Guo G.B., Thames M.D. Abnormal baroreflex control in renal hypertension is due to abnormal baroreceptors // Am. J. Physiol. - 1983. - Vol. 245, № 3. - P. H420-H428.
25. Mancia G., Ferrari A., Leontelli G. et al. Carotid sinus baroreceptor control of arterial pressure in renovascular hypertensive subjects // Hypertens. - 1982. - Vol. 4, № 1. - P. 47-50.
27. Sleight P., Robinson J.L., Brooks D.E., Rees P.M. Characteristics of single carotid sinus baroreceptor fibers and whole nerve activity in the normotensive and the renal hypertensive dog // Circ. Res. - 1977. - Vol. 41, № 6. - P. 750-758.
29. Ricksten S.E., Thoren P. Reflex control of sympathetic nerve activity and heart rate from arterial baroreceptors in conscious spontaneously hypertensive rats // Clin. Sci. (Lond.) - 1981. - Vol. 61 (suppl. 1). - P. 169s-172s.
31. Rodrigues M.C., Campagnole-Santos M.J., Machado R.P. et al. Evidence for a role of AT (2) receptors at the CVLM in the cardiovascular changes induced by low-intensity physical activity in renovascular hypertensive rats // Peptides. - 2007. - Vol. 28, № 7. - P. 1375-1382.
33. Allen A.M., MacGregor D.P., McKinley M.J., Mendelsohn F.A. Angiotensin II receptors in the human brain // Regul. Pept. - 1999. - Vol. 79, № 1. - P. 1-7.
35. Dampney R.A., Fontes M.A., Hirooka Y. et al. Role of angiotensin II receptors in the regulation of vasomotor neurons in the ventrolateral medulla // Clin. Exp. Pharmacol. Physiol. - 2002. - Vol. 29, № 5-6. - P. 467-472
Адренергические и имидазолиновые механизмы функционирования артериального барорецепторного рефлекса в краткосрочной и долговременной регуляции артериального давления
Цель настоящей работы заключалась в изучении того, как избирательная активация центральных адренергических и имидазолиновых рецепторов в условиях покоя и эмоционального напряжения влияет на функциональное состояние артериального барорецепторного рефлекса (БР) в кратковременной и долговременной регуляции артериального давления (АД).
Материалы и методы. Эксперименты проводились на бодрствующих крысах линии Wistar. Для активации адренергических рецепторов был использован клонидин (в дозах 1 и 10 мг/кг), для активации имидазолиновых рецепторов — моксонидин (в дозах 10 и 100 мг/кг). Эмоциональное напряжение вызывалось звуковым сигналом — звонком.
Результаты. Проведенные исследования показали, что активация имидазолиновых рецепторов центральной нервной системы не изменяет уровень АД, в то время как в центральной регуляции исходного тонуса сосудов и деятельности сердца активную роль играют альфа 2‑адренергические системы. Показано, что в функ- ционировании БР участвуют как имидазолиновые, так и альфа 2‑адренергические системы.
Выводы. Активация имидазолиновых рецепторов у крыс, находящихся в условиях эмоционального напряжения, восстанавливает исходный БР и уменьшает подъем АД. Альфа 2‑адренергические системы не имеют существенного значения в реализации сердечно-сосудистых проявлений эмоционального напряжения.
Федеральное государственное бюджетное учреждение «Северо-Западный федеральный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации; Государственное бюджетное образовательное учреждение высшего профессионального образования «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации
Россия
кандидат биологических наук, старший научный сотрудник отдела экспериментальной физиологии и фармакологии, ул. Аккуратова, д. 2, Санкт-Петербург,197341;
лаборатория биофизики кровообращения, Санкт-Петербург
кандидат медицинских наук, заведующий отделом экспериментальной физиологии и фармакологии, ул. Аккуратова, д. 2, Санкт-Петербург,197341;
заведующий лабораторией биофизики кровообращения, Санкт-Петербург
младший научный сотрудник отдела экспериментальной физиологии и фармакологии, ул. Аккуратова, д. 2, Санкт-Петербург,197341;
доктор медицинских наук, главный научный сотрудник отдела экспериментальной физиологии и фармакологии, ул. Аккуратова, д. 2, Санкт-Петербург,197341;
доктор медицинских наук, главный научный сотрудник отдела экспериментальной физиологии и фармакологии, Санкт-Петербург
1. Шляхто Е.В., Плисс М. Г., Цырлин В. А. Барорецепторный рефлекс и долговременная регуляция артериального давления. СПб.; 2011. 153 с. [Shlyakhto EV, Pliss MG, Tsyrlin VA. Baroreceptor reflex and long-time regulation of arterial pressure. St Petersburg; 2011.153 p. In Russian].
2. Tsyrlin VA, Bravkov MF. Effects of alpha-adrenoceptor stimulating drugs on baroreceptor reflex in conscious cats. Eur J Pharmacol. 1980;67:75-83.
3. Bousquet P, Feldman J, Schwartz J. Central cardiovascular effects of alfa adrenergic drugs: differences between catecholamines and imidazolines. J Pharmacol Exp Ther. 1984;230(1):232-236.
4. Гавриков К. Е. Автоматизированная установка для регистрации и анализа артериального давления и периода сердечных сокращений у бодрствующих животных. Физиол. журн. СССР. 1991;77(12):102-105. [Gavrikov KE. The automated system for registration and analysis of blood pressure and heart rate period in awake animals. Physiological journal of USSR. 1991;77 (12):102-105. In Russian].
5. Бравков М. Ф., Бершадский Б. Г. Роль барорецепторов в регуляции сердечного ритма у бодрствующих животных. Физиол. журн. СССР. 1978:64;475-482. [Bravkov MF, Bershadsky BG. Role of baroreceptors in the regulation of cardiac rhythm in awake animals. Physiological journal of USSR. 1978:64;475-482. In Russian].
6. Tsyrlin VA, Pliss MG, Patkina NA, Bershadsky BG, Eremeev VS. Baroreceptor reflex inhibition as a mechanism for raising blood pressure under negative emotions. In: Systems Research in Physiology, Gordon and Breach Science Publishers. Amsterdam. 1989;3:329-341.
7. Smyth HS, Sleight PS, Pickering GW. Reflex regulation of arterial pressure during sleep in man. Circulat Res. 1969;24:109-121.
8. Korner PI. Central nervous control of autonomic functionpossible implications in the pathogenesis of hypertension. Circul Res. 1970;27(l.II):159-168.
9. Osborn JW. Hypothesis: set-points and long-term control of arterial pressure. A theoretical argument for a long-term arterial pressure control system in the brain rather than the kidney. Clin Exper Pharmacol Physiol. 2005;32:384-393.
11. Malpas SC. What sets the long-term level of sympathetic nerve activity: is there a role for arterial baroreceptors? Am J Physiol Regul Integr Comp Physiol. 2004;286(1): R1-R12.
13. Thrasher TN. Baroreceptors and the long-term control of blood pressure. Exp physiol. 2004;89(4):331-335.
14. Adams DB, Bacelli G, Mancia G, Zanchetti A. Cardiovascular changes during naturalli elicited fighting behavior in the cat. Am J Physiol. 1969;216(5):1226-1235.
15. Korner P, West M, Shaw I. Central nervous resetting of baroreceptor reflexes. Australian J Exp Biol Med Sci. 1973;51 (1):53-54.
16. Цырлин В.А., Плисс М.Г. Обеспечение гипертензии при аверсивных эмоциогенных воздействиях как одна из функций барорецепторного рефлекса. Бюлл. экспер. биол. мед. 1985;5:56-59. [Tsyrlin VA, Pliss MG. Ensuring of hypertension with aversive emotiogenic effects as one of the functions of the baroreceptor reflex. Bulletin of Experimental Biology and Medicine. 1985;5:56-59. In Russian].
17. Nikolic K, Agbaba D. Imidazoline antihypertensive drugs: elective i (1)-imidazoline receptor activation. Cardiovasc Ther. 2012;30(4):209-216.
18. Boblewski K, Lehmann A, Saczewski F, Kornicka A, Rybczyńska A. Vagotomy reveals the importance of the imidazoline receptors in the cardiovascular effects of marsanidine and 7-MEmasanidine in rats. Pharmacol Rev. 2014;66(5):874-879.
19. Karlafti EF, Hartzitolios AI, Karlaftis AF, Baltatzi MS, Koliakos GG, Savopoulos CG. Effects of moxonidine on sympathetic nervous system activity: an update on metabolism, cardio, and other target organ protection. J Pharm Bioallied Sci. 2013;5 (4):253-256.
20. Rusu G, Mutitelu-Tartau L, Lupusoru CE, Lupusoru RV, Grigoraş I, Popa G et al. Imidazoline receptor antagonists idazoxan and efaroxan enhance locomotor function in rats. Rev Med Chir Soc Med Nat Lasi. 2015;119(1):193-200.
7. Барорецепторные рефлексы регуляции ад:
Увеличение артериального давления => Раздражение барорецепторов высокого давления рецепторной зоны дуги аорты => Увеличение частоты импульсации в афферентных нервных волокнах, идущих в составе депрессорного нерва (веточка вагуса) => Активация депрессорной зоны сосудодвигательного центра в передних отделах продолговатого мозга у нижнего угла ромбовидной ямки (гигантоклеточное ретикулярное ядро, ретикулярное вентральное ядро, каудальное и оральное ядра моста, заднее ядро Х нерва) => Активация ядер блуждающего нерва (парасимпатической нервной системы) через медиатор ацетилхолина на м-хр приводит к снижению частоты работы сердца (подавление активности аденилатциклазы и открытие К каналов в кардиомиоцитах СА узла), уменьшению скорости распространения возбуждений по проводящей системе сердца, силы сокращений предсердий и желудочков => Уменьшение ударного и минутного объемов крови => Снижение артериального давления
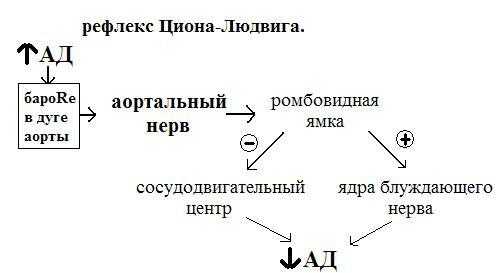
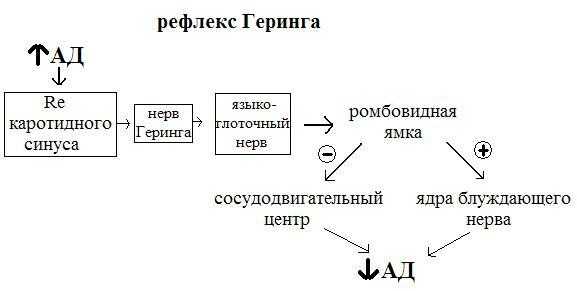
- блок-схема рефлекса регуляции АД с синокаротидных рефлексогенных зон (рефлекс Геринга).
Снижение артериального давления (например, в результате кровотечения) => Раздражение барорецепторов каротидного синуса сонных артерий => Изменение частоты возбуждений, идущих от этой рецепторной зоны по нервным волокнам в составе языкоглоточного нерва (нерв Геринга) в сосудодвигательный центр => Активация прессорной зоны сосудодвигательного центра, расположенного в заднебоковых отделах продолговатого мозга на уровне нижнего угла ромбовидной ямки (ядро одиночного пути, латеральное и парамедианное ретикулярное ядро, хеморецепторная зона дыхательного центра). Нейроны этой зоны имеют эфферентный выход на симпатические центры: Th-5 - для сердца (и Th1,-L2 - для сосудов) => Активация центров симпатической нервной системы вызывает с помощью медиатора норадреналина и β1 -адренорецепоров положительный хроно-, ино-, дромотропный эффекты => Увеличение ударного и минутного объемов крови => Увеличение артериального давления.
8. Почечный эндокринный контур регуляции ад.
К эндокринным аппаратам почек относят: - Юкстагломеруллярный аппарат (ЮГА), выделяют ренин и эритропоэтин;
- Интерстициальные клетки мозгового вещества и нефроциты собирательных трубок, вырабатывают простагландины;
- Клетки APUD-системы, содержащие серотонин.
Данный механизм адаптации также в основном противодействует острой артериальной гипотензии. Начальным звеном почечного эндокринного контура является юкстагломерулярный аппарат почек, в клетках которого синтезируется ренин. В норме около 80 % ренина находится в плазме в неактивной или малоактивной форме (проренин). Главным активатором проренина считается плазменный калликреин. Поврежденная почка в отличие от здоровой преимущественно секретирует активный ренин. К увеличению секреции ренина приводят снижение перфузионного давления в артериолах почек, снижение транспорта ионов С1 в восходящем колене петли Генле, усиление b-адренергической стимуляции.
Кроме того, секреция ренина зависит от содержания в крови катехоламинов, простагландина (простациклина), глюкагона, ионов Na и К, ангиотензина П. Увеличение концентрации последнего тормозит секрецию ренина по механизму отрицательной обратной связи. Образование ренина снижается при увеличении объема внеклеточной жидкости и содержания ионов Na в плазме.
При взаимодействии с ангиотензиногеном образуется ангиотензин I. В физиологических условиях плазменная концентрация ангиотензиногена, вырабатываемого в печени, является достаточно стабильной и регулируется уровнем ангиотензина II по механизму обратной связи. Ангиотензин I считается промежуточной субстанцией, но также самостоятельно усиливает высвобождение норадреналина из окончаний симпатических нервов и вызывает прессорную сосудистую реакцию на периферии.
В результате воздействия на ангиотензин I превращающего (конвертирующего) фермента образуется ангиотензин II. Ангиотензин II — наиболее мощный вазопрессор, сосудосуживающая активность которого в 50 раз выше, чем у норадреналина. В случае острого снижения АД образование ренина и ангиотензина II возрастает. Последний совместно с норадреналином восстанавливает нормальное АД, воздействуя на специфические ангиотензиновые рецепторы артериол (имеется 2 типа ангиотензиновых рецепторов, находящихся в различных тканях). При этом увеличивается концентрация ионов Са в миоплазме гладкомышечных клеток артериол, что приводит к повышению их тонуса. Для развития максимального эффекта данного механизма требуется около 20 мин.
Другие механизмы восстановления АД при развитии острой гипотензии с участием ангиотензина II реализуются путем непосредственного его взаимодействия с центральными и периферическими звеньями симпатического отдела вегетативной нервной системы. Основным местом центрального нейрогенного прессорного эффекта ангиотензина II является area postrema продолговатого мозга. Быстрый компонент возникающей ответной реакции обеспечивается благодаря повышению симпатической активности на периферии. Ангиотензин II, воздействуя на определенные участки ЦНС, не только способствует повышению системного АД, но и усиливает чувство жажды, выделение антидиуретического гормона вазопрессина.
Периферические прессорные реакции ангиотензина II связаны с высвобождением адреналина из мозгового слоя надпочечников и норадреналина из окончаний постганглионарных симпатических волокон. Кроме того, ангиотензин II повышает чувствительность гладкомышечных клеток сосудов к сосудосуживающему действию норадреналина.
Ангиотензин II расщепляется с участием ферментов плазмы с образованием ангиотензина III. Периферическая и центральная прессорная активность последнего в 2 раза ниже, чем ангиотензина II. Разрушение ангиотензина II и его удаление из кровеносного русла компенсируются усилением секреции ренина и новым образованием ангиотензина П. Все три ангиотензина участвуют в регуляции внутрипочечного кровотока.
БАРОРЕЦЕПТОРНЫЙ РЕФЛЕКС И АДАПТАЦИЯ ВИСЦЕРАЛЬНЫХ СИСТЕМ ПРИ РАЗВИТИИ РЕНОВАСКУЛЯРНОЙ ГИПЕРТЕНЗИИ
Цель настоящего исследования заключалась в проверке гипотезы о том, что артериальный барорецепторный рефлекс является одним из факторов, обеспечивающих феномен адаптации висцеральных систем к длительному афферентному воздействию.
Материалы и методы. В экспериментах на крысах линии Wistar создавалась артериальная вазоренальная гипертензия в модели «две почки — один зажим». В отдельной серии наблюдений животные либо до, либо через 8 недель после наложения зажима на почечную артерию подвергались двусторонней бароденервации основных механорецепторных зон.
Результаты. Проведенные эксперименты показали, что клипирование почечной артерии у крыс с интактными сино-каротидно-аортальными механорецепторными зонами только у 17 % животных вызывает стойкое повышение артериального давления (АД). Отсутствие артериальной гипертензии (АГ) у этих животных, вероятно, связано с возникновением феномена адаптации системы кровообращения к длительному афферентному воздействию из почки с перевязанной артерией. Установлено, что денервация основных механорецепторных зон, предшествующая клипированию почечной артерии, в 100 % случаев способствует развитию АГ. В то же время денервация сино-каротидных зон и дуги аорты у крыс, у которых АГ не развивалась через 8 недель после клипирования почечной артерии, не оказывает существенного влияния на уровень АД.
Выводы. Высказывается предположение, что отсутствие гипертензии после стенозирования почечной артерии свидетельствует о том, что произошла адаптация системы кровообращения к длительной афферентации из почки, и денервация механорецепторных зон крупных сосудов в этих условиях не изменяет этого процесса. В то же время нарушение артериального барорецепторного рефлекса до наложения зажима на почечную артерию способствует нарушению феномена адаптации висцеральных систем к афферентному воздействию и возникновению АГ.
Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова, Санкт-Петербург: Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург
Россия
Доктор медицинских наук, профессор, заведующий отделом экспериментальной физиологии и фармакологии ФЦСКЭ им. В.А. Алмазова, заведующий лабораторией биофизики кровообращения Института сердечно-сосудистых заболеваний СПбГМУ им. акад. И.П. Павлова
Кандидат биологических наук, старший научный сотрудник отдела экспериментальной физиологии и фармакологии ФЦСКЭ им. В.А. Алмазова, лаборатории биофизики кровообращения Института сердечно-сосудистых заболеваний СПбГМУ им. акад. И.П. Павлова.
Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова, Санкт-Петербург: Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург
Россия
Кандидат медицинских наук, старший научный сотрудник отдела экспериментальной физиологии и фармакологии ФЦСКЭ им. В.А. Алмазова, лаборатории биофизики кровообращения Института сердечно-сосудистых заболеваний СПбГМУ им. акад. И.П. Павлов
Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова, Санкт-Петербург: Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург
Россия
Младший научный сотрудник отдела экспериментальной физиологии и фармакологии ФЦСКЭ им. В.А. Алмазова, лаборатории биофизики кровообращения Института сердечно-сосудистых заболеваний СПбГМУ им. акад. И.П. Павлова
1. Weinstock M., Gorodetsky E., Kalman R. Renal denervation prevents sodium retention and hypertension in salt-sensitive rabbits with genetic barorefl ex impairment // Clin. Sci. — 1996. — Vol. 90, № 4. — P. 287-293.
2. Kline R.L., Kelton P.M., Mercer P.F. Effect of renal denervation on the development of hypertension in spontaneously hypertensive rats // Can. J. Physiol. Pharmacol. — 1978. — Vol. 56, № 5. — P. 818-822.
3. Kline R.L., Denton K.M., Anderson W.P. Effect of renal denervation on the development of cellophane-wrap hypertension in rabbits // Clin. Exp. Hypertens. — 1986. — Vol. 8, № 8. — P. 1327-1342.
4. Vari R.C., Freeman R.H., Davis J.O. et al. Role of renal nerves in rats with low-sodium, one-kidney hypertension // Am. J. Physiol. — 1986. — Vol. 250, № 2, Pt. 2. — P. H189-H194.
5. Norman R.A., Murphy W.R., Dzielak D.J. et al. Role of the renal nerves in one-kidney, one clip hypertension in rats // Hypertension. — 1984. — Vol. 6, № 5. — P. 622-626.
6. Емельянов И.В., Звартау Н.Э., Конради А.О. и др. Резистентная артериальная гипертензия / Под ред. Е.В. Шляхто. — СПб., 2012. — 117 с. / Yemelyanov I.V., Zvartau N.E., Konradi A.O. et al. Resistant arterial hypertension / Ed. by E.V. Shlyakhto. — St Petersburg, 2012. — 117 p. [Russian].
7. Wyss J.M., Donovan M.K. A direct projection from the kidney to the brainstem // Brain Res. — 1984. — Vol. 298, № 1. —P. 130-134.
8. Wyss J.M., Aboukarsh N., Oparil S. Sensory denervations of the kidney attenuates renovascular hypertension in the rat // Am. J. Physiol. — 1986. — Vol. 250, № 1, Pt. 2. — P. H82-H86.
9. Winternitz S.R., Katholi R.E., Oparil S. Decreased in hypothalamic norepinephrine content following renal denervation in the one-kidney, one clip Goldblatt hypertensive rat // Hypertension. — 1982. — Vol. 4, № 3. — P. 369-373.
10. Osborn J.W. Hypothesis: set-points and long-term control of arterial pressure. A theoretical argument for a long-term arterial pressure control system in the brain rather than the kidney // Clin. Exper. Pharmacol. Physiol. — 2005. — Vol. 32. — P. 384-393.
11. Черниговский В.Н. Часть 5. Привыкание (адаптация) и поведение висцеральных систем. Избранные труды. — СПб.:Наука, 2007. — С. 431-460. / Chernigovsky V.N. Part 5. Addictive (adaptation) and visceral behavior of visceral systems. Selected works. — St Petersburg: Science, 2007. — P. 431-460 [Russian].
12. Kopp U.C., Buckley-Bleiler R.L. Impaired renorenal reflexes in two-kidney, one clip hypertensive rats // Hypertension. — 1989. — Vol. 14, № 4. — P. 445-452.
13. Wagner C., Hinder M., Krämer B.K. et al. Role of renal nerves in the stimulation of the renin system by reduced renal arterial pressure // Hypertension. — 1999. — Vol. 34, № 5. — P. 1101-1105.
14. Abboud F.M. The sympathetic system in hypertension. State-of-the-art review // Hypertension. — 1982. — Vol. 4, suppl II. — P. II-208-II-225.
15. Dargie H.J., Franklin S.S., Reid J.L. Plasma noradrenaline concentrations in experimental renovascular hypertension in the rat // Clin. Sci. Mol. Med. — 1977. — Vol. 52, № 5. — P. 477-482.
16. Robertson J.I., Morton J.J., Tillman D.M. et al. The pathophysiology of renovascular hypertension // J. Hypertens. — 1986. — Vol. 4, № 4. — P. S95-S103.
17. Кузьменко Н.В., Плисс М.Г., Рубанова Н.С. Cимпатическая активность и вариабельность сердечного ритма при экспериментальной реноваскулярной гипертензии у крыс с интактными и денервированными барорецепторными зонами // Бюлл. ФЦСКЭ им. В.А. Алмазова. — 2011. — № 3. — С. 31-37. / Kuzmenko N.V., Pliss M.G., Rubanova N.S. Sympathetic activity and heat rate variability during experimental renovascular hypertension in intact and sino-aortic denervated rats // Bulletin of the Almazov Federal Heart, Blood and Endocrinology Centre [Bulleten FCSKE imeni V.A. Almazova]. — 2011. — №. 3. — P. 31-38 [Russian].
18. Цырлин В.А., Кузьменко Н.В., Плисс М. и др. Соматосимпатический рефлекс у крыс с разными моделями артериальной гипертензии // Росс. физиол. журн. — 2011. — Т. 97, № 5. — С. 498-508. / Tsyrlin V.A., Kuzmenko N.V., Pliss M.G. et al. Somatosympathetic refl ex in rats with various models of arterial hypertension // Russian Physiology Journal [Rossiyskiy Fisiologicheskiy Zhurnal]. — 2011. — Vol. 97, №. 5. — P. 498-508 [Russian].
19. Stella A., Golin R., Genovesi S., Zanchetti A. Renal refl exes in the regulation of blood pressure and sodium excretion // Can. J. Physiol. Pharmacol. — 1987. — Vol. 65, № 8. — P. 1536-1539.
20. Цырлин В.А., Кузьменко Н.В., Плисс М.Г. Участие артериального барорецепторного рефлекса в долговременной регуляции артериального давления // Артериальная гипертензия. — 2009. — Т. 15, № 6. — С. 679-682. / Tsyrlin V.A., Kuzmenko N.V., Pliss M.G. Baroreceptor refl ex role in blood pressure long-term regulation // Arterial Hypertension [Arterialnaya Gipertenziya]. — 2009. — Vol. 15, №. 6. — P. 679-682 [Russian].
21. Шляхто Е.В., Плисс М.Г., Цырлин В.А. Барорецепторный рефлекс и долговременная регуляция артериального давления. — СПб., 2011. — 153 с. / Shlyakhto E.V., Tsyrlin V.A., Pliss M.G. Baroreceptor refl ex and the long-term regulation of blood pressure. — St Petersburg, 2011. — 153 p. [Russian].
22. Шляхто Е.В., Конради А.О., Цырлин В.А. Вегетативная нервная система и артериальная гипертензия. — СПб.: ООО «Медицинское издательство», 2008. — 312 с. / Shlyakhto E.V., Konradi A.O., Tsyrlin V.A. The autonomic nervous system and arterial hypertension. — St Petersburg: OOO «Medical publishing house», 2008. — 312 p. [Russian].
23. Rodrigues M.C., Campagnole-Santos M.J., Machado R.P. et al. Evidence for a role of AT (2) receptors at the CVLM in the cardiovascular changes induced by low-intensity physical activity in renovascular hypertensive rats // Peptides. — 2007. — Vol. 28, № 7. — P. 1375-1382.
Читайте также:
- Диагностика ретракционных изменений мозга. Профилактика
- Виды ангиоматозных невусов. Диагностика ангиоматозных невусов.
- Рекомендации по методике УЗИ печени
- Техника соединения кожи и подкожной жировой клетчатки ( подкожки ). Зашивание кожи и подкожной клетчатки.
- Синдром Харбитца-Мюллера (Harbitz-Muller)
