Белки регулирующие полимеризацию актина
Добавил пользователь Morpheus Обновлено: 08.01.2026
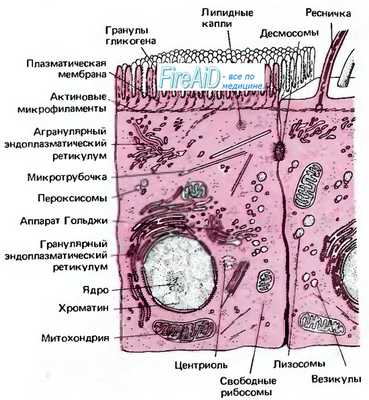
Эукариотические клетки способны изменять свою форму, перемещаться, передвигать органеллы по цитоплазме и разделять хромосомы во время митоза. Эта способность обеспечивается трехмерной сетью белковых нитей (филаментов), составляющих главную архитектуру клетки - цитоскелет (иногда обозначаемый как цитоматрикс). Белковые волокна пронизывают цитоплазму эукариотических клеток и во множестве точек связаны с белками плазматической мембраны и органелл. Все эти волокна представляют собой структуры, состоящие из субъединиц - особых глобулярных белков. (Белки цитоскелета, как и другие белки клетки, закодированы в генах и синтезируются на рибосомах.)
Субъединицы цитоскелета соединяются между собой слабыми связями (водородными, ионными и др.) и это свойство позволяет клетке формировать легко изменяющиеся динамичные пространственные структуры цитоскелета. Отмечено, что при различных воздействиях клетка в первую очередь перестраивает цитоскелет, демонтируя основные компоненты своей архитектуры, а затем формирует их заново, в соответствии с характером полученного сигнала; при этом детальное строение цитоскелета постоянно меняется при сохранении общего плана его организации. Такую форму работы цитоскелетной системы называют принципом динамической нестабильности.
В зависимости от диаметра филаменты разделяются на три группы: микрофиламенты (5-7 нм), промежуточные волокна (около 10 нм) и микротрубочки (около 25 нм). Каждый тип цитоскелетных структур образует в клетке собственную систему со своими основными и минорными белками. Эти системы не являются абсолютно независимыми, а взаимодействуют друг с другом и с другими компонентами клетки - плазматической мембраной, ядром и другими органоидами клетки. Согласно существующим представлениям, цитоскелет не только способствует поддержанию формы клетки и осуществляет все типы клеточных движений, но и объединяет разные части клетки и обеспечивает передачу сигналов внутри клетки за счет образования пространственных белковых комплексов между рецепторами и ферментами.
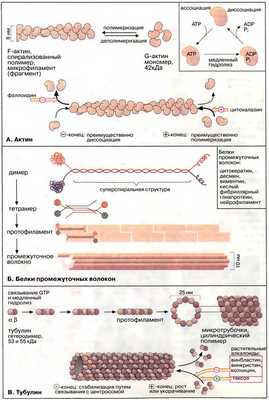
Микрофиламенты встречаются практически во всех типах клеток и состоят из белка актина - наиболее распространенного в эукариотических клетках. (Актин составляет около 5% общего белка клетки; в скелетных мышцах - приблизительно 20% клеточной массы.) Актин может существовать в виде мономера (G-актин - «глобулярный актин», состоящий из 375 аминокислотных остатков) или волокна (F-актин - «фибриллярный актин»). Каждый F-актиновый филамент представляет спиралевидную структуру длиной несколько микрометров. Волокна F-актина имеет два разноименно заряженных конца, которые полимеризуются с различной скоростью. Быстро растущий конец называется плюс-концом, а медленно растущий - минус-концом. Плюс-конец актинового филамента растет в 10 раз быстрее, чем минус-конец.
Микрофиламенты участвуют в динамических процессах, таких, как мышечное сокращение, движение немышечных клеток, фагоцитоз, образование выростов цитоплазмы у подвижных клеток и акросом в процессе слияния сперматозоида с яйцеклеткой. Все эти процессы осуществляются с помощью актин-связывающих белков.
В цитоплазме клеток имеются более 50 различных типов актин-связывающих белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объём G- актинового пула (профилин), стабилизируют концы нитей F-актина (фрагин), сшивают филаменты с другими компонентами цитоскелета. Некоторые актин-связывающие белки, например, гельформирующие (от слова - желе) - скрепляют волокна актина крест-накрест и, тем самым, переводят состояние участка цитоплазмы из состояния золь (от лат. solutio - раствор) в гель. Ещё один актин-связывающий белок - спектрин, называемый также фодрином, соединяет волокна актина в пучки и прикрепляет их к цитоплазматической мембране и к сетке, построенной из промежуточных волокон. Белок валлин сцепляет актиновые филаменты в параллельно упорядоченные жесткие структуры и оказывает влияние на скорость полимеризации G-актина.
Почти все типы движений в клетке происходят с участием актин-связывающего белка миозина. У всех молекул миозина имеется головка, шейка и хвост. Головка миозина способна присоединяться к мономеру актина и, при наличии АТФ, двигаться от плюс- к минус-концу микрофиламента. В скелетных мышцах молекулы актина и миозина расположены на фиксированных расстояниях друг от друга, а перемещение головок миозина по актиновым нитям приводит к сокращению мышц. В немышечных клетках при взаимодейстии с белком миозином актиновые филаменты могут формировать сократительные пучки, благодаря которым образуются инвагинации (впячивания) клеточной поверхности. Такие инвагинации образуются, например, при делении клеток. В общем, характер движений в клетке зависит от строения белка миозина, структура которого имеет более 80 вариантов. Комбинируя актиновые микрофиламенты с различными вариантами миозина и другими актин-связывающими белками, клетка формирует структуры, различающиеся по архитектуре, подвижности и времени существования.
У большинства клеток микрофиламенты образуют под плазматической мембраной трехмерную структуру, так называемую актиновую кору (актиновый кортекс). Особенность этой структуры - быстрое обновление микрофиламентов; например, в кортексе лейкоцита филаменты существуют не более 5 секунд. Основной тип перестроек кортекса у подвижных клеток связан с образованием
псевдоподий - выростов цитоплазмы. Псевдоподии могут иметь форму плоской пластинки (ламеллоподия), узкого цилиндра (филоподия) или шаровидного пузыря. Форма псевдоподий зависит от типа актин-связывающих белков, взаимодействующих с микрофиламентами и плазматической мембраной.
Актиновые микрофиламенты участвуют также в создании сложных пространственных и относительно стабильных цитоскелетных структур. Например, основу микроворсинок эпителиальных клеток кишечника и почек составляют длинные пучки актиновых филаментов. На верхней поверхности волосковых клеток улитки внутреннего уха, отвечающих за восприятие звуков, находятся специализированные отростки (волоски) - стереоцилии. Стереоцилии располагаются правильными рядами подобно трубам клавишно-музыкального инструмента - оргáна. Внутренняя полость волоска-стереоцилии заполнена актиновыми филаментами и молекулами других белков. Мутации некоторых генов, кодирующих эти белки, приводит к дегенерации волосковых клеток и проявляется в виде одной из форм наследственной глухоты (синдром Ашера).
Микрофиламенты принимают активное участие в движении клетки. При этом актиновые филаменты постоянно полимеризуется на конце двигательного края клетки и деполимеризуется с внутренней стороны. Процессы полимеризации и деполимеризации F-актина могут быть нарушены ядами (токсинами) грибов. Например, фаллоидин (яд бледной поганки) связывается с минус-концом актина и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к плюс-концу, блокируя полимеризацию актина и движение клетки. Длительное воздействие веществ, нарушающих полимеризацию или деполимеризацию актиновых филаментов, приводит к смерти этих клеток.
Полимеризация актина - это точно регулируемый процесс, контролируемый с помощью поверхностных рецепторов клетки, ферментов (протеинкиназ) и ионов кальция. Нарушение этого процесса сопровождается клиническими проявлениями. Например, в трансформированных клетках отмечается уменьшение экспрессии белков, регулирующих сборку актина. Значительные аномалии актиновых филаментов наблюдаются в клетках некоторых злокачественных опухолей. В клетках саркомы (опухоли соединительной ткани) обнаружено наличие тонких и коротких филаментов актина. Эти клетки, в отличие от нормальных клеток, очень подвижны и обладают большой способностью к метастазированию.
Промежуточные филаменты состоят из белков специфических для определенных клеточных типов (напр. кератины в эпителиальных клетках, виментин в клетках соединительной ткани, десмин в клетках мышечных тканей и др). Промежуточные филаменты придают прочность клетке, так как они представляют собой крепкие, волокнистые, устойчивые к растяжению полипептиды и распределяются по всей цитоплазме клетки, образуя прочную сеть. Кроме того, промежуточные волокна присутствуют в ядре, образуя сеть филаментов (ламину) на внутренней поверхности ядерной мембраны, тесно связанную с ядерными порами.
Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин и нейрофиламент. Все эти белки имеют в центральной части базовую стержневую структуру, которая носит название α-спирали. Две пептидные цепи (димер) образуют суперспираль. Такие димеры соединяются антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу «голова к голове» даёт протофиламент. Восемь протофиламентов сплетаются вместе и образуют промежуточное волокно диаметром 10 нм. Эластичность промежуточных филаментов обеспечивается тем, что димеры каждого тетрамера расположены в шахматном порядке относительно друг друга.
Волосы и ногти человека, шерсть, перья, иглы, когти, и копыта животных состоят главным образом из кератина (цитокератина). В одном волокне шерсти переплетены миллионы фибрилл. Отдельные цепи кератина скреплены многочисленными дисульфидными связями, что придает им дополнительную твердость. Выделено более 30 различных кератинов, комбинирующихся по два типа в эпителиальных клетках человека. Кроме того описано восемь изоформ тяжелых кератинов, специфичных для волос и ногтей. В нервных клетках существуют нейрофиламенты, придающие необходимую механическую опору длинным аксонам. Филаменты десмина расположены в Z-дисках саркомеров скелетных мышц. В различных типах клеток промежуточные филаменты играют важную роль в формировании клеточных контактов, называемых десмосомами, которые соединяют соседние клетки. Полудесмосомы прикрепляют эпителиальные клетки к базальной мембране, на которой они расположены.
Микротрубочки
Присутствующие во всех эукариотических клетках микротрубочки представляют собой длинные нитевидные структуры, протянутые по всей цитоплазме и формирующие сеть, которая поддерживает структурную организацию и локализацию некоторых органелл.
Микротрубочки образуются при полимеризации белка тубулина (лат. tubula - трубочка), который является гетеродимером, образованным субъединицами α- и β- тубулина. В процессе полимеризации α-тубулин одного димера контактирует сβ-тубулином следующего димера с образованием протофиламентов. Тринадцать тубулиновых продольных рядов протофиламентов (нитей), идущих по спирали, образуют микротрубочку диаметром 24 нм и длиной несколько микрометров.
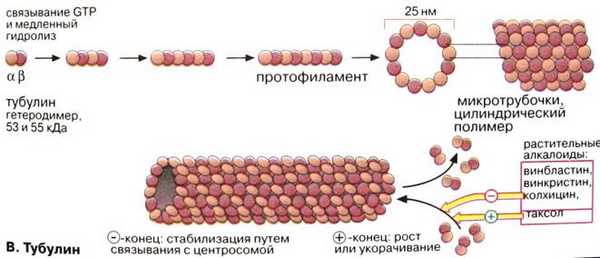
Рис. Схема строения микротрубочки, показывающая каким образом тубулиновые полипептиды, связываясь друг с другом, образуют цилиндрическую стенку. А. Поперечный срез Б - Короткий отрезок микротрубочки.
Микротрубочки способны образовывать синглет, дублет и триплет.
A микротрубочка дублета или триплета состоит из 13 протофиламентов.
Трубочки B и C состоят из меньшего числа протофиламентов, обычно 10.
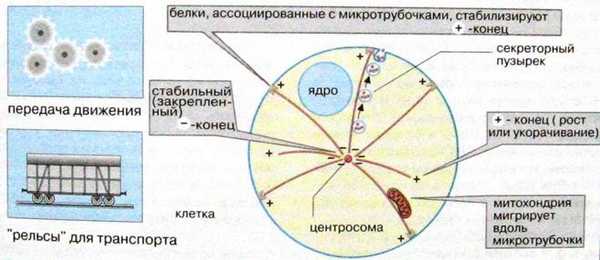
Полимеризация микротрубочек происходит в направлении от головы к хвосту таким образом, что микротрубочка имеет определенную полярность: её концы обозначаются соответственно как плюс- и минус-концы. Микротрубочки в клетке нестабильны. Они могут быстро собираться и разбираться. В клетке минус-концы связаны с центром организации микротрубочек (ЦОМТ) - структурой, расположенной около ядра, которая содержит в животных клетках пару маленьких телец - центриолей, образованных из слившихся микротрубочек. Как правило, микротрубочки ассоциированы с другими белками (миозин, динеин, кинезин), которые связывают микротрубочки с другими элементами цитоскелета и органеллами. Кинезин обеспечивает транспорт органелл и везикул (пузырьков) из одной части клетки в другую от плюс-конца микротрубочки к минус-концу, а динеин от минус-конца к плюс-концу.
Известны химические соединения, способные блокировать сборку микротрубочек (колхицин, винбластин) и стимулирующие образование стабильных микротрубочек (таксол). Следует отметить, что в развивающемся организме могут сложиться условия (недостаток кислорода, пониженная или повышенная температура и т.д.), когда нарушается сборка микротрубочек в клетках, это может служить причиной отклонения от нормального развития.
Микротрубочки, как и актиновые филаменты, принимают участие в поддержании формы клетки. Наряду со статической функцией, микротрубочки участвуют во многих процессах, протекающих во всех эукариотических клетках: мейозе, митозе, клеточном движении и секреции. Они служат направляющими «рельсами» для транспорта органелл. Вместе с ассоциированными белками микротрубочки способны осуществлять механическую работу, например, транспорт митохондрий, перемещение синаптических пузырьков, движение ресничек (волосоподобных выростов клеток в эпителии легких, кишечника и яйцеводов) и биение жгутика сперматозоида. Пузырьки, образуемые аппаратом Гольджи, направляются в различные места клетки по микротрубочкам строго по назначению. Кроме того микротрубочки в форме митотического веретена - важнейшая часть аппарата, обеспечивающего правильное распределение хромосом между дочерними клетками при делении эукариотических клеток.
Функции микротрубочек: 1) обеспечение расхождения хромосом при делении клеток, 2) поддержание формы клетки, 3) участие в транспорте макромолекул и органелл, 4) обеспечение подвижности жгутиков, ресничек.
Функции цитоскелета
Цитоскелет выполняет три главные функции.
1. Служит клетке механическим каркасом, который придаёт клетке типичную форму и обеспечивает связь между мембранной и органеллами. Каркас представляет собой динамичную структуру, которая постоянно обновляется по мере изменения внешних условий и состояния клетки.
2. Действует как «мотор» для клеточного движения. Двигательные (сократительные) белки содержатся не только в мышечных клетках, но и в других тканях. Компоненты цитоскелета определяют направление и координируют движение, деление, изменение формы клеток в процессе роста, перемещение органелл, движение цитоплазмы.
3. Служит в качестве «рельсов» для транспорта органелл и других крупных комплексов внутри клетки.
Микрофиламенты и промежуточные волокна.
Микрофиламенты построенные из F-актина пронизывают микроворсинки, образуя узлы. Эти микроволокна удерживаются вместе с помощью актинсвязывающих белков, наиболее важными из которых являются фимбрин и виллин. Кальмодулин и миозиноподобная АТФ - аза соединяют крайние микроволокна с плазматической мембраной. .
Клетка может менять набор синтезируемых белков цитоскелета в зависимости от условий, но процесс этот медленный. Конструкция цитоскелета способна быстро меняться даже без синтеза новых молекул, за счет полимеризации и деполимеризации нитей. В клетке все время идет обмен между нитями и раствором белков-мономеров в цитоплазме. Во многих клетках примерно половина молекул актина и тубулина находится в виде мономеров в цитоплазме и половина входит в состав нитей микрофиламентов. Клетка регулирует стабильность нитей цитоскелета, присоединяя к ним специальные белки, изменяющие скорость полимеризации. Общий принцип функционирования цитоскелета - динамическая нестабильность. Например, форму эритроцита в виде двояковогнутого диска поддерживает примембранный цитоскелет из волокон, образованных белком спектрином. Спектрин связан с белком анкерином (anchor - якорь), который соединяется с белком цитоплазматической мембраны, ответственным за транспорт анионов (Cl - , HCO - 3). Дефекты белков спектрина и анкирина вызывают необычную форму эритроцитов. Такие эритроциты очень быстро разрушаются в селезенке. Болезни, вызываемые такими нарушениями, называют наследственным сфероцитозом или наследственным эллиптоцитозом.
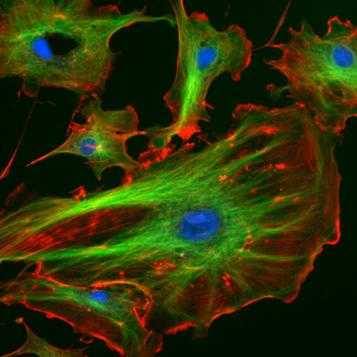
Рис. Цитоскелет эукариот. Актиновые микрофиламенты окрашены в красный, микротрубочки — в зеленый, ядра клеток — в голубой цвет.
Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
А. Актин
Микрофиламенты (актиновые нити) состоят из актина — белка, наиболее распространённого в эукариотических клетках. Актин может существовать в виде мономера (G-актин, «глобулярный актин») или полимера (F-актин, «фибриллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа), состоящий из двух доменов. По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несёт прочно связанную молекулу АТФ (АТР), которая при переходе в F-актин, медленно гидролизуется до АДФ (ADP), то есть F-актин проявляет свойства АТФ-азы.
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью. Волокна F-актина имеют два разноимённо заряженных конца — (+) и (-), которые полимеризуются с различной скоростью. Эти концы не стабилизированы специальными белками (как, например, в мышечных клетках), и при критической концентрации G-актина (+)-конец будет удлиняться, а (-)-конец укорачиваться. В условиях эксперимента этот процесс может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Актинассоциированные белки. В цитоплазме клеток имеются более 50 различных типов белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объем G-актинового пула (профилин), оказывают влияние на скорость полимеризации G-актина (виллин), стабилизируют концы нитей F-актина (фрагин, β-актинин), сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, α-актинин, спектрин, MARCKS) или разрушают двойную спираль F-актина (гельзолин). Активность этих белков регулируется ионами Ca 2+ и протеинкиназами.
Статьи раздела «Цитоскелет: состав»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Структура и стабильность биологических макромолекул
В книге рассмотрены строение и свойства биополимеров — в основном белков. Такие .
Основы клинической биохимии
Авторы монографии поставили перед собой задачу отобрать наиболее достоверные и .
Handbook of Nanoindentation: With Biological Applications
Broadly divided into two parts, this guide’s first part presents the a’basic sciencea’ of nanoindentation, including the background of contact .
Культура животной ткани вне организма
В стенограмме публичной лекции характеризуется метод тканевых культур и .
Справочное издание в наглядной форме — в виде цветных схем — описывает все биохимические процессы. Рассмотрены биохимически важные химические соединения, их строение и свойства, основные процессы с их участием, а также механизмы и биохимия важнейших процессов в живой природе. Для студентов и преподавателей химических, биологических и медицинских вузов, биохимиков, биологов, медиков, а также всех интересующихся процессами жизнедеятельности.
Актин: характеристика, строение, волокна, функции
В актин это цитозольный белок, образующий микрофиламенты. У эукариот актин - один из самых распространенных белков. Например, он составляет 10% от общего веса белка в мышечных клетках; и от 1 до 5% белка в немышечных клетках.
Этот белок вместе с промежуточными филаментами и микротрубочками образует цитоскелет, основной функцией которого является подвижность клетки, поддержание формы клетки, деление клеток и перемещение органелл у растений, грибов и животных.
Изоформы актинового цитоскелета выполняют различные функции, такие как: регулирование развития активного напряжения в гладких мышцах, клеточный цикл, развитие эмбриона, развитие тканей и заживление ран.
С эволюционной точки зрения актин является высококонсервативным белком. Гомология последовательностей у разных видов составляет около 90%. У одноклеточных организмов один ген кодирует изоформу актина. В то время как в многоклеточных организмах разные гены кодируют несколько изоформ актина.
Актин вместе с миозином были решающими структурами в эволюционной эволюции эукариотических организмов и в их диверсификации, поскольку они позволяли движение в отсутствие других структур, таких как жгутики и реснички.
Структура: актиновые нити
Актин представляет собой глобулярный одноцепочечный полипептидный белок. В мышцах актин имеет молекулярную массу примерно 42 кДа.
Этот белок имеет два домена. У каждого есть два поддомена и промежуток между доменами. АТФ - Mg +2 присоединяется к нижней части расщелины. Амино- и карбоксильные терминалы встречаются в субдомене 1.
Актин G и актин F
Есть две основные формы актина: мономер актина, называемый G-актином; и нитевидный полимер, состоящий из мономеров G-актина, называемый F-актином.Филаменты актина, наблюдаемые с помощью электронной микроскопии, имеют узкие и широкие области, соответственно 7 нм и 9 нм в диаметре.
Вдоль филамента мономеры актина образуют плотно упакованную двойную спираль. Повторяющаяся единица вдоль филамента состоит из 13 спиралей и 28 мономеров актина и находится на расстоянии 72 нм.
Актиновая нить имеет два конца. Один образован щелью, которая связывает ATP-Mg +2 , который расположен в одном направлении во всех актиновых мономерах филамента, называется (-) концом; а другая крайность противоположна, называемая (+) крайностью. Следовательно, актиновая нить имеет полярность.
Эти компоненты часто называют микрофиламентами, поскольку они представляют собой компоненты цитоскелета с наименьшим диаметром.
Где мы находим актин?
Актин - чрезвычайно распространенный белок в эукариотических организмах. Из всех клеточных белков актин составляет около 5-10% - в зависимости от типа клетки. В печени, например, в каждой из составляющих ее клеток содержится почти 5-10 клеток. 8 молекулы актина.
характеристики
Две формы актина, мономер и филамент, постоянно находятся в динамическом балансе между полимеризацией и деполимеризацией. В целом, это явление можно выделить три основных характеристики:
1) Актиновые нити характерны для строения мышечной ткани и цитоскелета эукариотических клеток.
2) Полимеризация и деполимеризация - это динамический процесс, который регулируется. Где полимеризация или агрегация мономеров актина G - ATP - Mg +2 это происходит на обоих концах. Произойдет ли этот процесс, зависит от условий окружающей среды и регуляторных белков.
3) Образование пучков и сеток, составляющих актиновый цитоскелет, придает силу подвижности клеток. Это зависит от белков, которые участвуют в образовании поперечных связей.
Сокращение мышц
Функциональной и структурной единицей скелетных мышц является саркомер, который имеет два типа волокон: тонкие волокна, образованные актином, и толстые волокна, образованные миозином. Обе нити расположены поочередно, точно геометрически. Они позволяют мышцам сокращаться.
Тонкие нити прикреплены к участкам, называемым дисками Z. Эта область состоит из сети волокон, в которых находится белок CapZ и к которым прикреплены (+) концы актиновых нитей. Этот якорь предотвращает деполимеризацию (+) конца.
С другой стороны, тропомодулин находится на (-) концах актиновых филаментов и защищает их от деполимеризации. В дополнение к актину тонкие филаменты содержат тропомиозин и тропонин, которые контролируют взаимодействия актомиозина.
Как происходит сокращение мышц?
Во время сокращения мышц толстые нити совершают вращательные движения, вытягивая тонкие нити к середине саркомера. Это вызывает скольжение грубых и тонких волокон.
Таким образом, длина толстых и тонких нитей остается постоянной, но перекрытие между обеими нитями увеличивается. Длина саркомера уменьшается из-за прикрепления тонких нитей к Z-дискам.
Как остановить сокращение мышц?
АТФ - это энергетическая валюта клетки. Поэтому он почти всегда присутствует в живых мышечных тканях.Принимая во внимание вышесказанное, должны быть механизмы, позволяющие расслабить мышцу и прекратить сокращение.
Два белка, называемые тропомиозином и тропонином, играют фундаментальную роль в этом явлении. Они работают вместе, чтобы блокировать сайты связывания миозина (тем самым предотвращая его связывание с актином). В результате мышца расслабляется.
И наоборот, когда животное умирает, оно испытывает явление, известное как трупное окоченение. За это упрочнение тушки отвечает блокирование взаимодействия между миозином и актином вскоре после смерти животного.
Одним из следствий этого явления является потребность в АТФ для высвобождения двух белковых молекул. Логично, что в мертвых тканях АТФ недоступен, и его высвобождение не может произойти.
Другие виды движения
Тот же механизм, который мы описываем (позже мы углубимся в механизм, лежащий в основе движения), не ограничивается мышечными сокращениями у животных. Он отвечает за амебоидные движения, которые мы наблюдаем у амеб и некоторых колониальных форм.
Точно так же движение цитоплазмы, которое мы наблюдаем у водорослей и наземных растений, осуществляется аналогичными механизмами.
Регулирование полимеризации и деполимеризации актиновых филаментов
Сокращение гладкой мышечной ткани и клеток приводит к увеличению F-актина и уменьшению G-актина.Полимеризация актина происходит в три стадии: 1) зародышеобразование, медленная стадия; 2) удлинение, быстрый шаг; и 3) устойчивое состояние. Скорость полимеризации равна скорости деполимеризации.
Актиновая нить растет быстрее на (+) конце, чем на (-). Скорость удлинения пропорциональна концентрации мономеров актина, находящихся в равновесии с актиновыми филаментами, называемой критической концентрацией (Cc).
Cc для (+) конца составляет 0,1 мкМ, а для (-) конца составляет 0,8 мкМ. Это означает, что для полимеризации (+) конца требуется в 8 раз меньшая концентрация мономеров актина.
Полимеризация актина в основном регулируется тимозином бета4 (ТВ4). Этот белок связывает G-актин и удерживает его, предотвращая его полимеризацию. Профилин же стимулирует полимеризацию актина. Профилин связывается с мономерами актина, облегчая полимеризацию на (+) конце за счет диссоциации комплекса актин-ТВ4.
Другие факторы, такие как увеличение количества ионов (Na + , К + или Mg +2 ) способствуют образованию волокон.
Формирование актинового цитоскелета
Формирование актинового цитоскелета требует создания поперечных связей между актиновыми филаментами. Эти связи образованы белками, выдающимися характеристиками которых являются: они имеют актин-связывающие домены; многие имеют домены, гомологичные кальпонину; и каждый тип белка экспрессируется в определенном типе клетки.
В филоподиях и стрессовых волокнах поперечные связи между актиновыми филаментами осуществляются фасциной и филамином. Эти белки, соответственно, заставляют актиновые филаменты располагаться параллельно или иметь разные углы. Таким образом, актиновые филаменты определяют форму клетки.
Область клетки с наибольшим количеством актиновых филаментов расположена рядом с плазматической мембраной. Эта область называется корой. Кортикальный цитоскелет организован по-разному, в зависимости от типа клетки, и связан с плазматической мембраной через связывающие белки.
Некоторые из наиболее описанных цитоскелетов - это мышечные клетки, тромбоциты, эпителиальные клетки и эритроциты. Например, в мышечных клетках белок, связывающий дистрофин, связывает актиновые филаменты с целостным гликопротеиновым комплексом на мембране. Этот комплекс связывается с белками внеклеточного матрикса.
Модель действия актин-миозинового взаимодействия
Исследователи под руководством Раймента предложили четырехступенчатую модель для объяснения взаимодействия актина и миозина. Первый шаг происходит при связывании АТФ с головками миозина. Это связывание вызывает конформационное изменение белка, высвобождая его из актина в тонком филаменте.
Затем АТФ гидролизуется до АДФ с высвобождением неорганического фосфата. Молекула миозина присоединяется к новой субъединице актина, создавая высокоэнергетическое состояние.
Выделение неорганического фосфата вызывает изменение миозина, возвращение к исходной конформации и движение мелких нитей относительно толстых нитей. Это движение вызывает движение двух концов саркомера, сближая их.
Последний шаг включает выпуск ADP. На этом этапе головка миозина свободна и может связываться с новой молекулой АТФ.
Движение клеток за счет полимеризации актина
Ползучая подвижность - это тип подвижности клеток. Шагами этого типа подвижности являются: проекция оси лидера адгезии к субстрату; адгезия к основанию; задний втягивание; и отторжение.
Проекция лидерной оси требует участия белков, которые участвуют в полимеризации и деполимеризации актиновых филаментов. Ведущая ось находится в коре клеток, называемой ламеллиподиумом. Шаги проецирования оси:
- Активация рецепторов внеклеточным сигналом.
- Образование активных GTPases и 4,5-бисфосфатфосфоинозитола (PIP2).
- Активация белков WASp / Scar и Arp2 / 3, которые связываются с мономерами актина с образованием ответвлений в актиновых филаментах.
- Быстрый рост актиновых филаментов ветви, украшенных миозином. Мембрана выдвигается вперед.
- Завершение удлинения, производимого белками оболочки.
- Гидролиз АТФ, связанного с актином в старых филаментах.
- Деполимеризация актин-АДФ из филаментов, вызванная АДФ / кофилином.
- Обмен АДФ на АТФ, катализируемый профилином, генерирующий актин Г-АТФ, готовый начать удлинение ответвлений.
Заболевания, связанные с актином
Мышечная дистрофия
Мышечная дистрофия - дегенеративное заболевание скелетных мышц. Он рецессивно наследуется и связан с хромосомой X. В основном он поражает мужчин с высокой частотой в популяции (один на каждые 3500 мужчин). Матери этих мужчин гетерозиготны, бессимптомны и могут не иметь семейного анамнеза.
Есть две формы мышечной дистрофии, Дюшенна и Беккера, и обе они вызваны дефектами гена дистрофина. Эти дефекты состоят из делеций, которые удаляют аксоны.
Дистрофин - это белок (427 кДа), который образует поперечные связи между актиновыми филаментами. Он имеет актин-связывающий домен на N-конце и мембранно-связывающий домен на C-конце. Между обоими доменами находится третий трубчатый домен, состоящий из 24 тандемных повторов.
В мышечном кортикальном ретикулуме дистрофин участвует в связывании актиновых филаментов с плазматической мембраной через гликопротеиновый комплекс. Этот комплекс также связывается с белками внеклеточного матрикса.
У пациентов с дефицитом функционального дистрофина с мышечной дистрофией Дюшенна кортикальный цитоскелет не поддерживает плазматическую мембрану. Следовательно, плазматическая мембрана повреждается стрессом от повторяющихся мышечных сокращений.
Белки регулирующие полимеризацию актина
Онкология:
Популярные разделы сайта:
Актиновые микрофиламенты - структура, функции
Актиновые микрофиламенты представляют собой полимерные нитевидные образования диаметром 6—7 нм, состоящие из белка актина. Эти структуры обладают высокой динамичностью: на конце микрофиламента, обращенном к плазматической мембране (плюс-конец), идет полимеризация актина из его мономеров в цитоплазме, тогда как на противоположном (минус-конец) происходит деполимеризация.
Микрофиламенты, таким образом, обладают структурной полярностью: рост нити идет с плюс-конца, укорочение — с минус-конца.
Организация и функционирование актинового цитоскелета обеспечиваются целым рядом актинсвязывающих белков, которые регулируют процессы полимеризации —деполимеризации микрофиламентов, связывают их друг с другом и придают контрактильные свойства. Среди таких белков особое значение имеют миозины.
Взаимодействие одного из их семейства — миозина II с актином лежит в основе мышечного сокращения, а в немышечных клетках придает актиновым микрофиламентам контрактильные свойства — способность к механическому напряжению. Эта способность играет исключительно важную роль во всех адгезионных взаимодействиях.
Формирование новых актиновых микрофиламентов в клетке происходит путем их ответвления от предшествующих нитей. Чтобы новый микрофиламент смог образоваться, необходима своеобразная «затравка». В ее формировании ключевую роль играет белковый комплекс Аф 2/3, включающий два белка, весьма сходных с актиновыми мономерами.
Будучи активированным, комплекс Аф 2/3 прикрепляется к боковой стороне предсуществующего актинового микрофиламента и изменяет свою конфигурацию, приобретая способность присоединить к себе еще один мономер актина. Так возникает «затравка», инициирующая быстрый рост нового микрофиламента, отходящего в виде ответвления от боковой стороны старой нити под углом около 70°, тем самым в клетке формируется разветвленная сеть новых микрофиламентов.
Рост отдельных нитей вскоре заканчивается, нить разбирается на отдельные АДФ-содержащие мономеры актина, которые после замены в них АДФ на АТФ вновь вступают в реакцию полимеризации.
Актиновый цитоскелет играет ключевую роль в прикреплении клеток к внеклеточному матриксу и друг к другу, в формировании псевдоподий, с помощью которых клетки могут распластываться и направленно перемещаться.
Актин в мышечных волокнах
Описаны основные характеристики сократительного белка актина (диаметр глобулы и молекулярная масса). Дается характеристика первичной и третичной структуры актина. Описан процесс полимеризации актина (соединения молекул глобулярного актина в фибриллу).
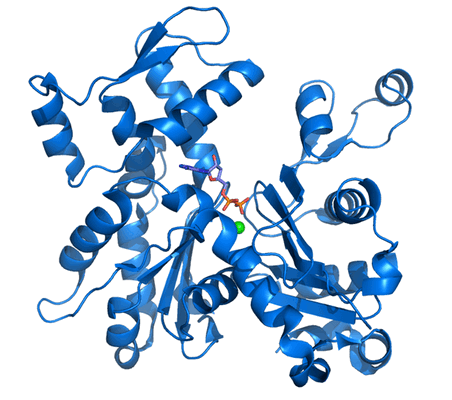
Основу тонкого филамента саркомера составляет сократительный белок актин, который имеет яйцевидную форму (форму глобулы). Диаметр глобулы G-актина примерно равен 55 Å[1]. Поэтому эта форма актина называется глобулярным актином (G-актин). На долю актина приходится 25% общей массы мышечного белка.
История выделения актина
Актин впервые выделен Б. Штраубом в 1948 году (Самойлов В.О., Бигдай Е.В., 2004).
Структура актина
Структура этого белка остается неизменной миллионы лет. Первичную структуру актина (полипептидную цепь) составляют 374 аминокислотных остатка. Молекулярная масса актина - 41,8 кДа.
Третичная структура актина представляет из себя глобулу с бугристой поверхностью, изрезанную щелями. Самая большая щель пролегает в середине молекулы и содержит активные центры связывания АТФ, АДФ, а также ионов кальция (Ca 2+ ) и магния (Mg 2+ ).
Полимеризация актина
На молекуле G-актина есть сайты (центры) связывания тропомиозина, тропонина и миозиновой головки. Кроме того молекула G-актина имеет две пары комплементарных (ключ-замок) сайтов прикрепления соседних молекул G-актина. Благодаря этим центрам связывания в присутствии ионов магния (Mg2+) глобулы G-актина при достаточной их концентрации самопроизвольно объединяются в фибриллы (происходит полимеризация G-актина). В результате образуется фибриллярный актин (F-актин). Контакты между глобулами G-актина обеспечиваются гидрофобными и электростатическими взаимодействиями (рис.1).
При такой спонтанной полимеризации актина на образовавшейся нити один из ее концов быстро связывается с G-актином (плюс-конец) и поэтому растет быстрее, чем противоположный (минус-конец). В результате возникает суперспираль, образованная молекулами G-актина, подобно бусинкам в ожерелье из двух ниток, закрученных одна вокруг другой.
Рис. 1. Полимеризация актина
Литература
1. Самойлов В.О., Бигдай Е.В. Клеточные и молекулярные основы биомеханики / В кн.: Математические модели и компьютерное моделирование в биомеханике: Учебное пособие.- СПб: Из-во Политехнического ун-та, 2004.- С. 29-102.
[1] Å - ангстрем устаревшая внесистемная единица измерения длины, равная 10 −10 м.
Читайте также:
- Контрастность рентгеновской пленки. Выбор напряжения трубки в зависимости от контрастности пленки
- Показания для операции при ревматоидном артрите шейного отдела позвоночника
- Герпетический стоматит: причины, симптомы и лечение
- Прогноз лечения рака молочной железы
- Показания для операции Z-остеотомии при варусной деформации пяточной кости
