Диагностика перерыва дуги аорты у новорожденного. Лечение атрезии дуги аорты.
Добавил пользователь Skiper Обновлено: 28.01.2026
Обструкция дуги аорты или ее перерыв часто требует неотложного хирургического вмешательства в неонатальном периоде [1]. Хотя результаты реконструктивных операций на дуге аорты были значительно улучшены, отдаленные результаты до сих пор нельзя назвать вполне удовлетворительными. Есть достаточно данных, свидетельствующих о том, что у 16-28% пациентов даже при отсутствии анатомической обструкции в отдаленные сроки сохраняются артериальная гипертензия и системная сосудистая дисфункция [5, 11]. Как правило, такие пациенты имеют структурные, функциональные и макроанатомические нарушения [3, 8, 9]. Комплекс этих нарушений приводит к раннему атеросклерозу аорты и коронарных артерий, аневризмам аорты и периферических артерий, а 18% оперированных (в том числе и в раннем возрасте) пациентов умирают в возрасте до 34 лет [14].
Материал и методы
В исследование были включены 62 пациента
(44 мальчика и 18 девочек) в возрасте 55±14 дней (от 1 до 98 дней), средней массой тела 3,5±1,2 кг (от 2,3 до 4,5 кг), оперированные в центре детской кардиохирургии ННИИПК им. акад. Е.Н. Мешалкина в период с 2004 по 2014 г. Всем пациентам выполняли хирургическую коррекцию врожденной аномалии дуги аорты в условиях искусственного кровообращения.
Реконструкцию дуги производили двумя методами - с помощью ксеноперикардиальной заплаты (1-я группа, 32 пациента) и с помощью анастомоза конец в бок (2-я группа, 30 человек). Варианты патологии дуги аорты и сопутствующие аномалии представлены в табл. 1.
Степень гипоплазии аорты оценивали по шкале Z-score. В отдаленном периоде все пациенты были не менее двух раз осмотрены кардиологом. Также в послеоперационном периоде проводили повторную МСКТ для оценки размеров и пропорциональности роста различных сегментов дуги аорты, выявления рекоарктационного синдрома и исследование формы послеоперационнной дуги аорты.
Хирургическая процедура. Все пациенты оперированы в условиях общей комбинированной анестезии. Мониторинг артериального давления проводили в правой лучевой и бедренной артериях. Церебральную сатурацию оценивали с помощью аппарата INVOS 5100 ("Somanetics", США) в течение всей процедуры. Для проведения искусственного кровообращения использовали системы Dideco Lilliput I ("Sorin", Италия).
Для доступа к сердцу и магистральным сосудам применяли срединную стернотомию. Для системной перфузии использовали три метода канюляции аорты: 1) прямую канюляцию восходящей аорты - 11 (17,5%) наблюдений; 2) канюляцию гепаринизированного политетрафторэтиленового протеза GoreTex 3,0-3,5 мм, который анастомозировали с проксимальной частью брахицефального ствола - 29 (46,8%) наблюдений; 3) двойную канюляцию: одну канюлю проводили в восходящую аорту или гепаринизированный протез, другую - через артериальный проток в нисходящую аорту для перфузии нижней половины тела - 22 (35,5%) наблюдения. Во всех наблюдениях выполняли раздельную канюляцию полых вен. При необходимости в правую верхнедолевую легочную вену устанавливали дренаж левого желудочка.
Глубокую гипотермическую остановку кровообращения осуществляли по достижении ректальной температуры 20 °С. Всем пациентам выполняли антеградную селективную перфузию головного мозга через протез GoreTex, анастомозированный с брахицефальным стволом. Первым этапом производили реконструкцию дуги аорты одним из двух методов: расширением суженного участка с использованием заплаты из ксеноперикарда или формированием анастомоза по типу конец в бок между нисходящей и восходящей аортой. Техника этой операции была предложена С. Fraser и R. Mee [4], а также модифицирована H. Rajasinghe и соавт. [13]. Вторым этапом после возобновления искусственного кровообращения устраняли внутрисердечные дефекты. После отключения от искусственного кровообращения производили модифицированную ультрафильтрацию.
Статистический анализ. Статистическую обработку полученных результатов проводили с помощью программы Statistica 6,0. Непрерывные переменные выражали в виде средних величин ± стандартное отклонение. Для сравнения величин при их нормальном распределении использовали t-критерий Стьюдента. Значение р≤0,05 считали статистически достоверным.
Результаты и обсуждение
Демографические характеристики пациентов приведены в табл. 2. Средний возраст был одинаковым в обеих группах - 20 дней (7,5±33,5 дня) в 1-й группе и 20 дней (12,0±28,5 дня) во 2-й группе. Группы были сопоставимы по значениям фракции выброса левого желудочка и конечного диастолического объема.
В 1-й группе умерли 3 (9,4%) пациента, из которых у 2 (6,2%) причиной смерти явилась полиорганная недостаточность и у 1 (3,2%) - сепсис. Два пациента умерли в течение 3 лет после операции вследствие сердечно-легочной недостаточности (1) и пневмонии (1).
Во 2-й группе умерли 6 (20%) пациентов, из которых у 4 (13,3%) смерть наступила вследствие сепсиса и полиорганной недостаточности и у 2 (6,7%) - от сердечно-легочной недостаточности. Послеоперационные осложнения представлены в табл. 3.
Период наблюдения составил 42±14 мес. В отдаленном периоде рекоарктация возникла у 7 (13,7%) пациентов, масса их тела на момент хирургической коррекции составляла менее 3 кг, средний градиент давления - 36,4±12,85 мм рт.ст. В 1-й группе рекоарктация отмечена у 6 (18,75%), во 2-й группе - у 1 (3,3%) пациента (p=0,02). Признаки рекоарктации определялись в сроки 9±5 мес (от 3 до
24 мес). Для устранения рекоарктации всем пациентам была выполнена баллонная ангиопластика с хорошим гемодинамическим результатом.
Остаточные неврологические осложнения наблюдались у 2 (7,4%) пациентов 1-й группы. Эти пациенты имеют правосторонний гемипарез и проходят реабилитационное лечение.
Резидуальная гипертензия имела место у 12 (23,5%) пациентов. В 1-й группе артериальная гипертензия выявлена у 10 (37%), во 2-й группе - у 2 (8,3%) пациентов (p=0,0025). Гипертензионный синдром возникал в сроки 20±12 мес (от 6 до 42 мес). 6 (50%) пациентов получают гипотензивную терапию, у 5 (41,6%) пациентов на фоне приема гипотензивных препаратов отмечено стойкое повышение артериального давления. Родители этих пациентов были опрошены дистанционно, точную причину повышения артериального давления выяснить не удалось. У одного пациента также на фоне терапии отмечен гипертонический ответ на функциональные пробы. Всем этим пациентам выполняли МСКТ. Обнаружено, что 8 (66,6%) из 12 пациентов имели готическую форму дуги аорты, 3 (25%) - амбразурную и 1 (8,4%) - романскую.
Современные возможности диагностики, анестезиологического, медикаментозного обеспечения, внедрение новых технологий перфузионного сопровождения обеспечили качественно новый подход в лечении пациентов с гипоплазией или перерывом дуги аорты.
При выборе метода коррекции у новорожденных и детей раннего возраста в последнее время отдается предпочтение технике анастомоза конец в бок или пластике ксеноперикардиальной или аутоперикардиальной заплатой. Высокая частота рекоарктационного синдрома остается проблемой при реконструктивных операциях на дуге аорты у новорожденных и грудных детей с использованием чужеродных материалов. B. Uchytil и соавт. [15] отметили высокую частоту рекоарктаций в группе реконструктивных операций с использованием синтетических и ксеноперикардиальных заплат по сравнению с методами реконструкции дуги аорты нативными тканями. Результаты нашего исследования подтверждают эти данные. Был продемонстрирован достоверно более низкий процент рекоарктационного синдрома у больных, которым выполняли анастомоз конец в бок. Похожие результаты описаны группой Melbourne Royal Children's Hospital [12], которая в своем долгосрочном наблюдении также выявила, что формирование анастомоза конец в бок с использованием срединного доступа может быть предложено при гипоплазии дуги аорты, так как процент рекоарктаций в этой группе крайне низкий. Нами отмечено также влияние низкой массы тела (менее 3 кг) на процент рекоарктаций, что подтверждают данные K. Zehr [16].
Другим частым осложнением после реконструктивных операций на дуге аорты является резидуальная гипертензия. Мы наблюдали артериальную гипертензию в раннем послеоперационном периоде у 23,5% пациентов, несмотря на то, что всем им операцию выполняли в грудном возрасте. При МСКТ было выявлено, что у большинства пациентов с резидуальной гипертензией имеется готическая форма дуги аорты. Связь формы дуги аорты и артериальной гипертензии описана в работе P. Ou и соавт. [9], а также L. Olivieri и соавт. [10]. Основываясь на геометрических данных, полученных при МРТ дуги аорты у 105 пациентов, они предложили классификацию дуги аорты: готическая (угловая), амбразурная (прямоугольная) и романская (нормальная). По результатам обследования отмечено повышенное артериальное давление у 22 из 44 пациентов с готической формой, у 5 из 18 с прямоугольной и у 2 из 43 с нормальной формой дуги аорты. Однако многие авторы [2, 3, 8] видят причину резидуальной гипертензии в изменении коллагеноэластинового каркаса в аорте или в аномальной функции барорецепторов, которые увеличивают периферическое сосудистое сопротивление [6, 7].
Данные этих авторов мы не можем ни подтвердить, ни опровергнуть. На амбулаторном этапе исследования было выявлено, что 50% пациентов (все из 1-й группы) имеют стойкую артериальную гипертензию и нуждаются в назначении лекарственной терапии. У 41,6% пациентов отмечено периодическое повышение систолического или диастолического давления, что не требовало назначения лекарственных препаратов.
Таким образом, реконструкция дуги аорты путем формирования анастомоза конец в бок сопровождается меньшим риском рекоарктационного синдрома и резидуальной гипертензии по сравнению с реконструкцией ксеноперикардиальной заплатой. Наши выводы могут быть приняты с некоторыми ограничениями. Во-первых, ретроспективный характер исследования и отсутствие рандомизации требуют взвешенного подхода к интерпретации полученных результатов. Во-вторых, относительно небольшой размер выборки может являться причиной недостаточной мощности статистического анализа. Высокий риск периоперационных осложнений и летального исхода у наблюдавшихся нами пациентов определяется тяжестью заболевания и сложностью операций. В связи с этим поиск оптимальных методов коррекции этой группы пороков представляется важным.
Перерыв дуги аорты ( Атипичная коарктация аорты , Атрезия дуги аорты )
МКБ-10

Общие сведения
Причины
Предрасполагающие факторы атипичной коарктации общие с любой генетической патологией. Группу риска составляют дети женщин, рожающих после 35 лет, ведущих нездоровый образ жизни либо состоящих в близкородственных браках, а также люди, рожденные в семьях, у которых в анамнезе выявляется два и более выкидыша или уже есть больной ребенок. Во время беременности к тератогенным последствиям могут привести перенесенные инфекционные заболевания матери — оспа, эпидемический паротит, грипп, корь.
Патогенез
При атрезии аорты любого типа значительно ухудшается кровообращение органов и тканей, особенно нижней части тела. Первые дни и недели жизни ситуация для пациента более благоприятная, поскольку часть дефицита крови компенсируется за счет функционирующего боталлова протока. По мере его физиологического зарастания появляются признаки гемодинамической недостаточности нижней половины тела, особенно органов брюшной полости, таза. Это приводит к почечной и печеночной недостаточности, эндогенному накоплению продуктов метаболизма, ацидозу, иногда с критическим смещением pH.
На фоне порока снижается сопротивление малого круга, что потенцирует патологическое перераспределение крови. Значительная часть минутного объема кровообращения попадает в систему легочной артерии, вследствие чего там развивается гипертензия, нарастают симптомы право- и левожелудочковой недостаточности. Постоянное высокое давление в сосудах легких вызывает гипертрофию, а затем массивную дилатацию левого предсердия, которое может сдавить бронхи и еще больше ухудшить работу дыхательной системы.
Классификация
Номенклатура данного дефекта дуги аорты главным образом стоится на анатомических характеристиках и месте формирования перерыва. Все типы могут сочетаться с сужением выходного отдела левого желудочка сердца, гипоплазией аортального клапана и дефектом межжелудочковой перегородки или быть изолированными пороками магистрального сосуда. В современной классификации патология делится на три вида:
● Тип А. Характеризуется отсутствием просвета аорты на уровне ее перешейка. На этот вид приходится порядка 44% случаев заболевания.
● Тип В. Перерыв в точке между общей левой сонной и подключичной артериями наблюдается у 52% пациентов. Делится на четыре подтипа:
○ Тип В1. Включает левый открытый артериальный проток, аберрантную правую подключичную артерию.
○ Тип В2. Артериальный проток имеет двусторонний характер. От аорты изолирована правая подключичная артерия.
○ Тип В3. Левый артериальный проток открыт, от аорты отходит правая легочная артерия.
○ Тип В4. Двусторонний артериальный проток, правосторонняя дуга аорты. Левая подключичная артерия изолирована от сосуда.
● Тип С. Самый редкий вариант дефекта — всего 4% от известных случаев. Перерыв происходит между безымянной и левой общей сонной артериями.
Симптомы
Клинические проявления различаются у больных разных возрастных категорий. У новорожденных на первый план выходят бледность кожи, затрудненное дыхание, рассеянные влажные хрипы в легких, нарушения диуреза вплоть до анурии, ацидоз. Характерным симптомом является цианоз нижней половины туловища после внутривенного введения простагландина Е1. Этот феномен — следствие раскрытия артериального протока, сопровождающегося сбросом крови из легочной артерии в нисходящую часть аорты. При неблагоприятном течении патологии у ребенка могут нарастать явления отека легких.
У детей старшего возраста симптоматика нередко отсутствует. Тот факт, что они смогли выжить с таким серьезным наследственным пороком, практически всегда говорит о том, что у пациентов развилась мощная коллатеральная сеть, способная компенсировать отсутствие соединения между сегментами аорты. Иногда больные жалуются на слабость, боли в ногах при физических нагрузках, головные боли, кровотечения на фоне развившейся артериальной гипертензии.
Осложнения
Перерыв дуги аорты относится к тяжелым порокам развития с высокой летальностью. В течение первых семи дней умирает около 40% новорожденных, к полугоду выживаемость снижается до 27% и держится на этом уровне до 15 лет. Особенно чреват осложнениями период зарастания артериального протока - на фоне скудной перфузии тканей может развиться метаболический синдром, сопровождающийся повреждением центральной нервной системы, сердечной мышцы, других органов. В случае выживания это может привести к отставанию умственного и физического развития, тяжелым сопутствующим заболеваниям.
Диагностика
Обнаружение данной патологии обычно осуществляется еще на этапе беременности при плановом посещении женщиной кабинета УЗИ и последующей консультации акушера-гинеколога. В ином случае диагноз ставится после родов неонатологами, детскими кардиологами. Большое значение отводится физикальным методам исследования. В частности, при пальпации определяется слабый пульс на ногах, аускультативно выслушивается усиление II тона над основанием сердца, систолический шум во втором межреберье, что говорит о нарушенной гемодинамике. Из инструментальных методов применяются:
- Электрокардиография. Базовый способ диагностики сердечно-сосудистых патологий, способный при атрезии дуги аорты выявить признаки гипертрофии правого желудочка, блокаду правой ножки пучка Гиса. При существенном нарушении гемодинамики появляется картина увеличения левого желудочка, нарушения проведения импульса в этой части органа. Стоит учитывать, что в 20% случаев на ЭКГ патология не обнаруживается.
- УЗИ сердца. Основной метод исследования при данном эмбриональном пороке. Перерыв дуги может быть заподозрен по существенному несоответствию диаметров восходящей аорты и легочного ствола. Также можно определить характер брахицефальных сосудов, их пропускную способность. В отличие от физиологического направления дуги кзади, при аномалии сосуда курс каротидных артерий направлен кверху.
- Магнитно-резонансная томография. Позволяет получить трехмерное изображение сосудистого пучка, установить характер отхождения сонных артерий, подтвердить отсутствие пути от нисходящей к восходящей части аорты. Существенным недостатком метода является невозможность дифференциальной диагностики между перерывом и тяжелой гипоплазией дуги.
- Рентгенография. Неспецифический метод, дающий возможность косвенно заподозрить перерыв аорты. Как следствие легочной гипертензии и следующего за ней гипертрофического, дилатационного перерождения миокарда на снимке можно увидеть кардиомегалию, усиление легочного рисунка, легочно-венозный застой, начинающийся отек легких. При синдроме Ди Джорджи верхнее средостение может быть слегка суженным из-за отсутствия вилочковой железы.
- Лабораторнаядиагностика. С помощью газового состава крови по уровню pH, рСО2, концентрации буферных систем можно определить наличие декомпенсированного метаболического ацидоза. В биохимическом анализе выявляются маркеры ишемического повреждения печени (высокие уровни АЛТ, АСТ, ЛДГ), почек (креатинина).
Лечение перерыва дуги аорты
Консервативная терапия
Патология является абсолютным показанием к хирургическому вмешательству. У новорожденных, которые на первых днях жизни могут плохо переносить операции, возможно непродолжительное лечение простагландином Е1. Данное вещество оказывает влияние на сосуды, снижая периферическое сопротивление и улучшая перфузию крови, уменьшает риск образования тромбов, способствует поддержанию проходимости открытого артериального протока, препятствует его зарастанию.
Хирургическое лечение
Согласно исследованиям, общая хирургическая летальность при оперативной коррекции атрезии составляет приблизительно 30%. Кроме того, лечение дефекта аорты остается проблемой современной медицины по той причине, что большинство пациентов изначально находятся в тяжелом состоянии с выраженной сердечной недостаточностью, анурией. Использование новых методик, совершенствование старых, внедрение в предоперационный период инфузий простагландина Е1 позволяет надеяться на скорое улучшение ситуации. Само вмешательство выполняется по одному из двух вариантов:
- Двухэтапный метод. Основные моменты этого способа на первом этапе — восстановление целостности дуги аорты с помощью имплантации собственных тканей либо сосудистого протеза с одномоментной перевязкой боталлова протока, временного сужения легочной артерии. Во вторую очередь закрывают дефект межжелудочковой перегородки (при его наличии). Как эндогенный материал могут быть использованы части сонной или подключичной артерии. Аутотрансплантат не провоцирует тромбообразование и активацию иммунитета, что упрощает течение послеоперационного периода и снижает вероятность повторных вмешательств.
- Одноэтапный метод. Представляет собой прямое анастомозирование нисходящей и восходящей частей аорты в условиях стернотомии, применения аппарата искусственного кровообращения и гипотермии. Данный способ технически более сложен, но предпочтителен при сочетании перерыва с множественными дополнительными пороками сердца, сосудов, так как дает хирургам максимальное количество времени для их устранения. Операция также применяется при сочетании атипичной коарктации с общим артериальным стволом, транспозицией магистральных сосудов.
Прогноз и профилактика
Естественное течение заболевания неблагоприятное. При хирургическом лечении в раннем возрасте, после проведения инфузионной терапии простагландинами прогноз в целом благоприятный. В отдаленном периоде велика вероятность повторных операций. Специфическая профилактика отсутствует. Супружеским парам с отягощенной наследственностью перед беременностью рекомендуется посещение центра планирования семьи, консультация генетика. Во время вынашивания ребенка и подготовки к гестации женщина должна придерживаться принципов здорового образа жизни, ограничить, а лучше исключить действие табака и алкоголя, предупреждать и своевременно лечить тератогенные внутриутробные инфекционные патологии.
1. Реконструктивная хирургия перерыва дуги аорты у взрослых/ Козлов Б.Н., Панфилов Д.С., Саушкин В.В.// Хирургия. Журнал им. Н.И. Пирогова - 2016 - №5.
2. Перерыв дуги аорты: диагностика порока методом мультидетекторной компьютерной томографии/ Ялынская Т.А.// Кардиоваскулярная радиология - 2012 - №4.
3. Описание этапной коррекции перерыва дуги аорты типа А в сочетании с гипоплазией левых отделов сердца/ Калашников С.В., Степаничева О.А., Беришвили Д.О.// Детские болезни сердца и сосудов - 2016 - №4.
Двойная дуга аорты ( Сосудистое кольцо аорты )
Двойная дуга аорты — это врожденная аномалия развития, при которой формируется полное сосудистое кольцо, состоящее из правой и левой дуг аорты. Патологическое состояние в основном проявляется в раннем детском возрасте. Типичные симптомы: шумное дыхание с периодами апноэ, срыгивания и отказ от кормления, частые инфекционные заболевания респираторного тракта. Для диагностики двойной дуги аорты используют инструментальные исследования — МСКТ-ангиографию, ЭхоКГ, бронхоскопию. При сосудистой аномалии применяется радикальное оперативное лечение — резекция участка дуги и пластика аорты.


Двойная дуга аорты (ДДА) входит в группу патологий под названием «сосудистые кольца и петли», частота которых составляет около 1% от всех врожденных сердечно-сосудистых аномалий. ДДА занимает первое место среди всех сосудистых пороков — удельный вес заболевания составляет 42%. В 20-30% случаев двойная аортальная дуга комбинируется с другими пороками развития — тетрадой Фалло, открытым артериальным протоком (ОАП). Статистически значимых различий в половой или расовой принадлежности пациентов не выявлено.

- Физические воздействия. Наиболее значимым для сердечно-сосудистых пороков является радиационное излучение, особенно при его длительном воздействии на организм беременной женщины. В группу риска входят беременные, проживающие в местности с повышенным радиационным фоном.
- Химические реагенты. Чаще всего неблагоприятное воздействие обусловлено употреблением алкоголя, курением, применением токсических или наркотических веществ. Формирование двойной дуги возможно, когда мать в период беременности принимает тератогенные лекарства (эстрогены, ретиноиды, химиопрепараты).
- Биологические агенты. Аномалии со стороны сердечно-сосудистой системы ребенка встречаются при инфицировании возбудителями TORCH-комплекса (краснуха, цитомегаловирус, токсоплазмоз и др.). Поражение плода возможно, даже если у беременной нет клинических проявлений заболевания.
Формирование аортального порока происходит на 4-5 неделе эмбриогенеза. В основе двойной сосудистой аномалии лежат нарушения развития и дифференцировки жаберных дуг — хрящевых пластинок, которые служат источником для образования подъязычной кости, гортани и трахеи, сосудов. Из IV, V и VI жаберных дуг формируются артерии, расположенные в грудной полости. При патологиях эмбриогенеза формируется аномальное аортальное кольцо, сдавливающее трахею с пищеводом.
По морфофункциональному принципу ДДА подразделяют на 3 варианта: доминантная правая дуга (в 70% случаев), доминантная левая дуга (20%) и сбалансированная форма, когда обе сосудистые ветви развиты одинаково. Существует другая классификация сосудистой аномалии, основанная на функциональной способности аортальных дуг. По этому принципу в современной кардиологии выделяют несколько типов и подтипов порока:
- Тип I. Характерно хорошее функционирование обеих дуг аорты, гемодинамика длительное время остается нормальной.
- Тип II. Одна из аортальных дуг хорошо функционирует (чаще правая), а вторая подвергается атрезии (заращению) на определенном участке.
- Подтип А. Атрезированный участок расположен между артериальной связкой и нисходящим отделом аорты.
- Подтип В. Атрезия в промежутке от подключичной артерии до артериальной связки.
- Подтип С. Атрезия участка двойной аортальной дуги, расположенной между общей сонной и подключичной артериями.
- Подтип D. Атрезия локализована между восходящей аортой и общей сонной артерией.
Клинические проявления двойной дуги обусловлены нарушением вентиляции воздуха через трахею и нарушением прохождения пищи по пищеводу. В большинстве случает первые симптомы аномалии проявляются сразу после рождения ребенка либо в раннем детстве. Начальные признаки наличия двойной дуги аорты — шумное учащенное дыхание, эпизоды рефлекторного апноэ. У младенцев наблюдаются частые срыгивания. В время кормления бывает синюшность кожи вокруг губ.
У детей около года и старше выявляются затруднения при глотании твердых продуктов, отказ от еды. Периодически возникают приступы кашля, сочетающиеся с периоральным цианозом. Одышка беспокоит как при физических нагрузках, так и в покое. Для больных с двойной аортальной дугой типичны частые респираторные заболевания (трахеиты, бронхиты), которые имеют затяжное течение и тяжело купируются медикаментами.
В редких случаях аномалия проявляется у старших детей, подростков или взрослых. Пациенты ощущают препятствия во время глотания твердой пищи, чувство «застревания» еды в пищеводе. После еды часто ощущаются боли и распирание в грудной клетке, иногда бывает рвота неизмененной пищей. Дыхание становится шумным, появляются хрипы, которые слышны на расстоянии. Характерна приступообразная одышка, усиливающаяся при небольшой физической нагрузке.
При двойной дуге аорты нарушается работа дыхательной, сердечно-сосудистой и пищеварительной систем. Сдавление трахеи и бронхов провоцирует хроническое воспаление слизистой, сопровождающееся кашлем и выделением мокроты. При длительной персистенции бронхита происходит необратимый фиброз стенок дыхательных путей. Из-за снижения проходимости пищевода дети медленно набирают вес, отстают в физическом развитии.
Патологическое сосудистое кольцо нарушает гемодинамику в крупных артериях и венах. Происходит утолщение аортальной стенки, повышается ее ригидность, что создает благоприятные условия для раннего начала артериальной гипертензии. В области незрелых стенок двойной сосудистой дуги зачастую формируются аневризмы, которые могут спонтанно разрываться. Иногда наступает внезапная смерть от острых кардиологических или пульмональных осложнений.
Для ДДА характерно сходство клинических симптомов с бронхопульмональными и эзофагеальными заболеваниями, что требует от врача проведения дифференциальной диагностики. С учетом возраста обследованием больного занимается неонатолог, педиатр или терапевт-кардиолог. При физикальном исследовании выслушивается жесткое дыхание, хрипы в легких, патологические сердечные шумы. Для постановки диагноза проводятся инструментальные диагностические методы:
- МСКТ-ангиография. Мультиспиральная компьютерная ангиография аорты и магистральных сосудов рекомендована для получения трехмерного изображения, на котором четко видна двойная сосудистая дуга. С помощью МСКТ измеряют диаметр аорты на разных уровнях, обнаруживают участки атрезии.
- Эхокардиография. УЗИ сердца выполняется для исключения сопутствующих кардиальных пороков и оценки кровотока. Признаков органической патологии сердца в случае двойной дуги нет. При длительном существовании аномалии наблюдается снижение сердечного выброса, дискоординация сократимости миокарда.
- Бронхоскопия. Инвазивное эндоскопическое исследование дыхательных органов выявляет щелевидное сужение трахеи на участке бифуркации, а также признаки хронического воспалительного процесса в бронхах. Используется для дифференцировки ДДА с бронхолегочными болезнями.
- Дополнительные методы. ЭКГ регистрируется для оценки работы проводящей системы сердца, диагностики аритмий или блокады ножки пучка Гиса. На рентгенографии ОГК визуализируются расширенные и неструктурные корни легких, поля повышенной пневматизации легочной ткани.

КТ сердца. Двойная дуга аорты. Стрелками указаны правая и левая дуги аорты примерно одинакового размера.
Лечение двойной дуги аорты
Медикаментозное лечение ДДА показано для коррекции витальных функций на этапе предоперационной подготовки. Если определяется осложненное течение двойной дуги аорты, назначают патогенетическую терапию — антибиотики, глюкокортикоиды, бронходилататоры. При серьезных дыхательных нарушениях требуется перевод пациента в реанимационное отделение, обеспечение кислородной поддержки.
Оперативное вмешательство — единственный способ радикального лечения двойной дуги аорты. Операцию планируют в максимально ранние сроки после выявления ДДА, пока не наступили необратимые изменения в трахее или пищеводе. Кардиохирургическая тактика предполагает резекцию одной дуги аорты (чаще левой) с последующей пластикой ее стенки. После операции нормализуется гемодинамика и исчезает компрессия соседних органов.
Результаты хирургической коррекции двойной дуги аорты удовлетворительные: частота послеоперационных осложнений сведена к минимуму, после устранения компрессии состояние больных резко улучшается. При ранней диагностике и коррекции порока прогноз для жизни и здоровья благоприятный. Профилактика включает устранение тератогенных влияний у беременных женщин, пренатальную УЗ-диагностику.
1. Двойная дуга аорты у детей/ С.А. Котов, А.А. Свободов, В.С. Разумовский, Н.Т. Сирия// Детские болезни сердца и сосудов. — 2018.
2. Двойная дуга аорты с формированием сосудистого кольца и развитием синдрома компрессии трахеи и пищевода: особенности клинической картины, диагностики и хирургической тактики/ В.С. Аракелян, Н.А. Гидаспов, П.П. Куличков, Г.Б. Тачиева, О.И. Шишкина// Грудная и сердечно-сосудистая хирургия. — 2016.
3. Аномалии дуги аорты, образующие сосудистое кольцо: клиника, диагностика и методы хирургической коррекции. Автореферат диссертации/ С.Н. Беседин. - 1991.
4. Врожденные сосудистые кольца/ Раад Таммо, Т.А. Ялынская, Н.В. Рокицкая, Л.В. Рокицкая, Е.Б. Ершова// Лучевая диагностика, лучевая терапия. — 2010.
Атрезия аорты (Q25.2)
Атрезия аорты - тяжелый врожденный (часто - сочетанный) порок сердца, который заключается в закрытии устья восходящей части аорты. Обычно сочетается со следующими пороками:
- гипоплазия аорты;
- гипоплазия или атрезия левого желудочка;
- атрeзия или выраженный стеноз митрального клапана;
- открытый артериальный проток;
- дефект межпредсердной перегородки.
Причинами атрезии аорты могут быть врожденные или приобретенные факторы затруднения выхода крови из левого желудочка.
Порок относится к 1 категории тяжести, выявление его во время беременности позволяет ставить вопрос о ее прерывании.
Этиология и патогенез
Вследствие того, что дуга аорты состоит из трех сегментов, имеющих различное эмбриональное происхождение, возможен перерыв дуги аорты в различных местах с различной частотой.
В редких случаях длительного функционирования открытого артериального протока сохраняется удовлетворительная гемодинамика во всех отделах туловища. Но между системным и легочным кровотоком присутствует динамическая конкуренция и при увеличении легочного кровотока наблюдается снижение периферического кровоснабжения. С другой стороны, постоянный высокий легочный кровоток (из-за сброса крови через септальные дефекты) приводит к явлениям застойной сердечной недостаточности.
Эпидемиология
Атрезия аорты встречается с частотой от 0,5 до 7,8 % среди всех врожденных пороков сердца. У новорожденных с пороками сердца эта аномалия является одной из самых частых причин смерти - 25%. Порок чаще встречается у мальчиков.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
кожа землисто-серая, снижение двигательной активности, одышка в покое, учащенное дыхание, втяжение уступчивых мест грудной клетки, влажные хрипы в легких, синеватый цвет кожи (цианоз), сердечная недостаточность, увеличение печени, отеки
Cимптомы, течение
Сразу после рождения у ребенка отмечаются следующие симптомы:
- бледно-серый цвет кожных покровов;
- адинамия;
- выраженная одышка - до 80-100 дыхательных движений в минуту (тахипноэ) с втяжением уступчивых мест грудной клетки;
- влажные хрипы в легких (как проявление левожелудочковой недостаточности).
Ведущий симптом врожденной атрезии аорты - прогрессирующая сердечная недостаточность.
Печень, как правило, значительно увеличена. У трети детей в терминальной стадии развивается отечный синдром.
Важный клинико-диагностический критерий - слабый, едва ощутимый пульс на ногах и руках в сочетании с усиленным сердечным толчком и видимой эпигастральной пульсацией. Систолическое артериальное давление не превышает 60- 80 мм рт. ст.
Аускультативная картина неспецифична, возможно выявление приглушения тонов сердца, небольшого систолического шума.
Наличие врожденных пороков сердца возможно установить внутриутробно при проведении УЗИ.
При атрезии дуги аорты сразу после рождения у ребенка может развиться яркая картина заболевания, не дающая усомниться в диагнозе. Для уточнения диагноза проводят следующие исследования: электрокардиография, рентгенография органов грудной клетки, эхокардиография, ретроградная аортография.
1. Эхокардиография.
Фетальная ЭхоКГ: внутриутробная диагностика перерыва дуги аорты (как и изолированной коарктации аорты) представляет значительные трудности. Косвенные признаки порока - асимметрия желудочков с преобладанием правых отделов и уменьшение скорости кровотока в восходящей аорте.
2. Электрокардиография. У новорожденных сохраняется отклонение электрической оси сердца вправо. При длительном существовании порока развивается левожелудочковая или бивентрикулярная гипертрофия.
3. Рентгенография грудной клетки. У новорожденных рентгенологическая картина может быть не изменена. Тень сердца умеренно расширена, сосудистый пучок часто узкий в результате отсутствия тимуса (при синдроме DiGeorge). По мере снижения общего легочного сопротивления легочный рисунок усиливается по артериальному руслу. При развитии сердечной недостаточности возникают симптомы венозного застоя и отека легких.
При переходе к постнатальному типу кровообращения у большинства больных развивается критическая сердечная недостаточность, которая приводит к быстрой гибели новорожденных.
Лечение
Основной метод лечения новорожденных с перерывом дуги аорты - инфузия простагландинов группы Е для поддержания проходимости открытого артериального протока. Одновременно следует поддерживать адекватный внутрисосудистый объем крови и корригировать анемию.
Для поддержания сердечного выброса применяют инотропные препараты. Наиболее часто - используют допамин (4-6 мкг/кг/мин.), оказывающий дополнительное положительное действие на почечную функцию, которая страдает при перерыве дуги аорты.
Следует избегать высоких доз препарата, так как это может вызвать увеличение периферического сопротивления и смещение объема крови в легкие.
В некоторых случаях приходится прибегать к искусственной вентиляции легких, которая осуществляется в режиме, исключающем гипервентиляцию, и без добавления кислорода. Такие меры требуются для предотвращения закрытия открытого артериального протока или избыточного легочного кровотока.
Не рекомендуется стремиться к повышению системного S02 более 75-85%.
Необходимы постоянный контроль и коррекция метаболического ацидоза .
При наличии сопутствующего синдрома DiGeorge требуется периодическая проверка уровня кальция; переливание цитратной крови таким больным может быть опасным.
Прогноз
Смертность на 1-й неделе жизни составляет 71%, а к 6 месяцам - практически 100%.
После хирургического вмешательства летальность составляет 20-60%, продолжительность последующей жизни также невелика.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
Коарктация аорты у плода. Точность и ошибки диагностики
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова" Минсоцразвития РФ, Москва.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин "сoarctatius" означает "суженный, стиснутый". Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты - это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова " Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 - сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек - это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
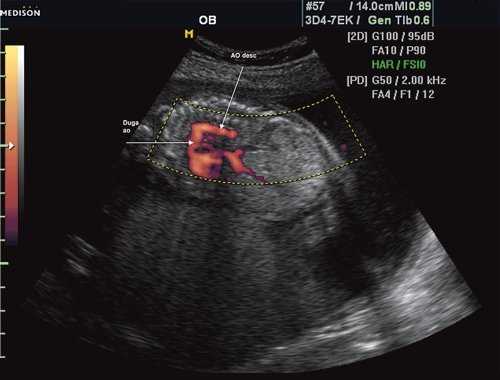
Рис. 1. Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно "теории дуктальной ткани" коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
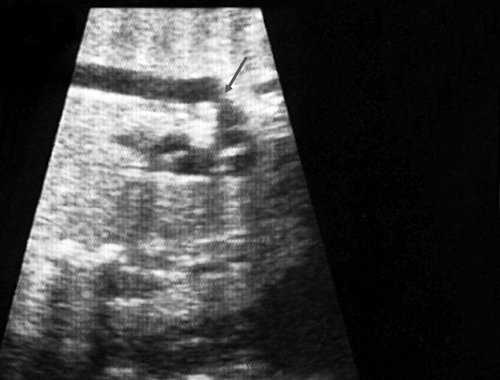
Рис. 2. Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
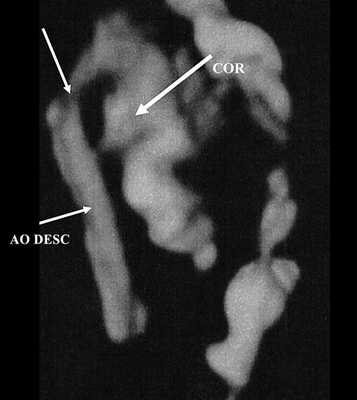
Рис. 3. Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC - нисходящий отдел аорты, COR - сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты - это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме - 1,1) и легочной артерии к аорте (у здоровых - 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).
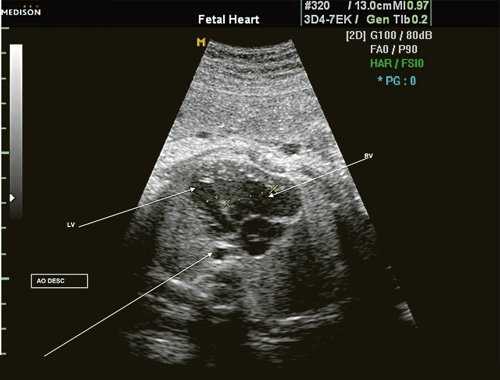
Рис. 4. Диспропорция размеров желудочков сердца при коарктации аорты. RV - правый желудочек; LV - левый желудочек; AO DESC - поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую - 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или "кинкинг" аорты - деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).
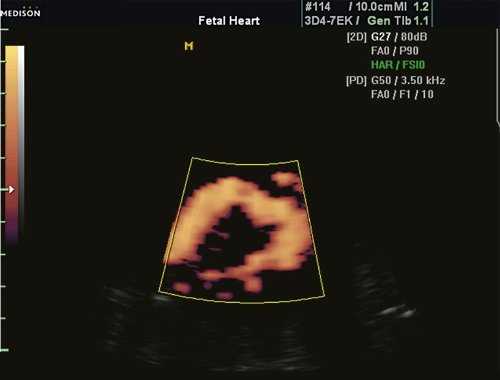
Рис. 5. Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак - визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка - на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
Читайте также:
