Допплерометрия при гемолитической болезни плода. Оценка гематокрита плода
Добавил пользователь Morpheus Обновлено: 21.01.2026
МБУЗ Городская клиническая больница № 1, Новосибирск; Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск; ГБОУ ВПО Новосибирский государственный медицинский университет Минздравсоцразвития России, Новосибирск
Цель исследования. Проанализировать собственные результаты за 10 лет и оценить эффективность внедренных современных методов пренатальной диагностики и лечения гемолитической болезни (ГБ) плода. Материал и методы. В исследование были включены 358 беременных, которые были разделены на 4 группы в зависимости от лечебной тактики: консервативное ведение и внутриутробное переливание крови плоду (ВПК), а также применяемого алгоритма (в периоды 1999-2005гг., когда учитывался анамнез, титр антител, наличие водянки у плода и 2006 - 2009гг, когда основой мониторинга плода становится максимальная скорость кровотока в средней мозговой артерии - МСКСМ). Результаты исследования. Внедрение мониторинга плода, основанного на измерении МСКСМ, позволило оптимизировать акушерскую тактику и достоверно снизить количество инвазивных диагностических вмешательств (р
Диагностика гемолитической болезни плода
Современная пренатальная диагностика гемолитической болезни плода основана на неинвазивном определении максимальной систолической скорости кровотока в средней мозговой артерии (МСС СМА), величина которой начиная с конца II и на протяжении III триместра беременности имеет выраженную корреляцию с уровнями гематокрита и гемоглобина в крови плода, получаемой при кордоцентезе [lb].
Другие неинвазивные ультразвуковые фетометрические показатели такие, как гепато-, сплено-, плацентометрия, допплерометрические показатели кровотока (в аорте плода, в вене и артериях пуповины) имеют лишь историческое значение и обладают низкой точностью в определении степени тяжести гемолитической болезни плода [5]. Исследование оптической плотности билирубина околоплодных вод, полученных при амниоцентезе, является инвазивной диагностической методикой и в настоящее время не применяется из-за низкой информативности. Выявление при УЗ-исследовании асцита и анасарки - сочетания гидроперикарда, гидроторакса, отека подкожной клетчатки головы, туловища и конечностей плода являются запоздалым свидетельством крайне тяжелого течения гемолитической болезни плода.
Ведущее место в диагностике анемии у плода занимает высокоинформативный неинвазивный метод - допплерометрическое исследование максимальной систолической скорости кровотока в средней мозговой артерии [25, 26, 27, 28]. Необходимо иметь ввиду, что после 35 недели беременности диагностическая значимость данного неинвазивного теста несколько снижается, и комплексная оценка состояния плода должна включать дополнительно результаты УЗ-фетометрии и КТГ.
Увеличение максимальной скорости кровотока в средней мозговой артерии плода для соответствующего срока беременности с высокой чувствительностью и специфичностью свидетельствует о развитии у плода гипердинамического типа кровообращения, а повышение значений этого показателя более 1,5 МоМ характерно для выраженной анемии [1В]. Использование показателя максимальной скорости кровотока в средней мозговой артерии плода позволило значительно снизить необходимость применения инвазивных внутриматочных диагностических вмешательств в целях получения крови плода.
При резус-изоиммунизации матери показано последовательное проведение серии допплерометрических определений МСС СМА с последующей зональной оценкой величин ее показателей (рис. 1). Данное исследование может проводиться амбулаторно, в условиях консультативного отделения регионального перинатального центра, имеющего возможность выполнения диагностических и лечебных внутриматочных инвазивных вмешательств. Кроме того, существует вероятность досрочного экстренного родоразрешения в виду развития осложнений при диагностических и лечебных внутриматочных инвазивных вмешательствах, что может потребовать оказания специализированной неонатальной помощи, которая возможна только в учреждениях 3 уровня.
- При нахождении показателя скорости кровотока в средней мозговой артерии в зоне "С" - показано повторное допплерометрическое исследование через 2 недели. При отсутствии повышения МСС СМА до зоны "А" - родоразрешение в соответствие с акушерской ситуацией при сроке беременности 38 недель +. Начиная с 36 недели беременности КТГ и допплерометрия кровотока в артерии пуповины и СМА 1 раз в неделю.
- При величине МСС СМА соответствующей зоне "В" - допплерометрию необходимо повторить через 7 дней. При отсутствии повышения МСС СМА до зоны "А" - родоразрешение проводится в соответствие с акушерской ситуацией при сроке беременности 38 недель +. Начиная с 36 недели беременности КТГ и допплерометрия кровотока в артерии пуповины и измерение МСС в СМА проводится каждые 3 дня.
- При величине МСС СМА соответствующей зоне "А", которая указывает на высокую вероятность развития тяжелой анемии у плода, показано вмешательство в течение беременности, вид которого зависит от срока беременности и возможности проведения кордоцентеза и последующего внутриматочного внутрисосудистого переливания плоду ЭМОЛТ.
A - наличие выраженной анемия тяжелой/средней степени, требующей вмешательства в течение беременности.
B - отсутствие тяжелой анемия у плода.
C - отсутствие анемии у плода.
Рис. 1. Оценка степени выраженности анемии плода в зависимости от максимальной систолической скорости кровотока в средней мозговой артерии плода и срока беременности
Значение одновременного использования автоматизированной кардиотокографии и ультразвуковой допплерометрии для оценки состояния плода во время беременности
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
Кардиотокография и ультразвуковая допплерометрия в настоящее время являются ведущими методами оценки состояния плода во время беременности.
До недавнего времени расшифровка кардиотокографии производилась на основании ее визуальной оценки. Однако значительный субъективизм при таком способе анализа мониторных кривых приводил к существенным расхождениям получаемых результатов. Так, по данным М.В. Медведева и Е.В. Юдиной [9], расхождения в заключении при интерпретации мониторных кривых, проведенных различными авторами, колебались от 37 до 75%. Более того, установлено, что различие в трактовке кардиотокографии при первой и второй ее расшифровке тем же исследователем достигало 28% [19]. Поэтому для повышения точности правильной оценки состояния плода рядом авторов первоначально была предложена методика балльной [2,25], а затем и математической расшифровки кардиотокографии [1,7,10]. При этом наиболее высокая точность в установлении наличия или отсутствия нарушений у плода (86,5%) была получена при использовании уравнения, предложенного В.Н. Демидовым и соавт. [5]. Достаточно высокую надежность этого уравнения при оценке состояния плода в последующем подтвердили и другие исследователи [7,8]. Однако необходимо отметить, что ручная обработка кардиотокографии имеет существенные недостатки: во-первых, она достаточно трудоемка, во-вторых, ее использование не позволяет рассчитать все необходимые элементы кривой. Все это в определенной мере снижает возможности широкого использования такого метода расчета кардиотокографии в клинической практике.
Чтобы избежать указанных недостатков, в последние годы были предложены компьютерные программы и приборы, позволяющие полностью автоматизировать процесс расшифровки кардиотокографии [21,23,24,29,34]. Именно такой подход, по мнению некоторых авторов [10,11,34,35], может способствовать существенному повышению точности диагностики состояния плода.
Несмотря на то, что допплерометрия в настоящее время является ведущим методом в оценке состояния плода, данные о его информативности существенно расходятся. Так, С. Гудмундссон [4] при ретроспективном анализе кровотока при гипотрофии плода констатировал его патологические изменения только в 56% наблюдений. Более надежные результаты были получены другими исследователями: по данным S. Campbell и соавт. [20], нарушение кровотока при гипотрофии плода при ретроспективном анализе отмечено в 68,5% случаев, а при проспективном - в 64,5%; по данным A. Fleisher и соавт. [26],-в 85,5 и 86% соответственно; по данным D. Arduini и соавт. [14],-в 74 и 75%; по данным А.Т. Бунина и соавт. [1], - в 87,6 и 87,6%; по данным Г.А. Григоряна [3]-в 95,9 и 88,9%. B.J. Trudinger и соавт. [36], H. Almstrom и соавт. [12], R.C. Pattinson и соавт. [31] расценивают измерение кровотока в артерии пуповины в качестве ценного метода при ведении беременных высокого риска. В то же время R.B. Beattie и соавт. [15] считают, что допплерометрия кривых скоростей кровотока в пуповинной артерии в качестве скрининговой методики не информативна при гипотрофии плода, а перинатальные потери не всегда связаны со снижением кровотока в артерии пуповины.
С учетом изложенногое, цель настоящего исследования состоит в уточнении значения автоматизированной кардиотокографии и ультразвуковой допплерометрии в диагностике состояния плода во время беременности.
Материалы и методы
Из всех обследованных нами плодов отставание в развитии отмечено у 18. Из них гипотрофия I степени имела место у 3, II степени-у 8 и III степени у 7. Внутриутробное инфицирование (пневмония) при рождении установлено у 12 детей. Важно отметить, что для анализа были отобраны только те пациентки, у которых процесс родов не оказал существенного влияния на состояние ребенка.
Для проведения кардиотокографии мы использовали автоматизированный антенатальный монитор (ААМ-04), созданный фирмой "Уникос" (Россия). Обычно регистрация кардиотокографии осуществлялась в течение 1 ч. После окончания исследования на дисплей монитора выводились все необходимые расчетные показатели, интегральный показатель состояния плода, кривая частоты сердечных сокращений плода (после устранения артефактов), базальная линия, отмечались также акцелерации и регистрировалась двигательная активность плода. При использовании данного монитора значение показателя состояния плода от 0,0 до 1,0 свидетельствует о здоровом плоде, значение от 1,1 до 2,0 - о начальных нарушениях его состояния, от 2,1 до 3,0 - о выраженном внутриутробном страдании и от 3,1 до 4,0 - о резко выраженном нарушении состояния плода. Основная отличительная особенность прибора состоит в том, что сон плода практически не влияет на конечный результат, а в сомнительных случаях прибор предлагает продлить исследование еще на 30 мин. Прогноз состояния новорожденных в наших наблюдениях был достоверен в течение первых 3 сут после рождения ребенка.
Результаты
При анализе данных автоматизированной кардиотокографии были получены следующие результаты (табл. 1). Из 60 плодов I группы показатель состояния плода ниже 1,0 имел место в 55 случаях; у 54 плодов, родившихся с различными нарушениями состояния, показатель состояния плода выше 1,0 отмечался в 49 наблюдениях. Таким образом, специфичность и чувствительность кардиотокографии, по нашим данным, составили 91,7% и 90,7% соответственно (в среднем 91,2%). При этом точность диагностики начальных нарушений состояния плода была не очень высокой и равнялась 56,5%; в то же время правильность установления выраженных и резко выраженных нарушений его состояния оказалась значительно выше, составив соответственно 72,7% и 77,8%. В среднем точность диагностики состояния плода по группам равнялась 74,7%.
Антенатальные эхографические мониторинги при гемолитической болезни плода
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Гемолитическая болезнь плода и/или новорожденного (ГБП, ГБН, ГБПН) - гемолитическая анемия, развивающаяся вследствие выработки иммунокомпетентной системой матери антител, разрушающих эритроциты плода. Наиболее часто антитела резус-отрицательной матери направлены против плодовых антигенов Rh, реже антитела вырабатываются в организме матери, имеющей группу крови 0, и направлены против групповых антигенов. Антитела проникают к плоду через плаценту.
Этиопатогенез ГБПН у Rh-отрицательной матери представлен следующей последовательностью: предшествующая беременность Rh-положительным плодом, плодово-материнские трансфузии в родах либо при прерывании беременности, иммунизация матери с формированием в ее крови anti-Rh антител (Rh-сенсибилизация), проникновение антител в кровь Rh-отрицательного плода, повреждающее (гемолитическое) действие антител на эритроциты плода, интоксикация плода и новорожденного продуктами распада гемоглобина. ГБПН является фактором высокого риска перинатальной смертности и заболеваемости [1, 2].
Существуют три клинические формы ГБПН: отечная, желтушная и анемическая. Проявления желтушной формы болезни: гипербилирубинемия, изменение окраски кожи и билирубиновая интоксикация новорожденного. При анемической форме имеются изолированные гематологические изменения (анемия, эритробластоз). Отечная форма (генерализованный врожденный отек) - наиболее тяжелая, имеющая крайне неблагоприятный прогноз, сопровождается значительным скоплением внеклеточной жидкости в тканях и полостях плода, фетальной гепато- и спленомегалией.
Инвазивный забор фетальной крови и гематологическое исследование позволяют наиболее точно диагностировать ГБП на антенатальном этапе. Очевидно, что поиск критериев, обеспечивающих неинвазивную, т. е. эхографическую, диагностику и оценку степени перинатального риска при сенсибилизированной беременности, является важной задачей современной перинатологии.
В акушерской клинике ультразвуковое (УЗ) исследование плода играет важную роль в диагностике ГБПН. Эхографические находки при отечной форме ГБП зависят от степени выраженности водянки. УЗ-проявления иммунной и неиммунной водянки плода практически одинаковы, к настоящему времени они подробно описаны в руководствах [2, 3]. К ранним признакам отечной формы ГБП относят плацентомегалию, гепатоспленомегалию плода и многоводие, к поздним - кардиомегалию и перикардиальный выпот, асцит, гидроторакс, повышенную эхогенность кишечника вследствие отека его стенки, отек подкожной клетчатки головы, туловища и конечностей плода (двойной контур) и расширение вены пуповины [4]. Некоторые авторы рекомендуют измерение длины печени плода в качестве критерия фетальной гепатомегалии [4, 5]. Что касается УЗ-биометрии фетальной селезенки, по мнению экспертов пренатальной эхографии, эти измерения чаще бывают неточными в связи с малым размером органа и методологической сложностью [6]. К сожалению, косвенные УЗ-признаки ГБП, которые рассматриваются как возможные индикаторы доклинических форм водянки плода (полигидрамнион, плацентомегалия, гепатомегалия и эхогенность кишечника плода), имеют недостаточную предсказательную ценность [7, 8].
Все перечисленное затрудняет пренатальное консультирование и прогнозирование результата беременности у сенсибилизированных женщин.
Кроме того, отсутствие стандартного регламента и алгоритма перинатальной тактики при аномальных показателях антенатальных мониторингов иммуноконфликтной беременности объясняется крайне низкой современной частотой подобных клинических случаев, что исключает получение доказательных выводов. Так, в крупном американском центре за 17 лет наблюдений было выявлено всего 167 случаев иммунной водянки плода, т. е. патология встречалась с частотой менее 10 случаев в год [3]. Опубликованный в 2009 г. ретроспективный анализ всех случаев Rh-иммунизации, имевших место в двух французских административных районах c 3 млн жителей, показал, что популяционная частота Rh-иммунизации в настоящее время ниже 0,41%о [13]. Это, по-видимому, связано с широким внедрением профилактических технологий Rh-десенсибилизации и с высоким уровнем контрацепции в экономически развитых регионах.
В настоящее время отсутствуют четкие протоколы ведения сенсибилизированной беременности в зависимости от результатов антенатальных УЗ-мониторингов, поскольку отсутствует доказательная база, основанная на результатах больших исследований. В каждом случае акушерская ситуация оценивается индивидуально, а алгоритмы отсутствуют. В частности, отсутствуют алгоритмы изменения перинатальной и акушерской тактики на основании допплерографии венозного протока (ВП) плода.
В то же время исследование гемодинамики ВП плода - важный компонент антенатальных допплеровских мониторингов беременности высокого перинатального риска (рис. 1). Различают два типа патологических изменений допплерограмм ВП: наличие а-реверсной волны и снижение фазы изоволюметрической релаксации (ИВР). Возрастание давления, гемодинамическая перегрузка и застой в правом предсердии отражаются возрастанием индексов сосудистого сопротивления ВП и появлением а-реверса. Фаза ИВР ВП - показатель функции миокарда. Период между систолическим и диастолическим пиками спектра кровотока ВП соответствует периоду ИВР миокарда, когда давление в предсердии и убывающее систолическое давление выброса сравнительно одинаковы. В этот период сердечная мышца расслабляется. Способность к полноценной релаксации в диастолу - важная функция миокарда. При гипоксии миокарда или ацидозе сердечная мышца становится менее податливой, хуже расслабляется и фаза ИВР снижается.

а) Норма, углубление между систолическим и диастолическим пиками (между 1 и 2) отражает период ИВР миокарда.
Оценка церебральной и центральной гемодинамики у новорожденных с перинатальной энцефалопатией
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Было обследовано 103 ребенка (I группа - 58 детей, родившихся недоношенными со сроком гестации 27-36 недель и массой при рождении от 910 до 1910 г, II группа - 45 детей, родившихся доношенными с массой от 2070 до 4400 г) в возрасте от 4 дней до 6 месяцев. Исследования проводились в динамике через 7-10 дней во время пребывания ребенка в стационаре на втором этапе выхаживания, а затем при явке его для наблюдения в поликлинику Научного центра здоровья детей РАМН (НЦЗД). Состояние всех детей в момент обследования было стабильным, а в клинической картине ведущей была неврологическая симптоматика различной степени тяжести. Всем пациентам проводили ультразвуковое исследование мозга и цветную допплерографию внутричерепных сосудов - передней мозговой, внутренней сонной и базиллярной артерий (рис. 1). Учитывали максимальную систолическую скорость (Vmax), среднюю скорость кровотока за время сердечного цикла (Vmean), минимальную диастолическую скорость (Vmin) и индекс резистентности RI=(Vmax-Vmin)/Vmin. Параллельно проводили ЭХО-кардиографическое исследование, определяя общий ударный объем (УО), вычисляемый как разница между диастолическим и систолическим объемами левого желудочка; эффективный ударный объем (УО эфф); минутный объем кровообращения (МО); фракцию изгнания (ФИ). Все ультразвуковые обследования проводили в одно и то же время - через 1 час после кормления детей в состоянии покоя. Регулярно оценивали пациентам соматический и неврологический статус и проводили общеклинические лабораторные исследования.
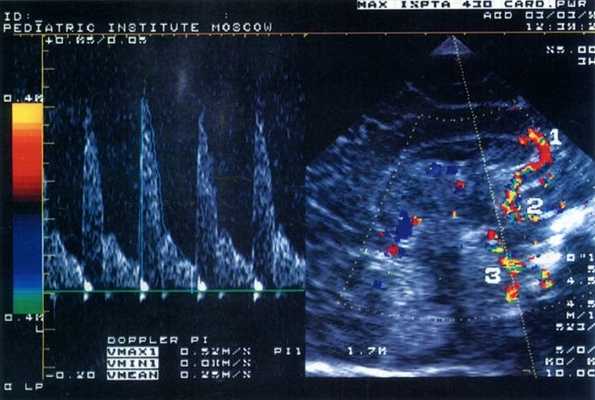
Рис. 1. Эхограмма головного мозга новорожденного (сагиттальный срез через большой родничок) и допплерограмма кровотока по базиллярной артерии.
Для вычисления описательных характеристик показателей центральной и церебральной гемодинамики обследованные были разделены на подгруппы по возрасту и периоду перинатальной энцефалопатии: первые 28 дней - острый период, старше 28 дней - восстановительный период.
Значения скоростей мозгового кровотока во всех трех обследованных сосудах были выше у доношенных детей по сравнению с недоношенными и в восстановительном периоде по сравнению с острым периодом (табл. 1). Другими словами, абсолютные скорости кровотока в крупных мозговых артериях повышались с увеличением массы тела, гестационного и постнатального возраста ребенка, что подтвердил корреляционный анализ. Наиболее выраженной была зависимость скоростей кровотока от массы тела (табл. 2). Индексы резистентности мозговых артерий были выше в группе детей, родившихся недоношенными (в остром периоде разница была высокодостоверной с р
| Показатель | Доношенные | Недоношенные | ||
|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | Восстановительный период | |
| V max ПМА, м/сек | 0,33±0,12 | 0,49±0,14 | 0,32±0,12 | 0,48±0,18 |
| V min ПМА, м/сек | 0,09±0,04 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean ПМА, м/сек | 0,20±0,08 | 0,30±0,09 | 0,19±0,07 | 0,29±0,12 |
| RI ПМА | 0,72±0,08 | 0,74±0,08 | 0,77±0,09 | 0,76±0,11 |
| V max ВСА, м/сек | 0,48±0,13 | 0,71±0,11 | 0,46±0,13 | 0,58±0,15 |
| V min ВСА, м/сек | 0,12±0,05 | 0,16±0,07 | 0,09±0,06 | 0,14±0,08 |
| V mean ВСА, м/сек | 0,29±0,09 | 0,41±0,07 | 0,26±0,09 | 0,35±0,12 |
| RI ВСА | 0,75±0,07 | 0,78±0,10 | 0,81±0,09 | 0,77±0,09 |
| V max БА, м/сек | 0,46±0,14 | 0,59±0,13 | 0,40±0,12 | 0,53±0,16 |
| V min БА, м/сек | 0,11±0,05 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean БА, м/сек | 0,27±0,09 | 0,34±0,08 | 0,22±0,07 | 0,32±0,11 |
| RI БА | 0,75±0,08 | 0,77±0,08 | 0,81±0,09 | 0,78±0,10 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
БА - базиллярная артерия.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Абсолютные показатели сердечного выброса - общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения были выше в группе доношенных детей как в остром, так и в восстановительном периодах (табл. 3). Так же, как и скорости мозгового кровотока, значения сердечного выброса увеличивались с увеличением массы тела у всех обследованных детей (табл. 2). Относительные показатели (сердечные индексы) - УО/кг, УО эфф/кг и МО/кг - были выше у недоношенных, что можно объяснить более высокими темпами роста, большей потребностью в кислороде и напряженностью метаболических процессов у таких детей по сравнению с доношенными.
Таблица 2. Коэффициенты корреляции между массой тела при обследовании и показателями центральной и церебральной гемодинамики (р<0,01).
| Дети | УО эфф | УО эфф/кос | МО | МО/кг | УО | УО/кг |
|---|---|---|---|---|---|---|
| Доношенные | 0,42 | -0,47 | 0,37 | -0,44 | 0,43 | -0,48 |
| Недоношенные | 0,69 | -0,31 | 0,60 | -0,36 | 0,57 | -0,42 |
| Дети | Vmax ПМА | Vmin ПМА | Vmean ПМА | RI ПМА | Vmax ВСА | Vmin ВСА |
| Доношенные | 0,27 | 0,28 | 0,30 | - | 0,35 | 0,30 |
| Недоношенные | 0,51 | 0,57 | 0,55 | -0,27 | 0,36 | 0,37 |
| Дети | Vmean ВСА | RI ВСА | Vmax ВСА | Vmin ВСА | Vmean ВСА | RI ВСА |
| Доношенные | 0,34 | - | 0,43 | 0,40 | 0,46 | - |
| Недоношенные | 0,37 | -0,23 | 0,42 | 0,54 | 0,50 | -0,34 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Один из основных параметров сократимости миокарда - фракция изгнания - в обеих группах был одинаковым и соответствовал норме.
| Показатель | Доношенные | Недоношенные | ||||
|---|---|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | P1 | Восстановительный период | P2 | |
| УО, мл | 6,35±1,61 | 6,70±2,04 | 4,84±0,99 | 5,78±1,81 | ||
| УО/кг, мл/кг | 2,08±0,60 | 1,78±0,48 | 2,27±0,58 | 2,14±0,56 | ||
| УО эфф, мл | 6,14±1,55 | 6,85±2,16 | 4,58±1,20 | 5,90±2,22 | ||
| УО эфф/кг, мл/кг | 2,01±0,54 | 1,71±0,55 | 2,16±0,67 | >0,05 | 2,09±0,58 | |
| МО, л/мин | 0,91±0,26 | 1,04±0,31 | 0,70±0,19 | 0,92±0,33 | ||
| МО/кг, л/мин/кг | 0,30±0,09 | 0,26±0,09 | 0,33±0,11 | 0,33±0,10 | ||
| ФИ | 0,69±0,04 | 0,69±0,04 | 0,69±0,03 | - | 0,69±0,05 | - |
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
ФИ - фракция изгнания.
P1 - коэффициент достоверности по отношению к подгруппе доношенных детей в остром периоде.
Р2 - по отношению к подгруппе доношенных детей в восстановительном периоде.
Между сердечными индексами и скоростями мозгового кровотока связь была обратной в обеих группах детей.
Зависимости между показателями мозгового кровотока, в том числе и индексами резистентности, и частотой сердечных сокращений в нашем исследовании не выявлено.
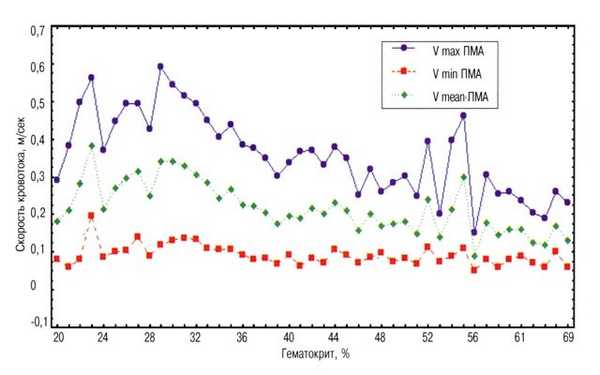
Рис. 2. Зависимость скоростей кровотока в передней мозговой артерии от величины гематокрита.
Результаты наших исследований показали, что у новорожденных детей с перинатальным гипоксическитравматическим поражением головного мозга после выхода их из критического состояния основными факторами, влияющими на показатели мозгового кровотока, были масса тела, гестационный и постнатальный возраст - так же, как и у здоровых новорожденных [3]. Это говорит о том, что нарушения мозгового кровотока без тяжелых органических изменений в головном мозге носят преходящий характер и быстро компенсируются.
Абсолютные скорости кровотока в крупных мозговых артериях растут с увеличением возраста и, в большей степени, массы тела ребенка. Индексы резистентности снижаются с увеличением гестационного возраста, т.е. у недоношенных детей, резистентность сосудов мозга в норме выше, чем у доношенных.
Сердечный выброс в обеих группах обследованных детей увеличивался с возрастанием массы тела, что также согласуется с литературными данными в отношении здоровых новорожденных [4, 5].
Обнаруженную нами положительную связь между сердечным выбросом и скоростями кровотока в передней мозговой и базиллярной артериях у недоношенных детей, на первый взгляд, можно объяснить влиянием на эти показатели массы тела. Известно, что связь между двумя физиологическими параметрами может быть не прямой, а опосредованной через третий показатель. Такое объяснение применимо к обнаруженной нами обратной связи между сердечными индексами и скоростями кровотока в мозговых артериях - с возрастанием массы происходит увеличение скоростей, но в меньшей степени, чем снижение значений сердечного выброса на килограмм веса, причем такое соотношение соблюдается в обеих группах обследованных детей.
У недоношенных детей имеется достоверная прямая зависимость абсолютных значений сердечного выброса и скоростей мозгового кровотока от массы тела. Однако такая же зависимость выявлена и у доношенных детей, но между собой показатели сердечного выброса и мозгового кровотока в этой группе не были связаны. Это означает, что зрелые новорожденные в стабильном состоянии уже со второй недели жизни обладают способностью поддерживать постоянство кровоснабжения мозга независимо от изменений центральной гемодинамики.
Н.С. Lou et al [6], обследуя доношенных и недоношенных новорожденных, находившихся в критическом состоянии (перенесших тяжелую асфиксию или имевших тяжелый синдром дыхательных расстройств), методом оценки клиренса радиоактивного ксенона, обнаружили у них прямую связь между мозговым кровотоком и изменениями артериального давления. Авторы назвали этот феномен нарушением ауторегуляции. Позже, с помощью допплерографического метода наличие такой же связи было установлено у глубоконедоношенных детей (с гестационным возрастом менее 31 недели и весом при рождении менее 1501 г) [7]. Из-за отсутствия регуляции мозговой кровоток пассивно следовал за изменениями артериального давления, увеличивая риск развития ишемических поражений при гипотензии и кровоизлияний при повышении артериального давления.
В нашем исследовании мы измеряли не артериальное давление, а непосредственно сердечный выброс у доношенных и недоношенных детей, находившихся в стабильном состоянии. Все обследованные дети живы и, более того, ни у одного ребенка с момента начала наблюдения не появилось новых патологических очагов ишемического или геморрагического генеза в головном мозге.
Мы полагаем, что выявленная нами зависимость мозгового кровотока от сердечного выброса у детей, родившихся ранее 34-й недели гестации, говорит не о тяжести состояния ребенка, а отражает морфологические особенности сосудистой системы мозга на этом этапе развития. К ним можно отнести значительную незрелость в количественном и качественном отношениях всех трех слоев стенок внутримозговых сосудов, а также наличие широких анастомозов между ветвями отдельных артерий и их связь с венами. После 30-32-й недель внутриутробного развития начинается регрессия артериальных анастомозов, бурный рост капиллярной сети, дифференцировка и созревание нервных окончаний и гладко-мышечных компонентов сосудистой стенки. Причем формирование внутримозговой ангиоархитектоники продолжается и у доношенных детей длительное время после рождения [8].
Результаты наших исследований еще раз подчеркивают необходимость максимально щадящей тактики выхаживания детей, родившихся недоношенными. Такое выхаживание должно включать в себя: придание удобного положения, поддержание стабильного уровня температуры тела (в кювезе или кроватке с подогревом), кормление через зонд (поскольку для незрелого ребенка даже акт сосания является серьезной физической нагрузкой), ограничение различных манипуляций, особенно связанных с болевыми ощущениями.
При обследовании новорожденных с перинатальным поражением головного мозга мы рекомендуем пользоваться не абсолютными значениями скоростей артериального кровотока ввиду их значительной вариабельности и зависимости от большого количества внешних факторов, а индексами резистентности, учитывая поправку на гестационный возраст. У недоношенных детей, особенно родившихся ранее 34-й недели гестации, также необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Литература
УЗИ сканер RS80
Читайте также:
