Доступ и ход операции ушивания разрывов селезенки
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
Число пострадавших в автоавариях, от стихийных бедствий и терроризма ежегодно увеличивается и является основной причиной смерти лиц до 40 лет, опережая летальность от сердечно-сосудистых и онкологических заболеваний [1, 3-6, 10, 17, 20-22, 25].
Закрытые повреждения живота при сочетанной травме выявляются у 19-40% пострадавших [6-9, 12, 14, 18, 19, 22, 23]. Разрывы селезенки при закрытой травме живота встречаются в 17-23% при сочетанных и в 11-13% наблюдений при изолированных повреждениях [11, 13, 15, 16, 24]. Травмированная селезенка подвергается хирургическому удалению в 99% наблюдений. Методы достижения гемостаза в зонах повреждений органа даже при использовании современных технологий не исключают высокого риска рецидива кровотечения и релапаротомии, которые резко ухудшают прогноз выживаемости [2, 5, 11, 13, 15]. В то же время удаление селезенки способствует развитию синдрома постспленэктомического гипоспленизма, который манифестирует увеличением гнойно-септических и плевролегочных осложнений. В отдаленном периоде наиболее опасны развитие молниеносного сепсиса с летальностью 50-70%, а также активное снижение антибластической резистентности и выраженный астенический синдром [2, 5, 20, 23, 24]. В связи с этим выбор альтернативного спленэктомии (СЭ) метода сохранения иммунокомпетентного органа остается актуальным.
Материал и методы
Мы представляем результаты хирургического лечения 383 больных, оперированных с 1987 по 2012 г. по поводу сочетанной (n=273) и изолированной (n=110) травмы живота с разрывом селезенки. Произведено 228 СЭ и 155 органосохраняющих операций с лигированием селезеночной артерии (ОСО+ЛСА), из них 34 эндохирургические. Самому молодому пациенту было 16 лет, самому пожилому- 56 лет. Соотношение мужчин и женщин 6,2:1. Средний возраст составил 30,7±14,8 года.
Основная группа представлена 155 пострадавшими, которым была выполнена ОСО на поврежденной селезенке. У 63 пострадавших травма живота была изолированной, у 92 - сочетанной.
Контрольная группа состояла из 228 больных, которым при закрытой травме живота с повреждением селезенки была выполнена СЭ. При этом у 47 больных селезенка удалена при изолированной травме живота, у 181 - при сочетанной.
К причинам изолированной травмы живота отнесены: избиение - 69 (62,73%), автодорожная травма - 29 (26,37%), падение с высоты - 1 (0,90%), прочие - 11 (10%). Среди сочетанных повреждений были автодорожная травма у 184 (67,39%) пострадавших, избиение у 58 (21,25%), падение с высоты у 10 (3,67%) и прочие у 21 (7,69%) пострадавшего.
В течение первых 6 ч с момента получения травмы поступило наибольшее количество больных - 305 (79,63%), в интервале 6-12 ч - 61 (15,92%), более чем через 12 ч - 17 (4,43%). Более 86% пострадавших госпитализированы в состоянии шока. Более 89% СЭ и 98% ОСО выполнены пациентам при наличии повреждений тяжелой степени (балл ВПХ-МТ 1,2-12,2) [6].
В состоянии алкогольного опьянения в момент поступления оказались 150 (39,2%) пострадавших. Для более корректного сравнения результатов хирургического лечения из исследования были исключены лица с циррозом печени, вирусным гепатитом, наркоманией, ВИЧ-инфекцией.
Закрытая травма живота с повреждением селезенки наиболее часто сочеталась с травмой груди, преимущественно левых отделов - 99 (25,84%) и черепно-мозговой травмой - 64 (16,71%) пострадавших. Одномоментное повреждение трех и более анатомических областей наблюдалось у 111 (28,98%) пациентов. У всех оперированных больных отмечался гемоперитонеум. Сочетание травмы более двух органов брюшной полости и забрюшинного пространства имело место в 292 (76,24%) наблюдениях. Острая кровопотеря составляла от 600 мл до 4,5 л.
Общая летальность составила 11,74% (умерли 45 из 383 пострадавших), при этом в 1-е сутки - 30 (7,83%).
Основной причиной смерти 25 (55,55%) из 45 умерших явился отек головного мозга как следствие черепно-мозговой травмы. Среди них в 1-е сутки умерли 14 больных (летальность составила 31,11%). Острая массивная кровопотеря, шок послужили причиной смерти 14 (31,11%) пострадавших. Все случаи смерти констатированы в первые часы (сутки) с момента поступления в стационар. После 6 сут пребывания в стационаре умерли 11 (24,45%) больных в связи c нарастанием отека головного мозга и 6 (13,33%) больных от легочно-сердечной недостаточности.
Результаты
Методика сохранения поврежденной селезенки описана нами ранее [2] и заключается в лапаротомном или лапароскопическом доступе в брюшную полость, лигировании (клипировании) селезеночной артерии, аспирации крови для аутогемотрансфузии, окончательной остановке кровотечения в зонах разрыва селезенки, санации и дренировании брюшной полости.
При торакоабдоминальном повреждении лапароскопию выполняли только после дренирования плевральной полости, что жизненно необходимо, так как создание карбоксиперитонеума при дефекте диафрагмы сопровождается напряженным пневмотораксом, вызывая риск смещения органов средостения с рефлекторной остановкой сердца. В этих ситуациях предпочтителен лапаротомный доступ.
Важно подчеркнуть, что во время операции ни в одном наблюдении мы не отметили продолжающегося кровотечения в момент ревизии (см. рис. 1 и далее на цв. вклейке). Рисунок 1. Данные видеолапароскопии. Этапы операции. а - осмотр зоны поперечного разрыва тела селезенки со сгустком до лигирования селезеночной артерии. Селезенка увеличена, капсула ее напряжена. Рисунок 1. Данные видеолапароскопии. Этапы операции. б - наложение клипсы на селезеночную артерию. Рисунок 1. Данные видеолапароскопии. Этапы операции. в - осмотр зоны коагуляции разрыва тела «спавшейся» селезенки после лигирования селезеночной артерии. Селезенка спавшаяся, без напряжения. Кровотечение из мест разрывов селезенки возобновлялось только после удаления фиксированных сгустков.
Сначала мы лигировали селезеночную артерию, считая это необходимым условием для дальнейшего сохранения селезенки. В ходе операции эта манипуляция позволяет уменьшить размер органа, снять эффект напряженности ее капсулы, что создает для хирурга условия безопасности выполнения дальнейших действий. Следующим этапом удаляли сгустки из зоны разрыва с окончательной остановкой кровотечения путем ушивания или коагуляции.
Селезенка находится в состоянии «покоя» с момента лигирования артерии, т.е. не меняет интраоперационный размер в сроки от 7 дней до 3,5 нед [2], это условие является достаточным для заживления зон разрыва органа и предотвращения послеоперационных кровотечений.
К объективным критериям оценки эффективности органосохраняющего метода относятся УЗИ для оценки в динамике состояния мест разрывов селезенки, восстановление сократительной функции органа в сроки до 3,5 нед, МСКТ-ангиография с мультипланарными и трехмерными реконструкциями, позволяющая оценить состояние ретроградного кровотока в селезеночной артерии. Ультразвуковая ангиография (в 3D/4D-режимах) дополняет данные КТ с визуальной оценкой зоны вмешательств и развития коллатерального кровообращения ворот селезенки.
С учетом улучшения технического обеспечения до- и послеоперационного обследования 10 пострадавшим выполнена МСКТ-ангиография.
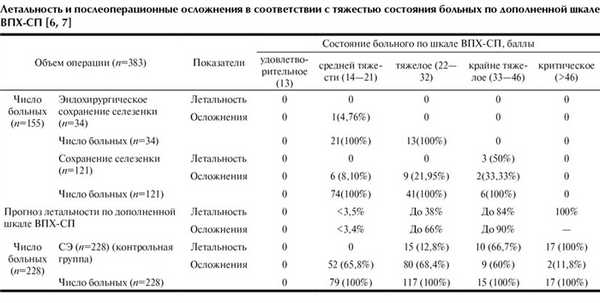
Сохранение поврежденной селезенки способствует снижению летальности и осложнений (см. таблицу). Так, в группе перенесших СЭ в состоянии средней тяжести (по шкале ВПХ-СП) количество больных с осложнениями составило 65,8% и уменьшилось при ОСО+ЛСА до 7,29% (7 из 96), из них при лапаротомном доступе до 8,1% (6 из 74) и при лапароскопии до 4,76% (1 из 21) (р<0,03). В группе больных в исходно тяжелом состоянии летальность снижалась с 12,8% при СЭ до 0 при ОСО+ЛСА. Частота осложнений уменьшилась соответственно с 68,4 до 21,95% и 0 (р<0,003). У пострадавших в исходно крайне тяжелом состоянии летальность снижалась с 66,7 до 50% (р<0,05), а частота послеоперационных осложнений - с 60 до 33,33%. Пострадавшим в критическом состоянии (n=17) выполняли только СЭ. Летальность обусловлена травмой, несовместимой с жизнью. При этом 15 пострадавших умерли в 1-е сутки, 2 - в поздние сроки при развитии осложнений.
Послеоперационные гнойно-септические осложнения развивались преимущественно с 5-7-х суток и имели место у 149 (65,4%) из 228 пострадавших после СЭ и у 18 (11,61%) из 155 после ОСО+ЛСА. К ним относили нагноение операционной раны, образование абсцессов в брюшной полости и распространенный перитонит, а также легочно-плевральные воспалительные процессы.
Наибольшее количество осложнений - 69 (18,01%) составили плевролегочные. Это обусловлено сопутствующей травмой груди и развитием в 1-2-е сутки острого респираторного дистресс-синдрома, травматического пневмонита с последующим присоединением пневмонии. У больных, перенесших СЭ, плевролегочных осложнений было больше, они возникли у 55 (24,12%) из 228 пострадавших, после ОСО+ЛСА - у 13 (8,38%) из 155, соотношение составило 2,9:1. Плевролегочные осложнения после ОСО+ЛСА встретились после традиционной СЭ у 12 (7,74%) из 155 больных и после лапароскопической у 1 (0,64%) из 155. После СЭ у 39 (17,1%) пациентов образовались абсцессы в левом поддиафрагмальном пространстве у ложа удаленной селезенки. Из них у 3 (1,3%) абсцесс сочетался с левосторонней плевропневмонией. После ОСО+ЛСА подобных осложнений не было. У 6 (2,63%) из 228 больных после СЭ и ушивания тонкой кишки по поводу травматического нарушения ее целостности отмечался послеоперационный перитонит с нагноением раны. Всего нагноение операционной раны после СЭ отмечалось у 43 (18,9%) больных, после ОСО+ЛСА - лишь у 5 (3,22%).
Таким образом, число летальных исходов и послеоперационных гнойно-септических осложнений прямо пропорционально исходной степени тяжести травмы и тяжести состояния пострадавших и статистически достоверно снижалось при ОСО+ЛСА (более чем в 5 раз).
Результаты клинических наблюдений и МСКТ-ангиографии в ближайшем послеоперационном периоде у больных после ОСО позволили отметить неосложненное заживление мест повреждений органа за счет эффективного развития естественного коллатерального кровообращения.
В отдаленном периоде для изучения коллатерального кровообращения нами была использована неинвазивная методика трехмерной (3D-режим) ультразвуковой ангиографии селезенки с определением показателей кровотока. Были обследованы
26 пациентов в сроки от 2 до 9 лет после ОСО на селезенке, 11 из них после лапароскопических и 15 после традиционных (лапаротомных) органосохраняющих вмешательств. Контрольную группу составили 13 здоровых добровольцев, ранее не оперированных.
Результаты первого этапа исследования в режиме серой шкалы и цветового допплеровского картирования позволили уточнить, что у пациентов после ОСО+ЛСА селезенка имела ровные контуры, средние размеры, однородную эхоструктуру, не отличимую от таковых в группе неоперированных здоровых людей (рис. 3, а). Рисунок 3. Ультрасонограммы. а - в режиме серой шкалы селезенка с ровными четкими контурами размером 10,5×7,2 см через 8 лет после ОСО+ЛСА по поводу закрытой травмы живота с повреждением селезенки; б - в режиме цветового допплеровского картирования селезеночная артерия с четко визуализированным местом лигирования. В селезеночной артерии выявлялось место лигирования (рис. 3, б). Рисунок 3. Ультрасонограммы. б - в режиме цветового допплеровского картирования селезеночная артерия с четко визуализированным местом лигирования.
Трехмерная ультразвуковая реконструкция сосудов селезенки (рис. 4, а, б) Рисунок 4. Ультразвуковые ангиограммы. а - вид сосудов селезенки в режиме 3D-реконструкции после ОСО+ЛСА (06.09.02). Рисунок 4. Ультразвуковые ангиограммы. б - вид сосудов селезенки неоперированного добровольца, страдающего язвенной болезнью двенадцатиперстной кишки в режиме энергетической допплерографии (3D-режим). у больных после ОСО+ЛСА показала хорошо развитое магистральное артериальное дерево, отделение сегментарных сосудов от селезеночной артерии, их взаимоотношение между собой и деление на мелкие трабекулярные сосуды.
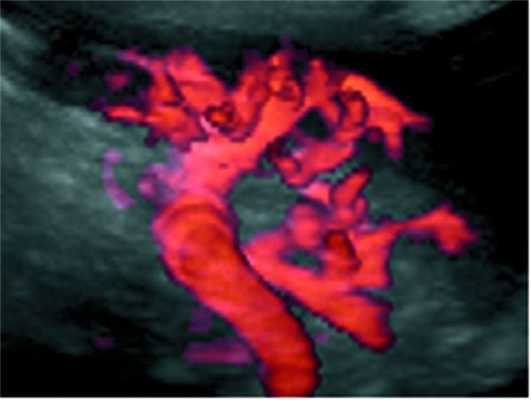
При сравнении данных ультразвуковой ангиографии, проведенной у здоровых неоперированных людей (рис. 4, в), Рисунок 4. Ультразвуковые ангиограммы. не получено отличий от пациентов, перенесших ОСО+ЛСА (см. рис. 4, в), возможно, лишь визуально сосуды оперированных пациентов были более разветвлены.
Таким образом, изучение артериального кровоснабжения селезенки до и после ОСО+ЛСА с использованием МСКТ с внутривенным болюсным трехфазным контрастированием в ближайшем послеоперационном периоде и ультразвуковой ангиографии в отдаленном периоде в режимах трехмерной реконструкции достоверно подтверждало тот факт, что при данном методе лечения не создавалось ишемии в зоне кровоснабжения тела и хвоста поджелудочной железы и в воротах селезенки и отмечалось хорошее заживление зон повреждения органа за счет естественного коллатерального кровообращения.
Число летальных исходов и послеоперационных гнойно-септических осложнений было прямо пропорционально исходной степени тяжести травмы и тяжести состояния пострадавших и статистически достоверно снижалось при сохранении травмированной селезенки более чем в 5 раз.
Снижение интраоперационной кровопотери и отсутствие рецидивов послеоперационного кровотечения позволяют предполагать, что метод органосохраняющей операции с лигированием селезеночной артерии является эффективной и безопасной альтернативой не только спленэктомии, но и другим методикам органосохраняющих операций при травме селезенки.
Разрыв селезенки
Разрыв селезенки - это нарушение целостности селезенки в результате травматического воздействия. Возникает при ударе в нижнюю часть левой половины грудной клетки или в область левого подреберья. Часто сочетается с повреждением других органов брюшной полости. Проявляется болями в левом подреберье и симптомами кровопотери, обычно наблюдаются признаки раздражения брюшины. Диагноз выставляется на основании клинических проявлений, данных лапароскопии и других исследований. Лечение оперативное - ушивание селезенки или удаление органа.
МКБ-10


Общие сведения
Разрыв селезенки - достаточно распространенное повреждение. Из-за высокой вероятности обильного кровотечения представляет непосредственную опасность для жизни, требует проведения немедленного оперативного вмешательства. Чаще встречается у лиц трудоспособного возраста, что обусловлено их более высокой физической активностью и более высоким риском попадания в экстремальные ситуации.
Разрывы селезенки могут быть изолированными, встречаться в составе сочетанной и множественной травмы (политравмы). Часто наблюдаются одновременные повреждения печени, брыжейки и толстой кишки. Возможно сочетание с переломами ребер, повреждением грудной клетки, переломом позвоночника, ЧМТ, переломом таза, переломами костей конечностей и другими повреждениями. Лечение данной патологии осуществляют травматологи и абдоминальные хирурги.

Причины
Разрыв селезенки встречается при различных высокоэнергетических травмах: падениях с высоты, промышленных, природных, железнодорожных или автодорожных катастрофах. К числу предрасполагающих факторов, повышающих вероятность повреждения селезенки, относятся недостаточно прочная тонкая капсула, полнокровие органа и его малая подвижность. С другой стороны, эти факторы нивелируются тем, что селезенка достаточно надежно защищена от внешних воздействий ребрами. Вероятность разрыва селезенки в результате травмы увеличивается при патологических процессах, сопровождающихся спленомегалией и повышением рыхлости паренхимы. Кроме того, прочность селезенки в некоторой степени зависит от степени ее кровенаполнения, положения органа в момент травмы, фазы дыхания, наполнения кишечника и желудка.
Патанатомия
Селезенка - паренхиматозный орган, расположенный в верхней левой части брюшной полости, кзади от желудка, на уровне IX-XI ребер. Покрыта капсулой. Имеет форму удлиненной и уплощенной полусферы, которая выпуклой стороной обращена к диафрагме, а вогнутой - к органам брюшной полости. Селезенка не относится к числу жизненно важных органов. Является основным источником лимфоцитов, продуцирует антитела, участвует в разрушении старых тромбоцитов и эритроцитов, выполняет функцию депо крови.
Классификация
В абдоминальной хирургии выделяют следующие виды разрывов селезенки:
- Контузия - наблюдается разрыв участка паренхимы при сохранении целостности капсулы органа.
- Разрыв капсулы без значительного повреждения паренхимы.
- Одномоментный разрыв селезенки - одномоментное повреждение капсулы и паренхимы.
- Двухмоментный разрыв селезенки - разрыв паренхимы, за которым через некоторое время следует разрыв капсулы.
- Разрыв капсулы и паренхимы с самостоятельной тампонадой (мнимый двухмоментный разрыв) - разрыв паренхимы быстро «закрывается» сгустком крови и кровотечение прекращается еще до появления выраженной клинической симптоматики. В последующем сгусток вымывается током крови, кровотечение возобновляется.
- Мнимый трехмоментный разрыв - двухмоментный разрыв, за которым через некоторое время следует самостоятельная тампонада, а позже - свободное позднее кровотечение.
Чаще всего наблюдаются одномоментные разрывы селезенки с немедленным возникновением кровотечения в брюшную полость. Двухмоментные разрывы составляют около 13% от общего количества закрытых повреждений селезенки, временной период между моментом травмы и началом кровотечения в брюшную полость колеблется от нескольких часов до 1-2,5 недель. Причиной разрыва капсулы при уже имеющейся центральной или подкапсульной гематоме становится физическое напряжение, чихание, кашель, ходьба, акт дефекации, поворот в постели и другие обстоятельства, вызывающие повышение давления в селезенке.
Большинство разрывов селезенки небольшие, сопровождаются стертой симптоматикой и диагностируются лишь через несколько часов, когда состояние больного ухудшается из-за продолжающейся кровопотери и скопления достаточного количества крови в брюшной полости. Профузное кровотечение с резким нарастанием клинических симптомов чаще наблюдается при двухмоментных повреждениях селезенки.

Симптомы разрыва селезенки
Клиника повреждений селезенки отличается большим разнообразием. Выраженность и наличие тех или иных проявлений зависят от степени разрыва, наличия или отсутствия сопутствующих повреждений, а также времени с момента травмы. Сразу после травматического воздействия может наблюдаться либо нерезкое ухудшение состояния, либо картина острой кровопотери без перитонеальных признаков, свидетельствующих о повреждении паренхиматозного органа. Основными жалобами в первые часы являются боли в районе левого подреберья и верхних отделах живота. Примерно у половины пациентов боли иррадиируют в левую лопатку и левое плечо.
Большинство больных принимают вынужденную позу: на левом боку с поджатыми ногами либо на спине. Брюшная стенка не участвует в акте дыхания. Степень напряжения брюшной стенки и выраженность болевого синдрома при пальпации живота может значительно варьировать как у разных больных, так и у одного и того же пациента в разные периоды после травмы. В отдельных случаях (при коллапсе или шоке) напряжение мышц живота может отсутствовать. Притупление звука в отлогих отделах живота при перкуссии наблюдается только при значительном кровотечении. Через некоторое время после травмы развивается парез кишечника, проявляющийся отсутствием дефекации, задержкой газов и вздутием живота.
Наряду с местными симптомами, наблюдается картина нарастающей острой кровопотери: бледность, липкий холодный пот, снижение АД, учащение пульса, рвота и тошнота, головокружение, прогрессирующая слабость, одышка и шум в ушах. В дальнейшем возможно двигательное возбуждение, сменяющееся потерей сознания, а также учащение пульса свыше 120 уд/мин и снижение АД ниже 70 мм рт. ст. При этом точно установить причину кровотечения на основании одних лишь клинических признаков удается не всегда, поскольку большинство перечисленных выше симптомов (за исключением болей в левом подреберье) непатогномоничны и появляются при любых острых катастрофах в животе.
Диагностика
Анализы крови на начальных этапах обследования малоинформативны, поскольку из-за механизмов компенсации кровопотери состав периферической крови может оставаться в пределах нормы в течение нескольких часов. Диагноз выставляется на основании клинических признаков, данных рентгенографии грудной клетки и рентгенографии живота. На рентгеновских снимках слева под диафрагмой определяется гомогенная тень. Дополнительными признаками разрыва являются ограничение подвижности и высокое стояние левого купола диафрагмы, расширение желудка, смещение левой части ободочной кишки и желудка вправо и книзу. При скудной клинической симптоматике, подкапсульных и центральных гематомах селезенки данные рентгенографии часто неспецифичны. Может потребоваться ангиография, однако этот метод не всегда применим из-за больших временных затрат, отсутствия необходимого оборудования или специалистов.
В настоящее время в связи с широким распространением эндоскопических методов все большее значение в диагностике разрывов селезенки приобретает лапароскопия. Эта методика позволяет не только быстро подтвердить наличие кровотечения в брюшную полость, но и точно установить его источник. При отсутствии эндоскопического оборудования альтернативой лапароскопии может стать лапароцентез - метод, при котором переднюю брюшную стенку прокалывают троакаром (полым инструментом), затем вводят через троакар катетер и выполняют аспирацию содержимого брюшной полости. Данная методика дает возможность подтвердить наличие кровотечения в брюшную полость, но не позволяет установить его источник.
Лечение разрыва селезенки
Кровотечения при подобных повреждениях крайне редко останавливаются самостоятельно, поэтому такая травма является показанием для экстренного хирургического вмешательства. Операция должна быть проведена в как можно более ранние сроки, поскольку нарастающая кровопотеря ухудшает прогноз. При возможности перед началом вмешательства добиваются стабилизации гемодинамики, осуществляя переливание крови и кровезаменителей. Если гемодинамические показатели не удается стабилизировать, операцию проводят даже при тяжелом состоянии пациента, параллельно продолжая осуществлять активные реанимационные мероприятия.
Классическим общепризнанным в травматологии и абдоминальной хирургии способом остановки кровотечения при любых разрывах селезенки считается полное удаление органа. Однако в последние годы, наряду с полным удалением, при отрывах фрагментов и неглубоких одиночных повреждениях некоторые хирурги в качестве варианта рассматривают органосохраняющую операцию - ушивание ран селезенки. Безусловными показаниями к полному удалению органа являются обширные разрывы и размозжения, разрывы в области ворот, обширные рваные и сквозные раны, невозможность надежного ушивания раны и прорезывание швов. В послеоперационном периоде после ушивания или удаления селезенки продолжают внутривенные инфузии крови и кровезаменителей, проводят коррекцию нарушений деятельности различных органов и систем, назначают обезболивающие и антибиотики.
Доступ и ход операции ушивания разрывов селезенки
Представлен обзор литературы, посвященный хирургическому лечению повреждений селезенки. Особое внимание отводится хирургическому лечению, направленному на сохранение этого органа с помощью лазерной техники. Показано, что практика использования операций, направленных на сохранение селезенки при ее травме прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока.
Значение селезенки в организме была описана Аристотелем (382-322 до н.э.). Несмотря на многочисленные научные исследования, некоторые функции селезенки до настоящего времени остаются невыясненными. Известно, что селезенка не относится к жизненно важным органам. Однако ей принадлежит ряд важных функций, таких как:
1) удаление микроорганизмов и антигенов из кровотока;
2) синтез иммуноглобулина и пропердина;
3) осуществление деструкции истощенных и патологически измененных эритроцитов;
4) участие в эмбриональном гемопоэзе, который при некоторых заболеваниях может выступать в качестве экстрамедуллярного гемопоэза [64, 87].
Повреждения селезенки при механической травме встречаются в 15-50 % от числа всех пострадавших с травмой живота [20, 45, 50, 53, 66]. Они занимают 2-3-е место после повреждений печени и кишечника [19, 29, 32, 44, 62]. При этом летальность достигает 25 % [25, 32]. Среди механизмов развития закрытых травм селезенки преобладают прямые удары в область левого подреберья, сдавления нижних отделов грудной клетки, сила инерции при падении с высоты [45]. Отмечено, что хрупкость селезеночной паренхимы обусловливает значительное внутрибрюшное кровотечение даже при небольших повреждениях капсулы. По данным П.Н. Зубарева и В.П. Еременко [26], D.E. Fri [66], 42-59 % больных с закрытой травмой селезенки госпитализируют в состоянии тяжелого геморрагического шока. При этом внутрибрюшная кровопотеря в среднем составляет 1685 мл [87].
Органосохраняющие операции при повреждениях селезенки пропагандируются лишь в отдельных публикациях [33, 35, 48]. При этом чаще других упоминается спленорафия, впервые выполненная Тиффани в 1894 году.
Вместе с тем вплоть до настоящего времени отношение к органосохраняющим операциям неоднозначно. Так, по мнению Р.Ш. Байдулатова [10], T.H. Ragsdale et al. [80], органосохраняющие операции часто оказываются сложными, не всегда гарантирующими от рецидива кровотечения. Из-за этого при большинстве травм селезенки авторы рекомендуют спленэктомию. В качестве относительного противопоказания к органосохраняющей операции некоторые ученые относят перитонит [22, 34, 37].
Зарубежные авторы [64, 87] разработали методику выбора того или иного органосохраняющего вмешательства в зависимости от морфологических типов нарушения целостности селезенки. Они различают 4 морфологических типа:
1. Первый тип - разрывы капсулы без нарушения целостности паренхимы.
2. Второй тип - разрывы капсулы селезенки сочетаются с нарушением целостности паренхимы.
3. Третий тип - разрывы распространяются на ворота органа.
4. Четвертый тип - фактически полное разрушение селезенки.
При повреждениях первого типа авторы накладывают швы нитью 3-0 из рассасывающегося материала. В подобных ситуациях ими используются также аппликации биологического клея или порошкообразного коллагена.
Повреждения второго типа, по мнению авторов, требуют иссечения размозженных тканей с последующим наложением глубоких швов (нить 3-0) с дополнительным укреплением их прядью сальника на ножке.
При повреждениях третьего типа выполняется резекция селезенки, или, выражаясь словами автора, - «частичная спленэктомия». К образующейся раневой поверхности фиксируют участок сальника, прибегают к аппликации биологического клея или порошкообразного коллагена.
Четвертый тип повреждения, естественно, требует удаления органа.
Массивные внутрибрюшные кровотечения, возникающие при повреждениях селезенки, нередко затрудняют выполнение органосохраняющих операций [36]. При глубоких разрывах паренхимы авторами предложена остановка кровотечения методом эмболизации, а при поверхностных разрывах - внутриартериального введения лекарственных веществ. Причем, это может быть использовано как с целью предоперационной подготовки больного, так и в качестве основного метода лечения.
При небольших повреждениях селезенки предложен метод гемостаза, заключающийся в заклеивании разрыва капсулы участком ксенобрюшины клеями МК-8 или МК-7. Ксенобрюшину используют также при разрывах в области полюсов органа, фиксируя ее непрерывным кетгутовым швом в виде колпачка. При ранениях в области ворот органа предложен метод «бинтования» ксенобрюшиной [13].
В случае разрыва селезенки на две части с сохранением их кровоснабжения используется методика, при которой раневые поверхности коагулируются, покрываются сеткой или гемостатической губкой, фиксируемых матрацными швами [60]. Авторами предложены следующие виды швов:
1. Горизонтально-матрацный - викриловой нитью с подкладкой из тефлона.
2. Матрацный - хромированным кетгутом.
4. Обычный - хромированным кетгутом с применением сетки.
Экспериментальными работами J.W. Alexander et al. [56], обосновано использование фибриновой пленки с целью гемостаза. Пленка, содержащая концентрированный фибриноген, обеспечивает хорошую системную и местную совместимость. Она может быть применена при паренхиматозных кровотечениях, что позволяет использовать минимальное количество травмирующих орган швов, способствует оптимальному заживлению ран селезенки.
Использование вышеописанных клеев не нашло широкого применения. Более эффективными оказались фибриновые клеи, клей Лигамент-Филанеду, принцип действия их заключается в воспроизведении конечных этапов свертывания крови [18, 42, 67].
Решая вопрос об оставлении фрагмента селезенки, не связанного с основными питающими сосудами ворот, при отсутствии других технических средств, В.В. Дибижев [24], накладывал зажим на сосудистую ножку. Отсутствие изменения цвета или пульсирующего кровотечения (за счет коротких желудочных или диафрагмальных сосудов) служили основанием к оставлению этого фрагмента в брюшной полости.
Возможна резекция селезенки с использованием сшивающего аппарата [7, 43, 86].
S. Frederic et al. [65], C.A. Steward [82], В.Н. Бордуновский [13], считают показанной резекцию при возможности сохранения 25 % органа.
Несомненно, перспективен метод гемостаза, предложенный В.С. Савельевым с соавт. [45], и Е.И. Бреховым с соавт. [14]. Метод разработан в экспериментальных условиях и заключается в использовании плазменных потоков для резекции, поврежденной селезенки. При воздействии на «сухое» операционное поле было отмечено значительное повышение гемостатических свойств. «Сухость» операционного поля достигается временным пережатием сосудов ворот селезенки или сдавливанием краев раны. При этом время воздействия уменьшалось со 100-120 до 60-80 с [14]. Е.И. Брехов с соавт. [14], и А.Д. Толстой с соавт. [49], сообщили об успешной остановке кровотечения из ран селезенки при ее интраоперационном повреждении.
Несомненный интерес представляют публикации, в которых в сравнительном аспекте содержатся некоторые сведения о применении лазерного скальпеля. Так, R. Orda et al. [78], выявили, что после резекции селезенки лучом СО2-лазера через 21-30 суток процессы организации заканчиваются включением в сформированный рубец инкапсулированных частиц, гигантских клеток и глыбок гемосидерина. Полное заживление после применения лазера наступало за три недели.
В.Н. Кошелев с соавт. [28], выполнили СО2-коагуляцию ран селезенки травматического происхождения у 24 больных с сохранением органа.
В результате многолетних исследований были определены противопоказания к применению СО2-лазера при травматических повреждениях. К ним относятся: тяжелое состояние больного, обусловленное шоком или сопутствующими повреждениями, отрыв селезенки от сосудистой ножки, полное размозжение органа, периспленит, разрыв патологически увеличенного органа. Кроме вышеописанных факторов, авторы подчеркивают, что для проведения подобных операций должна быть «настроенность» всего коллектива на сохранение органа [28].
Основными противопоказаниями к сохранению селезенки служат тяжелый шок с нестабильной гемодинамикой, значительное повреждение паренхимы, отрыв селезенки от сосудистой ножки [13,21,55,61].
С.А. Афендулов [8], F.P. Angelecu N. et al. [57], C.I.C. Nei et al. [76] считают, что выполнение органосохраняющих операций менее уместно в случаях шока, при одновременных повреждениях других органов брюшной полости, массивном загрязнении брюшной полости при проникающих ранах, при неконтролируемом артериальном кровотечении, при тяжелых нарушениях системы свертывания крови, при ожирении и преклонном возрасте.
Важно подчеркнуть, что добиться выполнения органосохраняющих операций в ста процентах наблюдений невозможно. Поэтому, в случае невозможности сохранения селезенки, альтернативой такой операции может быть аутолиентрансплантация [15, 41, 48, 54, 70, 85].
Начало экспериментальной разработки этого метода относится к 20-м годам ХХ века, а интенсивные исследования проблемы началось только в 60-е годы.
В настоящее время предложены многочисленные способы аутолиентрансплантации. К ним относят помещение фрагментов селезенки в большой сальник, в карман брыжейки [16, 76] или в мышечный массив забрюшинного пространства [85], кроме того, предложены способы аутолиентрансплантации в брыжейку тонкой кишки, толстой кишки [22].
Среди всех предложенных методик аутолиентрансплантации можно выделить 2 группы, используемые для подготовки селезеночной ткани к имплантации. К ним относится имплантация «кусочков ткани» с сохранением гистологической структуры и без сохранения структуры - имплантация пульпы или клеточной взвеси селезеночной ткани [8, 35].
При имплантации фрагментов ткани селезенки нарезают небольшие фрагменты органа, определенного размера, погружают в жидкость для удаления излишков крови и помещают в брюшную полость. С целью улучшения приживаемости аутолиентрансплантата Н.И. Батвинников и соавт. [11], предлагают промывать кусочки селезенки в физиологическом растворе с добавлением антибиотиков. Операция не занимает много времени [4, 6, 29, 46].
Имплантация пульпы ткани селезенки требует тщательного ее измельчения и обработки в биологически активных жидкостях, что значительно усложняет операцию [1, 2, 23, 30, 38].
И.И. Бабич и соавт. [9], разработали в эксперименте и применили в клинике оригинальный метод геторотопической аутолиентрансплантации в поперечную мышцу живота с прикрытием трансплантата прядью сальника на ножке. Н.А. Кущ и соавт. [30], предложили реплантацию гомогената пульпы селезенки, для приготовления которой использовали специальное устройство.
В работе А.А. Матиненко [35], показано, что процессы регенерации в ткани селезенки проходят три фазы: некробиотическую, восстановительную и структурной регенерации. Вновь образованная ткань селезенки имеет морфологически органо-типическую функцию [4, 41].
Использование гетеротопической аутолиентрансплантации селезеночной ткани у детей в разволокненную поперечную мышцу живота с перитонизацией прядью большого сальника на ножке позволило предупредить тяжелые осложнения и купировать синдром гипоспленизма [9]. Данная методика, по мнению авторов, обладает некоторыми преимуществами: оптимальными условиями питания селезеночной ткани в различные периоды реваскуляризации трансплантата, локализацией его в функциональном месте с участием в портальном кровообращении, перспективой роста «новой селезенки». В то же время получены сведения, что структурные повреждения в аутолиентрансплантате, изменения в его массе и кровообращении могут оказать отрицательное влияние на фагоцитарную активность [81].
В эксперименте было проведено исследование реваскуляризации фрагментов ткани селезенки в серозно-мышечно-подслизистом лоскуте желудка на сосудистой ножке [12]. При этом выявлена хорошая приживаемость имплантата. Авторы полагают, что селезеночная ткань не только замещает функционирующий орган, но и, в определенной степени, стимулирует адаптационно-компенсаторные процессы после спленэктомии, что проявляется реактивной гиперплазией лимфатических узлов уже с первых дней послеоперационного периода. Авторы считают, что имплантант начинает функционировать через 1-2 месяца.
Реимплантированная ткань селезенки в большинстве случаев хорошо адаптируется, о чем можно судить по тому, что тельца Жолли в эритроцитах, появляющиеся в ближайшее время после операции, перестают определяться к концу второй недели после операции [39]. Авторы показывают, что через 1,5-2 месяца трансплантат начинает визуализироваться при сцинтиографическом и ультразвуковом исследовании. В дальнейшем аутолиентрансплантат функционирует нормально, повышенной наклонности к инфекционным заболеваниям у оперированных больных не отмечается [63]. Вместе с тем оценки жизнеспособности и функциональной активности трансплантатов, высказанные после обследования пациентов, перенесших аутолиентрансплантацию, противоречивы. Так, М.М. Абакумов и соавт. [3], И. Фурка и соавт. [51] расценивают жизнеспособность трансплантатов полной. В то же время P. Klaune et al. [68], эффективность ее оценивают как сомнительную.
Существует точка зрения, что аутолиентрансплантация в сальник уменьшает смертность, повышает выживаемость экспериментальных животных [74]. При этом в клиренсе бактерий большую роль играет масса трансплантата и объем перфузионной ткани [83].
В раннем послеоперационном периоде осложнений не было, при этом авторы отмечают нормализацию иммунного статуса, связанную с регенерацией перенесенной ткани селезенки. К сожалению, отсутствуют сведения об отдаленных результатах этой процедуры (инфекционные осложнения, качество жизни, прогрессирование онкопроцесса, долговременная выживаемость). Негативным фактором следует считать возможные воспалительные осложнения самой аутоспленотрансплантации, которые в неотложной и гнойной хирургии могут достигать 30 % при экстраперитонеальном размещении фрагментов селезенки [5].
E. Kunz et al. [69], произвели 35 реимплантаций ткани селезенки в клинике, пересаживая 35-50 % от массы органа. Через год после операции при помощи сцинтиографии подтверждали наличие селезеночной ткани. При радиоизотопном исследовании с помощью эритроцитов, меченных 99 Тс, уже через две недели отмечалось накопление изотопов в зоне трансплантата [58, 84].
Радионуклидное исследование, выполненное J.C. Orlando et al. [79], показало нарастание функциональной активности селезенки, начиная со 2-й до 3-й недели. В то же время гистологические исследования обнаружили начало клеточной пролиферации с 5-й недели, восстановление структуры ткани к 7-й неделе, массы имплантированной ткани к 24-30-й неделе.
Однако, по мнению М.Х.A. Frederic [65], оценка функционального состояния фрагментов селезенки по степени включения в него радиофармопрепарата ( 99 Тс) не является исчерпывающей. В связи со сказанным, очевидно, что требуются более сложные иммунологические исследования.
К противопоказаниям для аутолиентрансплантации относят: наличие остаточных очагов ткани (спленоз, добавочная селезенка) после иссечения органа, тотальное поражение пульпы гнойно-деструктивным процессом, старческий (более 70 лет) возраст пациента [22].
Необходимо отметить, что в последнее время широкое применение нашла спленэктомия с использованием лапароскопической техники. По мнению К.В. Пучкова и соавт. [40], лапароскопическая спленэктомия является альтернативой открытой спленэктомии при гематологических заболеваний, и ее применение позволяет снизить частоту интра- и послеоперационных осложнений, уменьшить послеоперационный койко-день и улучшить качество жизни пациентов. Б.Ю. Цветков и соавт. [52], в качестве абсолютных противопоказаний для проведения таких операций у гематологических больных, относят увеличение размера селезенки более 30 см, гнойное поражение селезенки. Применив данный вид операции у 18 пациентов, авторы сообщают о двух осложнениях гнойно-септического характера, проявляющихся развитием абсцессов брюшной полости. Широкое использование лапароскопической спленэктомии при гематологических заболеваниях отмечено в детской практике [31]. При этом, по мнению А.Ф. Дронова и соавт. [31], применение данной методики позволяет получить отличные функциональные и косметические результаты при отсутствии интра- и послеоперационных осложнений.
Таким образом, вышеизложенное показывает, что практика использования органосохраняющих операций при травматических повреждениях селезенки прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока. Следует подчеркнуть, что, несмотря на большое количество предложенных органосохраняющих операций, до настоящего времени основным вмешательством остается спленэктомия. При этом как альтернатива полному удалению органа все шире применяется аутолиентрансплантация.
Травмы паренхиматозных органов диагностируются у 12-50% больных с повреждениями органов брюшной полости, занимая 2-3-е место [1, 5, 11, 17]. Хирургическая тактика при повреждениях печени, селезенки определяется характером травмы и должна быть направлена в первую очередь на обеспечение гемостаза и холестаза 16. Для достижения окончательного гемостаза при ранениях печени и селезенки применяют прошивание, биологические и синтетические пленки, клеевые композиции, методы неконтактного воздействия (лазерная, плазменная, аргоновая и электро-коагуляции) [2-8, 13, 18, 19]. При обширных раневых дефектах печени, селезенки с размозжением ткани выполняют резекции с гемостазом по ходу и с иссечением нежизнеспособных участков паренхимы, по типу первичной хирургической обработки [11, 14]. При отдельных видах травмы печени возможно выполнение оменто- и френогепатопексии. Нередко развиваются некрозы паренхимы печени, селезенки в зоне швов, с развитием нагноений, вторичных кровотечений, желчных свищей, требующих повторных операций [3, 7, 9, 10, 12]. Одной из причин неудач хирургического лечения травм печени и селезенки является отсутствие четких рекомендаций по выбору метода достижения окончательного гемостаза и определения объема вмешательства в зависимости от тяжести повреждения. Совершенствование методов остановки кровотечения при травмах печени и селезенки, а также разработка критериев выбора рациональной тактики при их повреждениях остаются актуальными и по сей день.
Травма печени и селезенки моделировалась в эксперименте на 138 беспородных собаках обоего пола весом от 7 до 20 кг. Смоделировано 268 травм печени и селезенки. Раны наносили с помощью скальпеля, снабженного ограничителем (68): резаные длиной 3 см и более, глубиной не более 2 /3 толщины органа (30) и колото-резаные (38). У 38 животных после обеспечения гемостаза первичной раны печени наносили рану селезенке. Тупую травму живота нанесли 26 животным с развитием подкапсульных (20) и внутриорганных (6) гематом. Из них у 13 животных нанесена тупая травма и печени и селезенки. Разрывы печени и селезенки моделировали интраоперационно путем раздавливания паренхимы зажимом по методике Е.С. Владимировой и соавт. [5] у 41 животного; разрывы диафрагмальной и висцеральной поверхностей печени у 20 и селезенки у 21. Размозженные раны доли и сегмента с повреждением интрапаренхиматозных структур смоделированы на 119 животных: селезенки (88) и печени (31) (когда выполняли резекцию органа). Травму ворот селезенки с повреждением ее сосудистой ножки и последующей спленэктомией нанесли 14 животным (см. таблицу).
Все операции выполняли под внутриплевральным тиопенталовым наркозом. Брюшную полость вскрывали верхнесрединным разрезом. Выводили в операционную рану селезенку, печень. При развитии профузного кровотечения накладывали специальное устройство на питающие сосуды соответствующего участка органа (патент РФ на полезную модель РФ №70622) или мягкий эластический жом (патент РФ №2014802) на паренхиму органа, проксимальнее раны или разрыва для обеспечения временного гемостаза. При травмах печени также применили маневр Прингла (пережатие печеночно-двенадцатиперстной связки) или накладывали эластический жгут на паренхиму органа, проксимальнее раны. Раны ушивали хромированным кетгутом (№2-3) или викрилом на атравматичных колющих иглах.
Техника шва при ранах глубиной до 2 /3 толщи органа: иглы вкалывали отступя от края раны (а) 1,0 см на расстоянии 1,0-1,5 см между ними, начиная с середины раны (в-в 1 ), с выколом на противоположной стороне под углом 45° (б) к длине раны, направляя иглы кнаружи и в разные стороны. Потом обе иглы переводили поверх раны на первоначальную сторону и строго напротив выкола еще раз на расстоянии 1,0 см от края раны делали вкол под углом 45° к длине раны, направляя иглы к центру раны, выводили их напротив первого вкола. Концы нитей связывали между собой (патент РФ №2346660) (см. рисунок). Рисунок 1. Схема ушивания резаных ран печени и селезенки. а - рана; в-в 1 - нити, последовательность проведения. Рисунок 1. Схема ушивания резаных ран печени и селезенки. б - угол, под которым проводится игла; в-в 1 - нити, последовательность проведения.
Предварительно шов был использован на изолированных макропрепаратах печени и селезенки с последующим контрастированием внутриорганных структур. Выявлено, что ушивание ран глубиной до 1 /3 толщины органа не приводит к выраженному нарушению архитектоники структур (сосудов и желчных протоков), а при ушивании ран глубиной от 1 /3 до 2 /3 толщины органа могут наблюдаться подобные изменения. Шов предотвращает прорезывание нитей при сближении краев раны и завязывании узлов и обеспечивает гемостаз.
Сквозные ранения органов ушивали следующим образом: проводили прядь сальника через рану на противоположную поверхность органа. Ушивали раны с помощью предложенного или П-образного шва с обеих сторон, захватывая и сальник (рацпредложение №95822).
При тупой травме с развитием подкапсульных гематом паренхиматозных органов малых размеров - диаметром до 3 см (печень - 10, селезенка - 10) и при отсутствии признаков продолжающегося кровотечения проводили миниинвазивное лечение (патент на изобретение РФ №2321427), из-за опасности вторичного разрыва гематом с последующим кровотечением. При гематомах больших размеров и внутриорганных производили атипичную резекцию соответствующего органа. При размозженных ранах, расположенных по краю органа и разрывах, занимающих целую долю или сегмент с повреждением крупных сегментарно-долевых интрапаренхиматозных структур, производили атипичную резекцию соответствующего участка.
При развитии массивной кровопотери наряду с инфузионной терапией осуществляли реинфузию крови. В большинстве наблюдений дренировали брюшную полость. Животные находились под наблюдением до 1 года.
В сроки от 1 нед до 12 мес проводили повторные операции. Макроскопически оценивали состояние селезенки, печени, их цвет, консистенцию. Селезенку удаляли, печень резецировали, проводили гистологическое исследование в сроки 7, 15, 30, 60, 120, 180, 360 сут после операций. Полученные препараты окрашивали гематоксилином и эозином.
Результаты и обсуждение
При ранах глубиной до 2 /3 толщи органа окончательный гемостаз достигнут в 13 наблюдениях из 15 ранений селезенки и в 12 из 15 ранений печени. Гемостаз удалось обеспечить в 16 из 23 и в 11 из 15 наблюдений при сквозных ранениях селезенки и печени соответственно. При продолжающемся кровотечении применяли дополнительные меры гемостаза. Поверхностные разрывы ушивали с захватом дна раны, но с проведением лигатур вне предполагаемой проекции сегментарных сосудов.
При обширных ранах и разрывах после иссечения нежизнеспособных участков паренхимы с целью гемостаза перевязывали (прошивали) сегментарнодолевые артерии и дополнительно накладывали швы с использованием пластических материалов в качестве подкладки у 8 животных с травмой печени и у 10 животных с травмой селезенки. При разрыве диафрагмальной поверхности селезенки в 6 наблюдениях (рацпредложение №05-1303) и печени в 5 наблюдениях на место разрыва укладывали рассасывающуюся гемостатическую марлю и фиксировали орган к брюшине, покрывающей диафрагму. Аналогично этому, при разрыве висцеральной поверхности селезенки у 3 собак на травмы укладывали гемостатическую марлю и фиксировали орган к большой кривизне желудка, проводя швы через его серозно-мышечный слой. У двух животных при разрыве нижнего полюса селезенки использовали метод «наружного сдавления прядью сальника», с фиксированием гемостатической марли с ушиванием.
При разрыве в проекции центральных сегментов печени глубиной около 2 /3 толщи органа производили «поэтажное» ушивание с использованием пластических материалов, перевязкой кровоточащих сосудов in situ и у 2 животных применили ушивание с «наружным сдавлением прядью сальника», рассасывающейся гемостатической марлей. При разрыве висцеральной поверхности печени у 3 животных применили ушивание с использованием гемостатической марли, ТахоКомба и у одного животного для достижения окончательного гемостаза пришлось перевязывать долевую артерию печени.
В общей сложности, резекцию селезенки произвели у 88 собак в 3 сериях. В первой серии резецировали верхний полюс и раневую поверхность укрывали сальником (30 собак). Во второй серии - нижний полюс и раневую поверхность укрывали париетальной брюшиной (23 собаки). В третьей серии резецировали 2 /3 органа и рану укрывали рассасывающейся гсмостатической марлей (35 собак). Резекцию печени произвели у 31 собаки также в трех сериях. В первой серии выполнили атипичную резекцию после предварительного прошивания паренхимы гемостатическим швом по границе резекции (8 собак). Во второй серии резекция печени произведена после выполнения маневра Прингла (8 собак). В третьей серии резецировали печень (15 животных), и среди них с использованием жома у 8 собак: предварительно прошивали паренхиму органа через прорези жома гемостатическим швом, отсекали удаляемую часть по краю жома и перитонизировали раневую поверхность органа. Резецированную поверхность укрывали сальником (15 наблюдений), париетальной брюшиной (6 наблюдений), рассасывающейся гемостатической марлей (10 наблюдений). Дополнительные швы вынуждены были наложить при резекциях селезенки у 12 животных и у 7 - перевязывали сосуды в плоскости резекции с помощью разработанного устройства (решение о выдаче патента на полезную модель РФ №2008124330/22(029510)). При резекции печени накладывали дополнительные швы и перевязывали сосудисто-протоковые структуры в плоскости резекции у 9 собак. Резекция печени в среднем занимала 15-18 мин, а селезенки 7-10 мин.
Окончательный гемостаз достигнут у 69 (78,4%) животных при резекциях селезенки (25, 18, 26 наблюдений) и 22 (71%) собак при резекциях печени (6, 5, 11 наблюдений) в первой, второй и третьей сериях соответственно.
При повреждении ворот селезенки и сосудистой ножки (14 животных) производили спленэктомию с аутотрансплантацией ткани селезенки в большой сальник (6), предбрюшинную клетчатку (2), забрюшинное пространство (2), в ложе прямых мышц живота (4). Для этого использовали фрагменты паренхимы органа размером 0,3×1,0×2,0 см.
У животных с ушитыми ранами селезенки и печени послеоперационный период характеризовался благоприятным течением. В послеоперационном периоде погибли 14 (10,4%) собак: вследствие невыхода из наркоза - 6 (резекция верхнего полюса селезенки (2), ушивание разрыва селезенки (1), резекция печени (2), ушивание разрыва печени (1)). Спаечная кишечная непроходимость развилась у 3 животных (резекция нижнего полюса селезенки (2), спленэктомия и аутотрансплантация в большой сальник (1)). Послеоперационный перитонит выявлен у 3 собак (резекция 2 /3 селезенки (1) резекция печени (1), ушивание разрыва висцеральной поверхности печени (1)). Кишечное кровотечение отмечено у одной собаки, она погибла на 50-й день после резекции 2 /3 селезенки. Одно животное погибло после ушивания разрыва диафрагмальной поверхности печени на 25-е сутки от поддиафрагмального абсцесса. Остальные животные перенесли операцию хорошо.
Морфологические данные, полученные в динамике после операции, свидетельствуют о хорошей регенерации в области оперированной раны.
Клинические наблюдения
Предложенный шов применили в клинической практике при ушивании:
- резаных ран печени (3 наблюдения): длиной до 5 см и глубиной до 2 /3 толщины паренхимы 3 и 4 сегментов печени (2 наблюдения), длиной 5,5 см диафрагмальной поверхности правой доли печени без повреждения интрапаренхиматозных структур (один больной);
- резаных ран диафрагмальной поверхности селезенки длиной до 5 см и глубиной до 2 /3 толщины органа (2 больных);
- сквозных ран 4 и 5-6 сегментов печени (2 больных) и селезенки (1 больной со сквозной раной, 1 больной с колото-резаной раной нижнего полюса селезенки);
- разрывов печени (4 больным): разрывы до 5,0 см левой доли диафрагмальной поверхности печени (2 пациента), до 5 см диафрагмальной поверхности 5-6 сегментов доли печени (2 наблюдения), из них с тампонадой сальником (3 больных) и рассасывающейся гемостатической марлей (1 больной);
- разрыва диафрагмальной поверхности селезенки размерами до 4,0 см выполнили ушивание с фиксацией к париетальной брюшине.
Атипичные резекции печени с наложением П-образных швов выполнили 2 больным (разрыв до 5,5 см, связанный с травмой живота и размозженная рана левой доли печени размером 4,5 см с повреждением сегментарных внутриорганных структур). Резекцию селезенки выполнили 4 больным (травмы селезенки (3 больных) и киста нижнего полюса (1 наблюдение)). Подкапсульные гематомы около 3,0 см при отсутствии признаков продолжающегося кровотечения лечили миниинвазивно: у 3 больных диафрагмальной поверхности печени (3 и 6 сегменты) и у 1 больной висцеральной поверхности 5 сегмента. Подкапсульные гематомы диафрагмальной поверхности селезенки размерами до 3 см при отсутствии признаков продолжающегося кровотечения лечили миниинвазивным методом у 4 больных (гематомы средней части селезенки - 2 и нижнего полюса - 2). Во всех наблюдениях удалось обеспечить надежный гемостаз.
Разнообразие повреждений печени и селезенки при травме живота определяет сложность выбора рациональной хирургической тактики. Многое зависит от данных интраоперационной ревизии поврежденного органа. После достижения временного гемостаза и эвакуации крови из брюшной полости решающее значение мы придаем оценке характера повреждений. Поверхностные разрывы печени, селезенки ушиваем с захватом дна раны, с проведением лигатуры вне предполагаемой проекции сегментарных сосудов и с фиксацией к линии шва пластического материала для предупреждения прорезывания.
При глубоких разрывах, более 2 /3 толщины органа, исключали возможное повреждение крупных долевых (сегментарных) сосудов и протоков [5]. Для достижения гемостаза при разрывах печени, селезенки наряду с ушиванием возможна и изолированная перевязка сегментарных артериальных сосудов. При краевых размозженных ранах и разрывах, занимающих долю или сегмент, производили соответствующую резекцию. При глубоких ранах в области ворот или множественных разрывах селезенки выполняли спленэктомию с имплантацией фрагментов селезенки. Обязательным условием является перитонизация резекционной поверхности печени, селезенки и дренирование зоны вмешательства.
Таким образом, проведенные исследования показали эффективность предложенных способов гемостаза, что позволит улучшить результаты органосохраняющих операций на печени, селезенке при повреждениях.
Читайте также:
