Дыхательный коэффициент. Дыхательный центр
Добавил пользователь Алексей Ф. Обновлено: 08.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Нарушение ритма дыхания: причины, заболевания, при которых развивается, методы диагностики и лечения.
Определение
Дыхание - это совокупность физиологических процессов, конечной целью которых является доставка и потребление кислорода, а также вывод углекислого газа.
К органам дыхания относятся дыхательные пути и легкие. Кроме того, в процессе дыхания принимают участие мышечная и нервная системы. Благодаря диафрагме, межреберным и некоторым другим мышцам выполняются дыхательные движения, происходит изменение объема грудной клетки, что является необходимым условием для расправления и спадания легочной ткани на вдохе и выдохе. В центральной нервной системе, а именно в продолговатом мозге, расположен дыхательный центр. Ключевая особенность функционирования дыхательного центра состоит в автоматическом зарождении в нем импульсов - то есть человек не задумывается о том, что ему нужно сделать вдох. В то же время активность дыхательного центра может быть подавлена вышерасположенными отделами головного мозга, например, человек может произвольно задержать дыхание при нырянии.
Разновидности нарушения ритма дыхания
Выделяют следующие виды дыхания:
- эупноэ - нормальный ритм дыхания (у здорового взрослого составляет около 14-18 дыхательных движений в минуту);
- гиперпноэ - глубокое и частое дыхание, отмечается при мышечной работе, эмоциональном напряжении, тиреотоксикозе, анемии, ацидозе, снижении содержания кислорода во вдыхаемом воздухе;
- тахипноэ - повышение частоты дыхательных движений вследствие выраженной стимуляции дыхательного центра при гиперкапнии, гипоксемии; наблюдается при повышении температуры тела, застое в легких и т.п.;
- брадипноэ - снижение частоты дыхательных движений, которое возникает при поражении и угнетении дыхательного центра на фоне гипоксии, отека, ишемии и воздействия наркотических веществ;
- апноэ - временная остановка дыхания (считается крайней степенью выраженности брадипноэ);
- дыхание по типу Чейна-Стокса - характеризуется чередованием групп дыхательных движений с нарастающей амплитудой и периодов апноэ;
- дыхание по типу Биота - характеризуется чередованием периодов апноэ с группами дыхательных движений равной амплитуды;
- дыхание Куссмауля - шумное и глубокое дыхание, для которого характерны отдельные судорожные сокращения основной и вспомогательной дыхательной мускулатуры. Этот тип дыхания свидетельствует о значимой гипоксии головного мозга.
На дыхательный центр могут напрямую воздействовать некоторые токсичные для головного мозга вещества, циркулирующие в крови.
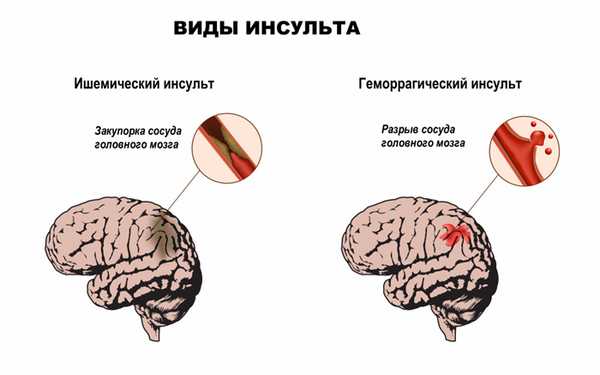
Нарушения работы дыхательного центра происходят в результате структурных изменений в соответствующей области мозга при инсультах, отеке головного мозга и т.д.
Заболевания, вызывающие нарушение ритма дыхания
Среди заболеваний, приводящих к накоплению в крови токсичных веществ, которые впоследствии могут раздражать или поражать дыхательный центр, стоит упомянуть следующие:
- сахарный диабет в стадии декомпенсации, когда в крови накапливаются продукты углеводного обмена; встречается в дебюте ранее не диагностированного сахарного диабета или при недостаточном контроле заболевания при инсулинотерапии и сахароснижающей терапии;
- печеночная недостаточность, развивающаяся остро на фоне гепатитов (вирусной, алкогольной, аутоиммунной этиологии и др.), токсического поражения печени (например, при отравлении парацетамолом), а также хроническая интоксикация при печеночной недостаточности на фоне цирроза. Токсическое поражение головного мозга при заболеваниях печени связано в первую очередь с тем, что патологически измененная печень не способна выполнять барьерную функцию (задерживать и нейтрализовать вредные вещества), в связи с этим токсины накапливаются в крови;
- почечная недостаточность, которая может манифестировать остро или иметь длительное хроническое течение, развивается на фоне воспалительных заболеваний (гломерулонефрита, тубулоинтерстициального нефрита и др.), токсического поражения почки (например, канальцевого некроза) и других заболеваний;
- тяжело протекающие инфекционные заболевания могут вызывать выраженную интоксикацию или приводить к непосредственному поражению головного мозга, например при вирусных или бактериальных энцефалитах.
Структурные изменения в головном мозге отмечаются при инсультах (остром нарушении мозгового кровообращения по причине кровоизлияния или закупорки сосудов головного мозга тромбом), при новообразованиях, отеке головного мозга.
Отдельно стоит упомянуть синдром Пиквика, развивающийся у пациентов с выраженным ожирением, одним из проявлений которого являются эпизоды остановки дыхания во время сна.
К каким врачам обращаться при нарушении ритма дыхания
Нарушение ритма дыхания является грозным симптомом, поэтому часто первым специалистом, оказывающим помощь пациенту, становится врач скорой помощи или врач-реаниматолог.
Если нарушение ритма дыхания не несет угрозы жизни, то диагностические мероприятия проводит терапевт , педиатр или врач более узкой специальности: эндокринолог , гепатолог (специалист по заболеваниям печени), нефролог (специалист по заболеваниям почек), токсиколог, инфекционист и др.
Диагностика и обследования при нарушении ритма дыхания
Диагностика начинается с опроса пациента, в ходе которого врач устанавливает возможные причины и факторы риска развития аритмичного дыхания.
Лабораторные исследования включают определение уровня глюкозы в крови, газов артериальной крови и кислотно-основного состояния КОС крови.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазм.
ДЫХАТЕЛЬНЫЙ КОЭФФИЦИЕНТ
Дыхательный коэффициент (устаревшие син.: дыхательное отношение, респираторный коэффициент) — отношение объема выделенного из организма (органа, ткани) углекислого газа (VCO2) к объему поглощенного за это же время кислорода (VO2). Определение Дыхательного коэффициента проводят при изучении особенностей газообмена (см.) и обмена веществ и энергии (см.) у животных и растительных организмов.
Определение Дыхательного коэффициента имеет важное значение также при исследовании внешнего дыхания. Во многие формулы для расчетного определения состава альвеолярного воздуха входит величина Дыхательного коэффициента. Так как между величиной Д. к. и отношением количества вентилирующего альвеолы воздуха к количеству протекающей через их капилляры крови существует определенная зависимость, то по Д.к. можно судить о вентиляционно-перфузионных отношениях. Установлено, что величины Д. к. для воздуха, выдыхаемого из верхних и нижних долей легких, существенно различны из-за неравенства их вентиляционно-перфузионных отношений.
Сравнение Д. к. левого и правого легкого при раздельной бронхоспирометрии помогает судить об особенностях вентиляции и обмене газов в каждом из них. Определение Д. к. в разных частях выдыхаемого воздуха используется для углубленного исследования некоторых сторон внешнего дыхания.
У человека и животных Дыхательный коэффициент обычно колеблется в пределах от 0,7 до 1. При окислении углеводов на 1 моль потребляемого кислорода в организме образуется 1 моль углекислого газа, т. к. весь потребляемый из вдыхаемого воздуха кислород в конечном счете идет только на окисление углерода углеводов, а окисление находящегося в составе углеводов водорода до воды обеспечивается заключенным в молекуле углевода кислородом. Грамм-молекулы различных газов (в данном случае кислорода и углекислого газа) занимают при одинаковых давлении и температуре равные объемы, поэтому при окислении углеводов Д. к. равняется 1. При окислении жиров, в молекуле которых содержится много атомов водорода и мало атомов кислорода, потребление кислорода количественно связано также с образованием воды из содержащегося в жирах водорода. В результате объем образующегося в организме (и выделяющегося) углекислого газа при диссимиляции жиров меньше объема потребляемого кислорода. При окислении жиров Д. к. равен 0,70— 0,72. Окислению белков, в результате к-рого образуются, кроме воды и углекислого газа, азотсодержащие соединения, выделяющиеся гл. обр. с мочой, соответствует величина Д. к., равная 0,80—0,82.
Количество окисляющегося в организме белка определяется по выводимым с мочой азотистым продуктам его распада. Учитывая эту величину (в приближенных расчетах ею можно пренебречь), по Д. к. определяют долю участия в диссимиляции жиров и углеводов. Количество энергии (в килокалориях), освобождающейся в организме при потреблении 1 л кислорода (так наз. калорический эквивалент кислорода), при окислении углеводов равно 5,05, жиров — 4,69, белков — 4,49.
Дыхательный коэффициент закономерно изменяется в зависимости от величины калорического эквивалента кислорода (табл.).
Таблица. Изменение величины дыхательного коэффициента в зависимости от величины калорического эквивалента кислорода
Дыхательный коэффициент и его значение в исследовании обмена веществ
Дыхательным коэффициентом называется отношение объема выделенного углекислого газа к объему поглощенного кислорода. Дыхательный коэффициент различен при окислении белков, жиров и углеводов . Рассмотрим для примера, каков будет дыхательный коэффициент при использовании организмом глюкозы. Общий итог окисления молекулы глюкозы можно выразить формулой:
При окислении глюкозы количество молекул образовавшегося углекислого газа и количество молекул затраченного (поглощенного) кислорода равны. Равное количество молекул газа при одной и той же температуре и одном и том же давлении занимает один и тот же объем (закон Авогадро — Жерара). Следовательно, дыхательный коэффициент (отношение СO₂/O₂) при окислении глюкозы и других углеводов равен единице.
При окислении жиров и белков дыхательный коэффициент будет ниже единицы . При окислении жиров дыхательный коэффициент равен 0,7. Проиллюстрируем это на примере окисления трипальмитина:
Отношение между объемами углекислого газа и кислорода составляет в данном случае:
Аналогичный расчет можно сделать и для белка;при его окислении в организме дыхательный коэффициент равен 0,8.
При смешанной пище у человека дыхательный коэффициент обычно равен 0,85—0,9. Определенному дыхательному коэффициенту соответствует определенный калорический эквивалент кислорода, что видно из табл. 20.
Определение энергетического обмена у человека в покое методом закрытой системы с неполным газовым анализом . Относительное постоянство дыхательного коэффициента (0,85—0,90) у людей при обычном питании в условиях покоя позволяет производить достаточно точное определение энергетического обмена у человека в покое, вычисляя только количество потребленного кислорода и беря его калорический эквивалент при усредненном дыхательном коэффициенте .
Количество потребленного организмом кислорода исследуется при помощи различного типа спирографов.
Определив количество поглощенного кислорода и приняв усредненный дыхательный коэффициент равным 0,85, можно рассчитать энергообразование в организме; калорический эквивалент 1 л кислорода при данном дыхательном коэффициенте равен 20,356 кДж, т.е. 4,862 ккал (см. табл. 20). Способ неполного газоанализа, благодаря своей простоте, получил широкое распространение.
Дыхательный коэффициент. Дыхательный центр
Физиология:
Популярные разделы сайта:
Спирометрия. Дыхательный центр
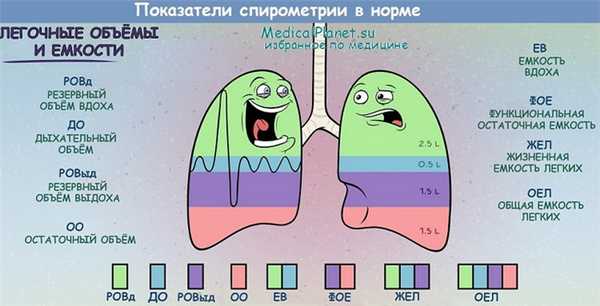
Для оценки вентиляционной способности лёгких, а также решения вопроса, по какому типу (обструктивному или рестриктивному) развивается дыхательная недостаточность, в клинической практике исследуют различные функциональные показатели. Определение последних проводят с помощью спирометрии (статические показатели) или пневмотахометрии (динамические показатели). Основные показатели спирометрии:
• остаточный объём (00) — количество воздуха, которое остаётся в лёгких даже после максимального выдоха;
• общая ёмкость лёгких (ОЕЛ) — сумма ЖЕЛ и 00;
• функциональная остаточная ёмкость (ФОЕ) — объём воздуха в лёгких в состоянии покоя по окончании обычного выдоха.
Динамические показатели системы дыхания:
• частота дыхания (ЧД);
• дыхательный ритм (ДР);
• минутный объём дыхания (МОД) — произведение ДО и ЧД;
• максимальная вентиляция лёгких (МВЛ) — произведение ЖЕЛ и форсированной частоты дыхания;
• объём форсированного выдоха за секунду (ОФВ1), выражаемый в процентах по отношению к форсированной жизненной ёмкости лёгких (ФЖЕЛ);
• форсированный экспираторный поток воздуха между 25% и 75% форсированной жизненной ёмкости лёгких (ФЭП 25-75%), позволяющий оценивать среднюю объёмную скорость воздушного потока.
У больных с обструктивными и рестриктивными заболеваниями выявляют характерные изменения.
Основное место в клинической практике в целях определения нарушений бронхиальной проходимости занимает форсированная спирометрия. Для её осуществления необходимо определить два показателя: объём односекундного форсированного выдоха (ОФВ1) и ЖЕЛ.
Дыхательный центр
Многочисленные экспериментальные и клинические исследования свидетельствуют о том, что в наибольшей зависимости от прилагаемого усилия для осуществления выдоха находится скорость воздушного потока в начале форсированного выдоха. Именно поэтому принято определять объём воздуха, выдыхаемого за первую секунду форсированного выдоха (ОФВ]). Этот показатель часто выражают в процентах по отношению к ЖЕЛ (ФЖЕЛ1) — так назьшаемый индекс Тиффно. Снижение этого отношения до величины 70% и менее однозначно свидетельствует о нарушении проходимости дыхательных путей.
Наиболее серьёзные и быстро возникающие расстройства вентиляции лёгких возникают при различной патологии дыхательного центра (ДД), приводящей к ослаблению активности или рассогласованию инспираторных и экспираторных ядер.
Известно, что дыхательный центр состоит из взаимосвязанных диффузных скоплений различных групп нейронов, расположенных в разных отделах ЦНС (от спинного мозга до коры больших полушарий головного мозга), ответственных за координированную и согласованную ритмическую деятельность дыхательных мышц и обеспечивающих приспособление вентиляции лёгких к постоянно изменяющимся условиям внешней и внутренней сред в целях сохранения газового гомеостаза организма.
В узком смысле под дыхательным центром понимают взаимосвязанные группы инспираторных (ИН) и экспираторных (ЭН) нейронов продолговатого мозга (так называемого центрального дыхательного регулятора — ЦДР), без функционирования которых ритмическое дыхание (вдох и выдох) в принципе невозможны.
Внедрение в исследовательскую практику современных электрофизиологических методов позволило установить локализацию основных групп дыхательных нейронов. Например, с помощью введения микроэлектродов, соединённых с усилителем, было показано, что ИН находятся в латеральной части дорсального дыхательного ядра продолговатого мозга. Их аксоны идут в шейный отдел спинного мозга, где импульсация переключается на мотонейроны, а те в свою очередь передают возбуждение на мышцы вдоха (внутренние межрёберные мышцы) и диафрагму.
Согласно данной модели, под влиянием хеморецептивной стимуляции возбуждается определённая группа ИН (ответственная за формирование т.н. центральной инспираторной активности — ЦИА). Чем сильнее афферентация (зависящая, главным образом, от напряжения СО2 в ликворе), тем быстрее происходит нарастание ЦИА и тем резче происходит вдох. Но тем скорее этот вдох и прекращается. Это обусловлено тем, что одновременно возбуждается другая группа нейронов, активность которой, достигнув определённой величины (порога), затормаживает и выключает ЦИА. Обрыву вдоха, переходу его в выдох способствуют также рецепторы растяжения лёгких. Вспомогательную роль в этом механизме играют влияния, поступающие сверху, прежде всего из пневмотаксического центра варолиева моста. Эти влияния способствуют более плавным переходам между инспираторной и экспираторной фазами.
Трансформаторная модель ритмогенеза дыхательного центра иллюстрируется приведённой выше схемой. Согласно последней, возбуждение инспираторных нейронов обеспечивает вдох. Одновременно активирующаяся другая популяция инспираторных нейронов передаёт своё возбуждение, когда оно достигает пороговой величины, постинспираторным нейронам (PI), которые, в свою очередь, затормаживают нейроны, прекращая вдох и поддерживая некоторое время состояние вьщоха. Активацию нейронов поддерживают и стимулы из хеморецепторов. Раздражение рецепторов растяжения лёгких способствует прерыванию вдоха, а ирритантных рецепторов — прерыванию вьщоха. Итак, можно констатировать, что ДЦ, получая от хеморецептров информацию о химизме внутренней среды, преобразует её в ритмический выходной сигнал (подобно трансформатору), обеспечивающий необходимую организму нормальную вентиляцию лёгких.
Рассмотрение нейрофизиологических механизмов работы дыхательного центра важно и для понимания конкретных звеньев нарушений регуляции дыхания.
Расстройства регуляции системы внешнего дыхания можно разделить на три категории:
• расстройства центральной регуляции дыхания;
• изменения в проводниковом (бульбоспинальном) тракте;
• нарушения проведения сигналов от мотонейронов спинного мозга к респираторным мышцам.
5.3. Мониторинг дыхания (респираторный мониторинг).
Понятие респираторного мониторинга включает мониторинг газообмена, а также мониторинг механики легких и грудной клетки.
5.3.1.Мониторинг газообмена
Мониторинг газообмена подразумевает анализ газового состава артериальной и венозной крови, а также выдыхаемого воздуха. Для оценки адекватности газообмена имеет значение определение рН, концентрации бикарбонатов и величины анионного провала. С дидактической точки зрения, можно разделить мониторинг газообмена на мониторинг оксигенации и мониторинг вентиляции.
Мониторинг оксигенации
При проведении мониторинга оксигенации врач должен получить ответы на три вопроса:
•Сколько кислорода может быть доставлено к тканям?
•Какой ценой достался этот кислород организму?
•Как его усвоили ткани?
Для ответа на первый вопрос оценивают напряжение кислорода (рaО2) и насыщения (сатурации) гемоглобина кислородом в артериальной крови (SaО2). Зная эти величины, по формуле рассчитывают содержание кислорода в артериальной крови (Cа - content arterial)
Cа = (0,00138 × SatО2 × Hb) + (0,003 × рa О2)
Умножая эту величину на величину сердечного выброса (CO - cardiac output), измеренного, например, методом термодилюции, можно рассчитать доставку кислорода (DО2 - delivery of oxygen) к тканям:
Не зная, какую долю сердечного выброса получает каждый отдельный орган (например, мозг), нельзя подсчитать, какое точное количество кислорода ему достается.
Для ответа на второй вопрос сравнивают напряжение кислорода в артериальной крови (рaО2) и в воздухе альвеол (РАО2). Величину РАО2 можно или измерить прямо, или рассчитать из так называемого уравнения альвеолярного газа. Прямое измерение возможно при помощи метода быстрой оксиметрии. При использовании этого метода непрерывно измеряют напряжение кислорода во вдыхаемом и выдыхаемом газе. Приборы, предоставляющие возможность измерения этих показателей, обладают низкой инерционностью, оцениваемой по очень быстрому времени отклика (600 мсек и менее).
Для определения РАО 2 интерес представляют конечные порции выдыхаемого газа, то есть фактически газ, выдыхаемый из альвеол. Эффективность обмена кислорода оценивается на основе расчета альвеолоартериального градиента по кислороду:
Р(А- а)О2
Этот показатель имеет нелинейный характер даже у здорового человека и зависит от содержания кислорода во вдыхаемой смеси (FiО2.): при дыхании воздухом он равен 10, при дыхании 100%-ным кислородом - около 100. Кроме того, он зависит от нарушений вентиляционно-перфузионных отношений и изменений венозной сатурации.
Для оценки эффективности кислородообмена большее практическое значение имеет расчет индексов оксигенации. Один из наиболее часто используемых индексов рассчитывается как частное от деления напряжения кислорода в артериальной крови к процентному содержанию кислорода во вдыхаемой смеси, выраженному в долях единицы:
рaО2 / FiО2
В норме этот показатель превышает 350-400 мм рт.ст. Снижение его ниже 300 мм рт.ст. является признаком острого повреждения легких, ниже 200 мм рт.ст. - острого респираторного дистресс-синдрома.
Расчет РАО 2 возможен с помощью уравнения альвеолярного газа, которое с этой целью используется в упрощенном варианте.
Немного физиологии
Уравнение альвеолярного газа в полной его форме представляет собой следующее математическое выражение:
РАО2 = РIО2 - (PAСО2 /RQ) +(PAСО2 × FiО2 × (1 - RQ)/RQ),
где РАО2 - напряжение кислорода в альвеолярном газе, PAС О2 - напряжение углекислоты в альвеолярном газе, РIО2 - напряжение кислорода во вдыхаемом воздухе, FiО2 - доля кислорода во вдыхаемом воздухе, RQ - респираторный коэффициент (respiratory quotent).
Обычно это уравнение используют для расчета респираторного коэффициента, а не РАО2. Данный коэффициент зависит от сопряжения процессов потребления кислорода и выделения углекислоты периферическими тканями, что определяется характером использующихся нутриентов - белков, жиров или углеводов. Он самый высокий при использовании углеводов (1,0), самый низкий при преимущественном поступлении в организм жиров (0,7).
Напряжение кислорода во вдыхаемом воздухе рассчитывается следующим образом:
РIО2 = (барометрическое давление - 47) × FiО2
Величины РАО2 и PAСО2 измеряют прямо в конечно-выдыхаемых порциях дыхательной смеси (то есть в альвеолярном воздухе) методами капнографии и быстрой оксиметрии.
Используя уравнение альвеолярного газа, можно рассчитать респираторный коэффициент, то есть фактически поглощение кислорода и выделение углекислоты на единицу объема вдыхаемого и выдыхаемого воздуха. Сопоставив эти показатели с величиной минутного объема вентиляции, можно оценить величину потребления организмом энергии и подобрать эффективную нутритивную поддержку.
Если величину респираторного коэффициента считать неизменной в течение коротких промежутков времени, то уравнение альвеолярного газа упрощается:
РАО2 = РIО2 - (1,25 × PAСО2),
Измеряя конечно-выдыхаемые величины PAСО2, можно вычислить РАО2. Из этого уравнения следует, что в норме при дыхании воздухом РАО2 равно 100-110 мм рт.ст., при дыхании чистым кислородом - 550 мм рт.ст.
Для ответа на третий вопрос оценивают потребление кислорода и эффективность его обмена. Потребление кислорода может быть рассчитано при помощи прямого и обратного методов Фика.
При использовании прямого метода Фика необходимо измерение напряжения кислорода в воздухе альвеол (РАО2) с помощью метода быстрой оксиметрии. Зная напряжение кислорода во вдыхаемом воздухе (РIО2) и в выдыхаемом воздухе (РА О2), измерив минутный объем дыхания с помощью спирометрии, можно рассчитать количество поступившего в организм и оставшегося в легких кислорода. Вычитая из первой величины вторую, рассчитывают потребление кислорода.
При использовании непрямого метода Фика потребление организмом кислорода является производным сердечного выброса и разницы в содержании кислорода в артериальной (Cа) и венозной (Сv) крови
Содержание кислорода в венозной крови считают по той же формуле, что и Ca, только используют показатели напряжения кислорода и сатурации гемоглобина не в артериальной, а в венозной крови.
Сv = (0,003 х рvО2) + (0,00138 х SvО2 х Hb)
Напряжение кислорода в артериальной и венозной крови, а также сатурацию гемоглобина измеряют инвазивными и неинвазивными способами. При инвазивных способах возможна дискретная и непрерывная оценка. При дискретной оценке повторно исследуют кровь из артерии или вены в газоанализаторе. Для непрерывной оценки SvО2 используют фиброоптические катетеры. Чтобы определить потребление кислорода для всего организма, этот катетер устанавливают в легочную артерию, то есть в сосуд, содержащий смешанную венозную кровь от всего организма. Необходимо предостеречь от использования для анализа крови, взятой из периферической вены. Эта кровь отражает доставку и потребление кислорода только в том периферическом участке, от которого она оттекает, и не может служить средством оценки оксигенации венозной крови в целом. В отличие от венозной, артериальная кровь практически одинакова в любой артерии, и поэтому нет разницы, что анализировать - кровь из аорты, сонной или лучевой артерии.
Кроме описанных методов, возможно также чрескожное (транскутанное) определение р О2 (как впрочем и рСО2), при помощи специальных датчиков с прогреванием кожи под ними. Показания этих датчиков хорошо согласуются с прямым определением рО2 и рСО2 в артериальной крови у детей. Однако нет единого мнения исследователей в вопросе, можно ли метод применять у взрослых пациентов.
Для неинвазивной оценки сатурации гемоглобина артериальной крови используют пульсоксиметрию. Принцип пульсоксиметрии основан на пропускании через ткани пальца или мочки уха параинфракрасного излучения. Излучение частично проходит через ткани, частично задерживается оксигенированным гемоглобином. Величина поглощенного излучения непрерывно меняется с каждым пульсовым сокращением. Анализ этой изменяющейся величины составляет основу пульсоксиметрической оценки сатурации гемоглобина артериальной крови (рис. 5.16).
Измерение потребления и доставки кислорода позволяет оценить зависимость первого показателя от второго. В норме потребление не зависит от доставки. Однако если доставка снижается, то наступает определенный момент, когда потребление тоже начинает снижаться. В тканях постепенно прекращаются зависимые от кислорода процессы (цикл трикарбоновых кислот) и нарастает накопление лактата из-за незавершенного анаэробного гликолиза. Эти взаимоотношения отображаются характерной кривой (рис. 5.17). Большинство исследователей считает, что при сепсисе эта кривая смещается вправо, отражая нарушение утилизации кислорода тканями.
Для изучения указанных процессов нужны независимые методы оценки потребления кислорода (прямой метод Фика с использованием быстрой оксиметрии и спирометрии) и доставки кислорода (непрямой метод Фика с использованием термодилюции и анализа газового состава крови). В ряде научных исследований авторы пытаются получить информацию о доставке и потреблении, используя для измерения и того, и другого показателя только один непрямой метод. Такой подход является методологически неправильным, так как нельзя изучить зависимость или независимость этих двух показателей, сам процесс измерения которых (одним методом!) делает их зависимыми друг от друга.
Мониторинг вентиляции
Мониторинг вентиляции чаще всего сводится к анализу содержания углекислого газа в выдыхаемом воздухе с помощью капнографии и прямому определению напряжения СО2 в крови с использованием газоанализатора.
При проведении анализа содержания углекислого газа нужно соблюдать ряд методологических условий. Главное из них - необходимость определенного промежутка времени перед проведением анализа после изменения параметров вентиляции легких. В организме существуют большие резервуары углекислоты с различной емкостью и скоростью наполнения и высвобождения СО2. Это приводит к значительной отсрочке стабилизации уровня СО2 - через 10 мин после гипервентиляции и 40 мин после гиповентиляции (J.J. Marini, A.P. Wheeler, 1997).
Прямое определение рСО2 в артериальной крови производят обычно одновременно с определением рО2 при заборе проб артериальной крови. Динамический контроль напряжения углекислого газа можно проводить, используя пробы венозной крови, где рСО2 обычно выше на 3-8 мм рт.ст., чем в артерии. Для анализа берут кровь из центральной вены или легочной артерии, но не из периферической вены.
При анализе выдыхаемого газа концентрация СО2 чаще всего представляют в качестве функции времени, реже - функции объема выдыхаемого газа. Изменения СО 2 во времени менее информативны, однако позволяют оценить степень нарушения вентиляционно-перфузионных отношений по форме кривой, мониторировать ритм дыхания, определить наличие гипо- и гипервентиляции (рис. 5.18). При отсутствии изменений нормальной кривой можно оценить напряжение углекислого газа в артериальной крови (рaСО2) по его напряжению в конечно-выдыхаемых (end tidal) порциях альвеолярного воздуха (рETСО 2 ). В норме величина градиента рaСО 2 - рETСО 2 равна 3-8 мм рт.ст. При развитии грубых нарушений вентиляционно-перфузионных отношений (ТЭЛА, ОРДС, аспирации крови и желудочного содержимого в трахею) этот градиент значительно возрастает. Изменяется также форма кривой напряжения углекислого газа в конечно-выдыхаемом воздухе. Минимизация величины рaСО 2 - рETСО 2 может использоваться как метод подбора оптимального РЕЕР.
Более информативно представление концентрации СО 2 в качестве функции объема выдыхаемого газа. Это позволяет определить, кроме указанных показателей, также среднюю концентрацию СО 2 в выдыхаемом газе и рассчитать величину дыхательного мертвого пространства, соотнесенного с дыхательным объемом (рис. 5.19).
Мониторинг механических свойств легких и грудной клетки
Показатели, имеющие клиническое значение для оценки динамики легочных нарушений - податливость (compliance - С), сопротивление (resistance - R), среднее давление в дыхательных путях (mPaw) и аутоРЕЕР.
Податливость.
Податливость - это изменение объема (volume, V), соотнесенное к изменениям давления (pressure, P):
С = ∆V/ ∆P.
Различают податливость легких (СL), грудной клетки (СW) и респираторной системы (СRS), но на практике оценивают обычно только последний показатель. Для расчета величины ∆V при проведении ИВЛ следует учитывать потери части дыхательного объема (VT) в контуре респиратора. Для приблизительного расчета используют специальную величину - фактор компрессии дыхательного контура (circuit compression factor - Сcf). Для большинства дыхательных контуров она считается равной 3 мл кислородно-воздушной смеси на каждый сантиметр водного столба пикового давления, подаваемого респиратором при вдохе.
Для измерения податливости нужно «выключить» с помощью медикаментов спонтанное дыхание больного и измерить давление в дыхательных путях во время пауз вдоха и выдоха (создать так называемые пассивные условия). Для чего нужны эти паузы? Нас интересует давление во всей респираторной системе, но измерить можно только давление на конце интубационной трубки. Чтобы это измеряемое давление отражало показатели давления в альвеолах, в бронхах, трахее и у конца интубационной трубки, создаются короткие паузы в конце вдоха и выдоха. Вследствие этого величины давления в разных частях респираторной системы временно уравниваются. Податливость респираторной системы определяется следующим образом:
СRS = VT × Сcf / PplatoInsp - PplatoExsp,
где PplatoInsp - давление на плато вдоха (inspiration) в условиях окончания вдоха и остановки потока, PplatoExsp - давление на плато выдоха (expiration) в условиях окончания выдоха и остановки потока (рис. 5.20). Нижняя граница нормы для величины податливости системы грудная клетка-легкие - 120-150 мл/см вод. ст. или 1,5-2 мл/см вод.ст на 1 кг массы тела.
Для раздельной оценки податливости грудной клетки и легких необходимо дополнительное измерение давления в пищеводе, которое отражает внутриплевральное давление. В настоящее время средствами раздельной оценки податливости легких и грудной клетки снабжены некоторые современные аппараты ИВЛ, что позволяет оптимизировать проведение респираторной поддержки при тяжелых дыхательных расстройствах.
Сопротивление
Различают инспираторное сопротивление дыхательных путей и экспираторное. Экспираторное сопротивление всегда больше, чем инспираторное, причем эта разница возрастает при патологии. Однако на практике обычно оценивают только инспираторное сопротивление (рис. 5.21):
RI = PD - PplatoInsp /Flow,
где RI - инспираторное сопротивление, Flow - поток (обычно пиковый поток респиратора), PD - пиковое давление в дыхательных путях, PplatoInsp - давление на плато вдоха (в условиях окончания вдоха и остановки потока). Верхняя граница инспираторного сопротивления - 5 см вод.ст./л∙сек. Увеличение инспираторного сопротивления свидетельствует об ухудшении проходимости трахео-бронхиального дерева из-за бронхоспазма, отека, скопления мокроты.
Среднее давление в дыхательных путях
С некоторой долей упрощения можно считать, что среднее давление в альвеолах (alveolar mean pressure, mPalv) соответствует среднему давлению в дыхательных путях (airways mean pressure, mPaw). Среднее давление в альвеолах - это усредненное давление, которое растягивает альвеолы и грудную клетку. Следовательно, mPalv и mPaw определяют артериальную оксигенацию и сопротивление венозному возврату. Для клинических целей нужно понимать, что mPaw увеличивается при возрастании минутного объема дыхания, положительного давления в дыхательных путях в конце выдоха (positive end-expiratory pressure, РЕЕР) и времени вдоха. Эти факторы, с одной стороны, повышают оксигенацию, с другой - снижают венозный возврат и повышают опасность баро- и волюмотравмы легких.
АутоРЕЕР
АутоРЕЕР представляет собой разницу между общим (тотальным) РЕЕР и установленным врачом на панели респиратора показателем положительного давления в дыхательных путях к концу выдоха. Тотальный РЕЕР определяют по показаниям манометра респиратора в конце вдоха при создании экспираторной паузы. Наличие аутоРЕЕР свидетельствует о затруднении выдоха (рис. 5.22). Имеется две основные причины этого состояния. Первая причина - повышение сопротивления в дыхательных путях во время выдоха, вследствие чего вдох начинается при не полностью законченном выдохе. Такая ситуация вызывает постепенное нарастание количества воздуха, задержанного в легких - так называемую дыхательную гиперинфляцию (рис. 5.23). Вторая причина аутоРЕЕР - появление активности мышц вдоха во время не полностью закончившегося выдоха. Мышечная активность отражает несинхронность работы аппарата ИВЛ и дыхательных попыток больного.
Первую причину аутоРЕЕР можно компенсировать увеличением пикового потока вдоха на панели респиратора. Это приводит к укорочению времени вдоха и удлинению времени выдоха. В результате пациент успевает выдохнуть до того, как наступит новый вдох. Причиной гиперинфляции может быть нерациональное использование паузы вдоха, что вызывает избыточное удлинение фазы вдоха. Это состояние компенсируется при исключении паузы вдоха.
Во втором случае появление аутоРЕЕР свидетельствует о нерациональном подборе режимов вентиляции, причиной чего могут быть недостаточные минутный объем дыхания, чувствительность триггера, содержание кислорода во вдыхаемой смеси, аппаратный РЕЕР. Одним из способов подбора оптимального аппаратного РЕЕР является его постепенное повышение до того уровня, когда исчезает аутоРЕЕР.
Расчет податливости, сопротивления, среднего давления в дыхательных путях и аутоРЕЕР производится на основе анализа обычных кривых, отражающих изменение давления в дыхательных путях, объема и потока газа во времени: кривые «давление в дыхательных путях - время», «поток воздуха - время», «объем воздуха - время» (рис. 5.23) Современные респираторы позволяют получать информацию также в виде петель давление-объем (P-V-петля) и поток-объем (F-V-петля) (рис. 5.24).
Принципиально новой информации они не несут, но делают ее представление более наглядным. Например, появление характерного «клюва» на петле давление-объем свидетельствует о снижении податливости легких и их перерастяжении вдуваемым дыхательным объемом. Разорванность петли поток-объем свидетельствует о наличии утечек в контуре аппарата ИВЛ.
Читайте также:
- Клиника и диагностика рака желудка
- Биологическая проба при диагностике туберкулеза. Серологические исследования при диагностике туберкулеза.
- Фиброматоз десмоидного типа
- Брови и ресницы. Красота и уход за бровями и ресницами
- Случай успешного лечения периодонтита с симптомами гайморита без привлечения ЛОРа
