ЭхоКГ патологических структур в левом желудочке
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Левый желудочек - это сердечная камера, из которой начинается большой круг циркуляции крови. В результате воздействия определенных факторов могут проявляться изменения этой камеры сердца. Что являют собой изменения миокарда левого желудочка? В норме он претерпевает модификации на протяжении всей жизни. У новорожденного его объем 5,5-10см 3 , а к 18 годам размер левого желудочка достигает 130-210см 3 . По причине развития патологий сердечно-сосудистой системы может происходить диффузное, метаболическое, очаговое нарушения в сердечной мышце.
Описание патологии
Изменение миокарда левого желудочка может спровоцировать различные заболевания или же нарушения обменных процессов в сердечной мышце. Умеренные нарушения функционирования сердца могут быть диффузными или очаговыми. Первый тип характеризуется сбоем миоцитов левого желудочка, в результате чего они неправильно сокращаются. То есть, по этим клеткам неправильно проводится электрический импульс.
Второй тип - это очаговые изменения. При этом на стенке левого желудочка образуются рубцы. Они состоят из соединительной ткани, которая не способна проводить электрические импульсы.
Умеренные нарушения метаболического типа могут сами собой прийти в норму, но если такие сбои происходят часто, то миокард не может восстановиться.
Таким образом, изменения могут трансформироваться в необратимые. В процессе усугубления ситуации они способны спровоцировать сердечные патологии.
Когда есть несоответствие между расходом энергии и поступлении ее в миокард, то последствием будут дистрофические изменения. Но даже дистрофия не всегда проявляет себя, а если и есть симптомы, то зачастую это повышенная утомляемость, на которую не всегда обращают внимание.
Гипертрофия левого желудочка - это состояние, которое организм активирует для компенсации процесса кровоснабжения. Особенно часто это происходит, если есть недостаточность митрального клапана. Гипертрофия отражается на состоянии стенок левого желудочка, они теряют эластичность. Также это касается и перегородки между желудочками.
При гипертрофии также происходит утолщение стенок. Оно не всегда равномерное, это может происходить по очаговому принципу, то есть только на определенном участке данной полости. А дистрофия миокарда приводит к тому, что стенка левого желудочка значительно истончается, а полость камеры растягивается.
Причины
Изменения миокарда возникают по многим причинам, и очень важно их правильно диагностировать. Некоторые из-них являются заболеваниями, которые могут даже угрожать жизни.
Причинами и результатом нарушений миокарда являются:
- фибрилляция предсердий;
- стеаноз сердечного клапана (аорты);
- мышечная дистрофия.
Патологические изменения в миокарде левого желудочка могут возникать по причине воспалительных заболеваний. Это миокардит, который провоцирует и диффузные, и очаговые нарушения. А он, в свою очередь, вызывается такими патологиями как ревматизм, грипп, корь, краснуха. Еще провоцируют изменения в миокарде разные аутоиммунные заболевания.
Для организма очень важно, чтобы обменные процессы нормально функционировали, в ином случае происходят дистрофические изменения, вследствие которых меняются миоциты. Нарушение обмена веществ чревато тем, что сердечная мышца не получает достаточного количества полезных веществ и кислорода. Еще это состояние называют кардиодистрофией.
Кадиодистрофия может возникать вследствие:
- Почечной и печеночной недостаточности.
- Сахарного диабета.
- Нарушения работы щитовидной железы, а именно ее гиперфункции.
- Анемии.
- Инфекционных заболеваний как острого, так и хронического характера, самыми популярными являются грипп, туберкулез.
- Интоксикации организма - алкогольная, наркотическая, отравление лекарственными препаратами и другими химическими веществами.
Дополнительно, причинами кардиодистрофии могут быть чрезмерные физические нагрузки, эмоциональные потрясения, стрессовые ситуации. Все эти факторы приводят к хроническому переутомлению. Еще нарушения обмена веществ провоцирует голодание или скудное питание.
У детей также может проявиться изменение миокарда левого желудочка, и причиной этого состояния стает кардиодистрофия. Факторами, спровоцировавшими ее проявление у ребенка, могут стать умственные перенагрузки, снижение двигательной активности.
Метаболические нарушения в миокарде могут возникать из-за сбоя процесса реполяризации. При этом нарушены процессы обмена калия и натрия на внутриклеточном уровне. А также метаболические нарушения возникают вследствие таких факторов:
- переохлаждение;
- повышенная нагрузка как эмоциональная, так и физическая;
- ожирение;
- хронические заболевания.
Кроме того, изменения миокарда ЛЖ возникают в результате прогрессирования атеросклероза, ишемии, гипертонической болезни, аритмии. Это серьезные заболевания, которые провоцируют гипертрофию миокарда.
Симптомы
Довольно часто данные изменения протекают бессимптомно по нескольку лет, или же проявляются незначительно.
Одним из самых распространенных признаков наличия патологических перемен в сердечной мышце является стенокардия. Так как когда стенка левого желудочка утолщается, происходит сжатие сосудов, которые питают мышцу.
Мерцательная аритмия и фибрилляция желудочков могут быть причинами развития изменений миокарда, а также и быть их следствием.
Еще одним симптомом возникновения изменений миокарда является «замирание сердца». При этом человек ощущает, что сердце несколько секунд не бьется. В результате он может потерять сознание.
Дополнительно могут возникать такие признаки:
- стойкое повышение артериального давления, частые его перепады;
- головная боль;
- боль в области сердца;
- слабость, быстрая утомляемость;
- нарушения сна.
Диффузные изменения
Что такое «изменения миокарда левого желудочка диффузного типа»? Данный вид является наиболее распространенным. При этом поражен не только левый желудочек, но и весь миокард, так как диффузные изменения характеризуются именно равномерным поражением.
Диффузные нарушения проявляются как при умеренных патологических процессах, так и при острых ситуациях, как например, инфаркт миокарда. В последнем случае есть и перемены в структуре тканей, и нарушение обменных процессов. Диффузные изменения - это скопление в левом желудочке миоцитов, которые, под влиянием определенных факторов, изменились, и не проводят импульсы.
При диффузных нарушениях миокарда левого желудочка, к общей симптоматике добавляется еще отечность ног, тахикардия, и даже скопление жидкости в легких.
Диффузные изменения миокарда левого желудочка могут спровоцировать ухудшение процесса кровообращения, гипоксии миокарда и возникновению некротических очагов. Самым опасным последствием этих нарушений является инфаркт миокарда.
Неспецифические аномалии
Данные нарушения регистрируются на ЭКГ. Звучит диагноз как «умеренные неспецифические изменения миокарда». Они имеют прямую связь с процессами реполяризации. Такое патологическое состояние влияет на процесс восстановления миоцитов после того, как через них прошел импульс.
Как правило, такие нарушения не опасны, и, при принятии необходимых мер, вполне обратимы, так как их провоцируют различные перенесенные заболевания, гормональные сбои, нарушенные метаболические процессы.
Осложнениями могут быть стенокардия, сердечная недостаточность, а даже инфаркт миокарда.
Изменения миокарда левого желудочка могут быть неопасными для здоровья человека. Довольно часто их диагностируют при плановых обследованиях, то есть случайно. Это значит, что характерных симптомов почти нет. Но не стоит и недооценивать такое состояние - если не принять необходимые меры, то состояние может ухудшиться. Обычно, при умеренных изменениях, врачи рекомендуют поменять рацион питания, отказаться от вредных привычек, наладить психоэмоциональное состояние.
Для подготовки материала использовались следующие источники информации.
Ложная хорда левого желудочка сердца: как действовать
Поговорим о состоянии, которое педиатры и кардиологи относят к малым аномалиям развития сердца, а отдельные авторы предлагают выделять как самостоятельную ситуацию, имеющую клиническое значение. Сегодня подробно разберемся, что такое дополнительная хорда левого желудочка (ДХЛЖ), каковы причины её развития, симптомы и методы диагностики. Также мы затронем тему опасности, осложнений и показаний к лечению.
Что такое хорда: расположение и функции
- правым трехстворчатым;
- левым (его ещё называют митральным) - двустворчатым.
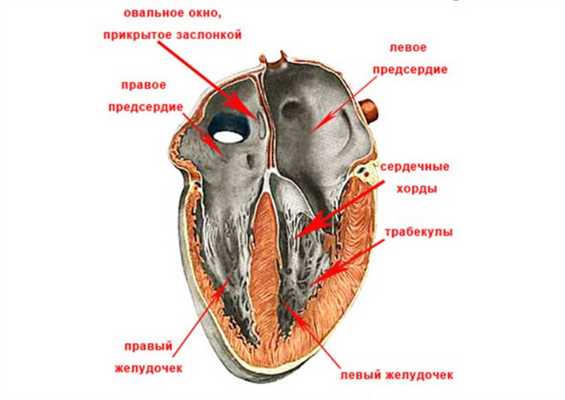
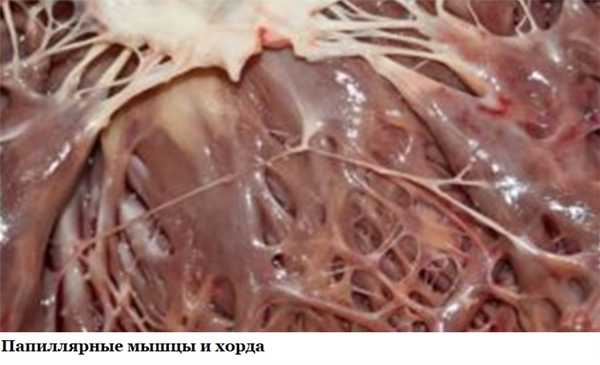
К створкам клапанов прикрепляются мясистые трабекулы, а также сухожильные хорды (тяжи, сердечные струны), образованные плотной соединительной тканью и отходящие от сосочковых мышц. Эти структуры природа «придумала» для того, чтобы удерживать створки клапанов:
- когда тяжи сокращаются, происходит открытие клапанов;
- в момент расслабления струн створки плотно смыкаются, создавая преграду для попадания крови в предсердия.
Иногда во время внутриутробного развития образуются добавочные, «лишние» волокна. Они могут обнаруживаться как справа, так и слева, но в 90 % случаев «страдает» левый желудочек. Если такая струна идет от папиллярных мышц к стенкам сердца или провисает свободно, кардиологи называют её ложной хордой левого желудочка (ЛХЛЖ). Если же она направляется от одной стенки желудочка к другой, то такое волокно именуют аномальным тяжем (АТЛЖ).
ДХЛЖ отличается от опорной струны митрального клапана:
- меньшей длиной и толщиной;
- структурной организацией.
Нормальное, типичное волокно характеризуется одним центральным стержнем, в котором проходит до 5 магистральных кровеносных сосудов. Ложная хорда левого желудочка образована 2 - 3-мя стержнями, разделенными соединительной тканью, внутри которой находятся сосуды микроциркуляторного русла.
Можно встретить и следующую формулировку - «дополнительная трабекула левого желудочка». Часто врачи имеют в виду при этом ДХЛЖ, хотя, с анатомической точки зрения, трабекула является отдельной структурой, продолжающей сердечную струну.
В англоязычной медицинской литературе употребляется термин falshe-chordae - «фальш-хорда». Некоторые авторы рекомендуют заменить дословный перевод на «эктопически крепящаяся хорда», как более точно отражающий суть изменений.
Причины развития аномалии
Главным этиологическим фактором возникновения такой аномалии, как дополнительная хорда в сердце у ребенка, является генетическая предрасположенность. Риск увеличивается при наличии кардиологической патологии у матери. Но специалисты не исключают и другие причины развития малых сердечных аномалий:
- употребление алкогольных напитков;
- курение;
- вирусные и бактериальные инфекции;
- стресс;
- чрезмерные физические нагрузки;
- неполноценное питание;
- загрязнение окружающей среды;
- радиация.
Аномалия соединительной ткани тесно связана с её дисплазией. Формирование сердечно-сосудистой системы плода заканчивается к восьмой неделе внутриутробного развития. Акушеры-гинекологи знают, что кровь у будущего ребенка самостоятельно циркулирует уже на 26 день беременности, клапаны сердца образовываются на 6 неделе, поэтому именно в первом триместре женщине необходимо особенно остерегаться неблагоприятных воздействий.
Симптомы и показания для визита к врачу
Детские кардиологи разделяют ДХЛЖ на гемодинамически значимые и такие, которые не влияют на здоровье и качество жизни. В подавляющем большинстве случаев родители не подозревают об имеющейся аномалии - ребенок развивается абсолютно нормально.
Клиника ДХЛЖ не имеет специфических признаков. Иногда ещё в периоде новорожденности диагностируется шум - акустическое явление в виде свиста, скрипа, которое врач слышит при выслушивании сердца. Причиной шума являются звуки от завихрений при продвижении крови в левом желудочке или вибрация дополнительной сердечной струны.
Проявление АХЛЖ определяется её внутрисердечной топографией и периодом жизни человека. Во время так называемых ростовых толчков, когда наблюдается усиленное увеличение длины тела, у детей возникают жалобы на:
- чрезмерную утомляемость;
- немотивированную усталость;
- бледность кожи;
- периодические учащения сердцебиения;
- болевые ощущения в области проекции верхушки сердца;
- чувство недостаточности воздуха.
Электрокардиографическое обследование может выявить наличие экстрасистол, нарушение проводимости, признаки гипертрофии миокарда левого желудочка. Если возникновение малой сердечной аномалии обусловлено синдромом дисплазии соединительной ткани, ДХЛЖ сопровождается следующими признаками:
- астеническое телосложение;
- низкий индекс массы тела;
- гипермобильность суставов;
- вывихи в анамнезе;
- деформация костей грудной клетки;
- нарушение осанки;
- структурные изменения внутренних органов.
Часто симптомы ДХЛЖ проявляются в подростковом периоде. Родители при этом могут связывать жалобы тинэйджера с трудностями школьной программы, переутомлением занятиями с репетиторами, перегрузками в спортивной секции, длительным сиденьем за компьютером.
Диагностика: как определить ЛХЛЖ
Когда врач говорит, что у вашего ребенка сердечный шум, это не повод для паники. Состояние не требует неотложных реанимационных мероприятий и интенсивного лечения. Главным диагностическим методом является ультразвуковое обследование. Оно поможет уточнить локализацию и количество добавочных тяжей. Различают следующие виды ДХЛЖ:
- по месту расположения в желудочке - верхушечные, средние, базальные;
- по отношению к оси сердца - диагональные, продольные, поперечные;
- по числу — единичные и множественные.
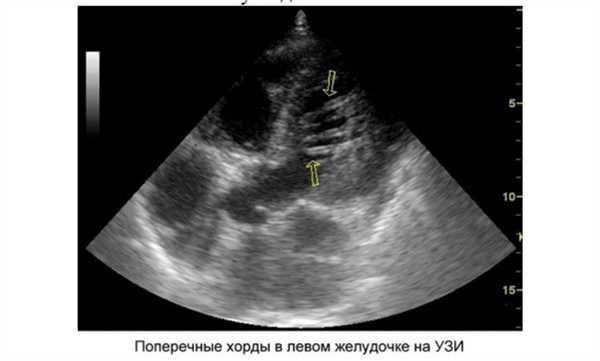
Если у малыша любого возраста с помощью эхокардиографии была выявлена в полости левого желудочка дополнительная хорда, советую родителям пройти следующие обследования:
- Общий анализ крови в плане диагностики ЛХЛЖ не имеет значения, но он выявит анемию или имеющийся воспалительный процесс в организме, который может усугубить состояние ребенка с малой сердечной аномалией.
- Электрокардиография. Желательно провести холтеровское мониторирование, которое позволит исключить аритмию с большей диагностической точностью.
- ЭКГ-пробы с физической нагрузкой покажут, насколько сердце ребенка «справляется» со своей функцией.
- Консультации узких специалистов (ортопеда, эндокринолога, отоларинголога).
Я всегда поясняю родителям грудничков, что иногда аномальная хорда может удлиниться и «врасти» в клапан, поэтому при последующих УЗИ врач ДХЛЖ не обнаруживает. В таких случаях говорят, что малыш «перерос» данную патологию.
Советы врача: как часто делать эхокардиографию при ложной хорде
Для стандартного чек-апа при малой сердечной аномалии достаточно проходить ЭхоКГ 1 раз в год. Обследование назначают внепланово, если:
- у пациента появились жалобы, включая те, что напрямую не связанные с кардиологией;
- вы замечаете, что ребенок интенсивно растет;
- произошло резкое снижение веса;
- диагностировано хроническое заболевание, например астма, гастрит, нефрит;
- ребенок идет в детский сад, школу, вуз;
- стоит вопрос о спортивной секции;
- произошел стресс: экзамен, потеря одного из членов семьи, конфликт в детском коллективе и дома;
- планируется или определяется беременность.
Единичные ДХЛЖ не считаются патологией. Специалисты рассматривают их как анатомическую особенность человека. Наличие добавочной хорды не является противопоказанием к посещению уроков физического воспитания. Юноши с аномальными тяжами могут призываться в армию, если у них не наблюдается осложнений и сопутствующей патологии. Важно лишь доступно рассказать ребенку о его состоянии и предупредить, что ему необходимо внимательно относиться к своему здоровью.
Какие осложнения могут встречаться при фальш-хорде
Прогноз при единичных аномальных хордах благоприятный. Осложнения наблюдаются редко, но множественные поперечные и диагональные хорды способны выступать пусковым механизмом для развития диастолической дисфункции сердца, повышая риск тромбообразования, бактериального эндокардита, а также сочетаться с другими врожденными аномалиями.
Иногда ЛХЛЖ может стать причиной:
- экстрасистолий;
- пароксизмальной желудочковой тахикардии;
- синдрома WPW;
- фибрилляции предсердий;
- ТЭЛА;
- тромботического поражения вен;
- ишемического инсульта;
- остановки сердца.
Данные нарушения наблюдаются во взрослом возрасте, но подросток, имеющий ДХЛЖ, должен быть проинформирован о них. Неблагоприятный прогноз свойственен только синдрому некомпактного миокарда левого желудочка (НМЛЖ), который характеризуется наличием многочисленных добавочных трабекул и хорд, сочетающихся с изменением структуры сердечной мышцы.
Несмотря на указанные осложнения, статистика утверждает: неоднократные клинические наблюдения не выявили взаимосвязи между наличием дополнительных тяжей в левом желудочке и риском сердечно-сосудистой смертности.
Лечение
Как правило, единичные ДХЛЖ без клинических проявлений лечения не требуют. Медикаменты назначаются при развитии осложнений и сопутствующей патологии сердца. Терапия симптоматическая - антиаритмические средства и вещества, корректирующие гемодинамику: мочегонные, гипотензивные, антиоксидантные, препараты калия и магния.
Хирургические методы лечения (локальная криодеструкция и иссечение ЛХЛЖ) применяются редко: если аномальный тяж выступает причиной аритмии, составляющей угрозу жизни пациента.
Рекомендации по ведению образа жизни:
- отказаться от фастфуда и сладких газированных напитков;
- минимум час в день пребывать на свежем воздухе;
- не засиживаться за компьютером;
- найти в личном расписании время для занятий физическими упражнениями;
- научиться противостоять стрессам;
- своевременно прививаться от гриппа и других инфекционных болезней;
Обязательно нужно обсуждать с подростком вопрос «вредных привычек». Важно, чтобы молодой человек осознанно считал для себя недопустимым сделать глоток слабоалкогольного напитка или вдохнуть сигаретный дым.
Женщинам с ДХЛЖ беременность не противопоказана. Она не несет угрозы для здоровья, проходит без негативных последствий для мамы и ребенка, следует лишь известить врача об имеющейся дополнительной хорде.
Методы профилактики: есть ли что-то особенное
Специфической профилактики ДХЛЖ не существует. Человек, имеющий единичную эктопически расположенную хорду, может вести активную жизнь. При отсутствии осложнений и нарушений гемодинамики нет ограничений для выбора профессии.
Некомпактный миокард левого желудочка ( Губчатая кардиомиопатия , Губчатый миокард )
Некомпактный миокард левого желудочка — тип кардиомиопатии, который характеризуется гипертрофией мышечных волокон указанной локализации, их чрезмерной трабекулярностью, образованием глубоких межтрабекулярных пространств. Пациенты жалуются на одышку, быструю утомляемость, нарушения ритма, головную боль, отеки ног. Диагностика основывается на инструментальных методах: Эхо-КГ, ЭКГ, МРТ, ПЭТ-КТ. Тактика лечения зависит от тяжести патологии, включает в себя медикаментозные и хирургические методики, направленные на коррекцию сердечной недостаточности, предупреждение опасных аритмических, тромбоэмболических осложнений.
МКБ-10
Общие сведения
Некомпактный, или губчатый, миокард левого желудочка (НЛМЖ) — диагноз, относительно недавно введенный в клиническую практику в связи с улучшением методов исследования сердца. Является редко встречающимся заболеванием, наблюдается примерно у 0,015% взрослых людей, в 18% случаев имеет наследственный характер. Специалисты отмечают, что реальные цифры могут существенно превышать официальные данные из-за выраженной гиподиагностики сердечно-сосудистых патологий. Аномалия строения чаще диагностируется у мужчин — 56-82%. У детей составляет до 10% обнаруживаемых болезней миокарда, занимает третье место по частоте после гипертрофической и дилатационной кардиомиопатии. У больных младше 18 лет около половины наблюдений является следствием генетического дефекта.
Причины НМЛЖ
- Эмбриональная. Заболевание является наследственным, передача осуществляется двумя путями: с аутосомами или с половой Х-хромосомой (около 40% наблюдений). Локализовать поврежденный ген лабораторно не удалось, но можно выделить общие закономерности - мутация затрагивает нормальный биосинтез белков, ответственных за построение внутреннего клеточного скелета (бета-миозин, кардиальный альфа-актин, тропонин-Т).
- Дезадаптационная. Образование некомпактного миокарда становится патологической реакцией на повреждающие факторы. Это предположение подкрепляется фактами обнаружения заболевания у взрослых пациентов с ранее неизмененной сердечной мышцей. Подобные случаи выявлялись у молодых спортсменов и беременных женщин, что говорит о повышенной нагрузке на кардиальные структуры как о ведущей причине развития повышенной трабекулярности, возможно - на фоне существующей наследственной предрасположенности.
Патогенез
В механизме развития заболевания ведущую роль играют три основных компонента: недостаточная функция сердца, нарушения ритма, повышенный риск тромбоэмболии. Некомпактный миокард представляет собой слой кардиомиоцитов с нарушенной структурной организацией, что не позволяет ему сокращаться так же эффективно, как здоровым участкам сердечной мышцы. Чем больше аномальных мышечных волокон - тем ярче выражены признаки кардиальной недостаточности. Патологическая архитектоника ткани создает условия для расстройства микроциркуляции крови и ишемии левого желудочка. Уменьшение функциональной активности органа может быть как систолическим, так и диастолическим по рестриктивному типу, что связано с повышенной трабекулярностью.
Нарушения сердечного ритма провоцируются анатомической неоднородностью миокарда - некомпактный, рыхлый слой сменяется слоем с более плотной структурой. Это негативно влияет на распространение электрического импульса по мышечным волокнам и может приводить к развитию желудочковых аритмий. На фоне сниженной насосной функции сердца, наличия обширных полостей между дополнительными трабекулами неритмичные сокращения создают предпосылки для изменения реологических свойств крови и тромбообразования.
Классификация
Некомпактный миокард определяют как первичную структурную и функциональную патологию сердечной мышцы, развивающуюся при отсутствии заболеваний, способных вызвать нарушение строения тканей: артериальной гипертензии, дисфункции венечных сосудов, клапанной системы. Аномалию, локализованную в левом желудочке, систематизируют по наличию либо отсутствию сопутствующих изменений строения сердца:
- Изолированная форма. Губчатый миокард представляет собой единственную структурную кардиальную патологию в виде массивных трабекулярных образований. Из-за скудной клинической картины и низкой вероятности развития осложнений обычно не диагностируется.
- Сочетанная форма. Некомпактный слой кардиальной мышцы сочетается с врожденными пороками сердца (дефект межпредсердной, межжелудочковой перегородки, врожденный стеноз легочной артерии) или нейромышечными заболеваниями (метаболическая миопатия, мышечная дистрофия Беккера, Эмери-Дрейфуса). Патологии не являются причиной увеличенной трабекулярности, которая нередко обнаруживается в процессе диагностики основного заболевания.
Симптомы НМЛЖ
Заболевание имеет чрезвычайно разнообразную клиническую картину, выраженность которой во многом зависит от степени гипертрофического процесса. Обычно симптомы проявляются у детей и подростков, однако манифестация возможна и в зрелом возрасте. Пациенты отмечают нарастающие симптомы сердечной недостаточности, прежде всего - появление одышки. Учащение дыхания вначале выявляется при активной физической активности, затем - при легкой нагрузке, в терминальных стадиях — в покое. Застойные явления в сосудах легких провоцируют затруднения дыхания в положении лежа, ночные приступы кашля, иногда с примесью крови.
При выраженной гипофункции кардиомиоцитов могут наблюдаться отеки и синюшность нижних конечностей. У ряда больных обнаруживается слабость, быстрая утомляемость, спутанность сознания, нарушение сна, уменьшение диуреза, особенно в дневное время. Развитие аритмии добавляет к клинической картине ощущение сердцебиения, перебоев в работе органа, тахикардию или выраженную брадикардию, боль за грудиной, головокружение, иногда - потери сознания. Некомпактный миокард нередко сочетается с нейромышечными патологиями, что проявляется снижением тонуса скелетной мускулатуры, нарушением походки, постепенной утратой физических навыков (ходьба, способность сидеть, держать голову).
Осложнения
НМЛЖ способен привести к развитию жизнеугрожающих состояний, природа которых тесно связана с тремя основными компонентами патогенеза аномалии. Сердечная недостаточность может стать причиной тяжелых клинических синдромов: отека легких, кардиогенного шока, острой почечной недостаточности. Прогрессирующее разрастание трабекул в полости левого желудочка иногда провоцирует внезапную сердечную смерть из-за критического нарушения функции проводящей системы и развития фибрилляции желудочков. Тромбоэмболические осложнения — ведущие причины инвалидизации пациентов с некомпактным миокардом, способствующие возникновению ишемического инсульта, коронарогенного инфаркта, тромбоза артерий брыжейки, почек.
Диагностика
Симптомы некомпактного миокарда достаточно неспецифичны, поэтому на первое место в обнаружении патологии выходят инструментальные методы. На первичном приеме кардиолог или терапевт может заподозрить наличие аномального строения сердца по сочетанию признаков сердечной недостаточности и аритмического синдрома. Специалист уточняет семейный анамнез, чтобы выявить возможную наследственную предрасположенность. Из дополнительных методов обследования используются:
- Ультразвуковое исследование (Эхо-КГ). Является основным способом визуализации при нефизиологическом строении мышечного слоя левого желудочка. На патологию указывает утолщение стенки камеры из-за выдающихся в полость массивных трабекул с объемными межтрабекулярными пространствами, особенно в области верхушки, боковой стенки. Толщина некомпактной части вдвое больше нормальной, при использовании доплеровского картирования в желудочке выявляются турбулентные потоки крови. Дополнительно уточняется вид заболевания - при изолированной форме другие аномалии строения органа не просматриваются.
- Магнитно-резонансная томография. Применение этого метода дополнительно к Эхо-КГ позволяет провести более полный дифференциальный диагноз, исключить ошибку, особенно при затруднительной визуализации верхушки сердца. Применение контрастного вещества помогает повысить разрешающую способность исследования и более точно определить внутреннюю структуру левого желудочка, а также диагностировать некомпактный слой на ранних стадиях.
- Позитронно-эмиссионная томография. Дает возможность оценить объем регионарного кровотока в измененных областях кардиальной мышцы, установить коронарный резерв в участках гипокинезии, сравнить перфузию, активность метаболических процессов в нормальных и аномальных участках. Методика применяется для уточнения эффективности терапевтических мероприятий.
- Электрокардиография. С помощью ЭКГ определяют частоту и характер сердечных сокращений, выявляют экстрасистолию, аритмию, вид нарушения внутрикардиальной проводимости, исключают органические повреждения. Иногда метод дополняют велоэргометрией для оценки резервных возможностей миокарда и уточнения степени сердечной недостаточности или холтеровским мониторированием для выявления редко проявляющихся нарушений ритма.
- Электрофизиологическое исследование. Использование этого инвазивного метода диагностики требуется при выраженных аритмиях для корректировки тактики лечения. Полученные данные помогают решить вопрос о необходимости установки кардиостимулятора или (при риске развития опасной для жизни фибрилляции желудочков) кардиовертера-дефибриллятора.
Дифференциальный диагноз проводят с опухолями сердца, другими видами кардиомиопатий, добавочными хордами, трабекулами, ишемической болезнью, амилоидозом, инфарктом миокарда, кардиогенным шоком, кардиогенным дистресс-синдромом. Как причины развития одышки необходимо исключить хронические обструктивные заболевания легких (ХОБЛ, бронхиальную астму, эмфизему легких), пневмонию.
Лечение НМЛЖ
При отсутствии симптоматики, нарушений ритма, уменьшения фракции выброса левого желудочка проведение специализированной терапии не показано. Необходим контроль над состоянием в динамике, плановые осмотры у кардиолога не реже 1 раза в 6 месяцев. При выраженных проявлениях патологии необходима коррекция состояния, предупреждение опасных осложнений. Существуют две основные линии лечения некомпактного миокарда левого желудочка:
- Медикаментозная терапия. Применение лекарственных препаратов обосновано при легкой и средней тяжести болезни. Для улучшения функции миокарда, увеличения ударного объема левого желудочка используют ингибиторы АПФ, бета-адреноблокаторы, антагонисты альдостерона. Выраженные нарушения ритма, особенно желудочковой локализации требуют применения антиаритмических средств: антагонистов кальциевых, натриевых, калиевых каналов. Профилактика тромбоэмболии заключается в назначении антикоагулянтов, антиагрегантов.
- Хирургическое лечение. Инвазивные методики рекомендованы при тяжелом течении некомпактного миокарда с выраженной сердечной недостаточностью, наличием жизнеугрожающих нарушений ритма. Непосредственно резекция губчатого слоя — перспективное направление, которое в клинической практике в настоящее время почти не используется. Обычно при серьезных нарушениях работы проводящей системы сердца производится вживление кардиовертера-дефибриллятора или искусственного водителя ритма. При трехкратном преобладании патологического слоя кардиомиоцитов на фоне терминальных стадий сердечной недостаточности рассматривается возможность трансплантации сердца.
Прогноз и профилактика
Долгосрочный прогноз зависит от распространенности аномалии, возраста пациента, наличия сопутствующих заболеваний. Смертность в течение 7 лет с момента постановки диагноза достигает 24%. При своевременном обращении к специалистам, комплексном полноценном лечении возможна коррекция недостаточной функции сердца, аритмических проявлений. Из-за преимущественно наследственной этиологии некомпактного миокарда специфическая профилактика отсутствует. Общие превентивные мероприятия включают ведение здорового образа жизни, достаточную физическую активность, правильное питание, снижение психоэмоциональных нагрузок.
2. Некомпактный миокард левого желудочка/ Голухова Е.З., Шомахов Р.А.// Креативная кардиология - 2013 - №1.
3. Некомпактный миокард левого желудочка: симптом, синдром или вариант развития/ Поляк М.Е., Мершина Е.А., Заклязьминская Е.В.// Российский кардиологический журнал - 2017 - №2.
4. Некомпактный миокард левого желудочка/ Ушаков А.В., Горянская И.Я., Драненко Н.Ю.// Крымский терапевтический журнал - 2011 - №2.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия - первичное изолированное поражение миокарда, характеризующееся гипертрофией желудочков (чаще левого) при уменьшенном или нормальном объеме их полостей. Клинически гипертрофическая кардиомиопатия проявляется сердечной недостаточностью, болью в грудной клетке, нарушениями ритма, синкопальными состояниями, внезапной смертью. Диагностика гипертрофической кардиомиопатии включает проведение ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, рентгенологического исследования, МРТ, ПЭТ сердца. Лечение гипертрофической кардиомиопатии проводится b-адреноблокаторами, блокаторами кальциевых каналов, антикоагулянтами, антиаритмическими препаратами, ингибиторами АПФ; в ряде случаев прибегают к кардиохирургической операции (миотомии, миоэктомии, протезированию митрального клапана, двухкамерной электрокардиостимуляции, имплантации кардиовертер-дефибриллятора).
В кардиологии различают первичные (идиопатические) кардиомиопатии (гипертрофическую, констриктивную, дилатационную, рестриктивную, аритмогенную дисплазию правого желудочка) и специфические вторичные кардиомиопатии (алкогольную, токсическую, метаболическую, климактерическую и ряд других).
Гипертрофическая кардиомиопатия - самостоятельное, не зависящее от других сердечно-сосудистых заболеваний, значительное утолщение миокарда левого (реже правого) желудочка, сопровождающееся уменьшением его полости, нарушением диастолической функции с развитием нарушений сердечного ритма и сердечной недостаточности.
Гипертрофическая кардиомиопатия развивается у 0,2-1,1% населения, чаще мужского пола; средний возраст пациентов составляет от 30 до 50 лет. Коронарный атеросклероз среди больных гипертрофической кардиомиопатией встречается в 15-25 % случаев. Внезапная смерть, вызванная с тяжелыми желудочковыми аритмиями (пароксизмальной желудочковой тахикардией), наступает у 50% пациентов с гипертрофической кардиомиопатией. У 5-9 % больных заболевание осложняется инфекционным эндокардитом, протекающим с поражением митрального или аортального клапана.
Гипертрофическая кардиомиопатия - заболевание с аутосомно-доминантным типом наследования, поэтому обычно носит семейный характер, что не исключает, однако, возникновение спорадических форм.
В основе семейных случаев гипертрофической кардиомиопатии лежат передаваемые по наследству дефекты генов, кодирующих синтез сократительных белков миокарда (гена тяжелой цепи b-миозина, гена сердечного тропонина Т, гена а-тропомиозина, гена, кодирующего сердечную изоформу миозин-связывающего белка). Спонтанные мутации этих же генов, происходящие под воздействием неблагоприятных факторов среды, обусловливают развитие спорадических форм гипертрофической кардиомиопатии.
Гипертрофия миокарда левого желудочка при гипертрофической кардиомиопатии не связана с врожденными и приобретенными пороками сердца, ИБС, гипертонической болезнью и другими заболеваниями, которые обычно приводят к подобным изменениям.
В патогенезе гипертрофической кардиомиопатии ведущая роль принадлежит компенсаторной гипертрофии сердечной мышцы, обусловленной одним из двух возможных патологических механизмов - нарушением диастолической функции миокарда или обструкцией выходного тракта левого желудочка. Диастолическая дисфункция характеризуется поступлением в желудочки недостаточного количества крови в диастолу, что связано с плохой растяжимостью миокарда, и обусловливает быстрый подъем конечного диастолического давления.
При обструкции выходного отдела левого желудочка имеет место утолщение межжелудочковой перегородки и нарушение движения передней створки митрального клапана. В связи с этим в период изгнания возникает перепад давления между полостью левого желудочка и начальным отрезком аорты, что сопровождается повышением конечного диастолического давления в левом желудочке. Возникающая в этих условиях компенсаторная гиперфункция сопровождается гипертрофией, а затем и дилатацией левого предсердия, в случае же декомпенсации развивается легочная гипертензия.
В ряде случаев гипертрофической кардиомиопатии сопутствует ишемия миокарда, обусловленная снижением вазодилататорного резерва коронарных артерий, увеличением потребности гипертрофированного миокарда в кислороде, сдавлением во время систолы интрамуральных артерий, сопутствующим атеросклерозом венечных артерий и т. д.
Макроскопическими признаками гипертрофической кардиомиопатии служит утолщение стенок левого желудочка при нормальных или уменьшенных размерах его полости, гипертрофия межжелудочковой перегородки, дилатация левого предсердия. Микроскопическая картина гипертрофической кардиомиопатии характеризуется беспорядочным расположением кардиомиоцитов, замещением мышечной ткани на фиброзную, аномальным строением интрамуральных венечных артерий.
В соответствии с локализацией гипертрофии выделяют гипертрофическую кардиомиопатию левого и правого желудочков. В свою очередь, гипертрофия левого желудочка может быть асимметричной и симметричной (концентрической). В большинстве случаев выявляется асимметричная гипертрофия межжелудочковой перегородки на всем протяжении или в ее базальных отделах. Реже встречается асимметричной гипертрофия верхушки сердца (апикальная гипертрофическая кардиомиопатия), задней или переднебоковой стенки. На долю симметричной гипертрофии приходится около 30 % случаев.
С учетом наличия градиента систолического давления в полости левого желудочка различают обструктивную и необструктивную гипертрофическую кардиомиопатию. Симметричная гипертрофия левого желудочка, как правило, представляет собой необструктивную форму гипертрофической кардиомиопатии.
Асимметричная гипертрофия может являться как необструктивной, так и обструктивной. Так, синонимом асимметричной гипертрофии межжелудочковой перегородки служит понятие «идиопатический гипертрофический субаортальный стеноз», гипертрофии средней части межжелудочковой перегородки (на уровне папиллярных мышц) - «мезовентрикулярная обструкция». Верхушечная гипертрофия левого желудочка, как правило, представлена необструктивным вариантом.
В зависимости от степени утолщения миокарда выделяют умеренную (15-20 мм), среднюю (21-25 мм) и выраженную (более 25 мм) гипертрофию.
На основании клинико-физиологической классификации выделяют IV стадии гипертрофической кардиомиопатии:
- I - градиент давления в выходном тракте левого желудочка (ВТЛЖ) не более 25 мм рт. ст.; жалобы отсутствуют;
- II - градиент давления в ВТЛЖ возрастает до 36 мм рт. ст.; появляются жалобы при физической нагрузке;
- III - градиент давления в ВТЛЖ увеличивается до 44 мм рт. ст.; появляются стенокардия, одышка;
- IV - градиент давления в ВТЛЖ выше 80 мм рт. ст.; развиваются выраженные нарушения гемодинамики, возможна внезапная сердечная смерть.
Симптомы гипертрофической кардиомиопатии
Длительное время течение гипертрофической кардиомиопатии остается бессимптомным, клиническая манифестация чаще происходит в возрасте 25-40 лет. С учетом преобладающих жалоб выделяют девять клинических форм гипертрофической кардиомиопатии: малосимптомную, вегетодистоническую, кардиалгическую, инфарктоподобную, аритмическую, декомпенсационную, псевдоклапанную, смешанную, молниеносную. Несмотря на то, что каждый клинический вариант характеризуется определенными признаками, всем формам гипертрофической кардиомиопатии присущи общие симптомы.
Необструктивная форма гипертрофической кардиомиопатии, не сопровождающаяся нарушением оттока крови из желудочка, обычно малосимптомна. В этом случае жалобы на одышку, перебои в работе сердца, неритмичный пульс могут отмечаться при выполнении физической нагрузки.
Типичными симптомами обструктивной гипертрофической кардиомиопатии служат приступы ангинозных болей (70%), выраженная одышка (90%), головокружения и обморочные состояния (25-50%), преходящая артериальная гипотензия, нарушения ритма сердца (пароксизмальная тахикардия, фибрилляция предсердий, экстрасистолия). Возможно возникновение приступов сердечной астмы и отека легких. Нередко первым эпизодом проявления гипертрофической кардиомиопатии служит внезапная смерть.
При диагностическом поиске обнаруживается систолический шум, высокий, скорый пульс, смещение верхушечного толчка. Инструментальные методы обследования при гипертрофической кардиомиопатии включают ЭхоКГ, ЭКГ, ФКГ, рентгенографию грудной клетки, холтеровское мониторирование, поликардиографию, ритмокардиографию. С помощью эхокардиографии выявляется гипертрофия МЖП, стенок миокарда желудочка, увеличение размеров левого предсердия, наличие обструкции ВТЛЖ, диастолическая дисфункция левого желудочка.
ЭКГ-признаки гипертрофической кардиомиопатии малоспецифичны и требуют дифференциальной диагностики с очаговыми изменениями миокарда, гипертонической болезнью, ИБС, аортальным стенозом и другими заболеваниями, осложняющимися гипертрофией левого желудочка. Для оценки тяжести гипертрофической кардиомиопатии, прогноза и выработки рекомендаций по лечению используются нагрузочные пробы (велоэргометрия, тредмил-тест).
Суточное мониторирование ЭКГ позволяет документировать пароксизмальные эпизоды желудочковой экстрасистолии и тахикардии, фибрилляции и трепетания предсердий. На фонокардиограмме регистрируется систолический шум различной степени выраженности, сохранность амплитуды I и II тонов. Сфигмография демонстрирует двухвершинную кривую каротидного пульса, характеризующуюся дополнительной волной на подъеме.
При рентгенологическом исследовании изменения контуров сердца (увеличение левых отделов сердца, расширение восходящей части аорты, выбухание ствола и расширение ветвей легочной артерии) обнаруживаются только в развернутой стадии гипертрофической кардиомиопатии. Для получения дополнительных данных за гипертрофическую кардиомиопатию прибегают к проведению зондирования левых отделов сердца, вентрикулографии, коронарографии, сканированию сердца с радиоизотопом таллия, МРТ, ПЭТ сердца. Окончательным подтверждающим методом служит генодиагностика.
Лечение гипертрофической кардиомиопатии
Пациентам с гипертрофической кардиомиопатией (особенно с обструктивной формой) рекомендуется ограничение физических нагрузок, которые могут спровоцировать увеличение градиента давления «левый желудочек-аорта», аритмии сердца и обмороки.
При умеренно выраженных симптомах гипертрофической кардиомиопатии назначают b-адреноблокаторы (пропранолол, атенолол, метопролол) или блокаторы кальциевых каналов (верапамил), уменьшающие ЧСС, удлиняющие диастолу, улучшающие пассивное наполнение левого желудочка и снижающие давление наполнения. В связи с наличием высокого риска развития тромбоэмболий необходим прием антикоагулянтов. При развитии сердечной недостаточности показаны диуретики, ингибиторы АПФ; при нарушениях желудочкового ритма - антиаритмические препараты (амиодарон, дизопирамид).
При обструктивной гипертрофической кардиомиопатии проводится профилактика инфекционного эндокардита, т. к. в результате постоянной травматизации передней створки митрального клапана на ней могут появляться вегетации. Кардиохирургическое лечение гипертрофической кардиомиопатии целесообразно при градиенте давления между левым желудочком и аортой >50 мм рт.ст. В этом случае может выполняться септальная миотомия или миоэктомия, а при структурных изменениях митрального клапана, вызывающих значительную регургитацию, - протезирование митрального клапана.
Для уменьшения обструкции ВТЛЖ показана имплантация двухкамерного электрокардиостимулятора; при наличии желудочковых нарушений ритма - имплантация кардиовертер-дефибриллятора.
Прогноз гипертрофической кардиомиопатии
Течение гипертрофической кардиомиопатии вариабельно. Необструктивная форма гипертрофической кардиомиопатии протекает относительно стабильно, однако при длительном стаже заболевания все же развивается сердечная недостаточность. У 5-10% пациентов возможен самостоятельный регресс гипертрофии; у такого же процента больных отмечается переход гипертрофической кардиомиопатии в дилатационную; еще столько же пациентов сталкивается с осложнением в виде инфекционного эндокардита.
Без лечения летальность при гипертрофической кардиомиопатии составляет 3-8 %, при этом в половине подобных случаев возникает внезапная смерть вследствие фибрилляции желудочков, полной атриовентрикулярной блокады, острого инфаркта миокарда.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) - отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки - наиболее часто встречающийся врожденный порок сердца (9-25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью - такое состояние характеризуется как единственный желудочек сердца.
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже - аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации - болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова-Роже), средний - равен примерно 1/2 диаметра аортального отверстия, большой - равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки - 10% (приточные, трабекулярные) - расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца - «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Читайте также:
