Экономика чрескожных коронарных вмешательств. Экономика антикоагулянтной и антитромботической терапии
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Мерцательная аритмия (МА) - распространенное нарушение ритма сердца, основной опасностью которого является развитие ишемического инсульта (ИИ) и системных эмболий (СЭ), приводящих к смерти и инвалидизации больных. Основной стратегией профилактики тромбоэмболических осложнений у больных МА является назначение антагонистов витамина K (АВК) 6.
- КЛЮЧЕВЫЕ СЛОВА: атеротромбоз, аритмия, ишемия, болезнь сердца, Варфарин
Рис. 1. Стратификация риска и выбор антитромботического препарата у больных (ACC/AHA/ESC practice guidelines, 2006)
Таблица. Расчет риска геморрагических осложнений у больного, принимающего АВК, на основании шкалы HEMORR2HAGES и Outpatient Bleeding Risk Index 25
Рис. 2. Анамнез заболевания и изменения в антитромботической терапии у больного МА на протяжении двенадцати лет терапии АВК
В настоящее время системой, определяющей выбор антитромботического препарата, является шкала CHADS2. Низким риском тромбоэмболических осложнений обладают пациенты, имеющие 0-1 балл по шкале CHADS2. Таким больным показана терапия аспирином. Больные, имеющие 1 балл по шкале CHADS2, в качестве альтернативы могут использовать Варфарин или аспирин. Больные с риском, превышающим 1 балл согласно данной системы оценки риска, имеют абсолютные показания к терапии Варфарином (рис. 1).
Развитие МА у больных неразрывно связано с другими сердечно-сосудистыми заболеваниями, такими как артериальная гипертония и ишемическая болезнь сердца (ИБС), пороки сердца. Количество больных МА, имеющих сопутствующую ИБС, составляет около 20-30%. Проведение чрескожных коронарных вмешательств (ЧКВ) с имплантацией стентов, как в плановом порядке, так и в связи с развитием острого коронарного синдрома (ОКС), в настоящее время является широко распространенным. После проведения ЧКВ больным в соответствии с существующими рекомендациями показана длительная двухкомпонентная антитромбоцитарная терапия аспирином и клопидогрелем [8]. Известно, что преждевременное прекращение приема тиенопиридинов сопряжено с 10-кратным увеличением риска тромбоза стента.
Около 5% всех больных, подвергаемых ЧКВ, нуждаются в терапии Варфарином в связи с наличием МА. Очевидно, что тройная антитромботическая терапия повышает риск кровотечений. Какова же тактика в таких случаях?
Во-первых, необходимо помнить, что отмена Варфарина и назначение терапии аспирином или комбинации аспирина и клопидогреля для больных МА с высоким риском тромбоэмболических осложнений не является адекватной заменой. Тромб в ушке или полости левого предсердия, являющийся причиной кардиоэмболических инсультов у больных МА, по структуре близок к венозному тромбу и ассоциирован с высокой тромбинемией. Именно этими факторами, вероятнее всего, объясняется значительно меньшая по сравнению с Варфарином эффективность монотерапии аспирином и комбинированной антитромбоцитарной терапии у больных МА. По результатам, объединившим исследования AFASAK, SPAF, EAFT, эффективность аспирина в предотвращении ИИ у больных МА не превышает 21% 11. Исследование ACTIVE-W [13], в рамках которого проводилось сравнение комбинации клопидогрель ≥ аспирин и Варфарина в отношении развития сердечно-сосудистых осложнений у больных МА, было прекращено досрочно в сентябре 2005 г., из-за явного преимущества Варфарина перед комбинацией двух антиагрегантов при одинаковом риске геморрагических осложнений.
В то же время, продолжение лечения Варфарином как в монотерапии, так и в сочетании с аспирином не предотвращает тромбоза стента. Таким образом, теоретически является логичным назначение так называемой трехкомпонентной терапии, включающей в себя Варфарин, аспирин и клопидогрель, что многократно увеличивает риск кровотечений [14].
Общеизвестно, что сама по себе антикоагулянтная терапия АВК связана с повышением риска геморрагических осложнений. Частота больших кровотечений на фоне терапии Варфарином составляет около 2%, а фатальных - около 0,1% в год [12, 15-19]. Частота больших кровотечений на фоне трехкомпонентной терапии по данным ряда ретроспективных и обсервационных исследований составляет от 3,1 до 18% [14, 20-23].
Для больного, принимающего комбинированную антитромботическую терапию, чрезвычайно важно минимизировать риск геморрагических осложнений. Как же снизить риск кровотечений, зная, что прием каждого из антитромботических препаратов абсолютно необходим больному? Во-первых, насколько это возможно уменьшить длительность одновременного приема трех препаратов и, во-вторых, назначать препараты в минимальной эффективной дозе. Однако далеко не все клинические ситуации, возникающие в реальной практике при лечении несколькими антитромботическими препаратами, могут быть освещены в рекомендациях. В качестве примера подобного случая приводим историю болезни одного из длительно наблюдаемых нами пациентов.
Клиническое наблюдение
В 1998 году у пациента установилась постоянная форма мерцания-трепетания предсердий. Назначение атенолола в суточной дозе 75 мг не урежало в достаточной степени частоту сердечных сокращений, а увеличение дозы до 100 мг в сутки оказывало проаритмогенное действие - у больного стала регистрироваться желудочковая эктопическая активность высоких градаций, включая неустойчивые пробежки желудочковой тахикардии. В связи с чем была подобрана терапия Финоптином (ретардированная форма 240 мг/сут) и Капотеном 37,5 мг/сут. Учитывая наличие у больного факторов риска тромбоэмболических осложнений - артериальной гипертонии и атриомегалии, в 1998 году больному была начата терапия антагонистами витамина K. В то время пациенту был назначен Аценокумарол в суточной дозе 3 мг под контролем МНО (целевой диапазон 2,0-3,0).
В начале лечения Аценокумаролом у больного отмечалась незначительная десневая кровоточивость, расцененная как проявления малых геморрагий, не требовавших отмены или коррекции дозы препарата.
На протяжении всего периода наблюдения у больного отмечалось повышение уровня общего холестерина до 8-8,9 ммоль/л. Учитывая гипербилирубинемию (общий билирубин 40-46 мкМ/л, прямой билирубин 10-13 мкмол/л), вероятнее всего, в рамках синдрома Жильбера, а также по экономическим причинам статины больной не получал до 2003 года. В дальнейшем на фоне соблюдения диеты и назначения симвастатина в дозе 20 мг уровень общего холестерина снизился до 5,6-6,0 ммоль/л.
С 1998 года у больного по результатам УЗДАС был выявлен стеноз в устье правой подключичной артерии до 50-55% и утолщение толщины интима-медиа в области бифуркации левой ВСА. Через 5 лет отрицательной динамики выявлено не было, а через 9 лет у больного появился стеноз 20-25% в бифуркации левой ОСА и окклюзия левой ВСА при отсутствии прогрессирования стеноза в устье правой подключичной артерии.
С 2004 года больной был переведен на терапию Варфарином в суточной дозе 6,25 мг. Значения МНО были в пределах 2,0-3,0. На протяжении всего времени наблюдения контроль МНО осуществлялся 1 раз в месяц. Среднее МНО за время наблюдения с 1998 по 2007 гг. составило 2,6. Больших геморрагических осложнений не было, изредка отмечалась десневая кровоточивость, не требовавшая отмены и изменения дозы препарата.
С 2003 года больной стал отмечать одышку при обычной умеренной физической нагрузке. Типичной клиники стенокардии у больного никогда не было, нитратами не пользовался. С 2006 года отметил существенное усугубление одышки и в 2007 году в возрасте 56 лет в связи с существенным снижением толерантности к физической нагрузке, больной был повторно госпитализирован в НИИ клинической кардиологии им. А.Л. Мясникова для проведения коронароангиографии.
При обследовании в мае 2007 года у больного выявлили расширение обоих предсердий, размеры которых увеличились по сравнению с данными прошлой госпитализации, ФВ превышала 60%, размер левого желудочка не был увеличен. По данным коронароангиографии было обнаружено: левый тип кровоснабжения миокарда и неизмененный ствол левой коронарной артерии. В передней нисходящей артерии были обнаружены два стеноза: протяженный стеноз до 50-60% в проксимальном и стеноз до 60-70% в дистальном сегменте. В диагональных и септальных ветвях признаков стенозирования не обнаружено. Огибающая артерия в проксимальном сегменте была стенозирована до 50%, в среднем и дистальном сегментах не изменена. В первой артерии тупого края имелся стеноз в средней трети до 60%. Задняя нисходящая артерия малого диаметра в устье была стенозирована до 70%. Правая коронарная артерия в проксимальном сегменте не изменена, в дистальном сегменте имелся стеноз на 80-90%.
Больному было проведено чрескожное коронарное вмешательство на передней нисходящей артерии, в дистальный и проксимальный отделы были имплантированы два стента с лекарственным покрытием. Остаточных стенозов в местах установки стентов не было. Процедура прошла без осложнений.
От выбора стента (голометаллический или с лекарственным покрытием) у больного, принимающего АВК, зависит длительность лечения тиенопиридинами, по мере увеличения длительности терапии возрастает риск геморрагических осложнений. Поэтому для больных МА перед проведением ЧКВ важно оценить риск кровотечений, который определяет выбор стента и соответственно длительность трехкомпонентной антитромботической терапии. Существует несколько шкал расчета риска кровотечений. Наиболее принятыми для больных, принимающих АВК, являются шкалы HEMORR2HAGES [24] и Outpatient Bleeding Risk Index [25] (см. табл.).
Для больных, имеющих высокий риск кровотечений, необходимо минимизировать продолжительность трехкомпонентной терапии Варфарином, аспирином и клопидогрелем, для чего у данной категории пациентов нужно избегать имплантации стентов с лекарственным покрытием. Эта мера позволяет уменьшить длительность трехкомпонентной терапии до 2-4 недель [14]. Для пациента, имеющего низкий/средний риск геморрагических осложнений, возможна имплантация стентов с лекарственным покрытием. В зависимости от типа имплантируемого стента и условий имплантации длительность трехкомпонентной терапии в таком случае составляет от 3 до 6 месяцев [14].
Принимая во внимание высокий риск тромбоэмболических осложнений при потенциально низком риске кровотечений, а также наличие стенозов в передней нисходящей артерии, нашему пациенту было имплантировано два стента с лекарственным покрытием и назначена трехкомпонентная терапия -
Варфарином с целевыми значениями МНО 2,0-2,5, аспирином 100 мг и клопидогрелем 75 мг/сут.
Через 4 месяца трехкомпонентной терапии у больного впервые в жизни развилось геморроидальное кровотечение, не приведшее к нарушениям гемодинамики и снижению гемоглобина и прекратившееся самостоятельно. В течение последующего месяца геморроидальные кровотечения неоднократно рецидивировали, появилась слабость, в анализах крови отмечалось снижение гемоглобина с 13,5 г/л до 10,8 г/дл, гематокрита до 37%. Мы были вынуждены реагировать на возникшее осложнение и снизить целевое МНО до 1,8-2,0, для чего доза Варфарина была уменьшена до 5,625 мг. Доза аспирина была уменьшена до 75 мг/сут, клопидогрель продолжен в прежней дозе. По рекомендации проктолога была начата терапия местными средствами. Однако геморроидальные кровотечения продолжались, хотя объем кровопотери, со слов больного, стал меньше. Несмотря на терапию препаратами железа, сохранялся сниженный уровень гемоглобина и гематокрита. Учитывая ранние сроки после имплантации стентов с лекарственным покрытием и невозможность отмены клопидогреля, аспирин был отменен. Было принято решение об оперативном лечении геморроя. Учитывая рецидивирующее кровотечения и невозможность полной отмены антитромботической терапии, больному была выполнена операция лигирования двух геморроидальных узлов под местной анестезией. Операция прошла без осложнений. Клопидогрель не отменялся, за два дня до предполагаемой операции Варфарин был отменен, и операция была выполнена на значении МНО 1,6. После операции доза Варфарина была увеличена до прежней 5,625 мг и МНО поддерживалось на значениях 1,8-2,2, учитывая одновременную терапию клопидогрелем. В дальнейшем геморроидальные кровотечения не повторялись.
В мае 2008 года, через год после ЧКВ, клопидогрель был отменен, была возобновлена терапия аспирином в суточной дозе 75 мг и продолжен Варфарин. В дальнейшем доза Варфарина была вновь увеличена до 6,25 мг, поддерживающая целевые значения МНО 2,0-2,5.
На фоне терапии Варфарином 6,25 мг и аспирином 75 мг с мая 2008 года и до настоящего времени (более 2-х лет) кровотечения не рецидивировали.
На протяжении наблюдения в течение 12 лет до настоящего времени у больного не было тромбоэмболических осложнений.
Анамнез заболевания больного и изменения в антитромботической терапии представлены на рис. 2.
Как демонстрирует данный клинический пример, безопасность является краеугольным камнем трехкомпонентной терапии. Несмотря на существующие шкалы расчета риска кровотечений, акцентирующие внимание врача на таких факторах, как пожилой возраст, хроническая почечная недостаточность, тромбоцитопатия, геморрагические осложнения в анамнезе, нельзя исключить возможность развития кровотечений у больного низкого риска. Так, наш пример демонстрирует отсутствие кровотечений на фоне девяти лет приема АВК у больного, не имеющего документированных факторов риска геморрагических осложнений и развитие рецидивирующих кровотечений, сопровождавшихся значимой анемией и потребовавших хирургического лечения через четыре месяца трехкомпонентной терапии.
В согласованном документе Европейского общества кардиологов, Европейской ассоциации нарушений ритма сердца и Европейской ассоциации по чрескожным коронарным вмешательствам, опубликованном в 2010 г. записано, что больному, принимающему АВК, необходимо избегать имплантации стентов с лекарственным покрытием во всех случаях, кроме имеющих специальные клинические или анатомические показания, такие как протяженный стеноз, малый диаметр сосуда, сахарный диабет [14]. Данная рекомендация обусловлена наличием связи между увеличением риска геморрагических осложнений и длительностью антитромботической терапии. Больной подвергается риску, связанному не только с самим кровотечением, но и с такими грозными осложнениями, как тромбоз стента и инфаркт миокарда на фоне отмены антитромботических препаратов в случае развития геморрагического осложнения.
Нельзя сказать, что больному, принимающему Варфарин, абсолютно противопоказано имплантировать стент с лекарственным покрытием. Однако в этих случаях целевой диапазон МНО должен соответствовать значениям 2,0-2,5, а клопидогрель и аспирин - назначаться в минимально эффективных дозах. Обязателен более четкий контроль и своевременная терапия, направленная на устранение потенциальных источников кровотечений.
В случае проявления малых геморрагий необходимо снизить целевые значения МНО до 1,8-2,2, рассмотреть возможность отмены аспирина. Необходимо создать мотивацию у больного на важность продолжения терапии клопидогрелем после ЧКВ. Для больных, имеющих высокий риск желудочно-кишечного кровотечения (пожилые пациенты, больные с язвенной болезнью желудка или двенадцатиперстной кишки или ЖКК в анамнезе), профилактически должны быть назначены ингибитор протонового насоса, Н2-блокатор или антацид.
Однако на практике не всегда бывает просто соблюдать, казалось бы, четкие рекомендации.
Для Варфарина характерны межиндивидуальные различия в антикоагулянтном ответе, обусловленные целым рядом внешних (диета, лекарственные взаимодействия), внутренних (соматическое состояние пациента, возраст), а также генетических факторов 26.
Поддерживающая доза Варфарина может широко различаться у разных больных, а также у одного и того же больного на протяжении длительного лечения. Анализ величин средних поддерживающих доз Варфарина у 115 больных, длительно наблюдающихся в НИИ клинической кардиологии им. А.Л. Мясникова, показал, что большинство больных (около 67%) принимают так называемые средние дозы Варфарина (2,5-7,5 мг/сут), а 9% больных требуется значительно меньшая доза (2,5 мг и менее) и у 24% пациентов поддерживающая доза Варфарина превышает 7,5 мг.
В последние годы установлено, что доза Варфарина генетически детерминирована. Наиболее изученными являются аллельные варианты двух основных ферментов биотрансформации АВК - CYP2C9 и VKORC1. В настоящее время изучаются влияния на поддерживающую дозу Варфарина таких полиморфизмов, как генотип CYP2C9*5 и CYP2C9*6, полиморфизм гена CYP4F2, описан ряд несинонимичных замен в гене VKORC1, ассоциированных с большими поддерживающими дозами Варфарина [27, 29, 31-34]. В августе 2007 года FDA внесла дополнения в листовку к Варфарину о том, что определение полиморфизмов CYP2C9 и VKORC1 может снизить риск кровотечений у носителей данных мутантных аллелей.
Нашему больному ретроспективно было проведено генетическое тестирование на чувствительность к Варфарину. Полиморфизмов в гене CYP2C9 выявлено не было. При исследовании гена VKORC1 был выявлен гетерозиготный полиморфизм - генотип AG.
Однако связать развитие повторных кровотечений у нашего пациента с полиморфизмом в гене VKORC1 вряд ли возможно, так как наличие полиморфизмов в основных ферментах биотрансформации АВК обуславливает нестабильность антикоагуляции и кровотечения в начале терапии, чаще всего при подборе дозы препарата. Носительство «медленных» аллельных вариантов CYP2C9*2 и CYP2C9*3 приводит к снижению скорости биотрансформации Варфарина и повышению его концентрации в плазме крови и ассоциируется с низкой поддерживающей дозой Варфарина, чрезмерной гипокоагуляцией и высоким риском кровотечений. Наибольшим риском в отношении развития геморрагических осложнений и чрезмерной антикоагуляции обладают носители гомозиготных полиморфизмов 30.
У нашего пациента был выявлен гетерозиготный полиморфизм в гене VKORC1 при «диком генотипе» CYP2C9, что не является документированным фактором риска кровотечений. Действительно, предшествующая 9-летняя терапия Варфарином не сопровождалась значимыми кровотечениями. И на продолжении последних двух лет после отмены клопидогреля также кровотечений отмечено не было.
В заключение необходимо отметить, что проведение чрескожных коронарных вмешательств в настоящее время становится рутинной практикой у больных ИБС. Назначение Варфарина больным мерцательной аритмией способствует не только снижению риска тромбоэмболических осложнений, но и увеличению продолжительности жизни больного. С возрастом увеличивается риск развития ИБС и необходимость проведения реваскуляризации.
Трехкомпонентная терапия позволяет избежать как тромбоэмболических осложнений, обусловленных мерцательной аритмией, так и осложнений, связанных с проведением процедуры эндоваскулярного вмешательства. Однако выбор типа имплантируемого стента должен определяться с учетом потенциального риска кровотечений. Развитие геморрагического осложнения требует отмены антитромботической терапии, что многократно повышает риск сердечно-сосудистых осложнений, в том числе и фатальных. Накопление опыта наблюдения за пациентами, принимающими трехкомпонентную терапию, и проведение дальнейших исследований в этой области позволит усовершенствовать алгоритмы лечения и сделать терапию более безопасной.
Антитромботическая терапия после ЧКВ у пациентов с ФП/ВТЭО: обзор рекомендаций ACC 2020
Одним из наиболее распространенных показаний для назначения постоянной антикоагулянтной терапии является фибрилляция предсердий (ФП). В то же время известно, что до 25-35% пациентов, страдающих ФП, одновременно имеют ишемическую болезнь сердца. Очевидно, что высокая частота встречаемости сочетания двух заболеваний во многом обусловлена общностью факторов риска их развития. Обсуждая антитромботическую терапию, следует отметить, что наиболее оптимальным вариантом при сочетании стабильной ишемической болезни сердца и ФП является назначение антикоагулянта.
Однако наибольшие вопросы антитромботической терапии при сочетании этих двух заболеваний возникают в случае необходимости более интенсивной антитромбоцитарной терапии после выполненного чрескожного вмешательства на коронарных артериях (ЧКВ). За последнее десятилетие было завершено несколько рандомизированных исследований (WOEST 1 , PIONEER AF-PCI 2 , RE-DUAL PCI 3 , AUGUSTUS 4 и ENTRUST-AF PCI 5 ), целью которых являлось определение наиболее оптимальной стратегии антитромботической терапии у пациентов, имеющих показания к приему антикоагулянтной терапии по поводу ФП и перенесших ЧКВ.
По большей части именно на основании перечисленных выше исследований эксперты Американской коллегии кардиологов (American College of Cardiology) выпустили рекомендательный документ 6 , посвященный обсуждению тактики антитромботической терапии у пациентов с ФП, которым было выполнено ЧКВ. Следует также отметить, что в качестве ситуации, требующей длительной/постоянной антикоагулянтной терапии, в тексте обсуждается не только ФП, но и венозные тромбоэмболии.
Далее мы остановимся на ключевых положениях нового документа.
1. Так, во-первых, авторы отметили, что у подавляющего большинства пациентов не должна использоваться тройная терапия, включающая антикоагулянт (практически во всех ситуациях, за исключением отдельных случаев, например, антифосфолипидного синдрома, предпочтительным является использование прямых пероральных антикоагулянтов, а не варфарина), аспирин и ингибитор рецепторов P2Y12. Стратегией по умолчанию (после выписки из стационара) является двойная терапия - антикоагулянт и ингибитор рецепторов P2Y12.
2. В случае использования тройной терапии ее назначение рекомендовано на максимально короткий период времени и только у пациентов с высоким риском атеротромботических событий. Так, например, если пациент имеет высокий риск тромбоза стента и низкий риск кровотечений, аспирин может быть добавлен к антикоагулянту и ингибитору рецепторов P2Y12 на период до 30 дней.
3. Предпочтительным антитромбоцитарным препаратом при сочетании с антикоагулянтом является ингибитор P2Y12 рецепторов. Продолжительность терапии им после ЧКВ не должна превышать 6 месяцев в случае вмешательства при стабильной ишемической болезни сердца и 12 месяцев - при остром коронарном синдроме.
4. Из ингибиторов P2Y12 рецепторов в случае сочетания с антикоагулянтом рекомендуется отдавать предпочтение клопидогрелю. В качестве антикоагулянтов следует использовать прямые пероральные антикоагулянты, а не аспирин. Отдельно подчеркивается, что несмотря на существование генетической вариабельности ответа на терапию клопидогрелем генетическое тестирование не должно использоваться рутинно и влиять на стратегию антитромбоцитарной терапии, что обусловлено отсутствием рандомизированных исследований, продемонстрировавших преимущества такого подхода.
5. В случае, если вместе с антикоагулянтом назначается аспирин, доза последнего не должна превышать 100 мг.
6. При венозных тромбоэмболических событиях, если антикоагулянт рекомендован на ограниченный период времени, длительность и интенсивность антитромбоцитарной терапии должна соответствовать действующим рекомендациям.
7. Для пациентов, перенесших венозные тромбоэмболические события и нуждающихся в постоянной антикоагулянтной терапии, длительность приема антитромбоцитарных препаратов должна ограничиваться 1 годом после ЧКВ.
8. У пациентов, имеющих высокий риск кровотечений, отмена антитромбоцитарного препарата возможна через 3 месяца при стабильной ишемической болезни сердца и через 6 месяцев после острого коронарного синдрома.
9. Для пациентов, у которых использование прямых пероральных антикоагулянтов невозможно, при приеме варфарина в сочетании с антитромбоцитарными препаратами предпочтительными являются значения международного нормализрвоанного отношения (МНО) в диапазоне 2-2.5. Таким пациетам рекомендован более частый контроль МНО.
10. Всем пациентам, принимающим 2 и более антитромботических препарата рекомендован прием ингибитора протонной помпы (или блокатора H2-гистаминовых рецепторов). При переходе на терапию только антикоагулянтом (через 1 год после ЧКВ при ФП) и при отсутствии других показаний следует отменить ингибитор протонной помпы (или блокатор Н2-гистаминовых рецепторов). Отдельно подчеркивается, что несмотря на обсуждение взаимодействия омепразола с клопидогрелем, следствием которого может быть снижение антиагрегантной эффективности последнего, единственное рандомизированное исследование, посвященное этому вопросу, не продемонстрировало увеличение риска ишемических событий у пациентов, одновременно принимающих клопидогрель и омепразол.
11. Одним из факторов, влияющим на принятие решения о продолжительности двойной антитромбоцитарной терапии, является характеристика выполненного вмешательства. Так, наибольший риск тромботических событий имеют пациенты с бифуркационным поражением.
12. При выборе конкретного варианта терапии могут иметь значение ее цена и предпочтения пациента.
1. Dewilde WJ, et al. Lancet. 2013;381(9872):1107-15.
2. Gibson CM, et al. Am Heart J. 2015;169(4):472-8.e5.
3. Cannon CP, et al. N Engl J Med. 2017;377(16):1513-1524.
4. Lopes RD, et al. N Engl J Med. 2019;380(16):1509-1524.
5. Vranckx P, et al. Lancet. 2019;394(10206):1335-1343.
6. Writing Committee, Kumbhani DJ, et al. J Am Coll Cardiol. 2020. doi: 10.1016/j.jacc.2020.09.011.
Отличия европейских и американских рекомендаций по лечению фибрилляции предсердий
Последние европейские рекомендации по ведению пациентов с фибрилляцией предсердий были опубликованы в 2020 г. [1]. А годом ранее американские эксперты обновили свое руководство [2]. Далее кратко будут приведены основные различия европейского и американского документов [3].
Антикоагулянтная терапия
В обоих документах при принятии решения о необходимости приема антикоагулянтной терапии рекомендовано ориентироваться на риск тромбоэмболических осложнений по шкале CHA2DS2VASc. Определенными и схожими являются рекомендации относительно необходимости (IA) антикоагулянтной терапии при сумме баллов ≥2 у мужчин и ≥3 у женщин, а также при низком риске тромбоэмболических осложнений (0 баллов у мужчин и 1 балл у жензщин): в первом случае антикоагулянтная терапия показана, а во втором - нет. В то же время при умеренном риске тромбоэмболических осложнений (1 балл у мужчин и 2 балла у женщин) эксперты-составители европейских рекомендаций все же рекомендуют рассмотреть назначение антикоагулянтной терапии (IIaB), тогда как американские специалисты считают, что основания для ее использования в этом случае не так очевидны (IIbC).
Антикоагулянтная терапия при кардиоверсии
Европейские эксперты рекомендуют инициацию антикоагулянтной терапии как можно раньше перед кардиоверсией у всех пациентов с фибрилляцией предсердий (IIaB), тогда как, согласно американскому документу, у пациентов с продолжительностью аритмии 2DS2VASc 0 у мужчин и 1 у женщин следует рассмотреть возможность неназначения антикоагулянтной терапии (IIbB).
Несколько отличаются и рекомендации по антикоагулянтной терапии после кардиоверсии у пациентов с низким риском тромбоэмболических осложнений. Так, если европейские эксперты считают, что антикоагулянтная терапия может не назначаться при низком риске и продолжительности аритмии ≤24 часов (IIbC), то американские эксперты в качестве критерия продолжительности аритмии, позволяющего не назначать антикоагулянтную терапию, рассматривают 48 часов (IIbB).
Катетерная аблация фибрилляции предсердий
В соответствии со стратегией, предлагаемой европейскими рекомендациями, катетерную аблацию следует рекомендовать пациентам, у которых антиаритмическая терапия оказалась неэффективной, тогда как американские эксперты считают ее выполнение возможной опцией у отдельных пациентов.
Если европейские эксперты считают, что в случае сочетания фибрилляции предсердий и хронической сердечной недостаточности со сниженной фракцией выброса аблация является предпочтительным методом лечения, то американские эксперты не столь категоричны и рекомендуют ее выполнение лишь как возможную опцию у симптомных пациентов (IIbB).
Фибрилляция предсердий и чрескожное вмешательство на коронарных артериях
В соответствии с американскими рекомендациями, продолдительность тройной терапии после чрескожного коронарного вмешательства у пациентов с фибрилляцией предсердий должна составлять 4-6 недель, тогда как европейские эксперты чаще всего ограничивают ее продолжительность лишь 1 неделей.
Таким образом, все представленные несоответствия являются лишь следствием недостаточной изученности отдельных моментов ведения пациентов с фибрилляцией предсердий. Для создания более четких и согласованных рекомендаций необходимо выполнение специально спланированных проспективных исследований, посвященных этим вопросам.
1. Hindricks G, et al. Eur Heart J. 2020. doi: 10.1093/eurheartj/ehaa612.
2. January CT, et al. Circulation. 2019;140(2):e125-e151.
3. Oraii A, et al. Eur Heart J. 2020. doi: 10.1093/eurheartj/ehaa1098/6062049.
Вторая редакция рекомендаций Европейского Общества Аритмологов по применению новых антикоагулянтов у пациентов с неклапанной фибрилляцией предсердий 2015г (фрагменты).
Понятие «клапанная фибрилляция предсердий (ФП)» включает в себя ФП у пациентов с механическими протезами клапанов сердца, либо со стенозом митрального клапана тяжелой или умеренной степени тяжести (чаще ревматического генеза). Пациенты с прочей клапанной патологией могут быть кандидатами для назначения НОАК (см. табл. 1).
Таблица 1. Показания и противопоказания к приему НОАК со стороны клапанной патологии.
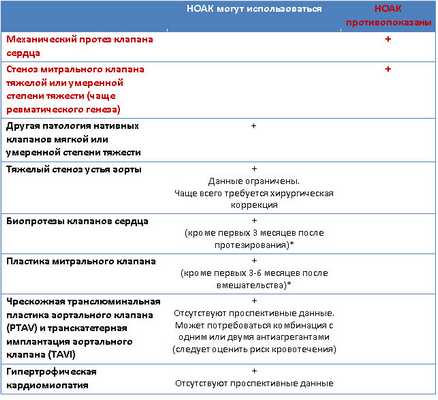
*- Американские рекомендации не допускают назначения НОАК после любого протезирования или пластики клапанов сердца.
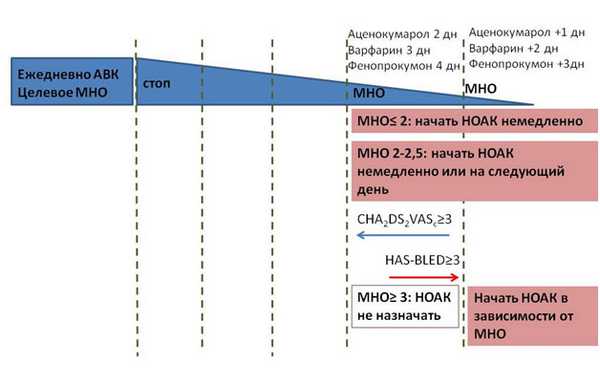
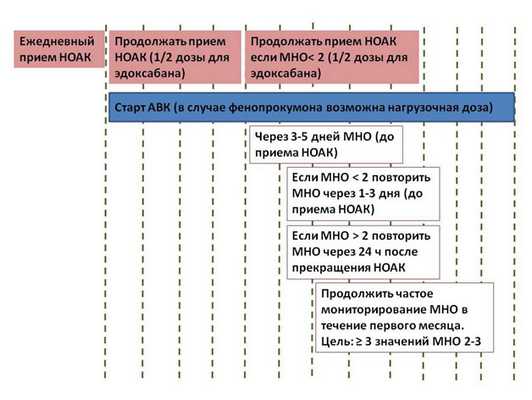
Переход с АВК на НОАК и наоборот
В общем виде рекомендация выглядит так: НОАК могут быть назначены в этот же или на следующий день при значении МНО 2,0-2,5. Ривароксабан может быть назначен при МНО ≤3,0; эдоксабан - при МНО≤2,5; апиксабан и дабигатран - при МНО ≤2,0. При обратном переходе - с НОАК на АВК стоит иметь в виду, что НОАК влияют на МНО. Для более адекватного определения степени антикоагуляции при одновременном приеме НОАК и АВК МНО необходимо определять непосредственно перед приемом очередной дозы НОАК и через 24 часа после приема последней дозы НОАК.
Рисунок 1. Переход с АВК на НОАК и наоборот.
Ведение пациентов, получающих НОАК, во время инвазивных вмешательств
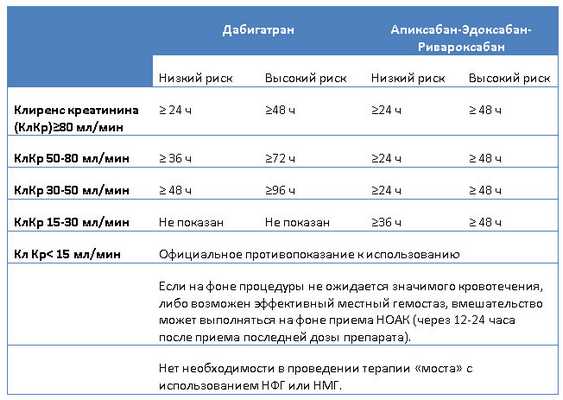
В случае использования НОАК не следует назначать терапию «моста» в виде нефракционированного гепарина (НФГ) или низкомолекулярных гепаринов (НМГ), поскольку это увеличивает риск кровотечений без преимуществ в отношении профилактики тромботических событий. Время последнего приема НОАК перед операцией зависит от её типа: как правило, в случае низкого риска кровотечения (происходит редко и не имеет значимых клинических последствий) препарат отменяют за ≥24 часа; в случае вмешательства с высоким риском кровотечения (происходит часто или грозит серьезными клиническими последствиями) НОАК следует отменять за ≥48 часов. Вторым принципиальным фактором является почечная функция: снижение клиренса креатинина является основанием для более ранней отмены антикоагулянта (подробно см. таблицу 2).
Таблица 2. Время последнего приема НОАК перед плановым инвазивным вмешательством.
Большинство электрофизиологических процедур на фоне НОАК проводятся так же, как и прочие хирургические вмешательства. Исключением является изоляция устьев легочных вен - процедура, характеризующаяся высоким риском и геморрагических, и тромботических осложнений. В случае приема пациентами АВК рекомендуется проводить аблацию на фоне продолжающегося приема препаратов. А вот с НОАК четкого понимания пока нет, поэтому рекомендуется придерживаться протокола, принятого в данном лечебном учреждении. В качестве допустимых вариантов предлагается заблаговременно перевести пациента на АВК и проводить процедуру на их фоне, либо проводить ее на фоне НОАК без их отмены, либо четко спланировать схему перерыва в приеме НОАК. При выборе тактики должны учитываться такие параметры, как почечная функция, значение индекса CHA2-DS2-VASc, опыт оператора, тип и объем аблации помимо вмешательства на устьях легочных вен, а также доступность периоперационной визуализации для контроля проведения транссептальной пункции. Если пациент принял НОАК за 36 часов до аблации и более, либо приверженность к лечению в недели, предшествовавшие аблации, вызывают сомнения, перед аблацией необходимо выполнить ЧП-ЭХОКГ.
В случае экстренного хирургического вмешательства следует проводить специфические и неспецифические мероприятия для прекращения действия НОАК.
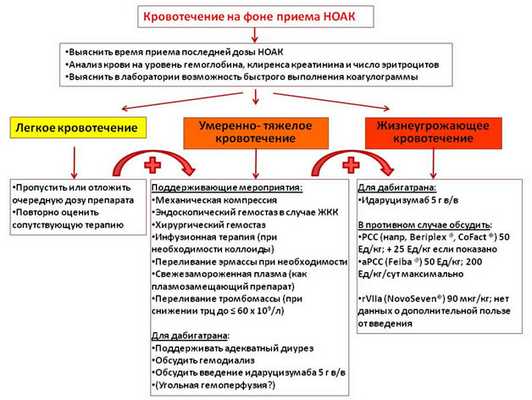
Ведение пациентов с кровотечением на фоне приема НОАК
В ближайшее время FDA и EMA одобрят специфический антидот к дабигатрану - идаруцизумаб (прим. переводчика: препарат в настоящее время уже одобрен FDA). Кроме того, на этапе клинических исследований находятся антидоты к ингибиторам Xa фактора - андексанет альфа и арипазин. В случае отсутствия возможности введения специфического антидота могут быть применены неспецифические методы прекращения действия НОАК - например, введение концентрата комплекса протромбина (PСC) или активированного концентрата комплекса протромбина (PСCa). Накопленный к настоящему времени опыт свидетельствует о том, что следует использовать большие дозы PCC и PCCa, чем было указано в предыдущей редакции данных рекомендаций (50 Ед/кг, а не 25 Ед/кг).
Рисунок 2. Ведение пациента с кровотечением на фоне приема НОАК (по van Ryn et al.).
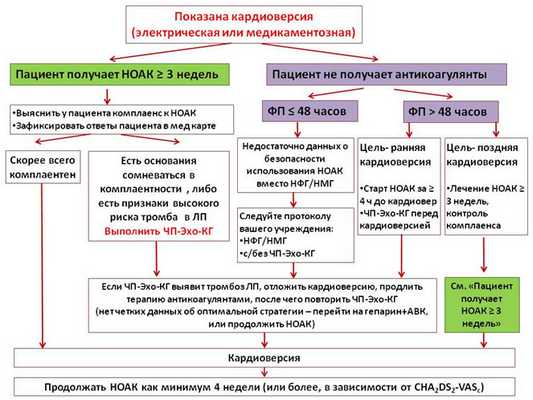
Кардиоверсия
Пациенты, получающие НОАК в течение 3 и более недель до кардиоверсии
В отличие от варфарина, оценить уровень антикоагуляции (и, соответственно, приверженность к терапии) перед кардиоверсией у принимающих НОАК трудно. Поэтому пациента подробно расспрашивают о том, насколько он регулярно принимал НОАК, и его ответы фиксируют в медицинской документации. Если возникают сомнения в том, что пациент был комплаентен, перед кардиоверсией выполняют чреспищеводную эхокардиографию (ЧП-ЭхоКГ).
Пациенты с недавним приступом ФП (не получают НОАК длительно)
Если эпизод ФП длится более 48 часов, а ждать 3 недели для длительной терапии НОАК нецелесообразно, следует за 4 часа и более до кардиоверсии начать прием НОАК, выполнить ЧП-Эхо-КГ, после чего восстановить синусовый ритм. В случае эпизода ФП менее 48 часов нет четкой ясности, достаточно ли принять 1 дозу НОАК перед кардиоверсией. Поэтому на настоящий момент рекомендовано следовать протоколу, принятому в лечебном учреждении с/без предварительным введением НФГ/НМГ и с/без предварительным выполнением ЧП-Эхо-КГ.
Рисунок 3. Ведение пациентов, получающих НОАК, во время кардиоверсии, в зависимости от длительности аритмии и предшествующей антикоагуляции
Пациенты с ФП и ИБС, в том числе с показаниями к совместному приему антиагрегантов
Клинических ситуаций и доступных препаратов на сегодняшний день достаточно много. Существующие рекомендации изложены в виде двух основных «сценариев» - ведение пациента в острую фазу ОКС и длительное лечение больных после ОКС и/или реваскуляризации (рис. 4).
«Острый» сценарий касается пациентов, перенесших ОКС на фоне приема НОАК. В случае АВК рекомендуется проводить реваскуляризацию без отмены антикоагулянтов. В случае НОАК прием препаратов лучше прервать. Это позволяет безопасно начать лечение антиагрегантами и проводить общепринятую антикоагулянтную поддержку чрескожного коронарного вмешательства (ЧКВ). После стабилизации состояния (отсутствия рецидива ишемии и/или потребности в повторной реваскуляризации) НОАК могут быть возобновлены после отмены парентеральных антикоагулянтов. Лучше возобновлять тот же препарат, который пациент принимал до манифестации ОКС. Нет достаточных данных о преимуществах того или иного НОАК или перехода на АВК. У получающих дабигатран в комбинации с антиагрегантами на время совместного приема доза дабигатрана должна быть снижена до 110 мг 2 раза в день. У пациентов с нормальной почечной функцией, получающих прочие НОАК, подобное снижение дозы не рекомендовано.
В рамках обсуждения сценария длительной терапии после ОКС и/или реваскуляризации указано, что при выписке пациента целесообразно заранее прописать всю схему перехода от многокомпонентной антитромботической терапии к постоянному лечению пациента. В стандартном случае после ОКС с ЧКВ или планового ЧКВ тройная антитромботическая терапия показана в течение 1 месяца в случае имплантации голометаллического стента (ГМС) и 6 месяцев в случае имплантации стента с лекарственным покрытием (СЛП) последнего поколения с дальнейшим переходом на двойную терапию (НОАК + антиагрегант, аспирин или клопидогрел на выбор). На рисунке 5 указаны факторы, которые могут увеличить или уменьшить продолжительность периодов тройной и двойной терапии. В подгруппе пациентов с ФП и низким риском инсульта (CHA2DS2-VASc 1 у мужчин и 2 у женщин, т.е из факторов риска - только сопутствующая ИБС) возможно сразу назначить двойную антиагрегантную терапию (без антикоагулянтов). Практически у всех пациентов с ИБС через год после ОКС или ЧКВ возможно назначение монотерапии антикоагулянтами (исключение составляют пациенты с очень высоким риском коронарных событий и низким риском кровотечений).
Рисунок 4. Ведение пациентов, принимающих НОАК, во время ЧКВ или эпизода ОКС.
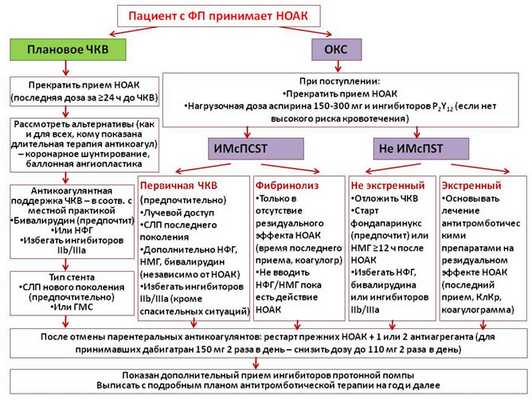
Рисунок 5. Базовый сценарий длительной антитромботической терапии у получающих НОАК после ЧКВ или ОКС, а также условия изменения длительности комбинированной терапии.
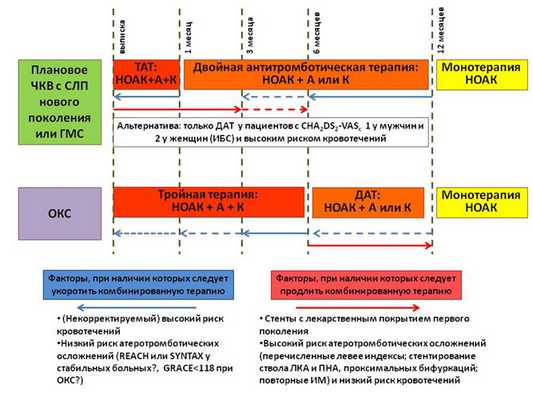
(ТАТ - тройная антитромботическая терапия; ДАТ - двойная антитромботическая терапия; А - аспирин 75 - 100 мг 1 раз в день; К - клопидогрел 75 мг 1 раз в день; ЛКА - левая коронарная артерия; ПНА - передняя нисходящая артерия)
Неврологическая патология
При внутричерепном кровоизлиянии при отсутствии доступных специфических антидотов к НОАК следует использовать неспецифические прокоагулянтные препараты, такие как концентрат комплекса протромбина (PCC) или активированный концентрат комплекса протромбина (aPCC). Влияние этих препаратов на прогноз не известно. Гораздо сложнее в случае развития ишемического инсульта на фоне приема НОАК. Эксперты указывают на то, что в отсутствие точного экспресс-метода, позволяющего оценить уровень антикоагуляции, проведение тромболизиса у таких пациентов невозможно (исключение, по-видимому, составляют пациенты, принявшие НОАК 24-48 часов назад). В общем случае рекомендованной тактикой лечения является механическая реканализация сосуда с использованием стента-ретривера (прим. переводчика: устройство, сочетающее стент и приспособление для удаления тромбов/эмболов).
На рисунке 6 представлены рекомендации о возможности и сроках возобновления терапии НОАК после внутричерепных кровоизлияний и ишемических инсультов.
Рисунок 7. Алгоритм инициации или возобновления антикоагуляции после ТИА, ишемического инсульта или внутричерепного кровоизлияния.
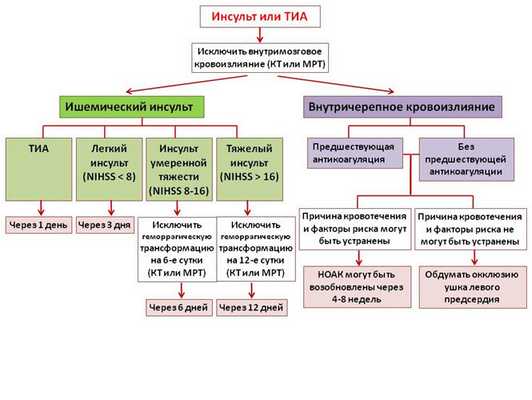
NIHSS - шкала тяжести инсульта Национального Института Здравоохранения США
Пациентам с ФП и бессимптомным каротидным атеросклеротическим поражением легкой и умеренной степени тяжести показана монотерапия НОАК (по аналогии со стабильной ИБС). У пациентов с атеросклеротическим поражением тяжелой степени должна быть выполнена каротидная эндартерэктомия, а не стентирование, что позволит избежать длительной тройной антитромботической терапии с высоким риском кровотечения. В случае проведения операции к лечению должен быть добавлен аспирин (непосредственно перед и в течение 10 дней после операции).
Настоящий раздел предназначен исключительно для лиц, имеющих среднее и высшее медицинское образование, а также студентов медицинских ВУЗов.
Никакие из опубликованных материалов не могут служить заменой медицинскому осмотру и не должны быть использованы как руководство к лечению. Только врач, который имеет личный контакт с пациентом, знаком с его историей болезни и наблюдает за состоянием его здоровья, может рекомендовать тот или иной метод лечения. Информация на данном сайте или другие предоставляемые им услуги не могут служить основанием для диагностики или лечения без соответствующего участия врача.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом, фельдшером или студентом медицинского ВУЗа.
Экономика чрескожных коронарных вмешательств. Экономика антикоагулянтной и антитромботической терапии
Материалы для сайта подготовлены сотрудниками лаборатории клинических проблем атеротромбоза Института Кардиологии им. А.Л.Мясникова
Антитромботическая терапия у пациентов с фибрилляцией предсердий, ОКС и/или чрескожными коронарными или клапанными вмешательствами: краткое резюме рекомендаций European Society of Cardiology Working Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Association of Acute Cardiac Care (ACCA), Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS)) 2014г.
Данные рекомендации основывались, в основном, на данных регистров (включавших множество небольших когортных исследований, часто - ретроспективных) и результатах небольшого рандомизированного исследования WOEST, продемонстрировавшего преимущества двойной терапии (варфарин+клопидогрел) над тройной (варфарин+клопидогрел+аспирин) у пациентов с ФП, которым было выполнено ЧКВ.
Основная мысль этих рекомендаций - максимальное сокращение длительности тройной антитромботической терапии, переход на двойную терапию (пероральный антикоагулянт + антитромбоцитарный препарат, предпочтительно клопидогрел). Длительность тройной терапии зависит от ряда факторов, в первую очередь - от риска кровотечения (оцененный по шкале HAS-BLED), ТЭО и наличия обострения ИБС.
У всех пациентов должен быть оценен риск тромботических осложнений (по шкале CHA2DS2-VASc) и риск кровотечений (по шкале HAS-BLED). Переоценка риска должна проводиться регулярно (раз в год). Риск ОКС следует оценивать по шкале GRACE.
В качестве антикоагулянта наравне с варфарином (при условии хорошего контроля МНО, TTR >70%) рекомендованы «новые» оральные антикоагулянты (НОАК).
Если выбор пал на НОАК, в комбинации с антиагрегантами их следует использовать в наименьших дозах, тестированных для лечения пациентов с ФП, если на варфарин - МНО следует поддерживать в диапазоне 2-2,5.
НОАК не следует применять у пациентов с механическими протезами клапанов сердца или при наличии умеренного/тяжелого стеноза митрального клапана.
В качестве компонента комбинированной антитромботической терапии не следует использовать тикагрелор или празугрел, поскольку эти препараты никогда не исследовались в комбинации с пероральными антикоагулянтами (возможно, исключение стоит делать для пациентов с доказанным тромбозом стента).
При выполнении эндоваскулярного вмешательства для снижения риска кровотечений целесообразно использовать радиальный доступ.
В таблице 1 суммированы основные положения рекомендаций.
Таблица 1. Антитромботическая терапия после ЧКВ у пациентов с ФП, нуждающихся в постоянном приеме пероральных антикоагулянтов.

АК - пероральный антикоагулянт, в том числе - апиксабан 2,5 мг 2 раза в сутки.
* - у пациентов очень высокого риска возможна комбинация АК с одним антиагрегантом.
Если НОАК применялись до планового ЧКВ, целесообразна их отмена на 48 часов и использование стандартного протокола антикоагулянтной поддержки ЧКВ с применением парентеральных антикоагулянтов. У пациентов с ОКС без подъема сегмента ST в случае ранней инвазивной стратегии (ЧКВ в первые 24 часа) или у пациентов с ОКС с подъемом сегмента ST также может быть целесообразно прервать прием НОАК перед эндоваскулярным вмешательством, в случае необходимости дополнительно вводить НФГ или бивалирудин во время процедуры. У пациентов с ОКС низкого риска, которым ЧКВ в первые сутки не выполняется, может быть целесообразно прерывание лечения НОАК на 36-48 часов с переходом на эноксапарин.
Авторы рекомендаций обсуждают, когда следует использовать АВК, а когда - отдать предпочтение НОАК. АВК целесообразно использовать в том случае, если TTR (время пребывания МНО в целевом диапазоне) составляет более 70%. Для «наивных» пациентов можно предположить, будет ли TTR достаточно высоким на основании подсчета числа баллов по недавно валидизированной шкале SAME-TT2R2 (таблица 2).
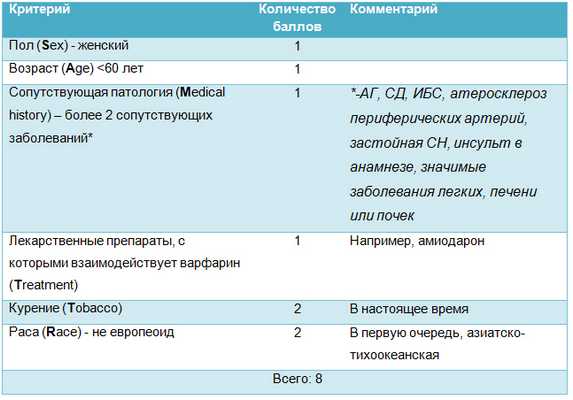
В случае если число баллов по этой шкале не превышает 2, можно ожидать устойчивого МНО и хорошего клинического эффекта от приема варфарина. Если число баллов >2, предпочтительно назначать один из препаратов группы НОАК.
Что касается антитромботической поддержки TAVI (транскатетерные вмешательства на аортальном клапане), авторы ограничились обзором режимов терапии из проведенных исследований и рекомендаций ряда кардиологических сообществ. В настоящее время во время процедуры используют НФГ в дозе 50-70 Ед/кг для достижения активированного времени свертывания (АВС) 250-300 сек. После процедуры терапия зависит от наличия ИБС и ФП (таблица 3).
Таблица 3. Антитромботическая терапия после TAVI.

По материалам:
Task Force M, Lip GY, Windecker S, Huber K, et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary or valve interventions: a joint consensus document of the European Society of Cardiology Working Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS) and Asia-Pacific Heart Rhythm Society (APHRS). Eur Heart J2014;35:3155-3179.
Читайте также:
- Синдром Бехчета (Behcet)
- Удаление конкрементов общего желчного протока лапароскопическим методом
- Аллергический гранулематоз Черджа-Стросс, симулирующий опухоль конъюнктивы: признаки, гистология, лечение, прогноз
- Влияние старения на иммунную систему
- Рекомендации по минимальному сегментарному пломбированию без дренирования. Обсуждение
