Влияние старения на иммунную систему
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Постоянные адаптивные изменения иммунной реактивности являются основой выживания организма в постоянно меняющемся внешнем мире. В разные периоды жизни (детство, старость, при беременности) и других случаях происходят существенные вариации выраженности иммунных механизмов (активация одних, подавление других звеньев), что является физиологическими реакциями приспособления, а не свидетельством формирования каких-либо патологических процессов.
Современное изменение демографической структуры популяции привело к тому, что доля пожилых людей в обществе в последние несколько десятков лет увеличилась в 2 раза и имеет тенденцию к дальнейшему возрастанию. Уже сегодня более половины госпитализированных составляют старики. И это не удивительно, поскольку в возрасте старше 65 лет заболевания встречаются у 60% обследованных. После 80 лет - у 80%, причем число диагнозов на одного больного достигает 10-11.
Какие же патологические процессы чаще всего бывают у пожилых?
- Атеросклероз сосудов с заболеваниями , которые зависят конкретно от локализации, - мозг, сердце и т.д.
- Опухоли, частота возникновения которых зависит от продолжительности и степени контакта с канцерогенами, от активности тканей, на которые они действуют, и от состояния иммунологического надзора. Частота злокачественных новообразований возрастает с 45 до 80 лет с тенденцией к удвоению каждые 9-10 лет. Как правило, это рак крови (лимфолейкозы), желудка, легких, предстательной железы и других органов.
- Инфекции - вирусные, бактериальные, с развитием системных поражений и локальных очагов - цистит. Коньюктивит, отит и т.д. Люди старческого возраста тяжело переносят инфенкционные заболевания, которые протекают у них атипично, затягиваются на длительное время, плохо поддаются лечению.
- Аутоиммунные заболевания, которые встречаются не менее чем у 50% пожилых людей. Чаще всего это аутоиммунные поражения щитовидной железы (почти у 25% женщин старше 50 лет), активный гепатит и т.д.
- Дегенерация и гибель клеток, - крайняя степень возрастного повреждения, особенно нервной ткани (старческое слабоумие, болезнь Паркинсона)
Необходимо подчеркнуть, что дегенеративные изменения претерпевает центральный орган иммунитета - тимус. Вилочковая железа к 10-15 годам достигает массы 30-40 г, затем постепенно уменьшается, достигая 10-13 г в 70-90-летнем возрасте. Жировая ткань постепенно замещает функционирующие компоненты тимуса, и к глубокой старости лишь незначительные участки выполняют защитную функцию.
Звенья иммунной системы нарушаются в разной степени, что приводит к тому, что общее течение заболевания у пожилых людей характеризуется тем, что в патологический процесс, как правило, вовлекается не одна, а ряд систем организма. Это неизбежно приводит к приему множества лекарственных средств. Учитывая извращенные детоксицирующие возможности старческого организма, это может обусловить непредсказуемые последствия.
Повышается чувствительность к инфекции, со склонностью к более тяжелому и затяжному течению болезни, с частым переходом в хронические формы, наблюдается более частое внутрибольничное заражение пожилых пациентов, в т.ч. условно-патогенной микрофлорой. Среди аллергических болезней уменьшается удельный вес атопий, но увеличивается частота инфекционных и химических форм аллергии ( в т.ч. лекарственной), часто со склонностью к генерализованным реакциям типа анафилактического шока.
Особенно страдает первичный иммунный ответ. На вакцинацию вырабатываются низкоавидные антитела класса IgM, и лишь вторичная иммунная реакция в старости оказывается более сохраненной. Поэтому для формирования полноценного напряженного иммунитета необходимо осуществлять несколько повторных иммунизаций. Если организм был вакцинирован антигеном в молодости, то при вакцинации в старческом возрасте нарушение антителообразования может быть небольшим. Парадоксальность ситуации заключается в том, что снижение выраженности иммунного ответа наблюдается на фоне увеличения общего количества иммуноглобулинов.
Профилактика нарушений иммунитета в старости заключается в проведении общеукрепляющих мероприятий, а также в коррекции питания, углеводного и жирового обмена. Эффективность мер специфической профилактики, например иммунизации, нуждается в постоянном контроле. Что касается назначения иммуномодуляторов, то показания к их применению определяют в каждом конкретном случае с учетом иммунного статуса.
Хронические инфекции и старение: как вирусы сокращают жизнь

Кто не мечтает жить долго, счастливо и активно? Человечество все еще надеется разобраться в механизмах старения и главное — в триггерах, запускающих этот процесс. Сегодня одним из таких триггеров предлагается считать некоторые инфекции.
Почему мы стареем и как на этот процесс влияют инфекционные заболевания, разбирался MedAboutMe.
Как стареет организм на клеточном и молекулярном уровне?

Мы представляем себе старение в образе пожилого человека, с морщинами на лице, оплывающей фигурой, медленно передвигающегося и вечно болеющего. Но это этап заката, период, когда старение организма зашло так далеко, что повлияло на внешний вид и образ жизни человека. На самом деле стареть мы начинаем, едва перешагнув через порог юности в 20-25 лет.
Ученые определяют именно этот возраст, как начало старения человека, потому что к этому моменту завершается развитие вилочковой железы (тимуса). После этого она начинает постепенно деградировать. Но в этом органе происходит «обучение» Т-лимфоцитов на распознавание «своих» и «чужих» клеток. В костном мозге они образуются, а тимусе - созревают, после чего отправляются в организм защищать его от инфекций.
По мере старения тимус работает все хуже, Т-лимфоцитов становится все меньше. Ученые утверждают, что к 40 годам мы еще способны противостоять уже известным нам заболеваниям, но очень плохо справляемся с новыми болезнями. Поэтому пожилые люди чаще болеют.

Пренебрежимое старение
Так называется процесс старения, когда изменения уже практически неразличимы, а вероятность смерти остается практически постоянной. О пренебрежимом старении говорят, например, в отношении людей старше 100 лет: на этом этапе изменения их организма с каждым лишним прожитым годом уже не заметны, а риск смерти остается одним и тем же — высоким. В то же время пренебрежимое старение наблюдается у видов с максимальной продолжительностью жизни, когда визуально признаки старения наблюдать почти невозможно. К таким видам относятся несколько видов черепах, алеутский морской окунь, морской еж, обитающий в Красном море, двустворчатый моллюск Arctica islandica и др.
Но дело, конечно, не только в тимусе. Стареют все наши клетки, точнее не сами клетки - они сменяются поколение за поколением с разной скоростью в зависимости от вида ткани или органа. Стареет информационно-наследственная система, которая хранится в их ядрах. С каждым прожитым годом возникают и накапливаются ошибки. Подавляющую часть из них наш организм выявляет и ликвидирует. Но со временем доля мутаций (ошибок) растет и скорость обновления клеток замедляется.
Тут следует вспомнить теорию о существовании теломер - концевых участков ДНК, которые не копируются при каждом клеточном делении целиком, а немного укорачиваются. Примерно через 50 делений теломеры становятся такими короткими, что делиться уже некуда, клетке грозит апоптоз - запрограммированная клеточная смерть.
Это тоже не единственный механизм клеточного старения. Так, известно о возрастном снижении транскрипционной и трансляционной активности в клетках млекопитающих. То есть, падает активность генов из-за снижения подвижности ДНК-белковых связей в хроматине и уменьшается активность синтеза РНК, необходимой для производства белков. Падают и показатели активности ферментов.
В целом меняется энергетика организма. Ученые говорят об энергетическом жизненном потенциале - это количество расходуемой за жизнь энергии. Человек - очень активное существо. Среднестатистическое млекопитающее тратит 924 кДж/г, а представители нашего вида (ну еще лемуров и капуцинов) - 3280 кДж/г. С возрастом этот показатель снижается. Уменьшается количество митохондрий («энергетических станций») в клетках, ухудшается потребление клетками кислорода, даже дыхание клеток смещается в сторону гликолиза - бескислородного образования АТФ («батареек» для клеток).
Замедление происходит во всех клетках и системах организма. Скорость транспорта в нейронах падает к пожилому возрасту почти в 1,5 раза. Уменьшается и количество нейромедиаторов - веществ, передающих нервный импульс.
Старение и хроническое воспаление
Итальянский ученый Клаудио Франчески разработал теорию воспалительного старения. Он считает, что старение - это воспаление, охватывающее весь организм. И именно воспалительные процессы лежат в основе всех возрастных заболеваний, начиная от болезни Альцгеймера и заканчивая атеросклерозом и диабетом 2 типа. Общему, то есть системному хроническому воспалению способствует целый ряд факторов - экологических, социальных, индивидуальных в виде образа жизни и культурных особенностей каждого конкретного человека, и т. п.
Закон смертности Гомпертца-Мейкхама
Вероятность смерти от любой причины увеличивается по экспоненте, начиная с возраста 40 лет и удваиваясь каждые 8 лет. Этот закон работает в промежутке от 30 до 80 лет. У людей более старшего возраста риск смертности растет намного медленнее.
Риск заболевания возраст-зависимыми патологиями, по расчетам ученых, примерно соответствует графику Гомпертца-Мейкхама - экспоненциальный рост и удвоение с той же скоростью. Это подтверждает связь между старением и хроническими возрастными заболеваниями.
Развитием этой теории стала концепция иммунного старения, в основе которой лежат изменения иммунной системы, накапливающиеся по мере прожитых лет. Это состояние еще называют «стерильным воспалением», то есть хроническим воспалением, развившимся на фоне отсутствия инфекции.
В январе 2019 года группа российских ученых из институтов Новосибирска опубликовала в журнале Nature Communications Biology статью, в которой сообщала о выявлении генетических факторов, влияющих и на развитие ряда хронических патологий (диабет, ХОБЛ, рак, деменция), и на процессы старения. Были также обнаружены тесные генетические связи между ЗОЖ и рисками развития ожирения, диабета 2 типа, ишемической болезни сердца и др.
Старение и вирусы

В апреле 2021 года ученые из Stanford University School of Medicine опубликовали статью, из которой следует, что вирусные инфекции приводят к состоянию, аналогичному хроническому воспалению, развивающемуся при старении. В своем исследовании они сравнивали состояние иммунной системы в группе пожилых людей и в группе пациентов с такими хроническими инфекциями, как ВИЧ и гепатит С. Пациенты получали соответствующее лечение.
В результате были обнаружены общие для обеих групп изменения, которые вели к все тому же системному хроническому воспалительному процессу: ухудшение Т-клеточной памяти (истощение Т-лимфоцитов, ответственных за Т-клеточный иммунитет), активизация внутриклеточных провоспалительных сигнальных путей, снижение чувствительности к цитокинам (сигнальным молекулам воспаления) в лимфоцитах и миелоидных клетках.
У пациентов с ВИЧ, даже среди людей, находящихся на ретровирусной терапии более 10 лет, эти изменения были более выражены. У пациентов с гепатитом С, прошедших курс лечения, менее, но даже после терапии многие изменения иммунной системы сохранялись на минимум на протяжении года и более.
Эти и ранее проведенные исследования показывают, что есть целый ряд вирусов, которые оказывают хроническое воздействие на иммунную систему. Характер этого воздействия таков, что можно говорить о старении, вызываемом вирусными инфекциями.
Так, в перечень таких вирусов входят, помимо уже упомянутых нами ВИЧ и гепатита С, представители семейства герпесвирусов: вирусы, вызывающие генитальный герпес, ветряную оспу и пузырьковый лишай (он же опоясывающий герпес), вирус Эпштейна-Барр, вызывающий мононуклеоз, а также вирус герпеса 5 типа, вызывающий цитомегаловирусную инфекцию.
Старение и коронавирус SARS-CoV-2
У каждого, без исключения, человека на Земле есть свой виром - совокупность обитающих в организме вирусов. За свою жизнь в организме человека успевает поселиться и остаться с ним навсегда 12-15 вирусов. Именно эти вирусы играют роль в старении организма. От острых инфекций мы успешно избавляемся при помощи иммунитета. Но хронические остаются с нами и сокращают нам отпущенные годы, даже не проявляя себя.
В этом отношении особенно интересен коронавирус SARS-CoV-2, который вызывает сильное острое воспаление, но может при этом вызывать и долгосрочные последствия для иммунной системы и других тканей и органов. Сейчас ученые собирают данные, которые в будущем помогут разобраться, как коронавирус влияет на старение человека.
Как старение влияет на иммунную систему: риск инфекций

По мере старения организма в целом закономерно изменяется и работа иммунной системы, ее реакции на аллергены, возбудителей инфекций, собственные ткани и трансформированные клетки тела. Известно, что с возрастом может уменьшаться выраженность аллергии, чаще возникают аутоиммунные патологии, что связано с постепенным возрастным снижением иммунных функций. Приобретенный иммунитет ко многим заболеваниям может ослабляться, способность организма бороться с инфекцией неизбежно замедляется. Поэтому пожилым людям зачастую рекомендуются прививки от наиболее опасных микробных или вирусных патологий. Кроме того, существенно ухудшает функционирование иммунной системы хроническое системное воспаление, провоцирующее серьезные обменные и соматические заболевания.
Старение и иммунная система
Хотя старение организма неизбежно, и на сегодняшний день медицина еще не научилась его тормозить или даже существенно замедлять, сам пациент может многое сделать, чтобы укрепить свою иммунную систему и сохранить ее здоровой с возрастом, насколько это возможно. Важно только знать некоторые признаки ослабления иммунитета и активные способы его укрепления.
Иммунная система человека поддерживает здоровье всего организма, предотвращая попадание посторонних веществ, которые могут нанести вред определенным тканям или органам. Наиболее опасны бактерии, вирусы, грибки и раковые клетки. Иммунная система борется с ними, используя систему гуморального и клеточного иммунитета, активизируя белые клетки крови, лимфоузлы, иммунные органы и местные защитные реакции тканей. Лимфатические узлы - это небольшие округлые лимфоидные образования, которые синтезируют, а затем выделяют специализированные клетки, называемые лимфоцитами. Лимфа и кровеносные сосуды переносят борющиеся с инфекцией клетки и биологически активные соединения по всему организму.
Старение является основным фактором, определяющим закономерные изменения в иммунной системе. По мере возраста иммунная система постепенно ослабевает, ее реакции становятся не такими быстрыми и бурными.
Борьба с инфекцией в зрелом возрасте

Учитывая тот факт, что старение тормозит иммунные реакции, организму в пожилом возрасте требуется больше времени, чтобы определить, что развивается опасная инфекция. После обнаружения опасных вирусов или микробов иммунной системе требуется больше времени на распознавание патогенов и запуск реакций. И только потом организм начинает борьбу с бактериальной или вирусной инфекцией. Поэтому по мере старения люди чаще болеют. Нередко инфекция может стать более серьезной, представляя большую угрозу, чем когда человек был моложе. Пожилые люди выздоравливают медленнее даже при банальных ОРВИ.
Изменения иммунитета с возрастом
Прививки, формирующие приобретенный активный иммунитет, являются хорошими способами защиты организма от инфекции. Однако вакцины могут работать не так хорошо, как раньше, плюс, не от всех опасных инфекций на сегодняшний день есть эффективные прививки. Кроме того, из-за возрастных изменений в иммунной системе чаще возникают аутоиммунные заболевания, такие как ревматоидный артрит.
Когда человек становится старше, иммунная система все еще довольно хорошо справляется с инфекциями, которые ранее уже возникали (работает приобретенный иммунитет). Но новые инфекции, с которыми организм никогда раньше не сталкивался, являются настоящей проблемой. На формирование активного иммунитета уходит больше времени, он может быть неполноценным, особенно когда речь идет о тяжелых вирусных или микробных поражениях.
Помогут ли прививки пожилым людям?
Несмотря на то, что иммунная система уже не настолько активна, проведение профилактических прививок и создание иммунитета от определенных опасных заболеваний в пожилом возрасте - это эффективная мера защиты их здоровья.
Особенно эффективны прививки против таких инфекций, таких как грипп и гемофильная, пневмококковая пневмония. Профилактические прививки в возрасте старше 60-ти лет в соответствии с рекомендациями - лучший способ защиты от инфекционных заболеваний и их тяжелых осложнений.
Пневмококковая вакцина, прививки от гемофильной инфекции рекомендуются людям старше 65 лет для предотвращения пневмонии и связанных с ней осложнений. Большинство пожилых людей должны также ежегодно получать прививки от гриппа. Кроме того, могут понадобиться периодические повторные прививки от столбняка и дифтерии, если они были выполнены более 10-ти лет назад.
Проблема хронического воспаления
Если имеется хроническое воспаление внутренних органов (почек, печени, суставов), это наносит ущерб иммунной системе. Но еще более выраженные проблемы с иммунной системой возникают на фоне хронического системного воспаления, возникающего при нарушении обменных процессов. По мере старения тканей, особенно в случае ожирения, при развитии атеросклероза, возникает системное воспаление слабой степени. Сегодня многие ученые заняты изучением влияния воспаления на здоровье и разработкой методов борьбы с ним.
Одни предлагают в качестве борьбы с воспалением устранение дисбаланса кишечных бактерий, другие - похудение, ограничение поступления калорий как возможность обеспечения достаточного количества энергии для правильной работы иммунной системы. Кроме того, изучается влияние определенных лекарств. В частности, рапамицин и метформин в исследованиях на животных показали антивозрастные и противовоспалительные эффекты.
Что можно сделать уже сейчас?
Возможно, что через 20-30 лет будет открыто «лекарство» от старения. Но пока таких препаратов нет, есть возможность помочь своему организму самостоятельно, без вмешательства ученых и современных технологий. Здоровая иммунная система тесно связана с нашим общим здоровьем. Предотвращение ожирения и лечение любых хронических патологий, включая сахарный диабет, снижают стресс иммунной системы.
Физические упражнения укрепляют иммунную систему, об этом свидетельствуют многочисленные факты. Регулярные физические нагрузки нормализуют обмен веществ, усиливают оксигенацию тканей, стимулируют иммунную систему.
Полноценное питание с коррекцией поступающих калорий и нутриентов согласно возрасту также поддерживает активность иммунной системы пожилых людей. С другой стороны, курение так же вредно для активности иммунной системы, как и для здоровья бронхов, легких. Частое употребление большого количества алкоголя также может нарушить иммунитет. Нарушения сна, такие как апноэ во сне и храп, бессонница могут снизить иммунитет и привести к опасным инфекциям.

Старческая деменция — это серьезный диагноз, прогрессирование этой патологии приводит не только к снижению качества жизни самого пожилого человека, но и к множеству хлопот для его близких родственников. Насколько велики риски подобных расстройств нервной системы именно у вас, поможет оценить наш тест, его результаты помогут в проведении активных профилактических мер.
Иммунная теория старения: от теории к практике
Инновационный подход к диагностике лиц пожилого возраста позволил разработать общие рекомендации, персонифицированные программы эффективного лечения и реабилитации лиц пожилого возраста, которые могу служить основой повышения качества и продолжительности
Innovative approach to diagnostics of elderly people allowed to develop general recommendations, personified programs of effective treatment and rehabilitation of elderly people that can be a basis for improvement of life quality and increase of elderly people life expectancy.
Решение проблемы активного долголетия крайне актуально как для человечества в целом, так и для каждого человека в отдельности.
Вопросы улучшения качества жизни лиц пожилого возраста имеют большое социальное значение, поскольку результаты мировых эпидемиологических исследований показывают, что число пожилых людей увеличивается и будет продолжать расти во всех странах мира: население Земли «стареет».
Иммунная теория старения
В настоящее время активно развивается иммунная теория старения, которая основана на самых современных научных данных о том, что иммунитет является не только «борцом с инфекциями», но и важнейшей регуляторной системой организма 4.
Показана несомненная связь процессов старения с состоянием иммунной системы:
- Обнаружена прогрессирующая атрофия тимуса, значительное снижение продукции тимических гормонов (полипептидов), всей лимфоидной системы (селезенки, лимфатических узлов) с увеличением возраста человека.
- С увеличением возраста отмечается снижение количества «зрелых» Т-лимфоцитов в тимусе и периферической крови, увеличение числа незрелых и активированных лимфоцитов (признак активации воспалительного процесса); снижение разнообразия антигенного репертуара лимфоцитов; снижение противоопухолевой устойчивости организма.
- Выявлено сходство «старческих изменений» и процессов, наблюдаемых при ранней тимэктомии и иммунодефицитных состояниях.
- Обнаружено, что у пожилых людей, а также в эксперименте (у старых животных) резко снижена способность лимфоцитов активироваться собственными клетками организма, то есть значительно снижена контролирующая, «надзорная» функция лимфоцитов по отношению к состоянию собственных органов и систем (это показано на модели в сингенной смешанной культуре лимфоцитов).
Аутоиммунитет — пересмотр парадигмы
В середине XX века была пересмотрена роль аутоиммунитета 10 в жизнедеятельности организма. Показано, что аутоантитела (ААТ) и аутолимфоциты существуют в норме (30% всех иммуноглобулинов — это ААТ). Они выполняют важнейшие регуляторные функции: являются «мусорщиками», — удаляют продукты апоптоза (физиологической гибели клеток, которая постоянно происходит в организме при их старении), участвуют в контроле за пролиферацией, дифференцировкой, удалением трансформированных клеток, постоянно образующихся в организме; работой нервной и эндокринной систем.
При старении увеличивается число аутоиммунных заболеваний за счет иммунорегуляторных нарушений, более активно работают патологические механизмы мимикрии, при этом на антигены микроорганизмов вырабатываются антитела (АТ), удаляющие патогены, однако при этом данные АТ повреждают и собственные клетки (органы) за счет наличия общих антигенов у патогенов и органов. С возрастом содержание в организме человека бактерий и вирусов существенно увеличивается, механизмы мимикрии начинают работать более активно. С возрастом значительно страдает иммунная система кишечника, где в норме находится более 70% иммунокомпетентных клеток. Это связано с дисбиотическими, секреторными, моторно-эвакуаторными, морфологическими нарушениями органов желудочно-кишечного тракта, неправильным питанием.
Общие механизмы патогенеза при хронических воспалительных процессах
В настоящее время сформулировано положение о том, что хронические воспалительные процессы, которые протекают более активно у лиц пожилого возраста, имеют ряд общих патогенетических механизмов 13, основой которых являются:
- нарушение процессов контроля за состоянием органов и систем со стороны иммунной системы (аутоиммунные механизмы);
- прогрессивное увеличение «бактериально-вирусной нагрузки» на организм, проявляющееся наличием «латентных инфекций» (бактериально-вирусного носительства);
- нарушение: состояния микробиоты, функционирования органов желудочно-кишечного тракта, иммунитета кишечника;
- нарушение питания.
Таким образом, на основе современных представлений о важной физиологической роли естественного аутоиммунитета, учитывая выраженные изменения (нарушения) показателей данного звена иммунитета у лиц пожилого возраста, нами разработаны инновационные методы диагностики — диспансеризации, лечения и реабилитации лиц пожилого возраста.
Инновационная диагностика лиц пожилого возраста
На основе современных представлений о важной физиологической роли естественного аутоиммунитета, учитывая выраженные изменения (нарушения) показателей данного звена иммунитета у лиц пожилого возраста, нами впервые предложено использовать комплексную оценку аутоиммунитета «Иммунная карта» по технологии Иммункулус в учреждениях геронтологической сети РФ для определения состояния основных органов.
Этот подход позволяет диагностировать:
- наличие воспалительных (или аутоиммунных) системных или органных процессов, степень их активности;
- новые звенья патогенеза;
- «органы-мишени» для патогенов.
Дополнительно (по показаниям) рекомендуется проводить диагностику инфекционных процессов и степень их активности, оценить состояние органов желудочно-кишечного тракта (ЖКТ), активно влияющих на течение основных хронических заболеваний (сделать посевы биологических сред или методом полимеразной цепной реакци (ПЦР) определить наличие вирусов, бактерий в биологических средах, определить титры антител к патогенам, использовать для диагностики инструментальные методы и др.).
Комплексная оценка аутоиммунитета «Иммунная карта»
Комплексная оценка аутоиммунитета по технологии Иммункулус включает в себя одновременное определение в сыворотке крови методом иммуноферментного анализа (ИФА) содержание 24 ААТ. Лабораторное иммунологическое обследование «Иммунная карта» прошло многолетнюю клиническую апробацию — в течение 8 лет обследовано более 15 000 пациентов с различными заболеваниями. Показано высокое клинико-диагностическое значение данного подхода [6, 9-11]. Этот подход позволяет диагностировать:
- наличие и активность распространенного воспалительного (аутоиммунного) процесса по содержанию ААТ к двуспиральной ДНК, ААТ к бета-2-гликопротеину 1 (характеризующих наличие антифосфолипидного синдрома, связанного с нарушением свертывающей системы крови), ААТ к коллагену, по повышению уровня ревмофактора (АТ к Fc-фрагменту IgG);
- наличие и активность воспалительного (аутоиммунного) процесса в основных органах и системах по уровню ААТ к антигенам мышцы сердца, проводящей системы сердца, к эндотелию сосудов (ANCA), к антигенам легких, к антигенам органов ЖКТ — желудка, печени, кишечника, поджелудочной железы, к антигенам эндокринных органов (надпочечников, щитовидной железы, инсулину, рецепторам инсулина), к антигенам различных отделов нервной системы (антигенам нейронов, глии, периферических нервов — к основному белку миелина), к антигенам мочеполовой системы.
С учетом клинико-иммунологических исследований делаются клинико-иммунологические заключения для каждого пациента — индивидуально, даются рекомендации по коррекции лечения и реабилитации.
Проведение комплексной оценки аутоиммунитета у пожилых лиц позволило выявить общие закономерности изменений в аутоиммунном звене иммунитета, разработать индивидуальные клинические рекомендации для лечащих врачей по коррекции лечения и реабилитации.
Общие закономерности изменения аутоиммунитета у пожилых лиц
Диагностика распространенного активного воспалительного процесса
Комплексная оценка аутоиммунитета «Иммунная карта» позволяет выявлять лабораторно-иммунологические признаки наличия активного, распространенного воспалительного (реже — аутоиммунного) процесса, при котором отмечается повышение содержания ААТ к двуспиральной ДНК и ААТ к бета-2-гликопротеину 1 (ГП1).
Клинически в данной группе пациентов имеются воспалительные заболевания с аутоиммунным компонентом (ревматоидный артрит), болезни суставов и позвоночника (артрозоартриты, распространенный остеохондроз).
Этим пациентам рекомендуется коррекция лечения: замена препаратов или проведение более интенсивной противовоспалительной терапии с последующей реабилитацией с включением фитотерапии — фитопрепаратов с противовоспалительным действием.
Через 2 месяца показано повторное обследование для определения уровня соответствующих ААТ.
Лабораторно-иммунологические признаки воспалительного процесса в эндотелии сосудов (повышено содержание ААТ к АNCA)
У части пациентов изменяется содержание ААТ к тромбоцитам, что может встречаться при коагулопатиях.
У другой части лиц отмечается изменение уровня ААТ к бета-2-гликопротеину 1, что характерно для антифосфолипидного синдрома.
Пациентам с измененным уровнем ААТ к эндотелию сосудов, с повышенным содержанием ААТ — к бета-2-ГП1, к антигенам тромбоцитов рекомендуется провести исследование состояния свертывающей системы крови, при нарушении — применять соответствующие препараты.
В период реабилитации таким пациентам рекомендуется проведение фитотерапии, включающей фитосборы с противоатеросклеротическим, сосудорасширяющим, разжижающим кровь действием.
Через 2 месяца показано проведение повторного определения уровня соответствующих ААТ.
Лабораторно-иммунологические признаки эндокринных изменений
При впервые обнаруженном повышенном уровне ААТ к тиреоглобулину, тиреоидной пероксидазе, рецепторам тиреотропного гормона проводится дополнительное обследование — УЗИ щитовидной железы, определение уровня гормонов. В зависимости от результатов назначается лечение или осуществляется наблюдение.
Нами обнаружено, что повышенный уровень ААТ к гормонам щитовидной железы в ряде случаев связан с наличием хронической бактериально-вирусной инфекции (часто — в носоглотке). При этом проводится соответствующее лечение, что благоприятно отражается на исходно повышенном уровне ААТ. В последующем рекомендуется реабилитация фитопрепаратами, оказывающими антимикробное и противовирусное действие (например, Cуперантитокс: по 1 капсуле (50 мг) 1 раз в день в течение 2 месяцев, Глицирам — глициризиновая кислота, оказывающая также противовоспалительный и противо-аллергический эффекты: по 1 таблетке 3 раза в день 2 месяца, эффективны растительные антимикробные средства: цетрария, Гипорамин и др.).
Лабораторно-иммунологические признаки наличия изменений в органах желудочно-кишечного тракта
У пациентов могут изменяться уровни ААТ к антигенам желудка, тонкого, толстого кишечника, печени, к инсулину, рецепторам инсулина.
С учетом выявленных нарушений лечащим врачом даются рекомендации по дополнительному обследованию пациентов, их лечению и реабилитации, назначается соответствующее питание, препараты, восстанавливающие микрофлору кишечника — про- и пребиотики, гепатопротекторы (с включением органотропной терапии — Гепатосан, Энтеросан), препараты, нормализующие моторную функцию кишечника, желчного пузыря (по показаниям).
Лабораторно-иммунологические признаки наличия изменений в нервной системе
При этом может меняться уровень ААТ к основному белку миелина, к GFAP (белку глии: глиальные клетки «питают» и защищают клетки головного мозга), к S100 (белок нейронов).
Данным пациентам показан курс лечения с применением ноотропных препаратов. Нами отмечено, что использование фитопрепаратов с противовирусным действием также способствует нормализации уровня соответствующих ААТ (Глицирам, Суперантитокс, Гипорамин, Сангвиритрин и др.).
Лечение и реабилитация лиц пожилого возраста: общая концепция
Лечение лиц пожилого возраста должно быть основано на применении базисной терапии с учетом наличия хронических заболеваний и персонифицированного подхода.
Методы реабилитации необходимо разрабатывать персонифицированно с учетом следующих общих положений:
- Правильное питание является основой реабилитации, это один из доказанных способов увеличить на 15-25% продолжительность жизни (в 70% случаев причина смерти и в 40% — ведущая причина возникновения заболеваний связаны с неправильным питанием), основой функционального питания служит сбалансированный микро- и макроэлементный (цинк, селен, кальций, магний и др.) состав пищи, витаминный (витамины А, С, Е, D, группы В) и белковый состав потребляемых продуктов (например, водный экстракт бобовых оказывает комплексный лечебно-реабилитационный эффект, положительно воздействуя на гормональный фон и иммунитет, обладает антидепрессивным действием), уровень содержания антиоксидантов. Эти компоненты и определяют качество пищевых продуктов.
- Нормальное функционирование иммунной системы — важнейшая составляющая увеличения продолжительности жизни.
Состояние микробиоты, органов ЖКТ — один из главных факторов активного долголетия.
Заключение
Комплексное исследование аутоиммунитета «Иммунная карта» по технологии Иммункулус у лиц пожилого возраста, проведенное на базе ФГБУ «ВНМГЦ», выявило важное клинико-диагностическое значение данной методологии.
Разработанный подход позволяет:
- улучшить клиническое течение основного заболевания, снизить выраженность и длительность клинических симптомов, улучшить ближайшие и отдаленные результаты лечения, провести профилактику осложнений, снизить частоту рецидивирования хронических заболеваний;
- повысить эффективность других методов лечения;
- осуществлять профилактику побочных эффектов фармакотерапии;
- повысить качество жизни пациентов.
Выводы
- Комплексная оценка аутоиммунитета «Иммунная карта» по технологии Иммункулус, проводимая у пожилых лиц, — инновационный подход, имеющий важное клинико-диагностическое значение для врачей-геронтологов.
- Комплексное исследование аутоиммунитета позволило разработать для врачей-геронтологов общие рекомендации по оценке состояния здоровья лиц пожилого возраста.
- Данный подход дает возможность лечащим врачам составлять персонифицированные рекомендации по эффективному лечению и реабилитации, направленные на улучшение клинического течения хронических заболеваний, повышение эффективности исследуемых методов лечения, на осуществление профилактики побочных эффектов фармакотерапии.
- Данная методология может использоваться для повышения качества и увеличения продолжительности жизни пожилых лиц.
Литература
- Донцов В. И., Крутько В. Н., Труханов А. И. Медицина антистарения. Фундаментальные основы. URSS. М., 2009.
- Хавинсон В. Х. Пептидная регуляция старения. СПб: Наука, 2009.
- Киселева Н. М., Иноземцев А. Н. Роль тимуса в работе стресс-лимитирующей системы // Иммунопатология, аллергология, инфектология. 2010. 3, с. 13-20.
- Кузьменко Л. Г., Быстрова О. В., Зимина И. В. и др. Функциональное состояние тимуса у новорожденных и их матерей // Педиатрия. Журнал имени Сперанского. 2011. 90 (2), с. 8-13.
- Coen I. R. Autoimmunity, microbial immunity // Immun. Today. 1991. 12, p. 105-110.
- Материалы международных конференций «Аутоиммунитет в норме и патологии». Москва, 2005. Москва, 2008. Инновационный центр Сколково, 2012. Симонова А. В. Инновационные подходы к диагностике, лечению хронических заболеваний. Материалы доклада.
- Shoenfeld Y. Natural autoantibodies. CRS Press. Boca Raton. 2000.
- Notkins A. L. New predictor of disease // Sci. Amer. 2007. 3, р. 72-79.
- Полетаев А. Б. Физиологическая иммунология. Миклош. М. 2011.
- Симонова А. В., Лебедева И. С. Инновационные методы диагностики и лечения иммунодефицитных состояний // Лечащий Врач. 2012. 4, c. 16-20.
- Симонова А. В., Лебедева И. С., Кузьменко Л. Г. Хронические инфекции: инновационные идеи в области патогенеза, лечения, вакцинации // Лечащий Врач. 2012. 10, с. 41-44.
- Гастроэнтерология Санкт-Петербурга. Материалы 13-го съезда Научного общества гастроэнтерологов России с международным участием. 2013.
- Ткаченко Е. И., Успенский Ю. П. Питание, микробиоциноз и интеллект человека. СПб: СпецЛит. 2006, с. 3-589.
- Дисбиоз кишечника (руководство по диагностике и лечению, под ред. Е. И. Ткаченко, А. Н. Суворова). СПб: Информ. Мед. 2009, с. 3-275.
- Дисбактериоз. Чернин В. В., Бондаренко В. М., Червинец В. М., Базлов С. Н. М.: МИА. 2011, с. 3-14.
- Шендеров Б. А. Роль питания и кишечной микрофлоры в программировании и реализации эпигенома здоровых и больных людей // Вестник восстановительной медицины. 2012. 3 (49), с. 102-107.
А. В. Афтеньев*
И. В. Архипов*, кандидат медицинских наук
И. Д. Баранова**, кандидат медицинских наук
И. С. Лебедева**
А. В. Симонова**, доктор медицинских наук, профессор
Л. Г. Кузьменко**, ***, доктор медицинских наук, профессор
* ФГБУ ВНМГЦ, ** ООО «СМ-Клиника», *** ФГБОУ ВПО РУДН, Москва
Хроническое воспаление при старении
Хроническое воспаление - один из главных биологических маркеров старения и элементов патогенеза возрастных заболеваний. В обзоре рассмотрены молекулярно-генетические механизмы персистирующего системного воспаления, сопровождающего физиологическое старение
Fumihiro Sanada1, Yoshiaki Taniyama1,2*, Jun Muratsu1,2, Rei Otsu1, Hideo Shimizu1, Hiromi Rakugi2 and Ryuichi Morishita1*
1Department of Clinical Gene Therapy, Graduate School of Medicine, Osaka University, Suita, Japan
2Department of Geriatric and General Medicine, Graduate School of Medicine, Osaka University, Suita, Japan
Оригинал статьи: © 2018 Sanada, Taniyama, Muratsu, Otsu, Shimizu, Rakugi and Morishita, распространяется по лицензии CC BY 4.0.
Перевод статьи: © 2021 ООО «Издательство «Открытые системы», распространяется по лицензии CC BY-NC-ND 4.0.
Аннотация
Ключевые слова: Хроническое Воспаление, Старение, Клеточное Старение, Старение Иммунитета, Провоспалительные Цитокины, Система Свертывания Крови, Дисбактериоз Кишечника, Chronic Inflammation, Aging, Cell Senescence, Immunosenescence, Proinflammatory Cytokines, Coagulation System, Gut Dysbiosis
В процессе биологического старения системное воспаление прогрессирует в отсутствие патогенных факторов («воспалительное старение», «inflammaging») и характеризуется резистентностью к гиполипидемической (снижение уровня липопротеинов низкой плотности, ЛПНП) и гипотензивной (контроль активности ренин-ангиотензиновой системы, РАС) терапии.
При клеточном старении центральными звеньями патогенеза хронического воспаления являются иммунная дисрегуляция и нарушение активности системы свертывания крови. Обзор посвящен рассмотрению молекулярно-генетических механизмов персистирующего системного воспаления, сопровождающего физиологическое старение, и его роли в патогенезе возрастных заболеваний.
Введение
Системное воспаление при старении - один из главных элементов патогенеза сердечно-сосудистых, эндокринных и онкологических заболеваний (1), распространенность которых неуклонно растет с каждым годом. Несмотря на центральную роль немедикаментозной терапии (изменение образа жизни и рациона питания, снижение влияния сопутствующих факторов риска) в профилактике возрастных заболеваний, требуется разработка фармакологических подходов, основанных на регуляции ключевых клеточных и молекулярных механизмов, участвующих в прогрессировании хронического воспаления.
Важную роль в прогрессировании хронического воспаления играют диетические факторы, старение клеток, снижение уровня половых гормонов и курение. Кроме того, в процессе старения наблюдается повышение уровня циркулирующих провоспалительных факторов, включая интерлейкин-6 (ИЛ-6) и фактор некроза опухоли-α (ФНО-α) (2), способствующих повреждению ДНК, развитию мышечной атрофии, метаболических нарушений и онкологических заболеваний. Повышение образования и секреции ИЛ-6 и ФНО-α при старении также наблюдается в адипоцитах висцеральной жировой ткани (3, 4), увеличение количества макрофагов в которых пропорционально значениям индекса массы тела (ИМТ) и является важным биомаркером хронического воспаления и предиктором инсулинорезистентности у людей с ожирением (5, 6). Среди факторов внешней среды повышению уровня провоспалительных цитокинов - ИЛ-6, ФНО-α и интерлейкина-1-β (ИЛ-1-β) - в крови способствуют хроническое воздействие сигаретного дыма, психоэмоциональный стресс и воспалительные заболевания полости рта (7). Однако системное воспаление низкой интенсивности персистирует даже после коррекции провоспалительного статуса - уровня ЛПНП и активности РАС - и отказа курения, что указывает на существование секреторного фенотипа клеток, ассоциированного со старением (senescent associated secretory phenotype, SASP) и иммунологического импринтинга. В обзоре рассмотрены данные о ключевых биомаркерах, молекулярных механизмах и сигнальных каскадах, участвующих в развитии системного воспаления низкой интенсивности в процессе биологического старения (Рис. 1).
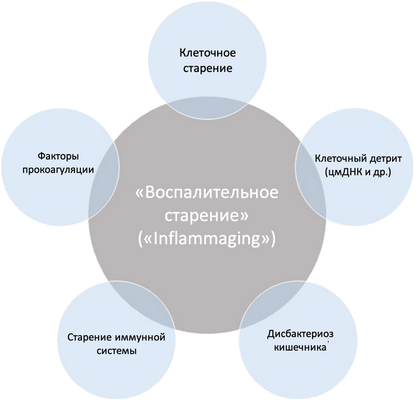
Рисунок 1. Молекулярные элементы системного воспаления, ассоциированного со старением: старение клеток, нарушение гемостаза, накопление клеточного детрита (в т.ч. циркулирующей митохондриальной ДНК, цмДНК), дисбактериоз и иммунная дисфункция. Дополнительные факторы: возраст, окислительный стресс, циркулирующие микроРНК и агалактозилированные N-гликаны.
Источники медиаторов хронического воспаления при старении
Острое воспаление - ключевой компонент в механизме формирования иммунного ответа на воздействие патогена или повреждение тканей и активации регенерации тканей. Системное воспаление низкой интенсивности, наоборот, вызывает хроническое повреждение клеток, способствуя развитию дегенеративных изменений в тканях (8). Воздействие провоспалительных цитокинов - ИЛ-6, ИЛ-1-β и ФНО-α - на структуры нервной и костно-мышечной систем (9) приводит к снижению активности анаболических процессов, опосредованных действием инсулина и эритропоэтина, вызывая развитие саркопении (10).
Клеточный детрит и накопление иммуноглобулинов
Накопление клеточного детрита и иммуноглобулинов в результате нарушения метаболических процессов в клетках стимулируют активацию иммунной системы и развитие системного воспаления. Важную роль в регуляции межклеточных и межмолекулярных взаимодействий и активности иммуноглобулинов играет гликозилирование - один из наиболее распространенных типов посттрансляционной модификации, основанный на присоединении углеводных остатков к аминокислотам (напр., к азоту аспарагиновых остатков в N-гликанах) (11, 12). Данные клинических (13-15) и экспериментальных исследований на животных (16-18) демонстрируют повышение уровня агалактозилированных N-гликанов, не имеющих в составе остатка галактозы в позиции Asn297 Fc-фрагмента IgG (IgG-G0), у пациентов с синдромом Гетчинсона-Гилфорда (прогерия) и некоторыми аутоиммунными заболеваниями.
Провоспалительный эффект IgG-G0 реализуется посредством усиления лектинового пути активации комплемента, связывания с Fcγ-рецепторами и образования агрегатов аутоантител. Кроме того, накопление IgG-G0 с возрастом служит независимым предиктором гиперактивации иммунной системы и развития системного воспаления.
Дополнительным биомаркером старения является митохондриальная дисфункция и высвобождение молекулярных паттернов, ассоциированных с повреждением (МПАП; damage-associated molecular patterns). Рядом исследований показана роль циркулирующих митохондриальных МПАП в патогенезе хронического воспаления и дегенеративных заболеваний (19, 20).
Старение сопровождается снижением барьерной функции эпителиальной выстилки кишечника и ротовой полости (21, 22), что способствует развитию дисбактериоза. Качественные и количественные изменения нормального состава кишечной микробиоты в процессе старения - снижения числа представителей «противовоспалительной» микрофлоры (напр., Clostridium XIVa, Bifidobacterium spp., F. prausnitzii) и увеличением количества условно-патогенных микроорганизмов (напр., Streptococcus spp., Staphylococcus spp., Enterococcus spp., Enterobacter spp.; 23) - может повышать уязвимость пожилых людей к инфекциям. Например, количество бактерий рода Bifidobacterium отрицательно коррелирует с уровнем провоспалительных цитокинов - ФНО-α и ИЛ-1β - в плазме крови.
Нарушение баланса микрофлоры кишечника в большинстве случаев вызвано особенностями рациона питания и наиболее выражено у пожилых лиц, длительно находящихся в учреждениях стационарного социального обслуживания по сравнению с пациентами в частных домах престарелых (24).
Старение клеток
Клеточное старение - необратимая остановка клеточного цикла и потеря способности клетки к делению. Остановка клеточной пролиферации происходит в результате ряда молекулярно-генетических изменений, включая укорочение теломер, генотоксический стресс, действие митогенных стимулов и провоспалительных цитокинов, активацию белка-супрессора опухоли p53 и/или ингибитора циклин-зависимой киназы p16 (25). С возрастом в различных тканях и органах увеличивается количество клеток, утративших способность к пролиферации и приобретающих секреторный фенотип, ассоциированный со старением. Это сопровождается высвобождением провоспалительных цитокинов и инициацией системного воспаления и лежит в основе патогенеза атеросклероза, онкологических заболеваний и сахарного диабета (26-28).
В исследованиях на животных неоднократно показана центральная роль процесса клеточного старения в прогрессировании дегенеративных заболеваний, включая атеросклероз и остеоартрит (29-31). Удаление стареющих клеток и контроль провоспалительных каскадов, участвующих в приобретении клетками секреторного фенотипа, ассоциированного со старением, может служить потенциальной терапевтической мишенью при разработке подходов к профилактике и терапии возрастных заболеваний.
Старение иммунной системы
Дисрегуляция системы врожденного иммунитета и активация воспалительного ответа является ключевым механизмом старения иммунной системы («иммуно-старение»; 32), который приводит к повышению уязвимости пациентов пожилого возраста к аутоиммунным, инфекционным и онкологическим заболеваниям, снижению иммунного ответа на вакцинацию и ухудшению регенерации тканей (33, 34). Хронические воспалительные заболевания, в свою очередь, также способствуют снижению количества клеток и нарушению функций иммунной системы. В частности, в процессе старения наблюдаются изменения характера экспрессии паттерн-распознающих рецепторов (pattern recognition receptors), активация которых при связывании с эндогенными лигандами - маркерами повреждения клеток - стимулирует секрецию провоспалительных цитокинов и прогрессирование хронического воспаления.
Таким образом, наряду с клеточным старением, возрастное снижение функции врожденной иммунной системы является важным элементом патогенеза системного воспаления низкой интенсивности при старении.
Система гемостаза: факторы свертывания крови и фибринолиза
Развитию возрастных заболеваний - атеросклероза и фиброза легких - у пациентов пожилого возраста способствует повышенная активация системы свертывания крови и стимуляция процесса фибринолиза, которые вызывают развитие хронического воспаления через активацию рецепторов, активируемых протеазами (protease-activated receptors, PAR; 35-38).
Увеличение сердечно-сосудистого риска, в частности риска развития тромботических заболеваний, с возрастом связано с повышением уровня факторов свертывающей системы плазмы крови I, V, VII, VIII и IX (39, 40) и концентрации фактора X в атеросклеротических бляшках эндотелиальных, гладкомышечных и иммунных клеток (41). Результаты клинического исследования ATLAS ACS 2-TIMI 51 Investigators показали, что высокоселективный прямой ингибитор фактора Xa ривароксабан снижает риск инфаркта миокарда, инсульта и сердечно-сосудистую смертность у пациентов с ишемической болезнью сердца (42). Увеличение активации системы свертывания крови и содержания фибриногена в плазме крови, наоборот, способствует развитию тромбоза, а повышение уровня фактора коагуляции Xa и тромбина усиливает провоспалительный каскад и вызываемую тромбином PAR-1/2-опосредуемую активацию тромбоцитов (43). Патогенетическая роль PAR-1/2-опосредованной сигнализации FXa и фибринолитического фактора плазмина в процессах клеточного старения и системного воспаления реализуется посредством повышения экспрессии протеина, связывающего инсулиноподобный фактор роста 5 (IGFBP-5; 37, 41, 44, 45). Как показали результаты работы Kojima et al., IGFBP-5, белок семейства сигнальных трансдукторов и активаторов транскрипции (STAT3), участвует в активации ИЛ-6-индуцированного образования активных форм кислорода (АФК), повреждению ДНК и гибели фибробластов (46).
IGFBP-5-опосредованная активация сигнального пути MAPK и транслокация EGR-1 в ядро приводит к активации транскрипции генов медиаторов воспаления и развитию фиброза, способствуя прогрессированию фибротического фенотипа (47). Важным звеном механизма старения гладкомышечных и эндотелиальных клеток является активация пути EGR-1-IGFBP-5-p53 с участием белков раннего ответа при повышении каталитической активности FXa (37). Все эти данные демонстрируют центральную роль IGFBP-5 в регуляции процессов «воспалительного старения», гиперкоагуляции и старения клеток (Рис. 2).
Учитывая равное распределение FXa- и IGFBP-5-положительных областей в атеросклеротических бляшках (41), можно утверждать, что, как и тромбин, местный синтез фактора коагуляции Xa является ключевым индуктором экспрессии IGFBP-5 и патогенетическим фактором SASP-опосредованного клеточного старения (41, 48).
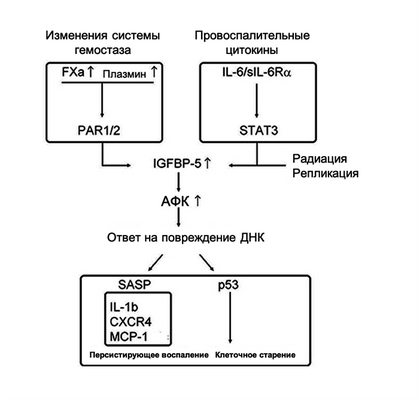
Рисунок 2. Активация каскада свертывания крови в патогенезе клеточного старения и хронического воспаления.
Заключение
В норме элиминация патогенного фактора позволяет устранить воспаление и активировать регенерацию поврежденных тканей. Однако с возрастом хроническое воспаление низкой интенсивности прогрессирует в отсутствие инфекционного агента, способствуя развитию деструктивных изменений в тканях и органах. Хроническое повышение уровня провоспалительных медиаторов при системном воспалении является ведущим фактором риска развития онкологических, сердечно-сосудистых и нейродегенеративных заболеваний, сахарного диабета II типа, саркопении и остеопороза у пожилых пациентов. Учитывая многофакторную природу процесса старения, существующие методы симптоматической и противовоспалительной терапии возрастных заболеваний в большинстве случаев не позволяют достигнуть устойчивого снижения прогрессирования дегенеративных процессов, что делает актуальным разработку методов «сенолитической» терапии, направленной на селективное устранение стареющих клеток (49-52).
Список литературы
Дисклеймер: все утверждения, высказанные в статье, относятся к суждениям авторов и необязательно согласуются с точкой зрения аффилированных организаций, издателя, редакторов и рецензентов. Любой продукт или утверждение производителя не гарантируются и не поддерживаются издателем.
Читайте также:
