Эндофтальмиты, отслойки сетчатки при 25G витрэктомии. Профилактика
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Ключевые слова: послеоперационный эндофтальмит, TASS-синдром, витрэктомия, антибиотики, стекловидное тело.
Эндофтальмит — (от греч. endo — внутри и ophthalmos — глаз) — это гнойное воспалительное заболевание внутренних оболочек глаза. Возникает вследствие инфицирования бактериями или грибами во время травмы, интраоперационно или в раннем послеоперационном периоде, в редких случаях — из-за распространения инфекции из эндогенных источников. Учитывая патогенез заболевания, время, необходимое для миграции патогенов в заднюю камеру глаза и накопления там медиаторов воспаления, составляет не менее 2 суток.
По механизму возникновения эндофтальмит подразделяют на:
- Острый послеоперационный (возникает в срок до 2 недель после выполненной операции)
Частота развития эндофтальмита после экстрации катаракты, по данным Европейского общества катаральных и рефракционных хирургов (ESCRS) [1], составляет 0,35 % без применения интракамерального введения цефуроксима, с применением — 0,05 %. В США, по данным Нила Шорстейна (Neal H. Shorstein) — 0,31 % и 0,014 % соответственно [8].
Этиология ипатогенез
По данным исследования Endophthalmitis Vitrectomy Study (EVS), основным источником инфицирования является микрофлора поверхности конъюнктивы пациента [7]. Самыми распространенными причинами развития острого послеоперационного эндофтальмита являются коагулазонегативные стафилококки, в частности Staphylococcus epidermidis (33-77 %); Staphylococcus aureus (10-21 %). При хроническом эндофтальмите наиболее вероятным возбудителем является Proprionibacterium acnes.
Микроорганизмы, часто встречающиеся при остром послеоперационном эндофтальмите [1]
Распространённость (%)
Виды микроорганизмов
КНС (коагулазонегативные стафилококки)
BHS (β-гемолитические стрептококки),
S. pneumoniae, ∂-гемолитические стрептококки, включая S. mitis и S. salivarius
Грамотрицательные бактерии, включая Ps. aeruginosa
Грибы (виды Candida, виды Aspergillus, виды Fusarium)
Микроорганизмы, часто встречающиеся при хроническом или позднем послеоперационном эндофтальмите [1]
К факторам риска развития эндофтальмита относятся:
- Увеличенное время операции у неопытного хирурга
- Повреждение задней капсулы хрусталика и стекловидного тела во время операции
- Наличие у пациента блефарита до операции
- Поверхность интраокулярных линз как среда для развития микроорганизмов
- Недостаточная стерилизация инструментов и операционного поля
Следует также отметить роль бесшовных оперативных методик в развитии послеоперационного эндофтальмита: использование туннельного бесшовного разреза роговицы способствует повышению частоты развития эндофтальмита после факоэмульсификации катаракты вследствие возможности всасывания в переднюю камеру слезной жидкости в раннем послеоперационном периоде.
По данным руководства ESCRS, у пациентов с роговичным туннелем вероятность развития эндофтальмита в 5,88 раз больше, чем при корнеосклеральном доступе [1].
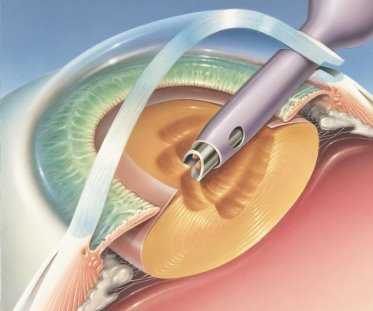
Рис. 1. Применение роговичного тоннельного доступа
В том же руководстве сообщается, что при имплантации силиконовых интраокулярных линз (ИОЛ) вероятность развития эндофтальмита в 3,13 раз выше в сравнении с линзами из акрила или другого материала, а хирургические осложнения сопровождались 4,95-кратным увеличением данного риска. Большинство имплантируемых ИОЛ на данный момент изготовлены из гидрофобного акрила, а силиконовые встречаются редко по причине инфекционных осложнений и риска повредить линзу при имплантации через разрезы менее 2,8 мм [15].
Клиника идиагностика
К основным клиническим проявлениям эндофтальмита, согласно исследованию EVS, относятся: нечёткость зрения (94 % пациентов), болевой синдром (74 %), отёк век (34 %), гипопион (80 %), покраснение глаза (82 %), помутнение сред глаза (74 %). Лизис стекловидного тела и замещение его гнойными массами вызывают жёлто-зелёный рефлекс с глазного дна.
По степени тяжести эндофтальмит может быть условно разделен на лёгкий, средней тяжести и тяжёлый:
- Лёгкий: слабо выраженный болевой синдром, умеренная инъекция глазного яблока, возможно проведение офтальмоскопии.
- Средней тяжести: выраженный болевой синдром и инъекция глазного яблока, невозможна офтальмоскопия, значительно снижена острота зрения, допускается наличие витреита, хемоза, отёка век.
- Тяжёлый: выраженный болевой синдром с иррадиацией в соответствующую половину черепа; выраженные: инъекция глазного яблока, хемоз, гипопион, витрит, отёк век; невозможна офтальмоскопия; снижение остроты зрения вплоть до светооощущения.
А. М. Южаков предложил классификацию в зависимости от формы развития:
- Очаговый эндофтальмит (абсцесс стекловидного тела), стадии I-II
- Диффузный эндофтальмит, стадии I-IV
- Смешанная форма, стадии I-IV
- Панофтальмит — конечный результат инфекционного процесса
При подозрении на послеоперационный эндофтальмит каждый час определяется острота центрального зрения, при ее резком снижении незамедлительно приступают к хирургическому лечению. Снижение зрительных функций до светоощущения является прогностически неблагоприятным фактором. Помимо визометрии, проводится биомикроскопия и офтальмоскопия для динамической оценки послеоперационного воспаления. Из инструментальных методов исследования обязательным является УЗИ (B-scan).
Дополнительно также проводятся периметрия и электрофизиологические исследования зрительного нерва и сетчатки (электроретинография). Снижение их показателей будет указывать на токсическое повреждение внутренних оболочек глаза и являться показанием для хирургического лечения.
Перспективным методом диагностики и контроля эффективности лечения является лазерная тиндалеметрия. Принцип работы основан на измерении интенсивности лазерного луча, отраженного от взвешенных во влаге передней камеры клеток и крупномолекулярных белков (альбуминов и макроглобулинов). Когда частица белка или клетка проходит через фокус лазера, происходит отражение излучения.
До начала лечения обязательным является предварительная пункция передней камеры глаза и биопсия стекловидного тела для проведения бактериологического анализа. Взятые пробы окрашивают по Граму (экспресс-метод) с дальнейшей идентификацией микроорганизмов и определением чувствительности к антибиотикам.
ПЦР с использованием праймеров широкого диапазона, нацеленных на высококонсервативные регионы эубактериальной 16S рДНК (18S рДНК для грибов), может выявлять и амплифицировать минимальные количества бактериальной ДНК, с их последующим секвенированием и идентификацией. Она обеспечивает намного лучшее выявление патогенов, особенно в случаях хронического эндофтальмита с малым количеством патогенов [9].
Дифференциальная диагностика сTASS-синдромом
Синдром токсического повреждения переднего сегмента глаза (TASS-синдром, экссудативно-воспалительная реакция) — состояние, сходное с эндофтальмитом по клиническим проявлениям, но имеющее другой патогенез. Синдром токсического повреждения переднего сегмента глаза (TASS-синдром) представляет собой стерильную послеоперационную воспалительную реакцию, вызываемую веществом неинфекционного происхождения, попавшим в передний сегмент глаза, что приводит к токсическому повреждению внутриглазных тканей.
Основные группы веществ, которые при попадании в передний сегмент могут вызвать TASS-синдром:
- Вещества извне, которые случайно проникают в переднюю камеру глаза во время или после операции (например, повидон-йод для местного применения).
- Продукты, вводимые в переднюю камеру глаза как часть хирургической процедуры, такие как сбалансированный солевой раствор из партии, произведенной с ошибочным рН или осмолярностью (или с лекарственными препаратами, добавленными в операционной) или анестетики (безопасным является только не содержащий консервантов 1 % лидокаин). Любой лекарственный препарат, вводимый в глаз, не должен содержать консервантов и должен использоваться в надлежащей концентрации, чтобы избежать развития токсических реакций.
- Раздражающие вещества на инструментарии, скопившиеся вследствие его неправильной очистки и/или стерилизации (например, денатурированные офтальмологические вискоэластики, оставшиеся на многоразовом инструментарии, стабильные к воздействию тепла эндотоксины, сульфатные примеси после автоклавирования паром).
К отличительным признакам TASS-синдрома относятся:
- Раннее начало (уже через 12-24 часа после операции)
- Отек роговицы от лимба до лимба, вторичный по отношению к распространенному повреждению слоя эндотелиальных клеток
- Повреждение радужной оболочки (фиксированный, расширенный или неправильной формы зрачок, дефекты просвечивания радужной оболочки)
- Высокое ВГД вследствие повреждения трабекулярной сети
- Отсутствие витрита (наиболее важная характеристика TASS-синдрома, поскольку он характеризуется главным образом воспалением переднего сегмента глаза, в то время как при эндофтальмите вовлекается задний сегмент).
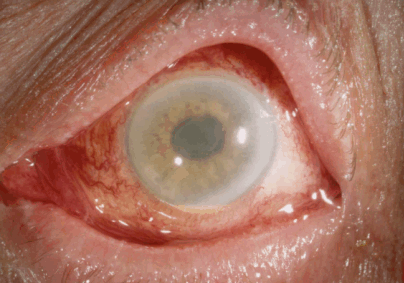
Рис. 2. Отёк роговицы, деформация зрачка и гипопион у пациента с TASS-синдромом [6]
Лечение TASS-синдрома включает в себя интенсивное применение местных кортикостероидов (и иногда пероральных).
Лечение острого послеоперационного эндофтальмита
Основными методами лечения являются витрэктомия и интравитреальное введение антибиотиков. ESCRS рекомендует при наличии витреоретинального хирурга и оснащенной операционной проводить стандартную трехпортовую центральную или полную витрэктомия по принципу «Ubi pus ibi evacuat» («Где гной, там очищай»). При центральной витрэктомии остается часть основы стекловидного тела, в то время как более полная витрэктомия сопровождается риском ятрогенного отслоения сетчатки, что является потенциальной катастрофой. Данный выбор остается за витреоретинальным хирургом.
После того, как витрэктомия выполнена, через один из разрезов склеры с использованием иглы диаметром 25-30G интравитреально вводятся антибиотики. В случае выполнения полной витрэктомии дозу следует уменьшить на 50 %. Данную инъекцию следует проводить медленно, в течение 1-2 минут, в середину стекловидного тела, направляя конец иглы вверх, подальше от макулы. Отдельные шприцы и отдельные иглы, для меньшей вероятности контаминации, вводятся через уже имеющееся отверстие. Затем интравитреально вводится дексаметазон (не содержащий консервантов).
Когда операцию «золотого стандарта» невозможно выполнить вследствие отсутствия витреоретинального хирурга и витреоретинальной операционной, приемлемым вариантом является проведение биопсии стекловидного тела с интравитреальным введением антибиотиков без последующей терапевтической витрэктомии («серебряный стандарт»). Поскольку простая аспирация с помощью иглы зачастую безуспешна, ее можно провести с помощью портативного витректора.
Дозы интравитреальных антибиотиков следует выбирать особо тщательно, потому что зазор для ошибки между терапевтической дозой и токсичностью является узким, особенно для аминогликозидов (гентамицин в дозе 200 мкг является эффективным, но в дозе 400 мкг может быть токсичным, вызывая макулярный инфаркт).
Комбинацией лекарственных средств первого выбора являются ванкомицин (1 мг) сцефтазидимом (2 мг).
Комбинация второго выбора: ванкомицин (1 мг) вкомбинации самикацином (0,4 мг), особенно у пациентов с чувствительностью к ß-лактамам. Несмотря на синергизм между ванкомицином и амикацином в отношении грамположительных микроорганизмов, многие хирурги избегают применения аминогликозидов для эрадикации грамотрицательных бактерий из-за риска ретинальной токсичности.
И. А. Фролычев предлагает введение раствора антибиотика в витреальную полость сочетать с тампонадой ПФОС [2], ввиду того, что раствор антибиотика активно перемещается с пузырем ПФОС в зависимости от положения тела пациента («на спине» — максимальное воздействие у зубчатой линии сетчатки, в положении стоя или сидя — воздействие на верхние отделы сетчатки, «на боках» — воздействие на назальную или височную половину сетчатки). При этом риск токсического локального воздействия растворов антибиотиков значительно снижается. При использовании ПФОС уменьшается риск токсического поражения макулярной зоны струей вводимого интравитреально АБ препарата. ПФОС, создавая противодействие вводимой струе препарата, препятствует токсическому повреждению макулы, освобождает хирурга от необходимости вводить раствор антибиотика медленно в течение 2-3 минут.
Тяжелый острый гнойный эндофтальмит следует лечить с использованием дополнительной системной антибиотикотерапии теми же лекарственными препаратами, которые используются для интравитреальной терапии. Такая схема лечения поможет поддерживать значимые интравитреальные концентрации лекарственного препарата на протяжении более длительного времени путем уравновешивания диффузии введенного препарата из глаза.
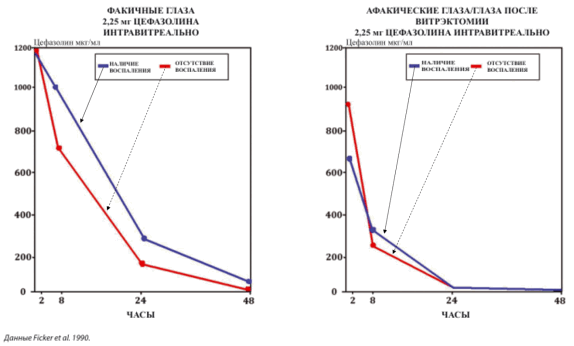
Рис. 3. Скорость выведения цефазолина из стекловидного тела [1]
Лечение хронического послеоперационного эндофтальмита
В отличие от острого послеоперационного эндофтальмита, представляющего собой неотложное состояние, в случае возможного хронического послеоперационного эндофтальмита имеется больше времени для правильной постановки диагноза и выбора вида лечения.
При хроническом эндофтальмите микроорганизмы изолированы в капсулярном мешке и защищены биопленкой; также они могут иметь внутриклеточную локализацию внутри макрофагов, где их не достигают антибиотики, часто используемые для лечения острого эндофтальмита. Однако некоторые антибиотики, такие как кларитромицин, хорошо абсорбируются при приеме внутрь, хорошо проникают в глаз, обладают антибиопленочными свойствами и концентрируются внутри нейтрофилов и макрофагов, где они в лучшей степени способны уничтожать внутриклеточные грамположительные бактерии.
Некоторые исследования [10,11] нашли применение кларитромицина эффективным и рекомендовали использовать дозу в 500 мг 2 раза в день на протяжении 2-4 недель. Добавление промывания ванкомицином капсулярного мешка повышало частоту ответа на лечение в случаях инфекции, вызванной видами Propionibacterium [13].
Для лечения хронического эндофтальмита существует несколько вариантов хирургических вмешательств:
- Промывание антибиотиком капсулярного мешка при первичной пункции передней камеры или при последующем вмешательстве в случаях положительного результата бакпосева
- Интравитреальная инъекция антибиотиков (ИИАБ)
- Витректомия рars plana (ВПП) с ИИАБ
- ВПП с частичной капсулэктомией (ЧК) и ИИАБ
- ВПП с тотальной капсулэктомией (ТК), ИИАБ, извлечением или заменой ИОЛ (зИОЛ)
Чем более агрессивным является лечение, тем ниже частота рецидивирования [14].
Профилактика
Основные этапы антисептики впредоперационном периоде
1. Обязательная обработка повидон-йодом роговицы и конъюнктивального мешка
2. Обязательная обработка повидон-йодом окологлазничной области
3. Использование медицинской спецодежды (халат, перчатки и пр.) и специального режима вентиляции в операционной
4. Обкладывание глаза салфетками,
заклеивание век и ресниц (не обрезать)
Основой профилактики послеоперационного эндофтальмита является соблюдение правил асептики и антисептики. Применение местных антибиотиков в каплях перед операцией не показано ввиду низкой эффективности и отсутствия доказательной базы [12].
Основные термины (генерируются автоматически): стекловидное тело, ESCRS, токсическое повреждение, EVS, передний сегмент глаза, антибиотик, выраженный болевой синдром, глазное яблоко, передняя камера глаза, лекарственный препарат.
Ключевые слова
Похожие статьи
Характер повреждения зрительного анализатора при алкогольной.
Глаза являются самой выразительной частью лица, и, как писал выдающийся русский писатель А. П. Чехов: «Глаза— это зеркало души».
Биомикроскопические исследования не выявили каких-либо особенностей в состоянии переднего отрезка глаза и стекловидного тела [3].
Современные подходы в лечении катаракты | Статья в журнале.
Деструкция стекловидного тела. Больные жалуются на постепенное снижение остроты зрения, как правило, возникающее на фоне воспалительных заболеваний глаза. При биомикроскопии хрусталик прозрачен, выявляется деструкция передних отделов стекловидноготела.
Влияние физических факторов окружающей среды на.
Передняя камера глаза — это пространство между роговицей и радужкой.
Стекловидное тело — гелеобразная прозрачная субстанция, расположенная в заднем отделе глаза.
Характер повреждения зрительного анализатора при алкогольной.
Дистрофия роговицы Когана: клиника, диагностика, лечение
5. Эндотелий является внутренней частью роговицы, обращенной в переднюю камеру глаза и омываемой внутриглазной жидкостью.
Симптоматическая клиника дистрофии связана с синдромом рецидивирующей эрозии роговицы и временным незначительным снижением.
Почему глаза двигаются вместе? | Статья в журнале.
Он находится в передней части глазного яблока. В преломлении света участвует также вещество, которым заполнена большая часть (2/3 объема) глазного яблока
Современные техники стабилизации изображения на сетчатке.
Первые способы фиксации стимуляции на сетчатке глаза включали в себя полное обездвиживание глаз [1]. Затем
Такие методы позволяли стабилизировать воспринимаемы объекты на глазном яблоке таким образом, что он перемещался вместе с движением взора с.
Клинические проявления, диагностика и исходы невритов.
Весь глаз по форме похож на шар и называется глазным яблоком (рис. 1). Рис. 1. Глазное яблоко. Когда свет достигает сетчатки, она
Основные термины (генерируются автоматически): поражение глаз, суставной синдром, ювенильный ревматоидный артрит, послеоперационный.
Офтальмологическая реабилитация больных ювенильным.
Деструкция стекловидного тела отмечалась у 9 (28 %), синехии почти у трети пациентов, катаракта — у 7 (22 %) больных.
Артикулярный синдром был вторичным по отношению к патологии глаз в 7 (22 %) случаях (артрит возник через 2-7 лет, в среднем 3,5 года).
Особенности течения и реабилитация больных ювенильным.
Артикулярный синдром был вторичным по отношению к патологии глаз в 7 (22 %) случаях (артрит возник через 2- 7 лет, в среднем 3,5 года).
Инфекционный и стерильный эндофтальмит после интравитреальных инъекций: дифференциальная диагностика, профилактика, лечение

Эндофтальмит — редкое, но крайне тяжёлое осложнение различных внутриглазных вмешательств. В статье проанализированы данные мировой литературы о частоте возникновения, дифференциальной диагностике, методах профилактики и лечения эндофтальмитов после интравитреальных инъекций.
Полный текст
ВВЕДЕНИЕ
Эндофтальмит (греч. endo — внутри + греч. ophthalmos — глаз) — воспаление внутренних оболочек глазного яблока, возникающее, как правило, в результате попадания внутрь глаза инфекционных агентов (бактерий, грибков, паразитов).
В последние годы интравитреальные инъекции (ИВИ) получили широкое распространение в офтальмологической практике. Количество ежегодных инъекции с 1991 г. возросло более чем в 160 раз, а с 2008 г. в мире выполняется свыше 1 миллиона инъекций в год [49]. В связи с этим чрезвычайно важны своевременная диагностика и лечение данного осложнения.
Эндофтальмиты, возникающие после интравитреальных инъекций, могут быть как инфекционными, так и неинфекционными. Проведение дифференциальной диагностики этих состояний и ранняя постановка правильного диагноза имеет большое значение, так как схемы лечения данных осложнений принципиально различаются.
ЭТИОПАТОГЕНЕЗ
Спектр возбудителей инфекционных эндофтальмитов разнообразен. Он зависит от экологических, географических и климатических факторов, а также от типа выполняемых операций [2]. Чаще возбудителями являются коагулаза-негативные стафилококки, S. aureus, бета-гемолитические стрептококки, грамотрицательные бактерии (включая H. influenza, Ps. aeruginosa) [33, 42, 60]. Реже инфекционные эндофтальмиты могут быть вызваны грибковой инфекцией (Candida sp., Aspergillus sp., Fusarium sp.) и простейшими [33].
При бактериальных эндофтальмитах различают три фазы: инкубации, развития и разрушения [47]. Фаза инкубации не имеет чётких клинических признаков и продолжается в среднем 16-18 часов [47]. Для наиболее частых возбудителей эндофтальмита коагулаза-негативных стафилококков и S. Aureus наибольшая инфильтрация наблюдается только на третий день после инфицирования [48]. Более раннее развитие процесса свидетельствует о его тяжести [2].
В случае первичного попадания возбудителя в задний сегмент глаза воспаление вначале развивается в передней камере и в течение 7 дней сопровождается специфическим иммунным ответом макрофагов и лимфоцитов в полости стекловидного тела. Через три дня после развития внутриглазной инфекции могут быть обнаружены специфические антитела к возбудителям, которые содействуют их устранению путём связывания и фагоцитоза. Это может явиться причиной отрицательных результатов микробиологических исследований на фоне тяжёлого воспалительного процесса в глазу [2, 48]. Медиаторы воспаления, вырабатываемые цитокинами, не только привлекают дополнительные лейкоциты, но и могут напрямую приводить к повреждению сетчатки и способствовать развитию витреоретинальной пролиферации (фаза разрушения) [2, 47].
В литературе описываются случаи развития стерильного эндофтальмита после любого из применяемых для интравитреальных инъекций препаратов (бевацизумаба, ранибизумаба, афлиберцепта, триамцинолона, окриплазмина) [21, 23, 27, 41, 58, 61].
Причины и механизм развития неинфекционного эндофтальмита до конца неизвестны. Согласно одной из гипотез воспаление при стерильном эндофтальмите может быть результатом иммунной реакции оболочек глаза на эндотоксины во введённом препарате [51]. Согласно этой теории эндотоксины появляются в препарате вследствие нарушения правил хранения препарата. В рекомендациях производителей ингибиторов ангиогенеза указано, что препарат необходимо хранить в холодильнике при температуре 2-8 °C, в защищённом от света месте, в оригинальной упаковке. Препарат должен быть использован в течение 8 часов после открытия [64]. Любые нарушения правил хранения и применения препарата могут привести к появления эндотоксинов и увеличению его иммуногенности [28, 39].
ЧАСТОТА РАЗВИТИЯ ЭНДОФТАЛЬМИТОВ ПОСЛЕ РАЗЛИЧНЫХ ВИДОВ ХИРУГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
До начала ХХ в. частота развития эндофтальмитов после экстракции катаракты была очень высокой и составляла примерно 10 %. После перехода от интракапсулярной к экстракапсулярной экстракции катаракты (1970-1990) количество послеоперационных эндофтальмитов сократилось в Европе до 0,12 % [38] и в США до 0,072 % [35]. По данным ряда ретроспективных исследований, внедрение в практику факоэмульсификации и переход к полностью роговичному разрезу (1990-2000) привели к увеличению количества послеоперационных эндофтальмитов до 0,3-0,5 % [37, 60]. На сегодняшний день информация о частоте развития эндофтальмита после хирургического лечения катаракты сильно варьирует — от 0,05 до 0,3 % [14, 26].
Эндофтальмит после трабекулэктомии встречается от 0,1 до 1,5 %, в раннем послеоперационном периоде составляет в среднем 0,1 %, в позднем — 0,2-0,7 % [4, 36]. После витрэктомии 20G частота развития эндофтальмита составляет 0,018-0,07 % [9, 40], а после микроинвазивной бесшовной витрэктомии 23G, 25G она гораздо выше — 0,23-0,84 % [40, 53]. Согласно данным разных авторов частота развития эндофтальмита после сквозной кератопластики может колебаться от 0,08 до 0,2 % [15, 56].
По данным ряда ретроспективных исследований, риск развития постинъекционного инфекционного эндофтальмита колеблется от 0,022 до 0,16 % [7, 17, 65]. Однако в опубликованных результатах клинического исследования CATT (The Comparison of Age-related Macular Degeneration Treatments Trial) частота развития инфекционного эндофтальмита составила 0,7 % после интравитреальных инъекций ранибизумаба и 1,2 % после бевацизумаба [10]. В ряде обзорных публикаций частота развития инфекционного эндофтальмита после инъекций бевацизумаба колеблется от 0,014 до 0,082 % [20, 34, 43, 55]. Большинство исследований не выявили достоверной разницы в частоте развития эндофтальмита между различными ингибиторами ангиогенеза [17, 27, 32, 41].
После интравитреальной инъекции возможно также развитие и неинфекционного воспаления в глазу [8, 13, 44]. Стерильный эндофтальмит чаще может возникать у пациентов с перенесенным ранее увеитом на этом глазу [61]. По данным L. Wu et al. и D.Y. Chong et al., частота развития неинфекционного эндофтальмита после интравитреальной инъекции составляет 0,09-1,1 % [8, 65], по результатам исследования CATT — 0,2 % [10]. Кроме того, данная воспалительная реакция на введение препарата возникает чаще у пациентов с сопутствующим сахарным диабетом (в стадии субкомпенсации или декомпенсации), хронической почечной недостаточностью, синдромом приобретённого иммунного дефицита или принимающих иммуносупрессивные препараты [42].
Проведены исследования по сравнению заболеваемости эндофтальмитом после интравитреальных инъекций, выполненных в операционной и кабинете врача. По данным ретроспективного анализа 40 011 ИВИ, выполненных в условиях операционной, эндофтальмит развился в 0,0075 % случаев [6]. При проведении процедуры в кабинете частота случаев эндофтальмита составляет от 0,029 до 0,09 % от всех ИВИ [7, 10, 50].
Следует отметить, что наличие в анамнезе интравитреальных инъекций не увеличивает риск развития эндофтальмита, а также тяжесть его течения [8, 67].
КЛИНИЧЕСКАЯ КАРТИНА И ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ИНФЕКЦИОННОГО И СТЕРИЛЬНОГО ЭНДОФТАЛЬМИТОВ
Постинъекционный инфекционный эндофтальмит, как правило, протекает в острой форме. Первые признаки заболевания обнаруживаются на 3-5-й день после интравитреальной инъекции. Симптомами начинающегося эндофтальмита являются сильная боль в глазу, резкое снижение остроты зрения, светобоязнь. По данным The Endophthalmitis Vitrectomy Study (EVS) сильная боль в глазу встречается в 94 % случаев [14]. При биомикроскопии обращает на себя внимание отёк век, хемоз, выраженная конъюнктивальная инъекция, отёк роговицы, опалесценция влаги передней камеры, фибрин, гипопион, наличие помутнений в стекловидном теле, ослабление розового рефлекса с глазного дна. D.R. Fintak et al. наблюдали наличие гипопиона в 78 % случаев инфекционного эндофтальмита [17]. Прогноз в отношении зрительных функций неблагоприятный.
Таблица 1. Дифференциальная диагностика инфекционного и неинфекционного эндофтальмитов [3, 52]
Table 1. Differential diagnosis of infectious and noninfectious endophthalmitis [3, 52]
слабая или практически отсутствует
выраженная, нередко хемоз
Состояние стекловидного тела
большое количество воспалительных клеток, помутнений (абсцесс)
Инфильтраты в сетчатке
Дифференциальная диагностика инфекционного и стерильного эндофтальмитов основывается на различиях в клинической картине, а также на результатах микробиологического исследования посева влаги передней камеры и стекловидного тела. Однако следует учитывать тот факт, что отсутствие роста в посеве не означает отсутствие инфекционного агента. Примерно в 20-30 % случаев не удаётся выявить возбудителя [29]. В таких случаях при постановке диагноза необходимо ориентироваться только на клиническую картину.
ЛЕЧЕНИЕ
Вопросы лечения пациентов с эндофтальмитом всегда оставались спорными. В 1976 г. на животных в случаях эндофтальмита, вызванного S. aureus, был продемонстрирован лучший эффект комбинированного лечения (сочетание задней витрэктомии с интравитреальным введением антибиотиков в стекловидное тело) по сравнению с выполнением только задней витрэктомии [11]. В 1987 г. A.R. Talley et al. оценили роль витрэктомии в лечении послеоперационных бактериальных эндофтальмитов и продемонстрировали, что при комбинированной терапии эффект достигается в течение 14 дней после оперативного вмешательства [62]. В другом исследовании, проведённом на афакичных глазах кроликов, сначала всем в стекловидное тело вводили ванкомицин. Затем одной группе испытуемых выполняли витрэктомию, а другой — продолжали введение антибиотика. Значимой разницы в результатах лечения эндофтальмита не было отмечено [18].
Стандартом лечения острого инфекционного эндофтальмита при снижении зрения до светоощущения, по данным EVS, является задняя витрэктомия через плоскую часть цилиарного тела. В случае когда острота зрения составляет движение руки у лица и выше — нет существенной разницы между задней витрэктомией и введением антибиотика в стекловидное тело. Системная антибактериальная терапия в лечении эндофтальмита не эффективна, по данным того же исследования [16].
Согласно рекомендациям ESCRS по профилактике и лечению эндофтальмитов после факоэмульсификации задняя витрэктомия является «золотым стандартом» независимо от остроты зрения пациента. При отсутствии возможности выполнения задней витрэктомии рекомендовано ввести в стекловидное тело антибиотики (в разных шприцах!): 1 мг ванкомицина (в 0,1 мл физиологического раствора) в сочетании, например, с 2 мг цефтазидима (в 0,1 мл физиологического раствора) или с 400 мкг амикацина (в 0,1 мл физиологического раствора) [5].
Из прогностических факторов, наиболее сильно влияющих на перспективы сохранения зрительных функций, неблагоприятным является снижение остроты зрения до светоощущения. Кроме того, к факторам риска относятся: пожилой возраст больного, наличие роговичных инфильтратов, рубеоз радужки, дефекты задней капсулы хрусталика, сопутствующий сахарный диабет, офтальмогипертензия и гипотония и отсутствие розового рефлекса с глазного дна [2]. Чем выше острота зрения при госпитализации, тем лучше эффект от проводимого лечения, независимо от его вида [16].
В случае постановки диагноза псевдоэндофтальмита достаточным считается лечение только глюкокортикостероидными препаратами [24]. В исследовании P. Hahn et al. показано, что инвазивных вмешательств (интравитреальное введение антибиотиков, витрэктомия) для лечения неинфекционного эндофтальмита не требуется [24].
ПРОФИЛАКТИКА
Основным источником инфицирования при эндофтальмите является бактериальная флора конъюнктивы [45]. Однако на сегодняшний день отсутствует единый стандарт выполнения интравитреальных инъекций. В связи с этим вызывает множество споров необходимость профилактического назначения антибактериальных препаратов. Данных, подтверждающих снижение риска развития эндофтальмита благодаря предварительному назначению антибиотиков, нет [1, 7, 31]. Ретроспективное исследование «случай - контроль» (117 171 ИВИ с антибиотиками или без) показало, что использование антибиотиков не снижает риск эндофтальмита, напротив, наблюдалась тенденция к повышению риска [59]. Результаты исследования, выполненного на кафедре офтальмологии ПСПбГМУ им. акад. И.П. Павлова, показали отсутствие преимуществ назначения местных антибактериальных препаратов перед ИВИ [1]. Кроме того, не доказана необходимость инстилляции антибиотиков и после интравитреального введения. Согласно данным W. Haas et al. частое применение антибактериальных средств приводит к увеличению риска развития бактериальной устойчивости [22]. Местное применение фторхинолонов приводит к росту мультирезистентной конъюнктивальной флоры (90 % S. epidermidis) уже после четырёх ИВИ [12]. Учитывая этот факт, ряд исследователей выступает за отказ от применения антибиотиков как до, так и после интравитреальных инъекций препаратов в пользу антисептиков [22, 66].
На сегодняшний день единственным доказанным способом профилактики развития эндофтальмита является применение перед инъекцией раствора повидон-йода (Бетадин, Betadine, 10 % Povidone-iodine, EGIS PHARMACEUTICALS) [2, 7, 57]. Рекомендована инстилляция 5 % раствора повидон-йода в конъюнктивальную полость непосредственно перед инъекцией. Время экспозиции раствора Бетадина — 2-3 минуты. После инъекции также необходима обработка операционного поля антисептиком. Повидон-йод является препаратом выбора для профилактики инфекционных осложнений ИВИ, так как обладает широким спектром активности в различных концентрациях, начинает действовать уже через 15-120 секунд после инстилляции. Проспективное рандомизированное исследование 131 глаза показало, что через 30 секунд после нанесения 5 % раствора повидон-йода происходит значительное снижение бактериального обсеменения [19]. Подготовка глазной поверхности для ИВИ с использованием только 5 % повидон-йода не сопровождается ростом микробной резистентности, также отсутствуют данные по анафилаксии [30, 66]. Кроме того, он безопасен при случайном попадании внутрь глаза во время инъекции [63]. При наличии аллергии на йод возможно использование водного раствора хлоргексидина. Следует помнить, что спиртовой раствор хлоргексидина токсичен для эпителия роговицы [25].
Отдельного внимания заслуживает необходимость соблюдения правил хранения препаратов, предназначенных для интравитреального введения (в холодильнике при температуре 2-8 °C, в защищённом от света месте, в оригинальной упаковке). Препарат должен быть использован в течение 8 часов после открытия [63]. Также следует избегать деления препарата (один флакон для одного пациента).
Тщательное изучение случаев инфекционного эндофтальмита позволяет предполагать, что причиной их возникновения является нарушение процедуры подготовки к проведению инъекции, а не сам лекарственный препарат или техника выполнения инъекции.
Необходимы обязательные осмотры пациента перед инъекцией для исключения воспалительных явлений со стороны придаточного аппарата и переднего отрезка глазного яблока и после интравитреального введения для исключения первых признаков внутриглазного воспаления.
ЗАКЛЮЧЕНИЕ
Инфекционный и неинфекционный эндофтальмиты являются грозными осложнениями после интравитреальных вмешательств. Оба состояния имеют схожую клиническую картину, но принципиально разную тактику лечения.
При появлении признаков внутриглазного воспаления нужно: тщательно собрать анамнез, выполнить ультразвуковое B-сканирование, взять посев на микрофлору влаги передней камеры и стекловидного тела. При подтверждении диагноза инфекционного эндофтальмита необходимо выполнение задней витрэктомии и/или введение антибиотиков (ванкомицин + амикацин; ванкомицин + цефтазидим) в стекловидное тело.
Если при суммировании данных клинической картины и результатов микробиологического исследования, инфекционный эндофтальмит не подтверждается, то таких пациентов следует лечить консервативно, применяя местную и системную кортикостероидную терапию. При стерильном эндофтальмите отмечается быстрый ответ на проводимую противовоспалительную терапию. Отсутствие положительной динамики от полученного лечения необходимо расценивать как инфекционное воспаление и перейти к соответствующей тактике лечения.
Эндофтальмит
Эндофтальмит - это абсцедирующее воспаление внутренних структур глаза, приводящее к скоплению гнойного экссудата в стекловидном теле. При эндофтальмите отмечаются боли в глазном яблоке, отек и покраснение век и конъюнктивы, значительное понижение остроты зрения, гипопион. В диагностике эндофтальмита используется визометрия, исследование полей зрения, биомикроскопия глаза, диафаноскопия, офтальмоскопия, электроретинография, УЗИ глаза. Комплексное лечение эндофтальмита включает антибиотикотерапию, дезинтоксикационную, противовоспалительную, рассасывающую терапию; интравитреальные, парабульбарные или субконъюнктивальные инъекции, парацентез и промывание передней камеры; при тяжелом течении эндофтальмита - витрэктомию.
МКБ-10
Общие сведения
Гнойные воспаления тканей глазного яблока относятся к числу грозных состояний в офтальмологии, требующих оказания специализированной неотложной помощи. Гнойный процесс при эндофтальмите прогрессирует стремительно, иногда в течение нескольких часов приводя к развитию панофтальмита - тотального воспаления и расплавления всех оболочек глазного яблока и тканей орбиты. По различным данным, частота слепоты, функциональной и анатомической гибели глаза, приводящей к энуклеации, у пациентов с внутриглазной инфекцией достигает 28 - 89%. Данные обстоятельства ставят перед офтальмологами задачу своевременной профилактики, раннего выявления и адекватного лечения инфекций глазного яблока.
Причины эндофтальмита
Экзогенные причины
Экзогенные случаи инфицирования внутриглазных тканей преимущественно связаны со следующими факторами:
- проникающими ранениями глаз (95-97 %),
- операциями на глазном яблоке (2-4%),
- прободными гнойными язвами роговицы,
- инфицированными ожогами глаз.
В структуре механических повреждений глаз, сопровождающихся развитием эндофтальмита, преобладает детский травматизм (40 %), производственные (30%) и сельскохозяйственные (25-50%) травмы. Проникновение в глаз инородного тела значительно повышает риски возникновения эндофтальмита. Послеоперационный эндофтальмит чаще развивается вследствие экстракции катаракты с имплантацией заднекамерной ИОЛ.
При экзогенном инфицировании глаза выделяют первичную и вторичную микробную инвазию. В первом случае микробы попадают в глубокие структуры глаза в момент проникающего ранения или инвазивного вмешательства, а воспалительная реакция развивается уже в первые 2-3 суток. При вторичной микробной инвазии инфицирование развивается в поздние сроки вследствие неадекватной первичной обработки раны, ее зияния, размозжения краев и т. п.
Эндогенные причины
Эндогенный механизм развития эндофтальмита встречается в 1-2 % случаев и связан с гематогенным заносом микробных возбудителей в капилляры радужки и ресничного тела из отдаленных воспалительных очагов в организме при:
- фурункулах, абсцессах, флегмонах,
- синуситах, тонзиллите,
- пневмонии,
- остеомиелите,
- сепсисе,
- менингите,
- септическом эндокардите и др.
Возбудители экзогенного и эндогенного эндофтальмита многообразны. Наиболее часто при бактериологическом исследовании выявляются стафилококки, стрептококки, коринебактерии, протей, гемофильная палочка, синегнойная палочка, нейссерии, энтеробактерии, клебсиелла, пневмококки и различные полимикробные ассоциации. Опасную разновидность представляет грибковый эндофтальмит, который может вызываться более чем двадцатью разновидностями грибков (рода акремониум, кандида, аспергилл, цефалоспориум, нейроспора и др.).
Патогенез
Патогенез эндофтальмита при экзогенном инфицировании многоплановый. В случае нарушения целостности роговицы или склеры микроорганизмы проникают внутрь стекловидного тела, где беспрепятственно размножаются. Образуется внутриглазной очаг инфекции, который быстро распространяется на все оболочки глаза. В свою очередь, нарушение иммунологической изолированности глаза сопровождается аутоиммунной воспалительной реакцией, способствующей ослаблению сопротивляемости инфекции, и агрессивному течению эндофтальмита и панофтальмита.
Образующийся гнойный экссудат приводит к увеиту, расплавлению сосудистой и сетчатой оболочек, инкапсуляции с образованием шварт. Швартообразование в последующем вызывает тракции и отслойку сетчатки с исходом в гипотензию и атрофию глазного яблока.
Симптомы эндофтальмита
Эндофтальмит может протекать по типу отграниченного очага в глазу (абсцесса стекловидного тела) либо диффузного процесса; иногда встречается смешанная форма. По степени тяжести симптоматики выделяют легкую, среднюю и тяжелую степени эндофтальмита.
Экзогенный эндофтальмит развивается на 2-3 сутки после механического повреждения глаза. Прогрессирующее течение заболевания сопровождается болью в глазном яблоке, нарастающим снижением остроты зрения иногда до светоощущения, плавающими помутнениями в поле зрения. Внешние изменения глаза характеризуются умеренным отеком век и конъюнктивы, резкой смешанной инъекцией глазного яблока. Могут развиваться признаки иридоциклита. Характерной чертой эндофтальмита является формирование абсцесса в стекловидном теле, который просвечивает через зрачок желтоватым свечением.
Осложнения
При эндофтальмите тяжелой степени развивается выраженный хемоз, гипопион и гноетечение. Эндогенные эндофтальмиты, протекающие на фоне иммунодефицита или интоксикации, могут носить двусторонний характер. Прогрессирование эндофтальмита приводит к переходу в панофтальмит, что угрожает анатомической и функциональной гибелью глаза, риском развития менингита.
Диагностика
Комплексное офтальмологическое обследование при эндофтальмите позволяет оценить тяжесть процесса и выработать лечебную тактику. При подозрении на эндофтальмит проводится:
- Визометрия. Типичная офтальмологическая картина при эндоофтальмите характеризуется снижением остроты зрения: при легкой степени - частичным, при средней - выраженным, при тяжелой - значительным снижением или отсутствием зрения.
- Исследование полей зрения. Поле зрения сужено или отсутствует.
- Биомикроскопия. Проведение биомикроскопии выявляет смешанную инъекцию глазного яблока, наличие преципитатов на поверхности роговицы, гипопиона, гиперемию и инфильтрацию радужки, образование задних синехий
- Диафаноскопия глаза. Диафаноскопия глаза в проходящем свете позволяет обнаружить желтовато-серый зрачковый рефлекс, свидетельствующий об образовании абсцесса в стекловидном теле. При обратном развитии эндофтальмита ввиду формирования на месте гнойника соединительной ткани рефлекс приобретает молочно-белый оттенок.
- Офтальмоскопия. Проведение прямой и обратной офтальмоскопии при эндофтальмите затруднено и частично возможно только при легкой степени тяжести заболевания.
- Измерение ВГД. Внутриглазное давление при эндофтальмите обычно снижено.
- УЗИ глаза. Выявляет ограниченные или тотальные помутнения в стекловидном теле. Для верификации возбудителя проводится посев культуры из стекловидного тела и водянистой влаги.
- Элекрофизиологические исследования. Показатели электроретинографии могут соответствовать или быть близкими к норме (при очаговом эндофтальмите), значительно снижаться вплоть до исчезновения (при диффузном или смешанном эндофтальмите).
Последствия эндофтальмита у детей необходимо дифференцировать от злокачественной опухоли сетчатки - ретинобластомы.
Лечение эндофтальмита
Лечение эндофтальмита проводится в условиях отделения хирургической офтальмологии. Сразу же после установления диагноза назначается:
- Системная терапия: ударные дозы антибиотиков широкого спектра действия, сульфаниламиды, антимикотические средства, противовоспалительные препараты (НПВП, кортикостероиды), мощная дезинтоксикационная терапия, общеукрепляющая терапия (витаминотерапия, аутогемотерапия), рассасывающая терапия (ферменты).
- Внутриглазные инъекции. Для достижения максимальной концентрации антибактериальных препаратов внутри глаза проводится их внутривенное, внутримышечное, субконъюнктивальное, ретробульбарное, парабульбарное, супрахориоидальное, интравитреальное введение. Одновременно назначаются инстилляции противомикробных глазных капель и аппликации мазей.
- Пункция стекловидного тела. При витреите или гипопионе производится лечебно-диагностическая пункция стекловидного тела с забором экссудата для бактериального посева и введением антибиотика в стекловидное тело. При эндофтальмите возможно проведение внутриартериальной офтальмоперфузии лекарственных препаратов через надглазничную артерию. Для лечения эндофтальмита используются цефалоспорины, гликопептиды, пенициллины, аминогликозиды, фторхинолоны, макролиды и др.
При неэффективности интенсивной консервативной терапии эндофтальмита возникает необходимость хирургического удаления части стекловидного тела - витрэктомии. В послеоперационном периоде антибиотикотерапия должна быть продолжена.
Прогноз и профилактика
Своевременное комплексное лечение эндофтальмита, начатое в легкой стадии, позволяет сохранить зрительные функции. В более поздних стадиях зачастую удается сохранить глаз как анатомический орган, но спасти зрение практически невозможно. Исходом эндофтальмита чаще всего является субатрофия и атрофия глазного яблока. При прогрессировании эндофтальмита в панофтальмит приходится прибегать к энуклеации глазного яблока.
Профилактика экзогенного инфекционного эндофтальмита требует предупреждения травм глаза, проведения адекватной ПХО раны при проникающих ранениях, своевременного удаления инородных тел конъюнктивы и роговицы, грамотного проведения операций на структурах глаза. Для исключения развития эндогенного эндофтальмита необходима санация фокальных гнойных очагов и лечение общих септических состояний.
Отслойка сетчатки
Отслойка сетчатки - патология сетчатой оболочки глаза, при которой происходит ее отделение от подлежащей хориоидеи (сосудистой оболочки). Отслойка сетчатки сопровождается резким ухудшением зрения, появлением пелены перед глазом, прогрессирующим сужением поля зрения, мельканием «мушек», «искр», «вспышек», «молний» и т. д. Диагностику осуществляют с помощью визометрии, периметрии, тонометрии, биомикроскопии, офтальмоскопии, УЗИ глаза, электрофизиологических исследований. Лечение проводится хирургическими (пломбирование склеры, баллонирование склеры, трансцилиарная витрэктомия, витреоретинальная операция, криокоагуляция и др.) или лазерными методами (лазерная коагуляция сетчатки).
Отслойка сетчатки - опасное по исходу и наиболее сложное в хирургической офтальмологии патологическое состояние, которое ежегодно диагностируется у 5-20 человек на каждые 100 тыс. населения. На сегодняшний день отслойка сетчатки является ведущей причиной слепоты и инвалидности; при этом 70% случаев данной патологии развивается у лиц работоспособного возраста.
При отслойке сетчатки слой фоторецепторных клеток (палочек и колбочек) в силу определенных причин отделяется от наружного слоя сетчатки - пигментного эпителия, что приводит к нарушению трофики и функционирования сетчатой оболочки. Если вовремя не оказать специализированную помощь, отслойка сетчатки может довольно быстро привести к потере зрения.
Причины и классификация
По механизму формирования патологии различают регматогенную (первичную), травматическую и вторичную (экссудативную и тракционную) отслойку сетчатки.
- Развитие регматогенной отслойки сетчатки связано с разрывом сетчатой оболочки и попаданием под нее жидкости из стекловидного тела. Данное состояние развивается при истончении сетчатой оболочки в зонах периферических дистрофий. При различных видах дистрофий сетчатки (решетчатой, кистевидной, ретиношизис и др.) разрыв в дегенеративно измененной области может быть спровоцирован резкими движениями, чрезмерным физическим напряжением, черепно-мозговой травмой, падениями или возникать спонтанно. По виду дефекта первичная отслойка сетчатки может быть пузыревидной или плоской; по степени отслоения - ограниченной или тотальной.
- Отслойка сетчатки травматического генеза обусловлена травмами глаза (в т. ч. операционными). При этом отслоение сетчатой оболочки может произойти в любое время: непосредственно в момент травмы, стразу после нее или спустя несколько лет.
- Возникновение вторичной отслойки сетчатки наблюдается на фоне различных патологических процессов глаза: опухолевых, воспалительных (при увеитах, ретинитах, хориоретинитах), окклюзионных (окклюзия центральной артерии сетчатки), диабетической ретинопатии, серповидно-клеточной анемии, токсикозах беременности, гипертонической болезни и т. д.
- К вторичной экссудативной (серозной) отслойке сетчатки приводит скопление жидкости в субретинальном пространстве (под сетчаткой). Тракционный механизм отслойки обусловлен натяжением (тракцией) сетчатки фибринозными тяжами или новообразованными сосудами, врастающими в стекловидное тело.
Факторами, увеличивающими риск отслойки сетчатки, служат близорукость, астигматизм, дегенеративные изменения глазного дна, хирургические вмешательства на глазах, сахарный диабет, сосудистая патология, беременность, случаи аналогичной патологии у близких родственников и др.
В большинстве случаев отслойка сетчатки развивается в одном глазу, у 15% пациентов существует риск возникновения двусторонней патологии. При наличии двусторонней катаракты риск двухсторонней отслойки сетчатки увеличивается до 25-30%.
Симптомы отслойки сетчатки
В начале заболевания появляются симптомы-предвестники - так называемые световые феномены. К ним относятся вспышки света (фотопсии) перед глазами и зигзагообразные линии (метаморфопсии). При разрыве ретинального сосуда появляется мелькание «мушек» и черных точек перед глазами, боли в глазу. Данные явления свидетельствуют о раздражении светочувствительных клеток сетчатки, обусловленном тракцией со стороны стекловидного тела.
При дальнейшем прогрессировании отслойки сетчатки перед глазами появляется «пелена» (по словам больных, «широкая шторка, занавеска»), которая со временем увеличивается и может занять большую часть или все поле зрения.
Быстро снижается острота зрения. Иногда по утрам на некоторое время острота зрения улучшается, а поля зрения расширяются, что связано с частичным рассасыванием жидкости во время сна и самостоятельным прилеганием сетчатки. Однако в течение дня симптомы отслойки сетчатки возвращаются вновь. Временное улучшение зрительных функций происходит только при недавней отслойке сетчатки; при длительном существовании дефекта сетчатка утрачивает эластичность и подвижность, ввиду чего не может самостоятельно прилегать на место.
При разрыве сетчатки в нижних отделах глазного дна отслойка прогрессирует относительно медленно, в течение нескольких недель или месяцев, длительно не вызывая дефектов поля зрения. Такой вариант отслойки сетчатки весьма коварен, поскольку выявляется лишь при вовлечении в процесс макулы, что отягощает прогноз в отношении зрительных функций. При локализации разрыва сетчатки в верхних отделах глазного дна, напротив, отслоение сетчатой оболочки прогрессирует довольно быстро, в течение нескольких суток. Скапливающаяся в субретинальном пространстве жидкость, своим весом отслаивает сетчатку на значительной площади.
Если вовремя не оказать помощь, может произойти отслойка всех квадрантов сетчатки, включая макулярную область - полная, тотальная отслойка. При отслоении макулы возникают искривления и колебания предметов с последующим резким падением центрального зрения.
Иногда при отслойке сетчатки возникает диплопия, обусловленная снижением остроты зрения и развитием скрытого косоглазия. В некоторых случаях отслойка сетчатки сопровождается развитием вялотекущего иридоциклита, гемофтальма.
Диагностика отслойки сетчатки
При подозрении на отслойку сетчатки необходимо полное офтальмологическое обследование, поскольку ранняя диагностика позволяет избежать необратимой потери зрения. В случае наличия в анамнезе ЧМТ, пациент должен быть в обязательном порядке проконсультирован не только неврологом, но и офтальмологом для исключения разрывов и признаков отслойки сетчатки.
Исследование зрительных функций проводится путем проверки остроты зрения и определения полей зрения (статической, кинетической или компьютерной периметрии). Выпадения полей зрения возникают на стороне, противоположной отслойке сетчатки.
С помощью биомикроскопии (в т. ч. с использованием линзы Гольдмана) определяется наличие патологических изменений стекловидного тела (тяжей, деструкции, кровоизлияний), осматриваются периферические участки глазного дна. Данные тонометрии характеризуются умеренным снижением ВГД по сравнению со здоровым глазом.
Ключевая роль в распознавании отслойки сетчатки принадлежит прямой и непрямой офтальмоскопии. Офтальмоскопическая картина позволяет судить о локализации разрывов и их количестве, взаимоотношениях отслоенной сетчатки со стекловидным телом; позволяет выявлять участки дистрофии, требующие внимания при хирургическом лечении. При невозможности проведения офтальмоскопии (в случае помутнений в хрусталике или стекловидном теле) показано выполнение УЗИ глаза в В-режиме.
В диагностический комплекс при отслойке сетчатки включаются методы исследования энтопических феноменов (феномена аутоофтальмоскопии, механофосфен и др.).
Для оценки жизнеспособности сетчатки и зрительного проводятся электрофизиологические исследования - определение порога электрической чувствительности и лабильности зрительного нерва, КЧСМ (критической частоты слияния мельканий).
Лечение отслойки сетчатки
Выявление патологии требует немедленного хирургического лечения. Промедление с лечением данной патологии чревато развитием стойкой гипотонии и субатрофии глазного яблока, хронического иридоциклита, вторичной катаракты, неизлечимой слепоты. Основная цель лечения отслойки сетчатки заключается в сближении слоя фоточувствительных рецепторов с пигментным эпителием и создании спайки сетчатой оболочки с подлежащими тканями в зоне разрыва.
В хирургии отслойки сетчатки применяются экстрасклеральные и эндовитреальные методики: в первом случае вмешательство осуществляется на склеральной поверхности, во втором - внутри глазного яблока. К экстрасклеральным методам относятся пломбирование и баллонирование склеры.
Экстрасклеральное пломбирование предполагает подшивание к склере специальной силиконовой губки (пломбы), которая создает участок вдавления склеры, блокирует разрывы сетчатки и создает условия для постепенного всасывания скопившаяся под сетчаткой жидкости капиллярами и пигментным эпителием. Вариантами экстрасклерального пломбирования при отслойке сетчатки могут быть радиальное, секторальное, циркулярное (циркляж) пломбирование склеры.
Баллонирование склеры при отслойке сетчатки достигается путем временного подшивания в зону проекции разрыва специального баллонного катетера, при накачивании которого возникает эффект, аналогичный пломбированию (вал вдавления склеры и рассасывание субретинальной жидкости).
Эндовитреальные методы лечения отслойки сетчатки могут включать витреоретинальную операцию или витрэктомию. В процессе витрэктомии производится удаление измененного стекловидного тела и введение вместо него специальных препаратов (жидкого силикона, физиологического раствора, специального газа), которые сближают сетчатку и сосудистую оболочку.
К щадящим методам лечения отслойки сетчатки относятся криокоагуляция разрывов и субклинических отслоек сетчатки и лазерная коагуляция сетчатки, позволяющие добиться формирования хориоретинальной спайки. Криопексия и лазеркоагуляция сетчатки могут использоваться как для профилактики отслойки сетчатки, так и в лечебных целях самостоятельно или в сочетании с хирургическими методиками.
Прогноз зависит от давности патологии и своевременности лечения. Операция, проведенная в ранние сроки после развития отслойки сетчатки, обычно способствует благоприятному исходу.
В большинстве случаев отслойку сетчатки возможно предупредить. С этой целью пациентам с миопией, дистрофией сетчатки, сахарным диабетом, травмами головы и глаз необходимо регулярное профилактическое обследование у офтальмолога. Осмотр окулиста входит в стандарт ведения беременности и позволяет предотвратить отслойку сетчатки во время родов. Пациентам групп риска по возникновению отслойки сетчатки противопоказаны тяжелые физические нагрузки, подъем тяжестей, занятия некоторыми видами спорта.
При выявлении участков дистрофии сетчатки в профилактических целях проводится криопексия или лазеркоагуляция сетчатки.
Читайте также:
