Эндоскопические системы в офтальмохирургии. Варианты
Добавил пользователь Владимир З. Обновлено: 08.01.2026
New technologies in diagnostics of ophthalmic diseases
T.V. Chernyakova
Russian State Medical University
Purpose: To evaluate data of polarimetric laser scanning, determine the function of scanning laser polarimeter GDx VCC in a number of glaucoma diagnostic methods, to compare diagnostic value of scanning laser polarimetry (SLP), computer perimetry («Octopus») and computer campimetry («Campi»).
Materials and methods: 33 patients (56 eyes) at the age from 37 to 75 years old participated in the study. The main group consisted of glaucoma patients with initial stage of glaucoma (19 eyes), developed stage (12 eyes), severe stage (11 eyes). Control group included healthy persons (14 eyes). All patients underwent standard ophthalmologic examination, and scanning laser polarimetry GDx VCC, perimetry with «Octopus 101» (program dG2) and campimetry with «Campi» (programs Porog -120 and Porog -83) additionally.
Results: It was found that progress of glaucoma process leads to decrease of nerve fiber layer thickness. Polarimetric laser scanning was informative in diagnostics of developed and severe stages of glaucoma. In comparative examination of layer of nerve fibers with methods of SLP, computer perimetry, computer campimetry it was found that computer perimetry with «Octopus 101» (program dG2) and computer campimetry with Campi» (program Porog - 120) were more sensitive in diagnostics of initial and developed stages of glaucoma.
Conclusion: SLP allows getting precise mathematical calculation of nerve fiber layer thickness of peripapillary zone within the limits of estimated circle. In early diagnostics of glaucoma method of SLP is recommended for usage as additional method with compulsory central visual field examination by perimetry and/or campimetry.
В настоящее время в практике офтальмолога стали появляться новые приборы и технологии, способные оценивать структурные изменения диска зрительного нерва (ДЗН). Были созданы конфокальные сканирующие лазерные офтальмоскопы (КСЛО), оптические когерентные томографы (ОКТ) и сканирующие лазерные поляриметры (СЛП). ОКТ работает по принципу ультразвукового B-скана и оценивает оптический срез сетчатки. КСЛО оценивает поверхность исследуемой структуры и позволяет оценивать топографию всего ДЗН. Данный метод доказал свою диагностическую значимость и рекомендован для использования в глаукомных кабинетах, диабетологических центрах и офтальмологических стационарах [2]. СЛП позволяет получить количественные данные о состоянии слоя нервных волокон сетчатки (ткани, которая в первую очередь поражается при глаукоме). Работа СЛП основана на запаздывании (смещении) фазы инфракрасного луча вследствие двойного лучепреломления при его прохождении через слой нервных волокон сетчатки. Уникальной функцией СЛП последнего поколения является переменная компенсация роговицы (VCC). С помощью этой функции система измеряет двойное лучепреломление роговицы и затем оптически гасит это преломление при получении изображения слоя нервных волокон сетчатки (RNFL).
Данная методика прошла апробацию за рубежом. По мнению авторов, СЛП обладает большей чувствительностью в раннем выявлении глаукоматозных изменений даже в сравнении с автоматизированной статической периметрией, проведенной такими высокочувствительными методиками, как white-white и blue-yellow [14]. Данная методика также доказала более высокую чувствительность, чем автоматизированная статическая периметрия при наблюдении за пациентами в динамике [16].
Анализ полученного в ходе обследования изображения поверхности диска зрительного нерва и перипапиллярной сетчатки производится автоматически, путем сравнения полученных данных в пределах расчетной окружности с нормативной базой данных, которая содержится в памяти прибора. Расчетная окружность располагается вокруг ДЗН, имеет диаметр 3 мм и ширину 0,4 мм. Данные размеры соответствуют усредненному эмметропическому глазу.
Результаты сканирования представлены в виде трех изображений исследуемой части глазного дна в пределах 20°х20°. Цветное изображение (рис.1-А) позволяет сделать начальную оценку качества изображения и возможность его использования для дальнейшего анализа. Исследуемая область диска зрительного нерва и сетчатки представлена цветными схемами и графиками, отражающими толщину слоя нервных волокон (RNFL) в различных сегментах. Самая малая толщина окрашена темно-синим цветом, что свидетельствует о меньшей задержке инфракрасного луча, самая большая ярко-красным цветом (большая задержка) (рис.1-Б). В норме изображение имеет яркий желтый и красный цвет в верхнем и нижнем секторах, зеленый и синий цвет в назальном и темпоральном секторах.
На рис.1-В отображено отклонение от нормальной схемы, т.е. сравнение толщины RNFL пациента со значениями, содержащимися в нормативной базе данных. На черно-белом изображении глазного дна цветными квадратами показана степень отклонения результатов данного исследования.
Для каждого исследуемого глаза представлен график TSNIT, где затемненная область обозначает границы нормы. Значения, полученные от конкретного пациента, обозначены темной линией (рис.1-Г). Анализ графика базируется только на данных внутри расчетной окружности. Вычерчивание графика начинается с темпоральной стороны, далее заносятся результаты верхней, носовой, нижней и вновь темпоральной позиции.
Результаты поляриметрического лазерного сканирования сведены в таблицу (рис. 2). Отражены значения средней толщины слоя нервных волокон сетчатки в пределах расчетной окружности (TSNIT Average); среднее значение в области верхнего (Superior Average) и нижнего (Inferior Average) секторов в пределах 120°; стандартное отклонение от средней (TSNIT Standard Deviation); корреляция значений симметричных точек для OD и OS (Inter-Eye Symmetry); индикатор состояния нервного волокна (NFI), свидетельствующий о вероятности наличия глаукомы. Значение NFI может находиться в пределах от 0 до 100. Причем чем больше числовое значение полученного результата, тем выше вероятность глаукомного поражения зрительного нерва.
В современной офтальмологии имеется ряд диагностических методов, направленных на раннее выявление глаукомы и позволяющих обеспечить мониторинг зрительных функций таким пациентам.
Структурные изменения в диске зрительного нерва и сетчатке при глаукоме выражаются нарушением всех зрительных функций. При этом наиболее информативным и доступным в настоящее время является исследование поля зрения [4,6]. Ранними признаками развития глаукомы являются очаговые скотомы в центральном поле зрения, которые при прогрессировании процесса сливаются в дуговую парацентральную скотому (в зоне Бьеррума), отдельную или связанную со «слепым» пятном. У ряда пациентов изменения поля зрения могут проявляться общим снижением световой чувствительности сетчатки [6]. Характерные для глаукомы центральная и/или периферическая назальные ступеньки часто связаны с парацентральными скотомами [13].
На современном этапе развития медицинской техники компьютерная периметрия позволяет обнаружить описанные изменения поля зрения в ранней стадии глаукомы [15]. Наиболее совершенными компьютерными периметрами в настоящее время являются анализатор поля зрения Humphrey и Octopus [1]. Они позволяют проводить скрининговое и пороговое исследования центрального и периферического поля зрения, используя статическую и кинетическую периметрию.
В нашей стране для выявления ранней глаукомы на протяжении более 10 лет используется метод цветовой статической кампиметрии [3,9,10-12].
С 2003 г. появились сведения о применении автоматизированного измерительно-вычислительного комплекса (ИВК) «Кампи», разработанного ООО «АСофтXXI» в сотрудничестве с академической группой академика РАМН проф. А.П. Нестерова и кафедрой глазных болезней лечебного факультета РГМУ [5]. Измерительно-вычислительный комплекс «Кампи» предназначен для исследования центрального и отдельных участков периферического поля зрения с использованием монитора персонального компьютера в качестве измерительного прибора. ИВК может применяться для исследования поля зрения у больных с заболеваниями зрительного нерва и сетчатки в лечебных учреждениях и на дому, а также для создания и ведения единой базы данных по всем пациентам, прошедшим когда-либо обследование. В зависимости от поставленных задач возможно проведение нескольких вариантов исследований для каждого глаза. В большинстве случаев за основу взята пороговая стратегия исследования [7]. Предложенная методика доказала свою эффективность при мониторинге больных глаукомой [8].
В глазной клинике на кафедре глазных болезней лечебного факультета была проведена апробация сканирующей лазерной системы GDx VCC.
Цель исследования: оценить результаты, полученные с помощью поляриметрического лазерного сканирования диска зрительного нерва и перипапиллярной сетчатки; определить назначение сканирующего лазерного поляриметра GDx VCC в ряду диагностических методов, направленных на выявление глаукомы; сравнить диагностическую ценность поляриметрического лазерного сканирования, периметрии по программе G2 Octopus и компьютерной кампиметрии (Порог-120 и Порог-83), выполненной на автоматизированном измерительно-вычислительном комплексе «Кампи».
Материалы и методы В исследовании приняло участие 33 человека (56 глаз) в возрасте от 37 до 75 лет (средний возраст 59 лет). Среди обследуемых основную группу составили больные глаукомой в начальной (19 глаз), развитой (12 глаз) и далекозашедшей (11 глаз) стадиях и контрольная группа (14 глаз) не страдающих офтальмологическими заболеваниями. Всем пациентам проводилось стандартное офтальмологическое обследование, сканирующая лазерная поляриметрия GDx VCC, периметрия dG2 (Octopus 101) и кампиметрия по программам Порог-120 и Порог-83 (ИВК «Кампи»).
Поляриметрическое лазерное сканирование позволяет оценивать значения средней толщины слоя нервных волокон сетчатки в пределах расчетной окружности (TSNIT Average); в области верхнего (Superior Average) и нижнего (Inferior Average) секторов в пределах 120° (табл.1; гистограмма 1).
Результаты исследования показывают, что по мере прогрессирования глаукомного процесса снижается толщина слоя нервных волокон. Достоверными являются различия по всем исследуемым величинам в группе II и III стадий глаукомы по сравнению с контролем (p Таким образом, поляриметрическое лазерное сканирование информативно в диагностике развитой и далекозашедшей стадий глаукомы. Однако нельзя исключить тот факт, что при увеличении числа наблюдений возрастет информативность метода СЛП в диагностике начальной глаукомы.
Проведен сравнительный анализ исследования слоя нервных волокон методом сканирующей лазерной поляриметрии, компьютерной периметрии по программе G2 (Octopus 101) и компьютерной кампиметрии - Порог-120 и Порог-83) (ИВК «Кампи») (рис.3). Результаты исследования представлены в таблице 2.
Сравнительный анализ данных показал, что в диагностике начальной и развитой стадий глаукомы более высокой чувствительностью обладают методы компьютерной периметрии G2 (Octopus 101) и кампиметрии Порог - 120 (ИВК «Кампи»).
Выводы
1. Сканирующая лазерная поляриметрия позволяет получать точный математический расчет толщины слоя нервных волокон перипапиллярной области в пределах расчетной окружности.
2. Наиболее информативны данные сканирующего лазерного поляриметра GDx VCC при развитой и далекозашедшей стадии глаукомы.
3. Метод сканирующей лазерной поляриметрии является менее чувствительным для выявления начальной глаукомы. В ранней диагностике глаукомы СЛП рекомендовано применять как дополнительный метод с обязательным исследованием центрального поля зрения методами периметрии и/или кампиметрии.
Литература
1. Алябьева Ж.Ю., Романова Т.Б. - Современные методы исследования поля зрения при глаукоме (периметрия и кампиметрия).// III Всероссийская школа офтальмолога.//Сб.науч.тр.-М.,2004.-С.32-48.
2. Астахов Ю.С., Акопов Е.Л., Григорьева Н.Н., Шадричев Ф.Е. - Дополнительные диагностические возможности Гейдельбергского ретинального томографа (HRT II)// Клин. офтальмол.-2005.-т.6.-№1.-С.1-4.
3. Ендриховский С.Н., Нестерюк Л.И.//Вестн.Моск.ун-та.Сер.14.Психология.-1993.-Т1.-С.50-51
4. Еричев В.П.- Ранняя диагностика глаукомы: не существует простых и надежных решений.// Глаукома: проблемы и решения. Сб.научн.ст.-2004.-С.43-46.
5. Нестеров А.П., Романова Т.Б., Алябьева Ж.Ю., Лактионов А.В. - Новый метод компьютерной кампиметрии в практике офтальмолога//Клин. офтальмол.-2003.-т.4.-№2.-С.63-67
6. Нестеров А.П. - Первичная открытоугольная глаукома: диагностика и мониторинг.//III Всероссийская школа офтальмолога.//Сб.науч.тр.-М.,2004.-С.10-15.
7. Нестеров А.П., Егоров Е.А., Романова Т.Б., Алябьева Ж.Ю., Лактионов А.В., Филиппова Т.В., Амиров А.Н. - Практика применения нового метода компьютерной кампиметрии в клинике глазных болезней// IV Всероссийская школа офтальмолога., сб.науч.тр.,-М., 2005.-С.440-447.
8. Нестеров А.П., Егоров Е.А., Романова Т.Б., Алябьева Ж.Ю., Лактионов А.В., Филиппова Т.В.- Компьютерная кампиметрия для мониторинга больных глаукомой//VIII Съезд офтальмологов России, тезисы докладов.-М., 2005.-С.206.
9. Шамшинова А.М., Нестерюк Л.И., Ендриховский С.Н.//Вестник офтальмологии.-1992.-№1.-С.29-34.
10. Шамшинова А.М., Ендриховский С.Н., Еричев В.П. и др.//Глаукома.-М.,1994.-С.26-37.
11. Шамшинова А.М., Нестерюк Л.И., Ендриховский С.Н и др.//Цветовая кампиметрия в диагностике заболеваний сетчатки и зрительного нерва: Метод.рекомендации.-М., 1994.-С.3-11.
12. Шамшинова А.М., Нестерюк Л.И., Ендриховский С.Н. и др.//Вестн.офтальмол.-1995.-№ 2.-С.24-27.
13. Шамшинова А.М., Еричев В.П., Арефьева Ю.А., Борисова С.А., Белозеров А.Е., Барсечян Г.Л., Петров А.С. - К вопросу о патофизиологических механизмах нарушения зрительных функций у больных глаукомой.//Глаукома на рубеже тысячелетий: итоги и перспективы.//Материалы Всероссийской научно-практической конференции.-С.13-19.
14. Denk PO, Markovic M, Knorr M. - Correlation between glaucomatous hemifield scotomas and measurements of nerve fiber layer thickness using scanning laser polarimetry.// Ophthalmologe.-2005.-May 4.
15. Jonson C.A.//Optom. Vis. Sci.-1993.-Vol.70, N4.- P.288-298.
16. Wollstein G, Schuman JS, Price LL, Aydin A, Stark PC, Hertzmark E, Lai E, Ishikawa H, Mattox C, Fujimoto JG, Paunescu LA. - Optical coherence tomography longitudinal evaluation of retinal nerve fiber layer thickness in glaucoma.// Arch Ophthalmol.-2005.-Vol.123.-N.4.-C.464-70.
Эндоскопические системы в офтальмохирургии. Варианты
Endoscopic and laser technologies of dacryocystitis
treatment. Literary review (part 2)
M.T. Aznabaev, G.N. Valieva, A.Ae. Babushkin
Ufa NII of Eye Diseases
Literary review shows the necessity of prophylactic measures and investigation of reasons that lead to imperforation of rhinostoma after laser treatment.
Статья принята в печать 6 сентября 2006 г.
Литература
1. Абдулкеримов Х.Т., Ободов В.А., Велиханова М.С., Николаев Н.С. // Мат. III евро-азиатской конф. по офтальмохирургии.- Екатеринбург, 2003.- С. 25.
2. Азнабаев Б.М., Клявлин Р.Р. // Мат. VI науч-практ. конф. офтальмологов.- Екатеринбург, 1998.- С. 7.
3. Азнабаев Б.М., Клявлин Р.Р., Латыпова Э.А., Фаттахов Б.Т. // Актуальные проблемы инфекционной патологии глаз.- Уфа, 1999.- С. 113-114.
4. Азнабаев Б.М., Мирхайдаров А.Р., Клявлин Р.Р. // Актуальные проблемы клинической офтальмологии.- Челябинск, 1999.- С. 324-325.
5. Азнабаев Б.М., Клявлин Р.Р. // Мат. VII съезда офтальмологов России.- М., 2000.- С. 189.
6. Азнабаев Б.М., Клявлин Р.Р. // Мат. юбил. Всерос. науч-практ. конф.- М., 2000.- С. 158-159.
7. Азнабаев Б.М., Клявлин Р.Р., Фаттахов Б.Т., Гильманшин Т.Р. // Новые технологии в офтальмологии.- Уфа, 2000.- С. 286-289.
8. Азнабаев Б.М., Мирхайдаров А.Р., Юлдашев М.Т., Клявлин Р.Р. // Тез. докл. науч-практ.конф., посв. 65-летию кафедры оперативной хирургии.- Уфа, 2000.- С. 21-22.
9. Азнабаев Б.М., Клявлин Р.Р. // Проблемы офтальмологии: итоги и перспективы развития.- Уфа, 2001.- С. 398-402.
10. Азнабаев Б.М., Даутова З.А., Мунирова Л.Н. // Клинические исследования лекарственных средств.- М., 2002.- С. 125-126.
11. Азнабаев Б.М., Клявлин Р.Р., Фаттахов Б.Т., Мунирова Л.Н. // Актуальные проблемы офтальмологии.- Алматы, 2003.- С. 181-183.
12. Азнабаев Б.М., Клявлин Р.Р., Фаттахов Б.Т., Мунирова Л.Н. // Неотложная помощь, реабилитация и лечение осложнений при травмах органа зрения в чрезвычайных условиях.- М., 2003.- С. 84-86.
13. Азнабаев М.Т., Азнабаев Б.М., Фаттахов Б.Т., Клявлин Р.Р. // Ерошевские чтения.- Самара, 1999.- С. 113-114.
14. Азнабаев М.Т., Азнабаев Б.М., Фаттахов Б.Т., Клявлин Р.Р. // Русс. офтальмол. журн.- М., 2001.- С. 113-115.
15. Азнабаев М.Т., Азнабаев Б.М., Клявлин Р.Р. // Окулист, 2001.- № 11.- С. 5.
16. Азнабаев М.Т., Азнабаев Б.М., Клявлин Р.Р. // Сб. науч-практ. трудов к 60-летию со дня образования кафедры глазных болезней Кыргызской гос. мед. академии.- Бишкек, 2001.- С. 9-12.
17. Азнабаев М.Т., Клявлин Р.Р. // Мат. XI науч-практ. конф. Екатеринбурского центра МНТК.- Екатеринбург, 2002.- С. 12-15.
18. Азнабаев М.Т., Даутова З.А., Мунирова Л.Н. Применение нового ферментного препарата коллагеназы в офтальмологической практике // Метод. рекоменд.- Уфа, 2003.- 13 с.
19. Азнабаев М.Т., Азнабаев Б.М., Фаттахов Б.Т., Клявлин Р.Р. Лазерная дакриоцисториностомия.- Уфа, 2005.- 152 с.
20. Астахов Ю.С., Чачанидзе Н.Ю., Новиков С.Н. // Вестн. офтальмол.- 1999.- № 6.- С. 24-25.
21. Астахов Ю.С., Плужников М.С., Рябова М.А, и др. // Мат. III евро-азиатско конф. по офтальмохирургии.- Екатеринбург, 2003.- С. 27.
22. Астахов Ю.С., Рябова М.А., Кузнецова Н.Ю., Дерен К.А. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 41-45.
23. Белоглазов В.Г., Груша О.В., Саад-Ельдин Н.М., и др. // Вестн. офтальмол.- 1999.- № 5.- С. 14-16.
24. Белоглазов В.Г., Атькова Е.Л., Малаева Л.В., Чиненов И.М. // Современные технологии диагностики и лечения в офтальмологии.- Махачкала, 2004.- С. 82-84.
25. Буренков Г.И., Вахрушев С.Г., Калиновский К.П. // Новые технологии микрохирургии глаза.- Оренбург, 2001.- С. 136-140.
26. Давыдов Д.В., Кравченко А.В., Франк Г.А., Ефремов Г.Д. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 105-108.
27. Давыдов Д.В., Крюков А.И., Кравченко А.В. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 108-110.
28. Даутова З.А., Фаттахов Б.Т., Мунирова Л.Н. // Мат. III евро-азиатской конф. по офтальмохирургии.- Екатеринбург, 2003.- С. 39-40.
29. Калиновский К.П., Буренков Г.И., Вахрушев С.Г., Афонькин В.Ю. // Мат. III евро-азиатской конф. по офтальмохирургии.- Екатеринбург, 2003.- С. 179-180.
30. Клявлин Р.Р. Трансканаликулярная лазерная эндоскопическая дакриоцисториностомия: Дисс. Еканд. мед. наук.- Уфа, 2002.
31. Клявлин Р.Р. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 133-136.
32. Кравченко А.В., Давыдов Д.В., Минаев В.П. .// Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 136-141.
33. Кузнецова Н.Ю., Астахов Ю.С. // Окулист.- 2005.- № 2.- С. 4-6.
34. Кузнецова Н.Ю., Астахов Ю.С. // Окулист.- 2005.- № 3.- С. 6-7.
35. Лузьянина В.В, Сорокин Е.А. // Мат. III евро-азиатской конф. по офтальмохирургии.- Екатеринбург, 2003.- С. 182-185.
36. Ободов В.А. // Мат. 12 науч-практ. конференции офтальмологов.- Екатеринбург, 2004.- С. 97-101.
37. Ободов В.А., Борзенкова Е.С. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 223-226.
38. Ободов В.А., Солощенко А.П. // Современные методы диагностики и лечения заболеваний слезных органов.- М., 2005.- С. 226-230.
39. Саад Ельдин Н.М. Анализ причин и меры предупреждения развития рецидивов после дакриориностомий: Автореф. дис. Е канд. мед. наук.- М., 1998.- 27 с.
40. Султанов М.Ю., Тагизаде Н.С. // Офтальмохирургия.- 1994.- № 2.- С. 33-37.
41. Aznabayev B.M., Kidraleyeva S.R., Klyavlin R.R. // Society of ophthalmology, Stockholm.- 1999.- P. 860.
42. Aznabayev M.T., Aznabayev B.M., Fattahov B.T., Klyavlin R.R. // TOD 37 Ulusal oftalmoloji kongresi.- 4-8 Oct., 2003.- Istanbul.- S. 86.
43. Bartly G.B. // Ophthalmolody.- 1994.- № 1.- P. 103-106.
44. Benger R., Forer M. // Aust. N. Z. J. ophthalmology.- 1993.- Vol. 21.- № 3.- P. 57-59.
45. Bernal M., Sprekelsen H. // An. otoloringol. Ibero Am.- 1994.- Vol. 21.- № 1.- P. 91-99.
46. Boush G.A., Lemke B.N., Dortzbach R.K. // Ophthalmology.- 1994.- Vol. 101.- № 5.- P. 955-959.
47. Choi W.C., Kim K.S., Park T.K., Chung C.S. // Ophthalmic Surg. Lasers.- 2002.- Vol. 33.- № 4.- P. 282-292.
48. Christenbury J.D. // Arch. Ophthalmology.- 1992.- Vol. 110.- № 2.- P. 170-171.
49. Eloy P., Watlet G., Claramunt R. // Bull. Soc. Belge. ophthalmology.- 1994.- Vol. 252.- № 31.- P. 4.
50. Eloy P., Bernard B., Martinez M., et al. // Rhinology.- 1995.- Vol. 33.- № 4.- P. 229-233.
51. Hakin K.N., Sullivan T.J., Sharma A., Welham R.A. // Aust. N. Z. J. ophthalmology.- 1994.- Vol. 22.- № 4.- P. 231-235.
52. Javate R.M., Campomanes B.B., Co N.D. et al. // Ophthalm. Plast. Reconstr. Surg.- 1995.- Vol. 11.- № 1.- P. 54-58.
53. Kristan R.W., Facs M.D. Laser intracanalicular CDCR // ENDO OPTIKS.- 1997.- Sycamore.- N J 07739.
54. Mandeville J.T., Woog J.J. // Curr. Opin Ophthalmology.- 2002.- Vol. 113.- № 5.- P. 303-309.
55. Massaro B.M., Gonnering R.S., Harris G.J. // Arch. ophthalmology.- 1990.- Vol. 108.- P. 1172.
56. Masssegur H., Trias E., Adema J. // Otolaryngol. Head Neck Surg.- 2004.- Vol. 130.- № 1.- P. 39-46.
57. May A., Fries U., Zubcov-Ivantscheff A. et al. // J. Otorhinolaryngol relat Spec.- 2002.- Vol. 6.- № 1.- P. 11-15.
58. Metson R., Woog J.J., Puliafito C.A. // Laryngoscope.- 1994.- Vol. 104.- P. 269-274.
59. Moore W.M., Bentley C.R., Olver J.M. // Ophthlmology.- 2002.- Vol. 109.- № 8.- P. 1575-1582.
60. Morgan S., Austin M., Whittel H. // Br. J. Ophthlmology.- 2004.- Vol. 88.- № 1.- P. 139-141.
61. Muellner K., Bodner E., Manner G.E. et al. // Br. J. Ophthalmology.- 2000.- Vol. 84.- № 1.- P. 16-18.
62. Patel B.C., Phillips B., McLeish W.M. et al. // Ophthalmology.- 1997.- Vol. 104.- № 7.- P. 1191-1197.
63. Pearlman S.J., Michalos P., Leib M.L., Moazed K.T. // Laryngoscope, 1997.- Vol. 107.- № 10.- P. 1362-1365.
64. Piaton J.M., Limon S., Ounnas N., Keller P. // J. Fr. Ophthalmology.- 1994.- Vol. 17.- № 10.- P. 55-56.
65. Rosen N., Barak A., Rosner M. // Ophthal. Surg. Lasers.- 1997.- Vol. 28.- № 9.- P. 723-726.
66. Schauss F., Weber R., Draf R., Keerl R. // Acta Otorhinolaryngol. Belg.- 1996.- Vol. 50.- № 2.- P. 143-146.
67. Serra A., Puxeddu R., Murgia F., Zucca I. // Abstruct book of the European Society of Ophthalmic Plastic and Reconstructive Surgery.- Rome.- 1997.- Lacrimal part.- P. 5.
68. Siegert R., Weerda H. // Laryngorhinootologie.- 1996.- Vol. 75.- № 5.- P. 309-310.
69. Tarbet K.J., Custer P.L. // Ophthalmology.- 1995.- Vol. 102.- № 7.- P. 1065-1070.
70. Unlu H.H., Toprak B., Aslan A., Guler C. // Amn. Otol. Rhinol. laryngol.- 2002.- Vol. 111.- № 8.- P. 704-709.
71. Von Buren M., Forrer A. // Klin. Monatsbl. Augenheilinkd.- 1994.- Bd. 204.- № 5.- S. 394-397.
72. Woo K.J., Moon S.H., Kim Y.D. // Ophthal. Surg. Lasers.- 1998.- Vol. 29.- № 6.- P. 451-455.
73. Yung M.W., Hardman-Lea S. // Br. J. Ophthalmology.- 2002.- Vol. 86.- № 7.- P. 792-794.
Данный обзор литературы посвящен роли фиксированных комбинаций (ФК) антибактериальных препаратов (АБП) и глюкокортикоидов (ГК) в хирургии катаракты. Послеоперационное медикаментозное сопровождение факоэмульсификации (ФЭ) призвано решить две основные задачи: контроль воспаления и предотвращение инфекционных осложнений. В этой связи закономерно встает вопрос о роли ФК АБП и ГК, способных решить обе стоящие перед офтальмохирургом задачи, но при непременном соблюдении основополагающих принципов. На данный момент наиболее эффективным способом профилактики острого эндофтальмита является внутрикамерное введение антибиотика на заключительном этапе операции. Однако уже через 10 ч концентрация препарата снижается до уровня, не способного предотвратить контаминацию водянистой влаги бактериями. Поэтому топическое применение АБП (как в варианте монопрепарата, так и в составе ФК) оправдано вплоть до полной эпителизации хирургических разрезов, наступающей примерно через 1 нед. после ФЭ.
На основании анализа данных литературы предложен алгоритм послеоперационного сопровождения неосложненной ФЭ, заключающийся в 4-кратных инстилляциях комбинированного препарата 0,5% левофлоксацина и 0,1% дексаметазона в течение 1-й недели. При сохранении воспалительных явлений — гиперемии конъюнктивы и клеточной взвеси в передней камере рекомендуется переход на монотерапию дексаметазоном (с той же частотой применения) на протяжении 2-й недели, в дальнейшем — без постепенной отмены препарата.
Ключевые слова: факоэмульсификация, эндофтальмит, профилактика, воспаление, антибиотик, глюкокортикоид, дексаметазон, фиксированная комбинация, глазные капли, синдром отмены.
V.P. Nikolaenko 1,2 , D.F. Belov 1
1 City Multidisciplinary Hospital No. 2, St. Petersburg, Russian Federation
2 St. Petersburg State University, St. Petersburg, Russian Federation
This paper reviews the relevance of fixed-dose combinations (FDC) of antibiotics (AB) and steroids in cataract surgery. Postoperative pharmacotherapy of phacoemulsification addresses two main issues — reducing inflammation and preventing infectious complications. Therefore, the question arises about the role of FDCs of ABs and steroids addressing both issues but in compliance with baseline principles. The most effective measure to prevent acute endophthalmitis is an intracameral injection of antibiotics at the end of surgery. Meanwhile, as early as after 10 hours, drug concentration reduces to a level that fails to prevent aqueous humor contamination with bacteria. Therefore, topical ABs, either monotherapy or FDC, are reasonable up to complete healing of phaco incisions (approximately after one week).
The authors suggest a postoperative management algorithm after uneventful phaco involving topical administration of an FDC containing 0.5% levofloxacin and 0.1% dexametha sone QID at week 1. If inflammation (conjunctival redness and cells/flare) persists, switching to dexamethasone as monotherapy QID during week 2 (and withdrawal without tapering) is recommended.
Keywords: phacoemulsification, endophthalmitis, prevention, inflammation, antibiotic, steroid, dexamethasone, fixed-dose combination, eye drops, withdrawal syndrome.
Введение
Ведущей корректируемой причиной слепоты во всем мире является катаракта, распространенность которой неуклонно возрастает по мере увеличения численности и продолжительности жизни населения земного шара [1]. Факоэмульсификация (ФЭ) стала наиболее распространенным хирургическим вмешательством, что во многом обусловлено быстрой зрительной реабилитацией из-за минимального разреза, не требующего наложения швов [2, 3].
Однако любая, даже такая отработанная в технологическом отношении операция, как ФЭ, вызывает местную воспалительную реакцию, проявляющуюся гиперемией конъюнктивы, той или иной степенью вовлечения роговицы, а также ответом переднего отдела сосудистой оболочки глаза (опалесценцией камерной влаги и клеточной взвесью) [4, 5]. Кроме того, первые 7 сут после операции, требующиеся для эпителизации роговичного разреза, сопровождаются реальной угрозой контаминации водянистой влаги (ВВ) микроорганизмами [6, 7]. Таким образом, послеоперационное медикаментозное сопровождение хирургии катаракты призвано решить две основные задачи: контроль воспаления и предотвращение инфекционных осложнений.
В международных практических рекомендациях по ведению пациентов после ФЭ [4, 5, 8] основная роль в профилактике острого эндофтальмита (ОЭ) отводится предоперационному использованию антисептиков (повидон-йод) и внутрикамерному введению антибиотиков (ВВА) на заключительном этапе вмешательства. Произошедшее в последние годы в Европейском союзе кардинальное изменение алгоритмов профилактики инфекционных осложнений в хирургии катаракты поставило под сомнение целесообразность местного применения антибактериальных препаратов (АБП), попутно затронув проблему назначения и безопасной отмены топических глюкокортикоидов (ГК) у офтальмологических пациентов. В этой связи закономерно встает вопрос о роли фиксированных комбинаций (ФК) АБП и ГК, способных решить обе стоящие перед офтальмохирургом задачи, но при непременном соблюдении основополагающих принципов. Данный обзор преследует цель определить алгоритм рационального применения ФК в современной хирургии катаракты.
Антибиотикопрофилактика внутриглазной инфекции
Острый эндофтальмит (ОЭ) является наиболее тяжелым осложнением офтальмологических операций, поскольку способен вызывать выраженное и необратимое снижение остроты зрения [9]. Факторами риска возникновения ОЭ являются роговичный разрез [10], наружная фильтрация [6], разрыв задней капсулы, потребовавший выполнения передней витрэктомии [11], имплантация интраокулярной линзы из силикона [12].
Исследование ESCRS [8] наглядно продемонстрировало эффективность профилактического внутрикамерного введения цефуроксима, снизившего частоту ОЭ с 0,226% до 0,050%, а в сочетании с предоперационной аппликацией повидон-йода и инстилляцией 0,5% левофлоксацина до и после ФЭ — до 0,025%.
Однако однократное ВВА не может поддерживать стерильность камерной влаги на протяжении всего периода эпителизации роговичного разреза. Установлено, что концентрация цефуроксима в ВВ снижается до бесконечно малой (приблизительно 0,0027 мг/л) уже через 10 ч после вмешательства, что существенно ниже минимальной подавляющей концентрации (МПК) для любого микроорганизма [13]. Таким образом, антибактериальный эффект ВВА цефуроксима исчезает в течение 1-х суток после операции. Как следствие, избежать контаминации ВВ в последующие 7 дней можно либо путем безукоризненного соблюдения пациентами рекомендаций, предотвращающих наружную фильтрацию (что не всегда осуществимо [14]), либо назначать после ФЭ топическую антибиотикотерапию [15].
Поскольку несвоевременно начатое и/или неадекватное лечение ОЭ приводит к катастрофическим последствиям, крайне важно использовать наиболее эффективный АБП [14], обеспечивающий значительно превышающую МПК концентрацию в конъюнктивальной полости и передней камере на протяжении недели, требующейся для эпителизации роговичного разреза [6, 16]. К сожалению, оптимальный и рекомендуемый европейскими экспертами по местной послеоперационной профилактике эндофтальмита (EUREQUE) [14] антибиотик для предупреждения внутриглазной инфекции до сих пор не определен.
В повседневной офтальмологической практике нередко используются аминогликозиды, но они обладают меньшей способностью проникать через строму роговицы [17, 18], а также имеют более узкий антибактериальный спектр по сравнению с фторхинолонами [19]. В исследованиях H.M. de Kaspar et al. [20] и F.A. Bucci Jr. [21] представитель именно класса фторхинолонов — левофлоксацин 0,5% (Офтаквикс ® ) выступил эталонным топическим АБП, так как эффективно подавлял рост патогенной флоры в конъюнктивальной полости, а также достигал в ткани роговицы и ВВ адекватной концентрации для предотвращения роста входящих в нормальную биоту слизистой оболочки, но представляющих опасность при попадании в полость глаза микроорганизмов.
Особенности применения фиксированных комбинаций
Контроль воспаления является второй основной задачей послеоперационного лечения, наиболее эффективным способом решения которой служит применение топических ГК — в частности, дексаметазона с его мощным противовоспалительным потенциалом [22]. Фиксированные комбинации дексаметазона и АБП могут стать действенным инструментом повышения комплаентности, особенно среди пожилых пациентов [14, 23]. Однако рациональные алгоритмы использования ФК АБП и ГК до сих пор не выработаны, многие офтальмологи удлиняют лечение до 2 нед. и более, нередко с постепенным уменьшением частоты инстилляций комбинированного лекарственного средства. Однако применение местного АБП после эпителизации роговичного тоннеля не имеет убедительного обоснования, а постепенное снижение дозы антибиотика не только бессмысленно, но и способствует развитию бактериальной резистентности [24, 25].
Выработке оптимальной схемы ведения пациентов после ФЭ было посвящено многоцентровое рандомизированное слепое клиническое исследование LEADER7 [26]. Оценивалась эффективность двух алгоритмов противовоспалительного лечения — 4-кратных инстилляций ФК 0,5% левофлоксацина и 0,1% дексаметазона в течение 1-й недели с переходом на монотерапию дексаметазоном на протяжении 2-й недели, а также 14-дневного использования ФК 0,3% тобрамицина и 0,1% дексаметазона с той же (4 р/сут) частотой инстилляций. Оба алгоритма продемонстрировали одинаковый профиль активности — исчезновение клеточной взвеси и опалесценции влаги у 85% пациентов, конъюнктивальной инъекции — у 90% пациентов после 7 сут лечения.
Предложенные в рамках клинического исследования схемы фармакологического сопровождения ФЭ закономерно поднимают вопрос о незыблемости принципа постепенного уменьшения частоты инстилляций ГК во избежание синдрома отмены. В понимании патофизиологов и фармакологов синдром отмены — это надпочечниковая недостаточность, возникающая по механизму обратной связи при системном приеме ГК [27]. Но клиницисты обычно подразумевают под синдромом отмены возвращение или усугубление тех симптомов и клинических признаков, на устранение которых была направлена глюкокортикостероидная терапия.
В офтальмологии длительное (на протяжении недель и месяцев) применение ГК входит в схемы лечения герпетического стромального кератита и макулярного отека на фоне хронического увеита, также гормональные препараты составляют основу алгоритмов поддержания фильтрации после синустрабекулэктомии и сохранения прозрачности трансплантата роговицы [28]. Во всех перечисленных выше случаях залогом успеха терапии является постепенное, иногда очень медленное, уменьшение дозировки дексаметазона, тогда как его ранняя отмена чревата обострением процесса 29.
Однако результаты исследования LEADER7 [26] наглядно продемонстрировали, что лечение, направленное на подавление, как правило, минимальной воспалительной реакции после неосложненной ФЭ, не требует соблюдения подобных мер. Учитывая результаты данного исследования [26] вкупе с преимуществами фторхинолоновых АБП III и IV поколения (более высокая биодоступность, расширенный по сравнению с аминогликозидами спектр активности, меньший риск развития антибиотикорезистентности) [17, 18, 31, 32], представляется целесообразным внедрение в повседневную клиническую практику следующей схемы ведения пациентов после неосложненной ФЭ:
В течение 1-й недели после операции (до эпителизации наружного края роговичного разреза) использовать ФК АБП и ГК.
В рамках очередного контрольного осмотра через 7 дней после ФЭ оценить состояние переднего отдела глаза.
При наличии клеточной взвеси и опалесценции камерной влаги продолжить лечение еще на протяжении 1 нед., но в виде инстилляций 0,1% дексаметазона 4 р/сут [26].
Заключение
Таким образом, с учетом широкого применения ФЭ вопрос профилактики послеоперационных осложнений является крайне актуальным. Применение ФК АБП и ГК для купирования воспаления после неосложненной ФЭ обладает рядом преимуществ перед комбинированным лечением теми же препаратами, что в свое время было более чем наглядно продемонстрировано на примере пациентов с глаукомой. Среди преимуществ ФК — уменьшение количества используемых флаконов и минимизация неудобств, связанных с многократными инстилляциями нескольких препаратов, что повышает приверженность лечению [33, 34]. Помимо улучшения комплаентности, ФК обеспечивают правильность дозировки и лучшую переносимость используемого препарата, также за счет уменьшения воздействия консервантов нивелируют эффект «вымывания» лекарства [28, 35].
Благодарность
Авторы и редакция благодарят ООО «Сантэн» за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgements
The authors and Editorial Board are grateful to Santen LLC for providing full-text foreign articles required to write the review.
Сведения об авторах:
1 Белов Дмитрий Федорович — врач-офтальмолог; ORCID iD 0000-0003-0776-4065.
1 СПб ГБУЗ ГМПБ № 2. 194354, Россия, г. Санкт-Петербург, пер. Учебный, д. 5.
2 ФГБОУ ВО СПбГУ. 199034, Россия, г. Санкт-Петербург, наб. Университетская, д. 7/9.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.12.2021.
About the authors:
1 Dmitrii F. Belov — ophthalmologist; ORCID iD 0000-0003-0776-4065.
1 City Multidisciplinary Hospital No. 2, 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation.
2 St. Petersburg State University, 7/9, Universitetskaya emb., St. Petersburg, 199106, Russian Federation.
There is no conflict of interests.
Received 07.12.2021.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Эндоскопическая дакриоцисториностомия
Из-за обструкции или сужения слезного протока может произойти разрыв слезного мешка. Носослезный канал имеет тенденцию к уменьшению с возрастом, но этот процесс, вероятно, усугубляется хроническими инфекциями, которые могут возникать еще в начале жизни. Для лечения обструкции и стеноза слезного протока необходима эндоскопическая дакриоцисториностомия (DCR).
Что такое наружная дакриоцисториностомия?
Операцию можно проводить с помощью местной или общей анестезии, она длится около 1 часа. Наружный доступ возможен через небольшой разрез на боковой стороне носа. Обычно он заживает очень быстро и остается почти незаметным, оставляя лишь небольшой шрам. Мягкий стент помещается в носослезный канал, удерживая его от спадения во время заживления. Эта трубочка обычно не проявляет себя, если установлена в правильное положение, и удаляется через 6 недель после операции.
Что такое эндоскопическая эндоназальная дакриоцисториностомия ?
Эта операция выполняется ЛОР-хирургом или хирургом-офтальмологом, прошедшим специализацию по эндоскопической хирургии носа.
В ходе такой операции доступ к слезному мешку производится изнутри носа с помощью имеющего видеокамеру эндоскопа. Это оборудование позволяет видеть отверстие слезного канала на внутренней поверхности носа, со стороны его полости, и вставить туда стент. Такая техника не оставляет разрезов на коже.
Какой вид операции выбрать?
Кому может быть проведена эндоскопическая дакриоцисториностомия ?
Возраст не является препятствием для данного вмешательства. Операция выполнялась у пациентов в возрасте от 3 месяцев и старше, вплоть до пожилых, если нет противопоказаний к общей анестезии.
Что представляет собой лечение?
Благодаря технологическим достижениям последних 15 лет стало возможным выполнить дакриоцисториностомию (DCR) с доступом через ноздрю без наложения швов на лице.
Во время эндоскопической дакриоцисториностомии (dacryocystorhinostomy) формируется прямое соустье между слезным мешком и носовым ходом, минуя заблокированный носослезный канал.
Эндоскопическая дакриоцисториностомия (DCR) обычно выполняется под общей анестезией. Время операции составляет около 45 минут.
Небольшой силиконовый стент, установленный во время операции, снимается в клинике через три недели.
Какие следы оставляет операция?
После эндоскопической дакриоцисториностомии (DCR) не останется никаких внешних следов, отеков или гематомы.
Какое время занимает восстановление после операции?
Послеоперационная боль выражена минимально и обычно требует только применения парацетамола (ацетаминофен). В течение первой недели потребуется избегать физических упражнений, бега или других действий, которые усиливают дыхание носом и, следовательно, повышают риск кровотечения.
Вы можете чувствовать заложенность носа, некоторые пациенте испытывают дискомфорт в области слезного мешка в течение 1-2 месяцев. Врач назначит послеоперационные глазные капли и назальные спреи.
Какой риск имеет данная операция?
Следует сказать, что любая хирургическая операция несет в себе определенный риск. Но в целом риск описанной процедуры очень низкий. Перед операцией мы еще раз подробно обсудим все риски, которые могут возникнуть во время операции, исходя из вашей конкретной ситуации и состояния вашего здоровья.
Насколько эндоскопическая дакриоцисториностомия эффективнее классической наружной операции?
Успешность эндоскопических и наружных DCR составляет примерно 95%.
В течение некоторого времени п ациенты носят установленный стент, помогающий обеспечить создание нового дренажного канала для слез. По истечении этого времени новая обструкция маловероятна.
Эндоскопическая дакриоцисториностомия / к лассическая наружная дакриоцисториностомия :
Есть ли противопоказания к операции?
Нос имеет очень богатое кровоснабжение, поэтому пациенты, принимающие препараты, влияющие на свертывание крови (антиагреганты, антикоагулянты: аспирин, варфарин и другие), должны быть отменены за 7-10 дней до операции. В любом случае этот вопрос следует дополнительно обсудить с вашим семейным врачом, кардиологом или другим специалистом, назначившим вам эти лекарственные средства.
Что это за процедура — дакриоцисториностомия, какой метод операции эффективней?
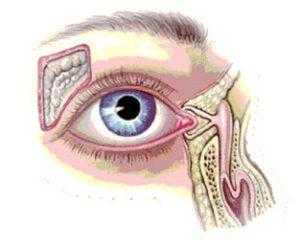
Дакриоцисториностомия - процедура формирования нового носослезного протока, необходимая в случаях закупоривания такого канала.
При таком оперативном вмешательстве старый канал не прочищают: проводится новый проток, который огибает закупоренный участок и соединяет носовую полость со слезным мешком.
Что такое дакриоцисториностомия?
К сведению! В ходе выполнения дакриоцисториностомии формируется новый путь оттока слезной жидкости, которая в нормальном состоянии без затруднений выводится в носовую полость.
Если естественные каналы закупориваются в результате развития дакриоцистита или при других патологиях - требуется создание нового канала.
Традиционно такая процедура проводится хирургическим путем, когда выполняется разрез от внутреннего уголка глаза в сторону носовой полости.
Но после такого вмешательства на коже остается рубец и возникает риск образования спаек в месте операции.
К тому же при таком методе во вновь сформированную полость вставляется трубка, по которой в первые дни будет осуществляться отток жидкости.
А такие инородные объекты всегда представляют потенциальную угрозу для организма (такие объекты могут отторгаться или нарушать целостность структуры тканей).
Операция выполняется только взрослым пациентам под общей или местной анестезией (на усмотрение врача) при отсутствии на момент проведения процедуры инфекционных офтальмологических или ЛОР-заболеваний.
Если таковые выявляются - их необходимо вылечить до проведения дакриоцисториностомии.
- смещения пластиковой трубки, используемой для формирования нового протока;
- развитие вторичной инфекции;
- носовые кровотечения.
Внедренная трубка извлекается спустя полтора-два месяца. До этого момента пациент несколько раз должен будет посетить врача для контрольных осмотров.
Показания к операции
Показаниями к выполнению процедуры являются:
- снижение остроты зрения на фоне дакриоцистита;
- постоянные неконтролируемые слезотечения;
- воспаление слезного мешка, переходящее в хроническую форму;
- частое развитие конъюнктивита из-за инфицирования конъюнктивы по причине закупорки слезного протока.
Операция выполняется только взрослым пациентам.
В детстве дакриоцистит, который может потребовать такого вмешательства, лечится более щадящими способами, а у новорожденных и вовсе считается нормальным и не требует вмешательства специалистов.
Методы проведения операции
Обратите внимание! Существует несколько видов дакриоцисториностомии, один из которых - эндоскопическая экстраназальная операция.
В таких случаях происходит вскрытие кожного покрова под местной анестезией.
Кожа пациента надрезается рядом с слезным мешком, после чего происходит отделение надкостницы и формируется костное окно, через которое далее формируется путь оттока жидкости.
После такой операции на лице пациента остается рубец размером около трех сантиметров.
Из-за такого косметического дефекта данный метод не очень популярен среди пациентов, и при возможности они предпочитают эндоназальный вариант операции.
В этом случае через слезный проток после предварительной анестезии вводят эндоскоп, оснащенный камерой.
Он же используется для формирования костного окна и формирования слезного протока.
В обоих случаях после операции в проток вставляется пластиковая трубка, которая не дает проходу срастаться в первые дни.
Относительно недавно появился метод лазерной дакриоцисториностомии.
Стоит отметить! В таком случае формирование костного окна и слезного канала выполняется не хирургическими инструментами, а лазерным лучом.
Судя по отзывам пациентов, это менее болезненная процедура, которая характеризуется меньшим количеством осложнений и проводится быстрее.
Но стоит она дороже эндоскопического вмешательства, к тому же такой вид операции может потребоваться повторно из-за низкой эффективности, при этом стоимость лазерных процедур значительно выше.
Полезное видео
В данном видео показано, как проводится лазерная дакриоцисториностомия:
Выбор методики зависит от показаний и отчасти - от предпочтений самого пациента.
Так как при одинаковой эффективности разные виды эндоскопической дакриоцисториностомии отличаются по стоимости (цены могут варьироваться в зависимости от клиники и квалификации специалиста).
Читайте также:
- Стартовая лихорадка
- Туморнекротизирующий фактор альфа. Роль туморнекротизирующего фактора альфа при воспалении.
- Примеры узловой гемангиобластомы диска зрительного нерва
- Обследование больного с хирургической патологией. Рентгеноскопия грудной клетки. Рентгенография грудной клетки.
- Фотохимия зрения. Родопсин и его распад под действием света
