Энтерококки (Enterococcus spp.) как причина раневых инфекций. Факторы патогенности
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Медицинская микробиология:
Резистентность энтерококков к антибактериальным препаратам
Большинство видов энтерококков природно резистентны к разным антибиотикам — β-лактамным, линкозамидам, аминогликозидам, ингибиторам обмена веществ с участием фолиевой кислоты, триметоприму и сульфаниламидам. Резистентность к β-лактамным препаратам обязана низкому аффинитету пенициллин-связывающих белков (ПСБ), образуемых некоторыми видами энтерококков. Минимальные подавляющие (ингибирующие) концентрации (МИК) пенициллинов могут в 2 раза и более превышать уровень 64 мкг/мл в зависимости от специфичности антибиотика, вида энтерококка или даже штамма. При более высоких значениях МИК для иолусинтетических пенициллинов и цефалоспоринов они клинически неэффективны.
Энтерококки, резистентные к аминогликозидным препаратам, имеют значения МИК от 8 до 250 мкг/мл в зависимости от аминогликозида, вида энтерококка или даже от штамма, что связано с ограничением транспорта препарата через клеточные мембраны. Природная резистентность энтерококков к β-лактамным антибиотикам, так же как и к аминогликозидам, может меняться при использовании комбинации антибиотиков (β-лактамных с аминогликозидами). Присутствие ингибитора синтеза клеточной стенки, такого как β-лактам, приводит к повышению захвата аминоглико-зидов энтерококками, что способствует их гибели. Приобретение высокого уровня резистентности ко всем клинически значимым аминогликозидам может привести к элиминации достигнутого синергетического эффекта в лечении многих вызываемых энтерококками инфекций.
Энтерококки также природно устойчивы к линкозамидам, таким как линкоми-цин и клиндамицин, со значениями достигаемого уровня МИК до 100 мкг/мл.
Природная резистентность энтерококков к ингибиторам обмена веществ с участием фолиевой кислоты обусловлена их способностью усваивать экзогенно тимидин, тимин и фолаты, такие как фолиевая кислота, гидрофолаты и тетрагидрофолаты.
а) Повышение уровня резистентности энтерококков к амидогликозидам. Описаны три типа ферментов, модифицирующих аминогликозиды, включая: фосфотрансферазы (APHs), ацетилтрансферазы (AACs) и нуклеотидилтрансферазы (ANTs), которые соответственно осуществляют фосфорилирование гидроксильной группы на аминогликозиде в присутствии АТФ-ацетилирования аминогрупп, используя коэнзим А в качестве донора, и аденилирование гидроксильной группы АТФ.
Приобретение этих ферментов обычно кодируется плазмидами, в результате чего возникает высокий уровень резистентности энтерококков к аминогликозидам, т.е. МИК этих антибиотиков доходит до 2000 мкг/мл и даже может быть выше 40 000 мкг/мл.
Высокий уровень устойчивости энтерококков к стрептомицину наблюдался более чем у 50% штаммов, выделенных от больных в середине 50-х годов прошлого столетия. Были описаны два типа ферментов, модифицирующих стрептомицин. Мутации в рибосомальной субъединице 30S приводят к снижению связывания стрептомицина с рибосомой, что, в свою очередь, способствует повышению уровня МИК препарата до 128 000 мкг/мл.
Большинство клинически значимых энтерококковых генов, приводящих к модификации активности аминогликозидов, являются aac (6)-Iе-Iа, которые кодируют бифункциональный энзим ААС (6 )-АРН (2), обусловливающий резистентность к гентамицину, тобрамицину, амикацину, канамицину, нетилмицину и дибекацину. Этот ген был впервые описан при определении высокого уровня резистентности к гентамицину у штамма E. faecalis, который также оказался резистентным к канамицину и тобрамицину, но не к стрептомицину.
Описаны более 90% штаммов, устойчивых к гентамицину, которые кодируются бифункциональными энзимами и обеспечивают резистентность к гентамицину, а также к другим аминогликозидам.
б) Повышение уровня резистентности энтерококков к бета-лактамам. Выделенный в 1981 году штамм Е. faecalis НН22 был первым энтерококком, проявляющим β-лактамазную активность. Второй такой же штамм энтерококка был обнаружен и описан в США в 1983 году. Вскоре штаммы Е. faecalis, образующие β-лактамазу, были выделены в 4 странах. Многие их этих штаммов были выделены вне- и внутрибольнично. Даже среди изолированных штаммов, которые не были клональными, β-лактамазная активность всегда ассоциировалась с высоким уровнем резистентности к гентамицину, и только единственный штамм Е. faecalis, образующий β-лактамазу, экспрессировал высокий уровень резистентности ко всем аминогликозидам. Высокий уровень резистентности энтерококков к β-лактамным антибиотикам, в особенности к пенициллинам, может также быть обязан сверхэкспрессии низкого аффинитета пенициллин-связывающих белков (ПСБ), и/или мутациям ПСБ в структурном гене, которые снизили их аффинитет к пенициллинам еще в большей степени. Спонтанные мутации у штаммов Е. faecalis и E. faecium также способны приводить к образованию высокого уровня аффинитета ПСБ у штаммов с ранее низким его уровнем.
в) Резистентность энтерококков к гликопептидным антибиотикам. Первый штамм Е. faecalis, резистентный к гликопептидным препаратам, был выделен в 1986 г. Он содержал плазмиду, которая обеспечивала резистентность к ванкомицину и тейкопланину. Было установлено, что эта резистентность была обязана генам, закодированным на транспозоне Тп 1546, и продукты этих генов явились результатом синтеза скорее пептидогликанового предшественника, чем нормального пептидогликана, заканчивающегося D-Ala-D-Ala.
Этот оригинальный пептидогликановый фенотип резистентности в исследовании стал известен как фенотип A (VanA). Дополнительно были описаны еще пять фенотипов от VanB до VanE (табл. 1.3.2). Штаммы Е. faecalis фенотипа VanA экспрессируют высокие уровни резистентности к гликопептидным препаратам — ванкомицину и тейкопланину. Штаммы энтерококков фенотипа VanB экспрессируют вариабельные уровни резистентности к ванкомицину, но эти штаммы чувствительны к тейкопланину. В этом случае резистентность к ванкомицину обуславливается геном van В, более часто локализованном на хромосоме, но он может также присутствовать на плазмиде. Кластер генов vanB может также быть локализован на сложном транспозоне Тп 1547 внутри большого хромосомно-конъюгативного элемента. Фенотип VanB в основном ассоциирован со штаммами Е. faecalis, E.faecium и иногда с Е. casseliflavus и Е. gallinarum.
Фенотип VanC резистентности энтерококков не является приобретенным, а скорее может быть природным у штаммов Е. gallinarum, Е. casseliflavus и Е. flavescens. Для фенотипа VanD, выявленного в штаммах Е. faecium, характерен основной тип резистентности к ванкомицину и тейкопланину. Ген vanD, локализованный только на хромосоме, но может быть также трансмиссивным. Пептид, имеющийся в VanD, как и в штаммах фенотипа А, заканчивается D-лактатом.
Фенотип VanЕ в штамме Е. faecalis, детерминированный на хромосоме, обеспечивает низкий уровень резистентности к ванкомицину и чувствительности к тейкопланину. Этот фенотип обязан своим возникновением индуцированному ванкомицином синтезу пептидогликана, заканчивающегося пептидом D-Ala-D-Ser.
г) Гены, обеспечивающие резистентность энтерококков к гликопептидам. Резистентность к гликопептидам у энтерококков включает двухкомпонентные системы, в которых строение клеточной системы изменяется от предшественника пептидогликана D-Ala-D-Ala (чувствительность к ванкомицину) до D-Ala-D-lactate (D-Lac), который имеет в 1000 раз меньший аффинитет для ванкомицина, в то время как D-Ala-D-Ser имеет семикратное снижение аффинитета для ванкомицина, тем самым снижая чувствительность мишени. Генами, включенными в эту двухкомпонентную систему, являются vanS/vanR. VanS — сенсор-киназа, активированная в ответ на ванкомицин, в результате приводит к активированию D-Lac- или D-Ser- предшественника пептидогликана и репрессии D-Ala-D-Ala. Шесть кластеров генов, связанных с резистентностью к гликопептидам, были идентифицированы в энтерококках разных видов: от van А до van G.
Кластерами генов vanC, vanА и vanВ кодируются три главных типа резистентности. Природная резистентность фенотипа VanC является специфичной для Е. gallinarum, Е. casseliflavus и Е. flavescens, и оперон vanC, локализованный на хромосоме, не является трансмиссивным. Оперон резистентности vanA включает в себя семь генов (vanН, vanA, vanX, vanR, vanS, vanY и vanZ), которые приобретает через транспозон Tn1546.
д) Резистентность энтерококков к фторхинолонам. Был изучен механизм резистентности клинических штаммов Е. faecalis и Е. faecium к фторхинолонам. Для обоих видов высокий уровень резистентности связан с заменой аминокислот в детерминантной области фторхинолоновой резистентности. МИК ципрофлоксацина в отношении 10 изученных штаммов Е. faecium варьирует от 32 до более 256 мкг/мл.
е) Резистентность энтерококков к прочим антибиотикам. Резистентность энтерококков к некоторым антибиотикам обнаруживали в штаммах, выделенных от людей еще в первой половине 50-х годов прошлого столетия.
Более 50 % штаммов энтерококков, выделенных от больных в городской больнице Бостона в 1953-1954 гг. были резистентны к стрептомицину и тетрациклину, а 96 и 25 % штаммов были резистентны к хлорамфениколу и эритромицину соответственно. Не было обнаружено ни одного штамма, резистентного к ампициллину, гентамицину или ванкомицину.
Среди штаммов энтерококков, изолированных от больных Вашингтона и его окрестностей в середине 50-х годов прошлого столетия, половина имела минимальный уровень чувствительности к эритромицину, но не к линкомицину.
Более общий механизм резистентности к эритромицину среди энтерококков и других грамположительных бактерий включает деметилирование адениновых остатков в 23S рРНК внутри рибосомальной субъеденицы 50S.
Частота случаев резистентности энтерококков к тетрациклину варьировала между 50 и 80 % и, как в случае с резистентностью к хлорамфениколу, зависела от географического расположения и времени выделения штаммов. У энтерококков выявлено два механизма устойчивости к тетрациклину — активный выброс (эффлюкс) и рибосомальная защита. Энергозависимый эффлюкс-механизм, связанный с плазмидами, обеспечивает ген tetL, в то время как ген tetM ответственен за защиту рибосом. Ген tetM был обнаружен в энтерококках, а также в грамотрицательных и грамположительных бактериях. Обычно в штаммах энтерококков ген tetM связан с хромосомой и часто может быть локализован на транспозоне, но он может также присутствовать и на плазмиде.
ж) Резистентность энтерококков к линезолиду. Линезолид — единственный представитель нового класса антибактериальных препаратов — оксазолидонов, предназначенных для клинического лечения некоторых бактериальных инфекций, вызываемых грамположительными микроорганизмами, включая инфекции, обусловленные резистентными к ванкомицину штаммами энтерококков.
Оказалось, что резистентность штаммов энтерококков к линезолиду развивается крайне редко. Впоследствии была собрана коллекция устойчивых к ванкомицину клинических штаммов энтерококков, чувствительных к линезолиду, которые были подвергнуты серийным пассажам с удвоенными концентрациями антибиотиков. В результате были выявлены резистентные к линезолиду варианты энтерококков. Штаммы Е. faecalis начали проявлять резистентность к линезолиду через три пассажа, их МИК к этому антибиотику достигли лишь уровня от 8 до 16 мкг/мл.
Значения МИК90 этого препарата для различных видов энтерококков, независимо от устойчивости к препаратам различных классов, составляет 4,0 мкг/мл. Линезолид применяется внутривенно и внутрь и не применяется внутримышечно.
Энтерококки (Enterococcus spp.) как причина раневых инфекций. Факторы патогенности
Факторы патогенности энтерококков
Энтерококки вызывают широкий круг инфекций у людей. Они обычно инфицируют мочевыводящие пути, кровяное русло, эндокард, брюшную полость, желчные пути, ожоговые раны и имплантированные извне устройства — например, внутрисосудистые катетеры. Реже энтерококки могут поражать нервную систему, легкие, мягкие ткани, околоносовые пазухи, уши, глаза и периодонт.
Известно, что энтерококки являются нормальными комменсалами человека в таких экологических его комплексах, как микрофлора полости рта, желудочно-кишечного тракта и влагалища, адаптированных к условиям питания и ограничению кислорода. Штаммы Е. faecalis обуславливают 80-90% энтерококковых инфекций у человека, в то время как другой вид энтерококков, Е. faecium, является причиной остальных 10-20% случаев. Такие виды энтерококков, как Е. avium, Е. casseliflavus, Е. durans, Е. gallinarum, Е. hirae, Е. malodoratus, Е. mundtii, Е. raffinosus, и Е. solitarius довольно редко обнаруживаются у людей.
В 70-е и 80-е годы прошлого века энтерококки стали одной из главных причин внутрибольничных инфекций. В настоящее время они занимают четвертое место среди ведущих видов микроорганизмов, вызывающих внутрибольничные инфекции и третье место — как причина бактериемий в США.
Показано, что Е. faecalis могут вторгаться в дентинные каналы, в то время как не все бактерии обладают этой способностью.
Наиболее изученные факторы патогенности, образуемые штаммами рода Enterococcus — поверхностные адгезины, агрегирующая субстанция, половые феромоны, липотейхоевые кислоты, внеклеточные перекиси, желатиназа, гиалуронидаза и цитолизины (гемолизины), а также факторы непрямого действия, такие как субстанция AS-48 и другие бактериоцины.
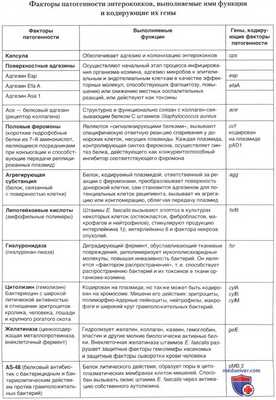
а) Поверхностные адгезины. Начальным этапом процесса инфицирования организма-хозяина является адгезия микроорганизма к эпителиальным и эндотелиальным клеткам, лейкоцитам или внеклеточному матриксу. Более того, адгезины, т. е. поверхностные белки, осуществляющие процесс адгезии, играют разнообразную роль в качестве эффекторных молекул, способствующих фагоцитозу, повышающих или снижающих местные воспалительные реакции или же действующие как токсины.
Интенсивное исследование энтерококковых адгезинов началось лишь в последнее время. Энтерококковый ген esp, кодирующий высокомолекулярный поверхностный белок Esp, определяется у значительного большинства штаммов Е. faecalis, выделенных при бактериемиях и эндокардитах, но редко — у штаммов, изолированных от здоровых лиц. Участие поверхностного белка Esp в колонизации и персистенции энтерококков в мочевом тракте было показано на животных.
Белок Esp также связан с первичным прикреплением и образованием штаммом Е. faecalis биопленок на абиотических поверхностях. Более того, образование биопленок штаммами Е. faecalis было обнаружено на стенках леченных дентинных каналов, что делало штамм энтерококка резистентным к бактерицидному эффекту перекиси кальция при лечении зубных каналов.
Исследовались факторы, обеспечивающие связывание энтерококков с белками внеклеточного матрикса (ВКМ). Различные штаммы Е. faecalis, выделенные из разных клинических источников, были способны агглютинироваться ВКМ-белками, включая коллагены типа 1 и IV, что может быть связано с поверхностной гидрофобностью клеток.
Адгезия бактерии к коллагену ослаблялась последующей предварительной обработкой энзимом, расщепляющим белки, или последующим расщеплением субстрата ферментом коллагеназой. Предполагаемый белковый адгезии был впоследствии идентифицирован как Асе.
Обнаружено также, что разрушение гена асе ослабляет связывание Е. faecalis с ВКМ-белками. Идентификация Асе-специфических антител в сыворотке, полученной от пациентов с энтерококковыми инфекциями, и особенно от больных эндокардитами, вызванными штаммами Е. faecalis, показывает, что Асе всегда образуются различными штаммами Е. faecalis, инфицирующими людей, но не образуются при 46ПС in vitro.
Изучение последовательности аминокислот белка EfaA выявило 55-60% гомологии с группой стрептококковых белков, являющихся адгезинами. Это позволило предположить, что белок EfaA может функционировать в качестве адгезина при эндокардитах. Продукция белка EfaA штаммами Е. faecalis, по-видимому, происходит с высокой вероятностью. В одном исследовании ген efaA был выявлен во всех биологических образцах (кровь, гной, моча, кал, в окружающей среде больниц) и во многих продуктах питания (молоко, сыр, мясо), содержащих Е. faecalis.
Нормальная сыворотка может вызывать экспрессию поверхностного адгезина, что доказывается адгезией Е. faecalis к эукариотическим клеткам с помощью углеводных остатков, присутствующих на поверхности бактерий. Так, штаммы Е. faecalis, выделенные от больных с инфекциями мочевого тракта, экспрессируют лиганды D-галактозы и L-фруктозы, если выращиваются в сыворотке, но не экспрессируют эти лиганды, когда их выращивают в бульоне с сердечно-мозговым настоем.
Патогенная значимость феромонов проявляется в том, что они являются посредниками процесса конъюгации и способствуют передаче реплицированных плазмид.
Половые феромоны являются короткими гидрофобными белками, состоящими из 7-8 аминокислот, которые переносятся хромосомой и являются «сигнализирующими белками» в штаммах Е. faecalis. Они были названы феромонами, потому что при конъюгации они вызывали специфическую ответную реакцию спаривания у донорских клеток, несущих плазмиды. Феромоны секретируются штаммами Е. faecalis, которые способствуют передаче плазмидной ДНК при конъюгации между штаммами. Каждая плазмида, контролирующая синтез феромона, синтезирует белок, который действует как конкурентоспособный ингибитор соответствующего феромона.
Некоторые, хотя и не все феромоны и ингибирующие их белки, еще действуют в качестве хемоаттрактантов для нейтрофилов, вызывая секрецию гранулирующих ферментов и ингибируя дыхательный взрыв. Последний процесс способствует усилению выработки супероксида нейтрофилами после фагоцитирования штаммов энтерококков, несущих конъюгативную цитолитическую плазмиду.
Система половых феромонов увеличивает в несколько раз частоту передачи конъюгативных плазмид Е. faecalis. При этом реципиентный штамм секретирует в среду половой феромон соответствующей плазмиды, которой у него нет. В ответ донорский штамм продуцирует адгезиноагрегирующую субстанцию, которая осуществляет тесный контакт между реципиентным и донорским штаммами, обеспечивая конъюгативную передачу реплицированной плазмиды. Через систему полового феромона резистентность к антибиотикам и некоторые факторы вирулентности (например, цитолизины) могут распространяться на другие штаммы E.facialis.
Феромоны с АМ373 и cPD1 действуют как хемоаттрактанты в наномолекулярных концентрациях. Однако некоторые исследователи сообщают о более низком уровне активности таких феромонов.
Штаммы энтерококков обычно выделяют феромоны, так что эффект хемотаксиса феромонов проявляется даже при их низкой концентрации. Правда, вопрос о том, могут ли эти пептиды и их ингибиторы модулировать воспалительные реакции in vitro, остается открытым.
б) Агрегирующая субстанция представляет собой белок, который связан с поверхностью бактериальной клетки и кодируется плазмидой, ответственной за реакции на феромоны у штаммов Е. faecalis. Она экспрессируется при индукции реакции на феромоны, а также преобразует поверхность бактерии-донора таким образом, что она становится адгезином для потенциальных клеток-реципиентов, вызывая их агрегацию или конгломерацию и облегчая при этом передачу плазмид.
Поскольку агрегирующая субстанция экспрессируется донорской клеткой, процесс бактериальной конъюгации нуждается в «связывающей субстанции», которая переходит на рецепторную клетку.
Показана стабильность генов, кодирующих агрегирующую субстанцию, которые получены от различных специфичных по цитолизину и не специфичных по нему плазмид, а также плазмид, отвечающих за реакцию на феромоны.
Агрегирующая субстанция фиксируется на бактериальной мембране с помощью С-конца цепи, прикрепляясь к белку, связанному с клеточной стенкой грамположительных бактерий. На электронных микрофотографиях агрегирующая субстанция выглядит как множество волосков на клеточной поверхности, включенных в клеточную стенку.
Наряду с адгезивной функцией в процессе бактериальной конъюгации, in vitro агрегирующая субстанция прикрепляет Е. faecalis к различным эукариотическим клеткам, включая почечные цилиндрические клетки и эпителиальные клетки кишечника. Показано также, что агрегирующая субстанция связывает белки, включая коллаген типа I, с внеклеточным матриксом. Этот факт открывает новые возможности для борьбы с зубными инфекциями, так как коллаген типа I является главным компонентом дентина.
Агрегирующая субстанция часто обнаруживается в клинических штаммах энтерококков, но ее редко находили в культурах, изолированных из фекалий здоровых людей, что наводит на мысль о возможной патогенетической роли агрегирующей субстанции в инфекциях, вызванных Е. faecalis у людей.
в) Липотейхоевые кислоты. Поверхностные мембранно-связанные липотейхоевые кислоты (ЛТК) являются амфофильными полимерами, состоящими из гидрофильной полиглицерофосфатной основы, имеющую эфирную связь с гидрофобным гликолипидным хвостом. Различные компоненты и особенно липотейхоевые кислоты Е. faecalis вызывают апоптоз в культуре клеточных линий (остеокласты, периодонтальный лигамент, фибробласты, макрофаги и нейтрофилы).
Изучены некоторые особенности энтерококковых ЛТК. Показано, что они, так же как и ЛТК патогенного стрептококка (S. pyogenes), обратимо связываются с эритроцитами человека. Важным для обеспечения процесса связывания являлся ацетильный остаток ЛТК. Эти данные имеют отношение к местным воспалительным процессам, т.к. ЛТК связывается с эукариотическими клетками, придавая им антигенную специфичность. В результате этого клетки подвергаются лизису опосредованно через комплемент, который находится в плазме.
ЛТК, образуемые энтерококками, являются мощными индукторами провоспалительных цитокинов. Выделенные из штаммов Е. faecalis, как и из других грамположительных бактерий, ЛТК стимулируют лейкоциты, освобождая некоторые медиаторы, играющие роль в различных фазах воспалительного ответа организма-хозяина (интерлейкины).
Очищенные ЛТК из штаммов Е. faecalis могут подавлять агрессию некоторых бактериальных клеток, индуцированную феромонами. Было также подтверждено, что ЛТК действуют как связывающая субстанция, узнаваемая как агрегирующая субстанция на донорских клетках.
Из изложенного выше можно заключить, что энтерококковые ЛТК могут выполнять роль факторов вирулентности, так как способствуют возникновению воспалительных реакций и облегчают перенос плазмид.
г) Цитолизин. Первое комплексное исследование факторов вирулентности было связано с именем Тодда (Е. W. Todd), который в 1934 году опубликовал работу, посвященную цитолизину (гемолизину). Продукция цитолизина штаммами Е. faecalis была выявлена по появлению четких зон а-гемолиза вокруг колоний, выращенных на кровяном агаре. Штаммы Е. faecalis с таким фенотипом, однако, часто пропускались в клинических лабораториях из-за использования бараньих эритроцитов в питательных средах, которые не лизировались выделяемыми цитолизинами. Эритроциты кролика, человека, лошади и крупного рогатого скота чувствительны к литическому действию цитолизинов.
Более общее название «цитолизины» было выбрано в связи с тем, что спектр клеток-мишеней для лизинов, более широк, чем эритроциты, и включает клетки эукариотов и прокариотов.
Цитолизин, продуцируемый разными штаммами Е. faecalis, чаще всего бывает кодирован плазмидой, но также может быть кодирован хромосомой.
Образование и активация цитолизина состоит из нескольких этапов, каждый из которых подвергся тщательному изучению. Образующая цитолизин бактерия защищена от лизиса с помощью cyl-генного продукта через неизвестный пока механизм. Среди известных клеток-мишеней цитолизина — эритроциты, полиморфноядерные лейкоциты, нейтрофилы, макрофаги и широкий спектр грамположительных, но не грамотрицательных бактерий.
Было также показано, что гены cylL1, и cylLs, кодирующие структурные субъединицы цитолизина, являются регуляторами ответа на изменяющиеся кислородные условия и вызывают образование повышенного количества цитолизина в анаэробных условиях. Иначе говоря, генная экспрессия цитолизина клетками Е. faecalis регулируется в ответ на условия аэробиоза. Эти данные очень важны с точки зрения инфицирования штаммами Е. faecalis зубных каналов, поскольку энтерококки могут выживать в анаэробных условиях зубных каналов и после истощения кислорода аэробами. Анаэробные условия могут также преобладать в слоях бактериальных биопленок в зубных каналах, поскольку штаммы Е. faecalis способны образовывать биопленки.
Цитолитические штаммы Е. faecalis выделяют бактериоцин с широким спектром активности против грамположительных, но не грамотрицательных бактерий. Вместе с тем, цитолитическая и бактерицидная активности утрачиваются при ультрафиолетовом облучении, хотя и восстанавливаются при реверсии штаммов. Эти явления указывают на то, что у энтерококков существует единый материал, ответственный и за цитолитическую, и за бактериолитическую активность.
Роль цитолизина как фактора патогенности доказана частично. Так, приблизительно 60 % клинических штаммов Е. faecalis, выделенных из образцов кала больных, были гемолитическими, но только 17 %, выделенных от здоровых людей, не проявляли гемолитической активности. В других исследованиях было показано, что только 16% клинических штаммов Е. faecalis образовывали цитолизин. Видимо, роль этого белка как основного фактора патогенности невелика.
У клинических штаммов Е. faecalis ген cyl не всегда экспрессируется (отсутствует гемолиз на кровяном агаре). Факторы, которые могут оказаться в инфицированном участке тела, могут активировать этот молчащий ген.
Потенциальный вклад энтерококковой протеиназы в вирулентность образующих ее штаммов доказан в 1975 году в опытах над безмикробными крысами, у которых такие штаммы вызывали кариес, в отличие от непротеолитического штамма E.faecalis. Была также выявлена способность к образованию протеазы у энтерококков, инфицирующих человека. 63% энтерококков, выделенных от больных в хирургических и нейрохирургических отделениях интенсивной терапии в Германии, образовывали протеазу. Следовательно, желатиназа также участвует в инфекционном процессе, вызываемом энтерококками.
При анализе нуклеотидной последовательности гена ge/E было выявлено сходство с цинкометаллопрогеазой (эластазой), образуемой штаммом Pseudomonas aeruginosa. Этот фермент рассматривается как фактор вирулентности при тяжелых инфекциях, особенно у больных муковисцидозом.
е) Гиалуронидаза (гиалуронанлиаза) действует на гиалуронан — мукополисахарид, входящий в состав соединительной ткани, и является, в основном, деградирующим ферментом, который вызывает тканевые повреждения. Она деполимеризирует мукополисахаридные молекулы, соединенные с тканями и, таким образом, повышает инвазивность бактерий.
Гиалуронидаза, являясь токсичным разрушающим ферментом, способствует распространению бактерий и их токсинов через ткани организма-хозяина. Присутствие микроорганизмов, включая и E.faecalis, при перитонеальных поражениях, может быть связано с активностью фермента, такого как гиалуронидаза.
ж) AS-48 является бактериоцином — белковым антибиотиком, обладающим бактерицидным и бактериолитическим действием против грамиоложительных (в том числе энтерококков), ряда грамотрицательных бактерий и других микроорганизмов. Как было определено, бактериоцин AS-48, является основным белком, вызывающим литический эффект путем образования пор в цитоплазматических мембранах клеток-мишеней. Он также способен вызывать лизис штамма Е. faecalis через активацию собственного аутолизина. AS-48 может быть кодирован трансмиссивной плазмидой рМВ 2.
Значимость этого бактериоцина в качестве фактора патогенности сомнительна, так как частота выявления штаммов, образующих AS-48, среди энтерококков-ком-менсалов человека еще не определена. Результаты, полученные с помощью ПЦР, свидетельствуют о том, что бактериоцины, образуемые многими штаммам Е. faecalis, близки или идентичны пептиду AS-48.
Enterococcus (энтерококки)
Энтерококки (лат. Enterococcus) — род повсеместно распространённых грамположительных бактерий.
Энтерококки не образуют спор и капсул. Они имеют овальную форму и размер 0,6-2,0 на 0,6-2,5 мкм. Энтерококки являются факультативными анаэробами, способными использовать энергию брожения и, поэтому, жить и при больших, и при ничтожных количествах кислорода. Энтерококк растет при температуре от 10 до 45° С, но температура от 35 до 37° С для него наиболее оптимальна. Энтерококк осуществляет метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, снижая кислотность среды до 4,2-4,6. Энтерококки высокорезистентены к различным факторам внешней среды и дезинфицирующим средствам, могут длительное время сохранять жизнеспособность на предметах домашнего обихода, выдерживают нагревание до 60° С в течение 30 минут.
Энтерококки — важнейшие представители микробиоты человека
Энтерококки, с одной стороны, являются возбудителями инфекций мочевыводящих путей, интраабдоминальных инфекций, инфекций органов малого таза, раневых инфекций, эндокардита, на их долю приходится существенное количество внутрибольничных инфекций (6 % от всех внутрибольничных инфекций мочевыводящих путей, 12 % — раневых инфекций и 9 % — внутрибольничных инфекций кровотока). С другой стороны, энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека и многих позвоночных, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки. Энтерококки колонизируют преимущественно тонкую кишку, но также в заметном количестве встречаются в толстой кишке, губчатой части мочеиспускательного канала, в половых органах и, иногда, в полости рта.
В клиническом материале 80-90 % от всех выделенных у человека энтерококков составляют Enterococcus faecalis. На втором месте Enterococcus faecium — 5-10 %, остальные энтрококки относятся к Enterococcus gilvus и Enterococcus pallens (Бондаренко В.М., Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции).
В количественном отношении в толстой кишке энтерококки составляют менее 1 % от общего числа бактерий, проигрывая, например, бифидобактериям примерно в 100 раз или более. У детей раннего возраста количество энтерококков на 1 г фекалий 10 6- 10 7 , у взрослых — 10 7 -10 8 , у пожилых — 10 6 -10 7 .
Энтерококки заселяет кишечник человека в первые дни жизни, причём это заселение происходит более активно у детей, находящихся на грудном вскармливании.
Энтерококки часто вызывают инфекции мочеполовых органов, особенно у пациентов, принимавших антибиотики и подвергавшихся инструментальным исследованиям. Наиболее патогенны для человека Enterococcus faecalis (фекальный энтерококк), Enterococcus faecium (энтерококк фэциум) и Enterococcus durans. К энтерококковой инфекции предрасполагают пожилой возраст, тяжелые заболевания, нарушения барьерной функции кожи и слизистых, подавление нормальной микрофлоры антибиотиками.
Титры энтерококков уменьшаются при болезни Крона и повышаются при колоректальном раке, бронхиальной астме, ассоциированы с раком легкого, эндометритом. Enterococcus faecium, Enterococcus faecalis участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).
Антибиотикорезистентность энтерококков
За последние три десятилетия энтерококки приобрели резистентность практически ко всем известным классам антимикробных препаратов. В целом, лечение антибиотиками повышает риск для отбора устойчивых к антибиотикам штаммов микробиоты желудочно-кишечного тракта (ЖКТ). В частности, эрадикационная терапия на основе антибиотиков в отношении Нelicobacter pylori может вызвать развитие антибиотикоустойчивых штаммов в микробиоте кишечника. Использование различных схем тройной терапии против Нelicobacter pylori, в том числе в сочетании с амоксициллином и метронидазолом или кларитромицином и метронидазолом привело к развитию резистентных стрептококков и стафилококков, а также к увеличению числа резистентных энтерококков, энтеробактерий и бактериоидов. Результаты когортного исследования показали, что тройная терапия, состоящая из омепразола, кларитромицина и метронидазола, способствует развитию устойчивости к макролидам в микробиоте хозяина и отбору устойчивых энтерококков, которые сохраняются в микробиоте человека в течение нескольких лет после окончания антибактериальной терапии (Старостин Б.Д.).
Важным с научной и практической точек зрения представляется вопрос распространения среди энтерококков устойчивости к ванкомицину. Ванкомицинрезистентные энтерококки (VRE) впервые были выделены в Великобритании и Франции в 1980-х гг. За последние 20 лет они признаны значимыми нозокомиальными патогенами. Для инфекций, обусловленных ванкомицинрезистентными энтерококками, характерны быстрое распространение и сравнительно высокие уровни заболеваемости и смертности среди инфицированных пациентов. Доля ванкомицинрезистентных среди всех выделяемых штаммов энтерококков наиболее высока в отделениях реанимации и интенсивной терапии. В США этот показатель составляет более 28,5%, в европейских странах — 2-3%. В России в последние годы данный показатель оценивается в 7-20%. Увеличение числа инфекций, обусловленных ванкомицинрезистентными энтерококками, в США объясняется широким использованием ванкомицина в медицине, тогда как в странах Европы — использованием гликопептидного антибиотика авопарцина в сельском хозяйстве (Светоч Э.А. и др.).
Энтерококковый гастрит
- микробиота желудка включает и другие микроорганизмы, помимо H. pylori.
- данные микроорганизмы могут вызывать различные заболевания желудка и осложнения у человека (атрофический гастрит, рак желудка и др.).
Энтерококки в составе лекарств, БАДов и пробиотиков

Энтерококки являются активным ингредиентом некоторых лекарственных средств-пробиотиков, предназначенных для лечения дисбактериоза и восстановления нормальной микрофлоры кишечника. В частности, в лекарственные препараты-пробиотики Бифиформ (фирма-изготовитель Ferrosan), Линекс (изготовитель Lek) и Bioflorin (изготовитель Cerbios-Pharma) включён специально подобранный, отличающийся высоким уровнем антибиотикорезистентности и непатогенности штамм Enterococcus faecium SF68, в геноме которого отсутствуют известные для патогенных клинических изолятов энтерококков гены вирулентности.
Беззародышевый водный субстрат продуктов обмена веществ Enterococcus faecium DSM 4086 входит в состав противодиарейного лекарства Хилак форте.
Для включения в пробиотики обычно используют штаммы энтерококков, исходно селекционированные для создания пищевых продуктов. Эти штаммы не приспособлены к длительному пребыванию в организме человека и за одну-две недели полностью выводятся из него.
СанПиН 2.3.2.2340-08, утвержденный Постановлением Главного государственного санитарного врача РФ 18 февраля 2008 г. № 13 разрешает к использованию в пищевой промышленности энтерококки Enterococcus durans и Enterococcus faecium.
Энтерококки при анализе кала на дисбактериоз
Количество энтерококков в кале исследуют при анализе на дисбактериоз. Норма: у детей до года — от 10 5 до 10 7 энтерококков (колониеобразующих единиц) на 1 г кала, от 10 5 до 10 8 энтерококков для пациентов от года до 60 лет и от 10 6 до 10 7 — для пациентов старше 60 лет. При этом абсолютное большинство среди других энтерококков составляют фекальные энтерококки.
Терапия при избыточном росте энтерококков
- детям до 6 месяцев — 10 мл
- детям от 6 месяцев до 1 года — 10-15 мл
- детям от 1 года до 3 лет — 15-20 мл
- пациентам старше 3 лет — 20-30 мл
- детям до 6 месяцев — 10 мл
- детям от 6 месяцев до 1 года — 20 мл
- детям от 1 года до 3 лет — 30 мл
- пациентам старше 3 лет — 40-60 мл
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении энтерококков: рифаксимин, рокситромицин. Не активен — линкомицин.
Энтерококки в микрофлоре влагалища
Энтерококки присутствуют в составе нормальной микрофлоры влагалища, при этом в норме их количество мало и составляет единицы процентов или даже десятые доли процента относительно других бактерий. Так как энтерококки в большом количестве содержатся в кишечнике, то повышенное их количество во влагалище может быть следствием несоблюдения гигиены или специфичностью применяемых сексуальных практик. Энтерококки, также как и некоторые другие бактерии, могут быть причиной вульвитов и вагинитов.
Инфекция мочевых путей и энтерококки
Бактериурия — наличие бактерий в моче может является признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 10 5 микробных тел в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. Часто бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной или асимптоматическая бактериурией. В то же время, бактериурия нередко сочетается с симптомами цистита, пиелонефрита, простатита, уретрита. а также встречается у беременных. Бессимптомная бактериурия не всегда требует немедленного лечения.
Энтерококки являются одним из возбудителей воспалений мочевыводящих путей, на их долю приходится от 1 до 18 % (в зависимости от типа заболевания) всех выявленных при бактериурии микроорганизмов. Энтерококки являются причиной 7 % всех острых простатитов. Среди энтерококков — возбудителей воспалений мочевыводящих путей доминирующим видом является фекальный энтерококк (Enterococcus faecalis).
Публикации и видео для профессионалов здравоохранения, затрагивающие роль энтерококков в заболеваниях ЖКТ

Материалы для пациентов
- «Советы врачей» в разделе сайта «Пациентам»
- «Популярная гастроэнтерология» в разделе «Литература»
- «Популярная гастроэнтерология» в разделе «Видео»
Энтерококки в классификации бактерий
По принятой ранее классификации энтерококки относились к стрептококкам класса D и, например, Enterococcus faecalis и Enterococcus faecium назвались Streptococcus faecalis и Streptococcus faecium. По современной классификации род Enterococcus входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
В род Enterococcus входят следующие виды энтерококков: Enterococcus alcedinis, Enterococcus aquimarinus, Enterococcus asini, Enterococcus avium, Enterococcus azikeevi, Enterococcus bulliens, Enterococcus caccae, Enterococcus camelliae, Enterococcus canintestini, Enterococcus canis, Enterococcus casseliflavus, Enterococcus cecorum, Enterococcus columbae, Enterococcus crotali, Enterococcus devriesei, Enterococcus diestrammenae, Enterococcus dispar, Enterococcus durans, Enterococcus eurekensis, Enterococcus faecalis, Enterococcus faecium, Enterococcus gallinarum, Enterococcus gilvus, Enterococcus haemoperoxidus, Enterococcus hawaiiensis, Enterococcus hermanniensis, Enterococcus hirae, Enterococcus inusitatus, Enterococcus italicus, Enterococcus lactis, Enterococcus lemanii, Enterococcus malodoratus, Enterococcus massiliensis, Enterococcus moraviensis, Enterococcus mundtii, Enterococcus olivae, Enterococcus pallens, Enterococcus pernyi, Enterococcus phoeniculicola, Enterococcus plantarum, Enterococcus pseudoavium, Enterococcus quebecensis, Enterococcus raffinosus, Enterococcus ratti, Enterococcus rattus, Enterococcus rivorum, Enterococcus rotai, Enterococcus saccharolyticus, Enterococcus saigonensis, Enterococcus silesiacus, Enterococcus sulfureus, Enterococcus termitis, Enterococcus thailandicus, Enterococcus ureasiticus, Enterococcus ureilyticus, Enterococcus viikkiensis, Enterococcus villorum, Enterococcus xiangfangensis, Enterococcus xinjiangensis.
Ранее входящий в род энтеркокков вид Enterococcus seriolicida в настоящее время реклассифицирован как Lactococcus garvieae.

Читайте также:
