Этапы ухода после торакопластики. Камфора после торакопластики
Добавил пользователь Алексей Ф. Обновлено: 09.01.2026
Торакопластика (греч. thorax, thorakos грудь, грудная клетка + plastike ваяние, пластика) — хирургическая операция, заключающаяся в резекции ребер и производимая с целью уменьшения объема грудной полости.
Развитие Торакопластики тесно связано с попытками оперативного лечения туберкулеза легких (см. Туберкулез органов дыхания). Идея резекции ребер для лечебного воздействия на туберкулезную каверну возникла в конце 19 в. Она основывалась на факте излечения или затихания туберкулезного процесса в легком после уменьшения объема соответствующей половины грудной полости. Первая Торакопластика выполнена Квинке (H. I. Quincke) в 1886 г. В 1890 г. Шеде (М. Schede) для лечения хронической эмпиемы плевры предложил удалять над остаточной полостью ребра вместе с надкостницей, межреберными мышцами, утолщенной плеврой. Шпенглер (С. Spengler) ввел термин «торакопластика». Дальнейшее усовершенствование методов Торакопластики тесно связано с применением искусственного пневмоторакса (см. Пневмоторакс искусственный) как метода коллапсотерапии (см.) туберкулеза легких. В 1907 г. Брауэр (L. Brauer) предложил обширное удаление реберного каркаса в случаях, когда наложение искусственного пневмоторакса было невозможно из-за плевральных сращений. Первую такую операцию в 1909 г. выполнил Фридрих (P. Friedrich). Однако торакопластика по Брауэру — Фридриху не получила широкого распространения вследствие травматичности и тяжести для ослабленных больных туберкулезом и высокой послеоперационной летальности.
В дальнейшей разработке Т. важное значение имели исследования Гурде (J. Gourdet, 1895), к-рый показал, что уменьшение объема грудной полости зависит в первую очередь от резекции паравертебральных (задних, или околопозвоночных) отрезков ребер.
В 1911 —1912 гг. Ф. Зауэрбрух разработал новую методику Т., при к-рой удалялись только паравертебральные отрезки ребер. Резекция ребер выполнялась поднадкостннчно, что обеспечивало их регенерацию в новой позиции и последующую устойчивость грудной стенки, причем с целью уменьшения размера грудной полости в вертикальном направлении обязательно удаляли первое ребро. Ф. Зауэрбрух считал необходимой резекцию десяти — одиннадцати ребер даже при относительно ограниченных поражениях, так как полагал, что только обширная резекция ребер создает покой для легкого и предупреждает возможность аспирации мокроты в его нижние отделы. Однако дальнейшее изучение исходов Т. показало, что при ограниченных процессах хорошие результаты можно получить и при более экономных, селективных (частичных) операциях. При этом нужно резецировать все ребра выше и одно — два ребра ниже уровня нижнего края каверны, определяемого относительно задних отрезков ребер на рентгенограмме легких в прямой проекции. При необходимости обширной Т., особенно у ослабленных больных, резекцию ребер целесообразно разделить на два или три этапа. Промежутки между этапами не должны превышать 2—3 нед. во избежание регенерации ребер из оставленной надкостницы. При такой щадящей методике эффективность операции в целом не снижается, больные же переносят ее легче.
Описано более 20 способов и модификаций Т. Современные виды селективной Т. являются высокоэффективными оперативными вмешательствами, при к-рых не наблюдается грубых деформаций грудной клетки и нарушений осанки. Поэтому старые представления о Т. как о калечащей и уродующей операции теперь могут иметь отношение только к очень редко производимой (гл. обр., при тяжелых туберкулезных эмпиемах плевры у больных после пневмонэктомий) тотальной Т. или гемитораксэктомии (односторонняя резекция всех ребер).
В разработку селективной Торакопластики большой вклад внесли советские хирурги Н. В. Антелава, Л. К. Богушу Б. М. Гармсен, А. Г. Гильман, Ю. Ю. Джанелидзе, К. Д. Есипову И. С. Колесников, Н. Г. Стойко и др.
С середины 20-х до середины 50-х гг. 20 в. Т. была основным методом оперативного лечения деструктивных форм туберкулеза легких. Затем она стала быстро терять свое значение благодаря достижениям химиотерапии (см.) и внедрению в практику прямых оперативных вмешательств на легком. Однако и до наст, времени остается определенный контингент больных туберкулезом и другими заболеваниями легких, для лечения к-рых показана Т.
В СССР применяют селективную Т. следующих видов: экстраплевральную верхнезаднюю Т., интраплевральную верхнюю Т., лестничную Т., расширенную и этапную Т., селективную Т. с мышечной пластикой.
Содержание
Показания
Основными показаниями к Торакопластике являются деструктивные формы туберкулеза легких и эмпиема плевры (см. Плеврит) различного генеза. Т. может быть основным методом хирургического лечения или дополнительной, корригирующей операцией. В качестве основного метода хирургического лечения туберкулеза легких Т. показана при фиброзно-кавернозном туберкулезе с каверной в верхней доле легкого и очагами в других долях, а также в случае сохранения каверны после ее дренирования (см.) или кавернотомии (см.). Операцию целесообразно производить в фазе стабилизации процесса, но в случаях легочного кровотечения, обильного кровохарканья и выраженной стойкой интоксикации Т. может быть произведена и в фазе обострения по неотложным и экстренным показаниям. Показанием к Т. может быть туберкулезная или неспецифическая эмпиема плевры как с бронхиальными свищами, так и без них. В качестве дополнительной, корригирующей операции Т. применяют с целью уменьшения объема плевральной полости или для ликвидации различных бронхоплевральных и легочных осложнений после резекции легкого, пневмонэктомии (см.) и других оперативных вмешательств на органах грудной полости.
Противопоказания
Противопоказаниями к Т. при туберкулезе легких являются множественные каверны в разных долях легкого, стенозы крупных бронхов, легочно-сердечная недостаточность (см. Легочное сердце), а при эмпиеме плевры свищ главного или долевого бронха, так наз. решетчатое легкое (см. Бронхиальный свищ).
Предоперационная подготовка
Предоперационная подготовка к Торакопластике больных туберкулезом легких заключается в комплексном лечении с целью ликвидации обострения процесса, снятия туберкулезной интоксикации, уменьшения количества мокроты, улучшения дыхательной функции. Главным компонентом предоперационного лечения является комбинированная специфическая антибактериальная терапия. У больных с эмпиемой плевры важно добиться максимальной санации полости с помощью плевральных пункций или аспирации (см. Аспирационное дренирование, Плевра, Плевральная пункция). Длительность предоперационной подготовки — от 1—2 нед. до нескольких месяцев.
Обезболивание
Операцию производят под эндотрахеальным наркозом (см. Ингаляционный наркоз). При наличии бронхиальных свищей показана интубация бронха противоположной стороны или раздельная интубация бронхов (см. Интубация).
Техника операции
Торакопластику производят экстраплеврально или интраплеврально. При экстраплевральной Т. резекцию ребер производят не вскрывая плевральную полость, а при интраплевральной — плевральную полость вскрывают до, во время или после резекции ребер. Экстраплевральную Т. применяют в основном для лечения деструктивных форм туберкулеза легких, а интраплевральную — для уменьшения объема грудной полости после резекции легких, для лечения эмпием и бронхиальных свищей. Т. может быть выполнена последовательно с обеих сторон.
Экстраплевральная верхнезадняя торакопластика показана при фиброзно-кавернозном туберкулезе, остаточной полости каверны после дренирования или кавернотомии, остаточной верхушечной плевральной полости после резекции легкого.
Разрез кожи и подкожной клетчатки начинают на уровне I грудного позвонка и ведут каудально, огибая лопатку, до задней подмышечной линии на уровне VII ребра. Поднадкостнпчно выделяют и резецируют нижнее из подлежащих удалению ребер — VII, VI или V. Далее освобождают от надкостницы и резецируют вышележащие ребра от поперечных отростков позвонков до средней или передней подмышечной линии. I ребро резецируют последним.
У больных с каверной в верхушечном сегменте пли с остаточной паравертебральной полостью лучше также . удалить (экзартикулировать) шейки и головки ребер (кроме первого). Кровотечение из ложа удаляемых ребер останавливают диатермокоагуляцией (см.) и тампонадой (см.).
При Т. с резекцией отрезков семи ребер лопатка с фиксированными к ней мышцами западает в образовавшийся дефект реберного каркаса и усиливает спадение легкого. В то же время после резекции пяти или шести ребер нижний угол лопатки может оставаться над нижним ребром и при движениях задевать верхнее из оставшихся ребер, вызывая боль и нарушая подвижность плеча. В связи с этим целесообразно резецировать подостную часть лопатки, предварительно отслоив от нее надкостницу с прикрепляющимися мышцами. Л. К. Богуш (1936) предложил заканчивать операцию пневмолизом (см.) верхушки легкого с целью усиления коллапса верхней доли.
После резекции ребер вдоль всей раны укладывают дренажную трубку с несколькими боковыми отверстиями, над к-рой послойно сшивают мягкие ткани. Накладывают давящую повязку с ватно-марлевыми; или поролоновыми валиками в подключичной и подмышечной областях. Руку на стороне операции сгибают в локтевом суставе под прямым углом и на 3—4 дня фиксируют к туловищу. Затем постепенно начинают упражнения для плечевого сустава оперированной стороны. Через 2—3 нед. после операции накладывают давящую повязку на 1V2 — 2 мес. для лучшего западения и моделирования грудной стенки в области резецированных ребер.
Интраплевральная верхняя (корригирующая) торакопластика разработана в 1954 г. Л. К. Богушем. Показана при недостаточном расправлении оставшихся отделов легкого после резекции верхней доли легкого или ее сегментов.
Т. производят после окончания операции на легком. Резекцию ребер производят из плевральной полости без дополнительного разреза. Вначале поднадкостнично резецируют I ребро. Затем поднадкостнично резецируют II ребро от уровня поперечного отростка II грудного позвонка до передней подмышечной линии. При необходимости резецируют также отрезки III и IV ребер. В результате подвижный участок грудной стенки прогибается во внутрь и заполняет остаточную полость. Плевральную полость дренируют, мягкие ткани ушивают послойно.
Лестничная торакопластика предложена Геллером (Н. Heller, 1922) и Б. Э. Линбергом (1945). Операция показана при хронической эмпиеме плевры без бронхиальных свищей или со свищами мелких бронхов в случаях, когда имеются противопоказания к плеврэктомии (см.) и декортикации легкого (см.).
Разрез мягких тканей грудной стенки начинают соответственно верхнему краю остаточной плевральной полости и ведут между позвоночником и медиальным краем лопатки с продолжением в вентральном направлении, одновременно иссекают свищ. Поднадкостнично резецируют примыкающие к свищу одно — два ребра. Продольно рассекают глубокую часть надкостницы резецированного ребра с подлежащими утолщенными тканями грудной стенки, проникая в полость эмпиемы. Последовательно резецируют все ребра над остаточной полостью, вскрывая ее через ложе каждого удаленного ребра, в результате чего межреберные промежутки, отделенные друг от друга разрезами, образуют ряд перекладин, а грудная стенка над остаточной полостью приобретает вид лестницы. Над верхней границей полости резецируют еще одно ребро без рассечения глубокой части надкостницы. С внутренней поверхности перекладин иссекают толстые плевральные шварты до обнажения мышц, затем укладывают «перекладины» на дно остаточной полости как пластический материал. Одну дренажную трубку с несколькими боковыми отверстиями укладывают на поверхность легкого, вторую — на перекладины, рану мягких тканей ушивают. Лестничную Т. часто сочетают с мышечной пластикой остаточной полости (см. ниже).
Расширенная этапная торакопластика, или этапная торакотомия, разработана Л. К. Богушем (1947, 1979). Операцию производят при туберкулезной эмпиеме плевры, когда имеются противопоказания к другим видам операций.
Первым этапом расширенной Т. является широкая торакотомия (см.), вторым — экстраплевральная верхнезадняя Т. (см. выше), третьим — мышечная пластика остаточной полости. Производят дугообразный разрез от наружного края длинных мышц спины по ребру, соответствующему нижнему краю полости, до средней подмышечной линии. Поднадкостнично резецируют отрезки трех — четырех ребер длиной 15—18 см. После широкого вскрытия плевральной полости иссекают утолщенную париетальную плевру, мобилизуя межреберные мышечные лоскуты, производят тщательный туалет полости эмпиемы. Межреберные мышечные лоскуты укладывают в реберно-диафрагмальный синус. В послеоперационном периоде проводят открытое лечение, в процессе к-рого стенки плевральной полости очищаются от казеозных масс, фибринозно-гнойных наложений и покрываются грануляционной тканью. Через 2—4 нед. после торакотомии производят экстраплевральную верхнезаднюю Т. с удалением оставшихся отрезков верхних ребер и отслаиванием купола плевры от грудной стенки и боковой поверхности позвоночника. Еще через 1V2—2 мес., если остаточная плевральная полость сохраняется, удаляют регенерировавшие ребра и закрывают полость мышечными лоскутами на ножке, к-рые формируют из широчайшей мышцы спины, большой грудной мышцы, межреберных мышц.
Селективная торакопластика с мышечной пластикой показана при ограниченной хрон. эмпиеме плевральной полости без бронхиальных свищей или при их наличии.
Операция обычно является атипичной, ее ход зависит от наличия или отсутствия дефекта грудной стенки или плевроторакального свища. Она заключается в достаточно широкой поднадкостничной резекции ребер над полостью эмпиемы, ушивании бронхиального свища, выкраивании хорошо васкуляризированных лоскутов из большой грудной или широчайшей мышцы спины. Остаточную полость заполняют мышечными лоскутами, к-рые надежно фиксируют швами; затем вводят дренажную трубку и ушивают мягкие ткани.
Осложнения
Осложнения во время Торакопластики при ее правильном и осторожном выполнении наблюдаются редко. Большинство осложнений связано с травмой прилежащих к ребрам тканей и органов: вскрытие свободной плевральной полости при экстраплевральной Т., повреждение легкого, перфорация каверны, повреждение подключичных сосудов, плечевого сплетения при удалении первого ребра.
Возможными послеоперационными осложнениями являются нарушение трахеобронхиальной проходимости, ателектаз (см.), пневмония (см.), легочно-сердечная недостаточность (см. Легочное сердце). Для профилактики послеоперационных осложнений необходимы ранняя активизация больных, дыхательная гимнастика, бронхофиброскопия (см. Бронхоскопия, бронхофиброскопия) или катетеризация бронхов с туалетом бронхиального дерева (см. Бронхи, хирургическое лечение). У больных, оперированных по поводу эмпиемы плевры, послеоперационное течение может осложниться инфицированием раны с задержкой гноя и развитием септического состояния. Профилактика и лечение этого осложнения состоят в полноценном аспирационном дренировании и направленном применении антибиотиков широкого спектра действия.
Рентгенологическая картина после торакопластики. На обзорных рентгенограммах и томограммах после экстраплевральной Т. определяется уменьшение объема оперированной половины грудной клетки и спадание соответствующего легкого. Степень уменьшения объема грудной клетки и легкого на оперированной стороне зависит от вида и объема Т. Рентгенологические изменения в легких наблюдаются при возникновении пневмонии, иногда осложняющей послеоперационное течение. В первые дни после операции могут возникать массивные ателектазы, в свою очередь осложняющиеся пневмониями. После обширной Т. может наблюдаться флотирование (маятникообразное смещение, синхронное с дыханием) средостения в области дефекта грудной стенки, исчезающее по мере регенерации костной ткани из оставшейся надкостницы ребер.
В отдаленные сроки после операции спавшееся легкое частично расправляется и вентиляция его улучшается за счет увеличения амплитуды дыхательных движений диафрагмы и ребер на стороне оперативного вмешательства, что отчетливо определяется на рентгенокимограмме (см. Рентгенокимография). В ряде случаев расправления легкого в отдаленные сроки не происходит вследствие развития в нем после операции пневмосклероза (см.), а иногда в последующем — бронхоэктазов (см.).
Определяемые после Т. тени регенерировавших ребер, особенно на фоне массивных плевральных шварт, затрудняют распознавание остаточных каверн и щелевидных остаточных полостей эмпием в случае неэффективной операции. Томография (см.) облегчает диагностику каверн в спавшемся легком, а фистулография (см.) и бронхография (см.) — выявление остаточных полостей.
Прогноз
Послеоперационная летальность среди больных, перенесших Торакопластику по поводу деструктивного туберкулеза легких, менее 1%. Полный клин, эффект со стойким исчезновением микобактерий туберкулеза из мокроты и закрытием каверны отмечается у 75—85% оперированных больных. После Торакопластики по поводу эмпиемы плевры летальность составляет 5—8%, закрытие полости достигается у 70—75% больных.
Библиогр.: Антелава Н. В. Хирургия органов грудной полости, с. 46, М., 1952; Атлас грудной хирургии, под ред. Б. В. Петровского, т. 1, с. 82, М., 1971; Богуш Л. К. и Калиничев Г. А. Корригирующие операции при резекции легких, Тбилиси, 1979; Ротенфельд М. 3. Рентгенологические наблюдения над механизмом легочной вентиляции при расширенной верхне-задней торакопластике, Хирургия, № 8, с. 68, 1950; Руководство по легочной хирургии, под ред. И. С. Колесникова, с. 308, Л., 1969; Стойко Н. Г. Хирургическое лечение легочного туберкулеза, М., 1949; Хирургическое лечение туберкулеза легких, под ред. Д. К. Богуша, с. 72, М., 1979; Bier A., Braun Н. и. Кummell H. Chirurgische Operationslehre, Bd 3/1, S. 402, Lpz., 1971; Di Rienzо S. Rontgenologie der operierten Lunge, Fortschr. Rontgenstr., Bd 78, S. 400, 1953.
Операция по Д. Нассу — коррекция деформации грудной клетки в России
В Национальном медицинском исследовательском центре имени Г.И. Турнера в отделении костной патологии успешно применяются инновационные методы лечения врожденных и приобретенных деформаций грудной клетки. Для коррекции воронкообразной грудной клетки в Центре проводятся малоинвазивные торакопластики, включая модифицированную операцию Дональда Насса (Nuss procedure).
Что такое операция по Д. Нассу?
Операция Насса — это хирургическое вмешательство с использованием малоинвазивной методики, предназначенное для устранения воронкообразной деформации грудной клетки. Технология коррекции деформации включает три этапа: установка пластины, период ее ношения и удаление пластины.
Преимущества
Любое хирургическое вмешательство, выполненное при помощи малоинвазивной методики, намного предпочтительнее традиционной операции. Обусловлено это наличием ряда существенных плюсов — минимальная травматичность проведения операции, минимальный объем кровопотери, небольшой период послеоперационного лечения, короткий срок реабилитации и многие другие.
К преимуществам малоинвазивной торакопластики относятся:
- отличный косметический результат из-за отсутствия больших рубцов по передней поверхности грудной клетки;
- минимальная травматичность мягких тканей во время операции в сравнении с радикальными методами;
- подходит детям любого возраста с воронкообразными деформациями;
- длительность операции в 1,5-2 раза меньше в сравнении с радикальными методами.
Для выполнения малоинвазивных торакопластик мы используем пластины из титана, этот материал биоинертен к окружающим тканям пациента (аллергия к данному металлу практически исключена), обладает определенной эластичностью, что является немаловажной деталью в достижении и сохранении коррекции грудинно-реберного комплекса.
Как проводится операция Насса?
Операция делается под наркозом, с мониторингом дыхания и сердечной деятельности. Небольшие операционные доступы делаются по боковым поверхностям грудной клетки в строго рассчитанных точках индивидуально для каждого пациента.
Врачи делают индивидуальную конфигурацию пластины с учётом:
- размеров и формы грудной клетки;
- типа и степени деформации грудной клетки.

Коррекция деформации грудной клетки происходит при установке пластины в грудной клетке за счёт её нагрузки на зону деформации. Деформация может быть любая:
- килевидная;
- комбинированная;
- воронкообразная.
Далее к лёгким подводят мягкие силиконовые дренажи для удаления воздуха, раны ушивают косметическим швом. Больной переводится в отделение реанимации для обезболивания и наблюдения за работой органов и систем в течение суток.
В НМИЦ детской травматологии и ортопедии им. Г. И. Турнера операции Насса проводятся с использованием инструментов по индивидуальным чертежам.
Сколько длится операция по Нассу?
Операция Насса длится в с среднем 40-60 минут, в зависимости от степени деформации. Длительность операции зависит от числа устанавливаемых пластин и от индивидуальных особенностей больного.
Сколько времени в среднем проводит пациент в стационаре?
Пациент находится в стационаре около 7 дней, в зависимости от возраста и степени деформации грудной клетки. В послеоперационном периоде больным назначается симптоматическая терапия и дыхательная гимнастика.
После операции
Малоинвазивная торакопластика позволяет практически сразу после операции увидеть эффект коррекции деформации.
Если оперируется ребенок, то в процессе роста наблюдаются временные изменения конфигурации грудной клетки. Но имплантированная пластина поможет грудной клетке даже в условиях несинхронного роста реберных хрящей избежать грубых деформаций.
Минимальный срок имплантации мы рекомендуем - год. У детей это время увеличивается иногда в несколько раз. Каждый пациент получает свои рекомендации.
Как в НМИЦ им. Г.И. Турнера наблюдают пациентов после операции?

Рыжиков Дмитрий ВладимировичРуководитель первого отделения костной патологии Рыжиков Дмитрий Владимирович (кандидат медицинских наук, врач высшей квалификационной категории, врач-травматолог-ортопед): Каждого пациента юного возраста мы берём на контроль, понимая, что в процессе роста деформация может прогрессировать. Если речь идет о подростке 16-17 лет, то после проведения операции и послеоперационного восстановления, он считается выздоровевшим, так как нет потенциала роста скелета и нет потенциала увеличения деформации грудины, ребер.
Пациентов, которые ещё находятся в стадии активного роста, мы наблюдаем до завершения роста, когда с уверенностью сможем сказать, что деформация исправлена, а полученный результат стабилен.
Прооперированным пациентам даются рекомендации, которые они должны выполнять в первые 2-6 месяцев после операции, по:
• физическим нагрузкам;
• дыхательной гимнастике;
• нежелательным явлениям (травмы или травмоопасный спорт).В первые два месяца идет адаптация органов грудной клетки к новому положению, новому объёму плевральных полостей, идет регенерация тканей.
Спустя несколько месяцев после операции абсолютное большинство пациентов отмечают начало увеличения физической активности. Также, наблюдаются изменения в психологическом поведении. Ребенок становится более уравновешенным и сосредоточенным, улучшается социализация с другими детьми.
Если Вашему ребёнку поставлен диагноз «Деформация грудной клетки» — мы можем проконсультировать вас очно, или дать консультацию специалисту в вашем регионе через телемедицинскую консультацию.
Наши специалисты проводят уникальные операции по лечению патологий грудной клетки у детей всех возрастов. Мы постоянно разрабатываем и внедряем новые технологии, также используем и методы консервативного лечения.
Все наши врачи — квалифицированные специалисты с большим опытом работы в детской хирургии и ортопедии. Мы сопровождаем пациентов на всех стадиях лечения: от диагностики до реабилитационного периода.
Этапы ухода после торакопластики. Камфора после торакопластики
Институт хирургии им. А.В. Вишневского Минздравсоцразвития РФ, Москва
Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева
Институт хирургии им. А.В. Вишневского, Москва
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава РФ, Москва, Россия
ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
ФГБУ «Институт хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
Комбинированная торакопластика сетчатым титановым эндопротезом у пациентов с тотальной нестабильностью грудины в исходе хронического послеоперационного стерномедиастинита
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(11): 13‑19
Ежегодно в России выполняют около 60 тысяч операций на открытом сердце [1]. Основной хирургический доступ в кардиохирургии — срединная стернотомия, был предложен Милтоном в 1897 г. [2]. Распространенность заболеваний сердца и сосудов в популяции, рост общей продолжительности жизни, совершенствование медицинских технологий сегодня приводят к появлению малоинвазивных методик, позволяющих у ряда пациентов отказаться от открытой операции. Несмотря на это абсолютное число открытых операций через срединную стернотомию в развитых странах имеет устойчивую тенденцию к росту. Частота гнойно-септических осложнений после стернотомии, по данным отдельных авторов [3, 4], достигает 4—8%, и сохраняет устойчиво высокий уровень даже в узкоспециализированных центрах, на уровне не менее 0,4—3%. Одно из наиболее значимых септических осложнений в кардиоторакальной хирургии — стерномедиастинит, развивающийся вследствие частичной или полной несостоятельности шва грудины. Летальность при остром стерномедиастините достигает 14—50% [5]. При достижении контроля над раневым процессом актуальность приобретает проблема реконструкции передней грудной стенки — замещения обширных дефектов мягких тканей и восстановления каркасной функции [6, 7].
Сегодня предложено большое количество методов замещения дефектов грудной стенки, однако не выработан единый подход к выбору реконструктивной операции у пациентов с хроническим послеоперационным остеомиелитом грудины. В настоящем исследовании представлен анализ лечения 100 пациентов с хроническим послеоперационным стерномедиастинитом и тотальной нестабильностью грудины, которым на завершающем этапе лечения выполнена комбинированная торакопластика с имплантацией сетчатого титанового эндопротеза.
Материал и методы
В период с января 2016 г. по декабрь 2018 г. в отделении торакальной хирургии НМИЦ хирургии им. А.В. Вишневского проведено лечение 100 пациентов с нестабильностью грудины в исходе хронического послеоперационного стерномедиастинита. Возраст пациентов составил от 42 до 78 лет с медианой 62 (58; 68) года. Соотношение мужчин и женщин составило 82:18. Послеоперационный остеомиелит грудины возник в результате операций на сердце через срединную стернотомию после аорто- и маммарокоронарного шунтирования у 79 (79%) пациентов, протезирования клапанов сердца у 9 (9%) пациентов, протезирования аорты у 2 (2%), различных вариантов сочетанных операций у 10 (10%).
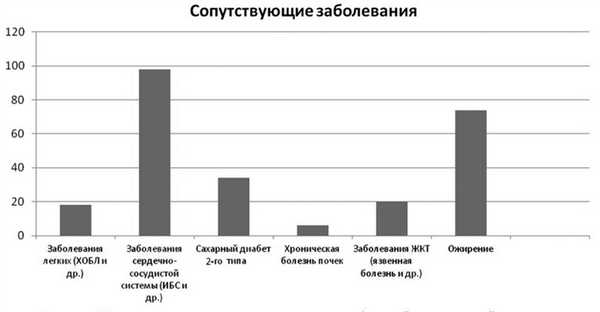
Сопутствующие заболевания различной степени тяжести были выявлены у всех пациентов, вошедших в исследование. Два сопутствующих заболевания и более выявлены у 54 пациентов из 100. Распределение наиболее частых сопутствующих заболеваний среди пациентов по органам и системам представлено на рис. 1. Рис. 1. Частота встречаемости основных сопутствующих заболеваний в анализируемой группе пациентов. Сахарный диабет 2-го типа диагностирован у 34 пациентов, заболевания сердца и сосудов (ИБС, гипертоническая болезнь, приобретенные пороки клапанов сердца и др.) у 98, ХОБЛ — у 18 пациентов, различные заболевания верхних отделов ЖКТ (хронический гастрит, язвенная болезнь и др.) — у 20 пациентов из 10. Индекс массы тела выше 25 был у 74 пациентов из 100.
Степень анестезиологического риска по шкале ASA (American Society of Anesthesiology) оценена как I, II, III и IV у 1,13, 82 и 4 пациентов из 100 соответственно.
Все пациенты, вошедшие в исследование, имели нестабильность грудины в исходе хронического послеоперационного стерномедиастинита. Изолированная нестабильность грудины без сопутствующего активного раневого процесса была у 35 пациентов из 100. У 65 пациентов на момент выполнения завершающей торакопластики была свищевая форма остеомиелита — 13 пациентов или обширная рана, вовлекающая все слои передней грудной стенки (4-й степени по классификации Oakley—Wright [8]) — 52 пациента. Поперечные переломы грудины в сочетании с нестабильностью были у 47 пациентов из 100.
Все больные обследованы по единому протоколу, который включал: МСКТ органов грудной клетки до начала лечения, хирургическую обработку раны передней грудной стенки с резекцией грудины, местное лечение раны, этапный контроль бактериальной контаминации раны, единый протокол системной антибактериальной терапии в периоперационном периоде, компенсацию сопутствующих заболеваний, выполнение МСКТ грудной клетки с контрастированием внутренних грудных артерий и УЗИ брюшной полости перед завершающим этапом хирургического лечения. Осложнения в послеоперационном периоде оценивали по шкале Clavien—Dindo [9].
Основная задача первого и второго этапов лечения пациентов со стерномедиастинитом — удаление всех некротизированных тканей передней грудной стенки, деконтаминация раны [10]. Этапное хирургическое лечение, включавшее выполнение одной или нескольких хирургических обработок до завершающей торакопластики проведено 62 пациентам из 100. В связи со сложностью объективной оценки истинно жизнеспособных тканей на фоне острого воспаления с целью максимального сохранения каркасности и резерва мягких тканей передней грудной стенки во время первичной хирургической обработки резекцию грудины выполняли максимально экономно. Одна, две и три хирургические обработки до заключительной торакопластики были проведены 30, 17 и 15 пациентам соответственно.
Вторым этапом лечения проводили местное лечение раны. Завершающую операцию выполняли при двукратных отрицательных посевах из раны или бактериальной нагрузке не более 10 3 КОЕ (колониеобразующих единиц).
При тотальной нестабильности грудины и технической возможности выполнения реостеосинтеза третьим этапом выполняли комбинированную торакопластику с имплантацией сетчатого имплантата из титана.
Результаты
Результаты лечения прослежены в сроки от 3 нед до 35 мес после завершающей торакопластики. Все пациенты оперированы по единой технологии. Продолжительность операции составила от 65 до 280 мин с медианой 150 (120; 187) мин. Учитывая особенности этиологии заболевания, длительное течение хронического инфекционного процесса, высокий риск генерализации инфекции выбор антибактериальной терапии и/или профилактики бактериальных осложнений проводили на основании предоперационного бактериологического исследования по индивидуальной чувствительности. Положительные посевы отделяемого из раны на момент выполнения завершающей торакопластики были у 32 (32%) пациентов. Антибактериальная профилактика в течение 24—72 ч проведена 12 пациентам, антибактериальная терапия — 88. Общая продолжительность приема антибактериальных препаратов составила от 1 до 15 суток с медианой 6 (4; 7) дней.
Продолжительность стационарного лечения составила от 6 до 91 сут с медианой 17 (13; 21) дней. Рецидива основного заболевания за время наблюдения не зафиксировано. Во всех случаях достигнута стабилизация передней грудной стенки.
Инфекционные осложнения после срединной стернотомии приводят к значительному увеличению госпитальной летальности, длительности и стоимости стационарного лечения [12]. Разнообразие факторов риска, таких как сахарный диабет, ожирение, ХОБЛ, остеопороз, асимметричная стернотомия, нарушение кровоснабжения грудины после реваскуляризации миокарда, не позволяют радикально снизить частоту развития послеоперационного стерномедиастинита даже в узкоспециализированных центрах [13—15].
Лечение пациентов с нестабильностью грудины в исходе хронического остеомиелита лежит в поле интересов кардиохирургов, торакальных, общих и пластических хирургов.
В настоящем исследовании проанализированы результаты комбинированной торакопластики с применением сетчатого имплантата из титана на завершающем этапе хирургического лечения у 100 пациентов с нестабильностью грудины. Реконструкция грудины у пациентов с хроническим стерномедиастинитом остается нерешенной и обсуждаемой проблемой. Многообразие предложенных методов реконструкции передней грудной стенки позволяет получить хороший функциональный результат при сохраненной костной ткани, симметричных половинках грудины, адекватном кровоснабжении тканей и хорошей адаптации краев грудины. Для уменьшения натяжения и создания дополнительных точек консолидации в зоне шва грудины при повторной торакопластике, а также с целью профилактики флотации средостения в послеоперационном периоде нами предложено выполнение комбинированной торакопластики с применением сетчатого импланта из титана.
Сетчатые имплантаты из титана применяют для пластики костных дефектов в нейрохирургии, офтальмологии и травматологии, в герниологии для закрытия дефектов брюшной стенки [16—20]. Эндопротез «титановый шелк» предназначен для пластики мягких тканей и изготовлен из титановой нити высокой степени очистки. Эндопротез обладает высокой эластичностью, за счет формы плетения нитей. Одна из особенностей титанового импланта состоит в его способности прорастать соединительной тканью, что приводит к формированию плотного рубца в отсроченном периоде и создает дополнительную каркасность грудной стенки. Биологическая совместимость и инертность сетчатого титанового эндопротеза показана в многочисленных экспериментальных и клинических исследованиях [21, 22].
Одна из особенностей лечения пациентов с хроническим послеоперационным стерномедиастинитом — тщательная предоперационная подготовка с декантаминацией раны к отсроченной торакопластике. В нашем исследовании у 62 пациентов из 100 на момент первичного обращения были признаки активного инфекционного процесса, что потребовало проведения дополнительных этапных санационных операций. В результате комбинированной предоперационной подготовки, включавшей хирургическое и местное лечение, у 68 (95% ДИ 58,3—76,3) пациентов на момент завершающей торакопластики удалость получить двукратные отрицательные посевы отделяемого из раны. Особняком стоит проблема профилактики антибактериальных осложнений. Только у 3 пациентов из 100 антибактериальная профилактика в течение 24 ч (однократное введение антибактериального препарата за 1 ч до начала операции) оказалась достаточной. Остальные пациенты потребовали пролонгированной профилактики в течение 72 ч (n=7), либо проведение антибактериальной терапии в течение 5—7 сут после операции. Одному пациенту из 100 в дальнейшем, после проведения курса профилактики длительностью 72 ч, потребовалась антибиотикотерапия в течение 7 дней в связи с нагноением послеоперационной раны в послеоперационном периоде. Всем пациентам антибактериальная терапия проводилась по результатам посевов после консультации клинического фармаколога. Медиана продолжительности антибактериальной терапии в нашем исследовании составила 6 (4; 7) сут.
Непосредственные результаты исследования включали оценку местных и общих осложнений, общую удовлетворенность пациента и рецидив нестабильности грудины. Все пациенты, вошедшие в исследование, отмечали уменьшение выраженности болевого синдрома в сравнении с дооперационным периодом, а также исчезновение флотации (подвижность) передней грудной стенки. Общая частота послеоперационных осложнений, включая отдаленные осложнения и повторные госпитализации, составила 15% (95% ДИ 9,3—23,3). Рецидив нестабильности грудины был отмечен у 1 пациента, течение послеоперационного периода у которого осложнилось нагноением послеоперационной раны и потребовало удаления титанового эндопротеза при повторной операции.
Таким образом, комбинированная торакопластика с применением сетчатого титанового эндопротеза безопасна и эффективна при стабилизации передней грудной стенки у пациентов с хроническим стерномедиастинитом, после повторных резекций, наличии поперечных переломов и дефиците костной ткани. Необходима дальнейшая оценка эффективности стабилизации передней грудной стенки и оценка качества жизни пациентов в отсроченном периоде после предложенного варианта торакопластики.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Килевидная деформация грудной клетки (КДГК) - врожденный порок развития, который характеризуется выпячиванием вперед грудины и сочленяющихся с ней ребер. В отличие от воронкообразной деформации КДГК встречается значительно реже и составляет от 5 до 22% всех деформаций грудной клетки [1, 2, 5, 10].
Консервативные способы лечения КДГК подразумевают использование различных наружных компрессионных устройств. Однако применение таких устройств требует длительного их ношения (до 2 лет), а рецидив заболевания после лечения возникает более чем в 50% наблюдений. При использовании этой технологии также бывают осложнения в виде некроза кожи грудной стенки вследствие ее компрессии такими устройствами.
В настоящее время наибольшее распространение при лечении КДГК получили хирургические методы с использованием внутренних или наружных фиксаторов или без фиксирующих конструкций [1, 3, 4-10, 11-17, 19]. Если первые два способа подразумевают выполнение повторного вмешательства для удаления фиксатора, то третий способ позволяет получить хороший косметический результат после одномоментной операции.
В настоящее время среди хирургов нет единодушия в оценке эффективности той или иной техники оперативного лечения КДГК, поэтому сохраняется актуальность поиска новых методов торакопластики, позволяющих получить хорошие косметические и функциональные результаты.
Материал и методы

В ДГКБ №13 им. Н.Ф. Филатова с 1994 по 2009 г. оперирован 91 ребенок с КДГК. Мальчиков было 76 (83,5%), девочек - 15 (16,5%). Все дети оперированы в возрасте 9-15 лет, когда деформация грудной клетки имела выраженный характер (табл. 1).
У всех пациентов КДГК имелась с раннего возраста. Наибольший темп прогрессирования деформации приходился на пубертатный период. К этому времени имел место грубый косметический дефект, что служит основным показанием к оперативному лечению. Мы отмечали грудинохрящевой (корпорокостальный) тип деформации грудной клетки, который характеризовался выступанием нижних реберных хрящей и тела грудины, а также рукояточно-хрящевой (манубриокостальный) тип деформации, характеризовавшийся дислокацией вперед грудины и II-III реберных хрящей, нижние сегменты грудины были смещены кзади.
В каждой группе по форме деформации выделены симметричные и асимметричные варианты. В наших наблюдениях грудинохрящевой тип и симметричные формы КДГК встречались чаще других.
Наследственные заболевания отмечены у 15 (16,5%) детей: синдром Марфана - у 2 (2,2%), марфаноподобный синдром - у 5 (5,5%), синдром Элерса-Данло - у 8 (8,8%). Сопутствующие заболевания выявлены у 35 (40%) детей: бронхиальная астма - у 2 (2,2%), детский церебральный паралич - у 1 (1,1%), уретероцеле - у 1 (1,1%), полителия - у 1 (1,1%), шизофреноподобный синдром - у 1 (1,1%), сколиотическая осанка - у 29 (31,9%). У 33 (36,3%) детей обнаружены изменения со стороны сердечно-сосудистой системы: нарушение сердечного ритма и внутрижелудочковой проводимости (неполная блокада правой ножки пучка Гиса, синдром ранней реполяризации желудочков), пролапс митрального или трикуспидального клапана, ложная хорда желудочка. Нарушения гемодинамики при этом не было ни в одном наблюдении. При выявлении сопутствующих заболеваний дети были консультированы соответствующими специалистами.
Методы хирургического лечения. В нашей клинике при хирургическом лечении КДГК используется торакопластика, в основе которой лежит операция Равича. За указанный период (1994-2009 гг.) торакопластика претерпела существенные изменения. В зависимости от выполненных оперативных вмешательств больных разделили на 2 группы: в 1-ю включены 32 (35,2%) ребенка, оперированных в период 1994-2001 гг., во 2-ю - 59 (64,8%) детей, оперированных в период 2002-2009 гг.
Техника операции в 1-й группе. Для стабилизации грудинореберного комплекса (ГРК) использовали титановую пластину. Для этого на грудной стенке выполняли вертикальный разрез кожи (рис. 1, а) Рисунок 1. Варианты разреза кожи при торакопластике. а - вертикальный; б - субмаммарный; в - «Мерседес»; г - поперечный, длиной не более 8 см. от рукоятки грудины до мечевидного отростка, послойно мобилизовывали кожу с подкожной клетчаткой и грудные мышцы, с двух сторон субперихондриально резецировали реберные хрящи от II до VII, VIII, в месте наибольшей деформации выполняли клиновидную стернотомию с сохранением заднего листка и дополнительно ретростернально устанавливали титановую пластину (рис. 2). Рисунок 2. Рентгенограммы больного. а - до операции; б - после торакопластики с фиксацией ГРК пластиной (техника, использованная в 1994-2001 гг.). Таким способом оперированы 8 (8,8%) детей. Всем им через 6 мес потребовалось повторное оперативное вмешательство для удаления пластины.
С 1996 г. метод торакопластики был изменен, основными ее этапами послужили: использование волнообразного субмаммарного разреза кожи (рис. 1, б) длиной до 12 см или разреза типа «Мерседес» (рис. 1, в); послойное обнажение ГРК, билатеральная субперихондриальная резекция реберных хрящей со II по VIII. При этом не пересекали реберные дуги и не проводили клиновидную стернотомию грудины, как было предложено автором, а отсекали мечевидный отросток и подшивали его на 3-5 см выше, на переднюю поверхность грудины. На оставшуюся в местах удаления хрящей надхрящницу накладывали кетгутовые швы, сморщивая ее в «гармошку». Всего по такой технологии оперированы 24 (26,7%) ребенка.
Техника операции во 2-й группе. С 2002 г. по настоящее время разработан оптимальный метод торакопластики, основными этапами которой являются:
- выполнение на грудной стенке поперечного разреза кожи длиной не более 8 см (рис. 1, г);

- мобилизация кожи, подкожной клетчатки и грудных мышц единым лоскутом (рис. 3, а); Рисунок 3. Интраоперационные фотографии при торакопластике. а - единый кожно-мышечный лоскут; б - резекция грудины; в - сшивание грудины конец в конец.
- поднахрящничная резекция деформированных реберных хрящей (II-VIII ребра) с двух сторон;
- резекция тела грудины до 2-2,5 см в месте наибольшей деформации и сшивание ее конец в конец отдельными узловыми швами (рис. 3, б, в и 4); Рисунок 4. Схема торакопластики при КДГК (2002-2009 гг.).
- послойное ушивание раны с наложением косметического кожного шва.
По данной технологии оперированы 59 (64,8%) детей. Операцию выполняли под комбинированной общей анестезией в сочетании с эпидуральной анестезией.
Сравнительная оценка методов хирургического лечения КДГК представлена в табл. 2. Отдаленные результаты хирургического лечения в сроки от 6 мес до 1 года оценивали у 11 (12%) детей, от 1,5 до 3 лет - у 30 (33%) детей, от 3 до 5 лет - у 50 (55%) детей. Для оценки полученного косметического результата торакопластики использовали метод анкетирования (табл. 3): отличный результат - полная коррекция деформации, отсутствие остаточных явлений деформации, отсутствие асимметрии грудной клетки (грудная клетка имеет форму, как у здорового ребенка), нормотрофический кожный рубец; хороший результат - полная коррекция килевидной деформации, отсутствие остаточных явлений деформации, отсутствие асимметрии грудной клетки, гипертрофический кожный рубец; удовлетворительный результат - умеренные явления остаточной деформации, умеренная асимметрия грудной клетки, умеренная девиация реберных дуг кпереди или келлоидный кожный рубец; неудовлетворительный результат - рецидив КДГК.
Результаты и обсуждение

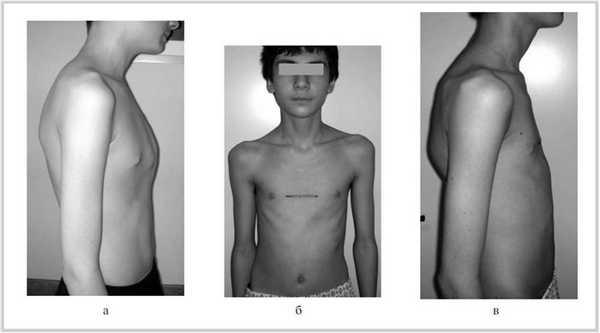
У всех 32 детей в 1-й группе (1994-2001 гг.) после торакопластики полностью ликвидирован косметический дефект. Однако протяженность кожного разреза в послеоперационном периоде не принесла эстетического удовлетворения больным (рис. 5). Рисунок 5. Внешний вид ребенка. а - КДГК до операции; б и в - после торакопластики (1994-2001 гг.).
У 24 (75%) детей этой группы в результате перемещения мечевидного отростка сохранялся выступ в послеоперационном периоде в течение от 6 до 9 мес, что вызывало негативную реакцию, в 8 (25%) наблюдениях потребовалось повторное оперативное вмешательство - удаление фиксирующей металлической пластины.
У 3 (2,2%) детей развились ранние послеоперационные осложнения. У 2 (2,2%) больных на 2-е сутки определялась подкожная гематома мягких тканей. С помощью пункции эвакуировано около 50 мл геморрагической жидкости. Наложена давящая повязка. Рана зажила первичным натяжением. Больные выписаны на 11-е и 14-е сутки. У 1 (1,1%) ребенка на 6-е сутки отмечено расхождение швов послеоперационной раны. Потребовалось наложение вторично-отсроченных швов. Больной выписан на 16-е сутки после операции.
Возникший у 1 /3 больных гемоторакс - довольно частое явление. В наших наблюдениях при контрольном УЗИ плевральных полостей выявлялось в среднем до 100 мл жидкости. Одному ребенку на 4-е сутки в связи с дыхательными расстройствами потребовались плевральная пункция и удаление гемолизированной крови.
Длительность операции составляла от 60 до 110 мин. Продолжительность обезболивания наркотическими анальгетиками в послеоперационном периоде составила в среднем 2-3 дня, ненаркотическими - 5-6 дней. Выписка осуществлялась после полной активизации детей на 13-15-е сутки.
Во 2-й группе (2002-2009 гг.) всего по предложенной методике оперированы 59 (65%) детей. У 98,3% из них полностью устранена деформация. Анкетирование пациентов указывает на отличные и хорошие результаты в 96,6% наблюдений. У подростков исчезло чувство стеснения перед сверстниками, стали преобладать положительные эмоции.
У 2 (3,4%) детей развились осложнения. Раннее осложнение встретилось в 1 (1,7%) наблюдении. На 2-е сутки после оперативного вмешательства возникло расхождение фиксирующих швов грудины. Потребовалась повторная операция - ревизия послеоперационной раны, наложение швов на грудину.
Одному ребенку, которому была выполнена двусторонняя поднадхрящничная резекция только IV, V, VI реберных хрящей, через 6 дней в связи с сохраняющейся деформацией на месте прикрепления третьих ребер потребовалась повторная операция - резекция хрящей третьих ребер, что позволило полностью устранить косметический дефект. Данное обстоятельство не относится к осложнениям, так как не связано с выбором метода оперативного лечения, а обусловлено погрешностью в технике операции. Пациенты осмотрены через 6, 9, 12, 24 мес, отмечен отличный косметический результат (рис. 6). Рисунок 6. Внешний вид ребенка. а - КДГК до операции; б и в - после торакопластики (2002-2009 гг.).
У 59% оперированных выявлен гемоторакс как довольно частое явление после торакопластики. Как правило, к 6-7-м суткам отмечается самостоятельная его регрессия, что подтверждается при проведении контрольного УЗИ или рентгенологического исследования. Лишь в одном наблюдении потребовалась плевральная пункция с эвакуацией около 250 мл геморрагической жидкости.
Позднее осложнение выявлено в 1 (1,7%) наблюдении. Через 8 мес после первой торакопластики была обнаружена локальная костная деформация за счет реберных хрящей, потребовавшая повторного оперативного вмешательства. Резекция хрящей VI-VII ребер справа и хряща VII ребра слева позволила полностью устранить деформацию. Пациент осмотрен через год, отмечен отличный косметический результат. Возникновение рецидива деформации, по-видимому, связано с неправильным, патологическим ростом реберных хрящей этой зоны.
Продолжительность оперативного вмешательства по предложенной методике составила 50-60 мин. Обезболивание наркотическими анальгетиками проводили в течение 2 дней, ненаркотическими - до 4 дней. На 3-4-е сутки больные начинали ходить. Швы снимали на 6-7-е сутки. Пациентов выписывали из стационара на 7-9-е сутки.
Основной принцип пластической хирургии состоит в минимальном хирургическом вмешательстве и получении максимального функционального результата. По данным литературы, вопрос о выборе кожного разреза для проведения торакопластики остается дискуссионным. В наших наблюдениях после использования волнообразных, вертикальных разрезов и разрезов кожи типа «Мерседес» основной жалобой больных был грубый и протяженный послеоперационный рубец. Нелогично устранять один косметический дефект - деформацию грудной клетки и формировать другой - грубые протяженные рубцы на коже. Используемый нами поперечный, протяженностью не более 8 см кожный разрез с отслойкой подкожной жировой клетчатки, фасции и мышц единым лоскутом позволил получить минимально инвазивный доступ для проведения торакопластики и тем самым улучшить эстетический вид больных. Это подтверждается в результате опроса оперированных детей.
Разработанный нами метод торакопластики снижает травматичность хирургического вмешательства, что способствует отказу от применения обезболивания и соответственно ранней активизации больных.
В настоящее время для удержания ГРК в правильном положении предложены методы с использованием и без использования дополнительных фиксаторов. Преимущество нашего метода заключается в одномоментной коррекции КДГК. Больным не требуется повторное оперативное вмешательство - удаление пластины и соответственно исключена вероятность такого осложнения, как смещение фиксатора.
Большинство авторов предложенных методов торакопластики вследствие большой кровопотери в ходе операции применяют различные дренирующие системы. Это приводит к более длительному заживлению послеоперационной раны. В нашем варианте - отслойка подкожной жировой клетчатки, фасции и мышц единым лоскутом, билатеральная резекция только патологически измененных реберных хрящей, резекция малого участка грудины значительно снижают кровопотерю во время оперативного вмешательства и вероятность образования гематом в послеоперационном периоде, мы отказались от использования дополнительных дренирующих систем.
Торакопластика, используемая в нашей клинике с 2002 г., позволила сократить продолжительность операции. В 1-й группе эти показатели хуже, чем во 2-й. Такие же результаты получены и при сравнении средних сроков пребывания в стационаре после операции (1-я группа - 14,0±1,6 сут, 2-я группа - 8,7±1,5 сут). Полученные данные подтверждают экономическую значимость метода торакопластики, примененного во 2-й группе.
Таким образом, поперечный разрез кожи длиной до 8 см и мобилизация кожи, подкожной клетчатки и грудных мышц единым лоскутом создают достаточный операционный доступ для выполнения торакопластики и косметически выгодна для пациента.
Фиксация грудинореберного каркаса после резекции грудины и ее сшивание конец в конец обеспечивают надежное ее удержание в анатомически правильной позиции без использования эндокорректоров и позволяют получить отличный результат.
Торакопластика, применяемая в нашей клинике, менее травматична, дает возможность сократить длительность послеоперационного пребывания больного в стационаре и может быть рекомендована для использования в практике детской хирургии.
Читайте также:
