Ферменты крови при стрессовой кардиомиопатии (СКМП). Дифференциация с инфарктом миокарда (ОИМ)
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Повышение активности МВ-фракции креатинкиназы (КК-МВ) традиционно является диагностическим маркером острого инфаркта миокарда, но регистрируется и при других заболеваниях, в отсутствие поражений коронарных артерий. У некоторых пациентов значения КК-МВ пре
Role of increase of MB-creatine kinase in different extracardiac pathologies T. A. Ruzhentsova, E. I. Mileykova, A. V. Mozhenkova, Yu. V. Novozhenova, O. M. Kobyzeva, V. A. Dubravitsky, L. L. Grebets, N. A. Meshkova
Traditionally, increase of activity of creatine kinase MB-fraction (CK-MB) is a diagnostic marker of acute myocardial infarction, but also registered in other diseases, when there are no lesions of coronary arteries. In some patients, the values of CK-MB exceed total creatine kinase indices (CK), which is related to formation of macrocomplexes. Diagnostic and forecasting value of CK-MB increase, with possible macrocomplex formation, in patients with extracardiac pathology, were evaluated.
Креатинкиназа (креатинфосфокиназа, КК) — фермент, который содержится преимущественно в клетках миокарда, скелетной мускулатуры, головного мозга, а в минимальном количестве — в щитовидной железе, легких. Повреждение клеток сопровождается выходом различных внутриклеточных компонентов в кровоток, что лежит в основе лабораторной диагностики большого ряда патологических процессов. КК обратимо катализирует фосфорилирование креатинина при помощи аденозинтрифосфата (АТФ), в результате образуется высокоэнергетическое соединение — креатинфосфат. КК представляет собой гетерогенный энзим, молекула которого состоит из двух субъединиц — В и М. Комбинации этих субъединиц образуют три различных изофермента: ММ — содержащийся в скелетных мышцах, ВВ — в головном мозге и МВ — гибридный — в сердечной мышце. В норме содержание изоферментов КК в сыворотке крови составляет: КК-ММ — 94-96%, КК-МВ — 4-6%, КК-ВВ отсутствует или обнаруживается в следовом количестве 2.
Повышение активности КК-МВ традиционно является диагностическим маркером острого инфаркта миокарда, что широко используется для ранней дифференциальной диагностики. Повышение более 6% от общей КК отмечается уже через 2-4 часа после начала острого болевого приступа, максимум достигается через 12-24 часа, возврат показателя к норме происходит достаточно быстро — на 3-и сутки. При расширении зоны инфаркта нормализация происходит позднее, на 4-6 сутки, в редких случаях позднее, что позволяет диагностировать пролонгированное или рецидивирующее течение. Величина повышения активности КК и КК-МВ коррелирует с размером пораженной зоны миокарда. Повышение активности КК нередко наблюдается и при острых миокардитах, но рост показателя при этом не столь велик, а продолжительность сохранения повышенных цифр значительно дольше, чем при инфаркте [2].
Высокая активность общей КК нередко встречается при травматических повреждениях и заболеваниях скелетных мышц (например, при прогрессирующей мышечной дистрофии, миопатии, дерматомиозите, столбняке), а также при заболеваниях головного мозга (шизофрении, маниакально-депрессивном психозе, эпилепсии, травмах головы), после хирургических операций, при любых видах шока, гипотиреозе. КК может повышаться в результате приема больших доз кортикостероидов, психотропных или наркотических препаратов, алкоголя, после судорог, инъекций, тяжелой физической нагрузки и при беременности. Увеличение показателя возможно за счет хилеза пробы или гемолиза. Для тиреотоксикоза, напротив, характерно снижение уровня КК [1].
Повышение этого фермента отмечается при различной патологии: острых инфекционных заболеваниях, онкологических процессах, травмах, как у взрослых, так и у детей разных возрастных групп [4]. Наибольшее число вопросов вызывают ситуации, когда по результатам лабораторного обследования у пациента обнаруживаются значения КК-МВ, превышающие показатели общей КК. Этот феномен исследователи связывают с возможностью изоферментов находиться в разных формах с образованием различных макрокомплексов. К макрокомплексам 1-го типа относят молекулы КК-МВ или КК-ВВ, связанные с иммуноглобулином IgG или (реже) IgA. Макрокомплексы 2-го типа — это олигомерные формы митохондриальной КК-МВ [3, 5, 6]. Эти необычные соединения становятся причиной повышения значений КК-МВ, определяемого с помощью метода иммуноингибирования, который используется в большинстве клинических лабораторий. Электрофоретически можно четко увидеть различные варианты КК в виде отдельных зон. Заподозрить образование макрокомплексов следует в случаях, когда показатель КК-МВ становится более 0,5 от КК общей или превышает ее.
Такие ситуации требуют анализа причин, поскольку обнаружение олигомеров КК регистрируется, как правило, у пациентов с тяжелой патологией. В отличие от инфаркта миокарда динамическое наблюдение за уровнями КК и МВ-фракцией показывает их незначительные изменения во времени, что абсолютно не свойственно инфаркту [7].
Увеличение показателя КК-МВ может быть вследствие присутствия в крови ВВ-фракции, вплоть до превышения уровня МВ-фракции над общей КК. Подтвердить предположение можно после исследования сыворотки крови методом электрофореза. Причиной этого является особенность методики определения методом иммуноингибирования. Он основан на иммунном ингибировании с последующим ферментативным определением КК. Реагент содержит антитела, которые специфически связываются с М-субъединицей, ингибируя ее ферментативную активность. Определяется активность В-субъединицы. Предполагается, что количество КК-ВВ в циркулирующей крови пренебрежимо мало. Определяемая данным методом активность, умноженная на два, представляет собой показатель КК-МВ.
По литературным данным, наличие макрокомплексов 1-го типа в сыворотке крови у взрослых связывают в первую очередь с сердечно-сосудистой патологией и миозитами, ассоциированными с аутоиммунными и онкологическими процессами, а также с нежелательными явлениями при приеме ряда лекарственных средств [5, 6]. Макрокомплексы 1-го типа были обнаружены в сыворотке крови больных сахарным диабетом, сепсисом, у детей с язвенным колитом и тяжелой респираторной инфекцией [6, 8].
Макрокомплексы 2-го типа выявляют при циррозах печени (у 14% больных), мелкоклеточном раке легкого, гастроинтестинальных опухолях, гепатокарциноме (у 16% больных), раке молочной железы (в 5%), опухолях предстательной железы с метастазами в печень и кости [6, 9, 10]. Их присутствие ассоциировано с высокой смертностью больных [6].
В то же время у детей были отмечены благоприятные исходы заболеваний, сопровождавшихся появлением макрокомплексов 2-го типа. Они были выявлены у новорожденных с диагнозами «кардиомиопатия», «дефекты межжелудочковой и межпредсердной перегородок», «перинатальная асфиксия» [8, 11].
Повышение КК-ВВ, сопровождающееся высокими значениями КК-МВ, отмечается не только при патологических процессах в головном мозге, но и у пациентов с солидными опухолями, мелкоклеточным раком легкого, аденокарциномами легких и толстой кишки [12].
Таким образом, повышение КК общей и КК-МВ требует оценки в соответствии с клинической картиной и особенностями пациента.
Целью данной работы было оценить частоту, диагностическое и прогностическое значение повышения КК-МВ с вероятным образованием макрокомплексов у пациентов с экстракардиальной патологией.
Материалы и методы исследования
В исследование включили 6299 пациентов с различной некоронарогенной патологией. 4099 взрослых находились на лечении в отделении реанимации и интенсивной терапии ГКБ им. С. С. Юдина ДЗ г. Москвы с января 2016 по июль 2017 г. Средний возраст их составил 59,8 ± 13,1 года. 2200 детей в возрасте от 1 месяца до 18 лет (в среднем 2,9 ± 1,9) были госпитализированы в базовые инфекционные отделения ФБУН ЦНИИ Эпидемиологии Роспотребнадзора с апреля 2010 по июль 2017 г. Определение активности КК-МВ осуществляли методом иммуноингибирования КК-МВ овечьими поликлональными антителами. Значения КК общей получали иммуноферментным способом с помощью оптимизированного ультрафиолетового теста. Диагноз устанавливали на основании клинической картины, результатов дополнительных обследований, проведенных в соответствии с имеющимися стандартами ведения больных. Этиологическую диагностику осуществляли методом полимеразной цепной реакции. Во всех случаях была исключена острая коронарная патология.
После получения результатов лабораторного обследования оценивали соотношение КК-МВ/КК общая.
Статистическая обработка всех полученных данных осуществлялась на персональном компьютере с использованием программы Statistica, версия 6.1 (StatSoft Inc., США). Рассчитывали среднюю арифметическую (M), стандартное отклонение (σ), стандартную ошибку средних величин (m). Различия между рассчитанными показателями в группах оценивали по Z-критерию и критерию χ-квадрат, статистически значимыми считали при вероятности > 95% (p < 0,05).
Результаты и обсуждение
Увеличение КК-МВ выше нормального значения (от 25 U/L) и соотношения КК-МВ/КК общая более 0,5 отмечали у 47 (1,1%) взрослых пациентов и 51 (2,3%) ребенка. Среди них мужчин было 23, женщин — 24, мальчиков — 29, девочек — 22.
Из взрослых пациентов имели онкологические заболевания — 36 (76,6%, которые составили группу 1), другую патологию — 11 (23,4%, которые вошли в группу 2). Среди детей больных острой кишечной инфекцией было 32 (62,7% — группа 3), острой респираторной инфекцией — 19 (37,2% — группа 4).
В группе 1 наиболее частыми диагнозами были: колоректальный рак — 12 (33,3%), рак желудка — 8 (22,2%) и рак молочной железы — 4 (11,1%). Метастатическое поражение отмечалось у 33 (91,7%) пациентов. Чаще всего метастазы в печень — у 25 (69,4%), в легкие — у 9 (25%), в кости — у 5 (13,9%). У 18 (50,1%) пациентов были признаки диссеминированного процесса. Летальный исход в течение месяца с момента госпитализации в стационар отмечен у 18 (50%) больных. Как представлено в табл. 1, наибольшие значения МВ-КК были отмечены у пациентов с колоректальным раком, однако достоверных различий по сравнению с показателями больных онкологическими заболеваниями другой локализации мы не получили, вероятно, за счет небольшого числа пациентов в группах. В то же время превышения значений КК общей были не настолько выражены, а у некоторых пациентов оставались в пределах нормы, что свидетельствовало об образовании макрокомплексов. Соотношение КК-МВ/КК общая при колоректальном раке было достоверно выше, чем при другой онкопатологии.
В группе 2 распределение по нозологиям получилось следующее: больных циррозом печени было 5 (45,4%), с черепно-мозговыми травмами и последствиями черепно-мозговых травм — 3 (27,3%), с тяжелыми поражениями желудочно-кишечного тракта (дивертикулез сигмовидной кишки — 2, язва желудка — 1) — 3 (27,3%). Значения исследуемых показателей были ниже у пациентов с циррозом печени и заболеваниями желудочно-кишечного тракта. В то же время у этих больных соотношение КК-МВ/КК общая нередко превышало 1. Высокие цифры КК-МВ при черепно-мозговых травмах понятны, обусловлены высокими значениями КК-ВВ, учитывая методику определения, что следует помнить при обследовании таких пациентов. Летальный исход в течение месяца с момента госпитализации в стационар отмечен у 8 (72,7%) больных.
Этиологическими факторами у пациентов с острой респираторной инфекцией были парагрипп в сочетании с респираторно-синцитиальным вирусом — у 2 (10,5%) детей, респираторно-синцитиальный вирус с аденовирусом — у 1 (5,3%), парагрипп — у 4 (21,1%), респираторно-синцитиальный вирус — у 3 (15,8%), грипп — у 3 (15,8%, H1N1 — у 2, В — у 1), неуточненная этиология — у 6 (31,6%). Пневмония была подтверждена у 8 детей (42,1%), необструктивный ларингит — у 3 (15,8%).
У большинства из этих пациентов (у 45-88%) отмечали среднетяжелое течение, у 6 (12%) — тяжелое. Как видно из табл. 3, у этих детей повышенные значения КК-МВ и КК общей были в целом ниже, чем у пациентов группы 1. Высокие значения соотношения КК-МВ/КК общая, в некоторых случаях превышающие 1, также указывали на вероятное образование макрокомплексов. На электрокардиограммах у этих детей были выявлены нарушения реполяризации в 2-3 или более отведениях со сглаженностью (у 39 пациентов — 76,5%) или инверсией зубцов Т (у 12-23,5%), снижение зубца R в стандартных отведениях — у 16 (31%), вентрикулярная экстрасистолия — у 4 (8%). В большинстве случаев были отмечены изменения по результатам ЭХО-КГ: диастолическая дисфункция одного (у 31-61%) или обоих (у 19-37%) желудочков, снижение фракции выброса левого желудочка — у 6 (12%). Изменения купировались на фоне терапии у 46 детей (90%) в течение 1-6 месяцев, а у 5 (10%) изменения на электрокардиограммах и ЭХО-КГ сохранялись длительно, в течение 1-5 лет наблюдения. У 4 детей, со слов родителей, отмечали повышенную утомляемость, плохую переносимость повседневных нагрузок. Летальных случаев среди них не было.
Сопоставляя полученные результаты в разных группах пациентов, можно сделать заключение о необходимости различной трактовки повышения КК-МВ и соотношения КК-МВ/КК общая при разной патологии. В рассмотренных случаях очевиден факт, что рост КК-МВ указывал на поражение миокарда некоронарогенного генеза при нарастании интоксикации у пациентов с онкологическими заболеваниями как за счет основного процесса, так, возможно, и вследствие нежелательных явлений от проводимой терапии. Инфекционная патология у детей была причиной изменений показателей работы сердечной мышцы как из-за непосредственного влияния возбудителей на сердечную мышцу, так и в результате интоксикации и/или водно-электролитных нарушений, что описано в литературе [4]. При дивертикулезе сигмовидной кишки и язве желудка рост КК-МВ отмечался, возможно, из-за метаболических нарушений и/или воздействия патогенной микрофлоры.
Выводы
Литература
Значение повышения MB-креатинкиназы при различной экстракардиальной патологии/ Т. А. Руженцова, Е. И. Милейкова, А. В. Моженкова, Ю. В. Новоженова, О. М. Кобызева, В. А. Дубравицкий, Л. Л. Гребец, Н. А. Мешкова
Для цитирования: Лечащий врач № 10/2018; Номера страниц в выпуске: 80-83
Теги: сердце, коронарные артерии, диагностика, маркеры
Кардиомиопатия Такотсубо, или стресс - индуцированная кардиомиопатия
Донецкая О.П., Тулупова В.А., Дзвониская В.Н., Бесшапошникова И.А.
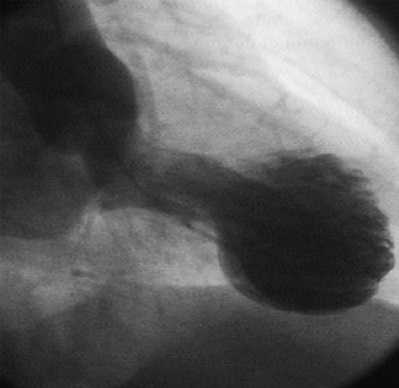
Кардиомиопатия такотсубо была описана впервые в Японии в 1990 г. H. Satoh как преходящие нарушения сократимости миокарда. Классический вариант болезни сопровождается акинезом или дискинезом верхушки сердца с гиперкинезом базальных сегментов. Сердце при этом приобретает своеобразную конфигурацию: левый желудочек в острой фазе по форме напоминает песочные часы или японскую ловушку для осьминогов такотсубо — кувшин с узким горлышком и широким дном. Кадиомиопатия такотсубо - это обратимая дисфункция левого желудочка в ответ на физический или психический стресс, клинически и электрокардиографически напоминающая острый коронарный синдром, преимущественно у женщин в посменопаузе без значимого стеноза коронарных артерий, отличающаяся относительно благоприятным исходом.
Патогенез синдрома такотсубо полностью не известен. Для объяснения возможных механизмов развития КМПТ было предложено несколько гипотез: вазоспазм коронарных артерий, обструкция выводного тракта левого желудочка (ВТЛЖ), перегрузка катехоламинами, нейрогуморальные нарушения и дисфункция микроциркуляторного коронарного русла. Основной теорией развития кардиомиопатии на настоящий момент является токсическое действие повышенного уровня катехоламинов на миокард и избыточная симпатическая стимуляция. Воздействие эндогенного (эмоционального) или экзогенного (травма, хирургические операции или чрезмерная физическая нагрузка) стресса отмечают в преобладающем большинстве случаев развития кардиомиопатии. Данная взаимосвязь привела к предположению, что механизм развития кардиомиопатии может быть ассоциирован с воздействием симпатической нервной системы при стрессе.
Клиническая картина. Как описано российскими и зарубежными исследователями, симптомы, развивающиеся при кардиомиопатии, во многом совпадают с клинической картиной, наблюдаемой при остром инфаркте миокарда. Так, наиболее типичными клиническими признаками кардиомиопатии являются острое начало, приступ загрудинных болей или одышки, тогда как на электрокардиограмме наиболее часто наблюдаются подъемы сегмента ST, а в крови определяется повышение уровня креатинфосфокиназы, МВ-фракции креатинфосфокиназы и тропонина, а также гиперкатехоламинемия. В тех случаях, когда проводится эндомиокардиальная биопсия, гистологически определяются очаги миоцитолиза, инфильтрация мононуклеарами, а также некроз кардиомиоцитов по типу полос пересокращения при отсутствии признаков миокардита. При проведении эхокардиографии у таких пациентов определяются тяжелые нарушения сократимости миокарда левого желудочка. При этом на коронарографии у пациентов с кардиомиопатией отсутствуют значимые стенозы коронарных артерий. Необходимо отметить, что основным критерием для постановки диагноза КМПТ является полная обратимость нарушений сократимости миокарда. Изменения ЭКГ в острой фазе КМПТ развиваются примерно в 80-85 % случаев. Согласно рекомендациям по диагностике КМПТ, основными изменениями ЭКГ, характерными для КМПТ, являются подъемы сегмента ST, инвертированные зубцы Т, удлинение интервала QT и редкие реципрокные изменения либо их отсутствие. Наиболее часто среди изменений ЭКГ у пациентов с КМПТ встречаются подъемы сегмента ST в грудных отведениях (в отведениях V1-V4). Также с течением времени возможно появление отрицательных зубцов Т и патологических зубцов Q. Таким образом, особенностями течения КМП Такотсубо является: отсутствие значимой обструкции коронарных артерий; площадь акинезии не соответствует зоне, которая может кровоснабжаться одной коронарной артерией; колоссальная разница между объемом вовлеченного миокарда и степенью повышения ферментов; быстрая полная нормализация сократимости миокарда.
Основные критерии диагностики кардиомиопатии Такотсубо («модифицированные критерии клиники Мейо»):
1. Транзиторный гипокинез, дискинез и акинез средних сегментов левого желудочка с вовлечением верхушки или без такового, баллоноподобное расширение полости левого желудочка, не соответствующее зоне кровоснабжения какой - либо одной коронарной артерии, желателен физический или психический травмирующий фактор, предшествующий развитию этого состояния.
2. Отсутствие обструкции коронарных артерий или ангиографического свидетельства признаков острого разрыва атеросклеротической бляшки.
3. Появление изменений ЭКГ - элевация сегмента ST, возможна инверсия зубца Т.
4. Умеренное повышение тропонина
5. Отсутствие предшествующей травмы головы, внутричерепного кровоизлияния, гипертрофической кардиомиопатии, феохромоцитомы или миокардита.
Осложнения:
- Аритмии: АВ - блокады, синусовая брадикардия, фибрилляция предсердий, желудочковые тахикардия и фибрилляция
- Острая левожелудочковая недостаточность
- Образование тромба в верхушке ЛЖ и эмболии
Лечение: В настоящее время специфические методы лечения не разработаны. Четких критериев длительности терапии нет. Необходимо продолжить терапию до полного восстановления сердечной функции. В большинстве случаев пациенты с кардиомиопатией поступают в больницу с клиническими и лабораторными признаками острого инфаркта миокарда, до установления диагноза кардиомиопатии тактика их лечения определяется рекомендациями по лечению острого инфаркта миокарда с подъемом сегмента ST. После диагностирования кардиомиопатии такотсубо возможно переведение пациентов на поддерживающую медикаментозную терапию. В связи с тем, что синдром такотсубо сопровождается развитием преходящей дисфункции левого желудочка, пациентам показано лечение ингибиторами ангиотензинпревращающего фермента либо блокаторами рецепторов к ангиотензину II. У гемодинамически нестабильных пациентов необходимо исключать возможную обструкцию выходного тракта левого желудочка (ВТЛЖ), при наличии которой требуется назначение в-блокаторов. В связи с отсутствием исследований по негативному влиянию вазопрессоров при тяжелом течении кардиомиопатии таким пациентам также показана поддержка ионотропными препаратами. Некоторые исследователи считают, что длительное лечение в-блокаторами показано для предотвращения рецидивов кардиомиопатии. Однако данное заболевание является доброкачественным, в большинстве случаев заканчивающийся полным восстановлением функции левого желудочка через 2-4 недели после манифестирования симптомов.
Прогноз: 95 % пациентов прогноз благоприятный, в течение нескольких недель наблюдается полная обратная динамика изменений ЭКГ и ЭХО-КГ, повторные случаи крайне редкие 2,7%
Заключение: Таким образом, кардиомиопатия такотсубо относится к редким синдромам. Тем не менее можно предположить, что встречается данный синдром значительно чаще, чем описывается, что связано со сложностью его диагностики. Синдром такотсубо занимает важное место среди сердечно-сосудистых заболеваний. Связано это прежде всего с тем, что в остром периоде по клиническим характеристикам болезнь напоминает острый инфаркт миокарда. Чаще всего болезнь развивается после эмоционального стресса и сопровождается приступом загрудинной боли, подъемами сегмента ST на ЭКГ, а также нарушениями сократимости миокарда по данным ЭхоКГ. Показано, что из числа пациентов, поступающих в отделение неотложной кардиологии с предварительным диагнозом ОКС, 3 % впоследствии ставится диагноз кардиомиопатии такотсубо.
Ремоделирование левого желудочка после острого инфаркта миокарда и прогностическая роль биомаркеров
Несколько классических биомаркеров используются для диагностики ИМ или острого коронарного синдрома. В последнее время были выявлены новые маркеры для предоставления диагностической и прогностической информации, а также исхода инфаркта миокарда или острого коронарного синдрома, которые показали значительную связь с ремоделированием левого желудочка и плохим прогнозом после инфаркта миокарда.

Инфаркт миокарда (ИМ) возникает в результате окклюзии коронарной артерии, которая препятствует кровоснабжению миокарда в левом желудочке (ЛЖ). Ремоделирование ЛЖ может быть описано как клеточные, интерстициальные, молекулярные и генетические изменения, которые проявляются клинически, что выражается в изменении размера, формы и функции ЛЖ после сердечной травмы, такой как инфаркт миокарда. Инфаркт миокарда приводит к миграции макрофагов, моноцитов и нейтрофилов в зону инфаркта; это инициирует внутриклеточную передачу сигналов и нейрогормональную активацию, которая локализует воспалительный ответ. Изменения в системе кровообращения определяются потерей миоцитов, возбуждением симпатической нервной системы, активацией ренин-ангиотензинальдостероновой системы или высвобождением натрийуретических пептидов .
Ремоделирование ЛЖ после ИМ было разделено на две фазы: ранняя фаза (через 72 часа) и поздняя фаза (после 72 часов). В ранней фазе ремоделирования расширение инфаркта происходит в результате деградации коллагеновых структур межмиоцитов сериновыми протеазами и активации матричных металлопротеиназ (ММР), высвобождаемых из нейтрофилов. Напряжение стенки ЛЖ стимулирует механорецепторы и передает внутриклеточные сигналы посредством высвобождения ангиотензина II (Ang II), что представляет собой усиленный синтез миофибрилл. Нарушение гемодинамики кровообращения запускает симпатическую адренергическую систему, которая стимулирует катехоламины, активирует систему ренин-ангиотензин-альдостерон и индуцирует выработку предсердных и мозговых натрийуретических пептидов (ANP, BNP). Поздняя фаза ремоделирования включает гипертрофию миоцитов и изменения в структуре желудочка, чтобы распределить увеличенное напряжения на стенке ЛЖ. На этом этапе гипертрофия миоцитов инициируется активацией нейрогормональной и ренин-ангиотензиновой систем, расширением миокарда и паракринно-аутокринными факторами.
Ремоделирование ЛЖ развивается через нескольких различных механизмах
1. Воспаление (С-реактивный белок, TNF-α, растворимые рецепторы TNF, Fas, интерлейкины (I, 6 и 18), остеопротегерин, адипонектин)
2. Гипертрофия / фиброз (матричные металлопротеиназы, коллагеновые пропептиды, галектин-3, растворимый ST2).
3. Апоптоз (GDF-15)
4. Разное (микроРНК, кивезин Q6, VEGFR-1)
Учитывая патогенетические механизмы ИМ, несколько классических биомаркеров были использованы для диагностики ИМ или острого коронарного синдрома. В последнее время были выявлены новые маркеры для предоставления диагностической и прогностической информации и исхода инфаркта миокарда или острого коронарного синдрома.
Три биомаркера оценивают различные пути, вовлеченные в патогенез ремоделирования ЛЖ:
1. Увеличение тропонина I (TnI) указывает на повреждение миоцитов
2. Мозговой (B-тип) натрийуретический пептид (BNP) увеличивается в ответ на перегрузку LV
3. С-реактивный белок (СРБ) является маркером воспаления
Тропонин I входит в состав тропонинового комплекса. Тропониновый комплекс состоит из трех субъединиц, которые регулируют кальций-опосредованный сократительный процесс поперечно-полосатой мышцы. К ним относятся тропонин C, который связывает Ca2 +, тропонин I (TnI), который связывается с актином и ингибирует взаимодействия актин-миозин, и тропонин T (TnT), который связывается с тропомиозином, тем самым фиксируя комплекс тропонина. После повреждения миоцитов начальное высвобождение cTnT и cTnI происходит из цитозольного пула с последующим высвобождением из структурного (связанного с миофиламентом) пула. Для ИМ сердечный тропонин T (cTnT) и сердечный тропонин I (cTnI) считаются более чувствительными и специфичными, чем другие биомаркеры сердца. cTnT и cTnI остаются в кровотоке приблизительно более 10 дней, достигают пика приблизительно через 1-2 дня после повреждения миокарда, как это было предложено Thygesen и Alpert в 2000 г. Из-за длительного высвобождения в крови эти биомаркеры являются основными диагностическими критериями острого повреждения миокарда. Исследования показали, что у пациентов с повышенным уровнем cTnI частота сердечной смертности и сердечных осложнений была значительно выше, так чаще развивался летальный исход, нефатальный инфаркт миокарда, требовалась реваскуляризация сосуда-мишени.
Натрийуретические пептиды (bnp и nt-probnp)
Мозговой (B-тип) натрийуретический пептид (BNP) представляет собой пептид из 32 аминокислот, который синтезируется и высвобождается преимущественно из миокарда желудочков в ответ на растяжение миоцитов. Как и предсердный натрийуретический пептид (ANP), BNP, по-видимому, обладает почти исключительно полезными физиологическими свойствами, включая сбалансированное расширение сосудов, натрийурез и ингибирование как симпатической нервной системы, так и ренинангиотензин-альдостерона . Он синтезируется в желудочках миокарде и высвобождается в ответ на повышение давления на стенку желудочка.
В исследовании DETECT было показано, что повышенные уровни NT-pro-BNP в плазме крови на исходном уровне были связаны с повышенным 5-летним коэффициентом риска для смертности от всех причин (HR 5,02; CI 3,26-7,72; p <0,0001) и для серьезных сердечно-сосудистых событий ( ЧСС 4,38; ДИ 2,82-6,80; р <0,0001), состоящий из сердечно-сосудистых событий и смертности от инфаркта миокарда или внезапной сердечной смерти.
С-реактивный белок (СРБ)
С-реактивный белок (СРБ) является белком острой воспалительной фазы, который активирует макрофаги и окислительный стресс. Он считается фактором риска и биомаркером сердечно-сосудистых заболеваний. Повышенный уровень СРБ связан с дисфункцией левого желудочка (ЛЖ) и демонстрирует более высокий риск смертности и заболеваемости у пациентов с сердечной недостаточностью. Это независимый фактор риска и плохого прогноза при заболевания х миокарда ишемической или неишемической этиологии. Сообщается, что СРБ способствует фиброзу и воспалению при ремоделировании миокарда, вызванном ангиотензином II .
Исследование Orn et al. показали, что через два дня после ЧКВ уровни СРБ сильно коррелировали с уровнем NT-proBNP, размером инфаркта и ФВ ЛЖ. Не было никакой корреляции с объемами ЛЖ, но была обратная корреляция с не поврежденной массой ЛЖ. Сходная картина корреляции наблюдалась через 1 неделю, но не через 2 месяца. В отличие от С-реактивного белка, IL-6 коррелировал с размером инфаркта только через 2 дня, что оценивали по CMR (0,38, P = 0,01), но не ферментативными методами [11].
В исследовании Schoos MM et al. было указано, что СРБ в начале исследования был связан с размером инфаркта, LVEF и конечным систолическим объемом (ESV) в начале исследования и через 6 месяцев наблюдения .
Эти данные показывают, что сам СРБ может играть определенную роль в развитии дисфункции ЛЖ и ремоделировании.
Кроме того, новые исследования Hofmann et al. и Savvatis et al., показали, что дефицит воспалительных факторов, то есть дефект IL-13 или IL-23, вызывает неблагоприятное ремоделирование после ИМ и может ухудшать исходы после ОИМ .
Новые маркеры
Матричные металлопротеиназы (ММП):
Матричные металлопротеиназы (ММП) представляют собой большое семейство кальций-зависимых и цинксодержащих эндопептидаз. ММП инициируют ремоделирование ткани и деградацию внеклеточного матрикса (ЕСМ), таких как коллаген, эластины, матричные гликопротеины, протеогликан, желатин. Они контролируются гормонами, факторами роста и цитокинами и выводятся из организма различными тканевыми и провоспалительными клетками, то есть фибробластами, остеобластами, эндотелиальными клетками, макрофагами, нейтрофилами, лимфоцитами. До настоящего времени 28 типов металлопротеиназ матрикса человека были признаны и классифицированы как коллагеназы, желатиназы, стромелизины, матрилизины, мембранные типы. Исследования показали повышенный уровень нескольких ММП. Больше всего были повышены уровни ММП-1, -2, -3, -7, -8, -9, -13 и -14. ММП-2, -8, -9 и-13 были исследованы в образцах плазмы и тканей.
МикроРНК (микроРНК) представляют собой эндогенно экспрессируемые небольшие некодирующие молекулы РНК. Гены, кодирующие микроРНК, можно найти в геномах практически всех организмов, включая вирусы. Их основным механизмом действия является посттранскрипционная репрессия экспрессии генов . Предполагается, что короткая длина (22 нт) максимизирует специфичность гена-мишени и минимизирует неспецифические эффекты. Предполагается, что miRNAs регулируют примерно 30% генов в геноме человека. Всего насчитывается более 2000 кодируемых человеческих микроРНК.
Pin и соавт. Исследование показало, что плазменные miR-208b и miR-34a могут служить доступными предикторами ремоделирования ЛЖ после ОИМ и связаны с шестимесячной смертностью или развитием сердечной недостаточности. MiR-208b характеризуется как специфичная для сердца микроРНК в ранней диагностике ОИМ, так же обнаружена корреляция между уровнем miR-208b в плазме и дисфункцией ЛЖ после ИМ. Несмотря на то, что семейство miR-34 обладает защитным свойством против патологического ремоделирования сердца, избыточная экспрессия miR-34a демонстрирует индуцированное старение эндотелиальных клеток и атеросклероз.
В исследовании Devaux et al., низкие уровни miR-150 связаны с ремоделированием ЛЖ после первичного ОИМ. Согласно Devaux и соавт., низкие уровни miR-150, miR-101 или повышенные уровни miR-16 и miR-27a коррелировали с повышенным риском нарушения сократимости ЛЖ и были связаны с ремоделированием сердца после ИМ.
Несмотря на это, два исследования показали, что некоторые из miRNAs (то есть miR-133a и miR-423-5p) бесполезны в качестве биомаркеров для прогноза пациентов с ИМ или для частоты ремоделирования ЛЖ через 1 год после переднего ОИМ.
Галектин-3 представляет собой β-галактозид-связывающий лектин, секретируемый активированными макрофагами, который интересен как минимум как маркер или, возможно, даже потенциальный медиатор воспаления и фиброза, процессов, которые являются центральными в патофизиологии ремоделирования ЛЖ.
Tsai et al. предположили несколько важных клинических проявлений галектина-3: 1) циркулирующий галектин-3 был значительно выше у пациентов с ОИМ, чем у пациентов без ОИМ; 2) имелась значительная положительная корреляция высокого уровня циркулирующего галектина-3 с оценкой острой сердечной недостаточности по Киллипу, нестабильной гемодинамикой, требующей поддержки вазопрессорами, прогрессирующей сердечной недостаточностью и высокой оценкой риска CADILLAC; 3) повышенный галектин-3, как было доказано, является достаточно сильным независимым предиктором 30-дневной летальности среди пациентов с ИМ, перенесших первичную ЧКВ.
Хотя Вейр и соавт.продемонстрировали, что более высокие концентрации галектина-3 на исходном уровне были в значительной степени связаны с более низкой сократительной функцией ЛЖ при 24-недельном наблюдении, они не установил значимой связи между галектином-3 и ремоделированием как таковым.
Фактор дифференциации роста 15 (GDF-15):
Фактор дифференциации роста 15 (GDF-15) представляет собой белок, который кодируется этим геном и принадлежит к семейству трансформирующих факторов роста-бета (TGF-бета). Этот белок экспрессируется в клетках как ответ при клеточном повреждении и действует на плейотропию. Повышенные уровни белка связаны с воспалением тканей, гипоксией, острым повреждением клеток или окислительным стрессом. В нормальном состоянии ткани GDF-15 не экспрессируется, однако, во время «стресса» было показано, что его уровни повышаются.
Несколько клинических исследований показали, что GDF-15 является независимым предиктором ремоделирования ЛЖ, смерти и сердечной недостаточности у пациентов с ИМ. Эхокардиографические и GDF-15 измерения были выполнены в начале исследования и были повторены через 6 или 12 месяцев. Исследования показали, что пациенты с более высоким уровнем GDF-15 выше среднего имели более низкую фракцию выброса ЛЖ, повышенный риск сердечной недостаточности или смерти.
Источник: Left Ventricular Remodeling after Acute Myocardial Infarction and Biomarkers J Cardiovasc Dis Diagn 5:291. doi: 10.4172/2329-9517.1000291 Diana Zaliaduonyte-Peksiene and Justina Portacenko
Ферменты крови при стрессовой кардиомиопатии (СКМП). Дифференциация с инфарктом миокарда (ОИМ)
Цель - изучить клиническую характеристику, маркеры NTproBNP и ST-2 на стационарном этапе лечения у пациентов с острым инфарктом миокарда с подъемом сегмента ST (ОИМпST) в зависимости от степени риска шкалы GRACE. Изучались пациенты с ОИМпST в первые сутки заболевания и в динамике стационарного лечения (n=149). Оценивались объективные, лабораторные данные, включая уровень NTproBNP и ST-2 на стационарном этапе лечения пациентов и в зависимости от степени риска летального исхода шкалы GRACE. Статистическая обработка материала проводилась с использованием программы «Statistica 6.0 for Windows». Средний возраст пациентов с ОИМпST 61,70±2,96 года. В первые сутки заболевания отмечается клинически значимое повышение значений NTproBNP и ST-2. Больные с ОИМпST низкого и среднего риска имеют тенденцию к снижению уровня ST-2 до нормальных значений. Пациенты высокого риска имеют высокие значения уровня NTproBNP и ST-2, без динамики снижения при выписке из стационара. У пациентов высокого риска выявлено снижение фракции выброса (ФВ), пиковой скорости трансмитрального кровотока в фазу раннего наполнения (Е) и повышение позднего наполнения (А), что отображает снижение сократительной способности миокарда и нарушения диастолической дисфункции. Пациенты высокого риска по шкале GRACE имеют высокие значения NTproBNP и ST-2 без существенной динамики на стационарном этапе лечения, что отражает негативный прогноз летального исхода. ST-2 является маркером фиброза миокарда, снижения сократительной способности миокарда, определяя дополнительное прогностическое значение у пациентов высокого риска шкалы GRACE.
1. Mallick A., Januzzi J.L. Biomarkers in acute heart failure. Rev. Esp. Cardiol. 2015. vol. 68. P. 514-525.
2. Remme W.J., Swedberg K. European Society of Cardiology. Comprehensive guidelines for the diagnosis and treatment of chronic heart failure. Task force for the diagnosis and treatment of chronic heart failure of the European Society of Cardiology. Eur. J. Heart Fail. 2002. No.4 (1). P. 11-22.
3. Усольцева Е.Н., Тавлуева Е.В., Барабаш О.Л. Гендерные и возрастные различия концентрации мозгового натрий-уретического пептида у пациентов с инфарктом миокарда // Российский кардиологический журнал 2014. №7(111). С.81-86.
4. Федорова И.Н., Белопольский А.А., Стуров Н.В. Диагностическая значимость NTproBNP у кардиологических больных // Трудный пациент. 2013. Т.11. №7. С.32-34.
5. Willems S., Hoefer I., Pasterkamp G. The role of the interleukin 1 receptor-like 1 (ST2) and Interleukin-33 pathway in cardiovascular disease and cardiovascular risk assessment. Minerva Med. 2012. vol. 103 (6). P. 513-24.
6. Domingo A. Pascual-Figal, Ordoñez-Llanos J., Tornel P.L., Vázquez R., Puig T., Valdés M., Cinca J., de Luna A.B., Bayes-Genis A. Soluble ST2 for Predicting Sudden Cardiac Death in Patients With Chronic Heart Failure and Left Ventricular Systolic Dysfunction. J. Am. Coll. Cardiol. 2009. no. 54. P. 2174-2179.
7. Ky B., French B., Levy W.C., Sweitzer N.K., Fang J.C., Wu A.H., Goldberg L.R., Jessup M., Cappola T.P. Multiple biomarkers for risk prediction in chronic heart failure. Circ. Heart Fail. 2012. no. 5. P.183-190.
8. Усольцева Е.Н., Барбараш О.Л. Место мозгового натрийуретического пептида в прогнозировании течения острого коронарного синдрома // Патология кровообращения и кардиохирургия. 2010. № 4. С. 74-78.
9. De Lemos J.A., Peacock W.F., McCullough P.A. Natriuretic peptides in the prognosis and management of acute coronary syndromes. Rev. Cardiovasc. Med. 2010. no. 11(2). P. 24-34.
10. Baba Y., Maeda K, Yashiro T, Inage E, Kasakura K, Suzuki R, Niyonsaba F, Hara M, Tanabe A, Ogawa H, Okumura K, Ohtsuka Y, Shimizu T, Nishiyama C. GATA2 is a critical transactivator for the human IL1RL1/ST2 promoter in mast cells/basophils: Opposing roles for GATA2 and GATA1 in human IL-1RL1/ST2 gene expression. J. Biol. Chem. 2012. vol. 287 (39). P. 32689-32696.
11. Sabatine M.S., Morrow D.A., Higgins L.J., MacGillivray C., Guo W., Bode C., Rifai N., Cannon C.P., Gerszten R.E., Lee R.T. Complementary roles for biomarkers of biomechanical strain ST2 and N-terminal prohormone B-type natriuretic peptide in patients with ST-elevation myocardial infarction. Circulation. 2008. vol. 117 (15). P.1936-1944.
12. Boisot S., Beede J., Isakson S., Chiu A., Clopton P., Januzzi J. Serial sampling of ST2 predicts 90-day mortality following destabilized HF. J Card Fail. 2008. vol. 14 (9). P. 732-738.
13. Дылева Ю.А., Учасова Е.Г., Груздева О.В., Федорова Н.В., Кашталап В.В. Клинико-диагностическое значение стимулирующего фактора роста (ST2) для оценки ранних осложнений инфаркта миокарда // Сибирский медицинский журнал. 2016. №31(1). С.27-31.
14. Wojtczak-Soska K., Pietrucha T., Sakowicz A., Lelonek M. Soluble ST2 protein in chronic heart failure is independent of traditional factors. Clinical research. 2013. no. 9 (1). P. 21-26.
15. Jenkins W.S., Roger V.L., Jaffe A.S. Prognostic Value of Soluble ST2 After Myocardial Infarction: A Community Perspective. Am J Med. 2017. vol.130. no. 9. P. 1112.e9-1112.e15. DOI: 10.1016/j.amjmed.2017.02.034.
16. Chen L.Q., de Lemos J.A., Das S.R., Ayers C.R., Rohatgi A. Soluble ST2 is associated with all-cause and cardiovascular mortality in a population-based cohort: The Dallas Heart Study. Clin. Chem. 2013. no. 59. P.536-546.
17. Van Kimmenade R.R., Pinto Y.M., Bayes-Genis A. Usefulness of intermediate aminoterminal pro-brain natriuretic peptide concentration for diagnosis and prognosis of acute heart failure. Am. J. Cardiol. 2006. no. 98. P. 386-390.
18. Протасов В.Н., Скворцов А.А., Кошкина Д.Е., Нарусов О.Ю., Терещенко С.Н. Использование современных биомаркеров в стратификации риска пациентов с сердечной недостаточностью // Кардиологический вестник. 2014. №4. С. 100-105.
19. Ho J.E., Chen W.Y., Chen M.H., Larson M.G., McCabe E.L., Cheng S., Ghorbani A., Coglianese E., Emilsson V., Johnson A.D. Common genetic variation at the IL1RL1 locus regulates IL-33/ST2 signaling. J. Clin. Invest. 2013. no. 123 (10). P. 4208-4218.
20. Волкова И.И. Ремоделирование сердца и сосудов при ишемической болезни сердца // Патология кровообращения и кардиохирургия. 2010. № 4. С. 96-98.
21. Li S., Liu H., Liu J., Wang H. Improved predictive value of GRACE risk score combined with platelet reactivity for 1-year cardiovascular risk in patients with acutecoronary syndrome who underwent coronary stent implantation. Platelets. 2016. Nov. no. 27 (7). P. 650-657.
Актуальной является оценка прогноза пациентов с острым инфарктом миокарда (ОИМ). В настоящее время разработаны шкалы оценки прогноза сердечно-сосудистых заболеваний и риска осложнений ишемической болезни. Стратификация риска пациентов с ОИМ включает демографические, клинические, лабораторные и инструментальные методы обследования. В клинической практике используют шкалы: PURSUIT - согласно данным Platelet Glycoprotein IIb-IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy (2000) (оценка случаев 30-дневной смертности, совокупности смерти и повторного инфаркта); TIMI - Thrombolisis In Myocardial Infarction (оценка раннего летального исхода при ИМпST, прогнозирование 30-дневной и годичной смертности у пациентов с острым коронарным синдромом без подъема сегмента ST); GRACE - Global registry of acute coronary events (определяет госпитальную летальность и летальность в течение шести месяцев). В шкале GRACE оценивают: возраст, класс острой сердечной недостаточности классификации T.Killip, частоту сердечных сокращений (ЧСС), остановку сердца, систолическое артериальное давление (АД), сегмент ST по данным электрокардиограмм, концентрацию креатинина крови, уровень маркеров некроза миокарда. Согласно сумме баллов шкалы GRACE определяется низкий, средний или высокий риск летального исхода пациентов с ОИМ.
В оценке прогноза ОИМ по данным литературы освещаются биохимические маркеры некроза, предсердный и мозговой натрийуретические пептиды, маркеры воспалительного процесса [1]. Доказано, что уровень N-концевой мозговой натрийуретический пептид пептиды В-типа (NTproBNP) увеличивается у пациентов с острым коронарным синдромом, определяя риск развития сердечной недостаточности, прогноз заболевания в дальнейшем [2, 3, 4]. Определение уровня NTproBNP широко используется в современной практике.
В течение последних лет изучается новый маркерстимулирующий фактор роста, экспрессируемый геном 2 (ST-2), играющий важную роль в развитии фиброзирования миокарда и воспалительного процесса [2]. ST-2 является рецептором белковой природы семейства интерлейкинов (ИЛ-1) и существует в двух основных формах: трансмембранной (ST2L) и растворимой (sST2). В крови sST2 нейтрализует защитные возможности системы ИЛ-33/ST2L, что приводит к гипертрофии, фиброзу миокарда [5], снижению сократительной способности миокарда левого желудочка (ЛЖ), дилатации сердца. Литературные данные подтверждают, что ST-2 является маркером сердечно-сосудистых событий, неблагоприятных клинических исходов, развития сердечной недостаточности больных ИБС [6, 7].
Больные острым инфарктом миокарда с подъемом сегмента ST (ОИМпST) имеют наиболее неблагоприятный прогноз на стационарном этапе лечения. На наш взгляд, интересным является изучение современных маркеров прогноза сердечной недостаточности NTproBNP и ST-2 у пациентов с ОИМпST в зависимости от риска шкалы GRACE.
Цель исследования - изучить клиническую характеристику, маркеры сердечной недостаточности NTproBNP и ST-2 на госпитальном этапе лечения у пациентов с острым инфарктом миокарда в зависимости от степени риска шкалы GRACE.
Материалы и методы исследования. На госпитальном этапе лечения изучались пациенты с ОИМпST в первые сутки заболевания (n=150) и при выписке из стационара. Диагноз ОИМпST подтверждался согласно рекомендациям ВНОК (2007) с учетом клинической картины, повышения маркеров некроза миокарда (МВ-КФК и тропонина I) и данных электрокардиограмм с подъемом сегмента ST в двух и более отведениях. Критерии включения: наличие артериальной гипертонии в анамнезе, первые сутки ОИМпST, осложненный острой сердечной недостаточностью Killip II-IV степени. Критерии исключения: системные заболевания соединительной ткани, аутоиммунные заболевания, онкологические заболевания в анамнезе, сахарный диабет 1-го и 2-го типа, почечная и печеночная недостаточность, бронхиальная астма, женщины репродуктивного возраста, осложненное чрескожное коронарное вмешательство.
Изучались клинико-инструментальные характеристики пациентов с ОИМпST при поступлении в кардиологическое отделение (визит 1) и при выписке (визит 2). Определяли клинические данные: систолическое (САД) и диастолическое (ДАД) артериальное давление, частоту сердечных сокращений (ЧСС), индекс массы тела (ИМТ); лабораторные данные: общий анализ крови, биохимический анализ крови, МВ-КФК, тропонин I, липидограммы. Концентрацию NTproBNT в плазме определяли иммунометрическим методом с использованием реактивов иммунодиагностических продуктов VITROS. Иммуноферментным методом в плазме определяли уровень ST-2 (использовались тест-системы фирмы Presage ST2 Assay Critical Diagnostics, UC). Выполнялась динамика электрокардиографии, эхокардиоскопии. Учитывая шкалу GRACE, рассчитывали прогноз госпитальной летальности пациентов при госпитализации: 126 баллов - низкий риск (2%) госпитальной летальности; 126-154 балла - средний риск (2-5%); 154 баллов - высокий риск (5%). Согласно степени риска шкалы GRACE все пациенты с ОИМпST разделены на группы низкого, умеренного и высокого риска.
Статистические данные рассчитывали с помощью пакета статистических программ «Statistica 6.0 for Windows». Рассчитывали непараметрические критерии методами Mann-Whitney, Wilcoxon. Вычисляли коэффициенты корреляции Спирмена и уровни его значимости. Статистически значимые различия показателей определяли при р
Результаты исследования и их обсуждение. Клинико-лабораторная характеристика пациентов с ОИМпST: возраст 61,70±2,96 года; ЧСС 81,62±18,50 в минуту, САД 135,00±27,60 мм рт. ст., ДАД 81,91±14,92 мм рт. ст., ИМТ 29,43±3,62 кг/м2; тропонин I 13,22±1,40 нг/мл, КФК 320,21±35,64 ЕД/л, МВ-КФК 61,60±14,93 ЕД/л, аланинааминотрансфераза (АЛТ) 45,01±2,62 ЕД/л, аспартатаминотрансфераза (АСТ) 86,3±8,7 ЕД/л, мочевина 6,6±2,3 ммоль/л, креатинин 84,74±33,03 мкмоль/л, скорость клубочковой фильтрации (СКФ) 81,17±1,98 мл/мин/1,73 м2; триглицериды (ТГ) 1,74±0,07 ммоль/л, общий холестерин (ОХС) 5,70±1,30 ммоль/л, липопротеиды высокой плотности (ЛПВП) 1,33±0,03 ммоль/л, липопротеиды низкой плотности (ЛПНП) 2,87±0,06 ммоль/л. Средний балл 162,21±2,53 по шкале госпитальной летальности GRACE, что соответствует высокому риску летального исхода на стационарном этапе лечения больных с ОИМпST.
Согласно данным литературы изучались разные временные точки оценки уровня NTproBNP - момент поступления пациентов, через 6 часов, 24 часа от начала ОКС, через несколько дней после ОКС [8]. Клинический риск изменяется в зависимости от времени заболевания и концентрация NT-proBNP. Независимо от фракции выброса (ФВ) левого желудочка (ЛЖ) на 3-5-е сутки ОИМ высокие значения BNP и NT-proBNP прогнозируют высокий риск сердечной недостаточности или смерти через шесть недель развития заболевания [9].
В нашем исследовании у больных с ОИМпST средний уровень NTproBNP на визите 1 - 2683,95±299,05 пг/мл, на визите 2 - 2489,46±275,06 пг/мл (р>0,05), статистически значимо не отличался. Уже в первые сутки ОИМпST уровень NTproBNP увеличился и сохранился высоким в течение госпитального этапа лечения. Рассчитаны положительные корреляции: уровня NTproBNP визита 1 с визитом 2 r=0,67 (р<0,01); уровень NTproBNP на визите 1 с функциональным классом хронической сердечной недостаточности (ХСН) r=0,20 (р<0,04) и шкалой GRACE r=0,38 (р<0,01), что свидетельствует о неблагоприятном прогнозе. Значения NTproBNP не имеют существенной динамики на госпитальном этапе лечения, что обусловливает неблагоприятный прогноз.
Значения ST-2 не более 18 нг/мл имеют здоровые люди, а уровень выше 35 нг/мл соответствует повышению риска сердечно-сосудистых осложнений [10]. Известно, что концентрация ST-2 отражает тяжесть сердечной недостаточности независимо от повышения NTproBNP и риска сердечно-сосудистых заболеваний [11]. При лечении пациентов концентрация ST-2 меняется и зависит от успешной терапии пациента [12].
Согласно данным литературы в сравнении с другими лабораторными маркерами уровень ST-2 изменяется в процессе терапии пациента [13]. В зависимости от степени тяжести сердечной недостаточности уровень ST-2 увеличивается и не связан с другими биомаркерами [14]. У больных ОИМпST и инфарктом миокарда без подъема сегмента ST значение ST2 является предиктором сердечной недостаточности и смерти [15].
Клинико-лабораторная характеристика пациентов с ОИМпST в зависимости от степени риска по шкале GRACE
Острый инфаркт миокарда нижней стенки левого желудочка с подъемом сегмента ST с переходом на правый желудочек
Правый желудочек (ПЖ) - это камера сердца с тонкой стенкой, которая через легочные артерии выталкивает кровь, обедненную кислородом, в легкие. Вследствие этого ПЖ работает в условиях низкого давления и гипоксии. Он снабжается кровью и в систолу, и в диастолу - и при напряжении, и при расслаблении сердечной мышцы. Эти факторы делают правый желудочек более устойчивым к развитию инфаркта миокарда (ИМ) по сравнению с левым. Тем не менее, он не защищен от негативного влияния атеросклероза.
Пациент Л, 75лет, был госпитализирован по СМП в ОРИТ с направительным диагнозом "ИБС. Нестабильная стенокардия с подъемом сегмента ST " При поступлении предъявлял жалобы на давящие боли за грудиной, иррадиирущие в межлопаточную область, частично купирующиеся приемом нитроглицерина, тошноту, общую слабость.
Из анамнеза: В течение многих лет (примерно с 50 лет) страдает артериальной гипертензией, с максимальными значениями АД до 160/100 мм рт.ст., привычные значения 140/90 мм рт.ст. Регулярно принимает гипотензивную терапию. Настоящее ухудшение самочувствия 11.08.2021 с 15:00 часов дня, когда стал отмечать выше указанные жалобы. 12.08.21г из-за затяжной боли обратился в ближайшее мед.учреждение, где была выявлена элевация ST на ЭКГ, положительный тест на тропонин. Доставлен в Волынскую больницу для дальнейшего лечения и обследования.
В ходе проведенного скрининг-обследования верифицирован инфаркт миокарда нижней стенки ЛЖ с поражением правого желудочка от 11.08.21г
Обследование:
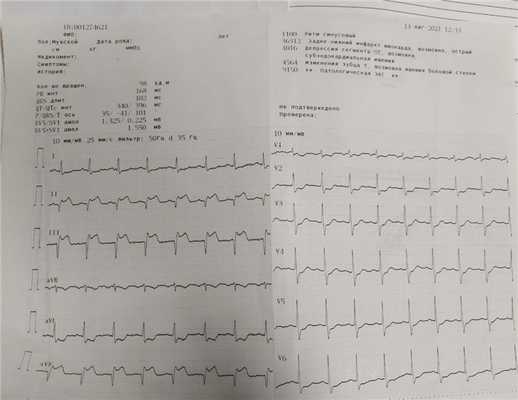
14.08.2021: Синусовая тахикардия с ЧСС 98 в мин. Обращает на себя внимание - подъем сегмента ST, патологический з.Q в отведениях II, III, AVF, реципрокная депрессия сегмента ST в отведениях I, AVL, V2-V6 - признаки острого инфаркта миокарда нижней стенки ЛЖ.
14.08.2021 Высокочувствительный тропонин Т: 1020.0 нг/л
Группа крови: A (II). Резус-фактор: Rh- отрицательный.
Биохимический анализ крови: СКФ по формуле CKD-EPI: 48 мл/мин/1.73м2.
Мочевина сыворотки: 7.4 ммоль/л. Креатинин: 125 мкмоль/л.
Повышение коэфф. атерогенности за счет повышения ЛПНП.
Креатинфосфокиназа - КФК: 978 Ед/л. Изофермент МБ-КФК: 88 Ед/л.
Калий: 4.37 ммоль/л. Натрий: 139 ммоль/л
Эхокардиография: Незначительная дилатация полости левого предсердия.
Гипокинез базального и среднего сегментов нижней стенки, базального сегмента МЖП, нижне-перегородочного сегмента ЛЖ, базального и среднего сегментов передней стенки правого желудочка. Глобальная сократимость несколько снижена. ФВ 47 %. Стенки миокарда ЛЖ не утолщены. При ДКГ-митральная регургитация -1 степени, трикуспидальная регургитация -1 степени. Диастолическая функция нарушена по рестриктивному типу. Отмечается сепарация листков перикарда за правыми отделами сердца и боковой стенкой ЛЖ до 3 мм (менее 100 мл жидкости).
14.08.2021 Выполнена экстренная коронарография, с последующим стентированием правой коронарной артерии с хорошим ангиографическим и клиническим эффектом.
Результаты исследования:
ЛЕВАЯ КОРОНАРНАЯ АРТЕРИЯ:
Ствол ЛКА - не изменён.
ПМЖВ - стеноз в п/3 80 % с переходом на устье ДВ, далее неровности контуров без гемодинамически значимых изменений.
ДВ - стеноз в п/3 от устья 40 %, далее неровности контуров без гемодинамически значимых изменений.
ОВ - неровности контуров на всем протяжении без гемодинамически значимых изменений.
ВТК - неровности контуров без гемодинамически значимых изменений..
ПРАВАЯ КОРОНАРНАЯ АРТЕРИЯ- окклюзирована в п/3, постокклюзионный сегмент не визуализируется (тромбоз).
ЗБВ ПКА - постокклюзионный сегмент не визуализируется.
ЗМЖВ ПКА - постокклюзионный сегмент не визуализируется.
Тип кровоснабжения - правый.
Ход операции:
Под местной анестезией sol. Lidocaini 2% - 5,0 пунктирована правая лучевая артерия. В/а введено 10 тыс. ед. гепарина.Проводниковый катетер 6F проведен в восходящий отдел аорты и установлен в устье правой коронарной артерии. Выполнена проводниковая реканализация, затем тромбаспирация. Извлечены фрагменты тромба. При контрольной коронарографии выявлен критический стеноз 90-95% с фрагментами пристеночных тромбов. Далее после предварительной дилатации баллонным катетером 2,0х20 мм (12 атм) выполнено стентирование ПКА. Имплантированы стенты "Resolute" 3,5х30 мм (14 атм), "Resolute" 3,0х26 мм (14 атм). Получен хороший ангиографический результат.
Завершение операции: Операция прошла без осложнений.
В острый период инфаркта отмечалась нестабильная гемодинамика:
гипотония, обусловленная поражением правого желудочка, проводилась инфузионная и кардиотоническая терапия, на фоне которой гемодинамика стабилизирована. По стабилизации состояния был переведен в 1-е кардиологическое отделение.
В отделении кардиологии проводился стационарный этап реабилитации - выполнены.
Тредмил-пробы (дистанция ходьбы 250 и 800м). В целом за весь период наблюдения пациент гемодинамически стабилен, гемодинамически значимые нарушения ритма и проводимости не регистрировались. Пациенту было показано продолжение реабилитации в условиях кардиологического отделения ФГБУ «Центр реабилитации» Управления делами Президента Российской Федерации. Имеющий место гемодинамически значимый стеноз ПМЖВ, требует хирургической коррекции в отсроченном периоде (не ранее 1 мес после перенесенного инфаркта миокарда).
19.08.2021: ЭКГ снято справа: Синусовый ритм с ЧСС 68 в мин.
Патологический з. Q и подъем сегмента ST в V2R-V4R отв. - не регистрируются.
24.08.2021: Синусовая брадикардия с ЧСС 58 в мин. Ед. предсердная экстрасистолия.
24.08.2021 Эхокардиография: Умеренный гипокинез базального и среднего сегментов нижней стенки, нижне-перегородочного сегмента ЛЖ. Глобальная сократимость после проведенного лечения выросла (ФВ-54%). Значения СДЛА в пределах нормы. Жидкость в полости перикарда не визуализируется.
Выводы: Клиника инфаркта миокарда правого желудочка может характеризоваться нетипичной симптоматикой, поэтому требует внимательного отношения со стороны врача и самого пациента. Острый и постинфарктный периоды должны протекать наиболее щадяще, учитывая склонность к дестабилизации артериального давления.
Список использованной литературы:
1. Мазур Н.А. Практическая кардиология. - М.: Медпрактика-М, 2009. - 616 с.
2. Шпектор А.В., Васильева Е.Ю. Кардиология: клинические лекции. -М.: АСТ: Астрель, 2008. - 765с
Читайте также:
- Синдром Деблера (Debler)
- Уход после операции эндопротезирования плечелучевого сочленения
- Местный остеопороз рук и его диагностика
- Снижение давления при инсульте. Ошибки терапии гипертонических кризов.
- Допа-чувствительная дистония (наследственная прогрессирующая дистония с заметными суточными колебаниями, болезнь Сегава)
