Функции Т-лимфоцитов. Активированные Т-лимфоциты. Цитокины.
Добавил пользователь Cypher Обновлено: 01.02.2026
Цитокины служат связующим звеном между врожденным и приобретенным иммунитетом, влияют на выраженность воспалительного и иммунного ответа, передают сигналы клеткам через рецепторы на их поверхности.
Цитокиновый шторм
Цитокины стимулируют воспалительный и иммунный ответ. Но также они и завершают их. Повышение содержания провоспалительных цитокинов (ИЛ-1, ИЛ-6, ФНО-альфа) в крови приводит к развитию системных эффектов: в печени вырабатываются белки острой фазы воспаления, в костном мозге происходит рост и выход лейкоцитов в кровь (лейкоцитоз), в головном мозге стимуляция гипоталамуса способствует развитию лихорадки, синтезу кортикотропин-рилизинг-гормона и последующему повышению уровня АКТГ и самых важных противовоспалительных гормонов - глюкокортикоидов надпочечников. Суммарно это позволяет мобилизовать все защитные силы организма в борьбе с микроорганизмом.
Когда провоспалительные цитокины «переходят границы» достаточного для защиты уровня, иммунный ответ становится неуправляемым. Под его атакой оказываются собственные ткани организма. Такое бывает при сепсисе - распространении инфекции из первичного очага по всему организму. Некоторые вирусы, в частности вирус SARS-CoV-2 новой коронавирусной инфекции COVID-19, способны сами стимулировать мощный выброс цитокинов, таких как Интерлейкин-6, ФНО-альфа и другие. В итоге нарастают лихорадка, слабость, тахикардия, одышка, отек легких, появляются сыпь, диарея, спутанность сознания, судороги. Такие больные требуют неотложной медицинской помощи, как правило, в условиях реанимации.
Воспалительная и иммунная реакции носят защитный характер и «граница» достаточного для защиты уровня цитокинов в крови индивидуальна. В это время виновник запуска каскада синтеза цитокинов (вирусов, бактерий) бывает уже изолирован. Отсюда сложность не только в диагностике, но и в выборе точек воздействия при лекарственной терапии.
Цитокины и их функции продолжение
Интерлейкины
Огромная группа высокоактивных молекулярных веществ. Являются точками влияния медицинских препаратов при лечении тяжелых, хронических воспалительных заболеваний.
Активация Т- и В-лимфоцитов, стимуляция стволовых клеток.
Ключевая роль в развитии местной воспалительной реакции через влияние на фагоцитирующие клетки и гранулоциты крови, вызывает повышение температуры тела
Т-хелперы 1 типа
Активирует цитотоксические клетки (Т-лимфоциты, Т-киллеры, естественные киллеры).
Играет роль в воспалительных, аллергических реакциях.
Влияет на созревание клеток крови.
Т-лимфоциты, преимущественно Т-хелперы 2 типа
Стимулирует развитие В-лимфоцитов, синтез IgE, снижает активность Т-хелперов 1 типа.
Стимулирует гуморальный иммунитет через секрецию IgM, IgE, IgG. Подавляет в макрофагах синтез ИЛ-1, ИЛ-6, ФНО.
Вызывают аллергическое воспаление.
Т-хелперы 2 типа, тучные клетки
Т-хелперы 2 типа
Активирует В-клетки, синтез IgA и рост эозинофилов.
Т-лимфоциты, моноциты, макрофаги
Активируют Т-лимфоциты, рост В-лимфоцитов.
Стимулируют воспалительную реакцию за счет выработки белков острой фазы.
Клетки костного мозга, фибробласты
Клетки костного мозга, селезенки, тимуса
Активирует рост предшественников лимфоцитов.
Моноциты, макрофаги, фибробласты
Активирует нейтрофилы как хемокин.
Влияет на развитие местной воспалительной реакции.
Т-лимфоциты, преимущественно Т-хелперы
Стимулирует рост лимфоцитов и других кроветворных клеток.
Т-хелперы 2 типа, Т-цитотоксические, В-лимфоциты, макрофаги
Подавляет образование ИЛ-1, ИЛ-2, ИЛ-6, ФНО, Т-хелперы 2 типа.
Подавляет воспалительную реакцию.
В-лимфоциты, моноциты, макрофаги
Стимулирует клеточный иммунный ответ через Т-хелперы 1 типа и продукцию ими ИФН-гамма, подавляет синтез IgE.
Эндотелиальные клетки, дендритные клетки
Стимулирует Т-хелперы 2 типа и рост эозинофилов.
Интерлейкины 35, 37
Макрофаги, дендритные клетки, лимфоциты
Подавляют воспалительную реакцию.
Интерфероны
Группа более 20 белков, объединенных в два типа, 1й тип - альфа-, бета- и омега - интерфероны, 2й тип - гамма-интерферон. Омега изучены слабо.
Подавляют размножение вирусов, увеличивают количество рецепторов для презентации антигенов на поверхности клеток.
Цитотоксические клетки (Т-лимфоциты, естественные клетки-киллеры), Т-хелперы 1 типа
Подавляет размножение вирусов, рост Т-хелперов 2 типа, активирует макрофаги, презентацию антигенов.










Выберите город
- Москва
- Санкт-Петербург
- Нижний Новгород
- Армавир
- Астрахань
- Белгород
- Белореченск
- Владимир
- Волгоград
- Вологда
- Воронеж
- Геленджик
- Ейск
- Екатеринбург
- Иваново
- Йошкар-Ола
- Казань
- Калуга
- Кострома
- Краснодар
- Курск
- Лабинск
- Липецк
- Новороссийск
- Орел
- Оренбург
- Отрадная
- Пенза
- Пермь
- Ростов-на-Дону
- Рязань
- Самара
- Саратов
- Смоленск
- Сочи
- Тверь
- Туапсе
- Тула
- Уфа
- Челябинск
- Череповец
- Ярославль
Годовой абонемент
Годовой абонемент входит в состав первого заказа и дает возможность год Вам и членам Вашей семьи сдавать анализы в два раза дешевле. Результаты всех анализов бессрочно будут храниться в личном кабинете. Подробнее
Истощение Т-лимфоцитов
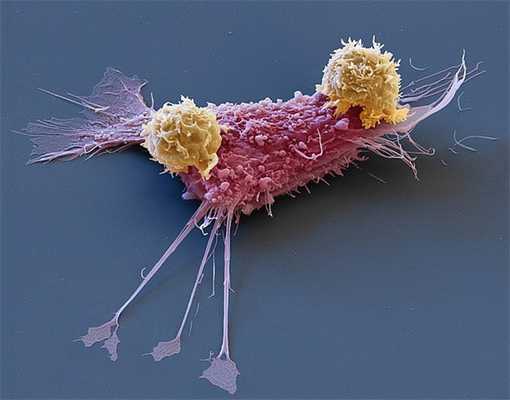
Эта микрофотография показывает, как Т-лимфоциты (желтые) атакуют раковую клетку (розовая), которую они узнают по антигенам на ее поверхности. Цель Т-лимфоцитов — предотвратить метастазирование и уничтожить опухоль. Цель же раковых клеток — выжить, для чего им необходимо подавить работу Т-лимфоцитов, в буквальном смысле доведя их до истощения (см. T cell exhaustion). Истощенные Т-лимфоциты уже не способны защитить организм от рака, инфекции или воспалительного процесса.
Т-клетки, или Т-лимфоциты, — важный компонент системы врожденного и адаптивного иммунитета (см. В иммунной системе человека найден аналог химического синапса, «Элементы», 03.08.2018). Они участвуют в борьбе организма с инфекционными заболеваниями и раком. Известны две основные популяции Т-лимфоцитов: Т-хелперы выявляют потенциально опасную цель и презентируют на своей поверхности ее антиген; после этого патоген становится мишенью для Т-киллеров — клеточных убийц, которые уничтожают врагов организма.
На ранних этапах активации Т-лимфоциты работают в полную силу: Т-хелперы узнают своих врагов и активируют В-лимфоциты и Т-киллеры, которые успешно вступают в борьбу. Со временем, однако, происходит истощение Т-лимфоцитов и борьба ослабевает: Т-хелперы перестают узнавать патогены и привлекать другие клетки для борьбы с ними, а Т-киллеры теряют свой цитотоксический потенциал.
Почему же Т-лимфоциты истощаются? Одна из причин — так называемая десенсибилизация (desensitization). Представьте, что вы слышите непрекращающийся шум за окном и не можете ничего с этим поделать. Сначала он будет вас раздражать, а потом вы перестанете обращать на него внимание — это и есть десенсибилизация. То есть повышается пороговый уровень молекул, необходимых для активации Т-лимфоцитов. Т-хелперы, постоянно окруженные раковыми клетками или патогенами, игнорируют вражеские сигнальные молекулы, считая их частью нормального, здорового организма. Такие Т-хелперы уже не способны привлечь другие клетки для борьбы.
Еще один механизм — изменения в клеточной активности Т-хелперов и Т-киллеров. В них снижаются запасы и выработка активных веществ — антиген-презентирующего комплекса у Т-хелперов и молекул, необходимых для борьбы с патогенами, у Т-киллеров: цитокинов интерлейкина-2, гамма-интерферона (см. Interferon gamma), фактора некроза опухолей. Запускаются молекулярные каскады цитотоксического Т-лимфоцит-ассоциированного белка 4 (CTLA-4) и белка программируемой клеточной гибели-1 (PD-1), которые подавляют активность Т-лимфоцитов и приводят к их гибели. Изменения в клеточной активности Т-лимфоцитов происходят из-за того, что: а) при хроническом заболевании они постоянно находятся в активированном состоянии, без отдыха и возможности восстановить запас активных молекул; б) их работу активно подавляют раковые клетки (см. рисунок ниже).
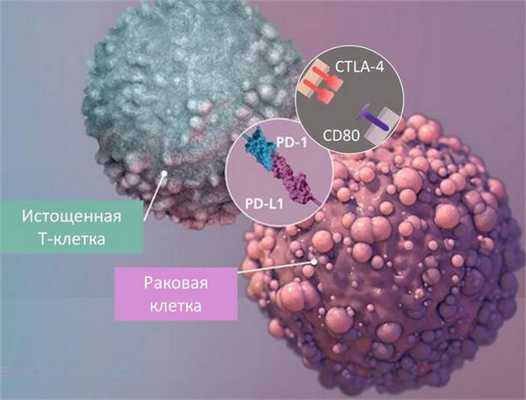
Вообще, феномен истощения во многом сходен с преждевременным клеточным старением: и стареющие (senescent), и истощенные Т-лимфоциты не экспрессируют белок CD28, из-за чего теряют способность к активации после взаимодействия с антигеном, а также не способны синтезировать цитокины для борьбы с инфекциями или раком и привлечения других иммунных клеток. Т-лимфоциты, измотанные затянувшейся (и безуспешной) борьбой и коварными атаками раковых клеток, постепенно перестают сопротивляться. Истощенность Т-лимфоцитов — одна из главных причин неспособности организма бороться с многочисленными формами рака и хроническими инфекциями, такими как вирус гепатита В и С или иммунодефицита человека (ВИЧ).
Однако есть и хорошая новость. Истощение Т-лимфоцитов обратимо, и современные методы лечения рака и хронических инфекций направлены на их оживление. Для этого применяются разнообразные ингибиторы, блокирующие каскады CTLA-4 и PD-1, а также иммуностимуляторы. Подобные ингибиторы прошли успешные клинические испытания при лечении меланомы, ходжкинской лимфомы, немелкоклеточной карциномы легкого и других видов рака.
Интересно, что иногда истощение Т-лимфоцитов, напротив, оказывается благоприятным для пациента. Любая процедура трансплантации органов, например пересадка донорской почки или сердца, запускает иммунный ответ и активацию Т-лимфоцитов реципиента. Как только они истощаются, риск отторжения трансплантатов снижается и пациент переходит в фазу выздоровления. Также феномен истощения играет положительную роль в аутоиммунных и воспалительных заболеваниях. Исследования роли истощенных Т-лимфоцитов и их терапевтического применения активно развивается, и мы ждем дальнейших научных и медицинских прорывов в этой сфере.
Функции Т-лимфоцитов. Активированные Т-лимфоциты. Цитокины.
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»

1. Алмазов В.А., Петрищев Н.И., Шляхто Е.В., Леонтьева И.В. Клиническая патофизиология. - М.: ВУНМЦ, 1999. - 464 с.
2. Белоцкий С.М., Авталион Р.Р. Воспаление. Мобилизация клеток и клинические эффекты. - М.: Изд-во БИНОМ, 2008. - 240 с.
5. Маянский А.Н. Лекции по иммунологии. - Изд-во Нижегородской медицинской академии.- Н. Новгород, 2003. - 200 с.
6. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. - 3-е изд. - М.: Издательский центр «Академия», 2010. - 480 с.
9. Типовые реакции иммунной системы на действие антигенов-аллергенов / Под общей ред. проф. Чесноковой Н.П. - Изд-во Саратов. мед. ун-та. Саратов, 2014. - 154 с.
10. Тотолян А.А. Клетки иммунной системы / А.А. Тотолян, И.С. Фрейдлин. - СПб.: Наука, 2000. - 231 с.
11. Фрейдлин И.С. Регуляторные Т-клетки: происхождение и функции / И.С. Фрейдлин / Медицинская иммунология. - 2005. - Т. 7, № 4. - С. 347-354.
12. Хаитов Р.М. Оценка иммунного статуса в норме и патологии / Р.М. Хаитов, Б.В. Пинегин // иммунология. - 2001. - № 4. - С. 4-6.
13. Ярилин А.А. Цитокины в тимусе. Биологическая активность и функции цитокинов в тимусе // Цитокины и воспаление. - 2003. - Т. 2, № 2. - С. 3-11.
14. Ярилин А.А., Донецкова А.Д. Регуляторные Foxp3+ - Т- клетки и их роль при аллергии // Росс. Аллергол. Журнал. - 2005. - № 2. - С. 22-26.
В-система лимфоцитов (лимфопоэз)
К центральным лимфоидным органам человека относят вилочковую железу (тимус), у птиц - «бурсу» (сумку Фабрициуса). У человека аналогом бурсы считают костный мозг, групповые лимфатические фолликулы кишечника (пейеровы бляшки).
В костном мозге поддерживается пул кроветворных стволовых клеток, являющихся источником образования всех клеток крови, в том числе и лимфоцитов.
Подавляющее большинство костномозговых лимфоцитов относится к бурсазависимым или В-лимфоцитам, обеспечивающим развитие иммунных или аллергических реакций гуморального типа.
В костном мозге под влиянием микроокружения стромальных костно-мозговых клеток осуществляется дифференцировка большей части В-лимфоцитов, относящихся к В2-субпопуляции клеток.
В1-субпопуляция лимфоцитов еще в эмбриональном периоде покидает костный мозг. Физиологическая регенерация В1-лимфоцитов в течение жизни человека поддерживается преимущественно в брюшной и плевральных полостях.
В1- и В2-субпопуляции лимфоцитов отличаются по своей функциональной значимости и экспонируемым на поверхности мембраны маркерам.
В процессе дифференцировки В2-лимфоцитов на их мембране экспонируются рецепторы иммуноглобулиновой природы, причем, незрелые В2-лимфоциты экспрессируют IgМ и небольшое количество молекул главного комплекса гистосовместимости класса II. По мере созревания В2-лимфоцитов на их поверхности экспрессируются молекулы иммуноглобулинов всех 5 классов. В то же время появляются рецепторы для различных компонентов комплемента и другие маркерные молекулы, в частности, СD19, СD21, СD23, СD35. Антигенчувствительными рецепторами В-лимфоцитов являются мембраносвязанный мономер IgМ, а возможно, и IgD.
Степень зрелости В-лимфоцитов определяется наличием на их мембране следующих рецепторов: антигенспецифических иммуноглобулиновой природы, к Fc-фрагменту Ig, к комплементу, к поликлональным В-активаторам, липополисахаридам и монопротеинам. В2-лимфоциты являются предшественниками клеток - плазмоцитов, обеспечивающих синтез иммуноглобулинов в ответ на антигенную стимуляцию. Необходимым условием их трансформации в клетки-продуценты антител является их взаимодействие с Т-лимфоцитами-хелперами.
В связи с этим очевидно, что В2-лимфоциты ответственны за развитие гуморального ответа на тимусзависимые антигены.
В настоящее время определена структура рецепторов В2 лимфоцитов, включающих помимо иммуноглобулина еще 4 полипептидные цепи, расположенные попарно с каждой стороны молекулы иммуноглобулина, обозначаемые как Ig-a и Ig-b. Назначение указанных пептидных компонентов заключается в проведении сигнала о связывании антигена иммуноглобулиновой частью рецептора в глубь клетки.
Как указывалось выше, дифференцировка и поддержание жизненного пула В1-лимфоцитов осуществляются за пределами костного мозга в основном в плевральной и брюшной полостях. В1-лимфоциты обеспечивают синтез антител только класса IgМ без взаимодействия с Т-хелперами. Особенностью иммуноглобулинов, продуцируемых В1-лимфоцитами, является их широкая перекрестная реактивность в ответ на воздействие бактериальных антигенов полисахаридной структуры.
Не доказана возможность реакции В1-лимфоцитов на антигены белковой природы. Характерно наличие на поверхности В1-лимфоцитов маркерной молекулы CD5, поэтому указанную субпопуляцию В-лимфоцитов нередко именуют CD5-лимфоциты.
В2-лимфоциты после созревания в костном мозге поступают в системный кровоток, а затем заселяют периферические лимфоидные органы (селезенку, лимфатические узлы, лимфоидную ткань кишечника, миндалин и других органов).
Как известно, в периферической крови в условиях нормы содержатся от 20 до 40 % лимфоцитов, причем, среди лимфоцитов периферической крови на долю В-лимфоцитов приходится лишь 20-30 %; 50-65 % составляют Т-лимфоциты и около 10 % лимфоцитов не имеют рецепторов, свойственных Т- и В-лимфоцитам; их называют «нуль-лимфоциты».
Незначительная часть лимфоцитов периферической крови имеет на своей поверхности маркеры Т- и В-лимфоцитов (D клетки).
В лимфатических узлах В-лимфоциты располагаются в тимуснезависимых зонах фолликулов, составляя лишь 35 % всех лимфоцитов. В-лимфоциты находятся в кортикальной зоне в покоящемся состоянии и образуют так называемые первичные фолликулы. На фоне антигенной стимуляции они формируют вторичные фолликулы.
Важным компонентом системы иммунопоэза является селезенка, в которой содержание В-лимфоцитов достигает 65 %, что обеспечивает быстрое накопление антителпродуцирующих плазматических клеток на фоне антигенной стимуляции.
При внутривенном введении антигена антитела образуются преимущественно в селезенке.
Лимфоидные образования червеобразного отростка, а также групповые лимфатические фолликулы - пейеровы бляшки - участвуют в синтезе антител класса IgA, тем самым обеспечивая иммунитет слизистых.
В миндалинах глоточного кольца имеются Т- и В-лимфоциты, обеспечивающие клеточный и гуморальный механизмы защиты, в частности, синтез антител класса IgA и IgG. В связи с этим тонзиллэктомия, проведенная в раннем возрасте, снижает противоинфекционную защиту глоточного кольца.
Т-система лимфоцитов
Тимус, как и костный мозг, является центральным, или первичным органом лимфоидной ткани. В составе тимуса имеются несколько долек, каждая из которых представлена эпителиальными клетками, дендритными клетками, макрофагами, лимфоцитами и другими клетками. Эпителиальные клетки тимуса синтезируют такие пептидные гормоны, как тимолин, тимозины, тимопоэтин. Крупные эпителиальные клетки коркового вещества выполняют роль «клеток-кормилиц» для лимфоцитов. Эпителиальные клетки коркового вещества имеют разветвленные отростки с большим количеством молекул главного комплекса гистосовместимости. В то же время на поверхности отростков эпителиальных клеток мозгового вещества тимуса представлены молекулы главного комплекса гистосовместимости классов II и I.
Продвигаясь из коркового вещества в мозговое, предшественники Т-лимфоцитов дифференцируются в Т-лимфоциты под влиянием тимических гормонов. В то же время секретируемые в кровь гормоны тимуса обеспечивают дозревание Т-лимфоцитов в периферических лимфатических органах - селезенке и лимфатических узлах.
Долгое время полагали, что дифференцировка всех Т-лимфоцитов происходит на территории тимуса. Однако в настоящее время обнаружены Т-лимфоциты с рецептором, большая часть которых дифференцируется экстратимически, преимущественно в стенке кишечника. В тимусе Т-лимфоциты составляют менее 0,5 % от общего числа тимоцитов.
Тимические Т-лимфоциты приобретают способность распознавать антигены в комплексе с собственными продуктами главного комплекса гистосовместимости.
Масса вилочковой железы достигает максимума к 10-12 годам, что соответствует периоду «иммунного созревания». Инволюция тимуса начинается обычно после 30 лет, но полной инволюции никогда не происходит. Касаясь особенностей дифференцировки Т-лимфоцитов в тимусе, следует отметить сохранение в клетках-предшественниках уникального репарирующего хромосомы фермента-теломеразы, что указывает на возможность многократной пролиферации Т-лимфоцита в течение жизни.
На мембране тимических Т-лимфоцитов экспрессируется специфический рецептор для распознавания антигена. В отличие от антигенраспознающего рецептора В-лимфоцитов иммуноглобулиновой природы специфический рецептор Т-лимфоцита является гетеродимером, состоящим из a- и b-цепей, обеспечивающих распознавание специфичности антигена, а также молекулы CD3. Последняя состоит из трех пептидных цепей и обеспечивает передачу сигнала о взаимодействии антигенраспознающих пептидных цепей a, b с антигеном в глубь клетки. Таким образом, полная структура рецептора Т-лимфоцитов представляется комплексом из пяти пептидов, включающих гетеродимер и молекулу CD3. Поверхностными антигенными маркерами Т-лимфоцитов являются CD3-рецепторы.
Помимо дифференцировки Т-лимфоцитов в тимусе осуществляются процессы элиминации и позитивной селекции указанных клеток. Элиминации подвергаются Т-лимфоциты, не связавшие или чрезвычайно сильно связавшие своим рецептором антигены системы МНС I и II класса, укомплектованные на клеточной мембране дендритных клеток тимуса. Такие тимоциты способны реагировать против собственных антигенов организма. Позитивная селекция проявляется в защите от апоптоза тех Т-лимфоцитов, которые связали своим антигенчувствительным рецептором антигены I и II класса МНС (HLA) со средней аффинностью.
Содержание Т-лимфоцитов в периферической крови достигает 50-65 % всех лимфоцитов крови, в грудном лимфатическом протоке - 85 % лимфоцитов.
Уровень Т-лимфоцитов в селезенке составляет 35 %, в лимфатических узлах - 65 %, где они занимают паракортикальные или тимус-зависимые зоны.
Главный комплекс гистосовместимости - группа генов, играющих важную роль не только в регуляции контроля иммунного ответа на аллотрансплантаты, но и в контроле клеточных взаимодействий.
Установлено, что система HLA (МНС) локализуется на коротком плече справа от центромеры VI аутосомной пары хромосом, включает примерно 105-106 генов. Продукты этих генов поставляются на мембраны клеток и являются антигенами гистосовместимости.
Гены, кодирующие антигены системы HLA, делят на IV класса.
Гены I класса - А, В, С, а кодируемые ими продукты - HLA-А, HLA-B, HLA-C. Гены II класса включают D-область, в которой, в свою очередь, выделяют 4 сублокуса: HLA-D, HLA-DR, HLA-DQ, HLA-DP. В состав III класса входят гены компонентов комплемента С2, С4а, С4в, пропердиновый фактор Вf. Антигены III класса присутствуют в сыворотке, на мембранах клеток их нет. К IV классу условно отнесены гены, связь которых с системой HLA требует дальнейших доказательств. Антигены HLA-системы I-II классов имеют гликопротеидную структуру. Антигены I класса присутствуют практически на всех ядросодержащих клетках организма, за исключением ранних эмбриональных и злокачественных клеток; в наибольшем количестве представлены на мембранах лимфоцитов, эпителиальных клетках, эндотелии, дендритных антигенпредставляющих клетках. Антигены А, В, С локусов системы HLA занимают примерно около 1 % клеточной поверхности.
Антигены II класса есть только на В-лимфоцитах, Т-лимфоцитах, макрофагах, дендритных антигенпредставляющих клетках.
Антигены I-II классов системы HLA выступают в качестве рецепторов для чужеродных антигенов. Антигенам I класса отводится главная роль во взаимодействии между клеткой-мишенью и Т-киллером в реакциях гиперчувствительности замедленного типа, в развитии инфекционного иммунитета. Между тем, Т-хелперы как предшественники, так и зрелые, распознают антигены II класса системы HLA в комплексе с негидролизованной частью антигена, в результате чего синтезируется интерлейкин-2. В свою очередь, интерлейкин-2 стимулирует созревание эффекторных клеток - Т-киллеров.
В связи с этим очевидна важная роль активности генов I и II классов в механизмах развития иммунных и аллергических реакций.
Следует отметить, что в системе HLA в структуре DR, т.е. генах II класса, предполагается наличие генов иммунного ответа (immune response).
HLA-DR-антигены экспонируются на В-лимфоцитах, макрофагах, эндотелии сосудов, сперматозоидах. На Т-клетках HLA-DR антигены в обычном состоянии не обнаруживаются, экспонируются лишь на фоне антигенной стимуляции.
Таким образом, HLA (МНС)- система представляет собой полиморфную систему генов и кодируемых ими продуктов- антигенов, экспонированных на мембранах различных клеток, участвующих в развитии иммунологических реакций.
Субпопуляционная характеристика T-лимфоцитов
Как указывалось выше, все Т-лимфоциты имеют на своей поверхности молекулу CD3, представленную 3 полипептидными цепями. Эти цепи армируют по бокам рецептор Т-лимфоцитов для антигена. У Т-лимфоцитов млекопитающих есть два молекулярных типа рецепторов для связывания антигена. Каждая из 4 пептидных цепей антигенсвязывающего рецептора Т-лимфоцитов кодируется отдельным геном. На каждом лимфоците есть только одна из двух пар полипептидных цепей.
В то же время, на мембранах Т- и В- лимфоцитов располагаются поверхностные антигенные маркеры, обозначаемые символом CD (Claster definion). В настоящее время идентифицировано всего свыше 130 маркерных молекул клеточных мембран лимфоцитов.
Субпопуляция CD4 Т-лимфоцитов
Характерная особенность субпопуляции CD4 Т-лимфоцита состоит в том, что антигенраспознающий рецептор представлен a- и b-полипептидными цепями. Последний способен распознавать только пептидные антигены в комплексе с молекулами МНС-II, экспрессируемыми на антигенпредставляющих дендритных клетках, В-лимфоцитах, макрофагах, эндотелии сосудов. Свободный антиген не распознается CD4-лимфоцитами.
Основными функциональными субпопуляциями CD4 лимфоцитов являются Т-хелперы (Th0, Th1, Th2, Th3) , выделена также минорная субпопуляция цитотоксических лимфоцитов с мембранным маркером CD4.
Разделение ТCD4-лимфоцитов на отдельные субпопуляции обусловлено их способностью к синтезу тех или иных лимфокинов с различной степенью интенсивности.
Ниже представлена функциональная характеристика отдельных субпопуляций CD4-лимфоцитов, используемая в нашей стране на протяжении ряда лет.
Th0 отличаются незначительной интенсивностью экспрессии генов, кодирующих цитокины всех других трех субпопуляций (Th1, Th2, Th3).
Th1 продуцируют лимфотоксин, интерлейкин-2, g-интерферон, туморнекротизирующий фактор (ФНО).
Th2 на фоне антигенной стимуляции продуцируют интерлейкин-4, интерлейкин-5, интерлейкин -9, интерлейкин-10, интерлейкин-13.
Th3 выделяют интерлейкин-4, интерлейкин-10, трансформирующий фактор роста В.
Однако, в последние годы в отечественной и зарубежной литературе предложено, наряду с представленными выше субпопуляциями Th1 и Th2, выделить субпопуляцию Th17, ответственную за развитие аутоиммунных воспалительных реакций за счет продукции провоспалительных и гемопоэтических цитокинов (TNFα, IL-6, IL-1β, IL-10, GCSF и др.
И, наконец, к числу Th относятся так называемые регуляторные Т-лимфоциты с маркерными молекулами CD4 + , CD25 + , Fox 3 , оказывающие иммуносупрессирующее действие за счет IL-10 , TGFB. Treg составляют около 10 % периферической крови, подавляют гиперактивность иммунной системы.
Следует отметить, что на поверхности всех лимфоцитов помимо антигенчувствительных рецепторов, CD-рецепторов различных категорий к малоизученным лигандам, имеются рецепторы к интерлейкинам, С3- и С4-компонентам комплемента, к Fc-фрагментам иммуноглобулинов и другим антигенам. Установлено, что продуцируемые Th цитокины обеспечивают межклеточное взаимодействие не только между отдельными субпопуляциями лимфоцитов, но и клетками мононуклеарной фагоцитирующей системы, костномозговыми клетками и другими клеточными элементами.
В настоящее время идентифицировано около 300 цитокинов, а история их изучения началась в 40-е годы 20 в. с описания биологических эффектов кахектина. Термин цитокины предложен N. Cohen в 1974 г.
Цитокины - белково-пептидные факторы с ММ от 5 до 50 кДа, участвующие в формировании и регуляции защитных реакций в ответ на действие экзогенных или эндогенных патогенов инфекционной или неинфекционной природы.
Цитокины включают следующие группы пептидов: интерлейкины, интерфероны, ростовые факторы, факторы некроза опухоли, колониестимулирующие факторы, хемокины.
К особенностям биологического действия действия цитокинов относят аутокринную стимуляцию, паракринную регуляцию межклеточного взаимодействия, а также системное действие. Цитокины обеспечивают одномоментное вовлечение иммунной, эндокринной и нервной систем в формирование реакций адаптации в ответ на действие стрессорного раздражителя.
Цитокины не являются антигенспецифическими факторами, но мониторинг показателей их содержания в крови позволяет сделать заключение об интенсивности антигенной стимуляции моноцитарно-макрофагальной и лимфоидной систем, степени активности патологических процессов или заболеваний.
На фоне антигенной стимуляции прежде всего возникает секреция цитокинов 1-го поколения с выраженной провоспалительной активностью (IL-1, IL-6, TNFα), которые индуцируют биосинтез центрального регуляторного цитокина IL-2, а затем противовоспалительных цитокинов IL-4, IL-10, TGFB и др.
Такое разделение цитокинов на про- и противоспалительные соединения далеко не всегда оправдано: так, IL-4 обеспечивает развитие IgЕ-зависимых атопических воспалительных реакций, а IL-10 подавляет продукцию ряда провоспалительных цитокинов, обеспечивающих формирование защитных реакций в зоне воспаления.
Достаточно четко определено участие Th в продукции цитокинов. Так Th1 продуцируют IFNγ, IL-2, TNFα, а Th2 - IL4, IL-5, Il-9,IL-10, IL-13.
Th17 - участники аутоиммунных реакций, синтезируют IL-17, а также GCSF, TNF, IL-6, IL-10, IL-12 и др.
Treg CD4 + , CD25 + являются источниками IL-10, TGFB, подавляющих суперэкспрессию ряда про- и противовоспалительных цитокинов.
Таким образом, в связи с гетерогенностью структуры лимфоидной ткани и многогранностью функций лимфоцитов становится очевидной значимость этих клеточных элементов в обеспечении не только специфических иммунологических механизмов защиты, развитии аллергических реакций гуморального и клеточного типов, но и в формировании синдрома системного воспалительного ответа за счет продукции цитокинов. Последние обладают способностью регулировать не только межклеточные взаимодействия в лимфоидной и моноцитарно-макрофагальной системах и, соответственно, интенсивность развития адаптивных реакций, но и дистантным действием на гипоталамо-гипофизарно-надпочечниковую систему, обеспечивая реализацию стресс-реакций, а также интенсивность продукции острофазных белков, изменение функциональной активности жизненно важных органов и систем.
Иммунная система Часть 4 Лимфоциты
В крови лимфоциты являются частью лейкоцитарной формулы (20-35%), по сути представлены разными популяциями в зависимости от иммунной функции. Образуются в костном мозге из столовой лимфоидной клетки-предшественницы. Общее свойство всех лимфоцитов - участие в иммунной толерантности - способности иммунной системы распознавать и не атаковать собственные ткани. С этой целью клетки, сталкивающиеся со своими антигенами, в процессе созревания, устраняются. Рост, развитие и работа лимфоцитов тесно связаны с особыми молекулами, которые рассмотрим в статьях позже, вводя потихоньку их обозначения.
В-лимфоциты
Развитие В-лимфоцитов происходит в костном мозге, после чего они покидают его и перемещаются в лимфатические узлы.
Зрелый В-лимфоцит выполняет роль антиген-презентирующей клетки и быть источником особых молекулярных веществ для регуляции иммунного ответа. Однако его основная задача вырабатывать антитела.
Для этого необходим контакт с антигеном и несколько дней для превращения В-лимфоцита в плазматическую клетку. В начале образующие антитела представлены иммуноглобулинами класса М IgM. После воздействия особых молекул из Т-лимфoцитов в плазматических клетках синтез антител переключается на классы IgG, IgA или IgE. Помня о встрече с антигеном, В-лимфоциты превращаются в клетки памяти.
При повторной встрече с антигеном, клетки памяти быстро преобразуются в плазматические клетки и сразу секретируют большое количество АТ. А Т-лимфоциты, сохранившие свою память, переключают В-клетки на образование более сильных IgG. Повторная встреча с антигеном нередко протекает незаметно для организма, так быстро и эффективно развивается иммунный ответ.
Т-лимфоциты
Родившись из стволовой клетки костного мозга, предшественники Т-лимфоцитов переходят в тимус, где подвергаются строгому отбору и сортировке. Существует несколько типов Т-лимфоцитов, выполняющих разные функции. Им принадлежит ключевая роль в формировании клеточного или гуморального ответа. Направление иммунитета во многом зависит от особых молекул, которые выделяют антиген-презентирующие клетки.
Тип и подтип Т-лимфоцитов
Способствуют формированию приобретенного иммунитета.
Th1-клетки (Т-хелперы 1 типа)
Активируют фагоцитирующие клетки и клетки-киллеры, выделяют ИФН-гамма, ИЛ-2, ФНО-альфа. Обуславливают приобретенный клеточный иммунный ответ, направленный на внутриклеточные патогены (вирусы), способствуют воспалительной реакции.
Th2-клетки (Т-хелперы 2 типа)
Активно участвуют в выработке антител В-лимфоцитами, выделяют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13. Обуславливают формирование приобретенного гуморального иммунного ответа, участвуют в противопаразитарном и аллергическом иммунном ответе.
Th17-клетки (Т-хелперы 17 типа)
Производят ИЛ-17, ИЛ-21, ИЛ-22, участвуют в аутоиммунных процессах, в борьбе с внеклеточными бактериями и грибами.
Th0-клетки (Нулевые Т-хелперы)
Наивные клетки, которые должны определиться с выбором. Под действием ИЛ-4, ИЛ-2 превращаются в Th2-клетки; Под действием ИЛ-12, ИФН-гамма в Th1-клетки; Под действием ИЛ-6, ТФР-бета в Th17-клетки.
Т- лимфоциты регуляторные супрессорные
Способствуют завершению иммунного ответа благодаря особым молекулам ТФР-бета, ИЛ-10, ИЛ-13 и другим, подавляющим иммунную реакцию.
Т-лимфоциты цитотоксические и Естественные Т-клетки-киллеры
Необходимы для уничтожения внутриклеточных патогенов, в частности, вирусов. Секретируют ИЛ-4 и ИФН-гамма, регулируют иммунный ответ.
Иммунных клеток гораздо больше, чем мы рассмотрели, они все несут разную функцию, их работа тесно переплетена. Многие иммунные клетки способны вырабатывать особые молекулы, которые регулируют острое воспаление и иммунный ответ.
Иммунная система Часть 5 Цитокины
Иммунная система работает, чтобы уничтожить антигены, используя иммунные клетки и особые молекулы. Одни и те же молекулы вырабатываются в разных типах клеток. Сами молекулы усиливают или подавляют действие друг друга, действуют последовательно или совместно.
Цитокины
Очень значительная группа крупных молекул, секретируемых клетками после их взаимодействия с антигенами и другими цитокинами. Они служат связующим звеном между врожденным и приобретенным иммунитетом, влияют на выраженность воспалительного и иммунного ответа, передают сигналы клеткам через рецепторы на их поверхности. Цитокины и их антагонисты используются в лечении онкологических, воспалительных, инфекционных, аутоиммунных заболеваний и при трансплантации органов и тканей.
Провоспалительные цитокины (ИЛ-1, ИЛ-6, ИЛ-12, ФНО-альфа, интерфероны, хемокины, ИЛ-8, и др.) стимулируют воспалительный ответ, разрушают пораженные клетки и вирусы. Высокий уровень этих цитокинов в крови отражает активность и тяжесть воспалительного процесса.
Противовоспалительные цитокины (ИЛ-4, ИЛ-10, ТФР-бета и др.) ограничивают развитие воспаления и завершают иммунный ответ.
Часть цитокинов несут дополнительные функции в активации клеточного или гуморального направления иммунного ответа.
Основные группы цитокинов:
- Хемокины
- Колониестимулирующие факторы (КСФ)
- Трансформирующие факторы роста (ТФР)
- Факторы некроза опухоли (ФНО)
- Интерфероны (ИФН)
- Интерлейкины (ИЛ)
Хемокины
Хемокины стимулируют хемотаксис - направленное движение и перемещение лейкоцитов. Производят хемокины лейкоциты, тромбоциты, эпителиальные и эндотелиальные клетки. Эти клетки расположены в местах наиболее частого проникновения возбудителей (кожа, слизистые оболочки, сосуды) и через хемокины зовут лейкоциты на помощь для быстрого обезвреживания чужеродных антигенов. Из минусов - к хемокиновым рецепторам на поверхности Т-лимфоцитов приспособился вирус иммунодефицита человека, используя их для проникновения в клетку.
Колониестимулирующие факторы
Вырабатываются эндотелиальными клетками, фибробластами, макрофагами, тучными клетками и T-хелперами. Предназначены для стимуляции гемопоэза - роста клеток крови. Выделяют:
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) стимулирует рост предшественников нейтрофилов.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) стимулирует рост моноцитов, нейтрофилов, эозинофилов и базофилов, активирует макрофаги.
Макрофагальный колониестимулирующий фактор (М-КСФ) стимулирует рост предшественников моноцитов.
Трансформирующие факторы роста
Трансформирующий фактор роста альфа
Макрофаги, моноциты, эпителиальные клетки, клетки костного мозга
Стимулирует рост и развитие иммунных клеток. Стимулирует выработку слизи.
Трансформирующий фактор роста бета
В-лимфоциты, макрофаги, тучные клетки
Подавляет рост лимфоцитов, отменяет эффекты многих цитокинов, переключает на синтез IgA. Способствует заживлению тканей и росту соединительной ткани в месте воспаления.
Факторы некроза опухоли
Фактор некроза опухоли - альфа
Макрофаги, лимфоциты, нейтрофилы, дендритные клетки, тучные клетки
Вызывает апоптоз, активирует макрофаги, синтез ИЛ-1, ИФН-гамма, ГМ-КСФ. Стимулирует воспаление, повреждает опухолевые клетки, повышает температуру тела.
Фактор некроза опухоли-бета
Лимфоциты, преимущественно Т-клетки
Усиливает фагоцитоз, развитие лимфоидных органов. Повреждает опухолевые клетки.
Читайте также:
