Спектр цитокинов при различных болезнях легких.
Добавил пользователь Skiper Обновлено: 22.01.2026
Для цитирования: Особенности цитокинового баланса при хронической обструктивной болезни легких. РМЖ. 2006;22:1620.
В настоящее время не вызывает сомнения, что реализация активации неспецифических и специфических иммунных реакций при хронической обструктивной болезни легких (ХОБЛ) связывается с влиянием на различные гомеостатические системы организма целого ряда универсальных медиаторов, среди которых особое место занимает цитокиновая сеть, контролирующая процессы реализации иммунной и воспалительной реактивности [7,8]. Основными продуцентами цитокинов являются Т-клетки и активированные макрофаги, а также (в той или иной степени) другие виды лейкоцитов, эндотелиоциты посткапиллярных венул, тромбоциты и различные типы стромальных клеток [4,5]. Цитокины приоритетно действуют в очаге воспаления и на территории реагирующих лимфоидных органов, выполняя в итоге ряд защитных функций [2,3]. Поэтому возникает необходимость анализа количественного и качественного состава цитокинов при патологии, отражающего локальный и системный характер воспаления [6].
С учетом вышеизложенного и была определена цель исследования, направленная на анализ особенностей цитокинового баланса в сыворотке крови и бронхоальвеолярной жидкости (БАЛЖ) у больных ХОБЛ при обострении.
Материал и методы исследования
В соответствии с поставленной целью исследования было обследовано 217 больных ХОБЛ в стадии обострения. Среди них было 159 мужчин (73,3%) и 58 женщин (36,7%) в возрасте от 40 до 74 лет (ср. возраст 56,7±2,31 лет). Стаж заболевания составлял от 3 до 32 лет. Среди курящих табак было 178 больных с индексом курения не менее 10 пачек/лет. В качестве контроля были обследованы 72 практически здоровых лица без ХОБЛ и факторов риска, сходного возраста и пола.
Содержание цитокинов (интерлейкинов - 4, 6, 8, ФНО-a), определялось с помощью иммуноферментного анализа на вертикальном фотометре Multiskan MCC-340 (450 нм) с использованием тест-систем ProCon (Россия). Полученные величины выражалась в пг/мл.
Статистическую обработку результатов осуществляли общепринятыми методами [1] с использованием пакета прикладных программ STATISTICA 6,0. Критерием статистической достоверности был уровень р Результаты исследования
Исследования по анализу содержания цитокинов у больных ХОБЛ в периферической крови показали, что общее содержание цитокинов у них достоверно выше, чем у лиц группы контроля (табл. 1). Так, уровни ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-a превышали контрольные величины соответственно в 1,76, 12,7, 4,37 и 1,56 раза (во всех случаях p <0,05).
При проведении сравнительного анализа в зависимости от стадии заболевания (табл. 2) было обнаружено, что содержание цитокинов в крови характеризуется повышением уровней ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-a.
Вместе с тем диагностически значимый (>50 пг/мл) подъем уровня цитокинов у большинства больных отмечается только во II стадии. Кроме этого, установлены отличия в динамике уровня цитокинов крови в зависимости от стадии ХОБЛ. Уровень ИЛ-4 на начальных стадиях заболевания является наиболее высоким в отличие от ИЛ-6, ИЛ-8 и ФНО-a, у которых выявлены пограничные значения у больных с клиническими проявлениями I стадии заболевания, при дальнейшем достоверном их нарастании у больных II стадии ХОБЛ. При переходе ХОБЛ от II к III-IV стадии установлены достоверные различия по уровню ИЛ-6 и ФНО-a на 40,4% и 67% (p <0,05). Сравнение больных I и III-IV стадии ХОБЛ показало достоверное различие уровня всех изучаемых цитокинов (p<0,05). Так, если содержание ИЛ-4 снижено в 1,94 раза, то ИЛ-6, ИЛ-8 и ФНО-a повышено соответственно в 3,07, 3,53 и 2,53 раза (p<0,05).
Учитывая, что при ХОБЛ очаг воспаления локализован в легких, представляло интерес изучение содержания цитокинов непосредственно в БАЛЖ (табл. 3).
Сравнение полученных результатов с контрольными цифрами показало, что у всех больных ХОБЛ содержание цитокинов в БАЛЖ было значимо выше, чем в контроле. Так, у больных ХОБЛ содержание ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-a превышало контрольные показатели, соответственно в 2,52 раза, в 2,34, 19,7 и 3,54 раза (во всех случаях p <0,05).
Данные, полученные в ходе исследования уровня цитокинов БАЛЖ в зависимости от динамики заболевания (табл. 4), показали, что сравнение больных I стадии с II и III-IV стадии ХОБЛ показывает достоверное различие уровня ИЛ-6 и ИЛ-8. При сравнительном анализе уровня исследуемых цитокинов у больных II и III-IV стадии ХОБЛ установлены достоверные различия значений только по уровню ИЛ-6, содержание которого в БАЛЖ на поздних стадиях ХОБЛ выше в 1,3 раза (p <0,05).
Следует отметить, что большой интерес для понимания патогенеза ХОБЛ и особенностей иммунной регуляции при ней представляет рассмотрение баланса интерлейкинов. Причем такую оценку целесообразно проводить с учетом возможной патогенетической значимости интерлейкинов, основываясь на их провоспалительных и противовоспалительных свойствах [7].
С учетом вышеизложенных данных была поставлена задача по определению соотношения (баланса) между уровнями про- и противовоспалительных цитокинов при ХОБЛ.
При расчете соотношения провоспалительных и противоспалительных цитокинов было установлено, что величина соотношения [ФНО-a + ИЛ-6 + ИЛ-8] / [ИЛ-4] у больных ХОБЛ в периферической крови значимо превышает в 1,43 раза (р <0,05) аналогичный показатель у лиц контрольной группы. Расчет соотношения цитокинов в БАЛЖ также свидетельствует о достоверном увеличении изучаемой величины у больных ХОБЛ в 1,74 раза по сравнению с группой контроля (р<0,05). Положительная динамика смещения баланса цитокинов в сторону провоспалительных характерна и для перехода заболевания от начальных к поздним стадиям.
Заключение
Суммируя полученные результаты, следует отметить, что при ХОБЛ регистрируется гиперцитокинемия как за счет провоспалительных (ИЛ-6, 8 и ФНО-a), так и противоспалительных цитокинов (ИЛ-4). Характер изменения гиперцитокинемии при ХОБЛ имеет четкую тенденцию увеличения от начальной стадии к конечной стадии заболевания, определяет значимую роль цитокинопосредованных механизмов в патогенезе данного заболевания.
Литература
1. Гланц С. Медико-биологическая статистика.- М.: Практика, 1998.- 459 с.
2. Кетлинский С.А., Калинина Н.М. Цитокины мононуклеарных фагоцитов в регуляции реакции воспаления и иммунитета // Иммунология.- 1995.- №3.- С. 30-44.
3. Козлов В. А. Научные аспекты современной цитокинотерапии при бактериальной инфекции: реальность и перспективы // Рос. Мед. Вести. - 1999.- №1. - С.52-54.
4. Симбирцев А.С. Цитокины - новая система регуляции защитных реакций организма // Цитокины и воспаление. - 2002. - Т. 1, № 1. - С. 9-17.
5. Фрейдлин И.С., Тотолян А.А. Иммунопатологические механизмы воспаления бронхов и легких. // Механизмы воспаления бронхов и легких и противовоспалительная терапия. - СПб., 1998. - С 194-298
6. Хаитов В.А., Гусев Е.Ю. Иммунология локального и системного воспаления // Аллергология и иммунология. - 2001. - № 5. - С. 6-7.
7. Balkwill F. Cytokine Cell Biology. - Oxford University Press, Oxford, England, 2001.- 272 pp
8. Barnes P.J., Shapiro S.D., Pauwels R.A. Chronic obstructive pulmonary disease: molecular and cellular mechanisms // Eur Respir J. - 2003. - V. 22. - P. 672-688
Роль макрофагов и цитокинов в формировании воспаления и прогрессировании хронической обструктивной болезни легких
Цель обзора. Рассмотреть некоторые приоритетные патогенетические механизмы формирования хронической обструктивной болезни легких.
Основные положения. Продемонстрировать приоритетное действие цитокинов в очаге воспаления и на территории реагирующих лимфоидных органов, а также связь реализации неспецифических и специфических иммунных реакций при хронической обструктивной болезни легких (ХОБЛ) с влиянием на различные гомеостатические системы организма целого ряда универсальных медиаторов, среди которых особое место занимает цитокиновая сеть, контролирующая процессы реализации иммунной и воспалительной реактивности.
Заключение. Изучение хронического альвеолярного/бронхиального воспаления является ключевым фактором в развитии теории патогенеза многих легочных патологий.
Хроническая обструктивная болезнь легких (ХОБЛ) - одна из важнейших проблем современного здравоохранения, причем это характерно практически для всех стран в связи с постоянно возрастающей распространенностью и смертностью от этого заболевания. ХОБЛ является единственной болезнью, от которой смертность продолжает увеличиваться. По данным исследования, проведенного Всемирной организацией здравоохранения и Мировым банком, к 2020 г. ХОБЛ будет занимать 5-е место по заболеваемости и 3-е место в структуре смертности среди всех болезней.
Известно, что острое или хроническое альвеолярное/бронхиальное воспаление является ключевым фактором в развитии патогенеза многих легочных патологий, таких как бронхиальная астма, ХОБЛ, респираторный дистресс-синдром взрослых, идиопатический фиброз легких. Локализация и специфические особенности воспалительного ответа могут быть различными для каждого из этих заболеваний, однако, для всех них характерно привлечение в легочную ткань и активация воспалительных клеток. Эти активированные клетки могут продуцировать цитокины, оксиданты и многие другие медиаторы, которые вовлечены в воспаление 4.
Основу патогенеза ХОБЛ составляет хроническое, диффузное, неаллергическое воспалительное поражение дыхательных путей, которое проходит с участием нейтрофилов, с повышенной активностью миелоперексидазы, нейтрофильной эластазы, металлопротеиназ. Воспалительная реакция связана с нейтрофильной инфильтрацией в очаге воспаления при повышенной активности интерлейкинов-6 и -8 и фактора некроза опухоли-альфа (TNF-альфа) 5. Процесс воспаления имеет многофакторную природу и представляет собой сложную систему взаимодействия клеток воспаления, продуцируемых ими цитокинов и факторов роста, а также активации рецепторного ответа каждой группы клеток, вовлеченных в воспалительный процесс. Повышение симпатической активности у больных ХОБЛ способствует активации ренин-ангиотензин-альдостероновой системы (РААС) и других нейрогормонов и медиаторов (цитокинов, эндотелинов, вазопрессина и др.).
Цитокины - это гормоноподобные белки, вырабатываемые различными клетками (лимфоцитами, моноцитами, гранулоцитами, мастоцитами, эндотелиоцитами, фибробластами, и др. клетками), обладающие широким спектром биологической активности, осуществляющие межклеточные взаимодействия при гемопоэзе, иммунном и воспалительном ответах, межсистемных взаимодействиях 17.
Цитокины традиционно делят на интерлейкины (Ил-1 - ИЛ-15), факторы некроза опухоли (TNF-альфа и -бетта), фактор, ингибирующий миграцию, интерфероны, хемотаксические факторы, ростовые факторы (фактор роста фибробластов, трансформирующий фактор роста - ТФР-бетта, эпителиалные и эндотелиальные факторы роста и т.д.) [7,8,19,20].
Основная часть провоспалительных цитокинов продуцируется нейтрофилами, активированными лимфоцитами, эндотелитальными и гладкомышечными клетками. В норме провоспалительные цитокины не должны находится в циркуляции, однако в ряде случаев они могут появляться, являсь проявлением вялотекущих скрытых воспалительных процессов, а также иммунопатологических состояний. ФНО-aльфа обладает широким спектром эффектов. Благодаря ФНО-опосредованной индукции генов факторов роста, цитокинов, факторов транскрипции, рецепторов, медиаторов и белков острой фазы воспаления, пирогенов, он вовлечен в индукцию кахексии. Существуют экспериментальные подтверждения того, что активация системы цитокинов, главным образом продукция ФНОальфа, связана с высокой активностью САС, РААС и состоянием хронической гипоксии [13]. Повышенная активность нейрогуморальной системы стимулирует выработку цитокинов, обладающих провоспалительным действием, что определяет развитие патологических изменений. Ведущая роль в патогенезе воспаления при ХОБЛ отведена нейтрофилам. Как показывают уже существующие данные, в регуляции апоптоза нейтрофилов крайне важно соблюдение баланса между провоспалительными и противовоспалительными цитокинами, который обеспечивает своевременное устранение “излишних” гранулоцитов после исполнения их функции в очаге воспаления. Если же происходит торможение апоптоза нейтрофилов, то появляется риск развития персистенции воспаления окружающих тканей, так как нейтрофилы крайне агрессивно вырабатывают цитокины воспаления, что наблюдается у больных с гнойно-септическими заболеваниями при исследованиях различных маркеров апоптоза в бронхо-альвеолярном лаваже, при биопсии в слизистой бронхов и в крови [5,9,15,21].
В развитии и функционировании нейтрофилов можно выделить три стадии, когда наблюдаются наиболее существенные различия по готовности клеток к реализации процесса апоптоза: 1) созревание в костном мозге; 2) пребывание в циркуляции; 3) нахождение в тканях, в том числе сюда необходимо отнести и экссудативные нейтрофилы (саливарные, перитонеальные, раневые, интраназальные, вагинальные, бронхоальвеолярные) [22,23].
Таким образом, активация системы цитокинов у больных ХОБЛ является маркером прогрессирования заболевания с вовлечением в патогенез все новых и новых составляющих, включая нейрогуморальную систему организма человека, приводящую к появлению и прогрессированию ЛГ, что требует особой фармакотерапевтической тактики в ведении этих больных [6].
При исследовании нейтрофилов у больных с тяжелыми гнойно-септическими заболеваниями обнаружен интересный факт - наличие высокого процента нейтрофилов (по сравнению со здоровыми людьми) с выраженной экспрессией CD95 (АРО-1, Fas) на мембранах клеток, что означало высокую готовность клеток к реализации апоптоза. Однако, при этом обнаружено торможение гибели нейтрофилов по времени (по сравнению с нейтрофилами, CD95-экспрессированными у здоровых людей), что означает наличие несостоятельности иммунитета у больных с тяжелыми гнойно-септическими заболеваниями в связи с дисбалансом между проапоптическими и антиапоптическими цитокинами.
Известно, что уровень некоторых циркулирующих в крови цитокинов и острофазных белков у пациентов ХОБЛ выше нормы. Пока не исследовалось, как базисная терапия ХОБЛ влияет на их динамику. Задачей исследования Malo O., Sauleda J. и др.[9,17,23] было описание изменений, происходящих в системе взаимодействия некоторых провоспалительных цитокинов, циркулирующих в крови во время обострения заболевания у больных ХОБЛ тяжелого течения и оценка потенциального эффекта проводимой кортикостероидной терапии. Исследователи определяли уровень TNF-альфа, ИЛ-6 и ИЛ-8 сыворотки крови и СРБ у 10 больных с ХОБЛ тяжелого течения в первые 24 ч. госпитализации по поводу внезапно нараставшей дыхательной недостаточности; повтороное лабораторное исследование проводили при выписке больного и спустя 2 месяца. Была набрана контрольная группа из 8 здоровых человек того же возраста [24]. По результатам исследования уровень сывороточного ИЛ-6 были значительно выше у пациентов с ХОБЛ по сравнению с группой контроля, а уровни ИЛ-8 в сыворотке крови в группе контроля и у больных ХОБЛ были похожими. Не было статистически значимого изменения исследованных показателей ни во время улучшения течения заболевания (несмотря на кортикостероидную терапию), ни спустя 2 месяца. Таким образом, полученные результаты продемонстрировали наличие системного воспаления во время обострения ХОБЛ, которое практически не изменилось даже под действием внутривенного введения кортикостероидов [23]. Определение TNF-альфа методом тест-системы ELISA является мало чувствительным, и не рекомендуется применять для подобного исследования.
Интересное исследование проведено группой испанских ученых - M.Miravitlles и соавт. [17], целью которого было определение роли повышенного уровня сывороточного ИЛ-6 или его растворимого рецептора (sRIl-6) в активации системы воспаления у больных с дефицитом альфа1-антитрипсин Обследованы 7 человек с дефицитом альфа1-антитрипсина и 23 человека с диагнозом ХОБЛ с такой же степенью обструкции по данным ФВД (ОФВ1 35.5-38.3%). Пациенты обеих групп были сопоставимы во возрасту (51-63 года). При сравнении показателей сывороточного ИЛ-6 и его растворимого рецептора в этих двух группах оказалось, что у больных с дефицитом альфа1-антитрипсина уровни ИЛ-6 сыворотки и растворимого рецептора ИЛ-6 в среднем составляли 4.7 pg/ml и 129.1 ng/ml соответственно, а у больных ХОБЛ с нормальным значением альфа-1-антитрипсина уровни ИЛ-6 и sRIl-6 - 4.1 pg/ml и sRIl-6 140.8 ng/ml соответственно. И только у одного больного с дефицитом альфа1-антитрипсина уровень ИЛ-6 был выше нормы. Таким образом, были обнаружены статистически не значимые различия значений уровня ИЛ-6 и рецептора ИЛ-6 сыворотки крови в обеих группах пациентов, что означает отсутствие разницы между этими показателями. Однако, динамическое исследование этих цитокинов на фоне терапии не проводилось [7-9,21,25].
В настоящее время альвеолярный макрофаг считается централь¬ной клеткой воспаления и регулятором сложных межклеточных взаимодействий. В результате активации альвеолярных макрофагов происходит скопление лимфоцитов, фибробластов, моноцитов, а также значи¬тельно активируются Т-лимфоциты. Активированные Т-лимфоциты выделяют интерлейкин-2, под влиянием которого Т-эффекторные лимфоциты активируются и продуцируют ряд лимфокинов. Наряду с этим Т-лимфоциты, как и альвеолярные макрофаги, вырабаты¬вают ряд веществ, стимулирующих пролиферацию фибробластов и, следовательно, развитие фиброза.
Альвеолярные макрофаги гиперпродуцируют ряд биологически активных веществ, в том числе интерлейкин-1, который стимулирует Т-лимфоциты и привлекает их в очаг воспаления, т.е. интерстициальную ткань легких и альвеолы [26].
Роль макрофагов в иммунитете исключительно важна - они обеспечивают фагоцитоз, переработку и представление антигена Т-клеткам, секретируют лизоцим, нейтральные протеазы, кислые гидролазы, аргиназу, многие компоненты комплемента, ингибиторы ферментов (антиактиватор плазминогена, альфа2-макроглобулин), транспортные белки (трансферрин, фибронектин, трансбаламин II), нуклеозиды и цитокины (ФНО альфа, ИЛ-1 ,ИЛ-8, ИЛ-12). ИЛ-1 выполняет много важных функций: воздействуя на гипоталамус, вызывает лихорадку; стимулирует выход нейтрофилов из костного мозга; активирует лимфоциты и нейтрофилы. Макрофаги являются одним из орудий врожденного иммунитета. Кроме того макрофаги, наряду с В- и Т-лимфоцитами, участвуют и в приобретенном иммунном ответе, являясь «дополнительным» типом клеток иммунного ответа: макрофаги являются фагоцитирующими клетками, чья функция - «проглатывание» иммуногенов и процессирование их для представления Т-лимфоцитами в форме, пригодной для иммунного ответа [27].
Т-лимфоциты распознают инфицированный макрофаг по экспонированию на его поверхности микробного антигена, находящегося в комплексе с гликопротеином МНС класса II, который в данном случае служит сигналом макрофага. В результате распознавания Т-клетки выделяют лимфокины, стимулирующие внутриклеточное уничтожение возбудителя макрофагом.
Таким образом, терапия, направленная на коррекцию моноцитарно-макрофагальной системы, является приоритетной у больных, имеющих воспалительную природу заболевания, на всех этапах воспалительного процесса и независимо от его локализации, как в бронхолегочной системе, так и в других.
Оценку прогрессирования хронической обструктивной болезнь легких необходимо проводить, сравнивая клинические показатели состояния пациента с показателями функции внешнего дыхания и с биомаркерами воспаления как специфическими, так и неспецифическими, так как прогрессирование заболевания у данной группы больных обусловлено особенностями процессов ремоделирования стенок бронхов [28]. Для оценки возможности влияния медикаментозной терапии на замедление прогрессирования заболевания важно изучить динамику уровня провоспалительных цитокинов [5,19].
Известно, что коварство ХОБЛ заключается в медленном, но неуклонном прогрессировании. Выраженная клиническая симптоматика появляется лишь в развернутой стадии болезни (2 стадия). На ранних стадиях ХОБЛ протекает скрыто, без постоянных клинических симптомов.
Совершенствование наших представлений о сущности заболевания - патогенеза ХОБЛ - является важнейшим инструментом, влияющим на основные подходы к классификации ХОБЛ, лечнению и профилактике заболевания.
С ХОБЛ нужно и можно бороться. Существуют лечебные мероприятия, способные уменьшить симптомы болезни, замедлить ее прогрессирование и улучшить качество жизни пациентов.
Спектр цитокинов при различных болезнях легких.
ИФА — иммуноферментный анализ
МБВ-1b — макрофагальный белок-1b воспаления
МХБ-1 — моноцитарный хемоаттрактантный белок 1-го типа
ФЛ — фиброз легких
Th1 — Т-хелпер 1-го типа
Th2 — Т-хелпер 2-го типа
α-ФНО — α-фактор некроза опухоли
За последние десятилетия изучение патогенеза поражения легких при саркоидозе позволило существенно расширить представления о механизмах развития гранулематозного воспаления и формирования фиброзных поствоспалительных изменений в легочной ткани. Проведенные исследования показали, что процесс фиброзообразования определяется персистирующими воспалительными стимулами, которые влияют на продукцию факторов роста и синтез фиброгенных цитокинов. При этом продолжаются процессы рекрутирования, пролиферации, дифференцировки и активации различных иммунокомпетентных клеток [1—3]. Начало воспалительного процесса сопряжено с появлением в интерстициальной ткани легких большого количества Т-клеток СD4+, интенсивно синтезирующих множество провоспалительных цитокинов, в том числе γ-интерферон (γ-ИНФ) и интерлейкин (ИЛ) 2. Нарушение апоптоза Т-клеток саркоидных гранулем приводит к хронизации воспаления и, по-видимому, способствует развитию фиброза легких (ФЛ) [2, 3].
Альвеолярные макрофаги являются клетками, представляющими антиген, и инициируют развитие саркоидного воспаления. Эти клетки синтезируют большое количество цитокинов: ИЛ-1, ИЛ-6, α-фактор некроза опухоли (α-ФНО), γ-ИНФ и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) [4]. Продукция супероксидных анионов, кислородных радикалов и протеаз легочными макрофагами, нейтрофилами, эозинофилами и тучными клетками вызывает повреждение базальной мембраны и других структур альвеол, что сопровождается рекрутированием фибробластов и эпителиальных клеток в альвеолярное пространство. Этому способствует действие местных хемоаттрактантов (хемокинов, факторов коагуляции и фибринолиза), а также матриксных протеинов (пептидов коллагена, ламинина, фибронектина и эластина). Синтез альвеолярными марофагами факторов роста (трансформирующего β-фактора роста, тромбоцитарного фактора роста, инсулиноподобного фактора роста 1-го типа) усиливает пролиферацию фибробластов и синтез этими клетками коллагена [5—7].
В настоящее время показанием к назначению стероидной терапии при саркоидозе считают наличие признаков активного системного воспаления, в то время как при развитии ФЛ наиболее эффективными оказываются противофиброзные препараты. Назначение адекватной патогенетической терапии может существенно влиять на течение болезни и определять прогноз заболевания, поэтому актуальной задачей остается поиск маркеров воспалительной активности саркоидоза и формирования фиброзных изменений в пораженных органах. Вместе с тем одновременное существование большого количества иммунопатологических процессов, регулируемых множеством факторов, затрудняет разработку методов для оценки развития заболевания.
В последние годы в иммунологических лабораториях используется метод мультиплексного анализа, который позволяет проводить одновременную оценку уровней множества цитокинов в одном образце [8, 9]. Его использование при саркоидозе может оказаться полезным для выявления тенденций в течении иммунопатологического процесса и проведения обоснованной патогенетической терапии.
Целью настоящего исследования было выявление особенностей иммунопатологического процесса у больных с различными клинико-рентгенологическими вариантами саркоидоза легких на основании одномоментной оценки цитокинового профиля периферической крови.
Материалы и методы
В исследование включали некурящих пациентов с морфологически верифицированным саркоидозом легких и внутригрудных лимфоузлов без тяжелых сопутствующих заболеваний. Обследован 41 пациент (30 женщин и 11 мужчин) в возрасте от 32 до 65 лет (средний 46,5 года). У 22 больных (группа А) отмечались признаки активности системного воспаления в виде периодического субфебрилитета, снижения массы тела, стойкого повышения уровня неоптерина в плазме крови либо прогрессирующих рентгенологических изменений в легочной паренхиме. В дальнейшем 13 пациентам этой группы проведено лечение системными глюкокортикостероидами — ГКС (преднизолон в начальной суточной дозе 0,3—0,5 мг/кг с переходом на поддерживающую дозу 0,2—0,3 мг/кг/сут в течение 6 мес). У 19 больных (группа Н) признаков активности саркоидного воспаления не выявлено; из них у 14 обнаружились рентгенологические проявления выраженного ФЛ.
Исследовали исходные концентрации ИЛ-2, ИЛ-4, ИЛ-18, α-ФНО в сыворотке крови методом иммуноферментного анализа (ИФА) на коммерческих наборах Bender Med Systems, а также уровень неоптерина на наборах IBL (Австрия), LOT 65769047, 68238023, 67256016, 71074016, 130228, соответственно. Количество определяемых значений составляло 96. Предел чувствительности измерения для ИЛ-2 0,1 пг/мл, для ИЛ-4 0,2 пг/мл, для ИЛ-18 9,2 пг/мл, для α-ФНО 2,3 пг/мл, для неоптерина 0,7 ммоль/л.
В 13 случаях исследование повторяли после курса терапии ГКС. У 9 больных с признаками выраженного ФЛ концентрацию цитокинов в сыворотке крови определяли с использованием технологии xMAP (27-plex) на анализаторе BioPlex-200 («Bio-Rad», США). Использовали наборы Bio-Plex Pro Human Cytokine Standard Group I 27-Plex («Bio-Rad», США). Число определяемых значений для анализатора BioPlex-200 составляло 27, предел чувствительности метода — 0,7 пг/мл.
Контрольную группу составили 30 здоровых доноров. Исследуемые сыворотки хранили при температуре -70 °С.
Статистическую обработку данных осуществляли с использованием пакета программ Stаtistica 6.0 (StatSoft, США) методами дискриптивной статистики и дисперсионного анализа. При сравнении уровней цитокинов у пациентов различных групп использовали критерий Манна—Уитни (различия по уровню α-ФНО оценивали методом χ 2 с применением точного критерия Фишера). При оценке динамики концентрации цитокинов использовали тест Вилкоксона. Результаты представлены в виде медианы (Ме) с интерквартильным размахом (25-й процентиль; 75-й процентиль) либо в виде среднего значения показателя и его стандартной ошибки. Различия считали достоверными при p
Результаты и обсуждение

У 6 из 10 включенных в исследование больных без признаков активного течения болезни уровень α-ФНО в крови оказался ниже пределов чувствительности используемого метода ИФА, у остальных 4 пациентов этой группы его значения соответствовали 5,4, 3,1, 5,0 и 5,1 пг/мл, в то время как у 22 пациентов с проявлениями воспалительной активности саркоидоза все значения были определяемы. Различия между группами больных по уровню α-ФНО оказались достоверными (р=0,015) и значительно выше в группе А (табл. 1). Кроме того, у больных с признаками активного течения саркоидоза выявлялось достоверное повышение уровня ИЛ-2 в крови. Известно, что как α-ФНО, так и ИЛ-2 относятся к провоспалительным цитокинам и синтезируются преимущественно Т-хелперами 1-го типа (Th1).
Уровень ИЛ-4 (цитокина, синтезируемого главным образом Т-хелперами 2-го типа — Th2), в группах А и Н не различался, однако отношение ИЛ-4/ИЛ-2 оказалось достоверно выше при неактивном течении заболевания (см. табл. 1).
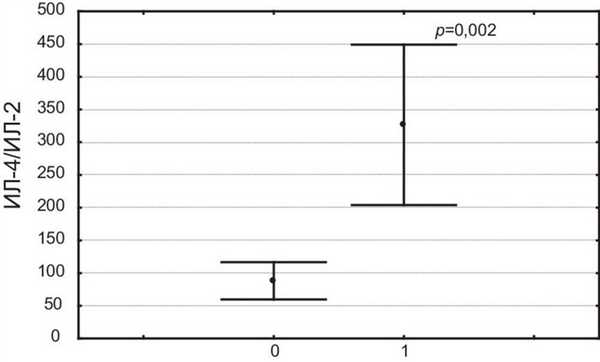
Для больных с ФЛ было характерно значительное повышение отношения ИЛ-4/ИЛ-2 в отличие от остальных пациентов (326,4±122,6 и 88,2±28,6% соответственно; р=0,002) (см. рисунок). Рисунок 1. Различие больных с признаками выраженного ФЛ (1) и пациентов с нефиброзными изменениями легочной паренхимы (0) по отношению ИЛ-4/ИЛ-2.
В настоящем исследовании не удалось выявить достоверного различия отношения ИЛ-4/ИЛ-2 в крови у больных саркоидозом с ФЛ и у пациентов с саркоидозом неактивного течения без признаков ФЛ, что было связано с малым числом наблюдений при выраженной вариабельности полученных данных.
Длительная терапия ГКС у 13 больных с признаками воспалительной активности саркоидоза привела к значительному улучшению клинико-рентгенологической картины и достоверному снижению уровня провоспалительных цитокинов в крови (табл. 2). Эти данные подтверждают высокую эффективность патогенетической терапии ГКС при активном течении саркоидоза.
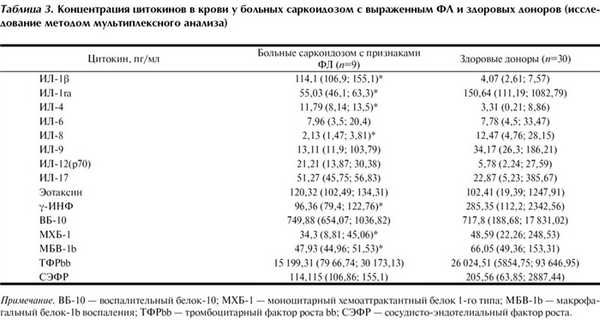
Исследование цитокинового профиля, включающего цитокины и хемокины моноцитарно-макрофагального, Th1- и Th2-клеточного происхождения и факторы фиброзообразования у больных с выраженным ФЛ и здоровых доноров, выявило следующие закономерности (табл. 3). По сравнению со здоровыми донорами у больных с ФЛ количество γ-ИНФ и факторов хемотаксиса (ИЛ-8, МБВ и МХБ) в крови было достоверно снижено, а уровень ИЛ-4 значительно превышал норму.
В настоящее время γ-ИНФ считается одним из ключевых триггеров воспаления при саркоидозе и экспрессируется главным образом клетками Th1 [10]. Участвуя в реакции гиперчувствительности замедленного типа, γ-ИНФ способствует повышению фагоцитарной активности легочных макрофагов, синтезу молекул ко-стимуляции и хемокинов семейства СХС, а также препятствует апоптозу клеток. При этом γ-ИНФ оказывает антифибротическое действие, ингибируя пролиферацию эндотелиальных клеток и синтез фибробластами коллагена в легочной ткани. В проведенном исследовании уровень γ-ИНФ в крови больных с ФЛ оказался существенно ниже, чем в группе здоровых доноров. Данные изменения не были ожидаемыми и, возможно, объясняются значительным снижением синтеза этого цитокина клетками Th1 в условиях редукции саркоидного воспаления при прогрессировании ФЛ.
МБВ и МХБ являются важными хемокинами, участвующими в привлечении и иммобилизации иммунокомпетентных клеток в зонах воспаления [11]. У пациентов с ФЛ снижение концентрации этих провоспалительных цитокинов в крови сопровождалось одновременным повышением уровня ИЛ-4, относящегося к кофакторам пролиферации фибробластов, который синтезируется в основном Т-хелперами 2-го типа.
Полученные результаты согласуются с концепцией нарушения баланса цитокинов Тh1/Th2 при развитии фиброза в легочной ткани. Согласно этой концепции появление ФЛ связано с возрастанием функциональной активности клеток Th2 и снижением синтетической активности клеток Th1, что приводит к соответствующему смещению цитокинового равновесия [3, 12].
Выявленное в данном исследовании повышение отношения ИЛ-4/ИЛ-2 при выраженном ФЛ соответствует преобладанию функциональной активности Th2 над Th1. Мы полагаем, что исследование соотношения цитокинов Th1 и Th2 у больных саркоидозом легких целесообразно для ранней диагностики ФЛ и определения показаний к назначению патогенетической противовоспалительной и противофиброзной терапии. Увеличение отношения ИЛ-4/ИЛ-2 в периферической крови при саркоидозе может свидетельствовать о начавшемся процессе фиброзообразования в легочной ткани.
У пациентов с ФЛ по сравнению со здоровыми донорами обнаружены нормальное содержание в крови ИЛ-12 (макрофагального цитокина, инициирующего активность клеток Th1 на этапе формирования саркоидных гранулем) и существенное снижение уровня ИЛ-8. Синтезируемый преимущественно легочными фибробластами ИЛ-8 относится к хемокинам семейства СХС и играет важную роль в привлечении Т-лимфоцитов и нейтрофилов в легочную ткань. Уменьшение концентрации этого хемокина в крови при ФЛ можно расценивать как признак редукции воспалительной активности заболевания [3, 4]. Вместе с тем повышение уровня ИЛ-1β в крови при одновременном снижении концентрации ИЛ-1ra (специфического антагониста рецепторов к ИЛ-1) свидетельствует о сохранении провоспалительного потенциала циркулирующих моноцитов и альвеолярных макрофагов у больных с выраженным ФЛ.
Заключение
Полученные результаты позволяют считать, что при саркоидозе развитие и прогрессирование ФЛ происходит на фоне смещения равновесия цитокинов Th1/Th2 в сторону Th2, проявляющегося повышением отношения ИЛ-4/ИЛ-2 и снижением уровня γ-ИНФ в периферической крови, что можно использовать для ранней диагностики ФЛ при этом заболевании.
У больных саркоидозом с признаками ФЛ в отсутствие симптомов воспалительной активности заболевания обнаруживаются повышение уровня провоспалительного цитокина ИЛ-1 и снижение количества антагониста рецепторов к ИЛ-1 в периферической крови, что свидетельствует о сохраняющейся активности текущего гранулематозного воспаления.
Кафедра болезней уха, горла и носа Ростовского государственного медицинского университета Минздравсоцразвития России, Ростов-на-Дону
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, Нахичеванский переулок, 29, Ростов-на-Дону, Российская Федерация, 344022
ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, Нахичеванский переулок, 29, Ростов-на-Дону, Российская Федерация, 344000
Цитокины в диагностике воспалительных заболеваний верхних дыхательных путей
Журнал: Российская ринология. 2017;25(4): 43‑47
В настоящее время более 50% воспалительных заболеваний верхних дыхательных путей возникают на фоне иммунодефицитных состояний и характеризуются атипичным латентным течением с многократным рецидивированием. Предикторами такого течения являются нарушения в механизмах врожденного и адаптивного иммунитетов, в частности в мультисистеме — цитокин-рецепторной сети. В работе проанализированы данные литературы по этой проблеме, перспективы цитокиновой/антицитокиновой терапии воспалительных заболеваний верхних дыхательных путей. Изучение цитокинового профиля позволяет получить информацию о функциональной активности различных типов иммунокомпетентных клеток, тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, а также о соотношении процессов активации Т-хелперов 1-го и 2-го типов, что очень важно при дифференциальной диагностике ряда воспалительных и иммунопатологических процессов верхних дыхательных путей.
Последнее десятилетие характеризуется ростом интереса к изучению патогенетической роли цитокинов в формировании воспалительных заболеваний ЛОР-органов и определению перспектив цитокиновой/антицитокиновой терапии.
Цитокины регулируют взаимодействие, пролиферацию и функциональную активность клеток-участников воспалительных иммунных реакций. Они модулируют направленность дифференцировки Th0-лимфоцитов, обеспечивая различные варианты воспалительной реактивности. Вирусная инфекция активирует дифференцировку Т-хелперов в субпопуляцию Th-1 иммунных Т4-лимфоцитов, специализирующихся на продукции интерферона-γ (INF-γ), тогда как бактериальные антигены — в субпопуляцию Th-2.
Цитокины являются антиген-неспецифическими факторами, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных цитокинов невозможна. Тем не менее изучение цитокинового профиля позволяет получить информацию о тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, а также о соотношении процессов активации Т-хелперов 1-го и 2-го типов, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов [1].
В настоящее время более 50% воспалительных заболеваний верхних дыхательных путей возникают на фоне иммунодефицитных состояний. В этих случаях заболевания протекают нетипично, латентно, длительно, с многократным рецидивированием, так как защитные механизмы не срабатывают из-за своей функциональной несостоятельности [2]. Предикторами такого рецидивирующего течения являются генетически детерминированные нарушения в механизмах врожденного и адаптивного иммунитета [3], в частности нарушения коммуникативных рецепторзависимых взаимодействий эффекторных клеток в результате изменений в мультисистеме — цитокин-рецепторной сети [1, 4]. Установлено, что гены цитокинов и их рецепторов в популяции человека характеризуются аллельным полиморфизмом и наличием изоформ, что определяет их способность модулировать направление иммунного ответа и лежит в основе формирования предрасположенности к определенному характеру течения инфекционного процесса [5]. Выявлена связь между полиморфизмом генов семейств интерлейкина (IL)-1 и IL-4 и развитием сенсибилизации к антигенам Streptococcus pyogenes, что повышает риск развития постстрептококковых осложнений [6]. Доказана ассоциативная связь полиморфизма генов провоспалительных и проаллергических цитокинов с аутоиммунной и аллергической патологией [6].
Цитокины играют роль связующего звена между лейкоцитами различных классов в реакциях общего и местного иммунитета.
Исследование содержания цитокинов IL-8, INF-γ, IL-1α и его рецептора IL-1Ra в носовом секрете у больных с различными формами риносинусита выявило, что переход острого воспаления в затяжное и хроническое течение связан с дисбалансом в системе провоспалительных и противовоспалительных цитокинов, проявляющимся гиперпродукцией IL-1Ra, IL-8 и дефицитом IL-10. В работе Е.В. Безруковой и соавт. предложены методы лечения с использованием рекомбинантных форм цитокинов при их дисбалансе [7].
Показано, что дисбаланс биологического действия IL-1β может возникать за счет функционального полиморфизма генов, кодирующих белки семейства IL-1, несущего небольшие мутационные изменения (точечные замены нуклеотидов, тандемные повторы частей гена) [8]. Это обстоятельство в ряде случаев приводит к качественным нарушениям фагоцитоза, что может сказываться на развитии воспаления слизистой оболочки околоносовых пазух и приводить к хронизации процесса [9].
Исследование цитокинового профиля позволяет оценить тяжесть течения риносинусита [10]. Основными цитокинами, обеспечивающими системную воспалительную реакцию, являются IL-1β, IL-6, IL-8, IL-10, фактор некроза опухоли-α. Величина соотношения провоспалительных и противовоспалительных цитокинов в сыворотке крови пациента свидетельствует об активности и выраженности системного воспаления.
Первым в защитную реакцию организма при действии патогенных факторов включается IL-1β. Этот многофункциональный цитокин с широким спектром действия играет ключевую роль в развитии и регуляции неспецифической защиты и специфического иммунитета. IL-1β инициирует и регулирует воспалительные и иммунные процессы, активирует нейтрофилы, Т- и В-лимфоциты, стимулирует синтез белков острой фазы и других цитокинов. Антагонистом IL-1β является IL-10, который продуцируется клетками Тh-2. IL-10 является противовоспалительным цитокином. Именно соотношение уровней этих цитокинов, а не их абсолютные значения наиболее полно отражает направленность иммунной реакции и активность воспаления и может быть использовано в качестве критерия определения степени тяжести воспаления при риносинусите [11]. Считается, что чем больше величина соотношения IL-1β/IL-10, тем более тяжелым является течение воспалительного процесса [1].
Активность острого воспалительного процесса клинически проявляется выраженностью болевого симптома. В настоящее время боль рассматривается как универсальный патофизиологический механизм, свидетельствующий о защитном потенциале ткани, органа и организма в целом, так как доказана роль нейроиммунных взаимодействий в формировании иммунного ответа [12].
Цитокиновый профиль пациентов с наличием и отсутствием болевого симптома имеет достоверные различия, поскольку острая боль стимулирует неспецифические факторы иммунитета. Боль и симпатический тонус стимулируют готовность к воспалительной реакции, что выражается в увеличении концентраций IL-1β и IL-4, которые по своей природе выступают в качестве плейотропных регуляторов воспалительной реакции [13].
При заболеваниях околоносовых пазух адекватный ответ иммунной системы на внедрение инфекционного агента проявляется умеренным болевым симптомом [14]. При этом смещение цитокинового баланса в сторону провоспалительных цитокинов усиливает болевой симптом, а в сторону противовоспалительных — ослабляет. Диссоциация выраженности болевого симптома и тяжести течения риносинусита является отражением нарушений формирования иммунных механизмов воспаления [15].
Выраженный болевой симптом при синуситах по типу нейрогенной боли свидетельствует о включении нейроиммунного механизма воспаления [10]. При этом IL-1β сам активирует ноцицепторы. Действуя в качестве датчика, IL-1β может непосредственно сигнализировать нервным клеткам о продолжающемся воспалении ткани [16]. Блокирование эффектов IL-1β в настоящее время рассматривается как терапевтический фактор при лечении болевых симптомов [17]. При этом баланс активности Th1- и Th2-лимфоцитов смещен в сторону Th-1, иммунная реакция проходит по цитотоксическому типу с преобладанием провоспалительного звена, которое продолжает стимулировать ноцицепцию, пролонгируя болевой симптом.
Латентные формы синуситов нередко протекают без болевого симптома, но имеют тяжелое течение с вовлечением в воспалительный процесс нескольких пазух и развитием орбитальных и внутричерепных осложнений [14]. Отсутствие боли свидетельствует о нарушении нейроиммунного взаимодействия и может служить маркером иммунодефицита. Дисбаланс цитокинов в виде недостаточности провоспалительного звена приводит к нарушению дифференцировки Т-лимфоцитов, несостоятельности воспалительной реакции и, как следствие, тяжелому или затяжному течению заболевания. У таких больных снижены концентрации IL-4, необходимого для развития гуморального Th-2 опосредованного иммунного ответа, и INF-γ, нарушен Th-1 путь дифференцировки лимфоцитов. Высокое содержание IL-10 сопровождается активацией супрессорных клеток и торможением воспалительного процесса, который еще не завершился. В результате течение гнойного воспалительного процесса становится более тяжелым. Низкие концентрации провоспалительных цитокинов IL-1β и INF-γ не индуцируют выработку алгогенов, а высокие концентрации IL-10 блокируют ноцицепторы, приводя к исчезновению болевого симптома. В этом случае доказана эффективность иммуностимулирующей терапии. Отсутствие болевого симптома у пациентов с тяжелым течением гнойного воспалительного процесса является частью нарушения единого нейроиммунного взаимодействия, запускающего механизмы защиты организма от патогена.
Скорость и специфичность реакции цитокинового профиля при различных внешних воздействиях позволяют использовать их в качестве индикатора эффективности различных методов лечения [18, 19].
Еще одна актуальная область исследования цитокинов — изучение особенностей течения воспалительных процессов на фоне аллергии.
Известно, что при аллергических заболеваниях имеет место дисбаланс в системе Т-хелперных лимфоцитов с превалированием субпопуляции Т-хелперов 2-го типа и относительным снижением активности Т-хелперов 1-го типа. О функциональной активности и преобладании одного из типов Т-хелперов судят по продуктам секреции этих клеток. Для Т-хелперных лимфоцитов 1-го типа таким маркером считают INF-γ, а для Т-хелперных лимфоцитов 2-го типа — IL-4, IL-5, IL-6, IL-10 и IL-13.
Последние исследования, посвященные изучению участия цитокинов в патогенезе аллергических заболеваний дыхательных путей, свидетельствуют о ведущей роли IL-33 и IL-22. IL-33 — цитокин семейства IL-1, экспрессируется в эпителиальных клетках лимфокольца глотки. Его экспрессия коррелирует с нейтрофильным воспалением и провоспалительными цитокинами, имеет обратную корреляцию с уровнями цитокинов IL-4, IL-5 и IL-22 [20]. IL-22 — цитокин семейства IL-10, участвует в регуляции хронического воспаления. Доказано, что дисбаланс IL-22 и его рецептора IL-22R1 лежит в основе местной эозинофильной инфильтрации и формирования полипов носа [21].
Установлено, что у детей с хроническим тонзиллитом (ХТ) в сочетании с атопическими процессами в период обострения данного заболевания (что практически всегда сопровождается обострением аллергических заболеваний дыхательных путей) уровень IL-4 в плазме крови достоверно выше по сравнению с таковым в межприступный период. В период ремиссии ХТ уровень IL-4 в плазме крови уменьшается. При динамическом исследовании уровней цитокинов в плазме крови было отмечено, что колебания уровней IL-4 и INF-γ носят прямо противоположный характер. Сделан вывод, что IL-4 и INF-γ, являясь медиаторами разных звеньев иммунного ответа, косвенно отражают направленность иммунологических реакций (активация клеточного или гуморального звена иммунитета) и что представленные данные свидетельствуют о клинико-патогенетическом значении данных цитокинов у детей с ХТ и сопутствующей аллергической патологией [22].
Исследование динамики провоспалительных цитокинов в раннем послеоперационном периоде после хирургических вмешательств на лимфоглоточном кольце позволяет адекватно оценить необходимость использования нестероидных противовоспалительных препаратов [23] в целях улучшения качества жизни пациентов и профилактики осложнений, например, поздних кровотечений [24, 25].
Механизмы функционирования воспалительных и провоспалительных цитокинов, участвующих в регуляции местной иммунной защиты, изучены недостаточно. В научной литературе имеются немногочисленные и противоречивые сведения об изучении показателей цитокинового статуса ткани глоточной миндалины путем проведения иммуногистохимических исследований у детей с гипертрофическими и воспалительными процессами [4, 26—29].
Исследование местной продукции IL-6, IL-8, IL-1β, IL-1α в ткани глоточной миндалины у детей с лимфопролиферативным синдромом позволило выявить различия в степени угнетения внутриклеточной продукции изучаемых цитокинов при лимфоидной пролиферации вирусной и бактериальной этиологии. Установлено, что герпесвирусная инфекция (вирус Эпштейна—Барр и цитомегаловирус) вызывает более глубокую иммуносупрессию, чем бактериальная. Стрептококковая инфекция характеризуется наиболее высокими показателями продукции провоспалительных цитокинов в ткани глоточной миндалины. Подавление продукции регуляторных цитокинов способствует вялому течению процесса заболевания с последующей хронизацией [26].
H. Wang и соавт. [30] изучали корреляционные связи продукции IL-6 и сосудистого эндотелиального фактора роста (vascular endothelial growth factor — VEGF) у детей с гипертрофией глоточной миндалины. VEGF является ключевым регулятором ангиогенеза, участвующим в формировании хронических воспалительных и опухолевых процессов [31, 32]. Учитывая многочисленные биологические эффекты VEGF и IL-6, авторы предположили их возможное участие в гипертрофии глоточной миндалины у детей. В этих целях были исследованы экспрессия VEGF в ткани глоточной миндалины методом иммуногистохимии, содержание IL-6 в отделяемом из носоглотки с помощью иммуноферментного анализа и изменение экспрессии VEGF в изолированных клетках глоточной миндалины после стимуляции IL-6 in vitro. Обнаружено, что экспрессия VEGF и содержание IL-6 в секрете носоглотки при значительной гипертрофии глоточной миндалины были достоверно выше, чем при ее умеренном увеличении при наличии корреляционной зависимости между исследуемыми цитокинами. Кроме этого, при инкубации клеток глоточной миндалины в присутствии рекомбинантного человеческого IL-6 in vitro отмечено достоверное дозо- и времязависимое увеличение экспрессии VEGF. Отмечено, что увеличение экспрессии VEGF в ткани гипертрофированной глоточной миндалины вполне ожидаемо, поскольку он стимулирует ангиогенез, являющийся необходимым условием гипертрофии любой ткани [33]. Полученные авторами результаты свидетельствуют об участии оси VEGF—IL-6 в развитии гипертрофии лимфоидной ткани носоглотки и объясняют связь увеличения аденоидов с хроническим воспалением.
Таким образом, имеющиеся в литературе немногочисленные исследования содержания цитокинов при различных заболеваниях верхних дыхательных путей свидетельствуют о том, что дальнейшее изучение вопроса поможет решить многие проблемы диагностики и лечения атипичного латентного течения воспалительных заболеваний ЛОР-органов.
Авторы заявляют об отсутствии конфликта интересов.
Участие авторов:
Концепция и дизайн исследования: И.С., Н.Б.
Написание текста: И.С., Н.Б., Е.Г., А.Б.
Сведения об авторах
АМ — альвеолярные макрофаги
БА — бронхиальная астма
БАЛЖ — бронхоальвеолярная лаважная жидкость
ГЭРБ — гастроэзофагеальная рефлюксная болезнь
ИГКС — ингаляционные глюкокортикостероиды
NF-κB — ядерный фактор транскрипции
В настоящее время доля пациентов с сочетанной патологией неуклонно увеличивается. Проблема современной медицины состоит в том, что изолированная терапия каждого заболевания сочетанной патологии часто оказывается малоэффективной. Становится очевидным, что без понимания особенностей патогенеза сочетанной патологии невозможно найти правильный подход к профилактике заболеваний и лечению таких пациентов [1, 2].
Одним из наиболее частых сочетаний является комбинация бронхиальной астмы (БА) и гастроэзофагеальной рефлюксной болезни (ГЭРБ) [3, 4]. Этиология и патогенез БА и ГЭРБ различны, однако при обоих заболеваниях имеется общий компонент — воспаление и нарушение адаптивного иммунного ответа в легких [5, 6].
Развитие воспаления и адаптивного ответа в значительной мере определяется макрофагами. Эти клетки врожденного ответа могут приобретать либо фенотип М1, который продуцирует преимущественно провоспалительные цитокины М1 и способствует развитию адаптивного ответа Th1, либо фенотип М2, который продуцирует противовоспалительные цитокины М2 и способствует развитию ответа Th2 [7—9]. Процесс смены фенотипа клеток называется репрограммирование. С учетом этих представлений мы выдвинули гипотезу о том, что нарушение иммунного ответа в легких при БА, ГЭРБ и сочетанной патологии связаны с нарушенным репрограммированием альвеолярных макрофагов (АМ).
Цель работы состояла в проверке этой гипотезы и оценке функционального фенотипа иммунного ответа в легких и фенотипа АМ больных БА, ГЭРБ и при сочетании этих заболеваний.
Материалы и методы
Характеристика групп обследованных. Сформированы 4 группы пациентов: больные БА персистирующего течения (n=15; 48,2±3,3 года), ГЭРБ (n=15; 46,4±4,2 года), их сочетанием (n=16; 49,3±3,6 года) и клинически здоровые лица (n=10; 51,8±3,5 года). Верификацию диагноза и терапию проводились в соответствии с действующими клиническими рекомендациями. Пациентам с БА и сочетанной патологией проводили терапию ингаляционными глюкокортикостероидами (ИГКС). В исследование включали больных в стадии ремиссии при отсутствие острого инфаркта миокарда, нестабильной стенокардии, недостаточности кровообращения IIБ—III стадии, острых нарушений мозгового кровообращения, пароксизмальных нарушений ритма сердца, гипертонического криза, дыхательной недостаточности III степени, онкологических заболеваний, туберкулеза, острых инфекционных заболеваний, нарушений свертывания крови, курения, беременности и кормления грудью. После добровольного подписания информированного согласия участникам исследования проводили фибробронхоскопию [10], результаты которой подтвердили наличие воспалительного компонента в бронхолегочной системе у больных всех групп. Дальнейшие исследования проводили на бронхоальвеолярной лаважной жидкости (БАЛЖ) и макрофагах, выделенных из БАЛЖ по методу Р. Orosi и соавт. [11].
Определение цитокинов в БАЛЖ и расчет функционального цитокинового фенотипа иммунного ответа в легких. БАЛЖ получали с помощью ФБС. Бронхоскоп (BF-B2, «Olympus», Япония) вводили в медиальный сегмент средней доли легкого. Для получения БАЛЖ вводили 6 порций стерильного изотонического раствора натрия хлорида по 20 мл с последующей аспирацией. Исследования выполняли по правилам GLP («надлежащей лабораторной практики») [12]. В БАЛЖ определяли содержание провоспалительных цитокинов М1: IL-1β, IL-8, IL-12p70, IFNγ, TNF-α и TNF-β; противовоспалительных цитокинов М2: IL-4, IL-5 и IL-10 и, цитокинов, обладающих свойствами популяции как М1, так и М2 (цитокинов М1/М2): IL-2 и IL-6 [13—15]. Содержание цитокинов оценивали методом проточной цитофлюориметрии (Beckman Coulter FC500, США) с помощью набора для определения цитокинов (BMS810FF, «BenderMedSystems», США) по инструкции производителя.
Содержание цитокинов в БАЛЖ зависит от суммарной их продукции всеми иммунными клетками в легких и отражает функциональный цитокиновый фенотип иммунного ответа в данном органе. Способ расчета изменения фенотипа иммунного ответа больных разработан нами впервые и представлен в разделе «Результаты».
Статистический анализ данных проводили с помощью программы Statistica 8.0 (Statsoft). Результаты представлены в виде средних значений полученных показателей (М) и их ошибок (±m). Статистически значимыми считали различия при р
Результаты
Функциональный цитокиновый фенотип иммунного ответа в легких здоровых людей, больных ГЭРБ и БА и с их сочетанием. В табл. 1 представлены данные о содержании цитокинов в БАЛЖ больных и здоровых лиц. Для получения наиболее объективной количественной оценки изменения цитокинового фенотипа иммунного ответа необходимо учитывать два важных обстоятельства.
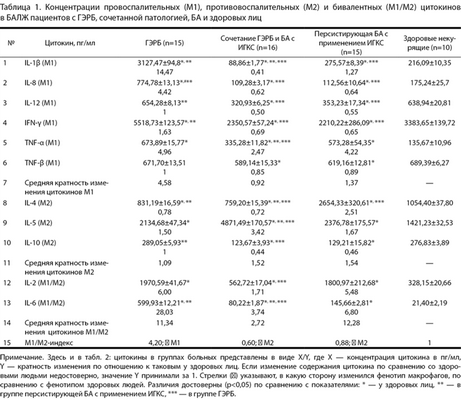
Таблица 1. Концентрации провоспалительных (М1), противовоспалительных (М2) и бивалентных (М1/М2) цитокинов в БАЛЖ пациентов с ГЭРБ, сочетанной патологией, БА и здоровых лиц
Во-первых, изменение фенотипа макрофагов в сторону провоспалительного варианта М1 может проявляться увеличением продукции цитокинов М1 на фоне снижения, неизменности или меньшей степени увеличения продукции цитокинов М2 либо это возможно даже при снижении продукции цитокинов М1, если оно развивается на фоне еще более низкого содержания цитокинов М2. Аналогичные соображения верны и для оценки изменения фенотипа в сторону варианта М2. Поэтому очевидно, что оценку изменения фенотипа иммунного ответа надо проводить по изменению отношения содержания цитокинов М1 к цитокинам М2 (индекс М1/М2), а не только по абсолютному количеству цитокинов М1 или М2.
Во-вторых, данные табл. 1 показывают, что при одном и том же заболевании изменение цитокинов одной и той же группы может происходить разнонаправлено. Например, в группе больных с сочетанной патологией содержание цитокина М1 IL-12 снижается, а другого цитокина М1 TNF-α увеличивается. Поэтому, если изменение фенотипа будет оцениваться только по отношению какого-либо одного цитокина М1 к какому-либо одному цитокину М2, то в зависимости от выбора пары цитокинов можно получить противоположные выводы о сдвиге фенотипа иммунного ответа при одной и той же патологии. В связи с этим с целью объективизации оценку изменения фенотипа иммунного ответа надо проводить по изменению отношения содержания большого количества цитокинов М1 к большому количеству цитокинов М2.
С учетом этих моментов изменение фенотипа иммунного ответа в легких у больных мы рассчитывали следующим образом. Сначала определяли кратность изменения содержания каждого цитокина в группе больных по сравнению с группой здоровых лиц (см. табл. 1, строки 1—6, 8—10, 12 и 13, значения в знаменателе). Затем рассчитывали среднюю кратность изменения цитокинов М1 (см. табл. 1, строка 7) и цитокинов М2 (см. табл. 1, строка 11). При этом если изменение концентрации цитокина было недостоверным, его кратность изменения принимали за 1. После этого рассчитывали индекс М1/М2 как отношение этих средних кратностей изменения (см. табл. 1, строка 15). В этом случае индекс М1/М2 выше 1 свидетельствует о сдвиге фенотипа иммунного ответа в сторону провоспалительного варианта М1, а значение меньше 1 — о сдвиге в сторону противовоспалительного варианта М2 по сравнению с фенотипом здоровых людей.
Результаты расчета показали, что индекс М1/М2 для больных ГЭРБ составил 4,20, для пациентов с сочетанной патологией — 0,60, а для больных БА — 0,88 (см. табл. 1, строка 15). Эти значения указывают на то, что при ГЭРБ происходит существенный сдвиг фенотипа иммунного ответа в сторону провоспалительного варианта М1, а при БА и сочетанной патологии — в сторону противовоспалительного варианта М2.
На рис. 1 изображена цитокиновая структура нарушенного иммунного ответа, при этом видно, что провоспалительный сдвиг при ГЭРБ связан с увеличением продукции цитокинов М1 IL-1β, IL-8, TNF-α и снижением продукции цитокина М2 IL-4, противовоспалительный сдвиг при БА — со снижением продукции цитокинов М1 IL-8, IL-12, IFN-γ, TNF-β и увеличением продукции цитокинов М2 IL-4 и IL-5, а противовоспалительный сдвиг при сочетанной патологии — со снижением продукции цитокинов М1 IL-1β, IL-8, IL-12, IFN-γ и увеличением продукции цитокина М2 IL-5. Наряду с наличием специфичности цитокиновой структуры при всех 3 заболеваниях обнаруживаются и общие черты: увеличение, хотя и в разной степени, содержания в БАЛЖ цитокинов TNF-α, IL-6 и IL-2 (см. рис. 1).
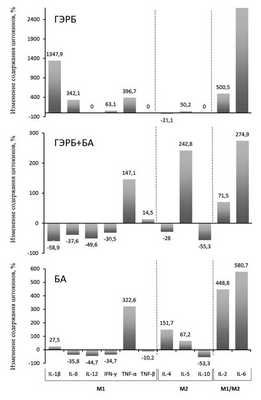
Рис. 1. Специфические образцы изменения содержания различных цитокинов в БАЛЖ больных ГЭРБ, БА и при их сочетании.
Из представленных диаграмм также следует, что внутри каждой группы цитокинов (М1 или М2) изменения имели разнонаправленный характер. Например, при БА продукция цитокина М1 IL-12 снизилась на 47,7%, а продукция другого цитокина М1 TNF-α, напротив, увеличилась на 322,5%. Это может указывать на наличие в БАЛЖ субпопуляций иммунных клеток как с провоспалительным, так и с противовоспалительным фенотипом.
В целом результаты оценки спектра цитокинов в БАЛЖ выявили серьезные деформации фенотипа иммунного ответа в легких у больных ГЭРБ в сторону провоспалительного ответа М1, а у больных БА — в сторону противовоспалительного ответа М2. Аналогичные выводы в отношении ГЭРБ и БА получены и другими исследователями [17—19]. В настоящей работе мы впервые показали, что при сочетанной патологии изменение иммунного ответа в легких происходит в сторону противовоспалительного фенотипа М2. Наша гипотеза состояла в том, что эти особенности иммунного ответа могут быть связаны с изменением фенотипа АМ.
Функциональный фенотип АМ здоровых лиц и пациентов. Фенотип А.М. мы оценивали по содержанию цитокинов в среде их культивирования. Результаты изучения фенотипа макрофагов свидетельствуют, что индекс М1/М2 для больных ГЭРБ составил 2,52; для лиц с сочетанной патологией — 0,84; для пациентов с БА — 1,59 (табл. 2, строка 15). Эти значения указывают на то, что при ГЭРБ и при БА изменение фенотипа АМ происходило в сторону варианта М1, а при сочетанной патологии — в сторону варианта М2.
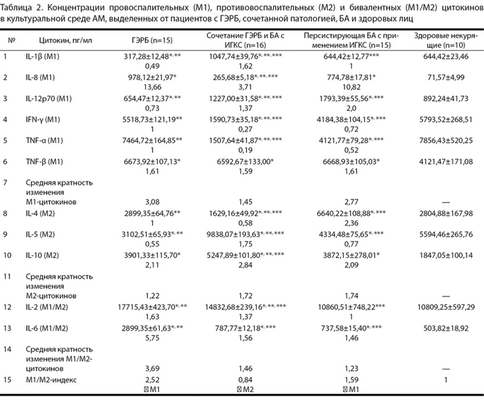
Таблица 2. Концентрации провоспалительных (М1), противовоспалительных (М2) и бивалентных (М1/М2) цитокинов в культуральной среде АМ, выделенных от пациентов с ГЭРБ, сочетанной патологией, БА и здоровых лиц
Диаграммы на рис. 2 показывают, что провоспалительный сдвиг фенотипа макрофагов у больных ГЭРБ связан с увеличением продукции цитокинов М1 IL-8, TNF-β и снижением содержания цитокина М2 IL-5; провоспалительный сдвиг у пациентов с БА — с увеличением продукции цитокинов М1 IL-8, IL-12 и TNF-β и снижением выработки цитокина М2 IL-5; при этом противовоспалительный сдвиг при сочетанной патологии связан со сниженным уровнем цитокинов М1 IFN-γ и TNF-α и увеличением синтеза цитокинов М2 IL-5 и IL-10.
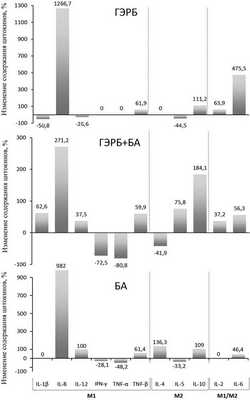
Рис. 2. Специфические образцы изменения содержания различных цитокинов в среде культивирования АМ, выделенных из легких больных ГЭРБ, БА и при их сочетании.
Наряду со специфичными для каждого вида патологии изменениями продукции цитокинов макрофагами, при ГЭРБ, БА и их сочетании существуют и общие по направленности изменения, хотя и выраженные в разной степени. Речь идет о повышенной выработке цитокинов М1 IL-8 и TNF-β, увеличении содержания цитокина М2 IL-10 и повышенном уровне цитокина М1/М2 IL-6 (см. рис. 2; см. табл. 2).
При анализе продукции цитокинов макрофагами мы также обнаружили, что внутри каждой группы цитокинов изменения разнонаправлены. Например, при БА продукция цитокинов М1 IL-8 и IL-12 существенно увеличивалась, а продукция других цитокинов М1 IFN-γ и TNF-α, напротив, снижалась (см. табл. 2). Это может указывать на гетерогенность популяции макрофагов, выделенной от больных, и наличие субпопуляции макрофагов с фенотипом как М1, так и М2.
В результате проведенного исследования мы обнаружили, что пациенты с ГЭРБ, БА и при сочетании этих заболеваний имеют в каждом случае свои, характерные только для данного состояния, изменения содержания цитокинов в БАЛЖ (см. рис. 1). Наличие такой специфичности, очевидно, отражает особенности нарушения иммунного ответа в легких, а также различие этиологических факторов, которые действуют на иммунную систему при этих заболеваниях. Специфичность цитокиновой структуры важно учитывать при разработке способов коррекции нарушенного иммунного ответа. Так, данные рис. 1 дают основание полагать, что провоспалительный сдвиг при ГЭРБ целесообразно корригировать за счет снижения продукции цитокинов М1 IL-1β, IL-8, TNF-α, выработка которых увеличена, и/или за счет стимуляции продукции цитокина М2 IL-4, синтез которого снижен. Ограничивать продукцию других цитокинов М1, таких как IL-12 или TNF-β, или увеличивать выработку цитокина М2 IL-10 при ГЭРБ нецелесообразно, потому что содержание этих цитокинов при данном заболевании соответствует их уровню у здоровых людей. Предварительное определение состава цитокинов у каждого конкретного больного могло бы повысить эффективность коррекции иммунного ответа в легких.
Выявлены также изменения и общего характера в содержании цитокинов в БАЛЖ при ГЭРБ, БА и сочетании этих видов патологии: увеличение содержания цитокина М1 TNF-α и цитокинов М1/М2 IL-6 и IL-2 (см. рис. 1). Это подтверждает наличие общего провоспалительного компонента в легких при всех 3 состояниях. Важную роль в развитии данного воспалительного компонента, вероятно, играет ядерный фактор транскрипции — NF-κB. Этот фактор вовлечен в процессы синтеза провоспалительных цитокинов и его активация, действительно, происходит в легких при повреждении, инфекциях, БА и других заболеваниях [20—22]. Поэтому NF-κB заслуживает внимания в качестве терапевтической мишени при лечении легочных осложнений ГЭРБ, БА и сочетанной патологии.
Кроме того, оказалось, что при каждом из заболеваний в БАЛЖ происходят разнонаправленные изменения содержания цитокинов одной и той же группы — М1 или М2. Это может быть связано с неоднородностью популяции иммунных клеток в БАЛЖ больных. Например, доминирующей при ГЭРБ, очевидно, является «патогенетическая» популяция макрофагов М1, которая запускает чрезмерное воспаление, тогда как реакция противовоспалительной, «терапевтической» популяции М2 представлена увеличением синтеза противовоспалительного цитокина М2 IL-5. Фенотипическую гетерогенность иммунных клеток целесообразно учитывать при разработке новых методов коррекции иммунного ответа. Например, при ГЭРБ было бы целесообразно ограничивать продукцию провоспалительных цитокинов в популяции иммунных клеток М1и увеличивать продукцию противовоспалительных цитокинов в популяции М2. Специфические маркеры фенотипа на поверхностности иммунных клеток дают возможность для зависимой от фенотипа доставки блокаторов или активаторов синтеза цитокинов.
В дальнейшем проанализированы изменения цитокинового фенотипа макрофагов, выделенных из БАЛЖ больных с различной патологией. Оказалось, что, как и в случае нарушения цитокинового фенотипа иммунного ответа (см. рис. 1), при ГЭРБ, БА и их сочетании имеется характерный для каждого состояния цитокиновой структуры активности АМ (см. рис. 2) и наличие общих для всех изменений. Общим явилось увеличение продукции цитокинов М1 IL-8 и TNF-β, цитокина М2 IL-10 и цитокина М1/М2 IL-6 (см. табл. 2; см. рис. 2). Увеличение продукции цитокинов М1, вероятно, отражает общий провоспалительный компонент, а увеличение противовоспалительного цитокина М2— компенсаторную реакцию макрофагов и в целом врожденного ответа при всех 3 заболеваниях.
Выявлено также, что продукция разных цитокинов одной и той же группы (М1 или М2) меняется разнонаправлено, и это позволило предположить связь данного феномена с фенотипической неоднородностью А.М. Ранее с помощью поверхностных клеточных маркеров фенотипа показано, что популяция макрофагов БАЛЖ здоровых людей, а также пациентов с ГЭРБ, БА и сочетанной патологией состоит из макрофагов как М1, так и М2 [23]. Эти данные дают еще больше оснований для разработки зависимой от фенотипа коррекции иммунного ответа при заболеваниях легких.
Для проверки нашей гипотезы важно было сравнить характер изменений цитокинов в БАЛЖ (см. рис. 1), где в продукцию цитокинов вносят вклад все иммунные клетки, и в среде культивирования изолированных макрофагов (см. рис. 2). При интерпретации такого сравнения необходимо учитывать, что иммунные клетки в БАЛЖ находились в организме и оказывались под влиянием этиологических факторов заболевания и лекарственных препаратов, а изолированные макрофаги — в условиях культуральной среды и активировались только бактериальным липополисахаридом. С учетом этого можно сделать два качественных вывода.
Во-первых, оказалось, что изменение функционального фенотипа АМ у больных ГЭРБ в сторону М1 и при сочетанной патологии в сторону М2-варианта (см. табл. 2, строка 15) совпадает с изменением фенотипа иммунного ответа (см. табл. 1, строка 15) в легких. У больных БА изменение фенотипа иммунного ответа в легких происходит в сторону варианта М2 (см. табл. 1, строка 15), а изменение собственного фенотипа АМ — в сторону варианта М1 (см. табл. 2, строка 15). При интерпретации этого сопоставления надо учитывать, что больные БА принимали ИГКС, которые могут репрограммировать макрофаги в сторону противовоспалительного фенотипа М2 [24]. При культивировании макрофагов больных БА в среде не было ИГКС и макрофаги проявляли свой истинный провоспалительный фенотип М1. Этот фенотип, вероятно, формирует провоспалительный компонент и может провоцировать обострение БА, связанное с острой воспалительной реакцией [25]. В целом проведенный сравнительный анализ поддерживает нашу гипотезу о важной роли репрограммирования макрофагов в патогенезе нарушения иммунного ответа в легких.
Во-вторых, наши данные показали, что при всех заболеваниях изменения содержания IL-2 в БАЛЖ очень существенны и доходят до 500% при ГЭРБ (см. табл. 2, строка 12), а в среде культивирования макрофагов — лишь незначительны: при ГЭРБ на 63,9%, при сочетанной патологии на 37,2%; при БА изменения и вовсе отсутствовали (см. табл. 1, строка 12). Чтобы понять причину этих отличий, надо учитывать, что основным источником IL-2 являются клетки Th1 [22]. В легких и БАЛЖ эти клетки есть, а в среде культивирования макрофагов — нет. Таким образом, наши данные показывают, что клетки адаптивного ответа также вносят вклад в нарушение иммунного ответа при заболеваниях легких. При этом, судя по данным табл. 1 (строка 12), вклад клеток Th1 (оцененный по продукции IL-2) в нарушение цитокинового фенотипа иммунного ответа при ГЭРБ и БА существенно выше, чем при сочетанной патологии.
Читайте также:
- Синдром Рубинштейна (Rubinstein)
- Техника внутриаортальной балонной контрпульсации. Завершение и осложнения внутриаортальной балонной контрпульсации (ВАБК)
- Особенности мышления у глухих. Умственное развитие при глухоте
- Усиление шумов сердца при пороках. Шумы левых отделов сердца при пороках
- КТ, МРТ при запертой жидкости в вершине пирамиды височной кости
