Газы крови. Кислородная емкость крови и оксигемометрия
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Транспорт кислорода кровью. Лишь небольшая часть O2 (около 2 %), переносимого кровью, растворена в плазме. Основная его часть транспортируется в форме непрочного соединения с гемоглобином, который у позвоночных содержится в эритроцитах. В молекулы этого дыхательного пигмента входят видоспецифичный белок - глобин — и одинаково построенная у всех животных простетическая группа — гем, содержащая двухвалентное железо.
Присоединение кислорода к гемоглобину (оксигенация гемоглобина) происходит без изменения валентности железа, т.е. без переноса электронов, характеризующего истинное окисление. Тем не менее гемоглобин, связанный с кислородом, принято называть окисленным (правильнее — оксигемоглобин), а отдавший кислород — восстановленным (правильнее — дезоксигемоглобин).
1 г гемоглобина может связать 1,36 мл газообразного O2 (при атмосферном давлении). Учитывая, к примеру, что в крови человека содержится примерно 15 г % гемоглобина, 100 мл его крови могут переносить около 21 мл O2 . Это так называемая кислородная емкость крови. Оксигенация гемоглобина (иначе говоря, процент, на который используется кислородная емкость крови) зависит от парциального давления O2 в среде, с которой контактирует кровь. Такая зависимость описывается кривой диссоциации оксигемоглобина Сложная S-образная форма этой кривой объясняется кооперативным эффектом четырех полипептидных цепей гемоглобина, кислородсвязывающие свойства (сродство к O2 ) которых различны.
Благодаря такой особенности венозная кровь, проходя легочные капилляры (альвеолярное РO2 приходится на верхнюю часть кривой), оксигенирируется почти полностью, а артериальная кровь в капиллярах тканей (где РО2 соответствует крутой части кривой) эффективно отдает O2 . Отдаче кислорода способствует содержащийся в эритроцитах 2,3-дифосфоглицерат, синтез которого усиливается при гипоксии и интенсификации окислительного процесса в тканях.
Кривая диссоциации оксигемоглобина сдвигается вправо при повышении температуры и при увеличении концентрации водородных ионов в среде, которая, в свою очередь, зависит от РCO2 (эффект Бора). Поэтому создаются условия для более полной отдачи кислорода оксигемоглобином в тканях, особенно там, где выше интенсивность метаболизма, например в работающих мышцах. Однако и в венозной крови большая или меньшая часть (от 40 до 70 %) гемоглобина остается в оксигенированной форме. Так, у человека каждые 100 мл крови отдают тканям 5−6 мл O2 (так называемая артериовенозная разница по кислороду) и, естественно, на ту же величину обогащаются кислородом в легких.
Сродство гемоглобина к кислороду измеряется величиной парциального давления кислорода, при которой гемоглобин насыщается на 50 % (Р50); У человека оно составляет в норме 26,5 мм рт. ст. для артериальной крови. Параметр Р50 отражает способность дыхательного пигмента связывать кислород. Этот параметр выше для гемоглобина животных, обитающих в бедной кислородом среде, а также для так называемого фатального гемоглобина, который содержится в крови плода, получающего кислород из крови матери через плацентарный барьер.
Кислородная емкость крови — количество кислорода, которое может быть связано кровью при её полном насыщении; выражается в объёмных процентах (об%); зависит от концентрации в крови гемоглобина. Определение Кислородной емкости крови важно для характеристики дыхательной функции крови. Кислородная емкость крови человека — около 18—20 об%.
Оксигемометрия — фотометрический метод измерения степени насыщения артериальной крови кислородом, основанный на спектральных свойствах оксигемоглобина и восстановленного гемоглобина. Для оксигемометрии пользуются специальными приборами — оксигемометрами, построенными на принципах фотоэлемента.
Оксигемография) — метод исследования насыщения крови кислородом, заключающийся в графической регистрации результатов оксигемометрии.
95.4Транспорт углекислого газа кровью. Роль эритроцитов и плазмы крови. Значение карбангидразы. Диффузия СО2 из тканей в кровь. Обмен СО2 между клетками тканей с кровью тканевых капилляров осуществляется с помощью следующих реакций: 1) обмена С1- и НСО3- через мембрану эритроцита; 2) образования угольной кислоты из гидрокарбонатов; 3) диссоциации угольной кислоты и гидрокарбонатов. В ходе газообмена СО2 между тканями и кровью содержание НСОз- в эритроците повышается и они начинают диффундировать в кровь. Для поддержания электронейтральности в эритроциты начнут поступать из плазмы дополнительно ионы С1- Наибольшее количество бикарбонатов плазмы крови образуется при участии карбоангидразы эритроцитов. Большая часть СО2 транспортируется в организме в связанном состоянии в виде гидрокарбонатов и карбаминовых соединений, что увеличивает время обмена СО2, затрачиваемое на диссоциацию этих соединений. В венозной крови, притекающей к капиллярам легких, напряжение СО2 составляет в среднем 46 мм рт.ст. (6,1 кПа), а в альвеолярном воздухе парциальное давление СО2 равно в среднем 40 мм рт.ст. (5,3 кПа), что обеспечивает диффузию СО2 из плазмы крови в альвеолы легких по концентрационному градиенту. Карбаминовый комплекс СО2 с гемоглобином образуется в результате реакции СО2 с радикалом NH2 глобина. Эта реакция протекает без участия какого-либо фермента, т. е. она не нуждается в катализе. Реакция СО2 с Нb приводит, во-первых, к высвобождению Н+; во-вторых, в ходе образования карбаминовых комплексов снижается сродство Нb к О2. Эффект сходен с действием низкого рН. Как известно, в тканях низкое рН потенцирует высвобождение О2 из оксигемоглобина при высокой концентрации СО2 (эффект Бора). С другой стороны, связывание О2 гемоглобином снижает сродство его аминогрупп к СО2 (эффект Холдена). Процесс выведения СО2 из крови в альвеолы легкого менее лимитирован, чем оксигенация крови. Это обусловлено тем, что молекулярный СО2 легче проникает через биологические мембраны, чем О2. По этой причине он легко проникает из тканей в кровь. К тому же карбоангидраза способствует образованию гидрокарбоната. Яды, которые ограничивают транспорт О2 (такие как СО, метгемоглобинобразующие субстанции — нитриты, метиленовый синий, ферроцианиды и др.) не действуют на транспорт СО2. Блокаторы карбоангидразы, например диакарб, которые используются нередко в клинической практике или для профилактики горной или высотной болезни, полностью никогда не нарушают образование молекулярного СО2.
96Газообмен в тканях.Парциальное напряжение кислорода и углекислого газа в тканевойжидкости,клетках и артериальной крови.Коэффициент утилизации кислорода.
Кислород проникает из крови в клетки тканей путем диффузии, обусловленной разностью (градиентом) его парциальных давлений по обе стороны, так называемого гематопаренхиматоз-ного барьера. Так, среднее РО2 в артериальной крови составляет около 100 мм рт. ст., а в клетках, где кислород непрерывно утилизируется, стремится к нулю.кислород диффундирует в ткани не только из капилляров, но частично из артериол. Гематопаренхиматозный барьер помимо эндотелия кровеносного сосуда и клеточной мембраны включает и разделяющую их межклеточную (тканевую) жидкость. Перемещение тканевой жидкости, конвективные токи в ней могут способствовать транспорту кислорода между сосудом и клетками. Ту же роль, играют внутриклеточные цитоплазматические токи. И все же преобладающим механизмом переноса кислорода здесь служит диффузия, которая протекает тем интенсивнее, чем выше его потребление данной тканью.
Напряжение кислорода в тканях в среднем составляет 20−40 мм рт. ст. Функция газотранспортной системы организма в конечном счете направлена на поддержание парциального давления кислорода на клеточной Мембране не ниже критического, т.е. минимального, необходимого для работы ферментов дыхательной цепи в митохондриях. Для клеток, интенсивно потребляющих кислород, критическое РO2 составляет около 1 мм рт. ст. Напряжение O2 в тканях зависит не только от снабжения кислородом, но и от его потребления клетками. Наиболее чувствительны к недостатку кислорода клетки мозга, где окислительные процессы очень интенсивны.
В отличие от нервных клеток и клеток сердечной мышцы скелетные мышцы относительно устойчивы к кратковременному прекращению кислородного снабжения. Они используют при этом в качестве источника энергии анаэробный гликолиз. Кроме того, мышцы (особенно "красные") более выносливы к длительной работе, располагают незначительным резервом кислорода, запасенного в миоглобине. Миоглобин представляет собой дыхательный пигмент, подобный гемоглобину. Однако его сродство с кислородом значительно выше (P50 = 3 + 4 мм рт. ст.), поэтому он оксигенируется при относительно невысоком РO2 зато отдает кислород при очень низком его напряжении в тканях.
Перенос СО2 из клеток тканей в кровь тоже происходит главным образом путем диффузии, т.е. в силу разности напряжений СO2 по обе стороны гематопаренхиматозного барьера. Среднее артериальное значение РСО2 в среднем составляет 40 мм рт. ст., а в клетках может достигать 60 мм рт. ст. Локальное парциальное давление углекислого газа и, следовательно, скорости его диффузионного транспорта в значительной мере определяются продукцией СO2 (т.е. интенсивностью окисилительных процессов) в данном органе.
По той же причине РCO2 и PO2. B различных венах не одинаковы. Так, в крови, оттекающей от работающей мышцы, напряжение O2 гораздо ниже, а напряжение СO2 гораздо выше, чем, например, в крови, оттекающей от соединительной ткани. Поэтому для определения артериовенозной разницы, характеризующей суммарный обмен газов в организме, исследуют их содержание наряду с артериальной кровью (ее газовый состав практически одинаков в любой артерии) в смешанной венозной крови правого предсердия.
Коэффициент утилизации кислорода (КУО2) представляет собой часть кислорода, поглощаемую тканями из капиллярного русла; КУО2 определяют как отношение потребления кислорода к его доставке.В норме КУО2 = 24%.
Скорость доставки кислорода в нормальных условиях значительно превышает его потребление, в результате чего лишь малая доля доступного кислорода извлекается из капиллярной крови в обычном состоянии (в покое КУО2 = 22-32%). Это позволяет тканям приспосабливаться к снижению доставки кислорода увеличением его утилизации. КУО2 при тяжёлой мышечной работе способен повышаться до 60-80%.
97.6Физиология дыхательных путей. Регуляция их просвета. Рефлекторная регуляция дыхания осуществляется благодаря тому, что нейроны дыхательного центра имеют связи с многочисленными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон. В легких человека находятся следующие типы механорецепторов: 1) ирритантные, или быстроадаптирующиеся, рецепторы слизистой оболочки дыхательных путей; 2) рецепторы растяжения гладких мышц дыхательных путей; 3) J-рецепторы.
Рефлексы со слизистой оболочки полости носа. Раздражение ирритантных рецепторов слизистой оболочки полости носа, например табачным дымом, инертными частицами пыли, газообразными веществами, водой вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружении в воду. У них возникает остановка дыхания, препятствующая проникновению воды в верхние дыхательные пути.
Рефлексы с глотки. Механическое раздражение рецепторов слизистой оболочки задней части полости носа вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, а следовательно, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных.
Рефлексы с гортани и трахеи. Многочисленные нервные окончания расположены между эпителиальными клетками слизистой оболочки гортани и главных бронхов. Эти рецепторы раздражаются вдыхаемыми частицами, раздражающими газами, бронхиальным секретом, инородными телами. Все это вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани и сокращение гладких мышц бронхов, которое сохраняется долгое время после рефлекса.
Кашлевой рефлекс является основным легочным рефлексом блуждающего нерва.
Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Раздражение этих рецепторов вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем. Рецепторы наиболее чувствительны к трем типам раздражителей: 1) табачному дыму, многочисленным инертным и раздражающим химическим веществам; 2) повреждению и механическому растяжению дыхательных путей при глубоком дыхании, а также пневмотораксе, ателектазах, действии бронхоконстрикторов; 3) легочной эмболии, легочной капиллярной гипертензии и к легочным анафилактическим феноменам.
Рефлексы с J-рецепторов. В альвеолярных перегородках в контакте с капиллярами находятся особые J-рецепторы. Эти рецепторы особенно чувствительны к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам, фенилдигуаниду (при внутривенном введении этого вещества). Стимуляция J-рецепторов вызывает вначале апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию.
Оксигемометрия и оксигемография
Эти методы используются в физиологических исследованиях (реже — в клинической практике) с целью неинвазивного определения содержания в крови оксигемоглобина, в % - имеющемуся гемоглобину. Методы основаны на том, что поглощение света зависит от формы гемоглобина: оксигемоглобин поглощает меньше света, чем дезоксигемоглобин. На ушную раковину испытуемого помещают фотодатчик с источником света. Луч, проходят через достаточно прозрачную поверхность ушной раковины, поглощается фотодатчиком. Когда в крови снижается уровень оксигемоглобина, например, при произвольной задержке и дыхания, — возрастает поглощение света, и датчик регистрирует это изменение либо на стрелочном приборе (оксигемометрия), либо на самописце (оксигемография). Этот способа позволяет определить величину падения парциального напряжения кислорода в крови при произвольном апноэ, а также оценить скорость движения крови на участке «легкое — ухо». Когда испытуемый после длительного апноэ делает вдох, он получает порцию кислорода, - кровь, обогащенная кислородом, от легких достигнет ушной раковины, на которой находится фотодатчик. Время от момента вдоха до сдвига кривой на оксигемографе или оксигемометре отражает время движения крови на участке «легкое — ухо».
Методы оценки газообмена
Потребность в таких определениях возникает, главным образом, при оценке максимального потребления кислорода, при изучении энергозатрат организма в каких-либо условиях, а также для исследования дыхательной функции легких. Существуют различные способы определения потребления кислорода и выделения углекислого газа. Они заключаются в том, что на определенном интервале времени регистрируют потребление кислорода и выделение углекислого газа (современные приборы типа «Спиролит») или только кислорода (прибор типа «Метатест»). В этих случаях оценка потребления кислорода, например, проводится по убыли объема воздуха, из которого испытуемый совершает вдох и куда он делает выдох.
Классический способ определения потребления кислорода и выделения углекислого газ» заключается в следующем. Определяют минутный объем дыхания, например, собирают весь выдохнутый воздух в мешок Дугласа. Затем проводят газовый анализ — определяют процентное содержание кислорода и углекислого газа (как и в атмосферном воздухе), и по разнице процентного содержания кислорода и углекислого газа во вдыхаемом и выдыхаемом воздухе определяют объемы кислорода и углекислого газа. Например, МОД =8 л/мин. Содержание кислорода в атмосфере 21%, в выдыхаемом воздухе — 16%. Следовательно, разница—21—1б%=5% от 8 л, т.е. (5х8)/100=0,4 л/минуту.
Горная болезнь
При подъеме на гору (более 4,5 км) возникает горная болезнь как результат низкого парциального давления кислорода. Если человек быстро поднимается на высоту, то развивается острая гипоксия. В основе явления лежит гипервентиляция, возникающая в ответ на
острую гипоксию (за счет возбуждения хеморецепторов каротидного синуса), но при этом ваблюдается гипокапния, т. е. вымывание углекислого газа, и поэтому импульсация с центральных хеморецепторов резко снижается, что приводит к гипопноэ. У горцев снижена чув-, ствительность к гипоксии, их периферические хеморецепторы снижают свою чувствительность к недостатку кислорода, т. е. наблюдается своеобразная гипоксическая «глухота». Поэтому у них МОД не возрастает, не создается снижение парциального напряжения углекислого газа. Есть, конечно, и другие механизмы, позволяющие горцам адаптироваться к таким условиям. Например, у них возрастает диффузионная способность легких, увеличивается кислородная емкость крови за счет роста содержания гемоглобина, повышается способность тканей экстрагировать кислород.
При подъеме в горы из-за падения атмосферного давления снижается парциальное давление кислорода в альвеолярном пространстве. Когда это давление снижается ниже 50 мм рт. ст. (5 км высоты), неадаптированному человеку необходимо дышать газовой смесью, в которой повышено содержание кислорода. На высоте 9 км парциальное давление в альвеолярном воздухе падает до 30 мм рт. ст., и практически выдержать такое состояние невозможно. Поэтому используется вдыхание 100% кислорода. В этом случае при данном барометрическом давлении парциальное давление кислорода в альвеолярном воздухе составляет 140 мм рт. ст., что создает большие возможности для газообмена. На высоте 12 км при вдыхании обычного воздуха альвеолярное давление =16 мм рт. ст. (смерть), при вдыхании чистого кислорода - всего лишь 60 мм рт. ст., т. е. дышать еще можно, но уже опасно. В этом случае можно подавать чистый кислород под давлением и обеспечить дыхание при подъеме на высоту 18 км. Дальнейший подъем возможен только в скафандрах (при использовании автономного атмосферного давления).
7.Транспорт кислорода кровью. Кривая диссоциации оксигемоглобина, ее характеристика. Кислородная емкость крови.
В 100 мл крови при температуре тела растворяется лишь 0,3 мл кислорода. Кислород, растворяющийся в плазме крови капилляров малого круга кровообращения, диффундирует в эритроциты, сразу же связывается гемоглобином, образуя оксигемоглобин, в котором кислорода 190 мл/л. Скорость связывания кислорода велика: время полунасыщения гемоглобина кислородом около 3 мс. В капиллярах альвеол с соответствующими вентиляцией и перфузией практически весь гемоглобин превращается в оксигемоглобин.
Кривая диссоциации оксигемоглобина. Превращение гемоглобина в оксигемоглобин определяется напряжением растворенного кислорода. Графически эта зависимость выражается кривой диссоциации оксигемоглобина (рис. 151).
Когда напряжение кислорода равно нулю, в крови находится только восстановленный гемоглобин (дезоксигемоглобин). Повышение напряжения кислорода сопровождается увеличением количества оксигемоглобина. Но данная зависимость существенно отличается от линейной, кривая имеет S-образную форму. Особенно быстро (до 75%) уровень оксигемоглобина возрастает при увеличении напряжения кислорода от 10 до 40 мм рт. ст. При 60 мм рт. ст. насыщение гемоглобина кислородом достигает 90%, а при дальнейшем повышении напряжения кислорода приближается к полному насыщению очень медленно. Таким образом, кривая диссоциации оксигемоглобина состоит из двух основных частей — крутой и отлогой.
Отлогая часть кривой, соответствующая высоким (более 60 мм.рт. ст.) напряжениям кислорода, свидетельствует о том, что в этих условиях содержание оксигемоглобина лишь слабо зависит от напряжения кислорода и его парциального давления во вдыхаемом и альвеолярном воздухе. Так, подъем на высоту 2 км над уровнем моря сопровождается снижением атмосферного давления с 760 до 600 мм рт. ст., парциального давления кислорода в альвеолярном воздухе со 105 до 70 мм рт. ст., а содержание оксигемоглобина снижается лишь на 3%. Таким образом, верхняя отлогая часть кривой диссоциации отражает способность гемоглобина связывать большие количества кислорода несмотря удумеренное снижение его парциального давления во вдыхаемом воздухе. И в этих условиях ткани достаточно снабжаются кислородом.
Крутая часть кривой диссоциации соответствует напряжениям кислорода, обычным для тканей организма (35 мм рт. ст. и ниже). В тканях, поглощающих много кислорода (работающие мышцы, печень, почки), оксигемоглобин диссоциирует в большей степени, иногда почти полностью. В тканях, в которых интенсивность окислительных процессов мала, большая часть оксигемоглобина не диссоциирует. Переход тканей из состояния покоя в деятельное состояние (сокращение мышц, секреция желез) автоматически создает условия для увеличения диссоциации оксигемоглобина и увеличения снабжения тканей .кислородом.
Сродство гемоглобина к кислороду (отражается кривой диссоциации оксигемоглобина) непостоянно. Особенно значительно на него влияют следующие факторы. 1. В эритроцитах содержится особое вещество 2, 3-дифосфоглицерат. Его количество увеличивается, в частности, при снижении напряжения кислорода в кро-ви. Молекула 2, 3-дифос-фоглицерата способна внедряться в центральную часть молекулы гемоглобина, что приводит к снижению сродства гемоглобина к кислороду. Кривая диссоциации смещается вправо. Кислород легче переходит в ткани. 2. Сродство гемоглобина к кислороду снижается при увеличении концентрации Н 4 ' и двуокиси углерода (рис. 152). Кривая диссоциации оксигемоглобина в этих условиях также смещается вправо. 3. Подобным же образом действует на диссоциацию оксигемоглобина повышение температуры. Нетрудно понять, что эти изменения сродства гемоглобина к кислороду имеют важное значение для обеспечения снабжения им тканей. В тканях, в которых процессы обмена веществ протекают интенсивно, концентрация двуокиси углерода и кислых продуктов увеличивается, а температура повышается. Это ведет к усилению диссоциации оксигемоглобина.
Гемоглобин крови плода (HbF) обладает значительно большим сродством к кислороду, чем гемоглобин взрослых (НЬА). Кривая диссоциации HbF по отношению к кривой диссоциации НЬА сдвинута влево.
В волокнах скелетных мышц содержится близкий к гемоглобину миоглобин. Он обладает очень высоким сродством к кислороду.
Количество кислорода в крови. Максимальное количество кислорода, которое может связать кровь при полном насыщении гемоглобина кислородом, называется кислородной емкостью крови. Для ее определения кровь насыщают кислородом воздуха. Кислородная емкость крови зависит от содержания в ней гемоглобина.
Один моль кислорода занимает объем 22,4 л. Грамм-молекула гемоглобина способна присоединить 22 400Х4== 89 600 мл кислорода (4 — число гемов в молекуле гемоглобина). Молекулярная масса гемоглобина — 66 800. Значит, 1 г гемоглобина способен присоединить 89 600:66 800== 1,34 мл кислорода. При содержании в крови 140 г/л гемоглобина кислородная емкость крови будет 1,34-. 140=== 187,6 мл, или около 19 об. % (без учета небольшого количества физически растворенного в плазме кислорода).
В артериальной крови содержание кислорода лишь немного (на 3—4%) ниже кислородной емкости крови. В норме в 1 л артериальной крови содержится 180—200 мл кислорода. При дыхании чистым кислородом его количество в артериальной крови практически соответствует кислородной емкости. По сравнению с дыханием атмосферным воздухом количество переносимого кислорода увеличивается мало (на 3—4%), но при этом возрастают напряжение растворенного кислорода и способность его диффундировать в ткани.
Венозная кровь в состоянии покоя содержит около 120 мл/л кислорода. Таким образом, протекая по тканевым капиллярам, кровь отдает не весь кислород. Часть кислорода, поглощаемая тканями из артериальной крови, называется коэффициентом утилизации кислорода. Для его вычисления делят разность содержания кислорода в артериальной и венозной крови на содержание кислорода в артериальной крови и умножают на 100. Например: (200— 120) :200-100=40%. В покое коэффициент утилизации кислорода колеблется от 30 до 40%. При тяжелой мышечной работе он повышается до 50— 60%.
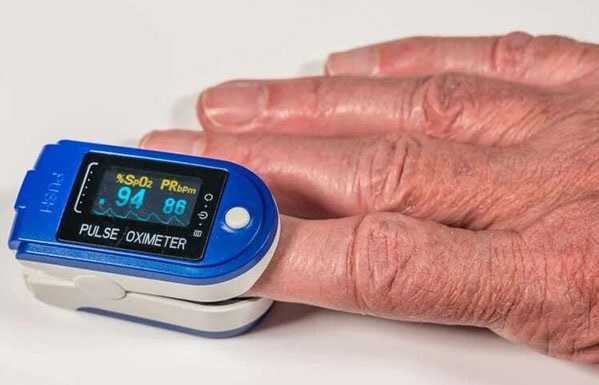
Пульсоксиметрия. Правила измерения.
Кислород для людей жизненно необходим, так как требуется всем органам в процессе жизнедеятельности, а мозг и сердце особенно чувствительны к его недостатку. Нехватка кислорода в организме называется гипоксией.
Попав в легкие во время вдоха, кислород связывается в легочных капиллярах с гемоглобином в эритроцитах. Сердце непрерывно перекачивает кровь по всему телу, чтобы доставить кислород к тканям.
Пульсоксиметри́я (оксигемометрия, гемоксиметрия) — неинвазивный метод определения степени насыщения крови кислородом. В основе метода лежит спектрофотометрический способ определения насыщения крови кислородом.
Основу метода пульсоксиметрии составляют два ключевых физиологических явления:
- Способность гемоглобина в зависимости от его оксигенации в разной степени поглощать свет определенной длины волны при прохождении этого света через участок ткани (оксиметрия).
- Пульсация артерий и артериол в соответствии с ударным объемом сердца (пульсовая волна).
Прибор состоит из датчика, имеющего два светодиода, фотодетектора и микропроцессора. Датчик фиксируется на пальце или мочке уха пациента. При прохождении светового потока через кровь оксигемоглобин интенсивно поглощает инфракрасное излучение, а дезоксигемоглобин - красное. Показатель сатурации отражается на дисплее пульсоксиметра (в норме SpO2 = 95-98 %).
Какие показатели отражает пульсоксиметрия?
Обыкновенные пульсоксиметры, рассчитанные на применение в больницах и домашних условиях, могут регистрировать два основных показателя - сатурация (насыщение) крови кислородом и частоту пульса. Во многих случаях уже эта информация дает общее представление о состоянии пациента,
В условную подготовку пациента к пульсоксиметрии входят следующие рекомендации:
- Не употреблять стимулирующие вещества. Любые стимулирующие вещества (наркотические препараты, кофеин, энергетические напитки) влияют на работу нервной системы и внутренних органов.
- Отказ от курения. Курение непосредственно перед процедурой может повлиять на глубину вдоха, частоту сердцебиения, тонус сосудов. Это изменения повлекут снижение насыщения крови кислородом, которое отразит пульсоксиметрия.
- Отказ от алкоголя. Печень ответственна за выработку многих компонентов крови и ферментов. Таким образом, результат пульсоксиметрии будет несколько искажен.
- Не использовать крема для рук и лак для ногтей. В большинстве случаев датчик пульсоксиметра крепится на палец. Использование различных кремов для рук может повлиять на «прозрачность» кожи. Световые волны, которые должны определить насыщение крови кислородом, могут встретить препятствие, что отразится на результате исследования. Лаки для ногтей (особенно синий и фиолетовый цвета) и вовсе делают палец непроницаемым для света, и прибор не будет работать.
Для получения достоверных результатов при использовании пульсоксиметра нужно придерживаться следующих рекомендаций:
- Правильный выбор места исследования. Желательно проводить пульсоксиметрию в комнате с умеренным освещением. Тогда яркий свет не будет влиять на работу светочувствительных датчиков. Интенсивный свет (особенно красный, синий и других цветов) может существенно исказить результаты исследования.
- Правильное расположение пациента. Основным требованием во время пульсоксиметрии является статичное положение пациента. Желательно проводить процедуру лежа на кушетке с минимальным количеством движений. Быстрые и резкие движения могут привести к смещению датчика, ухудшению его контакта с телом и искажению результата.
- Включение и питание прибора. Некоторые современные пульсоксиметры включаются автоматически после надевания датчика. В других моделях аппарат нужно включить самостоятельно. В любом случае, перед использованием пульсоксиметра, нужно проверить уровень зарядки (для моделей на аккумуляторах или батарейках). Исследование может длиться довольно долго, в зависимости от информации, которую хочет получить врач. Если аппарат разрядится до окончания процедуры, ее придется повторить.
- Прикрепление датчика. Датчик пульсоксиметра крепят на часть тела, указанную в инструкции. В любом случае он должен хорошо держаться, чтобы не упасть случайно при движениях пациента. Также датчик не должен слишком сильно зажимать палец или стягивать запястье.
- Правильная интерпретация результатов. Пульсоксиметр выдает результаты в понятном для пациента виде. Обычно это частота сердечных сокращений и уровень насыщения крови кислородом. Однако грамотно интерпретировать результат может только лечащий врач. Он сопоставляет показатели с результатами других исследований и состоянием пациента.
Техника проведения пульсоксиметрии включает следующие этапы: - пациента «готовят» к процедуре, объясняя, что и как будет происходить;
- на палец, мочку уха или другую часть тела (по необходимости) устанавливают датчик;
- аппарат включают, и начинается, собственно, процесс измерения, который длится не менее 20 - 30 секунд;
- аппарат выводит результат измерений на монитор в удобной для врача или пациента форме.
Попутно пульсоксиметры считывают и частоту сердечных сокращений (ЧСС), регистрируя пульсацию сосудов.
Наиболее часто допускают следующие ошибки при проведении пульсоксиметрии: - наличие лака на ногтях;
- неправильное прикрепление датчика (слабая фиксация, плохой контакт с тканями);
- некоторые заболевания крови (о которых не знали до начала исследования);
- низкая температура тела;
- движения пациента во время исследования;
- использование датчиков неподходящей модели (по возрасту, весу и др.).
На точность измерений могут оказывать отрицательное влияние ряд факторов:
- яркий внешний свет и движения могут нарушать работу прибора;
- неправильное расположение датчика: для трансмиссионных оксиметров необходимо, чтобы обе части датчика находились симметрично относительно просвечиваемого участка ткани, иначе путь между фотодетектором и светодиодами будет неравным, и одна из длин волн будет «перегруженной»;
- значительное снижение перфузии периферических тканей ведет к уменьшению или исчезновению пульсовой волны. В этой ситуации увеличивается ошибка измерения SpO2;
- при значениях SaO2 ниже 70% также возрастает погрешность измерений сатурации методом пульсоксиметрии - SpO2. В связи с этим следует отметить, что в практической работе врача терапевтической специальности вероятность столкнуться со значениями SaO2 ниже 70% у пациента крайне мала;
- анемия требует более высоких уровней кислорода для обеспечения транспорта кислорода. При значениях гемоглобина ниже 50 г/л может отмечаться 100% сатурация крови даже при недостатке кислорода;
- отравление угарным газом (высокие концентрации карбоксигемоглобина могут давать значение сатурации около 100%);
- красители, включая лак для ногтей, могут спровоцировать заниженное значение сатурации;
- сердечные аритмии могут нарушать восприятие пульсоксиметром пульсового сигнала;
- возраст, пол, желтуха и темный цвет кожи не влияют на работу пульсоксиметра.
Требования стандартов по пульсоксиметрии устанавливают основную погрешность измерения сатурации в диапазоне (80. 99)% равную ± 2%, (50. 79)% - ± 3%, для сатурации ниже 50% погрешность обычно не нормируется. Высокая точность пульсоксиметрии для значений сатурации более 80% необходима для надежной дифференциации развития состояния гипоксемии и гипоксии. В этом диапазоне кривая диссоциации гемоглобина имеет малую крутизну (рис.38) и небольшое уменьшение сатурации означает сильное изменение напряжения кислорода в крови, что является предвестником гипоксии. Увеличение допустимой погрешности при низких уровнях оксигенации (менее 80%) является клинически обоснованным, так как в этом диапазоне наибольшей ценностью обладает не абсолютное значение сатурации, а оценка динамики процесса, т.е. изменение сатурации в течение определенного времени.
Требования быстродействия измерений сатурации связаны с тем, что на определенных стадиях ведения наркоза, например, интубации, возможно быстрое развитие эпизодов гипоксемии, которые могут привести к гипоксическим состояниям, чреватым серьезными осложнениями. Реальным требованием анестезиологической практики является длительность процесса измерения и оценки сатурации, составляющая не более 6. 10с.
Основные помехи, влияющие на точность измерения сатурации, имеют электрическую, оптическую и физиологическую природу. - Электрические помехи (“наводки”) возникают в усилительном тракте пульсоксиметра в результате влияния внешних электромагнитных полей, создаваемых, в частности, питающей сетью 50 Гц, электрохирургическим инструментом, физиотерапевтической аппаратурой. Подавление помех осуществляется путем частотной фильтрации сигналов, так как полезная информация в ФПГ сигнале сосредоточена, в основном, в диапазоне до 10 Гц, т.е. значительно ниже частотного диапазона помех. Для этой цели используются аналоговые фильтры нижних частот в усилительном тракте, а также цифровая фильтрация, дающая высокую крутизну спада частотной характеристики фильтров.
- Помехи оптического происхождения возникают в случае попадания света от посторонних источников излучения (от хирургических ламп, ламп дневного света и т.п.) на фотоприемник датчика. Под действием данных помех уровень сигнала, снимаемого с фотоприемника, может изменяться, искажая сигнал, обусловленный абсорбцией излучения светодиодов в тканях. Для подавления оптических помех используют метод трехфазной коммутации светодиодов датчика. В первые две фазы коммутации поочередно включаются либо “красный”, либо “инфракрасный” светодиод датчика, в третьей фазе оба светодиода выключаются и фотоприемник регистрирует фоновую засветку датчика, включающую оптические помехи. Напряжение фоновой засветки запоминается и вычитается из сигналов “красного” и “инфракрасного” каналов, получаемых в первые две фазы коммутации. Таким образом, действие фоновой засветки датчика на полезный сигнал ослабляется.
- Коммутация светодиодов с достаточно высокой частотой (намного превышающей частоты оптических помех) позволяет при выделении сигналов различных каналов в усилительном тракте использовать принципы синхронного детектирования, существенно улучшающие соотношения сигнал/шум. Сильная фоновая засветка датчика может стать причиной возникновения искажений в усилительном тракте, поэтому фотоприемник и первые каскады усиления должны обладать линейностью характеристики в большом динамическом диапазоне входных сигналов. Это необходимо для устранения амплитудных искажений переменной составляющей сигнала и подавления перекрестных помех. Ослабление фоновых засветок достигается также конструктивным построением датчика с использованием оптического экранирования.
- Помехи физиологической природы оказывают наиболее сильное влияние на показания пульсоксиметров. К таким помехам можно отнести влияние двигательных артефактов, в том числе и дыхания, непостоянство формы пульсовой волны и снижение ее амплитуды у различных пациентов. Движение конечности с закрепленным на ней датчиком вызывает, например, перераспределение объема крови, находящегося в поле зрения датчика, что дает на выходе фотоприемника помеховый сигнал. Ослабление указанных помех особенно важно при выделении максимумов артериальных пульсаций фотоплетизмографических сигналов обоих каналов.
Возможные источники погрешностей при пульсоксиметрии - Особенность определения уровня оксигенации крови с помощью пульсоксиметра заключается в том, что, в соответствии с принципом действия прибора, в нем производится измерение величины поглощения света, прошедшего через ткани, содержащие артериальные сосуды, в красном и инфракрасном диапазоне и вычисление R - отношения измеренных величин. Значение сатурации определяется по величине R в соответствии с калибровочной зависимостью, устанавливаемой параллельными градуировочными измерениями функциональной или фракционной сатурации у добровольцев с помощью отбора проб крови и их анализа в кюветном оксиметре.
- Показания пульсоксиметра при определении оксигенации крови у пациентов соответствуют градуировочной сатурации только тогда, когда доля дисгемоглобинов у пациентов и у лиц, участвующих в градуировке прибора, совпадают. В большинстве случаев предполагается, что фракция дисгемоглобинов (СОНb, МеtНb) не превышает 2% и ее долей в определении сатурации можно пренебречь. Однако при колебаниях этой фракции показания пульсоксиметра отличаются от величин SaО2функ или SaО2фр, по которым производилась градуировка прибора. Поэтому для более корректного обозначения показаний пульсоксиметров используется термин SрО2, применяемый большинством изготовителей аппаратуры, который подчеркивает возможность ошибок определения сатурации при возрастании фракции дисгемоглобинов.
- Влияние СОНb на показания сатурации определяются спектром его поглощения (рис.40). На волне 940нм СОНb обладает очень низким поглощением и не вносит вклад в общее поглощение. На волне 660нм СОНb обладает поглощением очень близким к поглощению НвО2. Следовательно, показания пульсоксиметра будут ошибочно завышены по отношению к величине SаО2фр. Это может маскировать опасные для жизни состояния с низким значением фракционной сатурации (например, при присутствии во вдыхаемом газе СО). Так при содержании СОНb - 50% SрО2 оказывается равным 95% / 96 /.
- Фракция МеtНb поглощает больше света на волне 940нм чем Нb, но на волне 660нм имеет почти равное с ним поглощение. Это приводит к завышению SрО2 при низких значениях SaО2фр и к занижению показаний при больших значениях. При высоких концентрациях МеtНb SрО2 приближается к 85% (отношение близко к 1) и не зависит от реальной оксигенации артериальной крови.
- Высокий уровень билирубина не оказывает влияние на поглощение света на используемых длинах волн и не искажает показания пульсоксиметра. Однако для кюветных оксиметров ошибки возникают при более низких длинах волн и могут привести к занижению показаний.
- Фетогемоглобин (НвF), имеющийся у новорожденных в первые несколько месяцев после рождения, и Нb имеют очень близкие характеристики поглощения, совпадающие на волне 940нм и различающиеся на несколько процентов на волне 660нм / 87 /. Это требует небольшого уточнения калибровочной зависимости, используемой в приборах фетального мониторинга / 88 /.
- Красящие вещества, вводимые в кровь, оказывают влияние на показания пульсоксиметров. Метилен голубой дает уменьшение величины SрО2, более значительно влияет введение индигокармина, используемого для измерения сердечного выброса.
- Ошибки в определении состояния пациента по данным SрО2 могут возникнуть из-за маскирования снижения величины РО2, которое может наступить прежде, чем начнется значительное падение SрО2. Это обстоятельство объясняется ходом кривых диссоциации НвО2 (рис.38). При больших сдвигах PО2 (в диапазоне выше 60 мм рт.ст.) наблюдаются небольшие изменения SаО2, но если PО2 становится меньше 60 мм рт.ст., малые изменения PО2 приводят к большим сдвигам SаО2 .Поэтому нижняя граница уровня тревожной сигнализации должна быть установлена равной 94%, что соответствует безопасному значению PО2.
- Ошибки могут возникать при низкой тканевой перфузии или выраженной вазоконстрикции вследствие слабости пульсации в месте расположения датчика прибора. Следует отметить, что при выраженной гемодилюции, анемии и кровопотере высокие показатели SpО2 отнюдь не гарантируют безопасный уровень доставки кислорода к тканям, т.к. общая кислородная емкость крови при этом может оказаться недостаточной.
1.Шурыгин, И.А. Мониторинг дыхания: пульсоксиметрия, капног- рафия, оксиметрия. - СПб.: Невский Диалект; М.: БИНОМ, 2000. - 301 с
2.«Руководство ВОЗ по пульсоксиметрии». Женева, Швейцария. 2009 год. 1- 23;
3.«Базовый курс анестезиолога». Учебное пособие, электронный вариант / под ред. Э. В. Недашковского, В. В. Кузькова. — Архангельск: Северный государственный медицинский университет, 2010 год. 184 — 188.
4. «Стандартизация клинических и неклинических производственных процессов в медицинских организациях, их внедрение и мониторинг» Методические рекомендации, РГП «РЦРЗ», Астана, 2017 год);
5.«Компьютерная пульсоксиметрия. В диагностике нарушений дыхания во сне.» Р.В.Бузунов, И.Л.Иванова, Ю.Н.Кононов, С.Л.Лопухин, Л.Т.Пименов. Учебно-методическое пособие для врачей.
6.Инструкция производителя по эксплуатации прибора «Пульсоксиметр»
Оценка тяжести кровопотери в хирургической практике. Часть I

Оценка тяжести состояния пациента при кровотечениях традиционно и, вполне оправданно с патофизиологических позиций, связывается с определением степени кровопотери. Именно острая, подчас - массивная, кровопотеря выделяет патологические процессы, осложненную геморрагией, из череды нозологических форм острой абдоминальной хирургической патологии, требуя проведения максимально быстрых лечебных мероприятий, направленных на спасение жизни больного. Cтепень нарушений гомеостаза, вызванных геморрагией, и адекватность их коррекции определяет принципиальную возможность, сроки и характер неотложного оперативного вмешательства. Диагностика степени кровопотери и определение индивидуальной стратегии заместительной терапии должны решаться хирургами совместно с врачами-реаниматологам, поскольку именно тяжесть постгеморрагического состояния организма является главным фактором, определяющим все дальнейшие лечебно-диагностические мероприятия. Выбор рациональной тактики лечения является прерогативной хирургов с учетом того, что тяжесть кровопотери служит важнейшим прогностическим признаком возникновения летальных исходов.
Так, летальность среди больных, поступивших в состоянии геморрагического шока в стационар с клинической картиной гастродуоденального кровотечения колеблется от 17, 1 до 28, 5% (Schiller et al. , 1970; C. Sugawa et al. , 1990). Кроме того определение тяжести кровотечения имеет важное прогностическое значение в возникновении рецидива гастродуоденального кровотечения: На Согласительной конференции Института Здоровья США (1989) единодушно признано, что ведущим фактором в возникновении рецидива язвенного гастродуоденального кровотечения является именно величина кровопотери до поступления, по мнению X. Mueller et al. (1994) шок является наиболее информативным признаком в прогнозе рецидива кровотечения и превосходит эндоскопические критерии.
В настоящее время известно более 70 классификаций степени тяжести кровопотери, что само по себе свидетельствует об отсутствии единой концепции в столь актуальном вопросе. На протяжении десятилетий менялись приоритеты в отношении маркеров тяжести кровопотери, что во многом свидетельствует об эволюции взглядов на патогенез постгеморрагических нарушений гомеостаза. Все подходы к оценке тяжести постгеморрагических расстройств, лежащие в основе классификаций тяжести острой кровопотери разделяют на четыре группы: 1) оценка объема циркулирующей крови (ОЦК) и его дефицита по гематологическим параметрам или прямыми методами, 2) инвазивный мониторинг центральной гемодинамики, 3) оценка транспорта кислорода, 4) клиническая оценка тяжести кровопотери.
Оценка объема циркулирующей крови (ОЦК) и его дефицита по гематологическим параметрам или прямыми методами используются для количественной оценки гиповолемии и качества ее коррекции. Многим авторам представлялось особенно важным дифференцированное определение дефицита циркулирующей плазмы и дефицита циркулирующих эритроцитов. При этом на основании дефицита объема циркулирующих эритроцитов (т. н. «истинная анемия») проводилось точное замещение недостающего объема эритроцитов гемотрансфузиями.
А. И. Горбашко (1974, 1982) использовал определение дефицита ОЦК по данным дефицита глобулярного объёма (ГО), выявляемого полиглюкиновым методом, что позволило выделить 3 степени кровопотери:
I степень (легкая) - при дефиците ГО до 20%,
II степень (средняя) - при дефиците ГО от 20 до 30%,
III степень (тяжелая) - при дефиците ГО 30% и более.
Определение глобулярного объёма в свою очередь проводилось по формуле:
ГО = (ОЦП - Ht) / (100-Ht), ОЦП=М х 100/С ,
где М - количество сухого полиглюкина в мг (в 40 мл 6% раствора полиглюкина - 2400 мг сухого вещества), С - концентрация полиглюкина в плазме в мг%, ОЦП - объем циркулирующей плазмы.
П. Г. Брюсов (1997) предлагает свой метод расчета степени кровопотери по дефициту глобулярного объёма в виде формулы:
Vкп=ОЦКд х (ГОд-ГОф) / Год ,
где Vкп - объем кровопотери, ОЦКд - должный ОЦК, Год - глобулярный объем должный, ГОф - глобулярный объем фактический.
Исследование гематокритного числа в динамике позволяет судить о степени постгеморрагической аутогемодилюции, адекватности проведения инфузионной и трансфузионной терапии. Считается, что потеря каждых 500 мл крови сопровождается снижением гематокрита на 5 - 6%, равно как переливание крови пропорционально повышает этот показатель. В качестве одного из быстрых и достоверных методов определения объёма кровопотери на основании показателей гематокрита может быть использован метод Мура (1956):
Объем кровопотери = ОЦКд х ( (Htд - Htф) / Htд,
где Htд - должный гематокрит, Htф-гематокрит фактический.
Тем не менее, абсолютное значение кровопотери и дефицита ОЦК при остром гастродуоденальном кровотечении выявить не удается. Это связано с несколькими факторами. Во-первых, крайне затруднительно установить исходный показатель ОЦК. Формулы теоретического расчета ОЦК по номограммам (Lorenz, Nadler, Allen, Hooper) дают лишь приблизительные значения, не учитывая конституциональных особенностей данного индивида, степени исходной гиповолемии, возрастных изменений ОЦК (у стариков его значение может варьировать в пределах 10-20% от должного). Во-вторых, перераспределение крови с секвестрацией ее на периферии и параллельно развивающаяся гидремическая реакция, а также начатая на догоспитальном этапе и продолжающаяся в стационаре инфузионная терапия делают ОЦК у каждого конкретного больного величиной весьма вариабельной.
Широко известны (но не широко применяемы в клинике) прямые методы определения ОЦК, основанные на принципах: 1) плазменных индикаторов - красителей, альбумина I131, полиглюкина (Gregersen, 1938; Е. Д. Черникова, 1967; В. Н. Липатов, 1969) ; 2) глобулярных индикаторов - эритроцитов, меченых Cr51, Fe59 и другими изотопами (Н. Н. Чернышева, 1962; А. Г. Караванов, 1969) ; 3) плазменного и глобулярного индикаторов одновременно (Н. А. Яицкий, 2002). Теоретически рассчитаны должные показатели ОЦК, объёма циркулирующей плазмы и эритроцитов, созданы номограммы для определения волемии по гематокриту и массе тела (Жизневский Я. А. , 1994). Используемые лабораторные методы определения величины ОЦК или даже более точный метод интегральной реографии, отражают величину ОЦК лишь в данный момент времени, тогда как достоверно установить истинную величину и, соответственно, объем кровопотери не представляется возможным. Поэтому методы оценки ОЦК и его дефицита в абсолютных значениях в настоящее время представляют интерес скорее для экспериментальной, нежели для клинической медицины.
Инвазивный мониторинг центральной гемодинамики. Простейшим методом инвазивной оценки степени гиповолемии является измерение величины центрального венозного давления (ЦВД). ЦВД отражает взаимодействие между венозным возвратом и насосной функцией правого желудочка. Указывая на адекватность наполнения полостей правого сердца, ЦВД косвенно отражает волемию организма. Следует принимать во внимание то, что на величину ЦВД оказывают влияние не только ОЦК, но и венозный тонус, контрактильность желудочков, функция предсердно-желудочковых клапанов, объем проводимой инфузии. Поэтому, строго говоря, показатель ЦВД не равнозначен показателю венозного возврата, но в большинстве случаев коррелирует с ним.
Тем не менее, по величине ЦВД можно получить ориентировочное представление о кровопотере: при уменьшении ОЦК на 10% ЦВД (в норме 2 - 12 мм водн. ст. ) может не измениться; кровопотеря более 20% ОЦК сопровождается снижением ЦВД на 7 мм водн. ст. Для выявления скрытой гиповолемии при нормальном ЦВД используют измерение при вертикальном положении пациента; снижение ЦВД на 4 - 6 мм водн. ст. указывает на факт гиповолемии.
Показателем, с большей степенью объективности отражающем преднагрузку левого желудочка, а значит, и венозный возврат, является давление заклинивания в легочных капиллярах (ДЗЛК), в норме составляющее 10+4 мм рт. ст. Во многих современных публикация ДЗЛК считается отражением волемии и является обязательной составляющей исследования называемого гемодинамического профиля. Измерение ДЗЛК оказывается незаменимым при необходимости высокой скорости заместительной инфузионной терапии на фоне левожелудочковой недостаточности (например, при кровопотере у стариков). Измерение ДЗЛК проводится прямым методом посредством установки в ветвь легочной артерии через центральный венозный доступ и полости правого сердца катетера Swan-Ganz и соединением его с регистрирующей аппаратурой. Катетер Swan-Ganz может быть использован для измерения сердечного выброса (СВ) по методу болюсной термодилюции. Некоторые современные мониторы (Baxter Vigilance) выполняют автоматическое непрерывное измерение сердечного выброса. Ряд катетеров снабжен оксиметрами, что позволяет осуществлять постоянный мониторинг кислородной сатурации смешанной венозной крови. Наряду с этим, катетеризация легочной артерии позволяет рассчитать индексы, отражающие работу миокарда, транспорт и потребление кислорода (Malbrain M. et al. , 2005).
Идея комплексной оценки гемодинамического профиля пациента и конечной цели гемодинамики - кислородного транспорта - нашла свое отражение в так называемом структурном подходе к проблеме шока. Предлагаемый подход основан на анализе показателей, представленных в виде двух групп: «давление / кровоток» - ДЗЛК, сердечный выброс (СВ), общее периферическое сосудистое сопротивление (ОПСС) и «транспорт кислорода» - DO2 (доставка кислорода), VO2 (потребление кислорода), концентрация лактата в сыворотке крови. Показатели первой группы описывают ведущие нарушения центральной гемодинамики в данный момент времени в виде так называемых малых гемодинамических профилей. В случае гиповолемического шока определяющим в нарушении центральной гемодинамики будет снижение наполнения желудочков (низкое ДЗЛК), приводящее к уменьшению СВ, что в свою очередь вызывает вазоконстрикцию и увеличение ОПСС (см. табл. ).
Таблица. Динамика основных показателей инвазивного мониторинга гемодинамики при критических состояниях.
Читайте также:
