Гены синтезирующие антитела. Количество генов участвующих в синтезе иммуноглобулинов
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Антитела могут быть получены к любому возможному антигену, общее количество которых превышает 10 7 . Какие же механизмы обеспечивают появление огромного разнообразия иммуноглобулинов с различной антительной специфичностью? Антитела - это белки, а синтез каждого белка запрограммирован соответствующим геном. Генотип человека составляет около 100 000 генов. Поэтому долгое время вопрос о том, как осуществляется генетический контроль синтеза антител, оставался неясным, так как господствовал принцип: один ген - один белок. В 1965 г. У. Дрейер и Дж. Беннетт высказали предположение о том, что синтез иммуноглобулинов контролирует один для каждого класса С-ген и множество V-генов, расположенных отдельно от С-гена. Эта гипотеза нашла подтверждение в 1977 г. Используя набор рестриктаз, С. Тонегава с сотрудниками установили, что в эмбриональных клетках мышей участки ДНК, кодирующие V- и С-домены легкой цепи ?, находятся на далеком расстоянии друг от друга, а в зрелых клетках - значительно ближе. Клонирование этих генов показало, что в них отсутствуют нуклеотиды для 13 аминокислот. Они были обнаружены на расстоянии в несколько тысяч нуклеотидных пар от остальной части V-гена и получили название J-сегмента. Последний располагается около С-гена. Было установлено, что ген, кодирующий ?-цепь, имеет следующую экзон-интронную структуру: L (область, кодирующая лидерный пептид, необходимый для секреции иммуноглобулинов из клетки) - интрон - V-ген - интрон - J-ген - интрон - С-ген. В ДНК людей обнаружены шесть С-генов для ?-цепи, перед каждым из них имеется свой J-ген. Позднее было показано, что синтез ?-цепи контролируется 300 вариантами V-гена и 4 вариантами J-гена. Рекомбинации этих генов позволяют получить 1200 (300 ? 4) вариантов различающихся по своей специфичности L-цепей.
Организация генов Н-цепи также имеет особенности:
1. Существует 9 разных С-генов, кодирующих С-домены Н-цепей различных изотипов (?1, ?2, ?3, ?4, ?1, ?2, ?, ?, ?).
2. V-гены тяжелой цепи состоят не из двух сегментов, а из трех: V-, D-, J-. D-сегмент (англ. diversity - разнообразие) кодирует от 1 до 9 аминокислотных остатков.
3. Любой из V-генов тяжелой цепи может соединяться с любым из С-генов.
4. Все С-гены, как и V-гены, имеют экзон-интронную структуру. Каждый домен кодируется отдельным экзоном, между последними расположены интроны.
5. В ходе иммунного ответа V-гены тяжелой цепи могут переключаться с С-гена одного класса на С-гены другого класса, что приводит к появлению антител одной и той же антительной специфичности, но принадлежащих к разным классам (IgM, IgG, IgA, IgE, IgD).
В общей сложности синтез Н-цепей иммуноглобулинов контролируют 200 вариантов V-генов, 20 вариантов D-генов, 4 варианта J-генов и 9 вариантов С-генов. Схематически полный ген Н-цепи иммуноглобулинов выглядит таким образом: L-ген - интрон - V-ген - интрон - D-ген - интрон - J-ген - интрон - С-ген.
Организация генов иммуноглобулинов в эмбриональном и соматическом геномах различна. В эмбриональном геноме зародышевые V-гены (как L-цепи, так и Н-цепи) отделены от участков С-генов, D- и J-сегментов многими тысячами пар нуклеотидов. В соматических клетках эти сегменты сближаются, хотя по-прежнему сохраняют экзон-интронную структуру. Сборка V-генов и сближение их с D-, J- и С-генами происходят с помощью особых сигнальных последовательностей, которые расположены на 3'-концах всех зародышевых V-генов и в инвертированном виде - на 5'-концах всех зародышевых J-генов. У D-сегментов сигнальные последовательности располагаются и на 5'-, и на 3'-концах.
Формирование полного гена L-цепи молекулы иммуноглобулина происходит следующим образом. Путем рекомбинации вначале лидерный сегмент с его интроном сливается с одним из V- и с одним из J-генов. Одновременно при этом происходит их сближение с С-геном. Образующийся блок из экзонов и интронов транскрибируется в единую мРНК. После этого все интроны из нее вырезаются и формируется с помощью механизма сплайсинга зрелая мРНК, представленная только генами V, J, C, которая и транслируется в единую цепь.
Благодаря избирательному соединению одного из V-генов с одним из J-генов подавляется выражение остальных V- и J-генов в данной лимфоидной клетке. Таким же образом происходит формирование гена и для Н-цепи, только в нем участвует и D-сегмент. Кроме того, в случае образования Н-цепи имеется дополнительная рекомбинация, с помощью которой происходит переключение синтеза тяжелой цепи одного класса на синтез тяжелой цепи другого класса. Обычно вначале синтезируются иммуноглобулины класса IgM, а затем происходит переключение на синтез иммуноглобулинов класса IgG или других классов.
Таким образом, существует три системы генов иммуноглобулинов: две - для L-цепи (одна - для ?, другая - для ?) и одна - для Н-цепи.
Общее число возможных рекомбинаций для Н-цепей иммуноглобулинов составляет:
Общее же число возможных рекомбинаций для всех иммуноглобулинов составляет:
Точки объединения зародышевых генов строго не фиксированы. Это увеличивает количество возможных вариантов полипептидных цепей, а в том случае, когда они участвуют в формировании активных центров, то и их разнообразия. Кроме того, в период созревания В-лимфоцитов в V-генах происходят точечные соматические мутации, которые окончательно подгоняют структуру активного центра антитела к структуре детерминанта антигена. Считается, что общее количество вариантов антител возрастает за счет неточности сплайсинга и соматических мутаций еще в 100 раз и составляет около 2 млрд:
Таким образом, приобретенный иммунитет может быть обеспечен к любому возбудителю, к любому возможному чужеродному антигену. Решающий вклад в обеспечение многообразия иммуноглобулинов (специфичности антител) вносят следующие факторы:
1) наличие множества зародышевых генов иммуноглобулинов;
2) внутригенные рекомбинации, обусловленные экзон-интронной структурой V-, D-, J-, C-генов;
4. Гены иммуноглобулинов
Прежде всего мы должны рассмотреть, как организованы гены ИГ у будущих лимфоцитов до того, как эти клетки стали отличаться друг от друга, т. е. до того, как образовались разные их клоны. Очевидно, что так же организованы гены ИГ и у всех других клеток организма, у тех, которые дифференцируются в иных направлениях и никогда не станут лимфоцитами.
Гены легких цепей расположены в двух разных хромосомах, а гены тяжелых — в третьей. Каждая из них в диплоидной клетке, естественно, представлена парой гомологичных хромосом. Это в принципе создает возможность для образования в одной клетке не одного, а двух видов легких цепей (каппа- и лямбда-типа), а с учетом возможных различий гомологичных хромосом и пары хромосом с генами тяжелых цепей — восьми видов ИГ. Фактически же в одном лимфоците всегда образуется только один вид ИГ. Это достигается путем так называемого аллельного исключения. Если в ИГ-продуцирующих клетках перестраивается и затем активируется ген легкой цепи каппа в первой хромосоме, то гены легких цепей каппа в гомологичной хромосоме не перестраиваются и не активируются, а как бы исключаются из состава генов данной клетки — родоначальницы клопа. Такое же исключение происходит и во всех потомках этой клетки, т. е. во всем клопе. Если в данном лимфоците активируется ген каппа-цепи в одной из хромосом, то не включаются и оба гена лямбда-цепей в другой паре хромосом. Наоборот, включение одного из лямбда-генов выключает тем самым оба каппа-гена. В итоге из четырех возможных активным в лимфоците остается только один ген легких цепей. Аналогичным образом активируется ген тяжелой цепи только в одной из двух гомологичных хромосом. В другой гомологичной хромосоме аллельный ген тяжелой цепи исключается. Благодаря аллельному исключению достигается то, что в клетках каждого клона работают только два гена ИГ — одной легкой цепи (каппа или лямбда) и одной тяжелой — и каждый лимфоцит продуцирует только один вид антител. Механизм аллельного исключения неизвестен. Он представляет в генетике один из очень немногих примеров такого рода,
«Ген» каждой цепи ИГ представляет собой сложную многокомпонентную систему, располагающуюся вдоль хромосомы на значительное расстояние, в десятки тысяч пар оснований (килобаз). Называть эту систему одним геном было бы так же неверно, как и считать ее десятком или сотней генов. Это именно система, состоящая из множества вариабельных и нескольких константных последовательностей, которые собираются в один ген иммуноглобулина только, в результате довольно сложных преобразований, которые происходят при появлении первых лимфоцитов, еще в эмбриогенезе.
Система гена легких цепей каппа состоит из следующих компонентов (рассматривая их в порядке считывания слева направо). В начале системы (слева) находится большая группа участков ДНК, кодирующих вариабельную часть гена. Каждый из них содержит 291 пару нуклеотидов и кодирует соответственно 97 аминокислот. Всего таких участков около трехсот. Далее (правее) через значительное расстояние (около 2700 пар нуклеотидов) находится группа небольших участков «джей» (их четыре или пять), кодирующих по 13 аминокислот, соединяющих вариабельную и константную части ИГ. Наконец, дальше (еще правее) располагается участок, кодирующий константную часть ИГ.
Во время дифференцировки лимфоцитов в одной из хромосом, несущих систему каппа-гена легких цепей, происходит сближение одного из вариабельных участков (V) с одним из участков «джей» (J) и с участком, кодирующим константную часть гена (С). Пока не до конца ясно, каков конкретный механизм сближения: это может быть делеция, т. е. выбрасывание части ДНК так, что одна из F-последовательностей оказывается рядом с одним из J. Ho может быть это и транспозиция, т. е. перенос одной из V к одному из J. Важно то, что процесс этот случаен и рядом с любой из V (их 300) может оказаться любая из J (их 4). В итоге создаются комбинации, общее возможное число которых нетрудно подсчитать: 300 ? 4 = 1200. Это число и означает количество теоретически возможных вариантов каппа-гена легких цепей. В лямбда-генах такой принципиальной перестройки не происходит, но самих этих генов у мыши 20 и если в лимфоците образуется легкая лямбда-цепь, то одна из двадцати возможных.
Приблизительно так же, как и каппа-ген, устроена и система гена тяжелых цепей. Различия состоят в том, что число вариабельных участков там меньше-(около 120), но зато между ними и «джей» находится еще 20 вариантов элемента D. Кроме того, в систему гена тяжелой цепи входит не один, а несколько константных участков, от которых, однако, антиген-узнающая специфичность антител не зависит. При случайном сближении элементов V, J и D (путем делеции ДНК между ними или путем их транспозиции) теоретически возможно следующее количество вариантов: 120V ? 20D ? 4J = 9600.
В итоге в лимфоците случайным образом создаются два гена — для легких и для тяжелых цепей. Так как в молекуле ИГ (антитела) свойства центра связывания антигена определяются вариабельными частями и легкой и тяжелой цепей совместно, то в принципе число вариантов строения такого центра равно числу возможных сочетаний и превышает десять миллионов: 1200 ? 9600 = 11,5 ? 10 8 . Действительно ли число возможных вариантов так велико, как это представляется из этих расчетов, точно пока неизвестно. Полагают, что оно несколько меньше.
Механизм делений, или транспозиций, также неизвестен, но подобный процесс определенно происходит, так как еще в первых работах Тонегавы было показано, что строение гена ИГ в лимфоците отличается от строения этого участка в ДНК недифференцированной или иначе дифференцированной клетки. Пока это единственный известный случай, когда в ходе дифференцировки происходит непременная, хотя и случайная перестройка генома. Что же касается деталей и точных механизмов такой перестройки, то на них сейчас обращено внимание стольких квалифицированных исследователей, что решение проблемы — это вопрос только времени.
Выше мы говорили, что система гена тяжелых цепей содержит не один, а несколько константных частей. Действительно, по ходу дифферепцировки лимфоцита в нем происходит смена этих частей. Сначала в состав гена входит только ближайшая константная часть и синтезируется антитело класса М, которое располагается на поверхности лимфоцита и является как бы выставкой, образцом его продукции. Если антиген окажется комплементарным этому образцу, то их соединение стимулирует лимфоцит к размножению и синтезу антител следующего класса (используется следующая константная часть класса G). Эти антитела уже секретируются в кровь и создают иммунитет.
Так, в результате преобразований в относительно небольшой части генома создается более миллиона различных клонов лимфоцитов, способных создавать иммунитет практически против любого антигена, случайно или искусственно попавшего в организм. Количество этих клонов намного превышает общее число генов. Оно, конечно, никак не могло быть получено «обычным путем», т. е. за счет наличия в геноме многих различных генов иммуноглобулинов и включения одного из них. Перестройка генов для образования разных антител — еще один пример того, что эволюция способна создавать такие «чудеса», которые не может предугадать ничья фантазия. Биологический смысл появления в эволюции подобного механизма очевиден — создание большого и случайного разнообразия за счет относительно небольшого участка ДНК.
Можно ли ожидать, что механизм, подобный этому, встретится и в других дифференцировках? Подобный механизм может оказаться целесообразным только там, где существенна не определенность, а разнообразие, даже случайное. Может быть, мы встретимся с чем-то подобным при изучении связей между отдельными нервными клетками мозга. А может быть, нечто похожее происходит при образовании пятнистой окраски, там, где положение пятен должно быть случайным. А может быть, перестройка генетической системы синтеза ИГ — это уникальный механизм и мы не встретим его больше нигде.
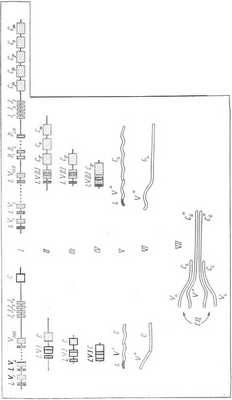
Схема образования молекулы иммуноглобулина (ИГ)
Системы генов легких (слева) и тяжелых (справа) цепей ИГ расположены в разных хромосомах и состоят из отделенных друг от друга участков ДНК, кодирующих разные части молекулы ИГ: L — лидерную последовательность, V — вариабельные части ИГ, D — участок ИГ, увеличивающий разнообразие V-части тяжелых цепей, J — соединительную часть и С — константные части молекулы ИГ (в тяжелых цепях их несколько классов). В эмбриональных клетках-предшественниках лимфоцитов ДНК содержит много генов для V-участков ИГ (для легких каппа-цепей их 300, для тяжелых цепей их 120), несколько последовательностей для D-участков (около 20) и четыре-пять последовательностей для J-участков (I). При дифференцировке (созревании) лимфоцитов происходит перемещение и исключение генетического материала, в результате чего создаются гены ИГ зрелых лимфоцитов (II). В них оказываются сближенными по одному из V-, D- и J-генов и ген константной части (С). Выбор V-, D-, J-участков при соэревании лимфоцитов происходит случайно. В результате создается один составной ген ИГ. При экспрессии генов ИГ в зрелом лимфоците транскрибируются пре-мРНК (III), которые теряют некодирующие белок интроны и становятся молекулами мРНК (IV). С них транслируются легкие и тяжелые полипептиды — пре-ИГ (V), содержащие на одном конце лидерную последовательность аминокислот, необходимую для прохождения полипептида через мембраны. После процессинга пре-ИГ образуются готовые субъединицы ИГ (VI), которые собираются в молекулу ИГ, состоящую ив двух одинаковых легких и двух одинаковых тяжелых субъединиц (VII). При созревании одного эмбрионального предшественника лимфоцитов (I ? II) возникает уникальное сочетание V-и J-участков легких цепей и V-, D- и J-участков тяжелых цепей. Эта клетка дает начало клону лимфоцитов, синтезирующих только один вид ИГ, отличающийся от ИГ лимфоцитов других клонов. СЦ — специальные центры, образованные между вариабельными частями легких и тяжелых цепей ИГ, в которых происходит связывание ИГ с антигеном
Что такое иммуноглобулины и зачем они нужны
зложена на разныеЧеловеческий иммунитет - это сложная многоступенчатая система защиты организма от вредоносного воздействия извне (вирусов, бактерий, аллергенов, грибков). Не существует одного органа, который бы отвечал за иммунную защиту. Эта функция возложена на разные органы иммунной системы: начиная с лимфатических узлов до кишечника и заканчивая белковыми веществами - иммуноглобулинами.
Общая характеристика иммуноглобулинов
Иммуноглобулины (Ig), или антитела, представляют собой гликопротеины, имеющие в своем составе центры специфического нековалентного связывания антигена, основанного на принципе комплементарности. Существуют растворимые формы иммуноглобулинов, которые и называют антителами, и мембранные формы иммуноглобулинов, составляющие основу В-клеточных рецепторов на поверхности В-лимфоцитов. Иммуноглобулины содержатся в крови и в некоторых секреторных жидкостях и вырабатываются как ответ на контакт с антигенами, например, бактериями или вирусами. Иногда иммуноглобулины продуцируются после контакта с собственными тканями организма, называемыми аутоантигенами.
Дефицит или избыток антител может быть признаком различных патологий, поэтому определение их количества в крови является важной частью при диагностике многих заболеваний. Кроме того, современные достижения в биомедицине позволяют использовать синтетические антитела в лечении некоторых заболеваний.
Структура антител
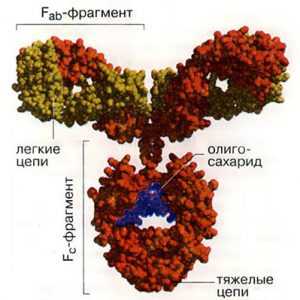
Иммуноглобулины - это симметричные Y-образные молекулы, состоящие из двух тяжелых длинных (Н) и двух коротких легких (L). цепей, которые соединены друг с другом либо дисульфидными (SS), либо водородными связями. Каждая молекула иммуноглобулина содержит не менее двух идентичных Н-цепей. Тяжелые цепи иммуноглобулинов разных классов состоят из четырех или пяти доменов и обозначаются буквами греческого алфавита соответственно латинской аббревиатуре класса. Принадлежность антитела к конкретному классу и подклассу называют изотипом, который обозначается по типу тяжелой цепи.
Легкие цепи построены из двух доменов. В их составе обязательно находится два вида доменов - вариабельный (V - variable) и константный (С-coпstaпt). Иммуноглобулины, продуцируемые разными клонами плазматических клеток, имеют разные по аминокислотной последовательности вариабельные домены. Константные домены сходны или очень близки для каждого изотипа иммуноглобулина. Вариабельные домены являются N-концевыми. В составе легкой цепи N-концевой домен является вариабельным (VL), С-концевой домен - константным (CL). Тяжелые цепи имеют один вариабельный (N-концевой) домен (Vн) и несколько константных доменов. Легкие и тяжелые цепи иммуноглобулинов гликозилированы.
Иными словами, каждое антитело подходит к антигену по принципу ключа и замка, а при соединении образуют иммунные комплексы. Но также антитела способны проявлять гибкость чужеродных агентов, благодаря чему с легкостью адаптироваться к различным антигенам. Однако эта способность иммуноглобулинов иногда провоцирует у человека перекрестные аллергические реакции - когда иммунитет человека с аллергией не может различать аллергены. Например, человек с аллергией на цветочную пыльцу вследствие “ошибки” иммуноглобулинов может также реагировать на сырые фрукты и овощи.
Разновидности иммуноглобулинов
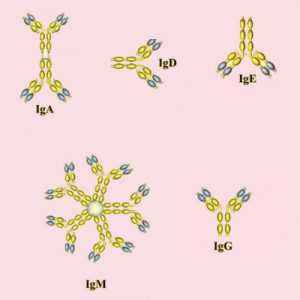
В человеческом организме иммуноглобулины представлены в двух формах:
- растворимые (продуцируются плазматическими клетками);
- связанные с наружной мембраной B-лимфоцитов, они же - рецепторные антитела.
Кроме того, существуют разные классы и подклассы (изотопы) иммуноглобулинов. Они различаются по своим биологическим особенностям, структуре и нацеленности на «мишени». На основе различий в структуре тяжелых цепей было выделено несколько классов антител. Каждый из них отличается функциями и ответными реакциями.
Кроме основных классов иммуноглобулинов существует несколько подклассов. Разница между ними основана на незначительных отличиях в типе тяжелых цепей каждого класса. В человеческом организме встречаются 4 подкласса антител. Нумерация соответствует порядку уменьшения их концентрации в сыворотке. Так, антитела IgG и IgA дополнительно группируют на подклассы IgG1, IgG2, IgG3, IgG4, а также IgA1 и IgA2.
Большинство антител (IgG, IgD, IgE) в организме представлены в форме мономера (одной молекулы). Исключение составляет антитела класса А, которые также встречается в форме димера, и IgМ, образующий форму снежинки (пентамер).
Характеристика разных классов иммуноглобулинов
Класс IgA
Около 15% антител, содержащихся в организме здорового человека, это иммуноглобулины класса IgA, которые разделяются на два подкласса IgA - IgA1 и IgA2. Они различаются молекулярной массой тяжелых цепей и концентрацией в сыворотке, где IgA представлен в основном как мономер, с молекулярной массой 160 кДа. В секреторных жидкостях иммуноглобулины присутствуют в виде димера, образованных двумя мономерами, их содержание составляет 10-15% от общего количества сывороточных иммуноглобулинов. Димерные иммуноглобулины присутствуют в большинстве секреторных жидкостей, включая слизистые оболочки дыхательных и мочеполовых путей, ЖКТ, а также слюну, слезы, молозиво и молоко у женщин. Поскольку IgA присутствует на слизистых оболочках пищеварительной системы, где он может подвергаться воздействию ферментов, в его составе есть специальный компонент, который защищает молекулу от преждевременного разрушения.
Иммуноглобулины класса A, как правило, не являются специфическими с точки зрения «подстраивания» под специфический антиген. Обычно антитела из этой группы присутствуют в уязвимых местах организма или на участках, где микробы могут легко проникнуть внутрь. Иммуноглобулины класса A обеспечивают местный гуморальный иммунитет. Это связано с их свойствами предотвращать проникновение патогенов через эпителиальные поверхности, благодаря присутствию IgA в секрете слизистых оболочек (слюна, слезы) он защищает организм от некоторых локальных инфекций.
Основная функция иммуноглобулинов этого класса состоит не в разрушении антигенов, а в предотвращении проникновения инфекционных агентов в систему кровообращения. Сами по себе IgA не способны самостоятельно разрушать бактерии, поэтому они всегда работают вместе с лизоцимами - ферментами, которые также присутствуют в секреторных жидкостях и могут разрушать бактерии.
Нарушения концентрации иммуноглобулинов класса IgA в организме способствуют его восприимчивости к инфекционным заболеваниям дыхательных путей и мочеполовой системы, в том числе нефропатии. Лица, с недостаточностью IgA, более склонны к аутоиммунным расстройствам, таким как ревматоидный артрит, волчанка, аллергия и астма.
К снижению содержания IgA могут привести разные заболевания, среди которых - гонорея. Бактерии, вызывающие гонорею, продуцируют фермент, который расщепляет IgA на две части: Fc и Fab фрагменты. Что интересно, Fab все еще может находить опасные для организма бактерии, но без взаимодействия с Fc он не способен противостоять им.
Класс IgD
Иммуноглобулины класса D в организме человека представлены в очень маленьком количестве и составляют примерно 0,2% от всех антител. Известно, что IgD прикрепляется к поверхности некоторых В-лимфоцитов как рецептор В-клеток. Тем не менее его функции в человеческом организме на сегодня до конца еще не изучены. Предполагается, что именно IgD является причиной аллергии на пенициллин, а также он может участвовать в запуске аутоиммунных реакций.
Класс IgE
Иммуноглобулин IgE в норме составляет не более 0.1% от общего количества сывороточных иммуноглобулинов. Более 90% синтезируемого плазматическими клетками IgE секретируется в слизистых экзосекретах желудочно-кишечного тракта. Биологическая функция заключается в защите от внеклеточных паразитов, хотя она полностью не выяснена, и резкое увеличение количества IgE является патогенетическим признаком при аллергических реакциях.
Иммуноглобулины этой группы связываются с поверхностью базофилов и тучных клеток. Дальше к ним присоединяется антиген, что в свою очередь ведет к выбросу в кровоток вазоактивных аминов и развитию IgE-зависимой аллергической реакции по следующему механизму.
Различные антигены, такие как пыльца, ядовитые вещества, споры грибов, пылевые клещи или перхоть домашних животных связываются с IgE и запускают высвобождение гепарина, гистамина, протеолитических ферментов, лейкотриенов и цитокинов. Это ведет к расширению сосудов и повышению их проницаемости, что способствует проникновению чужеродных агентов в капилляры, а затем и в ближайшие ткани, вследствие чего развиваются характерные для аллергической реакции симптомы. Однако, большинство типичных аллергических реакций в виде чихания, кашля, слезотечения и повышенного выделения слизи способствует выведению из организма оставшихся аллергенов.
Исследования показали, что такие расстройства, как астма, ринит, экзема, крапивница и дерматит вызывают повышение уровня IgE. Антитела Е-типа также активно продуцируются в ответ на присутствие в организме гельминтов, персистирующих инфекций (герпесвирусы, атипичные микроорганизмы) и некоторых членистоногих (например, вшей). Кроме того, IgE играет косвенную роль в иммунном ответе, стимулируя другие иммунные компоненты. Также он может защищать поверхности слизистых оболочек, вызывая, в случае опасности, воспалительные реакции.
Патологически низкий уровень антител класса IgE может возникать на фоне редкого генетического заболевания, сопровождающегося нарушением координации мышц (атаксия телеангиэктазия).
Класс IgG
Иммуноглобулины класса G являются доминирующими в человеческом организме. На их долю приходится 75% всех антител. Частично это связано с длительным периодом полураспада: от 7 до 23 дней (зависимо от подкласса). Кроме того, они могут сохраняться в крови в течение нескольких десятков лет после контакта с антигеном.
Существуют 4 подкласса IgG:
- IgG1 составляет от 60 до 65% от общего количества иммуноглобулина этого класса. Его дефицит обычно является признаком гипогаммаглобулинемии (дефицит плазматических клеток).
- IgG2 - второй по распространенности изотоп, составляет 20-25% от общего количества IgG. «Взрослые» концентрации антитела обычно появляются к 6-7-летнему возрасту. Дефицит IgG2 связывают с рецидивирующими инфекциями дыхательных путей.
- IgG3 занимает от 5 до 10% от общего IgG. Играет основную роль в иммунных реакциях против белковых или полипептидных антигенов.
- IgG4 составляет до 4% в общей доле IgG. Раньше IgG4 связывали только с пищевой аллергией, но недавние исследования показали, что повышение IgG4 в сыворотке отмечается у пациентов, страдающих склерозирующим панкреатитом, холангитом и интерстициальной пневмонией. Тем не менее точная роль IgG4 до сих пор неизвестна.
IgG играет ключевую роль в гуморальном иммунном ответе. Это основной иммуноглобулин, содержащийся в крови, а также в лимфатической, спинномозговой и брюшной жидкостях. Способность оставаться в организме в течение длительного времени делает его наиболее полезным антителом для пассивной иммунизации. Это единственное антитело, способное проникать через плаценту матери и попадать в кровообращение плода, обеспечивая послеродовую защиту новорожденного в течение первых месяцев его жизни.
Главные функции IgG:
- усиление фагоцитоза в макрофагах и нейтрофилах;
- нейтрализация токсинов;
- инактивация вирусов;
- уничтожение бактерий.
Класс IgM
IgM - это самый важный представитель семейства человеческих иммуноглобулинов, хотя он и отличается весьма коротким периодом полураспада - около 5 дней.
Иммуноглобулины класса IgM в общей доле сывороточных антител в человеческом организме составляют примерно 10-13%. Они участвуют в первичных иммунных реакциях и обладает выраженной антибактериальной активностью, способностью связывать комплемент, не проникают через плацентарный барьер. Первыми синтезируются в ответ на антигенную стимуляцию организма. Наиболее ранние антитела относятся к иммуноглобулинам класса М, что нередко используется в диагностике инфекционных заболеваний. Они же первыми появляются в процессе онтогенеза и филогенеза.
Повышение уровня IgM можно расценивать как признак недавно перенесенной инфекции или присутствия в организме антигена. На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора.
Роль иммуноглобулинов в организме
Антитела являются частью гуморального иммунного ответа и действуют очень специфично, так как всегда направлены против определенного антигена.
Задача любого антитела в организме человека - участвовать в иммунных реакциях. Иммуноглобулины обладают способностью образовывать иммунные комплексы с молекулами антигена, активировать систему комплемента (комплекс белков, содержащихся в крови, необходимых для защиты организма от чужеродных агентов) и вызывать воспаления. Все эти действия направлены на нейтрализацию антигена и безопасное удаление его из организма.
Вследствие различных структурных свойств разные классы антител могут выполнять специализированные функции:
- нейтрализовать паразитов (IgE);
- нейтрализовать микроорганизмы (IgM, IgG);
- защищать от повторных заболеваний, таких как эпидемический паротит (IgG);
- защищать слизистые оболочки (IgA);
- участвовать в синтезе лимфоцитов (IgD);
- защищать плод (IgG) и новорожденного малыша (IgA).
Антитела и иммунологическая память
Иммунный ответ делится на первичный и вторичный. Первичный ответ проявляется во время первого контакта с антигеном, после чего организм сначала вырабатывает иммуноглобулины класса IgM, которые затем замещаются более специфическими и стабильными антителами IgG.
Вторичный иммунный ответ возникает при повторном контакте с тем же антигеном. Он интенсивнее первичного, концентрация антител достигает более высоких уровней, чем в первый раз.
Такой эффект обусловлен иммунологической памятью, которая опосредована В-имфоцитами. Это долгоживущие клетки которые вступают в контакт с антигеном, начинают очень интенсивно делиться и продуцировать специфические антитела.
Как определяется количество антител
Антитела составляют от 12% до 18% сывороточных белков. Количества отдельных белковых фракций, в лабораторных условиях определяется на основании протеинограмм.
Тест на антитела методом иммуноферментного анализа (ИФА), как правило, проводится с венозной кровью (позволяет определить количество иммуноглобулинов класса IgM, IgG, IgE, IgA). Кроме того, определить количество антитела класса IgA можно путем биохимического исследования слюны или кала человека - методом полимеразной цепной реакции (ПЦР). В отдельных ситуациях тест может быть проведен с использованием другого материала, например спинномозговой жидкости.
Если в крови пациента диагностировано критическое повышение некоторых иммуноглобулинов, говорят о гипергаммаглобулинемии. Как правило, у таких пациентов чрезмерно повышаются антитела класса IgM, при этом остальные остаются в дефиците.
На фоне патологического повышения некоторых антител могут развиваться разные заболевания, в том числе:
- острые и хронические воспаления;
- паразитарные, бактериальные, вирусные или грибковые заболевания;
- аутоиммунные болезни;
- цирроз печени;
- саркоидоз; .
Патологически низкое количество антител в сыворотке может возникать на фоне:
- врожденных генетически расстройств;
- приема некоторых противомалярийных, цитостатических, глюкокортикоидных препаратов;
- недоедания;
- инфекции, в том числе ВИЧ;
- онкологических заболеваний;
- нефротического синдрома;
- обширных ожогов;
- тяжелой диареи.
Иммуноглобулины и вакцинация
Антитела играют ключевую роль в развитии иммунитета после вакцинации. В результате контакта с антигеном, содержащимся в вакцине, иммунная система вырабатывает антитела. Сначала менее стойкий и специфический IgM, а затем более стойкий IgG. Например, во время вакцинации против вируса гепатита В, вакцину вводят трижды с определенным интервалом между прививками. Это позволяет создать стойкий иммунитет к болезни. Эффективность такой вакцинации определяется изменением в организме количества антител IgG.
Антитела в медицине
Благодаря развитию биохимии, молекулярной биологии и медицины, в наше время стало возможным синтезировать иммуноглобулины в лабораторных условиях (как правило, антитела класса IgG). Такие антитела называются моноклональными, так как они происходят из клона одной клетки и работают против определенного антигена.
Сегодня моноклональные иммуноглобулины используют для лечения разных заболеваний. Впервые эта методика была применена в 1981 году для лечения лимфомы. А уже в 1984 году изобретатели моноклональных антигенов - немецкий биолог Георг Келер и британский иммунолог Сезар Мильштейн - получили Нобелевскую премию.
В современной медицине моноклональные антитела применяют для:
- уничтожения раковых клеток;
- ингибирования отдельных клеток иммунной системы после трансплантации органов (позволяет предотвратить отторжение пересаженного органа);
- подавления иммунных реакций при аутоиммунных заболеваниях.
Иммунный ответ на каждый отдельный антиген включает продукцию множества молекул антител, синтезируемых разными плазматическими клетками, и имеющих разное строение активного центра и изотип. Вследствие различий в строении активных центров образующиеся антитела имеют различную специфичность и аффинность.
Специальность: врач педиатр, инфекционист, аллерголог-иммунолог .
86.Генетика иммуноглобулинов.
Гены иммуноглобулинов являются аутосомными кодоминантными, а тяжёлые и лёгкие цепи находятся под независимым генетическим контролем. Иммуноглобулины кодируются тремя несцепленными генетическими системами. Первая группа кодирует синтез тяжёлых цепей (H), вторая группа - синтез лёгких х-цепей, а третья группа - синтез лёгких гамма-цепей. Вариабельная область тяжёлых цепей (Vн) кодируется одной группой локусов, а константная область этих цепей (Сн) - другой.
Аллотипы иммуноглобулинов. У человека, кроликов , мышей и крыс изучено большое число аллотипов иммуноглобулинов. Аллотипы - это внутривидовые антигенные детерминанты, присутствующие на иммуноглобулинах. Кроме фллотипов, имеется две группы антигенных детерминант иммуноглобулинов: изотипы и идиотипы. Изотипы - это антигенная специфичность, общая для всех особей одного вида.
Пять классов иммуноглобулинов (А,М,G,E,D) являются изотипами. Идиотипы - это антигенные различия между антителами, принадлежащими к одному классу, субклассу и аллотипу у отдельных особей. Идиотипы одной особи опрелеляются клонами клеток, вырабатывающими иммуноглобулины. Следует обратить внимание на то,что аллели групп а, х,у, вариабельной области тяжёлой цепи кодируются разными тесно сцепленными локусами. Три группы фллотипов (у,х,а) Vн-областей и пять групп аллотипов (n,d,e,f,g) Сн-областей наследуется аллогруппами (группами сцепления). Молекула иммуноглобулина имеет только один (из двух) тип лёгких цепей (или х,или гамма). Между Vн- и Сн-генами, а также между Сн-генами с небольшой частотой происходит кроссинговер. Одна плазматическая клетка вырабатывает антитела одной специфичности. В гетерозиготных плазматических клетках работет один из двух аллельных генов Vн- и Сн-цепей и один ген лёгкой цепи, т.е. имеет место аллельное исключение. Несмотря на экспрессию одного из аллелей, в потомстве можно наблюдать любые комбинации материнских и отцовских аллотипов. В связи с огромным количеством антителопродуцирующих клеток и их потомства (клонов) наблюдается большое разнообразие специфичностей антител.
Взаимодействие генов Vн- и Сн-областей. При синтезе одной цепи иммуноглобулина взаимодействуют:
2)V-гены,определяющие аллотипическое детерминанты
3)V-гены, определяющие гипервариабельные участки и идиотипы.
Согласно теории двух генов, на С- и V-генах транскрибируется одна мРНК, определяющая одну полипептидную цепь иммуноглобулина. По теории взаимодействия генов, много генов V-области , в результате чего образуется мРНК, а потом - одна полипептидная цепь. Объединение генетической информации, содержащейся в V- и С-генах, происходит на уровне ДНК.
Происхождение разнообразия антител. С позиции теории гаметных генов можно объяснить разнообразии антител:
1)почти все вариабельные области цепей иммуноглобулина закодированы генами , содержащимеся в гаметах. Возникает большое количество и соматических вариантов V-областей.
2)в процессе эволиции благодаря точковым мутациям, делециям и вставкам возникают различия между V-генами.
3)давление отбора стабилизирует множественное семейство V-генов.
4)одним из основных механизмов сохранения множества V-генов является неравный кроссинговер между сестринскими хроматидами.
Генетика иммуноглобулинов
Гены иммуноглобулинов аутосомны, кодоминантны. Структурное разнообразие иммуноглобулинов определяется последовательностью аминокислот.
В биологии существовал принцип «один ген — одна полипептидная цепь», а также утверждалась неизменность генома в онтогенезе организма. Однако в случае Ig видно, что несколько генов кодируют одну полипептидную цепь.
Иммуноглобулины контролируются тремя семействами генов, расположенными в разных хромосомах. Одно семейство кодирует синтез всех классов тяжелых цепей (Н), другое — синтез легких к-цепей, третье — синтез легких Х-цепей.
У мыши вариабельная область легкой Х-цепи кодируется двумя V-генами, а константная область — четырьмя С-генами (рис. 50). V- и С-гены называются также V- и С-сегментами. Перед каждым С-геном находится короткий отрезок ДНК, который называется J-сегментом. Любой V-ген может соединиться с любой парой J-сегмент — С-ген. Следовательно, легкая Х.-цега> кодируется сегментами'V, J, С. В эмбриональном геноме эти
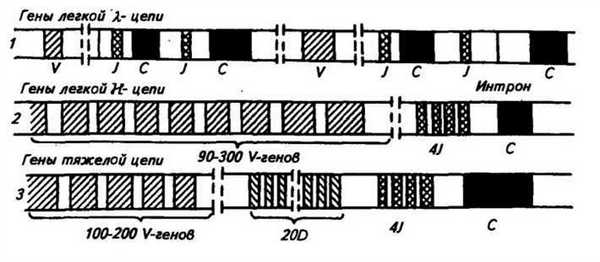
Рис. 50. Гены Ig мыши (1 — легкая А.-цепь; 2 — легкая к-цепь; 3 — тяжелая цепь; V—ген (сегмент); J—сегмент; D—сегмент; С—геп (сегмент)
сегменты удалены друг от друга, а в зрелых лимфоцитах в результате соматической рекомбинации они сближаются.
Для легкой к-цепи имеется несколько сот V-генов, четыре J-сегмента и один С-ген (см. рис. 50). В зрелом лимфоците Х.-цепь кодируется сегментами V, J и С (по одному из многих сегментов. V и J).
Для тяжелых цепей всех типов существует 100—500 V-генов, 20 D-сегментов, 4 J-сегмента и несколько тесно сцепленных С-генов. В плазматической клетке тяжелая цепь кодируется сегментами V, D, J, С (см. рис. 50).
Сбор генов Ig осуществляется в два этапа. В результате соматической рекомбинации соединяются V- и J-сегменты легкой цепи или V-, D- и J-сегменты тяжелой цепи. Часть V- и J-cer-ментов при этом выбрасывается. Затем происходит транскрипция, образуется пре-иРНК. При сплайсинге про-иРНК (удаляются интроны и соединяются экзоны) вырезаются интроны и V-, J-, С-сегменты располагаются рядом. В цитоплазме происходит трансляция и образуется легкая к-цепь (рис. 51). Такой же процесс осуществляется и при образовании тяжелых цепей Ig. При иммунном ответе предшественники зрелых лимфоцитов сначала образуют филогенетически самый древний IgM, а потом в лимфоцитах происходит переключение на синтез Ig других классов.
Аллотшгы иммуноглобулинов. Это генетически детерминированные варианты белков (в данном случае иммуноглобулинов), по которым особи внутри вида отличаются друг от друга. Алло-типы представляют отдельные варианты генов иммуноглобулинов и обусловливают их генетический полиморфизм. Каждая молекула иммуноглобулина имеет не один, а несколько аллоти-пических детерминант (или аллотипинеских маркеров). Из сель-
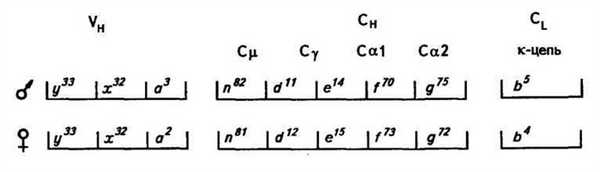
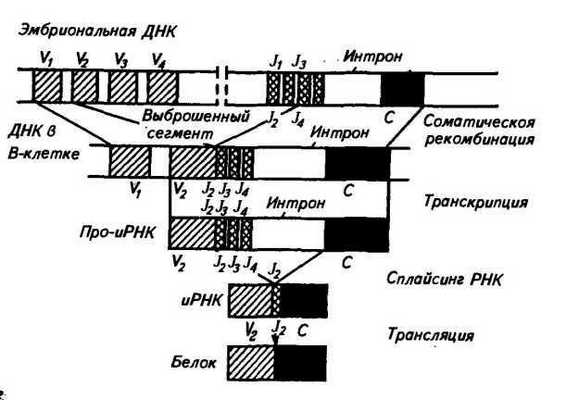
Рис. 51. Сборка гена иммуноглобулина из отдельных фрагментов на примере легких к-цепей (но Тонегава, 1985)
скохоэяйственных животных наиболее изучены аллотипы кролика (табл. 35).
35. Аллотипы иммуноглобулинов кролика (по Кульбергу, 1985)
С-область, у-цепи (Fc-
участок молекулы Ig)
f69, f70, f71, f72, f73
Msl, Ms2, Ms4, Ms5, Ms6 n81, n82
С-область, ц-цепи Тоже
Аллотипические детерминанты, указывающие аллотипичёскую группу (локус), обозначают буквой (a, b, e и т. д.), а аллели — цифрой (a 1 , Ь*, е 14 и т. д.)- При написании фенотипа аллотипы разных групп отделяют косой чертой, например а2аЗ/е14е15/Ь5, а генотип обозначают а^е^е 15 ^ 5 .
Имеется еще две группы антигенных детерминант иммуноглобулинов: изотипы и идиотипы.
Изотипы — это антигенная специфичность, общая для всех особей одного вида. Пять классов иммуноглобулинов (А, М, С, Е, D) являются изотипами.
Идиотипы — это антигенные различия между антителами, принадлежащими к одному классу, субклассу и аллотипу у отдельных особей. Идиотипы одной особи определяются клонами клеток, синтезирующими антитела.
В зависимости от числа замен различают простые и сложные (комплексные) аллотипы. Простые аллотипы возникают при замене одной, двух аминокислот, сложные аллотипы — при замене многих аминокислот. Например, комплексные Ь4 и Ъ9 аллотипы константного района к-цепи различаются по 35 % аминокислот.
Гены каждого вида цепи тесно сцеплены, поэтому их аллель-ные варианты наследуются как единое целое, т. е. аллогруппами (гаплотипами, группами сцепления). Например, три группы аллоти- г пов кролика (у, х, а) Ун-области и пять групп аллотипов (л, d, e, f, g) Сн-области наследуются аллогруппами. Ниже показаны алло-группы кролика, унаследованные потомками от отца и матери*.
Известно, что в молекуле иммуноглобулина или только к-цепь, или только Х,-цепь сочетается с любым типом тяжелых цепей. В одной плазматической клетке вырабатываются антитела одной 'Специфичности. В гетерозиготных плазматических клетках работает только один из двух аллельных генов Vh- и Сн-цепей и один •ген из двух легкой цепи — аллельное исключение (рис. 52). Поэтому фенотип клетки может не полностью соответствовать ее генотипу, несмотря на кодоминантное наследование. Однако в связи с наличием большого числа плазматических клеток в организме встречаются все типы антител в соответствии с его генотипом и любые комбинации материнских и отцовских аллотипов.
Разнообразие антител. Одна из главных и интересных проблем иммунологии — это объяснение природы происхождения громадного разнообразия антител. Ведь организмы в течение жизни могут встречаться с десятками тысяч антигенов и должны отличать «чужеродные» агенты от «своих». Но существует ли тогда
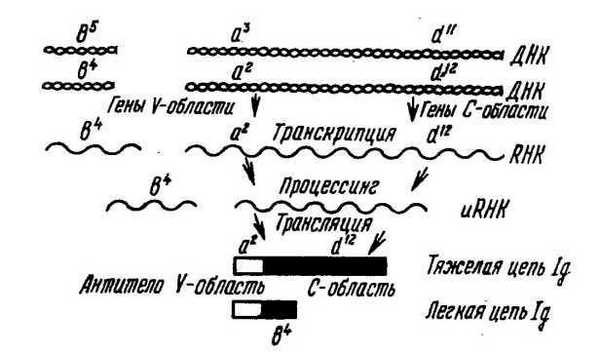
Рис. 52. Схема синтеза плазматической клеткой тяжелых и легких целей иммуноглобулина. Гепотип клетки — (tif/d u d' 2 /b\b 5 , фешггип клетки — о 7 /? 2 /** — пример алделыюго исключения; д\ а\ d l \ d l \ * 4 , Ь ь — аллотяпы иммуноглобулина кролика
огромное количество генов антител, передающихся из поколения в поколение?
Установлено, что разнообразие антител может быть обеспечено следующими факторами:
наличием ограниченного числа гаметных генов;
сборкой и экспрессией генов в соматических клетках из ограниченного набора зародышевых сегментов;
неточностью аппарата сплайсинга РНК, когда соединяются сегменты V, D и J;
соматическими гипермутациями генов антител.
Вам уже известно (см. рис. 50), что набор зародышевых генов для к-, Х-цепей и тяжелой цепи не столь велик: от 2 до 300 V-сегментов, 4 J-сегмента, около 20 D-сегментов и 1—4 С-сег-мента.
Количество вариантов сборки гена иммуноглобулина, например, легкой к-цепи равно произведению чисел V- и J—сегментов. Соединение V-, D- и J-сегментов может произойти более 10 тыс. способами. Таким образом, число вариантов формирования активного центра Ig (паратопа) участками легкой и тяжелой цепи превышает 10 млн.
Разнообразие антител может возникать вследствие нарушения соединения V-, D- и J-сегментов, а также вклинивания лишних нуклеотидов уже не в ДНК, а при сплайсинге про-иРНК. В результате образуется несколько измененная иРНК и при трансляции изменяется последовательность аминокислот в иммуноглобулине.
Значительный источник разнообразия антител — это повышенная частота соматических мутаций в вариабельных доменах, особенно в гипервариабельных районах. Показано, что в V-райо-не Ig происходит три мутации на 30 делений В-лимфоцитов, т. е. на несколько порядков превышает обычную частоту мутаций. Предполагают наличие в В-клетках специальных ферментов, усиливающих темп мутирования.
Таким образом, при наличии различных вариантов сборки зародышевых генов, неточности соединения сегментов, вставок пар нуклеотидов и соматических мутаций может возникнуть более 1 млрд типов антител.
Читайте также:
