Гептрал в лечении гепатитов В и С у гематологических больных - эффективность
Добавил пользователь Alex Обновлено: 22.01.2026
Печень представляет собой центральный орган химического гомеостаза, где создается единый обменный и энергетический пул для метаболизма жиров и углеводов, кроме того, печень участвует в синтезе некоторых ферментов, витаминов, принимает непосредственное участие в водном, минеральном и пигментном обмене; чрезвычайно важное значение имеет детоксицирующая функция печени.
- КЛЮЧЕВЫЕ СЛОВА: холестаз, анамнез, гепатит, холангит, зуд, гепатомегалия, спленомегалия, асцит, Гептрал
Круг патологических состояний печени очень велик, и большинство этих изменений могут сопровождаться нарушением любой из перечисленных функций печени или многими с тем или иным преобладанием.
Образование желчи является одной из важнейших функций печени. Любые нарушения синтеза, секреции или тока желчи, приводящие к биохимическим, патофизиологическим, патологоанатомическим изменениям, сопровождающимся теми или иными клиническими проявлениями, обозначаются термином «холестаз», который классифицируют на 2 группы: внутрипеченочный и внепеченочный. Внепеченочный холестаз обусловлен механическим препятствием в протоковой системе, а внутрипеченочный - нарушением функции гепатоцита или нарушением тока желчи в межклеточном пространстве. В свою очередь внутрипеченочный холестаз классифицируют на две подгруппы: печеночно-канальцевый (внутридольковый) и протоковый (междольковый). Различные типы холестаза в значительной степени перекрываются между собой. Накопление желчных кислот внутри клеток печени может в конечном итоге вести к их гибели, т.е. возникает порочный круг, в котором внутрипеченочный холестаз, вызванный различными типами повреждений печени, в свою очередь усугубляет эти нарушения (1).
Гептрал (адеметионин) - S - аденозил - L - метеонин - аминокислота, которая синтезируется в организме и участвует в ферментативном переаминировании и пересульфировании, синтезе и активации гормонов, нейромедиаторов, нуклеиновых кислот, фосфолипидов. Отдавая метильную группу при переметилировании и пересульфировании, адеметионин способствует образованию глутатиона - основного клеточного антиокислителя, обезвреживающего воздействие ряда экзо- и эндотоксинов.
В медицинской практике используется в двух формах: инъекционной, состоящей из 1 флакона с лиофилизированной солью адеметионина и 1 ампулы растворителя, который делает вводимую среду нейтральной (рН 7,5 ± 1). Форма Гептрала для перорального применения представляет собой белые таблетки в энтеросолюбильной оболочке, нерастворимой в кислой среде желудка. Адеметионин является универсальным соединением, участвующим в трех важных метаболических реакциях: трансметилировании, транссульфировании и аминопропилировании (синтез полиаминов), где служит либо донором групп, либо модулятором ферментов. Активная роль адеметионина в этих реакциях обусловлена наличием положительного заряда на атоме серы, благодаря чему происходит разрыв серо-углеродных связей.
Независимо от патогенеза внутрипеченочного холестаза, адеметионин играет важную роль как в развитии так и в предотвращении внутрипеченочного холестаза. Адеметионин является донором метильной группы, участвуя в реакциях трансметилирования (это биосинтез фосфолипидов, которые являются основными строительными блоками клеточной мембраны). Количество фосфолипидов определяет «текучесть» клеточной мембраны. Показано, что «текучесть» клеточной мембраны является важнейшим фактором, влияющим на связанные с мембраной ферментативные процессы. Структура и состав мембран гепатоцитов является ключевым звеном в регуляции наиболее важных метаболических путей, участвующих в выработке желчи (Chawla et al, 1990 г.).
Снижение «текучести» мембраны ведет к уменьшению активности Na/K - АТФазного насоса и нарушению натрий-зависимых синтранспортных систем (имеющих прямое отношение к транспорту желчных кислот). Адеметионин способен предотвращать подобные изменения.
Вторым положительным аспектом влияния адеметионина является его участие в поддержании на достаточном уровне глутатиона - серосодержащего пептида, имеющего отношение к защите печеночной клетки от токсического повреждения свободными радикалами. Наконец, участвуя в реакциях сульфатирования, адеметионин играет важную роль в детоксикации ряда метаболитов, таких как токсичные желчные кислоты, переводя их в сульфаты, которые не оказывают повреждающего действия на клетку. Предыдущие два эффекта имеют прямое отношение к защите печени от токсического эффекта этанола, который реализуется через ацетальдегид. Эти эффекты предотвращаются адеметионином, посредством поддержания митохондриального транспорта глутатиона.
Клиническое изучение эффективности Гептрала у больных, страдающих заболеваниями печени с внутрипеченочным холестазом, было начато в 90-е годы прошлого века. Так, Frezza et al (1990 г.) провели лечение адеметионином 220 больных с патологией печени, доказанной биопсией (внутрипеченочным холестазом). Необходимым условием лечения было, по крайней мере, двукратное повышение общего и конъюгированного билирубина и щелочной фосфатазы в сыворотке крови. Больные получали либо 1600 мг препарата внутрь, либо плацебо. Продолжительность лечения составила 15 дней. При этом была доказана эффективность Гептрала как в отношении клинических проявлений, так и лабораторных показателей холестаза (по сравнению с плацебо). В 1992 году Manzillo и соавт. у 420 больных провели лечение в 2 этапа (первый - 800 мг в день внутривенно 2 недели, затем - 1600 мг в день или плацебо в течение 8 недель). Они подтвердили еще больший эффект при увеличении продолжительности лечения (он составил 68%). Таким образом, было показано, что у больных с хроническими заболеваниями печени более продолжительное лечение сопряжено с дальнейшим улучшением биохимических показателей печени. В дальнейшем была подтверждена эффективность адеметионина у женщин с внутрипеченочным холестазом при беременности (Frezza M., Terpin, 1992 г.), у больных с депрессией (Rozenbaum, 1990 г.), у больных с хроническим панкреатитом - для того, чтобы ингибировать активность свободных радикалов (Bilton et al, 1994 г.); при остром панкреатите (Braganza et al, 1995 г.) - для снижения окислительного стресса. Рассматриваются и другие возможности использования Гептрала (профилактика поражений печени при парентеральном питании, при гипоксических состояниях, при операциях трансплантации печени). Оценка эффективности Гептрала у разных групп больных (алкогольное поражение, вирусное, в стадии цирроза печени, в дистрофической стадии с печеночно-клеточной недостаточностью). Рассматривались различные дозы препарата, разные пути введения, разная продолжительность лечения (500 мг, 800 мг, 1600 мг). Все исследования сравнивали с плацебо и эффект Гептрала составлял 60% и выше, пероральный прием усиливал эффект парентерального введения (продолжительность лечения составляла от 2 недель до месяца и более (Lieber C.S., 1999; Di Perri T. et al, 1999 г.; Mato J.M., 1999 г.). Переносимость Гептрала оценивалась всеми исследователями как хорошая. Побочные эффекты в виде кратковременной бессонницы, тошноты, потливости, легкого флебита при двойном слепом исследовании отмечены у очень небольшого количества больных и не отличались от группы плацебо.
Учитывая вышеизложенное, мы также оценили эффективность применения Гептрала у 60 больных с хроническими заболеваниями печени и синдромом холестаза на основании своего клинического опыта.
Характеристика больных:
- первичный билиарный цирроз - 8 больных;
- алкогольный гепатит - 22 больных;
- хронический гепатит С - 20 больных;
- хронический гепатит В - 4 больных;
- хронический вирусный гепатит в стадии цирроза печени - 4 больных;
- первичный склерозирующий холангит - 2 больных.
Мужчин было 38, женщин - 22; возраст - от 30 до 65 лет (средний возраст 43,4 ± 1,7 года); средняя продолжительность заболевания 5,7 ± 3 года (минимально - 3 года, максимально - 12 лет). Больные с алкогольным поражением печени длительное время (от 15 до 17 лет) употребляли алкоголь с частотой от 2 до 7 раз в неделю; ежедневно доза алкоголя в пересчете на этанол составляла от 60 до 200 мл. Критериями включения в эту группу служили: диффузный характер поражения печени, «алкогольный» анамнез, системность поражения, отсутствие маркеров вирусов гепатита В и С.
Методы исследования:
- клиническая оценка (желтуха, кожный зуд, астенический синдром, гепатомегалия, спленомегалия, асцит);
- биохимический мониторинг (АлАТ, АсАТ, билирубин, холестерин, γ ГТП, ЩФ, белок и белковые фракции, креатинин - исходно и по окончании курса лечения);
- ультразвуковой мониторинг и оценка денситометрических показателей, размеров печени и селезенки, диаметра селезеночной вены, измерения «столба затухания» с отключением автоматического усиления сигнала по глубине;
- маркеры вирусов гепатита В и С (анти HCV; HbsAg; HbeAg; HBcAg; HCV - РНК; HBV - ДНК);
- рутинные лабораторные исследования (общий анализ крови, мочи);
- больным циррозом печени проводили ЭГДС с оценкой степени варикозно-расширенных вен пищевода и «коронарных» вен желудка.
Гептрал назначался в дозе 800 мг внутривенно, медленно - в течение 14 дней с последующим переходом на пероральный прием в дозе 1600 мг в сутки (разделенных на 2 приема) - на протяжении 14 дней.
У 10 больных с недостаточным эффектом терапии (сохраняющийся холестаз и кожный зуд) врачом индивидуально было принято решение о продолжении лечения Гептралом в суточной дозе 3200 мг (по 1600 мг х 2 приема) - на протяжении 2 недель. Данное решение принималось врачом в случае, если были серьезные основания считать, что возможная польза увеличения дозы превосходит риск.
Клинический опыт использования дозы 3200 мг позволял оценить лечебный эффект, переносимость дозы, целесообразность и возможности использования высокой дозы.
Клинические проявления заболевания в зависимости от нозологической формы и их динамика под влиянием терапии Гептралом представлены в таблице.
В числителе представлены исходные данные, в знаменателе - эффективность терапии.
10 больных с сохраняющимся кожным зудом, желтухой, астенией продолжили лечение Гептралом в суточной дозе 3200 мг (по 1600 мг ´ 2 раза в день) еще 2 недели. При этом были купированы клинические синдромы и продолжено улучшение лабораторных показателей.
Разрешения асцита удалось добиться у всех больных - у 4 с циррозом печени потребовалось введения в комплекс лечения верошпирона и мочегонных.
У 10 больных заметной динамики лабораторных признаков холестаза отмечено не было, а клинические синдромы только уменьшились в интенсивности. У этой группы больных доза Гептрала была повышена до 3200 мг/сутки еще на протяжении 14 дней (по 1600 мг ´ 2 раза в день).
Практически у всех больных это лечение сопровождалось дальнейшим улучшением или нормализацией клинических проявлений и положительной динамикой лабораторных показателей (особенно билирубина, который на исходных дозах положительной динамики не показал).
Побочных эффектов у больных, получавших Гептрал в дозе 3200 мг в сутки, отмечено не было, переносимость препарата была хорошей.
Общее заключение
- Гептрал является эффективным препаратом в лечении больных, страдающих хроническими воспалительными заболеваниями печени с холестазом.
- Эффект зависит от использованной дозы и продолжительности лечения.
- Доза Гептрала 3200 мг/сутки в течение 2 недель лечения, как показал наш клинический опыт, возможно, является альтернативой рекомендуемому 4-недельному двухфазному курсу.
- Препарат максимально эффективен при алкогольном поражении печени.
Переносимость обоих форм препарата хорошая, побочных эффектов не наблюдалось.
Гептрал в лечении гепатитов В и С у гематологических больных - эффективность
ОПЫТ ПРИМЕНЕНИЯ ГЕПТРАЛА У РЕБЕНКА С ХРОНИЧЕСКИМ ГЕПАТИТОМ С И ЦИРРОЗОМ ПЕЧЕНИ
Л ечение вирусных гепатитов остается во многом нерешенной проблемой. В последние годы при различных заболеваниях печени, в том числе при хронических гепатитах и циррозах, применяется препарат гептрал. Этому биологическому веществу, встречающемуся во всех тканях и жидких средах организма, принадлежит важнейшая роль в процессах транссульфурирования (промежуточный продукт) и трансметилирования (донор метильной группы) .
Применение препарата при холестазах, вызванных эстрогенами, представляется особенно перспективным в связи с упорными холестазами у подростков в пубертатном периоде. Опыт применения препарата у детей почти отсутствует. В связи с этим представляет интерес наше наблюдение. Больной В., 13 лет, находится под нашим наблюдением в течение 2 лет с диагнозом хронического гепатита С, цирроза печени .
Раннее развитие ребенка без особенностей. С 4 летнего возраста отмечено увеличение печени, в последние 3 года - частые носовые кровотечения, периодически - боли в животе, рвота после приема жирной пищи, запоры .
В сентябре 1993 г. появилась иктеричность кожи и склер, отмечались потемнение мочи, осветление стула, боли в животе; мальчик поступил в стационар с диагнозом вирусного гепатита. При поступлении обращали на себя внимание значительная иктеричность кожи, множественные сосудистые звездочки на лице, туловище и конечностях, пальмарная эритема, выраженный гепатолиенальный синдром (печень пальпировалась на 5 Заболевание приняло непрерывно рецидивирующее течение с обострениями, сопровождавшимися явлениями печеночной энцефалопатии, выраженными симптомами холестаза (повышение уровня билирубинадо 120 мкмоль/л), высокой активностью трансаминаз [повышение активности АлАТдо 1750 нмоль/(с · л)], снижением протромбинового индекса до 47% .
Лечение: дезинтоксикационная инфузионная терапия, рекомбинантный a 2 -интерферон по 1 млн ME в сутки 3 раза неделю в течение 18 мес. В связи с упорным синдромом холестаза в лечение включен препарат урсофальк в дозе 10 мг на 1 кг массы тела в сутки в течение 7 мес .
Клинико-лабараторные показатели эффективности лечения гептралом больного B., 13 лет, с хроническим гепатитом и циррозом печени.
Однако проводимая терапия приводила лишь к кратковременному улучшению клиниколабораторных показателей, причем явления холестаза сохранялись, а активность трансаминаз оставалась стабильно высокой .
Гептрал был назначен в начальной дозе 400 мг в сутки внутривенно, внутримышечно, затем перорально. При попытке увеличения дозы до 800 мг/сут наблюдались побочные реакции в виде повышения температуры, озноба, болей в суставах, которые купировались приемом антипиретиков .
После 3-месячного курса лечения гептралом у ребенка впервые отмечены нормализация уровня билирубина (со 102 до 23 мкмоль/л), значительное снижение активности трансаминаз [с 1780 до 500 нмоль/(с · л)], уменьшение выраженности симптомов хронической печеночной энцефалопатии, гинекомастии .
Результаты лечения представлены на рисунке .
см ниже реберной дуги, селезенка - на 3 см) при значительной плотности органов. Отмечались явления гиперэстрогении (двусторонняя гинекомастия) .
Данные биохимического анализа крови: общий билирубин 102 мкмоль/л, прямой - 74,5 мкмоль/л, непрямой - 27,5 мкмоль/л, АлАТ-1680 нмоль/(с · л) .
Многократные исследования посредством иммуноферментного анализа (ИФА) на HBsAg, анти-НВс lgM и суммарные, НВеАд, анти-НВе, анти-HBs, анти-HDV дали отрицательный результат. В апреле 1994 г. обнаружены анти-HBV. С помощью полимеразной цепной реакции выявлена РНК HCV .
При пункционной биопсии печени обнаружены воспалительные, склеротические, атрофические изменения паренхимы, характеризующиеся обильной лимфогистиоцитарной инфильтрацией портальных трактов и печеночных долек, обширным разрастанием соединительной ткани в перипортальных отделах с врастанием в дольки, формированием множества ложных долек .
А.Р. Рейзис, ведущий научный сотрудник, доктор мед. наук; Т.С.
Никитина, ст. научн. сотрудник, канд. мед. наук;
А.К. Дрондина, старший научн. сотрудник, канд. мед. наук, ЦНИИ эпидемиологии ГК СЭН РФ;
Н.П. Ананьева, врачординатор отделения вирусных гепатитов Детской инфекционной больницы № 5, Москва
Примечание .
Статья была направлена на рецензию независимым голландским экспертам и получила положительный отзыв .
Адеметионин занимает важное место в лечении алкогольной болезни печени (АБП), оказывая детоксицирующий, антиоксидантный, холеретический, цитопротективный (гепатопротективный), антифибротический и нейропротективный (антидепрессивный) лечебные эффекты. Представлены результаты исследования по оценке эффективности и безопасности препарата Гептор (таблетки адеметионина) производства ЗАО "Верофарм", Россия в сочетании с парентеральной формой адеметионина (препарат Гептрал производства фирмы "Кнолль", Германия) у 60 больных АБП (хронический гепатит или цирроз печени) в сравнении с монотерапией препаратом Гептрал (лиофилизат + таблетки). Восемнадцатидневные курсы лечения таблетками Гептор и Гептрал продемонстрировали сходные результаты по времени развития положительного эффекта и степени воздействия на биохимическую активность заболевания. Профиль безопасности Гептора (таблетки) сходен с таковым Гептрала (таблетки). Таким образом, Гептор (таблетки адеметионина) может быть рекомендован для лечения больных АБП на стадии хронического гепатита и цирроза печени.
Алкогольная болезнь печени и клиническое значение адеметионина
Злоупотребление алкоголем является важнейшей социальной и медицинской проблемой. В развитых странах 60 % мужчин, злоупотребляющих алкоголем, умирают в возрасте до 50 лет. В России регистрируется один из самых высоких уровней потребления алкоголя в мире (более 10 млн
больных хроническим алкоголизмом). Алкоголизм находится на третьем месте среди причин смертности у мужчин в России. Примерно у 30 % больных хроническим алкоголизмом в результате повреждающего токсического действия этанола развивается алкогольная болезнь печени (АБП), при этом уровень смертности от цирроза печени (ЦП) прямо коррелирует с таковым употребления алкоголя.АБП - хроническое, прогрессирующее воспалительно-дегенеративноепоражение печени, развивающеесяв результате токсического воздействия этанола при длительном егоупотреблении в значительных дозах.Безопасной дозой этанола, по данным ВОЗ, принято считать ежедневное употребление 30-60 г для мужчини 20-40 г для женщин, критическимуровнем - 60-120 г и 40-80 г соответственно.
Клинически АБП проявляется тремя основными формами (стадиями): стеатозом, стеатогепатитом и ЦП. Факторами, определяющими высокий риск развития АБП, являются опасные дозы алкоголя; характер и длительность злоупотребления им; генетический полиморфизм ферментов, метаболизирующих этанол; пол (у женщин склонность к развитию и прогрессированию АБП выше); применение лекарственных препаратов, метаболизирующихся в печени; инфекция гепатотропными вирусами, иммунные нарушения; дефицит пищевых веществ вследствие неполноценного питания. Отмечается нуклонный ростзаболеваемости АБП. Так, по данным ЦНИИГ, рост заболеваемости данной патологией с 2005 по 2008 г. составил 10 %.
Повреждающее действие главного метаболита алкоголя ацетальдегида обусловлено непосредственным цитотоксическим влиянием последнего, что сопровождается истощением запасов глутатиона, продукцией супероксида и усилением процессов перекисного окисления липидов, ведущими к повреждению клеточных мембран и избыточному синтезу коллагена. Доказано, что окислительный стресс представляет собой одно из основных звеньев патогенеза АБП. Хроническое употребление этанола сопровождается повышением активности цитохрома CYP2E1. Индукции цитохрома способствуют также накапливающиеся в гепатоцитах жирные кислоты и кетоновые тела. Высокая активность цитохрома приводит к нарастанию образования из этанола токсичного ацетальдегида и свободных радикалов. Индукция CYP2E1 при АБП наблюдается не только в гепатоцитах, но и в клетках Купфера, что способствует их активации и высвобождению провоспалительных цитокинов, включая фактор некроза опухоли α(ФНО-α). Повреждение тканей цитокинами активирует процессы репарации - образование коллагена и стимуляцию фиброгенеза при активном участии трансформирующего факторароста. Высокие концентрации провоспалительных цитокинов (ФНО-α иинтерлейкин-6) прямо коррелируют с такими клиническими проявлениями заболевания, как резкая потеря веса, фиброз и гипергаммаглобулинемия, внутрипеченочный холестаз (ВПХ) вследствие угнетения гепатоцеллюлярного образования желчи. В клинической картине АБП преобладают неспецифические проявления, такие как астенический синдром (слабость, повышенная утомляемость, нарушение сна), диспепсический синдром (метеоризм, тошнота, нарушения стула, тяжесть в правом подреберье), болевой синдром (тупые боли в правом подреберье). Гепатомегалия различной степени определяется у 75 % пациентов. Изменения биохимических показателей характеризуются прежде всего наличием цитолитического синдрома: повышение активности аланиновой (АЛТ) и аспарагиновой (АСТ) трансаминаз. Более чем у половины больных в различной степени повышается уровень γ-глутамилтранспептидазы (ГГТП), у части пациентов повышен уровень щелочной фосфатазы (ЩФ). По данным ЦНИИГ, у 80,6 % больных АБП выявлено повышение уровня сывороточных желчных кислот (47,5 ± 12,2мкмоль/л) с преобладанием являющейся наиболее токсичной литохолевой кислоты. Синдром ВПХ утяжеляет течение и ухудшает прогноз АБП, о чем свидетельствуют прямые корреляции (ЦНИИГ, 2008) между уровнем холемии, степенью выраженности клинических симптомов (слабость, тяжесть в правом подреберье), показателями функционального состоянияпечени (билирубинемия) при АБП.По данным ЦНИИГ, синдром ВПХ развивается у 21,6 % больных с АБП. По мере формирования ЦП развиваются и симптомы портальной гипертензии: варикозное расширение вен пищевода, отечно-асцитический синдром, энцефалопатия.
Целью лечения больных АБП является предотвращение формирования фиброза печени и ЦП, улучшение качества жизни. Непосредственные задачи лечения - нормализация биохимических показателей крови, устранение болевого, диспепсического и астенодепрессивного синдромов. Лечение АБП включает прежде всего полный отказ от употребления алкоголя. Необходимо полноценное питание с энергетической ценностью рациона не менее 1 г белка на 1 кг веса (не менее 2000 ккал/сут). Медикаментозная терапия включает применение гепатопротекторов (пре-
паратов, избирательно улучшающих работу печеночных клеток), кортикостероидов (у больных с тяжелой формой острого алкогольного гепатита). В обязательном порядке проводится лечение ассоциированных состояний - хронического холецистита, панкреатита. В случае развития осложнений в виде портальной гипертензии, отечно-асцитического синдрома, энцефалопатии проводится соответствующая коррекция нарушений.
Исходя из патогенеза АБП, очевидно, что для успешного лечения даннойкатегории больных большое значениеимеет отсутствие дефицита биологически активных соединений, играющихважную роль во всех метаболическихпроцессах организма. К таким веществам относится прежде всего адеметионин. Это химически чрезвычайно активное вещество содержится во всехтканях и средах организма, синтезируется преимущественно в печени (до8 г/сут) из аденозина и метионина с участием S-аденозилметионинсинтетазы. Биологическое действие адеметионина обусловлено участием его в трехважнейших биохимических реакцияхорганизма.
Одна из этих реакций - трансметилирование, с помощью которой осуществляется синтез белков, гормонов,нуклеиновых кислот, фосфолипидов,нейромедиаторов. Результатом данной реакции являются восстановление текучести и поляризации клеточной мембраны, обеспечение молекулярного транспорта, нормализация деления и дифференцировки клеток, восстановление активности ферментных систем, регуляция синтезажелчи.
Вторая реакция - аминопропилирование, необходима для синтеза полиаминов, таких как путресцин, спермидин, спермин. Эти активные вещества нужны для формирования структурырибосом, пролиферации гепатоцитов,регенерации печени и нервной ткани, восстановления синаптической передачи.
Третья реакция, в которой участвует адеметионин, - транссульфурирование. В результате этой реакции осуществляется синтез цистеина - предшественника глутатиона, таурина,сульфатов, коэнзима-А. В свою очередь глутатион незаменим для осуществления печенью антиоксидантной и детоксикационной функций. Таурин увеличивает растворимостьжелчных кислот и снижает их токсичность. Уменьшению токсичностигидрофобных токсичных желчныхкислот способствует также сульфатирование. Участвуя в цикле Кребса,коэнзим А необходим для восстановления энергетического потенциалаклетки. С помощью реакции транссульфурирования осуществляетсятакже синтез стероидов, мукополисахаридов, ацетилхолина и желчныхкислот.
Таким образом, адеметионин имеет детоксицирующий, антиоксидантный,холеретический, цитопротективный(гепатопротективный), антифибротический и нейропротективный (антидепрессивный) лечебные эффекты.При повышенном потребленииадеметионина (например, при воздействии алкоголя, лекарств, наркотиков) и/или нарушении синтеза(снижение активности) ферментовS-аденозилметионинсинтетазы иметионинаденозилтрансферазы возникает его дефицит, что приводитк нарушению детоксикационной и антиоксидантной функций печени, а также к нарушению регенерации гепатоцитов. В таких ситуациях вводимыйизвне адеметионин восполняет егодефицит и стимулирует его выработкув организме, прежде всего в печени и мозге.
Клинические исследования свидетельствуют о том, что использованиеадеметионина в лечении АБП повышает уровень глутатиона в ткани печени, а также положительно влияет на выживаемость пациентов (особенно при тяжелых формах болезни).У больных алкогольным ЦП классов Аи В (по классификации Чайлд-Пью)применение адеметионина приводитк снижению летальности с 29 до 12 %(Mato J.M. и сооавт. 1999). Сочетаниегепатотропного и антидепрессивногодействий адеметионина делает наиболее оптимальным его применение убольных с алкогольным поражениемпечени, в т. ч. при наличии депрессии и абстинентного синдрома.
Целью нашего исследования являлась оценка эффективности и безопасности препарата Гептор (таблетки адеметионина) производства ОАО“Верофарм”, Россия, в сочетании с парентеральной формой адеметионина (препарат Гептрал производствафирмы “Кнолль”, Германия) у больных АБП в сравнении с монотерапиейпрепаратом Гептрал (лиофилизат + таблетки).
Материал и методы
В исследовании приняли участие 60 пациентов с АБП на стадии стеатогепатита и ЦП печени с индексом Мэддрея, вычисляемым как (4,6 × [разность между протромбиновымвременем у больного и в контроле] +сывороточный билирубин в мкмоль/л) менее 32, рандомизированных в двегруппы.
АБП верифицировали с помощью специальных опросников CAGE и ВОЗ. В течение 10 дней группа А получала 800 мг адеметионина внутривенно (Гептрал-лиофилизат) ежедневно, затем в течение 18 дней 1600 мг адеметионина (Гептор-таблетки) внутрь в2 приема между приемами пищи.
Группа В в течение 10 дней получала 800 мг адеметионина внутривенно (Гептрал-лиофилизат) ежедневно,затем в течение 18 дней 1600 мг адеметионина (Гептрал-таблетки) внутрь в 2 приема между приемами пищи.Длительность курса лечения составила28 дней. В период терапии больные не употребляли алкогольные напитки. В качестве критериев эффективности лечения оценивали динамикувыраженности клинических проявлений в баллах по шкале от “0” (отсутствие симптома) до “3” (симптомсильно выражен). Проводился мониторинг биохимической активностизаболевания по динамике основныхбиохимических параметров: уровней АСТ, АЛТ, ЩФ, ГГТП, билирубина. В процессе исследованияфиксировались все нежелательныеявления.
Результаты
Пациенты, включенные в исследование, не различались в группах пополу, возрасту, длительности алкогольного анамнеза и существования АБП (табл. 1).
Таблица 1. Характеристика пациентов, включенных в исследование (n = 60).
В группах больных также не отмечено существенных различий в клинической симптоматике и клинико-
биохимической активности заболевания (табл. 2, 3)
Таблица 2. Клиническая симптоматика больных, включенных в исследование (n = 60).
Таблица 3. Биохимические показатели больных, включенных в исследование (n = 60).
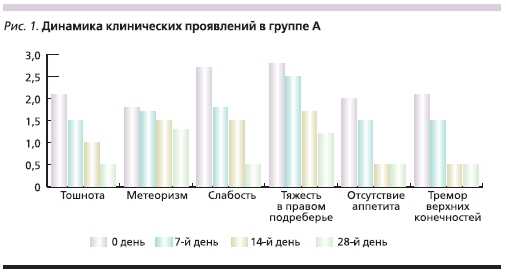
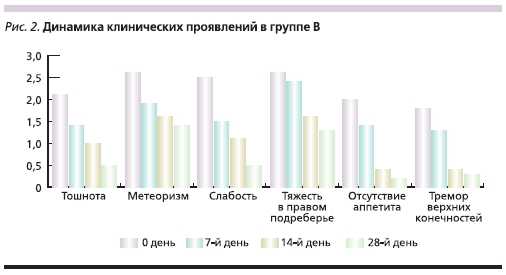
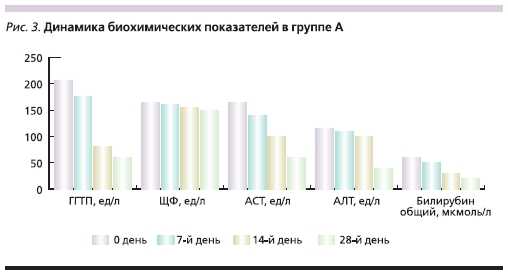
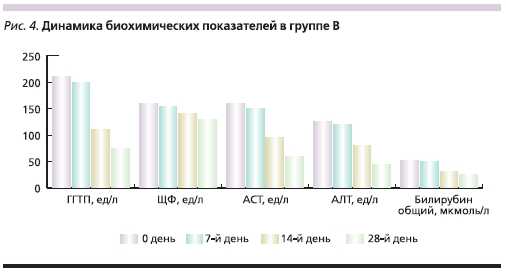
Во время проводимой терапии вобеих группах наблюдались нежелательные явления, возможно связанныес проводимым лечением (табл. 4).Наблюдаемые нежелательные явления в обеих группах были незначительно выражены, купировалисьсамостоятельно, не требовали корректировки дозы препарата или прекращения лечения. Частота выявлениянежелательных явлений и их характер
в обеих исследуемых группах были сходными.
Таблица 4. Нежелательные явления на фоне лечения адеметионином (n = 60).
Заключение
Применение адеметионина патогенетически обоснованно и эффективно при АБП, сопровождается достоверным снижением клинико-биохимической активности, уменьшением выраженности синдрома ВПХ, повышением качества жизни больных. Восемнадцатидневные курсы лечения таблетками Гептор и Гептрал продемонстрировали сходные результаты по времени развития положительного эффекта и степени воздействия на биохимическую активность заболевания. Профиль безопасностиГептора (таблетки) сходен с таковымГептрала (таблетки). Таким образом, Гептор (таблетки адеметионина) может быть рекомендован для лечения больных с алкогольными поражениями печени на стадии хроническогогепатита и ЦП.
Литература
Представлены данные исследования биохимических процессов, происходящих в организме больных гемобластозами не только при опухолевом росте, но и при воздействии противоопухолевых средств (при полихимиотерапии), которые явились основой для разработки программ сопроводительной терапии, направленной на предупреждение и уменьшение гепатотоксичности противоопухолевых средств. Полученные результаты свидетельствуют, что препарат Гептрал (адеметионин) обладает высокой лечебной эффективностью и может быть использован у онкогематологических больных с печеночной недостаточностью при проведении цитостатической терапии.
Успехи современной химиотерапии позволили добиться излечения многих заболеваний системы крови, считавшихся ранее фатальными [1, 2]. Повышение эффективности лечения достигнуто благодаря интенсификации режимов химиотерапии. Однако негативной стороной полихимиотерапии (ПХТ) являются побочные эффекты противоопухолевых лекарственных средств, обусловленные низкой селективностью большинства цитостатиков, что служит серьезным ограничением в достижении максимального лечебного действия 2.
Этиология, патогенез, клинические проявления развившихся осложнений, структура и методы их лечения у больных гемобластозами в условиях тяжелой иммуносупрессии, депрессии одного или нескольких ростков кроветворения имеют определенные отличительные черты: скоротечность, полиэтиологичность, однообразие клинических проявлений, значительную тяжесть состояния, частое сочетание поражений органов и систем. Для достижения адекватного лечебного эффекта необходим ряд мероприятий, получивших название терапии сопровождения. Сегодня сопроводительная терапия является обязательной составляющей противоопухолевых программ. Эти обстоятельства способствовали рождению новой области гематологии - “интенсивной терапии при гемобластозах”, которая позволяет больному пережить тяжелые, но потенциально обратимые расстройства функций жизненно важных органов и систем на всех этапах лечения. В полной мере это относится и к гепатотоксичности, которая приводит к печеночной недостаточности (ПН).
Общепринятого определения ПН не существует. Многие клиницисты под ПН понимают синдром, развивающийся при острых или хронических заболеваниях печени, основным патогенетическим механизмом которого является печеночно-клеточная недостаточность и/или портальная гипертензия. Другие авторы рассматривают ПН как более широкое понятие, включающее не только различные нарушения функций печени, но и гепатоцеребральную недостаточность, финалом которой является печеночная кома.
Своевременное распознавание и устранение провоцирующих факторов печеночно-клеточной недостаточности уменьшают риск развития печеночной энцефалопатии (ПЭ), которая, как показывают клинические наблюдения, является весьма частым осложнением течения ПН, а при ее выраженных формах - просто неизбежным. ПЭ - это потенциально обратимое нарушение функции головного мозга, возникающее как у пациентов с хроническими заболеваниями печени, так и у больных острым гепатитом.
Необходимо подчеркнуть особую важность своевременного распознавания и лечения латентной ПЭ (ЛПЭ). Согласно результатам последних исследований, в 30-84 % случаев пациент “не чувствует себя больным”, и лишь с помощью психометрических тестов можно выявить отклонения в его поведении. У 40 % больных регистрируется явная ПЭ, т. е. пациент “чувствует себя больным” [9, 20, 33]. Клиническая значимость ЛПЭ объясняется двумя причинами: во-первых, она может предшествовать развитию клинически выраженной ПН; во-вторых, психомоторные нарушения, возникающие при ЛПЭ, оказывают отрицательное влияние на качество жизни пациента. Многие пациенты являются работоспособными людьми и на этапах химиотерапевтического лечения продолжают трудиться. Поэтому проведение сопроводительной терапии порой необходимо для улучшения качества их жизни.
Существует ряд препаратов целенаправленного действия для проведения сопроводительной терапии, т. н. гепатопротекторов, к которым можно отнести и препарат Гептрал (адеметионин). Адеметионин является естественным метаболитом, содержится во всех средах организма и играет ключевую роль во всех метаболических процессах. За сутки из аденозина и метионина в печени синтезируется до 8 г эндогенного адеметионина. При всех поражениях печени, сопровождающихся внутрипеченочным холестазом, имеет место дефицит адеметионина.
Адеметионин обладает детоксикационными, антиоксидантными, холеретическими, холекинетическими, антидепрессивными, нейропротективными, регенерирующими свойствами. В печени он выступает в качестве необходимого структурного элемента в трех важных биохимических процессах: трансметилировании, транссульфировании и аминопропилировании (рис. 1). К числу наиболее важных реакций адеметионинзависимого трансметилирования относится синтез белков, гормонов, нуклеиновых кислот, фосфолипидов, нейромедиаторов (обеспечивается молекулярный транспорт, происходят восстановление текучести и поляризации клеточной мембраны, активности ферментных систем, деление и дифференцировка клеток, синтез желчи).
Нарушение транссульфирования адеметионина приводит к дефициту глутатиона (эндогенного пептида) - одного из самых важных внутриклеточных детоксицирующих агентов. Недостаточность глутатиона и изменение активности глутатионтрансферазы снижают устойчивость печени к повреждающему действию свободных радикалов и других гепатотоксических воздействий.
Реакция аминопропилирования имеет отношение к процессам пролиферации гепатоцитов и регенерации печени (синтез полиаминов). Известно об антидепрессивном действии адеметионина.
В отделении химиотерапии гемобластозов ГУ РОНЦ им. Н.Н. Блохина РАМН проведены исследования биохимических процессов, происходящих в организме не только при опухолевом росте, но и при воздействии противоопухолевых средств (при полихимиотерапии). Полученные результаты стали основой для разработки программ сопроводительной терапии, направленной на предупреждение и уменьшение гепатотоксичности противоопухолевых средств. При развившейся печеночно-клеточной недостаточности в схемы интенсивной терапии были включены препараты, улучшающие метаболические процессы в печени. Рациональные подходы к коррекции нарушений метаболизма клеток печени - это реальный путь к повышению эффективности лечения и улучшению качества жизни онкогематологических больных. С учетом важной физиологической роли цепи перекисного окисления липидов (ПОЛ) и нарушения ее регуляции при злокачественном росте можно предположить влияние этих изменений и на резистентность организма. Особое значение имеет исследование указанного процесса на мембранах опухолевых и нормальных клеток, т. к. доказана однотипность изменений клеточных мембран.
Цель исследования заключалась в изучении особенностей нарушений гомеостаза у больных гемобластозами при лекарственной гепатотоксичности и возможностей применения препарата Гептрал для профилактики и лечения выявленных нарушений печени на основе анализа нашего клинического опыта.
Материал и методы
Были обследованы 44 больных гемобластозами с печеночно-клеточной недостаточностью. В схемы лечения ПН включен препарат Гептрал, который назначали в дозе 400-800 мг (по 5-10 мл) внутривенно либо внутримышечно или по 400-800 мг (1-2 таблетки) перорально 2 раза в сутки до устойчивой нормализации функционального состояния печени (продолжительность курса лечения составляла не менее 30 дней). При необходимости курс лечения продлевался. Пациентам групп риска Гептрал назначали на весь период химиотерапии.
Обследование пациентов проводилось в несколько этапов в следующие периоды:
- до начала ПХТ;
- в 1-2-й дни после окончания ПХТ;
- до лечения Гептралом (функциональные нарушения печени);
- в 1-2-й дни приема Гептрала;
- в период выраженных функциональных нарушений печени;
- в период восстановления функциональной способности печени.
Все тесты проведены также в контрольной группе, включавшей 120 практически здоровых людей. Их показатели были приняты за норму.
Биохимические методы исследования: проводился мониторинг уровней трансаминаз, ГГТП (g-глутамилтранспептидазы), ЩФ (щелочной фосфатазы), содержания билирубина в сыворотке крови. Изучены биохимические процессы, связанные с метаболизмом клетки, в т. ч. антиоксидантная система (АОС) клетки, включающая ферментативную и неферментативную регуляции процессов ПОЛ, а также нарушения детоксикационной способности печени по содержанию глутатиона и активности глутатионзависимых ферментов на этапах химиотерапевтического лечения (см. таблицу). Интенсивность ПОЛ оценивали по содержанию малонового диальдегида (МДА). Состояние АОС оценивали по активности супероксиддисмутазы (СОД), каталазы, содержанию a-токоферола и ретинола. Особенности изменений системы глутатиона изучались по показателям глутатиона и глутатионзависимых ферментов (глутатионредуктазы, глутатионпероксидазы, глутатионтрансферазы). Степень эндотоксикоза оценивали по коэффициенту интоксикации (КИ), который вычисляли как соотношение показателей средних молекул (280 и 254 нм). Все биохимические показатели определяли в периферической крови. Для объективизации психоневрологических изменений ПЭ применялся тест связи чисел.
При анализе полученных результатов (рис. 2) до начала ПХТ у всех больных были обнаружены нарушения метаболических процессов и компенсаторных возможностей организма, обеспечивающих поддержание гомеостаза. Исследования интенсивности ПОЛ и АОС в крови больных выявили достоверные различия в активности ферментативной и неферментативной цепей свободнорадикального окисления липидов по сравнению с показателями практически здоровых людей. Сравнительные исследования ферментативной системы антиоксидантной защиты показали повышение активности СОД у всех онкогематологических больных по сравнению с нормой (до 52 %, р
Снеговой А.В., Манзюк Л.В.
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
У 19 пациентов с различными злокачественными опухолями проведена оценка эффективности препарата Гептрал® (адеметионин) при лечении гепатотоксичности, индуцированной химиотерапией. Показано, что при 4-недельном приеме Гептрала® внутрь по 400 мг 2 раза в день уровень трансаминаз снизился до нормы у 10 из 12 пациентов с 1-й степенью гепатотоксичности. Для нормализации уровня трансаминаз при 2-й степени гепатотоксичности потребовался более длительный прием Гептрала® (от 2 до 4 месяцев). Режим химиотерапии в период применения Гептрала® не менялся.
Введение
Противоопухолевая цитостатическая терапия обычно оказывает повреждающее действие на различные органы и системы организма. Гепатотоксичность является одним из наиболее частых побочных эффектов химиотерапии и зависит от препарата, доз и схем его применения, а также сопутствующих хронических заболеваний печени [1]. Печеночная токсичность может требовать изменения режима лечения, удлинения интервалов между курсами, а в ряде случаев - прекращения лекарственной терапии. Все это негативно сказывается на психическом состоянии пациентов и результатах лечения.
На сегодняшний день механизмы токсического повреждения печени цитостатиками до конца не изучены, а в современной отечественной литературе обнаруживается не так много работ, посвященных этой проблеме.
Эффективность гепатопротекторов связана с их правильным и своевременным назначением, при том что реальная практика их применения зачастую является хаотичной и неадекватной.
Метаболизм лекарственных препаратов в печени проходит несколько основных этапов: первый - с участием системы цитохрома Р450, монооксигеназ и других ферментов; второй - биотрансформация, конъюгация метаболитов с эндогенными молекулами; третий - транспорт и экскреция продуктов биотрансформации. Важную роль в развитии токсического повреждения печени играют реактивные метаболиты и свободные радикалы. Реактивные метаболиты связываются с белками и липидами мембран, вызывая их перекисное окисление [2]. Это ведет к развитию структурных и функциональных нарушений, повышающих активность аминотрансфераз и вызывающих гибель гепатоцитов [3].
Цитостатики могут вызывать любые известные повреждения печени, включая некроз, стеатоз, фиброз, холестаз и поражение сосудов [4, 5]. До 90 % проявлений гепатотоксичности включают:
1) острый гепатоцеллюлярный гепатит,
2) острый холестатический гепатит и
3) смешанный гепатит [6].
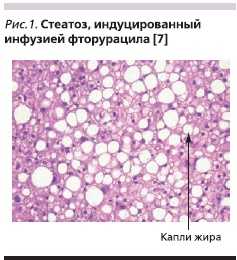
В 1920 г. впервые описана обструкция и дилатация печеночных синусов (венооклюзионное заболевание) как летальная интоксикация в результате употребления ядовитых растений. Данная морфологическая форма характеризуется повреждением синусоидальных эндотелиальных клеток вследствие активации металлопротеиназ и оксидативного стресса [7].На рис. 1 представлена морфологическая картина индуцированного цитостатиками стеатоза, которая характеризуется наличием больших капель жира в гепатоцитах. В среднем частота стеатоза составляет 30 %.
Стеатогепатит связан с оксидативным стрессом, следствием которого является повреждение митохондрий гепатоцитов.
Ниже представлены группы лекарственных препаратов, вызывающих различные варианты токсического повреждения печени [8]:
- алкилирующие агенты (циклофосфан, иофосфамид, мелфалан, хлорамбуцил и др.) могут приводить к развитию центролобулярного или перипортального повреждения, холестаза, в ряде случаев на фоне холестаза развивается воспаление;
- антиметаболиты (фторурацил - ФУ, меркаптопурин, метотрексат, гемцитабин) вызывают развитие венооклюзионной болезни, холестаз и оказывают прямое цитотоксическое повреждающее действие на гепатоциты;
- производные нитрозомочевины (кармустин, ломустин) приводят к истощению внутрипеченочных запасов глутатиона, что увеличивает риск окислительного повреждения печени;
- противоопухолевые антибиотики (доксорубицин, блеомицин, митомицин, дактиномицин, митоксантрон) повреждают мембрану гепатоцита с образованием свободных радикалов;
- винкаалколоиды и таксаны вызывают различные токсические повреждения печени, включая стеатогепатиты;
- ингибиторы топоизомеразы I (этопозид, иринотекан, топотекан) при биотрансформации образуют токсический метаболит SN-38;
- производные платины вызывают стеатозы, стеатогепатиты, венообструктивную болезнь;
- интерфероны, интерлейкины приводят к активации T-киллеров и цитокинов, а также к прямому токсическому повреждению гепатоцитов;
- гормонотерапия (тамоксифен, антиандрогены) может приводить к развитию холестаза;
- таргетная терапия (бевацизумаб) в ряде случаев ассоциируется с синусоидальной дилатацией.
Таким образом, в большей или меньшей степени, но каждая группа препаратов, используемых в современном лекарственном лечении злокачественных опухолей, оказывает воздействие на функциональное состояние печени.
Для оценки тяжести гепатотоксичности используются следующие клинико-лабораторные показатели (табл. 1) [8].
Таблица 1. Клинико-лабораторные показатели оценки тяжести гепатотоксичности.
Для диагностики токсического повреждения печени дополнительно можно использовать инструментальные методы (компьютерную, магнитно-резонансную томографии и др.), биопсию. По соотношению показателей АСТ/АЛТ можно судить о характере гиперферментемии [8]. В норме отношение АСТ к АЛТ ближе к 1,0. При отношении АСТ к АЛТ меньше 0,7 подтверждается печеночный характер гиперферментемии. Если отношение АСТ к АЛТ более 1,3, имеет место гиперферментемия внепеченочного генеза.
Тактика коррекции доз при гепатотоксичности в основном ориентирована на уровень повышения уровней общего билирубина и трансаминаз [8].
- При повышении уровня общего билирубина в 1,2-2,5, трансаминаз - в 2-5 раз дозы антрациклинов уменьшают на 50 %, а других цитостатиков - на 25 %.
- При повышении уровня общего билирубина в 2,6-5,0, трансаминаз - в 5-10 раз дозы антрациклинов уменьшают на 75 %, а других цитостатиков - на 50 %.
- Если отмечается дальнейшее увеличение лабораторных показателей, противоопухолевая терапия прекращается.
Специфическим антидотом при дозозависимой гепатотоксичности являются N-ацетилцистеин и другие доноры сульфгидрильной группы [9]. Лекарственная гепатотоксичность чаще всего ведет к прекращению противоопухолевого лечения или отсрочке применения гепатотоксичного препарата, иногда назначают симптоматическое лечение.
Эффективность кортикостероидов при иммуноаллергическом гепатите и урсодеоксихолевой кислоты при холангите убедительно не доказана [10, 11].
Hirata и соавт. продемонстрировали важность метилирования для обеспечения функции и целостности мембран гепатоцитов [12]. Глутатион выполняет ряд важных функций, включая нейтрализацию свободных кислородных радикалов, обмен тиосульфида, хранение и перенос цистеина, конъюгацию и нейтрализацию реактивных метаболитов при биотрансформации ксенобиотиков [13]. Недостаточность глутатиона приводит к повышению восприимчивости к окислительному стрессу. В печеночных клетках недостаток его также вызывает инактивацию адеметионинсинтетазы, что служит причиной нарастания истощения запасов глутатиона в печени [14].
Адеметионин (Гептрал ®) - основной эндогенный донор метильной группы в биологических реакциях трансметилирования [15]. Он необходим для синтеза нуклеиновых кислот и белка, играет основную роль в синтезе полиаминов и является источником цистеина, необходимого для образования глутатиона - важнейшего эндогенного гепатопротектора [15].
В экспериментальных исследованиях продемонстрирована эффективность адеметионина в лечении поражений печени, вызванных четыреххлористым углеродом, D-галактозамином, ацетаминофеном, алкоголем и др. 18. В клинических исследованиях применение адеметионина позволило отложить трансплантацию печени и увеличить выживаемость у больных с алкогольным поражением этого органа [21]. Кроме того, препарат обеспечивает благоприятный эффект при внутрипеченочном холестазе, развивающемся у беременных, и хроническом неалкогольном поражении печени.
Целью настоящего исследования была оценка эффективности препарата Гептрал ® (адеметионин, соль SD-4) при лечении гепатотоксичности, индуцированной химиотерапией.
Мы использовали Гептрал ® (адеметионин, соль SD-4) в таблетках по 400 мг (фармацевтическая компания Эбботт).
Материал и методы
В исследование были включены 19 пациентов с различными злокачественными опухолями: колоректальный рак - 12, рак молочной железы - 3, рак желудка - 2, рак яичников - 1, рак правого надпочечника - 1.
Возраст больных составлял от 41 до 80 лет: 41-60 лет - 14 (73 %), 61-80 - 7 (27 %) человек. Общее состояние оценивалось по шкале ECOG: 1 - 10 пациентов, 2 - 9 больных. Несколько линий предшествующей химиотерапии до включения в настоящее исследование получали большинство пациентов (14/19-73,6 %).
Метастазы в печень исходно обнаружились у 7 из 19 (36,8 %) пациентов. Незначительное повышение уровня общего билирубина (от 21 до 22 мкмоль/л) выявлено у 4 больных с метастазами в печень, но не требовало выполнения дренирующих хирургических пособий. Уровень общего белка у всех пациентов был в пределах нормы (от 60 до 80 г/л).
Проводились следующие режимы химиотерапии:
Адьювантное лечение получили 3 пациентки с раком молочной железы после радикальных операций, остальные 16 больных имели диссеминированный процесс и получали лечебную химиотерапию.
Критерием гепатотоксичности явилось увеличение активности АСТ и/или АЛТ в крови на фоне химиотерапии. Степень гепатотоксичности определена по наибольшему уровню одной из них. Уровень щелочной фосфатазы и других печеночных ферментов лабораторно рутинно не определялся и нами не оценивался. Активность ферментов определяли в одной лаборатории. В исследовании не было контрольной группы.
Гептрал ® при наличии гепатотоксичности назначался внутрь по 400 мг 2 раза в день ежедневно в течение минимум 4 недель на фоне химиотерапии. Оценка динамики уровня трансаминаз проведена через 2, 3, 4 и более недель от начала применения Гептрала ®.
Таблица 2. Распределение больных по уровню трансаминаз.
Результаты
Как указывалось выше, эффективность терапии препаратом Гептрал ® анализировали на основании динамики активности трансаминаз через 2, 3, 4 и более недель после начала лечения. Статистическая обработка данных не применялась в связи с небольшим количеством наблюдений. Уровень билирубина нами контролировался, но не оценивался, т. к. не являлся критерием оценки и оставался незначительно повышенным у 4 пациентов с метастазами в печень на фоне положительной динамики трансаминаз. Напомним, что больные с гепатотоксичностью 1-й и 2-й степенями получали Гептрал на фоне химиотерапии.
Уровень АСТ и АЛТ через 2 недели лечения существенно не изменился ни у одного пациента (рис. 2).

Через 3 недели в группе пациентов с 1-й степенью гепатотоксичности уровень АСТ снизился до нормы (менее 37 ЕД/л) у 3 человек, АЛТ (менее 40 ЕД/л) - у 2 пациентов. В группе больных со 2-й и 3-й степенями гепатотоксичности через 3 недели лечения уровень трансаминаз оставался стабильным.
Через 4 недели печеночные показатели снизились до нормы еще у 5 пациентов с 1-й степенью гепатотоксичности. Кроме того, отмечено снижение показателей АСТ и АЛТ у всех пациентов со 2-й степенью гепатотоксичности, в среднем до 100 ЕД/л, т. е. до нижней границы значений, характеризующих эту степень поражения печени.
Таким образом, через 4 недели уровень трансаминаз снизился до нормы у 10 из 12 пациентов с 1-й степенью гепатотоксичности, т. е. эффективность Гептрала ® составила 83,3 %. При 2-й степени гепатотоксичности показатели трансаминаз также снизились, но не достигли уровня, характерного для 1-й степени гепатотоксичности.
Продолжение приема Гептрала ® еще в течение 2 недель (до 6 недель) позволило добиться нормализации уровня трансаминаз у остальных двух пациентов с 1-й степенью гепатотоксичности.
Для нормализации уровня трансаминаз при 2-й степени гепатотоксичности потребовался более длительный прием Гептрала ®: у 2 пациентов - 2 месяца, у 1 - 3, у 3 - 4 месяца (химиотерапия продолжалась без изменения доз).
У пациентки с 3-й степенью гепатотоксичности, имевшей метастазы в печень, уровень трансаминаз снизился до 1-й степени (89 ЕД/л) после 4 месяцев приема Гептрала ®.
Прием Гептрала ® в режиме по 400 мг внутрь 2 раза в день в течении всего срока терапии не вызывал каких-либо побочных реакций у пациентов.
Заключение
Проведенное исследование показало эффективность Гептрала ® при лечении гепатотоксичности, обусловленной химиотерапией:
- Гептрал, назначаемый в дозировке 400 мг 2 раза в сутки в течение 4 недель пациентам с 1-й степенью гепатотоксичности на фоне полихимиотерапии (ПХТ), позволяет полностью устранить проявления синдрома цитолиза у 83,3 % пациентов без изменения схем ПХТ. Продление курса терапии еще на 2 недели обеспечивает нормализацию сывороточных трансаминаз у всех больных данной группы.
- Гептрал в указанном режиме применения стабилизирует уровни АСТ и АЛТ у больных со 2-й степенью гепатотоксичности, удерживая уровень трансаминаз на нижней границе, характерной для этой степени поражения печени. Это позволяет пациентам получать ПХТ в полном объеме и в запланированные сроки.
- Для нормализации сывороточных трансаминаз у пациентов со 2-й степенью гепатотоксичности требуется продление курса терапии Гептралом ® до 2-4 месяцев без отклонений от режима ПХТ.
- При приеме внутрь по 400 мг 2 раза в день Гептрал ® не вызывает побочных реакций и хорошо переносится больными. Таким образом, Гептрал ® может быть рекомендован в рамках сопроводительной терапии для лечения гепатотоксичности, возникшей в процессе цитостатической химиотерапии.
Информация об авторах:
Снеговой Антон Владимирович - кандидат медицинских наук, старший научный сотрудник,
отделение изучения новых противоопухолевых лекарств, РОНЦ им. Н.Н.Блохина.
Тел. 8 (495) 324-41-09
Манзюк Людмила Валентиновна - доктор медицинских наук, профессор кафедры онкологии
ФПДО МГМСУ, заведующая отделением изучения новых противоопухолевых лекарств, РОНЦ им. Н.Н. Блохина.
Тел. 8 (495) 324-25-74
1. King PD, Perry MC. Hepatoioxiciry of chemotherapy. The Oncologist 2001; 6:162-76.
2. DeLeve LD, Kaplovitz N. Mechanisms of druginduced liver disease. Gastroenterol Clin North Am 1995;24:787-810.
3. Dansette PM, Bonierbale E, Minoletti С, et al. Drug-induced immunotoxicity. Eur J Drug Metab Pharmacokinet 1998;23:443-51.
4. Kaplowitz N, Aw TY, Simon FR et al. Druginduced hepatotoxicity. Ann Intern Med 1986;104:826-39.
5. Ishak KG, Zimmerman HJ. Morphologic spectrums of drug-induced liver disease. Gastroenterol Clin North Am 1995; 24:759-86.
6. Larrey D. Drug-induced liver diseases. J Hepatol 2000;32:77-88.
7. Zorti D, et al. Chemotherapy-associated hepatotoxicity and surgery for colorectal liver metastases. Br J Surgery 2007;94:274-86.
8. Paul D, et al. Hepatotoxicity of chemotherapy. The Oncologist 2001;6:162-76.
10. Strieker BH. Drug-induced Hepatic Injury. 2nd edn. Amsterdam: Elsevier, 1992.
11. Pessayre D, Larrey D, Biour M. Drug-induced liver injury. Oxford Textbook of Clinical Hepatology, 2nd edn. Oxford University Press 1999;2:1261-315.
12. Hirata F, Viveros OH, Diliberto EJ. Identification and properties of two methyltransferases in conversion of phosphatidylethanolamine to phosphatidylcholine. Proc Natl Acad Sci USA 1978;75:1718-21.
13. Kretzschmar M, Klinger W. The hepatic glutathione system influences of xenobiotics. Exp Pathol 1990;38:145-64.
14. Cabrero C, Duce AM, Ortiz P, et al. Specific loss of the high-molecular-weight form of S-adenosyl-L-methionine synthetase in human liver cirrhosis. Hepatology 1988;8:1530-34.
15. Cantoni GL. The nature of the active methyl donor formed enzymically from L-methionine and adenosine triphosphate. J Am Chem Soc 1952;74:2942-43.
16. Dunne JB, Davenport M, Williams R, et al. Evidence that S-adenosylmethionine and N-acetylcysteine reduce injury from sequential cold and warm ischaemia in the isolated perfused rat liver. Transplantation 1994;57:1161-68.
17. Mato JM, Camara J, Fernandez de Paz J, et al. Adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial. J Hepatol 1999;30:1081-89.
18. Giudici GA, Le Grazie С, Di Padova C. The use of ademethionine (SAMe) in the treatment of cholestatic liver disorders: meta-analvsis of clinical trials. Methionine Metabolism: Molecular Mechanism and Clinical Implications. Madrid: CSIC Press pp 1992;67-9.
19. Feliu J, Mel JR, Camps C, et al. Raltitrexed in the treatment of elderly patients with advanced colorectal cancer. An active and low toxicity regimen. Eur J Cancer 2002; З8:1204-11.
20. Cascinu S, Graziano F, Ferrau F, et al. Raltitrexed plus oxaliplatin (TOMOX) as firstline chemotherapy for metastatic colorectal cancer. A phase II study of the Italian Group for the Study of Gastrointestinal Tract Carcinomas (GISCAD). Ann Oncol 2002; 13:716-20.
Читайте также:
- Временное пломбирование баллоном без дренирования при отслойке сетчатки. Преимущества
- Компьютерная томография (КТ) в диагностике ранений шеи, груди, живота
- Как лечить заднее носовое кровотечение с помощью баллона
- Техника, этапы операции реконструкции грудино-ключичного сустава с использованием сухожилия полусухожильной мышцы
- Причины височной эпилепсии. Органический компонент височной эпилепсии
