Гипофосфатазия: причины, симптомы и лечение
Добавил пользователь Morpheus Обновлено: 21.01.2026
Гипофосфатазия (ГФФ) - редкое наследственное жизнеугрожающее заболевание, вызванное недостаточностью фермента тканенеспецифической щелочной фосфатазы (ТНЩФ), кодируемой геном ALPL, сопровождающееся характерной клинической картиной и низким уровнем активности щелочной фосфатазы в сыворотке крови. Частота встречаемости ГФФ варьирует в различных странах, и для российской популяции оценивается как 1:100 000. Наиболее частыми клиническими проявлениями ГФФ в детском возрасте являются задержка роста, нарушение минерализации костей, рахитоподобные деформации скелета, низкий мышечный тонус, утомляемость при физической нагрузке, болевой синдром в виде миалгии и оссалгии, повторные переломы костей, выпадение зубов, дыхательные расстройства, пиридоксин-зависимые судороги, гиперкальциемия, нефрокальциноз. Полиорганный характер поражения и выраженные метаболические расстройства приводят в некоторых случаях к тяжелым жизнеугрожающим состояниям. Смертность при ГФФ с ранним дебютом составляет от 50 до 100%.
В настоящей работе представлен результат ретроспективного исследования для идентификации пациентов с редким заболеванием ГФФ. Для исследования был разработан диагностический алгоритм, учитывающий современные референтные значения активности ТНЩФ для детей, скрининг базы тестов и анализ клинических симптомов. В результате проведенной работы обнаружены 3 пациента с ГФФ, у которых заболевание подтверждено генетически.
Приведенный алгоритм может быть использован для эффективной диагностики ГФФ в других лечебных учреждениях без дополнительных финансовых затрат.
Ключевые слова: гипофосфатазия, ГФФ, тканенеспецифическая щелочная фосфатаза, рахитоподобные состояния, скелет, детский возраст, диагностика, скелетные деформации, низкорослость, генетическая диагностика, ALPL.
Retrospective diagnostics of hypophosphatasia in children
Sosnina I.B. 1 , Sukcheev M.B., Ivashikina T.M. 1 , Snegova E.V. 1 , Pashkova V.P. 1 , Klimenkova O.A. 1 , Pervunina T.M. 2
1 Consultative Diagnostic Center for Children, St. Petersburg
2 V.A. Almazov Federal North-West Medical Research Center, St. Petersburg
Hypophosphatasia is a rare inherited life-threatening condition resulting from the deficiency of tissue-specific alkaline phosphatase (AP) encoded by APL gene. This disorder with specific clinical manifestations is characterized by low serum activity of AP. The occurrence of hypophosphatasia varies among the countries, its estimated rate in Russia is 1 per 100,000 population. The most common symptoms of hypophosphatasia in children are defective bone mineralization, rachitic skeletal deformations, low muscle tonus, fatigue after physical activity, pains (myalgia, ossalgia), recurrent bone fractures, losing teeth, respiratory disorders, pyridoxine-dependent seizures, hypocalcaemia, and nephrocalcinosis. Multiple organ dysfunction and severe metabolic disorders lead to life-threatening conditions. Early hypophosphatasia mortality is 50-100%.
The publication addresses the outcomes of retrospective study on the identification of patients with this rare disease. Diagnostic algorithm considers current reference values of tissue-nonspecific AP activity in children and includes test database screening and clinical symptom assessment. As a result, three patients with genetically verified hypophosphatasia were identified. This algorithm can be used for precise cost-effective diagnosis of hypophosphatasia in other clinics.
Key words: hypophosphatasia, HPP, tissue-nonspecific alkaline phosphatase, rickets like conditions, skeleton, children, diagnostics, skeletal deformations, stunting, genetic diagnostics, ALPL.
For citation: Sosnina I.B., Sukcheev M.B., Ivashikina T.M. et al. Retrospective diagnostics of hypophosphatasia in children // RMJ. 2016. № 26. P. 1778-1781.
В статье представлен опыт ретроспективной диагностики гипофосфатазии у детей
Введение
Тканенеспецифическая щелочная фосфатаза (ТНЩФ) - это фермент из группы гликопротеинов, катализирующих гидролиз фосфодиэфирной связи с высвобождением неорганического фосфата [1]. ТНЩФ экспрессируется на поверхности клеток и представлена в различных органах и тканях человека, включая костную ткань, печень и почки. Сниженная активность ТНЩФ приводит к широкому спектру клинических проявлений.
ГФФ - это редкое наследственное жизнеугрожающее заболевание, при котором активность ТНЩФ снижена. ГФФ вызвана нарушением функции гена ALPL, кодирующего ТНЩФ, что приводит к ее недостаточности [2]. В норме ТНЩФ регулирует обмен неорганического пирофосфата (НПФ) и поступление витамина B6 в нервные клетки [1].
При ГФФ НПФ не разрушается, его концентрация увеличивается, и прекращается рост кристаллов гидроксиапатита 4, что вызывает нарушения в формировании костной ткани и скелетные деформации [1, 6]. В то же время НПФ в повышенной концентрации образует связи с ионами кальция с формированием кристаллов пирофосфата кальция, который может накапливаться в почках (вызывает нефрокальциноз) или суставах (вызывает боли в суставах и развитие кристаллического артрита и псевдоподагры) [7].
Важной функцией ТНЩФ в работе нервной системе является регулирование поступления витамина В6 в ткани головного мозга. ТНЩФ отщепляет фосфат от пиридоксаль-5-фосфата (П5Ф, форма витамина B6) с образованием пиридоксаля, который способен проникать через клеточные мембраны в ЦНС, где происходит повторное присоединение фосфата к пиридоксалю с образованием П5Ф. П5Ф выступает кофактором нейротрансмиттеров (серотонина, допамина, гамма-аминомасляной кислоты и др.), а его дефицит в ЦНС при ГФФ выражается в виде судорог, которые купируются введением витамина B6 [8, 9]. Наличие судорог при ГФФ служит прогностическим признаком высокой вероятности летального исхода [10]. Кроме того, аномалии формирования костей грудной клетки становятся одной из причин гипоплазии легких, что может приводить к дыхательной недостаточности у пациентов с ГФФ [11].
Тяжелые формы ГФФ чаще всего вызваны наличием гомозиготной или компаунд-гетерозиготной мутации в гене ALPL (OMIM 171760) [12]. ТНЩФ экспрессируется на поверхности клеток как гомодимер, поэтому некоторые гетерогизогные мутации могут приводить к доминантно-негативному эффекту со снижением активности гомодимерной молекулы фермента [13, 14]. Мутация даже в одном аллеле может приводить к развитию ГФФ [15]. Носители одинаковой мутации в семье могут иметь различные степени проявления ГФФ, что указывает на наличие модулирующих факторов, участвующих в метаболизме фосфатов. В некоторых случаях ГФФ мутации в гене ALPL не удается обнаружить стандартными методами генетической диагностики [16], поэтому для постановки диагноза ведущими критериями являются клинические признаки ГФФ и сниженная активность ТНЩФ (ниже нижней границы нормы для данного возраста и пола) 20.
Клинические формы ГФФ
В зависимости от возраста, в котором появляются первые симптомы, ГФФ условно разделяют на несколько форм 21. Перинатальная форма (иногда называемая перинатальной летальной формой ГФФ) диагностируется при беременности на УЗИ или сразу после рождения. При инфантильной форме ГФФ первые симптомы заболевания обнаруживаются в первые 6 мес. жизни. Для таких пациентов характерна дыхательная недостаточность, судороги, обусловленные дефицитом витамина В6, скелетные деформации, переломы (иногда полученные внутриутробно) и отставание в развитии [21]. При биохимическом обследовании у пациентов с перинатальной и инфантильной формами ГФФ обнаруживается гиперкальциемия, которая может приводить к развитию нефрокальциноза [22]. Неправильное формирование костей черепа приводит к краниосиностозу и повышению внутричерепного давления, что может потребовать нейрохирургического лечения [16].
Если признаки ГФФ проявились после 6 мес. жизни, такую форму заболевания принято называть детской формой. Для нее наиболее характерны задержка роста и моторного развития, дефицит массы тела, рахитоподобные изменения, скелетные деформации, ранняя потеря зубов с интактными корнями (в среднем до 5 лет). Кроме того, пациенты с детской формой ГФФ подвержены риску частых переломов костей [21, 22].
Для взрослой формы ГФФ характерен широкий спектр проявлений: остеопорозные изменения скелета, «утиная походка», боли в мышцах, частые плохо заживающие переломы, отложения кристаллов в суставах [21, 22, 24, 25].
Единственным клиническим проявлением одонтогипофосфатазии является раннее выпадение зубов с интактным корнем [21, 22, 26].
Данные о распространенности заболевания различаются в разных странах, но предполагаемая средняя распространенность тяжелых форм ГФФ примерно 3,3 случая на 1 млн новорожденных. Рассчитанный уровень заболеваемости средними формами ГФФ 1:6000 [12]. В России ожидаемая распространенность 1:100 000 [27].
Ретроспективная диагностика ГФФ
В настоящее время известно около 7000 редких заболеваний, которые поражают примерно 5% человеческой популяции [28, 29]. По статистике, пациент с редким заболеванием получает правильный диагноз в среднем через 5 лет после наступления первых симптомов [29] и после консультаций примерно у 7 врачей разных специальностей [30]. В то же время около 30% пациентов с редкими заболеваниями умирают, не достигнув 5-летнего возраста. Поэтому своевременная диагностика редких заболеваний критически необходима для начала адекватного ведения пациентов. При ГФФ с ранним наступлением первых симптомов 73% умирают в течение первых 5 лет жизни [28], а пациенты с детской формой ГФФ подвержены риску инвалидизации в последующие годы [22, 31, 32]. Кроме того, терапия ГФФ при неправильной диагностике может приводить к дополнительному ухудшению состояния пациентов [33, 34]. Разнообразие клинических проявлений ГФФ, а также распространенный во врачебной практике недостаток внимания к пониженной активности ТНЩФ и отсутствие установленных педиатрических норм активности ТНЩФ ведут к значительной гиподиагностике ГФФ в РФ [20].
Чтобы провести ретроспективную диагностику ГФФ среди пациентов детского возраста, в Консультативно-диагностическом центре для детей (КДЦД) (Санкт-Петербург) были установлены педиатрические референтные значения активности ТНЩФ, которые значительно зависят от возраста. Значения активности ТНЩФ взяты из международного исследования CALIPER [32], в котором были установлены референтные значения нескольких десятков биохимических маркеров в зависимости от возраста, а также из клинических рекомендаций по диагностике ГФФ, разработанных в РФ (табл. 1) [20].
Алгоритм ретроспективной диагностики
В КДЦД проведен ретроспективный анализ лабораторных данных пациентов в возрасте от 0 до 18 лет, обратившихся к специалистам центра в 2015 г. (около 560 тыс. тестов) (рис. 1). Было отобрано для исследования 280 амбулаторных карт пациентов, имеющих показатели ТНЩФ ниже установленных возрастных значений. С целью определения необходимости дальнейшего генетического тестирования было проведено сопоставление жалоб, клинической картины и лабораторных данных пациентов с клиническими критериями гипофосфатазии. В результате выборки выявлено 9 случаев с наличием в клинической картине характерных для гипофосфатазии симптомов в виде задержки роста, костных деформаций, болей в ногах. Все 9 пациентов были приглашены на осмотр для оценки клинической картины и решения вопроса о целесообразности проведения исследования на наличие мутации в гене ALPL. Из приглашенных явились на осмотр 6 пациентов. Пациенты и их родители, проинформированные о цели исследования, выразили добровольные согласие на участие в исследовании. Произведен забор венозной крови в пробирку с ЭДТА для направления на генетическую диагностику. У 2-х пациентов выявлены патогенные мутации в гене ALPL и поставлен диагноз «гипофосфатазия». Диагноз подтвержден повторными независимыми исследованиями в лабораториях, осуществивших также генетическое тестирование родителей пациентов.
Предварительный анализ тестов с низкой активностью ТНЩФ показал, что примерно в 2/3 случаев это были пациенты гастроэнтерологического профиля с различными заболеваниями ЖКТ (целиакия, лактазная недостаточность и другие ферментопатии, реконвалесценты перенесенных кишечных инфекций) и примерно в 1/3 случаев - пациенты эндокринологического профиля (в основном с диагнозом «гипотиреоз»).
Установка педиатрических референтных значений ТНЩФ позволила диагностировать также одного пациента с ГФФ проспективно в течение 2016 г. Диагноз ГФФ подтвержден при помощи генетического исследования гена ALPL, где была найдена патогенная мутация (c. 571G>A, p. E191K), ранее описанная в литературе как патогенная (см. рис. 1) [33].
Описание клинических случаев ГФФ Клинический случай № 1
Пациент Г.П., 2009 г. р., обратился с жалобами на задержку роста с 5 лет. Анамнез жизни: роды 2-е, на 36-й неделе (5-я беременность, токсикоз 2-й половины, гестоз, резус-отрицательная мать, носитель HCV), вес при рождении - 2850 г, рост - 51 см, оценка по шкале Апгар - 7/8 баллов. При рождении установлен диагноз: внутриутробная гипотрофия, перинатальная энцефалопатия, внутриутробная инфекция. В семейном анамнезе обнаружен низкий рост у бабушек по линии отца и матери (150 см), рост отца - 171 см, матери - 161 см. Пациент проконсультирован эндокринологом в 6 лет. Данные пациента при осмотре: рост - 105 см (отставание на 7 см), вес - 14,8 кг (дефицит массы тела - 13,4%). По данным рентгенограммы кистей рук: развитие скелета соответствует 3-м годам, турецкое седло - без патологии. УЗИ органов брюшной полости: уплотнение стенок желчного пузыря. УЗИ щитовидной железы: без патологии, объем железы - 2,3 см3 (соответствует норме). Эндокринологом диагностированы первичный субклинический идиопатический гипотиреоз и низкорослость. Обследование по гастроэнтерологическому профилю позволило исключить паразитозы, хроническую кишечную инфекцию. В гемограмме обнаружен сниженный уровень половых гормонов.
Тестирование крови на гипофосфатазию выявило снижение уровня щелочной фосфатазы до 88 Ед/л (возрастная норма 142-335 Ед/л). В результате генетического обследования пациента выявлен дефект гена ALPL, аутосомно-доминантный тип наследования (мутация с. 571G>A в гетерозиготном состоянии) [33]. Результаты генетического обследования родителей: у матери мутация с. 571G>A в гетерозиготном состоянии в гене ALPL; у отца мутация с. 571G>A в гене ALPL отсутствует. В качестве дополнительного исследования проведено измерение концентрации субстрата ТНЩФ П5Ф в цельной крови пациента: 44 мкг/л (возрастная норма - 8,7-27,2 мкг/л).
Клинический случай № 2
Пациент И.Ш., 2008 г.р. Задержка роста и отставание в физическом развитии отмечались с раннего возраста. Анамнез жизни: родился от 1-й беременности на сроке 35 нед. Вес при рождении - 2400 г, рост - 46 см. Синдром дыхательных расстройств, дыхательная недостаточность II-III степени, внутриутробная инфекция с поражением легких. Проводилась дыхательная поддержка с помощью искусственной вентиляции легких. В раннем возрасте отмечались частые ОРВИ, отиты, бронхиты, а также ветряная оспа, пищевая аллергия, атопический дерматит и аллергический ринит. Семейный анамнез: рост матери - 158 см, вес - 40 кг, рост отца - 168 см, ожирение II степени. Данные осмотра пациента в 8 лет: рост -114 см, вес - 18,2 кг. По данным рентгенографического исследования кисти: развитие скелета соответствует 5-6 годам, турецкое седло без патологии. Исследование водно-солевого баланса: без патологии. Инсулиноподобный фактор роста - 128,154 мкм/л, кортизол - 272,8 нмоль/л, фосфор - 1,34 ммоль/л, кальций - 4,9 ммоль/л, ионизированный кальций - 1,32 ммоль/л. Уровень активности ТНЩФ в сыворотке крови - 38 Ед/л (возрастная норма - 142-335 Ед/л). Диагноз «гипофосфатазия» подтвержден в результате генетического исследования: выявлена гетерозиготная мутация с. 436G>A, р. Е146К (rs138587317, частота минорного аллеля 0,02%) [33].
Заключение
Приведенный в данной публикации алгоритм ретроспективной диагностики редкого заболевания ГФФ позволил без дорогостоящего массового скринига и привлечения дополнительных ресурсов применить ранее полученные биохимические и клинические данные и выявить группу пациентов с высокой вероятностью положительного результата.
В итоге выявлены 2 пациента с низкорослостью и рахитоподобными изменениями скелета, у которых диагноз «гипофосфатазия» подтвержден генетически. Кроме того, после установления педиатрических норм активности ТНЩФ обнаружен еще один пациент с низким уровнем активности ТНЩФ, клиническая картина у которого соответствовала ГФФ. Секвенирование гена, кодирующего ТНЩФ, показало наличие описанной ранее патогенной мутации. В последующем данным пациентам может быть оказана медицинская помощь соответственно диагнозу.
Таким образом, применение теста на активность щелочной фосфатазы, входящего в различные панели и часто назначаемого для диагностики, а также алгоритма клинического анализа позволяют обнаружить пациентов с редким заболеванием ГФФ. Адаптация данного алгоритма ретроспективной диагностики в других ЛПУ может способствовать улучшению качества диагностики и медицинской помощи без применения дополнительных средств.
Случай диагностики одонтогенной формы гипофосфатазии у трёхлетнего ребенка
22 декабря 2017 года через соцсети ко мне обратилась женщина с жалобами, что у её трехлетнего сына выпадают здоровые молочные зубы с нерассосавшимися корнями.
Жалобы
У ребенка с 2 лет наблюдалось постепенное выпадение молочных зубов. К трём годам отсутствовало 5 зубов. Выпадали безболезненно, предварительно расшатываясь. У пациента наблюдалось килевидное искривление грудной клетки, общая слабость.
Зубы выпадали без внешнего воздействия. Ортодонты явных причин для ранней потери зубов не выявили, коррекция не была предложена, учитывая возраст пациента.
Анамнез
Ребёнок от первой беременности,протекавшей с угрозой, первых срочных родов. Вес при рождении — 3250 гр, рост — 51 см. По шкале Апгар — 7/8 баллов, трёхкратное обвитие пуповины вокруг шеи. Выписан с мамой на 5 сутки. С рождения наблюдается у невролога с диагнозом "гипотонус конечностей", проходит курсы массажа, ЛФК. Наблюдается умеренная гидроцефалия, лечение не требуется. Хирург на плановом медосмотре зарегистрировал искривление грудной клетки. Ребёнок пониженного питания. Рост и развитие соответствуют возрасту. Педиатр предположил диагноз "рахит", начато соответствующее лечение, без эффекта. При проведении онлайн-консультации заподозрен диагноз "гипофосфатазия, детская форма".
Обследование
Ребёнок пониженного питания, астенического типа телосложения. Вес 12,500 кг, рост 94 см. Голова гидроцефальной формы с выступающими лобными буграми, зубы с жёлтой эмалью. Имеется умеренная килевидная деформация грудной клетки, выступающие рёберные дуги, клинодактилия мизинцев, плосковальгусные стопы. Отмечается отсутствие 5 молочных зубов. Зона суставов не изменена. Патологии со стороны дыхательной, пищеварительной,нервной, сердечно-сосудистой систем не выявлено.
Данные лабораторной диагностики: — щелочная фосфатаза 85 (снижение); — кальций 2,46; — фосфор 2,10; — общий анализ крови без патологии; — общий анализ мочи без патологии; — Кальций в моче 3,12 ммоль/л. Проведено исследование щитовидной железы-без патологии. Рентгенография кисти — костный возраст соответствует 1,5-2 годам. На рентгенографии грудной клетки выявлена умеренная деформация, не требующая коррекции. На основании значительного снижения уровня щелочной фосфатазы ребёнок был направлен в московский Центр Молекулярной генетики, где было проведено исследование мутаций в гене ALPL и выявлены мутации в 5 и 6 экзонах. На основании молекулярно-генетического анализа диагноз "гипофосфатазия" подтверждён. Обследование родителей показало, что отец и мать являются носителями мутаций в гене ALPL в гетерозиготном состоянии. У родного брата также выявлена одна мутация в гене, ответственном за развитие гипофосфатазии в гетерозиготном состоянии.
Диагноз
Лечение
Лечение данного заболевания финансируется из средств бюджета, так как гипофосфатазия относится к орфанным заболеваниям. Лечение показано при жизнеугрожающих и инвалидизирующих состояниях. В данном случае оно не показано.
Заключение
Гипофосфатазия — это наследственное заболевание, частота которого составляет 1:100000, однако в России выявлено только 19 человек с данным заболеванием, что говорит о малой осведомлённости врачей о данной патологии, сложностях диагностики, дифференциации с другими заболеваниями и реабилитации. Лечение возможно в НИИ педиатрии в г. Москве. Следует помнить, что пациентам с данной патологией противопоказан приём витамина Д и препаратов кальция, обычно применяющихся для лечения рахита, заболевания со схожей симптоматикой, так как высокие дозы кальция могут усилить проявления основного заболевания, привести к тяжёлой гиперкальциемии.
Гипофосфатазия - симптомы и лечение
Что такое гипофосфатазия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Боровиковой Ольги Игоревны, генетика со стажем в 7 лет.
Над статьей доктора Боровиковой Ольги Игоревны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Гипофосфатазия — это наследственное метаболическое заболевание, связанное со снижением активности либо с полным отсутствием тканенеспецифической щелочной фосфатазы. Эта редкая болезнь затрагивает многие органы и системы и является жизнеугрожающей для пациента. [20] [23]
Такой фермент, как щелочная фосфатаза, играет важную роль в минерализации тканей. Поэтому её дефицит становится причиной различных системных нарушений, проявляющихся недостаточной минерализацией костей и их деформацией. При тяжёлых формах гипофосфатазии у новорождённых также развивается дыхательная недостаточность и судороги.
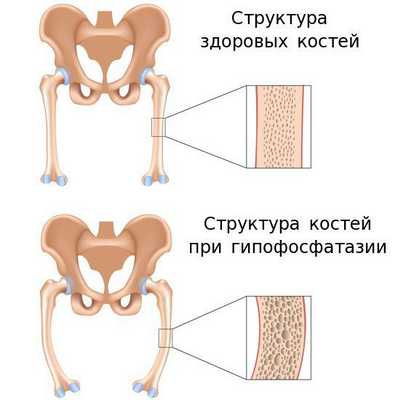
Причиной заболевания является мутация в гене ALPL, кодирующем указанный фермент. Этот ген расположен на коротком плече первой хромосомы, которая содержит большее количество генетической информации о структуре организма человека по сравнению с остальными хромосомами.
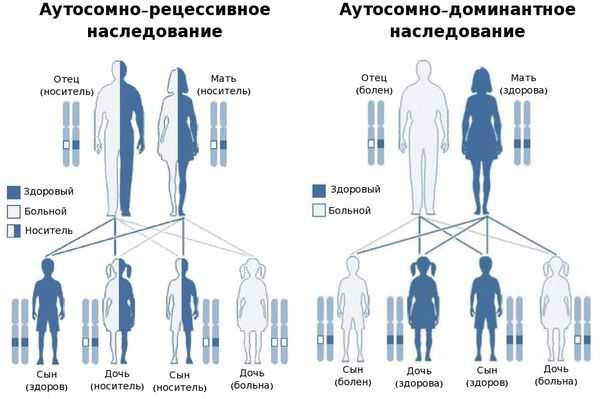
В большинстве случаев заболевание передаётся по аутосомно-рецессивному типу, т. е. при условии, что мутировавший ген передался к ребёнку от обоих родителей. Также описаны и случаи аутосомно-доминантного типа наследования — передача мутировавшего гена только от одного родителя. [25]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипофосфатазии
Клиническая картина заболевания в значительной степени зависит от возраста пациента и формы заболевания. [1]
К основным проявлениям гипофосфатазии относят повреждения скелета в виде:
- значительной гипоминерализации костей — нарушения развития костной ткани;
- краниосиностоза — деформации черепа в связи с преждевременным закрытием черепных швов;
- рахитоподобной деформации скелета;
- остеомаляции — ухудшение прочности костей в связи с их недостаточной минирализацией;
- незаживающих переломов;
- повторяющихся переломов, требующих применения инвалидного кресла и других способов поддержки для передвижения. [23]
Боли в суставах, мышцах и костях — одно из значительных и прогрессирующих проявлений гипофосфатазии. [14]
Поражение дыхательной системы проявляется гипоплазией (недоразвитием) лёгких и дыхательной недостаточностью, при которой в некоторых случаях требуется применение кислородной поддержки. [23]
Со стороны центральной нервной системы наблюдаются судорожные приступы, повышение внутричерепного давления, различные внутричерепные кровотечения. [20]
Очень часто при гипофосфатазии встречаются тяжёлые поражения почек в виде нефрокальциноза и почечной недостаточности.
Патология мышечной системы проявляется различными миопатиями, хронической болью в мышцах, задержкой или полным отсутствием моторного развития. [22]
Характерны поражения суставов в форме хондрокальциноза (псевдоподагры) и прогрессирующего артрита.
Гипоминерализация костей приводит к раннему выпадению зубов у детей и потере здоровых зубов у взрослых. [20]
Ещё одним характерным проявлением гипофосфатазии является отставание костного возраста от паспортного по результатам рентгенологического исследования.
При перинатальной форме гипофосфатазии отмечается укорочение трубчатых костей, недоразвитие и укорочение рёбер, мягкие кости черепа, повышается вероятность поражения центральной нервной системы в процессе родов. [20]
Патогенез гипофосфатазии
Патогенез гипофосфатазии связан со снижением выработки либо активности щелочной фосфатазы, структура и функционирование которой нарушается п ри наличии мутации в гене ALPL .
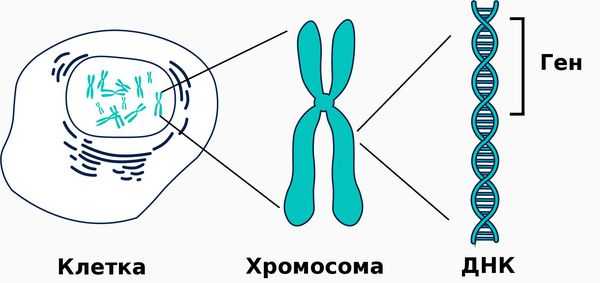
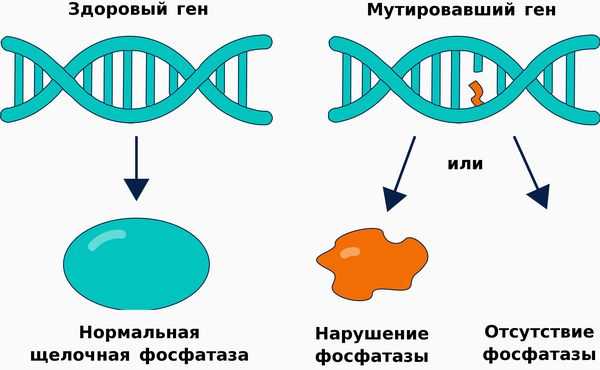
Щелочная фосфатаза принимает участие в метаболизме трёх важных субстратов:
- пиридоксаль-5-фосфат (витамин В6 , PLP);
- неорганический пирофосфат (PPi);
- фосфоэтаноламин (PEA).
Нарушение метаболизма пиридоксаль-5-фосфата приводит к повышению его циркуляции в крови и недостатку активной формы витамина В6. В циркулирующей форме витамин В6 не может проникнуть через гемато-энцефалический барьер. Недостаток активной формы витамина сопровождается поражением центральной нервной системы, что проявляется развитием судорожного синдрома, снижением мозговой активности и трудностями в усвоении информации. [23]
Неорганический пирофосфат является основным компонентом гидроксиапатита, входящего в состав костей. При нарушении метаболизма неорганического пирофосфата происходит повышение его концентрации в крови, гиперфосфатемия и гиперкальциемия, что приводит к отложению солей кальция в суставах, почках и других внутренних органах:
- отложение солей кальция в суставах является причиной артритов, в том числе, тяжёлых;
- поражение почек приводит к развитию почечной недостаточности и полиорганным нарушениям.
Неорганический пирофосфат накапливается и в швах черепа, что сопровождается развитием краниосиностоза, нарушением роста головного мозга, родовым травматизмом, внутричерепной гипертензией, мозговыми кровоизлияниями и отёком диска зрительного нерва. [23]
В результате этих процессов снижается содержание гидроксиапатита в костях, что приводит к деминерализации костей, их искривлению, укорочению и переломам. Патология цементирования зубов является причиной их раннего выпадения. [16] Из-за деформации грудной клетки развивается дыхательная недостаточность и гипоплазия лёгких. Снижение плотности и прочности костей черепа приводит к травмам головного мозга. Искривления позвоночника вызывают сдавление спинного мозга и нарушение осанки. [22]
Фосфоэтаноламин является промежуточным метаболитом, нарушение его метаболизма сказывается на различных реакциях.
Классификация и стадии развития гипофосфатазии
Выделяют четыре формы гипофосфатазии:
- пренатальная (предродовая);
- инфантильная;
- детская;
- взрослая.
При пренатальной форме клинические проявления развиваются ещё до родов и характеризуется задержкой внутриутробного роста плода, гипоксией, дефектами черепа ("мембранозный череп"), деформациями костей, тяжёлой патологией грудной клетки и гипоплазией лёгких. Такие дети в большинстве случаев погибают внутриутробно либо рождаются преждевременно, у них развивается дистресс-синдром (тяжёлое расстройство дыхания). [20] Ранее считалось, что 100% таких детей погибает, но в последнее время благодаря своевременной диагностике и лечению возможно выхаживание пациентов с пренатальной формой гипофосфатазии и продление их жизни. Данную форму заболевания можно диагностиравать во время ультразвукового исследования в период беременности по характерным эхографическим признакам. Тип наследования: аутосомно-рецессивный. [25]
Инфантильная форма проявляется в скором времени после рождения. Смертность таких пациентов без лечения достигает 40%. В неонатальном периоде дети с этой формой гипофосфатазии возбудимы, им характерен плохой аппетит, наблюдается повышенная реакция на внешние раздражители, судороги, диспепсия (нарушение пищеварения), обезвоживание, снижение мышечного тонуса, тяжёлые костные аномалии (мягкие кости, увеличенные черепные швы и роднички), повышение кальция в крови. Часто смерть наступает в неонатальном периоде в связи с тяжёлой дыхательной недостаточностью, но известны случаи спонтанного улучшения. [17] Деформация грудной клетки в 50% случаев приводит к развитию пневмонии . В 64% случаев пациентам требуется кислородная поддержка, 66% детей с этим заболеванием нуждаются в искусственной вентиляции лёгких, из которых 95%, к сожалению, умирают. [17] Тип наследования: аутосомно-рецессивный. [25]
При детской форме гипофосфатазии наблюдается постепенное развитие рахитоподобных скелетных изменений, ранняя потеря зубов, хондрокальциноз и артропатии. При данной форме заболевания очень часто ошибочно ставится диагноз "Рахит", что приводит к неправильному лечению и развитию осложнений. Тип наследования: аутосомно-рецессивный. [25]
При взрослой форме наблюдаются частые переломы и снижение минеральной плотности костей, [7] выпадение зубов, искривление конечностей, встречается изолированная фосфоэтаноламинурия. При рентгенографии выявляется уменьшение минеральной плотности костей черепа, трубчатых костей и отложение кальция в почках. Тип наследования: аутосомно-доминантный. [25]
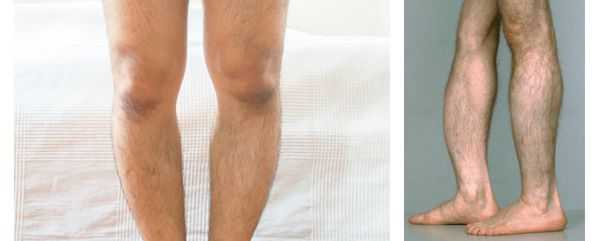
Некоторые авторы выделяют отдельно зубную форму гипофосфатазии . Она характеризуется выпадением здоровых зубов и отсутствием другой симптоматики. Считается самым лёгким вариантом течения гипофосфатазии. [22]
Осложнения гипофосфатазии
Гипофосфатазия является жизнеугрожающим состоянием.
В раннем детском возрасте основными осложнениями заболевания, приводящими к смерти, являются дыхательная недостаточность, травмы головного мозга, внутримозговые кровоизлияния. [12]
В более старшем возрасте развивается почечная недостаточность, связанная с нефрокальцинозом (отложением солей кальция в почках). Это приводит к полиорганной недостаточности и смерти.
Инвалидизация пациентов происходит за счёт снижения мышечного тонуса и артропатий. Поэтому многие пациенты нуждаются в специальных устройствах для облегчения передвижения, в том числе, в инвалидных креслах. [22]

Недостаток биодоступного витамина В6 вызывает судороги, снижение когнитивных функций, задержку психического развития. [8] Эти осложнения лечат витаминами группы В, однако это приводит к избытку пиридоксаль-5-фосфата в крови.
Краниосиностоз приводит к нарушению роста головного мозга, повышению внутричерепного давления, многим пациентам требуется оперативное лечение.
Очень часто осложнения наступают по причине неправильно поставленного диагноза и соответствующего лечения. Так, детям с гипофосфатазией во многих случаях ошибочно ставится диагноз "Рахит" и проводится лечение витамином Д и препаратами кальция. Это приводит к гиперкальциемии, усиленному отложению солей в суставах и почках, а также к гипервитаминозу Д.
Диагностика гипофосфатазии
Диагностика гипофосфатазии основывается на выявлении снижения щелочной фосфатазы в крови.
Диагностика пренатальной и инфантильной гипофосфатазии
Диагностировать пренатальную форму гипофосфатазии возможно во время беременности. Ей характерны следующие ультразвуковые признаки:
- отсутствие оссификации костей (их окостенения);
- более чёткая визуализация структур головного мозга;
- положительный "тест надавливания"; [5]
- недостаточная оссификация, укорочение и деформация длинных трубчатых костей;
- специфическая картина метафиза (участка трубчатой кости);
- характерные акустические дорожки на ультразвуковом снимке. [22][24]
Отсутствие оссификации костей черепа и "мембранозный череп" являются проявлениями, общими для несовершенного остеогенеза и гипофосфатазии, поэтому необходима дифференциальная диагностика этих состояний. [17]
При ультразвуковом исследовании , как правило, трудно дать количественную оценку остеогенеза. Однако если на картине УЗИ внутренняя структура черепной коробки и поверхность мозга, которые обычно невидны у нормально развивающегося плода, визуализируются ярче обычного, то это можно принять в качестве особенности нарушенной формирования костей черепа. [24]
Далее, если провести "тест надавливания" — сильно нажать датчиком ультразвука на брюшную стенку матери — и посмотреть, насколько деформируется череп плода, то у нормально развивающегося малыша форма черепа сохранится (так как кости черепа твёрдые), а в случае выявленного нарушенного остеогенеза костей черепа и "мембранозного черепа" будет наблюдаться его деформация. [24]
Обычно считается, что для того, чтобы увидеть состояние костей, лучше прибегнуть не к ультразвуковой, а к рентгенологической диагностике . На рентгенограмме ясно видны укорочение и искривление длинных трубчатых костей, а также просветление "языков", которые выступают из метафиза в сторону диафиза, являющееся наиболее специфической диагностической картиной при гипофосфатазии. [24]
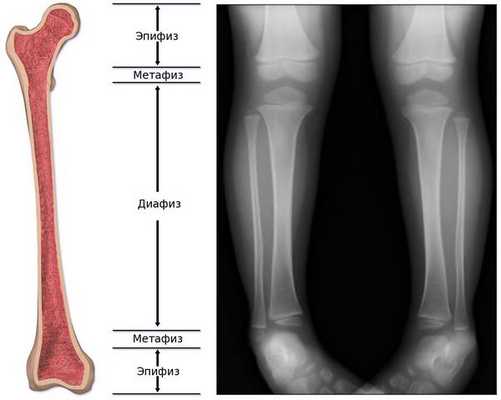
С другой стороны, на ультразвуковом снимке можно убедиться в таких особенностях, как укорочение длинных трубчатых костей, загибы и деформация, но при этом трудно определить, является ли искривление следствием перелома кости или изгиба, а также трудно визуализировать просветление пониженной плотности ("языки пламени" у более взрослых пациентов). [24]
При гипофосфатазии происходит относительно хорошее окостенение средней части диафиза (тела) длинных трубчатых костей, однако к периферии костей оссификация постепенно ухудшается, и на участках метафиза видна только поверхность костей. Поэтому на рентгенограмме это визуализируется как просветление "языков" пониженной плотности. [13]
На ультразвуковом снимке относительно окостеневшие средняя и периферическая части диафиза визуализируются как линии низкой плотности. [10] С другой стороны, рядом с метафизом на поверхности наблюдается незначительная оссификация, изображение поверхности кости нечёткое, под диафизом с обеих сторон появляются "пояски". Всё это является специфической ультразвуковой картиной недостаточно "окрепших" костей при гипофосфатазии и не наблюдается при нормальном развитии плода. [24]
Описание характерных акустических дорожек
Ультразвуковой луч, прошедший через мягкие ткани и достигший поверхности кости, на 90% отражается от её поверхности, что отображается на ультразвуковом снимке в качестве линии низкой эхогенности (плотности). Однако в перинатальном периоде эпифиз практически не заметен и даже у нормально развивающегося плода не визуализируется на ультразвуковом снимке.
В основном у льтразвуковой луч отражается от поверхности кости, а сквозь кость проходит лишь его незначительное количество, поэтому обычно непосредственно под костью визуализируется большая область чёрного цвета, кроме которой больше ничего не видно. Это явление называется "акустическая тень". [18]
На современном оборудовании для ультразвуковых исследований, чтобы визуализировать на снимке область чёрного цвета, находящуюся непосредственно под костью, определяют сильную отражающую волну, после чего автоматически усиливают возвращающийся ультразвуковой сигнал и пытаются визуализировать структуру, которая скрывается в акустической тени. [2] На ультразвуковом снимке длинных трубчатых костей при гипофосфатазии с обеих сторон диафиза в нижней части видны дорожки. Предполагается, что это происходит из-за того, что усиливается ультразвуковой сигнал от метафиза, через который проходит относительно большое количество ультразвуковых лучей. [21]
Диагностика детской и взрослой гипофосфатазии
В более старшем возрасте диагноз можно заподозрить по клиническим проявлениям.
При подозрении на гипофосфатазию определяется уровень щелочной фосфатазы в крови. Приняты следующие нормы щелочной фосфатазы:
Гипофосфатемия
Гипофосфатемия - это патологическое состояние, характеризующееся снижением концентрации в плазме крови неорганического фосфора ниже 0,9 ммоль/л. Причин гипофосфатемии может быть множество: недостаточное поступление с пищей, заболевания почек, околощитовидных желез и т.д. Основные клинические проявления включают мышечную слабость, вплоть до паралича, и расстройства высшей нервной деятельности в виде заторможенности, сонливости. Диагноз устанавливается на основании определения уровня фосфатов в крови. В качестве лечения проводится восполнение дефицита фосфатов и терапия основного заболевания.
Фосфор (P) является внутриклеточным анионом. Наряду с кальцием, P составляет минеральную основу костной ткани, необходим для синтеза молекул АТФ (главного «энергоносителя»), а также выполняет важную роль в поддержании кислотно-щелочного равновесия крови. В организм человека фосфор поступает с пищей. Его суточная потребность равняется 1000-1200 мг. Гипофосфатемия отмечается у 2% больных, находящихся в стационаре. Среди госпитализированных пациентов, страдающих алкоголизмом, это состояние встречается чаще (у 10%).
Причины гипофосфатемии
Гипофосфатемия, особенно, клинически значимая, в большинстве случаев развивается вследствие влияния множества факторов, т.е. является полиэтиологичной. Ниже представлены причины гиперфосфатемии, сгруппированные по механизму действия на различные этапы фосфорного обмена:
- Избыточная экскреция. Потеря фосфатов с мочой наблюдается при первичных тубулопатиях (синдром Фанкони), почечном канальцевом ацидозе, отравлении тяжелыми металлами. Также почечная экскреция P увеличивается при первичном гиперпаратиреозе, эктопической секреции паратиреоидного гормона, дефиците витамина Д, длительном приеме мочегонных лекарственных средств (фуросемида).
- Недостаточное экзогенное поступление. Так как фосфор широко представлен во многих пищевых продуктах, его алиментарная недостаточность может возникнуть только в условиях длительного недоедания или голодания, что часто встречается при хроническом употреблении алкоголя и нервной анорексии.
- Нарушение усвоения в ЖКТ. Некоторые лекарственные препараты способны связывать P, тем самым затрудняя его всасывание в тонком кишечнике. К таким препаратам относятся антациды (гидроокись алюминия, гидроксид магния). Недостаточное усвоение фосфатов происходит при длительной диарее и повторяющейся рвоте.
- Трансмембранный переход. Перемещение ионов фосфора из экстрацелюллярного пространства внутрь клетки наблюдается при респираторном алкалозе (сдвиге pH в щелочную сторону), в фазе нормализации уровня гликемии после интенсивного лечения диабетического кетоацидоза.
К более редким причинам гипофосфатемии можно отнести:
- «синдром возобновленного кормления» (рефидинг-синдром) после длительного голодания;
- интенсивное парентеральное питание;
- «синдром голодных костей» после хирургического лечения первичного гиперпаратиреоза;
- состояние после трансплантации печени, почек;
- гипофосфатемический рахит;
- опухоли, секретирующие фосфатонины (вещества, стимулирующие фосфатурию), например, фактор роста фибробластов-23 (FGF-23);
- прием вальпроатов, противотуберкулезных лекарственных средств, глюкокортикостероидов.
Патогенез
Падение концентрации неорганических фосфатов приводит к снижению образования молекул АТФ, в результате чего возникает гипоэнергетическое состояние. Наиболее неблагоприятный эффект это оказывает на органы с высокой энергетической потребностью - центральную нервную систему, скелетные мышцы и миокард. Гипофосфатемия вызывает стремительную деминерализацию костей, дисфункцию остеобластов.
При низком содержании P истощаются запасы 2,3-дифосфоглицерата в эритроцитах, из-за этого повышается сродство гемоглобина к кислороду и затруднение его передачи клеткам и тканям. Также вследствие дефицита внутриклеточного АТФ ухудшается пластичность эритроцитов, они становятся более чувствительными к повреждениям в капиллярном русле и могут подвергнуться гемолизу. При крайне выраженной гипофосфатемии происходит дисфункция тромбоцитов и лейкоцитов.
Классификация
По степени выраженности различают 2 вида гипофосфатемии:
- Умеренную. Уровень фосфатов от 0,32 до 0,9 ммоль/л.
- Тяжелую. Содержание фосфатов ниже 0,32 ммоль/л.
По скорости развития различают острую и хроническую гипофосфатемию. Степень выраженности и острота состояния имеют важное значение для дифференциальной диагностики этиологического фактора.

Симптомы гипофосфатемии
Клиническая картина зависит от времени наступления и степени выраженности истощения запасов P в организме. Медленно развивающаяся хроническая гипофосфатемия зачастую протекает абсолютно бессимптомно. Иногда таких пациентов может беспокоить незначительная мышечная слабость, проявляющаяся при выполнении физических нагрузок.
При длительном течении могут присоединиться ноющие боли в костях. Яркая симптоматика присуща остро возникшей тяжелой гипофосфатемии. Мышечная слабость более выражена, даже обычные движения, такие как ходьба, затруднены. Из-за слабости диафрагмы наступает гипервентиляция (одышка), в дыхании начинает участвовать вспомогательная мускулатура.
Появляются расстройства ЦНС - заторможенность, сонливость, ухудшение концентрации внимания. У некоторых больных наблюдаются моторные дисфункции - нарушение координации движения, походки, тремор рук. Острые психические эпизоды у больных хроническим алкоголизмом (бред, слуховые, зрительные галлюцинации) напоминают таковые при алкогольном абстинентном синдроме.
Осложнения
Тяжелая острая гипофосфатемия вызывает большое число неблагоприятных последствий. Выраженное ослабление скелетной мускулатуры особенно пагубно сказывается на дыхании, у части больных развивается острая дыхательная недостаточность. Также вследствие миопатии затрудняется глотание, что увеличивает риск аспирационной пневмонии. Повышается судорожная активность головного мозга, возможны эпилептоподобные припадки.
Усугубляется нарушение сознания, вплоть до супора и впадения в коматозное состояние. Значительное снижение сократительной способности миокарда приводит к острой или застойной сердечной недостаточности. В редких случаях возможен рабдомиолиз. При хронической гипофосфатемии происходит остеомаляция, из-за чего часто возникает искривление костей, деформации конечностей и позвоночника, случаются патологические переломы.
Диагностика
Так как гипофосфатемия имеет широкий спектр этиологических факторов, то курацией пациентов с данным расстройством занимаются врачи различных специальностей. Чаще такие больные находятся под наблюдением нефрологов, эндокринологов, реаниматологов. Концентрация фосфора исследуется в сыворотке при биохимическом анализе.
Заподозрить данное состояние можно при общем осмотре пациента (О- или Х-образное искривление конечностей, гипервентиляция, ослабленный тонус мышц). Также на основе физикальных данных иногда удается предположить причину развития гипофосфатемии (гиперемия и телеангиэктазии на лице, желтушность кожи, слизистых, увеличение размеров печени при хроническом алкоголизме; кахексичный внешний вид при гиперпаратиреозе, особенно эктопическом).
Помощь в установлении причины оказывают анамнестические данные: прием лекарственных препаратов (диуретиков, антацидов), перенесенные хирургические операции. Для подтверждения диагноза и определения этиологического фактора назначается следующее обследование:
- Общий анализ крови. При тяжелой гипофосфатемии в клиническом анализе крови отмечается снижение уровня гемоглобина, содержания эритроцитов, тромбоцитов. При микроскопии мазка крови находят фрагменты эритроцитов (шизоциты), деформацию клеток (стоматоцитоз, микросфероцитоз).
- Биохимический анализ крови. В БАК выявляются маркеры костной деструкции (повышение показателей щелочной фосфатазы), гемолиза (увеличение содержания непрямого билирубина, лактатдегидрогеназы), алкогольного поражения печени (АЛТ, АСТ, ГГТП). Для подтверждения хронического алкоголизма определяется уровень углеводдефицитного трансферрина (CDT).
- Анализ мочи. В моче обнаруживается увеличение содержания фосфатов, наличие большого количества фосфатных кристаллов. При тубулопатиях отмечается глюкозурия, аминоацидурия, бикарбонатурия.
- Определение канальцевой реабсорбции фосфатов. Это наиболее информативный показатель потерь P с мочой. Для расчета необходимо измерить уровень креатинина и фосфора в сыворотке и моче. Его результаты используются при дифференциальной диагностике причин гипофосфатемии.
- Обследование на гиперпаратиреоз. У больных с гиперпаратиреозом в крови повышена концентрация паратиреоидного гормона (ПТГ), ионизированного кальция. На УЗИ или КТ околощитовидных желез обнаруживаются узловые или опухолевые образования (аденомы).
- Денситометрия. Остеоденситометрия (DEXA) показывает снижение минеральной плотности костной ткани (Т-критерий от -1,0 и ниже).

Лечение гипофосфатемии
Пациенты с умеренной бессимптомной формой этого состояния или с незначительными клиническими признаками могут проходить лечение амбулаторно. Больные с тяжелой острой гипофосфатемией подлежат обязательной госпитализации в стационар. ЛС, вызывающие снижение в крови уровня фосфатов, должны быть немедленно отменены и заменены на альтернативные препараты.
В терапии данного расстройства преследуют 2 главные цели: лечение основного заболевания, на фоне которого развилась гипофосфатемия (удаление паращитовидных желез при гиперпаратиреозе, коррекция алкалоза, назначение бикарбонатов и синдроме Фанкони и пр.) и восполнение фосфатного дефицита. Для выполнения последнего существуют следующие меры:
- Диета. Зачастую при умеренном дефиците достаточно назначения полноценного питания с включением продуктов, богатых фосфором (мясо, рыба, молочные продукты). Особое внимание организации питания необходимо уделить при предшествующем длительном голодании. Общий калораж стоит увеличивать постепенно, во избежание рефидинг-синдрома, который может резко усугубить гипофосфатемию.
- Лекарственная терапия. В более тяжелых ситуациях применяются пероральные либо парентеральные препараты, содержащие P - фосфаты натрия и калия.
Прогноз и профилактика
Умеренная гипофосфатемия имеет благоприятный прогноз и никак не влияет на продолжительность жизни человека. Тяжелая и остро возникшая гипофосфатемия нередко может привести к летальному исходу. Нередко она определяет исход у больных, которые находятся в критическом состоянии. Чаще всего причиной смерти становятся дыхательная недостаточность вследствие паралича диафрагмы, сердечная недостаточность, нарушения ритма сердца, кома.
Первичная профилактика сводится к своевременной диагностике и лечению тех заболеваний и состояний, которые могут послужить фоном для развития гипофосфатемии. Также для предупреждения данного расстройства, рекомендуется регулярный мониторинг концентрации P у пациентов с хронической почечной недостаточностью, находящихся на заместительной почечной терапии (гемодиализ), и принимающих фосфатбиндеры.
1. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
2. Homeostasis сalcium and phosphorus/ Avner E, Harmon W, Niauted P, Yoshikama N.// Pediatric Nephrology. - 2009. - Vol 1.
3. Approach to treatment of hypophosphatemia/ Felsenfeld A.J., Levine B.S.// Am J Kidney Dis. - 2012. - Oct; 60 (4).
Гипофосфатазия
В настоящем обзоре рассмотрены этиология, патогенез, клинические признаки гипофосфатазии, а также методы диагностики и лечения с акцентом на взрослых.
Актуальные проблемы
Специализации
- Premium
- Аллергология
- Бронхопульмонология
- Вакцинопрофилактика
- Гастроэнтерология
- Гепатология
- Гинекология
- Дерматовенерология
- Иммунология
- Инфекции
- Кардиология
- ЛОР-патология
- Медтехника
- Неотложная помощь
- Нутрициология
- Онкология
- Педиатрия
- Психоневрология
- Ревматология
- Сезонная аллергия
- Терапия
- Уронефрология
- Фармакология
- Эндокринология
- ИТ в здравоохранении
Календарь событий:
Вебинар «Тревога и сердечно-сосудистые заболевания» дата окончания: 26 Октября 2022 Место проведения: Онлайн
V Всероссийский форум «Россия - территория заботы» дата окончания: 03 Ноября 2022 Место проведения: Онлайн
Читайте также:
- Переломы (травмы) голеностопного сустава. Классификация, диагностика и лечение
- Электрокардиография плода при переношенной беременности. Гормоны, гормональные тесты при переношенности.
- Атрезия и гипоплазия. Объем циркулирующей крови. Объем кровотока и величина шунта.
- Тендинит ахиллова сухожилия
- Массивная стимуляция симпатической нервной системы. Стимуляция парасимпатической нервной системы
