Гистологические срезы. Техника выполнения гистологических срезов
Добавил пользователь Alex Обновлено: 28.01.2026
Существует множество причин для исследования клеток и тканей человека. Медицинские и биологические исследования опираются на знания о стандартном строении и функционировании клеток и тканей, и структур, которые они составляют. В здоровом состоянии клетки и другие тканевые элементы организованы на основе постоянных и узнаваемых форм. Изменения, вызываемые воздействием широкого спектра химических и физических факторов, выражаются в структурных изменениях на микроскопическом уровне. Для многих заболеваний характерны структурные и химические аномалии, отличающиеся от нормального состояния. Выявление этих изменений и привязка их к конкретным заболеваниям является основой патогистологии и цитопатологии, важными специальностями современной медицины. Микроскопия играет важную роль в гематологии (исследования крови), микробиологии (изучение микроорганизмов, в том числе паразитов и вирусов), и в более широком смысле в областях биологии, зоологии и ботаники. Во всех этих дисциплинах образцы изучаются с помощью микроскопа.
Микроскопия
Существует много различных видов микроскопии, но наиболее часто используемый - это светлопольная микроскопия, в которой образцы просвечиваются пучком света, проходящим через них (в отличие от пучка электронов в электронной микроскопии). Общие требования к образцам для наиболее эффективного исследования с помощью светлопольной микроскопии:
- Клетки и другие элементы в образце должны храниться в «жизнеподобном» состоянии (данный процесс называется «фиксация»);
- Образец должен быть прозрачным, нежели светонепроницаемым, для того, чтобы свет мог проходить через него;
- Образец должен быть тонким и плоским, то есть должен присутствовать только один слой клеток;
- Некоторые компоненты должны быть дифференциально окрашены, так они смогут быть четко различимы.
Способы подготовки
Из-за требований микроскопии подготовка образцов ограничена следующими способами:
- Целостное закрепление образца, при котором весь организм является достаточно небольшим и тонким для того, чтобы быть размещенным непосредственно на предметном стекле микроскопа;
- «Сплющивание» образца, при котором клетки специально сплющены на предметном стекле для того, чтобы раскрыть их содержание (например, растительные образцы, где клетки разрушаются для выявления хромосом);
- Мазки, где образец состоит из клеток, находящихся в жидкости (например, в крови, сперме или спинномозговой жидкости), или где отдельные клетки соскребаются с поверхности или аспирируются (всасываются) из органа (эксфолиативная цитология). Мазки являются основой известного теста Папаниколау, используемого для выявления рака шейки матки у женщин;
- Резка, при которой образцы удерживаются таким образом, чтобы была возможность отрезать от них тонкие фрагменты, закрепить на предметном стекле и окрасить. Фрагменты подготавливаются с использованием специального прибора - микротома
Из всех этих вариантов только целостное закрепление и резка позволяют сохранить структурные связи между отдельными клетками и внеклеточными компонентами. Мазки и сплющивание предоставляют детальные сведения об отдельных клетках и относительном числе клеток, однако структурные связи утрачиваются. Подготовка срезов является технически наиболее сложным из этих методов, так как требует специализированного оборудования и значительного опыта. Микроскопическое исследование срезов патологоанатомами является краеугольным камнем в диагностике рака. Хотя методика подготовки срезов из животного и растительного материала одинакова, последующее описание относится к тканям животных (человека).
Подготовка срезов
Самая свежая ткань является очень чувствительной к воздействиям, легко подверженной к деформациям и повреждениям, и поэтому невозможно подготовить тонкие фрагменты (срезы), если образец не поддерживается во время резки. Также обычно образец нуждается в «фиксации» перед подготовкой срезов. В целом существуют две стратегии, которые могут быть использованы для того, чтобы обеспечить эту поддержку.
- Ткани могут быть быстро заморожены и поддерживаться в таком состоянии во время резки с использованием криостатного микротома (микротом в морозильной камере). Такие фрагменты называются «замороженными срезами». Замороженные срезы могут быть подготовлены очень быстро, и поэтому используются, когда интраоперационное исследование необходимо для проведения хирургических процедур или тогда, когда необходимо избежать любого вмешательства в химический состав клеток (как при некоторых гистохимических исследованиях).
- В качестве альтернативы, образцы могут быть пропитаны жидким веществом, которое впоследствии может быть преобразовано в твердое тело, обладающее необходимыми физическими свойствами, что позволит отрезать от него тонкие фрагменты. Используются различные вещества для пропитки и поддержки образцов, в том числе эпоксидная смола и смолы метакрилата, но гистологический парафин является самым популярным средством для обычной световой микроскопии. С его помощью получают так называемые «парафиновые срезы». Такие срезы обычно подготавливаются с использованием роторного микротома. Слово «роторный» описывает способ резки данного инструмента. Во всех гистопатологических лабораториях парафиновые срезы подготавливают почти из всех образцов и используют в диагностике.
В нижеследующих пунктах описываются основные шаги при подготовке парафиновых срезов. Эти шаги в целом диктуют план и рабочий процесс в крупных, специализированных гистопатологических лабораториях, где ежедневно обрабатываются сотни образцов.

Рис. 1. Срез для диагностики подготавливается с помощью криостатного микротома. Срез, полученный из мгновенно замороженной ткани снимается на теплое стекло, где он будет незамедлительно зафиксирован и окрашен.

Рис. 2. Роторный микротом используется для подготовки парафиновых срезов. На переднем плане лента из срезов «выходит» готовой для крепления к стеклу микроскопа.
Получение образцов
Образцы, полученные для гистологического исследования, могут происходить из ряда различных источников. Они варьируются от очень крупных экземпляров или целых органов до крошечных фрагментов ткани. Например, ниже приводятся несколько типов образцов обычно получаемыми в гистопатологических лабораториях.
- Удаленные образцы (хирургическая биопсия), где целые органы или поврежденные участки удаляются при операции;
- Образцы, полученные с помощью инцизионной биопсии, где для диагностики ткань забирается с пораженного участка;
- Образцы, полученные с использованием щипковой биопсия, при которой используется круговое лезвие для того, чтобы удалить небольшой участок подозрительной ткани для исследования (часто из кожи);
- Скарификационная биопсия, где маленькие фрагменты ткани срезаются с поверхности (как правило, кожи);
- Кюретажная биопсия, при которой маленькие кусочки ткани удаляются со слизистой оболочки матки или шейки матки;
- Сердцевинная биопсия, когда небольшой образец удаляется с помощью специальной иглы, иногда через кожу (перкутанно).
Образцы обычно получают в фиксаторе (консерванте), но иногда они поступают свежими и должны быть незамедлительно зафиксированы. До того, как образцы будут приняты в лаборатории, маркировки и сопроводительные документы тщательно проверяются, все детали записываются, и начинается "отслеживание образца".
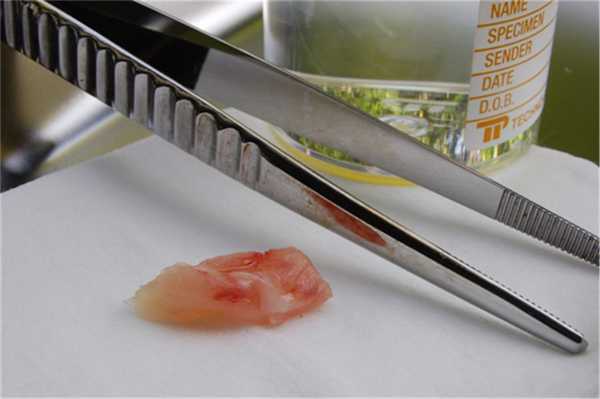
Рис. 3. Свежие, незафиксированные образцы после хирургического удаления. Чтобы предотвратить дегенерацию или высыхание образца, он должен быть зафиксирован как можно скорее.
Фиксация
Фиксация является важнейшим шагом в процессе подготовки образцов для микроскопического исследования. Ее цель заключается в предотвращении процесса разрушения и сохранении клеток и тканей в «жизнеподобном» состоянии. Это происходит путем остановки активности ферментов, уничтожения микроорганизмов и затвердевания образца при сохранении достаточной молекулярной структуры, позволяющей использовать необходимые методы окрашивания (в том числе с применением реакции антиген-антитело и других реакций, в зависимости от сохранения ДНК и РНК). Чем раньше начат процесс фиксации после отделения образца от кровоснабжения, тем лучше будет результат. Самый популярный фиксирующий агент - это формальдегид, обычно в форме натрий-фосфатного буфера (часто упоминается как «формалин»). В идеале образцы должны быть зафиксированы путем погружения в формалин на срок от шести до двенадцати часов, прежде чем они будут использоваться.

Рис. 4. Хирургические образцы в процессе фиксации в формалине. Обратите внимание, что объем консерванта значительно превышает размеры образцов. Кассета, в которой будут находиться образцы во время обработки, уже имеет маркер с идентификаторами пациента.
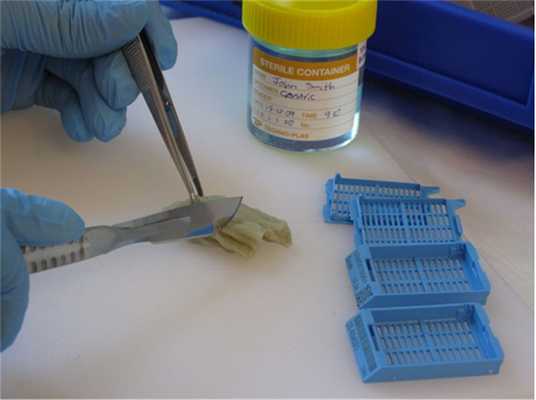
Рис. 5. Этот хирургический образец желудка был зафиксирован в формалине. Элементы толщиной около 4 мм теперь будут взяты из соответствующих областей и помещены в маркированные кассеты для обработки.
Обработка
Для больших партий образцов, подготовка «парафиновых срезов» автоматизирована с помощью инструмента под названием «тканевый процессор». Эти инструменты позволяют образцам последовательно пропитываться различными растворителями и расплавленным парафином, завершающим данный процесс. В начале образцы находятся в водной среде (на водной основе) и должны пройти через несколько преобразований: обезвоживание и очистка растворителями (как правило, этанолом и ксилолом), прежде чем быть помещенными в расплавленный воск (который является гидрофобным и не смешивается с водой). Длительность и детали промежуточных шагов «плана обработки» для конкретной партии будут зависеть от происхождения и размера образцов. План может быть, как один час для небольших образцов, так и двенадцать часов или более для больших образцов. Во многих лабораториях основная обработка проводится ночью. Из-за стремления улучшить рабочий процесс и сократить сроки, в настоящее время оказывается заметное давление на лаборатории с целью использовать процессоры, способные производить быструю обработку.


Рис. 6. Тканевый процессор загружается корзиной с кассетами, содержащими образцы ткани для обработки. Подробные сведения о процессе обработки и план отображаются на экране процессора.
Заливка
После обработки образцы помещаются в заливочный центр, где они извлекаются из кассет и помещаются в формы, заполненные парафином. На этом этапе образцы аккуратно ориентируются, потому что это будет определять плоскость, через которую они будут разрезаны на фрагменты, а также определять, будут ли аномальные зоны видны через микроскоп. Кассеты, в которых производилась обработка, содержат данные для идентификации образцов, и теперь они помещаются сверху формы и закрепляются добавлением парафина. Блоку образцов дают затвердеть на холодной поверхности, а затем форма снимается. Кассеты, заполненные парафином, являются неотъемлемой частью блока и обеспечивают устойчивую основу для зажима в микроскопе. Блок, содержащий образец, готов для резки на фрагменты.

Рис. 7. Заливочный центр помогает оператору, так как объединяет холодную панель, горячую панель и контролируемый поток расплавленного парафина.
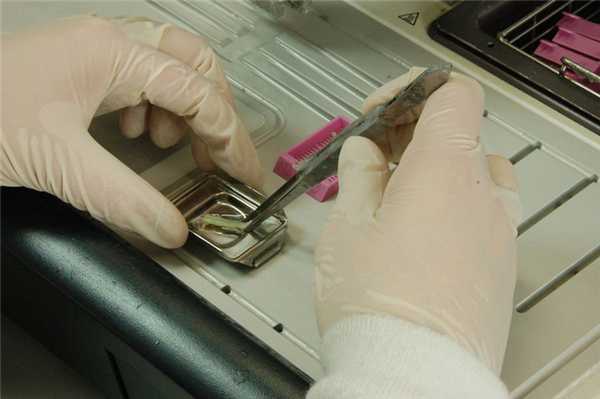
Рис. 8. Образец желудка размещен и ориентирован в заливочной форме на горячей панели заливочного центра.

Рис. 9. Блок готов для микротомии. Образец желудка, который был обработан и залит, готов к подготовке срезов с помощью микротома. Бледно-синяя кассета была использована для того, чтобы держать образец во время обработки, и сейчас является частью «блока». Она будет зажата в держателе образца, и фрагменты будут отрезаны от лицевой части блока.
Резка
Фрагменты отрезаются с помощью высокоточного инструмента, называемого «микротом», который использует очень тонкие стальные лезвия. Парафиновые срезы обычно отрезают при толщине в 3-5 мкм, гарантируя, что срез состоит только из одного слоя клеток (красные клетки крови имеют диаметр около 7 мкм). Одним из преимуществ парафина, как заливочного агента, является то, что при резке фрагменты будут держаться вместе от края до края, образуя «ленты» из срезов. Это делает обработку проще.
Теперь срезы «выходят» на поверхность теплой воды в флотационной ванне для того, чтобы разгладить их, а затем снять на предметные стекла микроскопа. После тщательной просушки они готовы к окрашиванию.

Рис. 10. Лента со срезами отрезается от парафинового блока с помощью роторного микротома. Обратите внимание, что срезы толщиной 4 мкм (4/1000 миллиметра) показывают малую деформацию и разрушение.

Рис. 11. Парафиновый срез устанавливается на стекло микроскопа после теплой воды, использованной для разглаживания.
Окрашивание
Помимо нескольких естественных пигментов, таких как меланин, клетки и другие элементы, составляющие большинство образцов бесцветные. Для того, чтобы выявить структурные детали с помощью светлопольной микроскопии, используются некоторые способы окрашивания. Окраска гематоксилином и эозином (H&E) повсеместно используется как отправная точка для предоставления важнейшей структурной информации. С помощью этого метода ядра клетки окрашиваются синим, а цитоплазма и многие дополнительные клеточные компоненты окрашиваются в оттенки розового. В гистопатологии многие состояния могут быть выявлены путем исследования только H&E.Однако иногда требуется дополнительная информация для того, чтобы обеспечить полную дифференциальную диагностику, а это требует дальнейшего, более специализированного метода окрашивания. Это могут быть «специальные пятна», сделанные с помощью красителей или металлических вкраплений для определения конкретной структуры микроорганизмов, или это могут быть иммунно-гистохимические методы, охватывающие расположение диагностически полезных белков с помощью отмеченных антител. Молекулярные методы, такие как гибридизация in-situ (ISH), также могут быть необходимыми для выявления специфических последовательностей ДНК или РНК. Все эти методы могут быть применены на парафиновых срезах, и в большинстве случаев полученные срезы полностью стабильны и могут храниться в течение многих лет.
После окрашивания, срезы покрываются покровным стеклом, после чего отправляются к патологоанатому, который будет рассматривать их под микроскопом, чтобы поставить правильный диагноз и подготовить отчет.
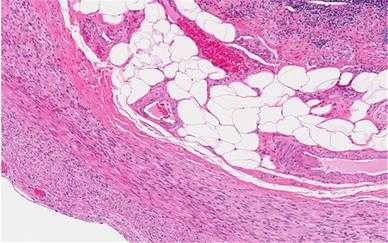
Рис. 12. Окраска гематоксилином и эозином. Это микроскопическое изображение (микрофотография) парафинового среза стенки человеческого аппендикса, полученное с помощью светлопольной микроскопии. Клетки окрашены синим цветом, а гладкие мышцы, коллаген и другие компоненты открашены в оттенки розового. Большие пустые пространства относятся к жировым клеткам, жиры были растворены во время обработки.

Рис. 13. Стойка для парафиновых срезов загружается в автоматизированный инструмент для окраски гематоксилином и эозином. Этот инструмент позволит окрасить элементы, а прилегающая система по подготовке срезов приложит покровное стекло, чтобы сохранить их и обеспечить оптимальные оптические условия для микроскопии.
Geoffrey Rolls
Geoffrey Rolls, консультант по гистологии, Leica Biosystems, Мельбурн, Австралия, имеет большой практический опыт и опыт в преподавании гистологии и гистотехнологии, в том числе 30 лет в качестве старшего преподавателя кафедры лабораторной медицины университета RMIT в Мельбурне, Австралия. Он имеет научную степень и профессиональное членство в австралийском Институте молодых ученых. Имеет большой интерес к гистотехнологии, особенно в областях обработки тканей, микротомии и общего образования по гистологии. В последние десять лет он выступал в качестве консультанта для Leica Biosystems.
Статьи
Прецизионный хирургический микроскоп Leica M530 OHX для нейрохирургии и пластической реконструктивной хирургии
Гистологические срезы. Техника выполнения гистологических срезов
Содержание темы
В гистологии, цитологии и эмбриологии существует много методов исследования.
Здесь рассматриваются лишь те, которые связаны со световой и электронной микроскопией мёртвых (фиксированных) клеток и тканей .
1.1. Световая микроскопия
1.1.1. Устройство микроскопа
1. Оптическая система включает объектив и окуляр.
а ) Объектив (1) - это система линз, вставляемая в тубус (2) снизу и непосредственно направляемая на объект (отсюда - и название).
Обычные увеличения объектива:
8 , 20 , 40 (сухие объективы),
Схема - строение светового микроскопа.
б) Окуляр (3) вставляется в тубус сверху. Применяются окуляры с увеличением
7, 10, 15.
в) Результирующее увеличение микроскопа - произведение увеличений объектива и окуляра, например:
г) Таким образом, функция оптической системы -
формирование увеличенного изображения препарата на сетчатке глаза наблюдателя.
а) Источник света (4) может быть встроен в микроскоп, а может находиться и вне микроскопа (пример - обычная настольная лампа).
Одна поверхность зеркала - плоская, вторая - вогнутая;
последняя используется при искусственном освещении.
в) Конденсор (6) состоит из линз, которые фокусируют лучи света на препарате. Поднимая и опуская конденсор (с помощью винта), можно настраивать фокусировку лучей.
г) Диафрагма (7) вмонтирована в конденсор; это система непрозрачных пластинок с отверстием посередине.
Она ограничивает световой поток, падающий на препарат.
При использовании объективов с большим увеличением отверстие диафрагмы следует уменьшить - для ослабления сферической аберрации.
а) С колонкой связаны макро- и микрометрический винты .
Макровинт используется при работе на малом увеличении,
а микровинт - на большом.
источник света (4) зеркало (5) конденсор (6) диафрагма (7)
препарат объектив (1) тубус (2) окуляр (3) .
1.1.2. Приготовление гистологического препарата
а) срезы органов (толщиной 5-15 нм),
б) мазки (крови, костного мозга и т.д.) и отпечатки (напр., селезёнки),
в) плёнки (брюшины, мягкой мозговой оболочки), или тотальные препараты
Чаще всего используются срезы.
2. Приготовление препарата обычно включает 4 следующих этапа:
а) взятие и фиксация материала,
б) обезвоживание и уплотнение материала,
в) приготовление срезов,
г) окрашивание препаратов и заключение в консервирующую среду.
1.1.2.1. Взятие и фиксация материала
2. Фиксация производится для предупреждения процессов аутолиза (самопереваривания) тканей.
Это достигается путём денатурации (коагуляции) белков .
1.1.2.2. Обезвоживание и уплотнение материала
2. Предварительно образцы обезвоживают (иначе гидрофобный уплотнитель не сможет проникнуть в ткань).
а) Для этого их “проводят” по батарее спиртов -
70 % , 80 % , 96 % , 100 % этанол -
по 24 часа в каждом спирте.
б) Т.к. парафин не растворим и в этаноле, образцы выдерживают потом в смеси этанол-ксилол и в чистом ксилоле.
3. Заливка : помещают образцы в смесь ксилол-парафин и затем в жидкий парафин
Дают парафину, остывая, затвердеть;
вырезают из него блок с заключённым образцом и
закрепляют на деревянном кубике.
1.1.2.3. Приготовление срезов
1. Кубики вставляют в специальный прибор - микротом , - служащий для приготовления срезов.
2. а) С помощью микрометрической механической системы объектодержатель вместе с кубиком перемещается за каждый шаг на определённое расстояние (напр., 10 мкм).
б) А микротомный нож, направляемый под углом к поверхности парафинового блока, срезает с него тонкой слой органа (срез) заданной толщины.
1.1.2.4. Окрашивание препаратов и заключение в консервирующую среду
ксилол, спирт 100 %, 96 %, 80 %, 70 %, 60 %, вода (по 2-5 мин)
(Этот ряд кончается водой в том случае, если затем используется водорастворимый краситель.)
2. Для окрашивания предметные стёкла со срезами
помещают на короткое время в раствор красителя,
промывают водой,
обрабатывают раствором другого красителя (если таковой используется тоже) и
вновь промывают водой.
3. Препарат
опять обезвоживают (проводя по батарее спиртов с возрастающей концентрацией),
а затем просветляют (в карбол-ксилоле и ксилоле) - для удаления лишней краски.
1.1.2.5. Мазки и тотальные препараты: особенности приготовления
2. В подобных случаях, а также при приготовлении мазков, из 4-х перечисленных в п. 1.1.2. этапов опускаются два -
уплотнение материала и
приготовление среза (с последующим освобождением от уплотнителя).
фиксация,
окраска и
заключение в консервирующую среду.
В остальных же случаях (т.е. при получении срезов) приготовление гистологического препарата - весьма долгая и трудоёмкая процедура.
Но при правильном её выполнении полученный препарат может храниться неопределённо долгое время.
1.1.3. Методы окрашивания гистологических препаратов
1.1.3.1. Типы красителей
Все красители, используемые в гистологической технике, подразделяются на 3 типа.-
эозин (искусственная краска; название - от греч. эос - заря);
гематоксилин
(точнее, продукт его окисления - гематеин);
Существует большое количество различных способов окраски.
Те из них, которые встречаются в нашем курсе, перечислены ниже.
1.1.3.2. Общие методы окраски
б) Сочетает основной и кислый красители.
в) Поэтому позволяет выявить почти все клетки и многие неклеточные структуры.
2. Ядра пр иобретают сине-фиолетовый цвет,
цитоплазма - желтовато-розовый цвет.
предварительно обрабатывают (протравляют) железноаммиачными квасцами,
а потом обрабатывают гематоксилином.
2. Структуры приобретают коричневато-серый цвет.
3. Хорошо выявляются
структуры ядра,
границы клеток,
мышечные волокна.
1.1.3.3. Выявление неклеточных структур соединительной ткани
а) Краситель - смесь растворов пикриновой кислоты и кислого фуксина.
1. Краситель является трёхцветным: это смесь
кислого фуксина,
анилинового синего,
оранжевогo G,
а также двух кислот.
2.а ) Коллагеновые волокна соединительной ткани окрашиваются в тёмно-синий цвет ;
1. а) Препарат обрабатывают аммиачным раствором серебра, а затем - восстановителями.
б) В итоге, выделяющееся серебро осаждается на определённых волокнах соединительной ткани. -
Эластические волокна соединительной ткани окрашиваются в тёмно-красный цвет ;
Эластические волокна окрашиваются пикриновой кислотой в жёлтый цвет ,
коллагеновые волокна - в красный цвет ,
1. Используется для окраски костей и дентина.
2. а) Предварительно кусочки материала
подвергают декальцинации (с помощью кислоты),
а затем выдерживают в растворе алюмокалиевых квасцов.
б) Краситель - раствор тионина.
3 . а) Стенки костных полостей и канальцев (выстланные сетью коллагеновых волокон) окрашиваются в тёмно-коричневый цвет;
1.1.3.4. Окраска клеток соединительной ткани и крови
б) Отличия же от приготовления срезов таковы:
фиксацию мазков проводят чистым метанолом ;
окрашивание продолжают всего 30-45 мин, а не 12-14 ч;
для заключения под покровное стекло используют кедровое масло, а не канадский бальзам.
2. Эритроциты приобретают бледко-красный цвет,
цитоплазма лейкоцитов - голубой или синий цвет,
1.1.3.5. Выявление элементов нервной системы
Фиксацию материала в формалине проводят не менее 7 дней .
Уплотнение образца осуществляют не путём заливки в парафин (или целлюлозу), а путём замораживания .
Срез готовят на специальном замораживающем микротоме.
2. При окрашивании срез последовательно обрабатывают растворами
азотнокислого серебра,
формалина,
аммиачного серебра.
1.1.4. Гистохимические методы исследования
а) Гистохимические методы основаны на специфической реакции между химическим реактивом и определённым компонентом препарата.
б) Образующийся продукт реакции имеет окраску, отличную от окраски исходного реактива.
1. Реактив (как отмечалось, - смесь двух красителей:
метилового зелёного и пиронина.
2. а ) А. Пиронин специфически окрашивает РНК в красный цвет .
Б. Поэтому на препарате ядрышки (в составе ядра) и рибосомбогатые участки цитоплазмы имеют красный цвет.
б) Другие структуры ядра (помимо ядрышек) - зелёные .
1. Основной реактив - фуксинсернистая кислота (реактив Шиффа).
1. Реактив - Ш ифф-пер и одная к ислота (выделенные буквы и составляют аббревиатуру ШИК ).
2. Периодат способствует образованию в субстрате альдегидной группы, которая взаимодействует с реактивом Шиффа.
1. При взаимодействии толуидинового синего с веществами, содержащими много кислотных групп, наблюдается метахромазия
- изменение окраски с синей на фиолетовую и красную.
2. Подобным свойством обладают, в частности, компоненты аморфного вещества соединительной ткани - гликозамингликаны
(являющиеся, как известно, гетерополисахаридами с высоким содержанием кислотных радикалов).
1.1.5. Просмотр препаратов
1.1.5.1. Срез; окраска гематоксилин-эозином
1. На снимке мы видим внутреннюю поверхность тонкой кишки с находящимися на ней кишечными ворсинками ( 1).
2. а) Ядра клеток (2) - базофильны и окрашены гематоксилином в фиолетовый цвет.
1.1.5.2. Тотальный препарат: окраска судан III - гематоксилином
1. а) Препарат является тотальным.
б) Это означает, что перед нами - не срез органа, а участок сальника, растянутого на предметном стекле.
1.1.5.3. Срез после декальцинации; окраска по Шморлю
1. В процессе изготовления препарата костный материал подвергнут декальцинации (п. 1.1.3.3).
2. Применённый метод окраски позволяет выявить
стенки костных полостей (1) и канальцев (2) , окрашивающиеся в тёмно-коричневый цвет благодаря высокому содержанию здесь коллагеновых волокон.
1.1.5.4. Срез; окраска по Маллори
1. В методе Маллори используются 3 красителя (п. 11.3.3), что делает картину многоцветной.
2. На снимке - женская половая клетка (ооцит), находящаяся в фолликуле яичника.
3. Цитоплазма (1) клетки окрашена в розовый ,
окружающая её блестящая оболочка (2 ) - в голубой ,
1.2. Электронная микроскопия
Если в световом микроскопе увеличение составляет 100-1000 раз,
то в электронном микроскопе - 10.000 -100.000 раз (и выше), т.е. примерно в 100 раз больше .
1.2.1. Принцип работы электронного микроскопа
1.2.1.1. Особенности:
электронная волна, электромагнитные "линзы"
Длина же электронной волны значительно меньше, чем световой.
Соответственно, такая волна “чувствует” меньшие препятствия: разрешающая способность микроскопа оказывается выше.
1.2.1.2. Ход лучей
1. а) Источником электронов служит катод (1) ,
а движущей силой - разность потенциалов между катодом и анодом (2).
б) Анод расположен вблизи катода и имеет отверстие посередине, через которое проскакивают электроны.
б) вторая катушка (5) - в качестве объектива (принимает лучи, расходящиеся от образца),
1.2.2. Особенности приготовления препарата
вначале глутаральдегидом (стабилизация белков),
затем - четырёхокисью осмия ( стабилизация фосфолипидов и контрастирование ткани).
Приготовление гистологических срезов
Изучение патологических процессов на клеточном и тканевом уровне производится при помощи микроскопических исследований. Гистологический метод исследования необходим для изучения строения и функции клеток в состоянии нормы, патологии и экспериментальном периоде. Для гистологического исследования берутся элементы тканей и органов. Толщина исследуемого образца не может превышать 1 см 3 .
Образцы тканей могут браться у человека сразу после смерти (чем быстрее, тем лучше) - аутопсия. Также материал может браться во время операции или непосредственно в диагностических целях при помощи специальных инструментов - биопсия.
Приготовление образцов
Приготовление образцов происходит в несколько этапов:
- Фиксация материала.
- Приготовление среза.
- Процесс окрашивания среза.
Суть фиксации материала заключается в остановке естественных процессов в тканях и клетках. Это необходимо для того, чтобы во время купировать процесс гниения и ферментативные изменения в структуре тканей.
В фиксируемых тканях за счет физико-химических процессов происходит свертывание (коагуляция) белков и липоидной составляющей. Это состояние позволяет тканям долго храниться в неизменном виде, без реакции на различные воздействия. Проще говоря, фиксация тканей проводится с целью сохранения прижизненной структуры биологического материала.
Для фиксации тканей применяются специальные жидкости (фиксаторы). Наиболее популярными фиксаторами можно назвать следующие варианты жидкостей:
- Формальдегид.
- Спирт (96, 100%).
- Осмиевая кислота.
Выше перечислены простые фиксаторы. Также для фиксации тканей применяются более сложные варианты фиксаторов (растворы):
- Спирт-формол.
- Жидкость Ценкера.
- Двухромовоокислый калий.
В списках указаны лишь некоторые виды применяемых фиксаторов. Продолжительность необходимого для фиксации образцов тканей периода может варьироваться от нескольких часов до суток. Длительность зависит от особенностей исследуемых образцов и типа выбранного фиксатора. После того как этап фиксации пройден необходимо произвести промывку материала (в течение нескольких часов) в проточной воде. Это делается для того чтобы освободить образцы от излишков фиксирующей жидкости и осадочной взвеси.

Мутные непрозрачные образцы не подходят для исследования. Такие кусочки материала не позволят получить необходимую информацию. Перед тем как приступить к одному из главных этапов - осуществлению среза, образцы промываются чистой водой в течение нескольких часов. Далее, материал подвергается процессу обезвоживания. Обезвоживание осуществляется при помощи проведения тканевого образца через спирты возрастающей крепости. Этот этап длительный. В каждом спирте кусочки материала находятся от 2-3 часов до суток.
После обезвоживания проводится заливка образцов. Этот этап необходим для уплотнения тканей и получения качественных блоков для исследования. Уплотнение проводится путем замораживания (срочная биопсия) или путем заливки парафином или целлоидином. Заливка парафином - достаточно длительная процедура (от 24 часов и дольше). Такой вариант уплотнения образцов используется для осуществления исследования в обычном режиме. Для лучшей визуализации отдельных структур тканей срезы окрашивают. Для окрашивания применяют специальные гистологические красители (кислые, основные, специальные).
Подготовленные к изучению образцы исследуют при помощи специального микроскопа.
Прежде чем приступить к изучению гистологического препарата необходимо убедиться, что последний полностью соответствует ряду обязательных требований:
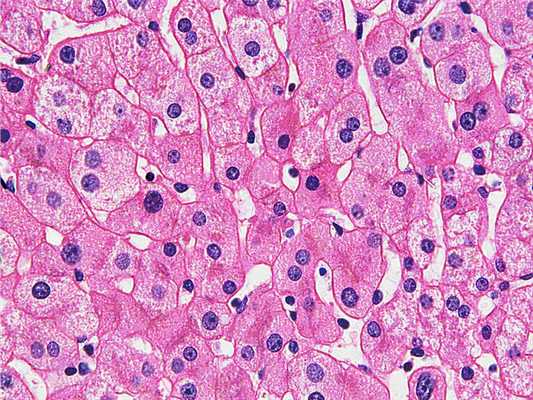
- В материале должны быть сохранены прижизненные структуры.
- Срез должен быть тонким и прозрачным.
- Структуры, которые требуется подвергнуть изучению должны быть четко визуализированы за счет окрашивания.
- Препараты должны иметь длительный срок хранения.
При качественном приготовлении препарата достичь соответствия всем перечисленным требованиям достаточно просто. Однако нельзя исключить возможность возникновения небольших погрешностей. Если вовремя распознать некоторые виды неточностей, купировать брак, создать качественный материал вполне возможно.
Самыми распространенными погрешностями при приготовлении срезов можно назвать следующие варианты:
- Крошение среза.
- Выпадение материала из парафиновой массы.
- Невозможность нарезки материала.
- Разрыв материала.
Те или иные погрешности могут возникать по разным причинам. Иногда в основе нарушения качества образца лежат ошибки во время изготовления. Для устранения каждой погрешности предусмотрены определенные алгоритмы действий.
Методы гистологического исследования
Для осуществления микроскопического исследования необходимы тонкие кусочки материала. Ширина таких кусочков измеряется в микрометрах. Для удобства получения таких срезов используются специальные приборы - микротомы. Конструкция этого прибора предусматривает возможность получения срезов толщиной 5-10 микрометров.
Основным методом исследования в гистологии является микроскопия. При помощи микротома можно изготавливать тончайшие срезы, подходящие для проведения микроскопических исследований. Получение среза происходит за счет движения ножа в одном направлении. Толщина среза задается на этапе срабатывания механизма подъема.
Для изготовления срезов из материала, залитого парафином или целлоидином, используют радиальный, ротационный или санный микротом.
Для получения среза с растительных или животных тканей могут применяться специальные замораживающие микротомы. Для микроскопического исследования используется несколько методов приготовления срезов. Для каждого из методов выбираются определенные виды микротомов и применяются определенные четкие алгоритмы действий.
Гистологические срезы бывают:
- Ступенчатые.
- Серийные.
- Горизонтальные.
Могут производиться срезы фиксированного и нефиксированного материала. Все зависит от характера исследуемых тканей и основных целей проведения означенного исследования. Также в гистологии существуют другие методы приготовления срезов.
Микротомы и их применение
Как уже было сказано выше, срезы в гистологии создаются при помощи специального устройства - микротома. В самом названии заложена расшифровка предназначения прибора - micros (маленький), tome (рассечение). Одним из самых используемых можно назвать санный микротом.
Название прибора произошло от принципа работы механизма, который базируется на подаче ножа с зажимом при помощи специальных салазок. Санный микротом предназначен для осуществления парафиновых срезов. Как правило, такой прибор работает с одноразовыми лезвиями или кассетами. Такой высокоточный микротом состоит из станины, механизма микроподачи, подъемного механизма, зажимов для блоков, ножедержателя.
Такой аппарат позволяет изготавливать срезы толщиной от 0,5 до 60 микрометров. Санный микротом отличается высокоточной регулировкой толщины среза. Функция подачи материала может быть механической или ручной. Данный прибор предназначен для осуществления рутинных исследований в области медицины, ботаники и биологии.
Ротационный микротом - прибор с неподвижным ножом и подвижным столиком. В приборе предусмотрена моторизованная подача образца. Этот микротом предназначен для использования в гистологической лаборатории для проведения исследований, направленных на решение гистологических и гистопатологических задач.
Для получения срезов с нефиксированных тканей или в тех случаях, когда необходимо срочное проведение исследования используются замораживающие микротомы. Такие приборы снабжены замораживающим столиком, на котором и закрепляется исследуемый образец. Главным правилом успешного получения гистологического среза при помощи микротома является правильный выбор угла наклона ножа и угла сечения. Наилучшим углом наклона является тот, при котором плоскость лезвия находится параллельно верхней части блока.
Если выбрать угол наклона больший, чем требуется, образуется риск, что срез будет крошиться. При меньшем угле наклона лезвие будет скользить по поверхности материала. Получение требуемого результата при таком положении ножа невозможно. Величина угла сечения зависит от характера исследуемого материала. Чем образец мягче, тем меньше будет угол резания. При обработке мягких блоков неплохим вариантом считается косое расположение ножа.
Резание на микротоме
Для приготовления срезов с парафинированных объектов или образцов, обработанных целлоидином, опять же чаще всего используют ротационный микротом.
Сначала блок подвергают обрезке. Это необходимо для устранения свободного парафина или другого уплотнителя. Если эту процедуру не произвести, срез может получиться неравномерным, морщинистым и, как следствие, малоинформативным. Также сморщивания можно избежать при помощи охлаждения исследуемого материала.
Далее, парафиновый блок прочно закрепляется в зажиме. Предварительно необходимо выверить правильный угол расположения ножа и выбрать необходимый угол резания. После этого нужно используя регулировку механизма подачи, установить блок так, чтобы его поверхность находилась от лезвия ножа на расстоянии 0,5-1 мм.
После осуществления подгонки проводится установка микрометрической шкалы для получения первых толстых срезов. После этого производится моделирование блока (срезка излишков парафина, предание прямоугольной формы). Заключительным этапом является выставление микрометрической шкалы на задуманную толщину и осуществление окончательной резки материала.
Оборудование для гистологической лаборатории
Гистология занимается изучением структурных основ заболеваний, позволяет определять клиническую морфологию патологических процессов и является важнейшим этапом на пути к постановке точного диагноза.
По сути, гистологическое исследование является теоретической стороной диагностического процесса, за счет которого определяется возможность получить всестороннюю картину заболевания на разных уровнях: системном, тканевом, клеточном, субклеточном, органном и др.
Сложно представить современную медицину без гистологии. Ведь микроскопическое изучение особенностей тканей дает возможность идентифицировать не только болезнь, но и ее характерные особенности.
Стоит ли говорить, что качество гистологических исследований напрямую зависит от оснащенности лаборатории и, конечно, от уровня квалификации специалистов-гистологов? Правильная организация рабочего места и современное оборудование лаборатории - это именно те несколько важных шагов, которые необходимо предусмотреть для успешного функционирования исследовательского звена. А, именно на качестве организации работы лаборатории базируется диагностика высокого уровня.
Рабочее пространство гистологов
Помещение, где проводятся исследования должно иметь достаточную площадь. Место каждого лаборанта- гистолога должно занимать не менее 60 х 120 см. Уровень искусственного и естественного освещения должен полностью соответствовать номам. Рабочие поверхности должны быть выполнены из специальных влагоустойчивых материалов. Под рукой у специалистов должны быть необходимые приспособления для организации верного фонового оттенка рабочей поверхности.
Рабочее место лаборанта должно всегда содержаться в идеальном порядке. В лаборатории должно быть организовано водоснабжение. Работникам исследовательского центра не должно составлять труда содержание в чистоте лабораторной посуды и инструмента. Для хранения инструмента и исследовательских образцов должны быть предусмотрены специальные места.
Лабораторная посуда и инструмент
Приготовление гистологических образцов - это достаточно кропотливый ответственный процесс, который требует не только соответствующей профессиональной подготовки, но и достаточного оснащения рабочего места специалиста - гистолога. Без необходимого гистологического инструмента и специальной лабораторной посуды едва ли удастся выполнить все пункты, предусмотренные для данного вида диагностической работы. Стоит начать с лабораторной посуды и инструмента.
В гистологической лаборатории в обязательном порядке должен быть следующий перечень предметов:

- Чашки петри - необходимый вид плоской лабораторной посуды, который применяется в процессе окрашивания гистологических срезов.
- Бюксы - специальные круглые емкости для обработки гистологических образцов и тканей.
- Банки на штативе с отведенной трубкой для дистиллированной воды.
- Кюветы - емкости, предназначенные для одновременного окрашивания нескольких образцов материала.
- Колбы - стеклянные емкости необходимые для хранения различных химических веществ или дистиллированной воды.
- Предметные и покрывные стекла - необходимы для размещения исследуемых образцов.
- Пипетки - предмет, необходимый для переноса красителей и некоторых других химических элементов на образцы.
- Кисточки - предмет, при помощи которого производится разравнивание и формирование правильного положения образца на предметном стекле.
- Стеклянные банки с широким горлом - емкости необходимые для хранения исследуемых материалов в фиксационном растворе.
К вышеописанному списку могут быть добавлены некоторые другие виды инструмента и лабораторной посуды. В указанном перечне перечислены лишь самые основные разновидности лабораторных предметов, необходимые для осуществления качественной исследовательской деятельности.
Гистологическое оборудование
Для четкой организации процесса гистологического исследования является важным качественный подбор необходимого оборудования. В каждой отдельной лаборатории имеется набор средств для автоматической обработки образцов. В зависимости от объемов и особенностей выполняемых задач перечень приборов может варьироваться.
Микротом

Одним из самых необходимых видов гистологического оборудования можно назвать микротом. Микротом - это специальное устройство, предназначенное для нарезки исследовательского материала. При помощи означенного устройства специалист имеет возможность приготовить образцы надлежащего качества. Основной задачей микротома является нарезка кусочков тканей для исследования заданной толщины. Процесс резанья на микротоме достаточно быстр, прост. Использование микротома значительно упрощает работу гистолога и увеличивает качественный уровень подготовки образцов.
Микротомы бывают разных типов:
- Санный;
- Ротационный;
- Замораживающий и др.
Гистологический автомат
Автоматы для гистологии - это сложные комплексные приборы, предназначенные для фиксации, уплотнения и парафинирования тканей. Такие приборы значительно экономят время и создают дополнительный комфорт при выполнении исследовательских работ. Работая с таким автоматом, гистолог имеет возможность контролировать качество процесса, и формировать правильные задачи при помощи удобной панели управления. В каждом конкретном автомате имеется свой набор гистологических программ.
Прибор для окраски препаратов

Современные приборы для окрашивания гистологических препаратов подразумевают возможность получения качественного равномерно окрашенного образца для исследования. Такой аппарат является отличным подспорьем для интенсивной потоковой работы исследовательской лаборатории. Применение подобного оборудования значительно экономит время на подготовку исследуемых образцов и обеспечивает возможность получения качественных результатов.
Существует несколько вариаций таких аппаратов. Они отличаются по пропускной способности и количеству дополнительных функций. В каждом случае прибор для окраски препаратов подбирается под индивидуальные особенности конкретной лаборатории.
Станция для заливки в парафин

Специальный прибор, переназначенный для автоматизированного приготовления исследуемого материала на определенном этапе работы. Станция для заливки в парафин - это эргономичный вариант прибора, который обеспечивает высокую производительность работы и позволяет получать высококачественные результаты.
Криостат

Криостат - современный высокоточный прибор, который позволяет осуществлять подготовку срезов из замороженных образцов тканей без предварительной фиксации. Такой прибор предполагает различный набор дополнительных функций. Каждая модель криостата снабжена безопасной подводкой образца к лезвию.
Дополнительное оборудование
Помимо перечисленных вариантов оборудования в каждой лаборатории могут быть следующие приборы:
- Водяная баня для расправления срезов - прибор позволяет без лишних трудностей осуществлять важный этап приготовления образцов для исследования.
- Нагревательные столики - прибор, предназначенный для сушки препаратов.
- Прибор для заключения образцов.
- Техническое обеспечение для архивации полученных данных и последующей обработки (фотокамера, компьютер и т.д.).
Стоит отметить, что помимо оборудования и инструмента в гистологической лаборатории необходим полный набор специальных реактивов и химических веществ.
Учитывая, что результаты гистологических исследований представляют большую важность для постановки диагноза и выбора предпочтительного направления в терапии, стоит понимать, что высокое качество оснащения и высококвалифицированный штат - это залог успешности лаборатории.
При организации гистологической лаборатории необходимо уделять особое внимание каждой детали. Это в последующем обеспечит четкость и результативность работы означенной медицинской отрасли в каждом конкретном случае.
Гистологическое исследование материала
Гистологическое исследование материала (1-3 препарата одного органа)
Гистологический метод исследования изучает строение тканей и патологические процессы в них. Материал для анализа (кусочки тканей и органов) получают инвазивными методами: с помощью биопсии или во время оперативного вмешательства. Поэтому этот вид исследования применяют при уже развившемся заболевании для определения характера патологических изменений тканей.
Цели исследования
Гистологическое исследование проводится в случаях, когда при помощи других методов не удается точно установить диагноз. Изучение ткани позволяет выяснить характер патологического процесса - это может быть воспаление, гиперплазия, дистрофия или новообразование. В последнем случае патоморфолог выясняет вид опухоли, что позволяет определиться с лечебной тактикой.
Гистологическое исследование помогает выяснить степень распространения процесса или проверить эффективность проведенного лечения. При онкологических заболеваниях целью гистологии может стать определение объема хирургического вмешательства.
Показания к исследованию
Гистологическое исследование материала используется, прежде всего, для диагностики онкологических заболеваний.
Но исследование тканей часто применяется и при болезнях неопухолевой природы. В частности, для диагностики гинекологической патологии - для определения причин бесплодия, предопухолевых и воспалительных болезней шейки матки.В гастроэнтерологии используют эндоскопические диагностические процедуры с проведением прицельной биопсии в пищеводе, желудке, кишечнике.
Гистологическое заключение требуется для уточнения диагноза или тяжести поражения некоторых органов (почек, печени, мышечной, нервной ткани и других).
Как проводится исследование?
Для проведения биопсии используют острый скальпель, пункционный шприц, специальные щипцы при проведении эндоскопической биопсии, кюретку. Материал для исследования берут из зоны на границе здоровых и измененных тканей. При неоднородности изменений может понадобиться больше одного образца для исследования. Кусочки тканей или органов фиксируют специальными растворами (формалин, спирт). После фиксации образцы заливают парафином или целлоидином. Из таких заготовленных гистологических материалов делают несколько срезов с помощью микротома и окрашивают их разными красителями. Каждый метод окраски имеет свои особенности и позволяет лучше рассмотреть те или иные тканевые структуры.
В зависимости от предположительного диагноза и количества образцов ткани готовят от 1 до 3 препаратов одного органа. При этом используются срезы из разных зон или проводится окрашивание несколькими красителями, учитывая какие тканевые структуры надо будет изучить для заключения. Для такой многоэтапной подготовки препаратов требуется несколько дней. Исключение составляют ситуации, когда заключение требуется срочно при взятии образцов ткани во время операции для определения необходимого объема вмешательства. Полученный гистологический образец замораживается, сразу же делаются срезы, проводится их окрашивание и изучение под микроскопом.
Подготовка к анализу
Перед исследованием необходимо проверить общий анализ крови, коагулограмму. За 2 недели до процедуры прекращается прием лекарственных средств и биодобавок, так как некоторые из них могут влиять на свертываемость крови. Если прием препаратов жизненно необходим, нужно сообщить врачу об используемых лекарствах. Перед диагностическим выскабливанием или биопсией матки берутся мазки из влагалища, проводятся анализы на венерические инфекции. За 2 дня до анализа не должно быть половых контактов, нельзя использовать спринцевание, вагинальные свечи и специальные гигиенические средства. Для туалета половых органов нужно использовать только воду. Процедура проводится под обезболиванием, накануне не следует употреблять пищу и нужно ограничить прием жидкости.
Интерпретация результатов
Заключение может содержать окончательный или предположительный гистологический диагноз в специальных терминах, подлежащих кодировке. В описательном ответе врач-патоморфолог описывает вид тканей и клеток, характер обнаруженных патологических изменений, дает рекомендации о дальнейшем обследовании пациента.
Окончательный клинический диагноз выставляет лечащий врач, сопоставив все данные и учитывая гистологический ответ. При ошибках на каком-то из этапов исследования нельзя сделать верное заключение по имеющимся гистологическим препаратам. В таком случае патологоанатом описывает то, что видит при изучении образца, и дает рекомендации о правильном проведении повторного анализа.
Что влияет на результаты?
Гистологический анализ включает много этапов, нарушения в проведении любого из них могут привести к получению некачественных образцов, по которым не удается установить диагноз. Результат зависит от правильности взятия образцов для исследования, их фиксации и последующего приготовления окрашенных срезов. Описание препаратов проводит опытный патологоанатом, при необходимости срезы изучаются несколькими специалистами.
Читайте также:
- Тест на нитратредуктазную активность бактерий. Хроматография при идентификации бактерий. Индикаторные бумажки для идентификации бактерий.
- Синдром длительного сдавления. Краш-синдром ( СДС ). Острая почечная недостаточность (ОПН). Острая печеночная недостаточность (ОПеН).
- Лечение рака яичника у беременной
- Дерматомиозит. Причины появления и диагностика
- Реаниматология. Реанимация. Предагональное состояние. Клиника ( признаки ) предагонального состояния.
