Гонадотропин-рилизинг гормон (ГнРГ) в лечении рецидива рака эндометрия и его эффективность
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Ю.Э. Доброхотова, Л.В. Сапрыкина
Кафедра акушерства и гинекологии № 2 лечебного факультета ГБОУ ВПО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова” Минздравсоцразвития РФ, Москва
Были обследованы 123 пациентки пременопаузального возраста с рецидивирующей гиперплазией эндометрия (ГЭ). Предшествующее лечение гестагенами оказалось неэффективным. Проводилось изучение клинических, ультразвуковых и гистологических признаков ГЭ. С целью лечения ГЭ был назначен агонист гонадотропин-рилизинг-гормона бусерелин. Женщины обследовались через 3 и 6 месяцев от начала курса лечения. Клинические проявления ГЭ отсутствовали среди 93,5 % пациенток.
Эндометрий - гормональночувствительная ткань, обладающая способностью динамично реагировать на любые изменения гомеостаза - от гиперплазии до атрофии. Нередко эти состояния последовательно сменяют друг друга и являются звеньями одной цепи нарушений репродуктивной системы [1]. Гиперплазия эндометрия (ГЭ) относится к мультифакторным заболеваниям, развивающимся в результате комплексного действия генов, гормонов, факторов роста, цитокинов на фоне воздействия неблагоприятных факторов окружающей среды [2]. Высокая частота (10-50 %) малигнизации ГЭ делает данную патологию не только медицинской, но и социальной проблемой нашего времени. Малигнизация ГЭ происходит в 0,25-50,00 % случаев и определяется морфологическими особенностями заболевания, длительностью его рецидивирования, а также возрастом пациентки [3].
Адекватная патогенетически обоснованная терапия ГЭ приводит к нормализации менструальной функции и стабильному функционированию репродуктивной системы, что позволяет избегать многократных лечебно-диагностических выскабливаний полости матки [4].
Общеизвестно, что эффект лечения ГЭ зависит от варианта гормнотерапии: эффективность гестагенов достигает 70 %, антигонадотропинов - 71-75 %, препаратов группы агонистов гонадотропин-рилизинг-гормона (аГнРГ) - 83-93,3 % 5. Отсутствие положительного результата при гестагенотерапии нередко обусловлено неадекватно подобранной дозой препарата, наличием очаговой гиперплазии на фоне атрофии эндометрия либо хронического эндометрита, прорывных
маточных кровотечений, формированием побочных эффектов в виде метаболических нарушений, ухудшением течения соматических заболеваний [8]. При ведении пациенток с рецидивирующей ГЭ (после терапии гестагенами) с целью повышения эффективности лечения целесообразно назначение
аГнРГ.
Широкое внедрение аГнРГ в клиническую практику лечения большого числа гормоночувствительных заболеваний послужило поводом к дальнейшему изучению механизмов их действия. Показано, что после связывания аГнРГ с рецепторами на поверхности гонадотропных клеток происходит интенсивное высвобождение лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов, опосредованно - увеличение синтеза эстрадиола в яичниках. Продолжительное воздействие аГнРГ на гипофиз в тече-
ние нескольких часов приводит к десенситизации его клеток, быстрому уменьшению интенсивности синтеза и высвобождения гонадотропинов, особенно ЛГ. В таком состоянии гонадотропные клетки могут оставаться до тех пор, пока воздействие высоких доз аГнРГ на гипофиз продолжается [9]. Этот феномен называют “медикаментозной кастрацией”. Угнетение стероидогенеза, вызываемое аГнРГ,
индуцирует атрофию эндометрия, эктопических эндометриальных желез и стромы. Блокада является обратимой, т. к. после отмены аГнРГ полностью восстанавливается чувствительность аденогипофиза к гипоталамической стимуляции [6, 10].
Бусерелин-лонг ФС (ЗАО “Ф-Синтез”, Россия) является аГнРГ, рекомендованным при всех видах пролиферативных процессов матки. Препарат обеспечивает стойкий терапевтический эффект при внутримышечном введении 1 раз в 28 дней в дозировке 3,75 мг. Возможно эндоназальное использование препарата Бусерелин ФСинтез по 300 мкг 3-4 раза в сутки (900- 1200 мкг/сут). Медикаментозная терапия ГЭ осуществляется в течение 6 месяцев после верификации диагноза [11].
Безопасное использование Бусерелина-лонг ФС обусловлено отсутствием влияния на углеводный и липидный обмены, гепатобилиарную, сердечно-сосудистую, свертывающую системы. Именно поэтому возможно использование Бусерелина-лонг ФС при сахарном диабете, ожирении, артериальной гипертензии, варикозной болезни и т. д.
Цель настоящего исследования - оценка качества лечения больных рецидивирующей ГЭ с использованием препарата Бусерелин-лонг ФС.
Материал и методы
Были обследованы 123 пациентки пременопаузального возраста с раздельным лечебно-диагностическим выскабливанием (РДВ) в анамнезе по поводу ГЭ. Проведенная терапия гестагенами оказалась неэффективной, согласно результатам гистологического исследования в анамнезе. Средний возраст пациенток составил 46,7 ± 1,1 года.
Неоднократное РДВ (более двух процедур) под контролем гистероскопии было выполнено 58 (47,15 %) больным. Интервал между выскабливаниями в 52,85 % случаев составил менее года, (в среднем 7,9 ± 1,8 месяца), более года - в 47,15 % (в среднем 19,8 ± 4,1 месяца).
Двадцати одной (36,21 %) пациентке с верифицированным диагнозом “гиперплазия эндометрия” в анамнезе проведена гормональная терапия (гестагены) с положительным эффектом в течение 6-9 месяцев. Однако через 3-10 месяцев после прекращения лечения наблюдались рецидив кровотечения и ГЭ.
Контрольную группу составили 30 женщин пременопаузального возраста, которым планировалась заместительная гормональная терапия. Этим больным биопсия эндометрия выполнена с целью исключения его патологии. Средний возраст пациенток контрольной группы составил 47,80 ± 1,75 года.
Наряду с клинико-анамнестическими методами в комплекс диагностических мероприятий включили
ультразвуковое исследование (УЗИ), гистероскопию, РДВ стенок полости матки, патоморфологическое исследование эндометрия.
УЗИ органов малого таза выполнено на аппарате ULTRAMARC-8 фирмы ATL (США), снабженном секторальным механическим датчиком с диапазоном частот 5,0, 7,5 МГц, и аппарате ACUSON 128/XP-10 фирмы ACUSON (США) с мультичастотным секторным датчиком 2,5-4 МГц, мультичастотным конвексным датчиком 2,5-3,5 МГц и линейным датчиком 5,0,-7,0 МГц.
Гистероскопия выполнена с помощью эндоскопического оборудования фирмы “Karl Storz” (Германия) по стандартной методике. Под контролем гистероскопии осуществлено РДВ слизистой оболочки цервикального канала и стенок полости матки.
При патоморфологическом исследовании слизистой оболочки матки путем кюретажа или Pipel-биопсии получена ткань эндометрия; материал зафиксирован в 10 %-ном растворе нейтрального формалина. После заливки в парафин готовили срезы толщиной 5-6 мкм и окрашивали их гематоксилином и эозином. Морфологическое исследование эндометрия проведено до назначения лечения и после окончания курса терапии с целью оценки ее эффективности.
Результаты исследования
Нарушение менструальной функции у наблюдавшихся женщин впервыеотмечено в 44,12 ± 1,3 года, а первоевыскабливание полости матки быловыполнено у них в 45,17 ± 1,5 года,т. е. в среднем спустя год. Выявленонесколько типов нарушений менструальной функции у женщин пременопаузального периода с ГЭ: меноррагия -54 (43,9 %), метроррагия - 7 (5,69 %),менометроррагия - 62 (50,41 %).
Основной жалобой при поступлении были кровянистые выделения изполовых путей (61,79 % ациенток).У 38,21 % больных гиперпластическиепроцессы эндометрия были выявленыпри контрольном обследовании (УЗИорганов малого таза).
М-эхо (толщина маточного эха)эндометрия в среднем составило 8,52 ±1,12 мм (в т. ч. на фоне кровотечения).У пациенток с ГЭ были выявлены воспалительные заболевания органовмалого таза в 69,11 % случаев, миомаматки - в 27,64 %, аденомиоз в 30,08 %и опухолевидные образования яичников - в 13,82 %.
Всем больным под контролем гистероскопии было выполнено РДВ полости матки и цервикального канала.При гистероскопии особое вниманиеуделено длине полости матки, которая варьировалась от 6,5 до 11,0 см (в среднем 8,23 ± 0,94 см), деформации полости матки за счет миоматозных узлов не отмечено. В результате гистологического исследования были выявлены следующие морфоструктурные изменения слизистой оболочки: простая ГЭ - у 71 (57,7 %) пациентки,сложная ГЭ - у 52 (42,3 %).
В качестве терапии ГЭ больным былназначен Бусерелин-лонг ФС 3,75 мгвнутримышечно 1 раз в 28 дней в течение 6 циклов. С целью профилактикиразвития остеопороза всем женщинам,получавшим гормональное лечение,дополнительно назначен Кальций-D3Никомед по 2 таблетки в день во время
еды в течение всего курса гормонотерапии.
Эффективность проводимой терапии оценивали через 3 и 6 месяцев отначала курса лечения.
Анализ жалоб больных обследуемойгруппы установил, что через 3 месяцапосле первой инъекции препарата менструации прекратились у 120 (97,56 %)женщин. У 3 (2,44 %) пациенток втечение первых трех месяцев отмечены скудные циклические кровянистыевыделения. Однако при онтрольном
обследовании через 6 месяцев посленачала применения Бусерелина-лонгаменорея имела место у всех больных.Основным побочным эффектом указанной терапии стало появление нафоне лечения симптомов гипоэстрогенного состояния: у 48,78 и 78,86 %больных через 3 и 6 месяцев соответственно. Степень тяжести этих нежелательных явлений не потребовалаотмены препарата, и они, как правило,купировались приемом фитоэстрогенов.
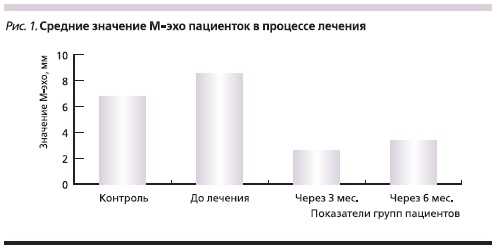
Завершающее УЗИ было выполнено на 32-35-й день после последней инъекции Бусерелина-лонг. При
этом эхоскопических признаков ГЭвыявлено не было. Величина М-эхоне превышала нормативных показателей, достоверно отличалась от исходного значения и составила 3,43 ±0,33 мм.
Согласно дизайну исследования,через 1-3 месяца после окончания курсалечения с целью оценки его эффективности 45 (36,58 %) пациенткам былавыполнена контрольная гистероскопияс РДВ. Тридцати женщинам она проведена на фоне аменореи, 15 - в раннюю пролиферативную фазу. При этому 34 (75,56 %) больных была выявле-на атрофия слизистой оболочки, у 11(24,44 %) эндометрий был бледнорозового цвета с мелкими кровоизлияниями на отдельных участках, что соответствовало гистероскопической картине фазы ранней пролиферации.
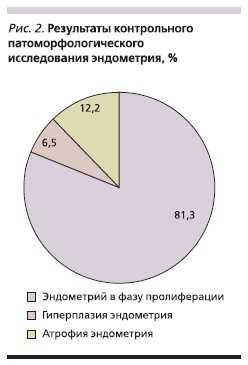
Pipel-диагностика проведена 75(60,98 %) пациенткам. Полученный аспират подвергался цитологическому исследованию. У 60 (76,92 %) больных клеточный состав соответствовал пролиферативной фазе менструального цикла. У 15 (19,23 %) больных в аспирате отсутствовали клетки эндометрия, что было расценено как его атрофия. Трем (3,85 %) женщинам Pipel-биопсию выполнить не удалось из-за облитерации полости матки на уровне внутреннего зева. Клинические проявления ГЭ у этих пациенток отсутствовали. Дальнейшее наблюдение за этими больными включало УЗИ органов малого таза с целью контроля величины М-эхо. Результаты морфологического исследования эндометрия явились наиболее важным критерием эффективности проведенного лечения (рис. 2). У 8 (6,5 %) пациенток с имевшейся до лечения сложной ГЭ после лечения аГнРГ был также выявлен данный морфологический вариант ГЭ без атипии.
Следует отметить, что среди женщин, у которых отсутствовал эффектот лечения, ни в одном случае мыне наблюдали прогрессирования процесса: патоморфологический диагнозу них при контрольном исследовании соответствовал исходному. Этимпациенткам с целью лечения ГЭ былавыполнена аблация эндометрия.
Таким образом, в ходе нашего исследования получены данные, подтверждающие положительное терапевтическое воздействие Бусерелина-лонг ФСна лечение ГЭ у пациенток пременопаузального возраста.
Литература
1. Бантыш Б.Б. Выявление информативныхвизуальных факторов по изображениям сгистологических препаратов при железистойгиперплазии эндометрия // Вестник новыхмедицинских технологий 2006. Т. XIII. № 4.122 с.
2. Мустафаева А.С. Оптимизация тактикиведения гиперпластических процессовэндометрия у женщин репродуктивноговозраста. Дисс. канд. мед. наук. Алмата,2010.
3. Novac L, Grigore T, Cernea N, at al. Incidenceof endometrial carcinoma in patients withendometrial hyperplasia. Eur J Gynaec Oncol2005;26(5);561-63.
4. Федина Е.В. Значение исследования системыгемостаза для выбора тактики ведениябольных репродуктивного периода сгиперпластическими процессами эндометрия.Дисс. канд. мед. наук. М., 2007.
5. Каппушева Л.М., Комарова С.В.,Ибрагимова З.А., Коган О.М. Современныеподходы к лечению больных с маточнымикровотечениями в перименопаузе // Вопросыакушерства гинекологии и перинатологии2005. Т. 4. № 3. С. 54-60.6. Тихомиров А.Л., Лубнин Д.М.
Патогенетическое обоснование примененияагонистов ГнРГ в терапии сочетаннойгинекологической патологии // Вопросыгинекологии, акушерства и перинатологии2006. Т. 5. № 1. С. 82-7.
7. Ivanov S, Kovachev E, Tsonev A, Abbud A. Modern tendencies in treatment of atypicalglandular hyperplasia-our and foreign experience.Akush Ginekol 2010;49(2):47-9.
8. Таюкина И.П., Мустафина Л.М.,Тихоновская О.А., Логвинов С.В. Экспрессиярецепторов стероидных гормонов иморфофункциональное состояниеэндометрия у больных с аномальнымиматочными кровотечениями // Бюллетеньсибирской медицины 2009. № 2. С. 50-6.
9. Манухин И.Б., Тумилович Л.Г., Геворкян М.А.Клинические лекции по гинекологическойэндокринологии. М., 2001. 247 с.
10. Лубнин Д.М., Тихомиров А.Л. Принципылечения миомы матки: от агонистов ГнРГ доэмболизации маточных артерий // Вопросыгинекологии, акушерства и перинатологии2005. Т. 4. № 4. С. 76-82.
11. Михельсон А.Ф., Романовская А.Г. Дифференцированный подход к применениюбусерелина у женщин репродуктивноговозраста с гиперплазией эндометрия //Фундаментальные исследования 2007.№ 12. С. 25.
Об авторах / Для корреспонденции
Гонадотропин-рилизинг гормон (ГнРГ) в лечении рецидива рака эндометрия и его эффективность
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Эффективность органосохраняющего лечения предрака и рака эндометрия у женщин репродуктивного возраста
Журнал: Онкология. Журнал им. П.А. Герцена. 2014;3(1): 77‑76
Лозовая Ю.А., Новикова О.В. Эффективность органосохраняющего лечения предрака и рака эндометрия у женщин репродуктивного возраста. Онкология. Журнал им. П.А. Герцена. 2014;3(1):77‑76.
Lozovaja JuA, Novikova OV. . P.A. Herzen Journal of Oncology. 2014;3(1):77‑76. (In Russ.).
Многочисленные исследования подтверждают, что возникновение предопухолевых и опухолевых состояний эндометрия обусловлено гормональными нарушениями, такими как хроническая ановуляция, синдром поликистозных яичников, гиперэстогения, бесплодие. Эндометрий является тканью-мишенью для половых гормонов и чрезвычайно чувствителен к действию эстрогенов, при этом гиперпластические процессы в эндометрии происходят на фоне длительного эстрогенного влияния и дефицита прогестерона. С морфологических позиций к предраку эндометрия относится только гиперплазия с атипией (АГЭ), риск малигнизации которой составляет 2—50%. Она нередко длительно персистирует, иногда подвергаясь обратному развитию. Учитывая реальную угрозу перехода процесса в рак эндометрия (РЭ), необходимо осуществлять дифференцированный подход к АГЭ. Несмотря на то, что РЭ является заболеванием преимущественно пери- и постменопаузального возраста, 10—14% случаев диагностируются у пациенток репродуктивного возраста. Большинство (74%) из них еще не имеют детей, органосохраняющее лечение которых является приоритетным. Таким образом, актуальность проблемы гиперпластических процессов эндометрия не теряет своего значения как с позиций профилактики РЭ, так и с позиций восстановления и сохранения репродуктивной функции.
Цель исследования — оценка эффективности современных методов органосохраняющего лечения АГЭ и РЭ у пациенток репродуктивного возраста с использованием внутриматочной левоногестрел-рилизинг системы мирена (ВМС мирена) и системным введением агонистов гонадотропин-рилизинг гормона (ГтРГ).
Материал и методы. В исследование включена 121 пациентка репродуктивного возраста (56 пациенток с АГЭ и 65 с РЭ), которым проведена самостоятельная гормонотерапия с использованием ВМС мирены и агонистов ГтРГ. При АГЭ лечение проводится в течение 6 мес с использованием левоноргестрел-содержащей ВМС мирены. При Р.Э. дополнительно к введению ВМС назначаются агонисты ГтРГ (золадекс). Эффективность лечения оценивали через 3 мес по данным УЗИ и биопсии эндометрия и через 6 мес по результатам цервикогистероскопии и раздельного диагностического выскабливания.
Результаты. Средний возраст больных составил 33 года. При АГЭ у подавляющего большинства (91%) женщин удалось достичь излечения. В случаях РЭ IA стадии результаты самостоятельной гормонотерапии оказались несколько хуже — излечение констатировано у 51 (79%) больной. Длительность наблюдения после окончания лечения составила от 5 до 22 мес (медиана 14 мес), за это время рецидивы заболевания диагностированы у 8 (16%) больных после лечения АГЭ и в 11 (21,5%) случаях после лечения Р.Э. Среди 51 пациентки, излеченной от АГЭ, у 4 (7%) наступила беременность, закончившаяся срочными родами. После излечения РЭ репродуктивную функцию реализовали 5 (7,7%) женщин.
Вывод. Представленные данные свидетельствуют о высокой эффективности применения самостоятельной гормонотерапии (ВМС мирена и агонистов ГтРГ) АГЭ и Р.Э. Органосохраняющее лечение позволяет значительному числу женщин в последующем реализовать репродуктивную функцию, при этом показатели фертильности могут быть улучшены за счет применения вспомогательных репродуктивных технологий. Однако, несмотря на высокую эффективность излечения, частота рецидивов требует совершенствования не только методов лечения, но и критериев отбора пациенток для них.
Лечение больных с миомой матки с использованием суперагониста гонадотропин-рилизинг-гормона
Журнал: Российский вестник акушера-гинеколога. 2017;17(5): 88‑90
Агонисты гонадотропин-рилизинг-гормона (ГнРГ) реализуют лечебный эффект на центральном и локальном уровнях, нарушают функционирование внутриклеточной системы реализации биологических эффектов факторов роста, половых гормонов и других веществ, способствующих прогрессированию миомы матки. У бусерелина благодаря модификации молекулы заблокирована инактивация ферментами в позициях 6 и 10, что делает его самым устойчивым агонистом ГнРГ.
С помощью медикаментозного лечения пациенток с миомой матки (ММ) можно добиться сокращения размеров миоматозных узлов и матки, а также нивелировать симптомы заболевания. На современном этапе индукторами регрессии ММ являются две основные группы препаратов: агонисты гонадотропин-рилизинг-гормона (ГнРГ) и модуляторы рецепторов прогестерона.
Однако миома матки у 55—85% больных сочетается с внутренним эндометриозом. Учитывая наибольшую выявляемость миомы матки в сочетании с эндометриозом у пациенток в возрасте от 40 до 50 лет, необходимо отметить, что в этот период в связи с возрастной ановуляцией к этим заболеваниям могут присоединяться и гиперпластические процессы эндометрия, которые в 70% наблюдений представлены простой гиперплазией эндометрия без атипии. Иначе говоря, примерно у 20—25% женщин с сочетанной гиперпластической патологией матки в этом возрасте диагностируются небольшие миомы, аденомиоз и, по сути, возрастной гиперпластический процесс в эндометрии. Как их лечить? При сочетанной патологии — провести гистерэктомию; казалось бы, что это — самый подходящий контингент для такого лечения. Однако после 2000 г. актуальным стал вопрос о чрезмерной распространенности гистерэктомий при доброкачественных гиперплазиях матки (примерно по 650 000 в год в России, США и Европе). При этом известно, что в России 90% гистерэктомий у женщин даже репродуктивного возраста проводится при абсолютно доброкачественной патологии матки. Средний возраст пациенток, подвергающихся самой распространенной полостной гинекологической операции — гистерэктомии — в России составляет 40 лет. Эта операция неизбежно приводит к развитию постгистерэктомического синдрома, характеризующегося выраженным (в 2—3 раза) снижением выработки эстрогенов уже на 2-й день даже после гистерэктомии без придатков в условиях тканевой гипоксии после пересечения яичниковой ветви маточной артерии. В результате развиваются преждевременные менопаузальные нарушения, не только снижающие качество жизни достаточно молодых женщин, но и способствующие более быстрому старению или ставящие вопрос о преждевременном использовании менопаузальной гормональной терапии со всеми ее не до конца решенными проблемами. При этом приходится не забывать о нередкой ассоциации миомы матки с гормональнозависимыми доброкачественными заболеваниями молочной железы, которые, как установлено в последнее время, могут быть как эстроген-, так и прогестерон-зависимыми.
Наиболее патогенетически обоснованным при представленных выше сочетаниях является использование агонистов ГнРГ (аГнРГ). Бусерелин депо является не только экономически наиболее доступным препаратом среди агонистов ГнРГ, но и обеспечивает максимальный лечебный ответ. В 1971 г. американский исследователь A. Schally расшифровал структуру молекулы белка ГнРГ, состоящую из 10 аминокислот, и в 1977 г. стал лауреатом Нобелевской премии в области медицины. В дальнейшем было определено, что основные модификации аГнРГ, позволяющие пролонгировать их действие с обеспечением высокого сродства экзогенных молекул и рецепторов ГнРГ, заключаются в замене аминокислот в химической структуре аГнРГ. Введение гидрофобной аминокислоты с большей липофильностью (третичный бутиловый эфир D-серина вместо глицина) в 6-е положение обеспечивает удлинение полураспада препарата, что связано с замедлением почечной экскреции и увеличением способности к депонированию в жировой ткани. Замещение амида глицина в 10-м положении на этиламид повышает сродство препарата к рецепторам. Именно в бусерелине, в отличие от других известных аГнРГ, объединены эти 2 модификации, позволяющие характеризовать его как суперактивный агонист: бусерелин в 140 раз активнее лютеинизирующего РГ (ЛГРГ), тогда как в аналогичных условиях лейпрорелин только в 80 раз активнее ЛГРГ [1].
Благодаря разной структуре молекул, агонисты ГнРГ имеют различную биологическую активность [2].
Важна и высокая устойчивость бусерелина против расщепления энзимами.
У бусерелина благодаря модификации его молекулы в позициях 6 и 10 заблокирована инактивация ферментами, что делает его самым устойчивым агонистом ГнРГ [3].
Таким образом под термином бусерелин — суперагонист подразумевают следующие его свойства [4].
1. Повышенное сродство к рецепторам:
— клеток-мишеней в лейомиомах, эндометриоидных гетеротопиях, эутопическом эндометрии.
2. Повышенная биологическая активность:
— усиление блокады синтеза ЛГ и ФСГ клетками аденогипофиза;
— выраженная блокада альтернативного синтеза половых стероидов клетками-мишенями;
— повышенный антипролиферативный и проапоптотический эффект.
Помимо гормональной абляции на фоне десенситизации гипофиза и прерывания оси гипоталамус—гипофиз—яичники—матка, аГнРГ непосредственно связываются с цитоплазматической мембраной патологических клеток, взаимодействуя со своими специфическими рецепторами; угнетают продукты генов, ассоциированных с G1-фазой клеточного цикла, таких как циклин E и p33cdk2; угнетают пролиферацию за счет повышения внутриклеточной концентрации аннексина V — эндогенного ингибитора протеинкиназы С; снижают высвобождение промитогенных цитокинов ИЛ-1β и сосудисто-эндотелиального фактора роста, что ведет к ингибированию пролиферации и неоангиогенеза; вызывают апоптоз за счет повышения активации Fas/FasL- и Bax-обусловленного механизма апоптоза, ослабляют действие антиапоптотического белка Bcl-2 [5]; угнетают локальную продукцию эстрогенов; приводят к увеличению экспрессии матриксных металлопротеиназ с сопутствующим уменьшением экспрессии их тканевых ингибиторов, что может обеспечивать благоприятную среду для деградации экстрацеллюлярного матрикса; приводят к снижению экспрессии трансформирующего фактора роста и его рецепторов, что сопровождается уменьшением в объеме миоматозных узлов [6—10]. Кроме этого, на фоне терапии аГнРГ происходит существенное уменьшение так называемых экстрацеллюлярных сигнал-регулирующих киназ и киназ фокальной адгезии, которые являются неотъемлемыми звеньями внутриклеточных сигнальных путей, активируемых половыми гормонами и факторами роста [11].
Бусерелин депо является доступным, эффективным и патогенетически обоснованным препаратом, который воздействует на два столь часто встречающихся сочетанных заболевания — миому матки и эндометриоз. Дополнительным преимуществом бусерелина является его способность вызывать атрофические процессы в эндометрии, что позволяет использовать его при сочетании эндометриоза и миомы матки с типичной гиперплазией эндометрия и сократить количество травматических хирургических вмешательств.
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава РФ
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Применение рилизинг-систем и агонистов гонадотропин-рилизинг-гормона в лечении атипической гиперплазии и начального рака эндометрия
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(1): 40‑43
Пронин С.М., Новикова О.В., Андреева Ю.Ю. Применение рилизинг-систем и агонистов гонадотропин-рилизинг-гормона в лечении атипической гиперплазии и начального рака эндометрия. Онкология. Журнал им. П.А. Герцена. 2013;2(1):40‑43.
Pronin SM, Novikova OV, Andreeva YuYu. The use of releasing systems and gonadotropin-releasing hormone agonists in the treatment of atypical hyperplasia and early-stage endometrial cancer. P.A. Herzen Journal of Oncology. 2013;2(1):40‑43. (In Russ.).
Проведена оценка эффективности внутриматочного воздействия левоноргестрела (52 мг) и подкожного введения агониста гонадотропин-рилизинг-гормона (золадекс депо 3,6 мг) в лечении женщин до 40 лет с атипической гиперплазией и начальным раком эндометрия IА стадии, ранее не реализовавших репродуктивную функцию. Первичное лечение закончено у 70 (57,8%) женщин, 39 (32,2%) - в процессе самостоятельной гормонотерапии. Гормональные препараты вводились в течение 6 мес. Период наблюдения составил от 1 до 38 мес (медиана 14 мес). Средний возраст больных составил 33 года. Эффективность терапии составила 82,8%. Рецидивы констатированы в 3 (4,2%) наблюдениях, неизлеченность заболевания - в 9 (12,8%) случаях. Репродуктивная функция реализована у 8 (11,4%) женщин.
Возможности органосохраняющего лечения атипической гиперплазии (АГЭ) и начального рака эндометрия (РЭ) IА стадии в течение многих десятилетий продолжают оставаться в центре внимания ведущих отечественных и зарубежных онкологов. Органосохранные методы лечения становятся все более востребованными в онкогинекологии, поскольку увеличивается число заболевших женщин молодого возраста. При этом, к сожалению, наблюдается неблагоприятная тенденция, когда в силу различных социально-экономических причин значительная часть женщин все чаще откладывают рождение даже первого ребенка на возрастной период старше 35 лет. Сохранение репродуктивного здоровья женщины является одним из приоритетных направлений современной онкологии, так как имеет особое значение при установлении диагноза злокачественной опухоли матки.
РЭ занимает 2-е место (7,1%) среди злокачественных новообразований органов репродуктивной системы [1]. Пик заболеваемости приходится на возраст старше 50 лет, при этом в 14,1% случаев опухоль выявляют в возрасте до 40 лет [2].
Согласно существующим стандартам, традиционное хирургическое лечение (экстирпация матки) при начальных стадиях РЭ позволяет в подавляющем большинстве случаев сохранить жизнь пациентки, однако приводит к необратимой утрате фертильности, что многократно снижает качество жизни женщин, не реализовавших ранее детородную функцию. Физиологические и психологические последствия бесплодия, вызванного лечением по поводу онкологического заболевания, чрезвычайно негативны. Помимо самого факта нереализованной репродуктивной функции, у большинства женщин этой группы наблюдаются депрессии различной степени тяжести, стрессорные расстройства и сексуальная дисфункция.
Значительное число женщин молодого возраста с диагнозом РЭ и достаточно высокая частота выявления заболевания на ранних стадиях послужили основанием для разработки органосохраняющего метода лечения, позволяющего в дальнейшем реализовать репродуктивную функцию. РЭ, диагностируемый в репродуктивном возрасте, как правило, высокодифференцированный, а значит гормоночувствительный. В этой связи консервативный метод терапии имеет приоритетное значение, поскольку заболевание характерно для социально активной группы женщин, у которых преимущественно и стоит вопрос о деторождении. РЭ считается наиболее сложной опухолью, поскольку беременность должна наступить непосредственно в пораженном органе. Надежным критерием чувствительности неоплазии к гормональному лечению является наличие высокой экспрессии рецепторов к эстрадиолу и прогестерону в опухолевой ткани. Принимая во внимание определяющую роль избыточного влияния эстрогенов и дефицита прогестерона, стандартной терапией различных форм гиперплазии и рака считают назначение высоких доз гестагенов, воздействие которых приводит к атрофическим изменениям в эндометрии и морфологической ремиссии заболевания, на фоне которой возможно проведение мероприятий, направленных на восстановление детородной функции [7].
За свою историю методика самостоятельной гормонотерапии претерпела существенные изменения.
С конца 50-х годов для лечения патологии эндометрия используют гестагены, занявшие лидирующую позицию среди других видов терапии. Первая отечественная публикация об успешном использовании гестагенов при высокодифференцированной аденокарциноме и последующем наступлении беременности относится к 1985 г. (Я.В. Бохман) [3]. Существуют различные протоколы применения прогестагенов при АГЭ и РЭ. Наиболее часто используются высокие дозы (500—1000 мг/сут) медроксипрогестерон ацетата (МПА) или мегестрол ацетата (80—160 мг/сут) с 3-месячным контролем морфологического состояния эндометрия. Лечебный эффект прогестинов сопровождается снижением пролиферативной активности и уменьшением экспрессии ER и PR в железистых структурах и строме [4]. Эффективность терапии гестагенами при АГЭ варьирует от 61 до 94%, при РЭ — от 42 до 71% [5]. Для повышения эффективности и разработки альтернативных схем терапии с начала 90-х годов начали использовать агонисты гонадотропин-рилизинг-гормона (ГТРГ), иногда в сочетании с МПА. Несмотря на длительную историю консервативного лечения ГЭ и РЭ, до настоящего времени не представлены результаты метаанализа эффективности различных видов гормонотерапии, что, вероятно, связано с отсутствием хорошо спланированных рандомизированных исследований, выполненных по стандартным протоколам.
За период с 1975 по 2009 г. отделение онкогинекологии МНИОИ им. П.А. Герцена располагает достаточным опытом лечения данных пациенток, используя в качестве лекарственных препаратов отечественный 12,5% масляный раствор 17 оксипрогестерон-капроната (17-ОПК), а также импортные препараты: депостат — инъекционная форма «чистого» гестагена пролонгированного действия или провера — инъекционная или таблетированная форма МПА [6]. Длительное системное применение лекарственных препаратов, необходимое для достижения и поддержания лечебного эффекта, ограничено как рядом нежелательных системных воздействий, так и низкой приверженностью пациенток к терапии из-за необходимости ее ежемесячного курсового использования без гарантий на рецидив заболевания. Это привело к поиску новых эффективных и безопасных способов лечения неоплазии.
С развитием фармакологии появилось больше оснований для интеграции эндокринологии в онкологию. Широкое внедрение в клиническую практику гормональных рилизинг-систем, доказанность их лечебных эффектов, протекторного воздействия на эндометрий явилось основанием для продолжения совершенствования научных исследований по применению самостоятельной гормонотерапии при начальном РЭ. Помимо системного введения высоких доз гестагенов, обладающих нежелательными метаболическими эффектами, в клиническую практику внедрен способ терапии путем внутриматочного воздействия левоноргестрела (ЛНГ) в комбинации с агонистом ГТРГ (золадекс). Концентрация ЛНГ в эндометрии в 100 раз выше, чем при использовании пероральных гестагенов [8].
Целью настоящего исследования явилась оценка эффективности внутриматочного воздействия ЛНГ (52 мг) и подкожного введения агониста ГТРГ (золадекс депо 3,6 мг) в лечении женщин до 40 лет с АГЭ и начальным РЭ (IА стадии), ранее не реализовавших репродуктивную функцию.
Материалы и методы
Критериями отбора пациенток для самостоятельной гормонотерапии явились: стадия заболевания IА (T1АN0M0); морфологическая форма гиперплазии эндометрия, отсутствие признаков инвазивного роста опухоли в миометрий по данным УЗИ и МРТ, репродуктивный возраст и настойчивое желание пациентки сохранить фертильность.
В отделении гинекологии МНИОИ им. П.А. Герцена разработана методика гормонотерапии для больных репродуктивного возраста с АГЭ и РЭ IА стадии, отличающаяся режимом сочетания гестагенов с агонистом ГТРГ (золадекс). Комбинация локального эффекта гестагенов в виде внутриматочной гормональной системы ЛНГ (ЛНГ — ВМС Мирена) с ингибирующим воздействием золадекса на секрецию гонадотропных гормонов гипофиза и продукцию эстрогенов в яичниках обеспечивает атрофию желез эндометрия и морфологическую ремиссию заболевания, на фоне которой возможно проведение мероприятий, направленных на восстановление детородной функции.
Существуют определенные отличия в назначении терапии при АГЭ и РЭ по интенсивности гормонального воздействия. Методика предполагает гормональное лечение в следующих режимах: при АГЭ — монотерапия путем введения ВМС Мирена («Shering» 52 мг ЛНГ) в течение 6 мес; при начальном РЭ сочетание внутриматочного воздействия ЛНГ и подкожного введения золадекса депо 3,6 мг, «ASTRAZeneca» в течение 6 мес с последующим заключительным обследованием (УЗИ, МРТ, цервикогистероскопия + раздельное диагностическое выскабливание, гистология соскобов), позволяющим констатировать излечение и завершить онкологический этап лечения.

За период с 02.09 по 07.12 г. в МНИОИ им. П.А. Герцена проведено лечение 121 пациентки по приведенным схемам с использованием ВМС Мирена и золадекса. Проанализированы истории болезни 38 больных с АГЭ и 32 РЭ IА стадии (схема). Схема 1. Дизайн исследования.
Результаты
Клиническая характеристика 70 больных, прослеженных после самостоятельной гормонотерапии, представлена на схеме. Период наблюдения составил от 1 до 38 мес (медиана 14 мес). Средний возраст больных составил 33 года. Первичное лечение закончено у 70 (57,8%) женщин, 39 (32,2%) — в процессе самостоятельной гормонотерапии. Рецидивы констатированы в 3 (4,2%) наблюдениях, неизлеченность заболевания — у 9 (12,8%) больных. У этих больных неизлеченность опухолевого процесса зафиксирована на онкологическом этапе, что потребовало выполнения хирургического лечения в объеме лапароскопической экстирпации матки или экстирпации матки с придатками, подвздошно-обтураторной лимфаденэктомией. После излечения все больные направлены к репродуктологам в Центры планирования семьи для реализации генеративной функции самостоятельно или посредством вспомогательной технологии ЭКО. У 8 (11,4%) из 70 женщин после окончания специального лечения констатировано 10 беременностей, закончившиеся в 8 случаях родами, в 2 — самопроизвольным выкидышем. В программу вспомогательной репродуктивной технологии (ВРТ) включены 17 пациенток, у 8 женщин в настоящий момент нет полового партнера.
Беременность является заключительным этапом лечения и максимальным проявлением медико-социальной реабилитации женщин, излеченных от рака. Роды не оказывают неблагоприятного влияния на течение основного заболевания. Учитывая ассоциацию РЭ с хронической ановуляцией, спонтанное наступление беременности зачастую не происходит. В этой связи ряд зарубежных исследователей предлагают после наступления морфологической ремиссии сразу использовать ЭКО, а после успешного родоразрешения с целью профилактики рецидива производить хирургическое лечение в классическом объеме экстирпации матки с придатками.
К основным критериям эффективности проведенного лечения относят: отдаленные результаты гормонотерапии, а именно сроки возникновения и методики лечения рецидивов. Наиболее опасным и угрожаемым по возобновлению болезни является период, начинающийся непосредственно после прекращения введения гормональных препаратов. Если овуляция спонтанно не наступает, то продолжаются ановуляторные циклы, которые приводят вновь к гиперэстрогении и возможному возникновению рецидива заболевания.
Все наблюдаемые пациентки, перенесшие органосохранное лечение, живы и социально активны. Изучение частоты и характера рецидивов напрямую зависит от организации мониторинга за больными после лечения.
Все больные находятся под строгим динамическим наблюдением. Временны`е интервалы между проводимыми обследованиями соответствуют стандартам, принятым в онкологической практике.
Органосохраняющее лечение используется пока лишь в отдельных онкологических клиниках у ограниченного по численности контингента больных, что не оставляет возможностей для проведения масштабных рандомизированных исследований. В таких условиях особую значимость приобретают даже небольшие по численности больных клинические исследования. Предлагаемые комбинированные схемы являются новой ступенью бóльшей эффективности (82,8%) данного вида органносохранного лечения у женщин с АГЭ и РЭ (IА стадии), заинтересованных в беременности.
Е.В. Бахидзе
ФГБУ «НИИ онкологии им. Н.Н. Петрова», Санкт-Петербург
В экономически развитых странах в течение 5-летнего периода наблюдения от рака эндометрия (РЭ) умирают не менее 30 % больных, что определяет актуальность лечения этих форм заболевания. Отличительной чертой РЭ является его выраженная гормонозависимость. В статье подробно проанализированы механизмы патогенеза РЭ на основании сопоставления клинических, морфологических и эндокринологических данных. Описаны наиболее распространенные методы лечения. Приведены данные, свидетельствующие, о том, что гормонотерапия является эффективным методом паллиативного лечения метастатического и рецидивного РЭ, развивающимся направлением клинической и экспериментальной медицины.
Каждый год примерно у 142 тыс. женщин во всем мире развивается рак эндометрия (РЭ) и около 42 тыс. женщин умирают от этого рака [1]. Среди органов репродуктивной системы женщины РЭ занимает второе место после рака молочной железы и третье-четвертое - среди всех злокачественных опухолей у женщин в экономически развитых странах Северной Америки и Европы, в т. ч. и в России [2]. В России заболеваемость РЭ в 2005 г. составила 22,5 случая на 100 тыс. женского населения, в США в том же году - 24,5 на 100 тыс. женского населения [2, 3]. Наиболее высокая заболеваемость РЭ наблюдается среди женщин старше 50 лет с пиком заболеваемости около седьмого десятилетия жизни 2.
Отличительной чертой РЭ служит появление симптомов на ранних стадиях заболевания в виде маточных кровотечений, что объясняет раннее обращение пациенток к врачу и диагностику ранних стадий (I-II) более чем у 70 % больных, благодаря чему прогноз при РЭ относительно благоприятный. Тем не менее, если при I стадии 5-летняя выживаемость больных РЭ составляет более 90 %, то общая 5-летняя выживаемость независимо от стадии не превышает 70 % [3, 4]. Таким образом, в течение 5-летнего периода наблюдения не менее 30 % больных РЭ умирают от рецидивов и метастазов, что определяет актуальность лечения этих форм заболевания.
К другой отличительной черте РЭ относится его выраженная гормонозависимость, в основе которой лежит длительная экспозиция эндометрия к эстрогенам в условиях прогестероновой недостаточности. Биологические, клинические и эпидемиологические исследования показали, что эстрогены в условиях дефицита прогестерона стимулируют пролиферацию клеток эндометрия и, таким образом, могут приводить к гиперплазии эндометрия и раку 5. Влияние эстрогенов на развитие РЭ обусловлено воздействием на рецепторы эстрогенов путем их димеризации и транслокации в ядро, где они модулируют экспрессию восприимчивых генов [4]. Механизмом, запускающим гормональный канцерогенез, способны стать изменения нормального гормонального баланса под влиянием экзогенных (питание, гормональные препараты) и эндогенных (эндокринно-метаболические нарушения) факторов риска [7, 8].
При этом не все случаи РЭ обусловлены только гормональным канцерогенезом. Рак эндометрия имеет различные варианты своего патогенеза. На основании сопоставления клинических, морфологических и эндокринологических данных Я.В. Бохманом в 1972 г. была выдвинута концепция о двух основных патогенетических вариантах развития гиперпластических процессов и рака эндометрия [9]. Согласно этой концепции, I патогенетический вариант РЭ, обнаруженный у 70-80 % больных, характеризуется сочетанием гиперэстрогении с нарушениями жиро-углеводного обмена. Клинический симптомокомплекс, развивающийся на фоне этих нарушений, включает ановуляторные маточные кровотечения, бесплодие, позднее наступление менопаузы, миому матки, гиперплазию тека-ткани яичников в сочетании с синдромом поликистозных яичников; гиперпластические процессы эндометрия, очаги атипической гиперплазии. При II патогенетическом варианте, встречающемся в 20-30 % случаев, указанные эндокринно-обменные нарушения выражены нечетко или совсем отсутствуют. По II патогенетическому варианту опухоли обычно развиваются в относительно старшем возрасте - примерно на 5-10 лет позже, чем при первом. При I патогенетическом варианте опухоли обычно имеют типичное строение высоко- или умереннодифференцированных эндометриоидных карцином, развиваются на фоне гиперплазии эндометрия, часто экспрессируют рецепторы эстрогенов (ER) и прогестерона (РR). При II варианте развиваются, как правило, либо низкодифференцированные эндометриоидные, либо неэндометриоидные опухоли, например серозные, на фоне атрофии эндометрия, с отсутствием рецепторов эстрогенов и прогестерона, отличающиеся более агрессивным течением и неблагоприятным прогнозом 7. Эта дуалистическая концепция Я.В. Бохмана была позже подтверждена молекулярными исследованиями [11, 12]. В эндометриоидных карциномах при I типе обнаружены четыре основных генетических изменения: мутация PTEN гена-супрессора опухоли, наличие микросателлитной нестабильности из-за изменений репарации генов, мутации K-Ras протоонкогена и изменение гена АРС. PTEN-ген негативно регулирует рост и жизнь клетки, ее апоптоз [13]. Мутация PTEN-гена обнаружена и в нормальном эндометрии при экспозиции эстрогенов, у 18-55 % больных предраком и у 26-80 % - раком эндометрия. В карциномах II типа обнаруживаются мутации р53 и экспрессии онкогена Her2/neu [11, 12]. Однако, как и в любой модели, есть исключения, когда обнаруживаются признаки двух типов в одной опухоли.
Во многих исследованиях была показана взаимосвязь между присутствием рецепторов стероидных гормонов в опухоли и уровнем ее гистологической дифференцировки: чем выше дифференцировка опухоли, тем выше содержание в ней ER и PR 14. Однако есть работы, которые не подтверждают связь между стероидными рецепторами и уровнем гистологической дифференцировки опухоли [18, 19]. Аналогично и корреляция между стероидными рецепторами, а также стадией заболевания и гистологическими подтипами РЭ не имеет однозначной трактовки [15, 18]. Таким образом, трудно утверждать, будто существует четкая корреляция между различными клинико-патологическими особенностями РЭ и рецепторным статусом опухоли. Кроме того, могут различаться биохимические анализы, используемые для определения содержания рецепторов [15]. Тем не менее положительный уровень этих рецепторов, особенно PR и в меньшей степени ER, служит основным критерием установления гормонозависимости РЭ. Так, по данным А.С. Вишневского, уровень PR положительно коррелировал с клинико-морфологическим вариантом заболевания, степенью морфологической дифференцировки и со спонтанной секрецией в опухоли, в то время как уровень ER положительно коррелировал с метастазами в регионарные лимфоузлы [20].
Наиболее распространенные методы лечения РЭ: хирургический, лучевой, лекарственный и их комбинации. Поскольку РЭ выявляется преимущественно на ранних стадиях, наиболее распространенным радикальным методом лечения РЭ остается хирургический, который приводит к 5-летнему излечению более 80 % больных. Однако при распространенном процессе или рецидиве заболевания хирургический метод не применяется, а лучевой и химиотерапевтический методы зачастую недостаточно эффективны.
Выраженная гормонозависимость РЭ позволила еще в середине XX в. успешно применить гормонотерапию прогестинами при распространенном РЭ, а затем и в качестве первичного органосохраняющего лечения молодых пациенток, желающих сохранить фертильность [21, 22].
Прогестины представляют собой синтетические прогестагены с эффектом РR. Основу противоопухолевого эффекта прогестинов составляет способность клеток эндометриоидной аденокарциномы отвечать теми же морфологическими реакциями, которые наблюдаются в нормальном эндометрии под влиянием РR в секреторной фазе менструального цикла. Указанное предположение подтверждается результатами гистологического, гистохимического и электронно-микроскопического исследований.
РRВ процессе прогестинотерапии наблюдаются следующие изменения опухоли: снижение пролиферативной активности, повышение морфологической дифференцировки, активная секреция вплоть до секреторного истощения, дегенерация, некроз, апоптоз [23].
Механизм действия прогестинов на клетки эндометриальных карцином до конца не известен. Его связывают с воздействием прогестинов на рецепторы ER и PR. Прогестины снижают экспрессию ER [24], подавляют ER-связанную транскрипцию генов, вовлеченных в клеточный рост [25], и активируют опухоль-супрессорные гены р21 [26].
Предикторы гормоночувствительности больных с рецидивами РЭ, по мнению авторов, - это:
- Степень дифференцировки опухоли.
- Длительность интервала между первичным лечением и рецидивом заболевания.
- Присутствие PR и ER в опухоли, которые позитивно коррелируют с эффективностью прогестинов [33].
К наиболее частым режимам применения препаратов относятся прием МПА по 200 мг в день, МА - по 160 мг в день [30]. С целью повышения эффективности прогестинотерапии больных РЭ были проведены исследования по применению препаратов в больших дозах. Такое исследование было предпринято группой GOG, которая в опубликованных результатах своих исследований отметила в 1986 г.: лечение большими дозами МПА и МА не увеличивает эффективности гормонотерапии [29]. При этом авторы подтвердили, что эскалация доз препаратов увеличивает частоту таких нежелательных побочных эффектов, как отеки, увеличение веса, и повышает риск развития венозной тромбоэмболии.
Процессы, происходящие в опухоли, под влиянием прогестинов изменяют фенотипическую способность опухолевых клеток РЭ, но при этом может сохраняться трансформированный онкогеном генотип клеток. Помимо этого при длительной гормонотерапии может развиваться вторичная резистентность, связанная с подавлением PR [34], что побудило клиницистов к поиску лекарственных способов восстановления PR. С этой целью была исследована возможность применения сначала эстрогенов, а затем антиэстрогенов (тамоксифена), поскольку введение антиэстрогенов, как и эстрогенов, увеличивало уровень PR в опухолях эндометрия [21, 36-39]. Эта гипотеза была проверена двумя протоколами GOG: GOG 119 и GOG 153 [40, 41]. В этих исследованиях оценивалось два режима применения тамоксифена и прогестинов: альтернирующий (чередование препаратов) и постоянный (прием одновременно двух препаратов). По данным этих исследований, различий в эффективности разных режимов применения препаратов не было. В нашей клинике чаще используется альтернирующий 10-дневный прием тамоксифена с перерывом 20 дней на фоне постоянного приема МПА [21].
В третьем исследовании, проведенном группой ECOG, при сочетанном применении МА и тамоксифена по сравнению с одним МА не было обнаружено различий в эффективности гормонотерапии в двух группах [42]. Во всех этих исследованиях пациенты отбирались без учета рецепторного статуса опухоли. Чтобы оценить влияние рецепторного статуса группой GOG 119 было проведено ретроспективное исследование с целью изучить связь между экспрессией рецепторов гормонов в метастатическом РЭ и клиническим ответом опухоли [43]. Было обнаружено, что ответ больных ER-положительными опухолями составил 47 %. Было также обнаружено, что экспрессия ER тесно связана с одной из изоформ PR - изоформой A, но не изоформой B, что предполагает разные роли изоформ PR. Было также отмечено, что 26 % ER-негативных опухолей и 32 % PRA- или PRB-негативных опухолей отвечали на комбинированную терапию [43]. Поскольку в этом исследовании не изучалась опухолевая ткань после гормонотерапии, осталось неизвестным, связан ли обнаруженный эффект с повышением экспрессии стероидных рецепторов, как предполагается, или обусловлен воздействием на сигнальные пути, не связанные с рецепторами?
Предполагаемый молекулярный механизм, при помощи которого PR снижает экспрессию PR, был недавно описан в работе S. Yang и соавт. (2011) [44]. Он основан на модификации экспрессии PR на уровне ДНК, м-РНК и кодируемых ими белков, в связи с чем обсуждается разработка способов восстановления экспрессии генов с помощью эпигенетических модуляторов [45].
Проведены исследования возможности гормонотерапии препаратами агонистов гонадотропин-рилизинг-гормона (LHRH). Так, в исследовании G. Emons и соавт. [46] был продемонстрирован антипролиферативный эффект агониста LHRH. Затем во II фазе клинических исследований лейпролида ацетата на больных распространенным и рецидивным РЭ в 25 % случаев были достигнуты полные или частичные ремиссии с медианой продолжительности до 20 месяцев [47]. При последующих многоцентровых исследованиях эти данные не подтвердились [48].
Среди новых кандидатов терапии РЭ обсуждается четвертое поколение прогестинов, ингибирующих рост и дифференцировку эндометриальных желез. Другим кандидатом служит метформин, подавляющий экспрессию белка теломеразной обратной транскриптазы - hTERT - и ингибирующий mTOR-путь активации AMPR c последующим подавлением клеточного цикла. Проводятся исследования по применению ингибиторов mTOR, способных подавлять рост опухолевых клеток путем остановки клеточного цикла в фазе G1, а также ингибиторов HDAC, которые блокируют рост раковых клеток путем транскрипционной активации опухолевых генов-супрессоров, остановки клеточного цикла и индукции апоптоза [49].
Приведенные данные свидетельствуют, что гормонотерапия является эффективным методом паллиативного лечения метастатического и рецидивного РЭ, развивающимся направлением клинической и экспериментальной медицины. Проведение дополнительных молекулярных исследований приведет к лучшему пониманию механизмов гормонального воздействия на РЭ, а также будет способствовать выявлению дополнительных молекулярных мишеней для терапии.
Читайте также:
