Легочный свищ после экстраплеврального пневмоторакса. Ведение пациента после экстраплеврального пневмоторакса
Добавил пользователь Валентин П. Обновлено: 28.01.2026
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия;
ФГБУ «Национальный медицинский исследовательский центр им. акад. Е.Н. Мешалкина» Минздрава России, Новосибирск, Россия
ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия;
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», Новосибирск, Россия
Эндоскопическая клапанная бронхоблокация при лечении бронхоплевральных свищей и утечки воздуха
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(5): 49‑57
Цель исследования. Оценка эффективности применения эндоскопической окклюзии бронха при лечении пациентов с бронхоплевральным свищом и длительным сбросом воздуха по плевральным дренажам различной этиологии. Материал и методы. Эндоскопическая окклюзия бронха выполнена 115 пациентам с бронхоплевральным свищом или сбросом воздуха по дренажам в послеоперационном периоде. В зависимости от причины формирования свища пациенты разделены на 5 групп: оперированные по поводу буллезной эмфиземы легких; с острыми гнойными заболеваниями легких; с хроническими гнойными заболеваниями легких и плевры; с буллезной эмфиземой легких, осложненной пневмотораксом, у которых не удалось добиться расправления легкого при дренировании плевральной полости; с другими заболеваниями легких, у которых после операции отмечен длительный сброс воздуха по дренажам. Результаты. Более чем у 70% пациентов процедура была эффективна. Осложнений во время ее выполнения и в послеоперационном периоде не зафиксировано. Заключение. Эндоскопическая окклюзия бронха является высокоэффективным мини-инвазивным методом лечения пациентов с бронхоплевральным свищом и сбросом воздуха в послеоперационном периоде различной этиологии.
Введение
Лечение пациентов с бронхоплевральным свищом и сбросом воздуха по плевральному дренажу — актуальная проблема современной торакальной хирургии. Длительный сброс воздуха в послеоперационном периоде, возникновение бронхоплеврального свища приводят к увеличению продолжительности пребывания пациента в стационаре, выполнению первичных или повторных вмешательств, что не всегда улучшает результаты лечения, может привести к инвалидизации пациентов и к снижению уровня качества их жизни [1—5].
Среди малоинвазивных методик лечения в этой ситуации предпочтение отдается эндоскопическим мероприятиям, направленным на прекращение поступления воздуха через дефект легочной ткани, таким как окклюзия бронха [2, 4, 6—9]. Использование поролонового окклюдера считается эффективным, но его нельзя устанавливать на длительный период из-за высокого риска миграции. Активно используемые за пределами России эндобронхиальные блокирующие устройства требуют особых навыков установки, у них высокая стоимость, и это делает невозможным их применение в общей клинической практике [2, 4, 6—12].
Метод клапанной бронхоблокации, разработанный и широко используемый в практике хирургов-фтизиатров, дает хороший клинический эффект у пациентов с фиброзно-кавернозным туберкулезом, в том числе при осложнениях послеоперационного периода. Опубликованы данные об эффективном применении этих устройств у пациентов с гнойными заболеваниями легких [1, 3, 13, 14].
Цель исследования — оценка эффективности применения эндоскопической окклюзии бронха при лечении пациентов с бронхоплевральным свищом и длительным сбросом воздуха.
Материал и методы
В клинике кафедры госпитальной и детской хирургии лечебного факультета Новосибирского государственного медицинского университета, в отделении торакальной хирургии Государственной Новосибирской областной клинической больницы c 2015 г. проходили лечение 115 пациентов с бронхоплевральными свищами и сбросом воздуха по плевральному дренажу (66 мужчин и 49 женщин). Возраст пациентов — от 15 до 73 лет.
В зависимости от причин утечки воздуха выделены группы пациентов. В группу 1 вошли пациенты, оперированные по поводу буллезной эмфиземы легких, эту группу разделили на 2 подгруппы в зависимости от сроков выполнения блокады: группу 1а составили 11 пациентов, которым блок проведен в сроки более 3 сут от момента операции, в группу 1б вошел 21 пациент, у них окклюзия бронха проведена в течение первых 3 сут после операции. Группу 2 составили пациенты с острыми гнойными заболеваниями легких, группу 3 — пациенты с хроническими гнойными заболеваниями легких и плевры, группу 4 — пациенты с буллезной эмфиземой легких, осложненной пневмотораксом, у которых не удалось добиться расправления легкого при дренировании плевральной полости. В группу 5 вошли пациенты с другими заболеваниями легких, у которых после операции отмечен длительный сброс воздуха по плевральным дренажам. Распределение пациентов по полу, возрасту, количеству в группах представлено в табл. 1.

Таблица 1. Характеристики пациентов
Целью выполнения окклюзии бронха являлось прекращение сброса воздуха по дренажам из плевральной полости, расправление легкого. У пациентов с хроническими гнойными заболеваниями легких процедуру проводили для санации плевральной полости перед предстоящим вмешательством.
Перед процедурой обязательно выполняли фибробронхоскопию для оценки состояния трахеобронхиального дерева и выбора блокатора нужного размера. Далее выполняли стандартную процедуру окклюзии бронха.
В послеоперационном периоде оценке подвергали длительность сброса воздуха из плевральной полости, сроки расправления легкого и извлечения дренажей из плевральной полости.
Для проведения статистического анализа использовали программы Statistica 7.0, MS Excel из пакета MS Office. Полученные данные представлены в виде средних и медианных значений с интерквартильными размахами 25 и 75% (М (Ме [25%; 75%]). Сравнение между группами проводили с помощью критерия Манна—Уитни. При использовании непараметрических методик применяли критерий Пирсона (χ 2 ), а при числовых значениях меньше 5 использовали точный критерий Фишера.
Результаты
Осложнений в процессе установки бронхоблокатора не отмечено. Сложнее было установить блокатор в бронх верхней доли правого легкого, что объясняется анатомическими особенностями (углом отхождения долевого бронха от правого главного бронха). Удаление блокаторов производили при фибробронхоскопии с помощью щипцов для фибробронхоскопа, петли для полипэктомии или щипцов «крысиный зуб».
Результаты применения бронхоблокации у пациентов разных групп представлены ниже.
Окклюзия бронха у пациентов после операций по поводу буллезной эмфиземы легких
Для оценки результатов провели сравнительный анализ ряда показателей (длительность сброса воздуха по плевральным дренажам, сроки расправления легкого и количество положительных исходов, не потребовавших повторного оперативного вмешательства) у пациентов двух групп.
При проведении окклюзии в сроки более 3 сут от начала сброса воздуха легкое расправилось в течение 1-х суток после установки блокатора лишь у 1 (9,1%) пациента, а при блокаде в сроки до 3 сут — у 11 (52,4%). Срок расправления легкого при ранней установке клапанного бронхоблокатора был в среднем на 1,52 сут меньше (47,49%), чем у пациентов, которым процедура выполнена в поздние сроки (3,18 (3,0 [2,0; 4,0]) vs 1,66 (1,0 [1,0; 2,0]); р=0,0022). В 11 случаях при ранней установке блокатора сброс воздуха прекратился в течение 1 сут, в то время как у всех пациентов при поздней установке блокатора прекращения сброса воздуха не произошло (точный критерий Фишера; р=0,0408). Средняя продолжительность поступления воздуха по плевральным дренажам при ранней установке клапана была более чем на 1,5 сут меньше (44,91%), чем при его поздней установке (3,54 (3,0 [3,0; 5,0]) vs 1,95 (1,0 [1,0; 2,0]); р=0,0024). Положительный эффект от раннего применения обструкции бронха отмечен у 18 (85,71%) пациентов группы 1б и у 6 (45,45%) пациентов группы 1а. Частота повторного вмешательства в группе 1а в 3,81 раза меньше, чем в группе 1б (54,54% vs 14,28%).
Окклюзия бронха у пациентов с острым гнойным процессом в плевральной полости и легочной ткани
Все пациенты госпитализированы в стационар с установленным диагнозом. Установку клапана в бронх производили на 2—3-е сутки после поступления в стационар. В 3 случаях через 1—2 сут после первичной проведена дополнительная процедура из-за сохраняющегося сброса воздуха. Данные по локализации установленных блокаторов в группе 1 представлены в табл. 2.
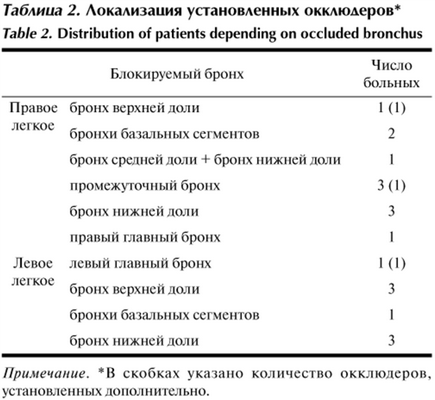
Таблица 2. Локализация установленных окклюдеров*
Примечание. *В скобках указано количество окклюдеров, установленных дополнительно.
В течение 1-х суток у 16 пациентов сброс воздуха по дренажам из плевральной полости прекратился или резко снизилась его интенсивность (рис. 1). Результаты проведенного вмешательства расценивали как хорошие, удовлетворительные или неудовлетворительные. Хорошим результатом считали ситуацию, когда прекращался сброс воздуха по плевральным дренажам и происходило расправление легкого (15—78,9% пациентов). Под удовлетворительным результатом рассматривали ситуацию, когда прекращалась утечка воздуха по плевральным дренажам, но не происходило полного расправления легкого (2—10,5% пациентов). Неудовлетворительным считали сохраняющийся сброс воздуха по дренажам и отсутствие расправления легкого (2—10,5% пациентов).
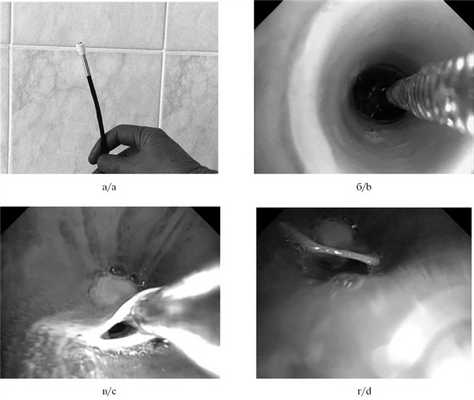
Рис. 1. Этапы установки окклюдера бронха: а — клапанный бронхоблокатор перед установкой в бронх, б — проведение бронхоблокатора, в — извлечение биопсийных щипцов, г — установленный бронохоблокатор (эндофотографии).
Данные о расправлении легкого подтверждали рентгенографией органов грудной клетки. Дренажи из плевральной полости извлекали не ранее чем через 7—10 сут после прекращения утечки воздуха.
В случае удовлетворительных результатов блокаторы оставляли на срок до 30 сут с продолжением лечения. Через 1 мес при контрольной рентгенографии органов грудной клетки: легкое полностью не расправлено, при этом остаточная плевральная полость содержит 20 и 50 мл жидкости. Дренажи из плевральной полости удалены, а результат лечения расценен как хороший. При отсутствии эффективности от окклюзии блокатор удаляли и продолжали лечение.
У 16 пациентов бронхоблокатор удаляли через 1,5—2 мес после установки. Осложнений и трудностей при удалении не возникло. Во всех случаях после удаления блокатора диагностированы признаки эндобронхита, в том числе с фибринозными наложениями на слизистой оболочке бронхиального дерева, незначительным сужением просвета бронхов. При осмотре в динамике у 3 пациентов выявлены рубцовые изменения бронхов, не вызывающие респираторных расстройств.
Окклюзия бронха у пациентов с хроническим гнойным процессом в плевральной полости и легочной ткани
Распределение пациентов в зависимости от диагноза и локализации установки блокатора представлено в табл. 3 и 4.
Таблица 3. Клинический диагноз

Таблица 4. Локализация установки блокатора*
Примечание. *В скобках указано количество блокаторов, установленных дополнительно.
Цель окклюзии бронха у этой категории пациентов — устранение сброса воздуха, подготовка остаточной плевральной полости к оперативному вмешательству и снижение осложнений в раннем послеоперационном периоде.
Дополнительная окклюзия выполнена 2 пациентам из-за сохраняющегося сброса воздуха в течение суток после установки первого блокатора. Результаты проведенного вмешательства расценивали как хорошие и неудовлетворительные. Под хорошим результатом подразумевали ситуацию, когда прекращался сброс воздуха по плевральным дренажам (10 пациентов — 90%). Неудовлетворительным считали сохраняющийся сброс воздуха (1 пациент — 9,1%).
Как правило, хороший клинический эффект возникал в течение 2 сут от установки бронхоблокатора. В этих случаях удалось добиться купирования гнойно-воспалительного процесса в плевральной полости при наличии торакостомы (5 пациентов — 45,4%) и выполнить торакомиопластику с хорошим клиническим результатом (рис. 2 и 3). При наличии несостоятельности швов культи бронха у 4 из 5 пациентов удалось добиться закрытия свища и ликвидации остаточной плевральной полости.
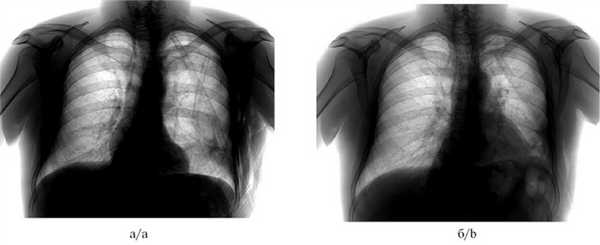
Рис. 2. Рентгенограммы органов грудной клетки пациента до (а) и после (б) выполнения окклюзии бронха.
а — пневмоторакс слева, подкожная эмфизема левой половины грудной клетки, б — через 2 сут после окклюзии, пневмоторакс разрешен, подкожная эмфизема не определяется.
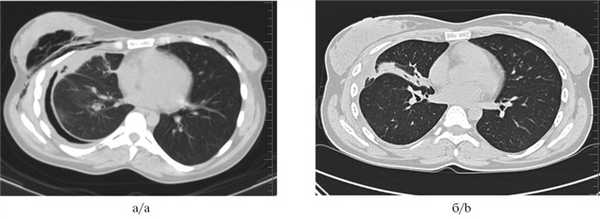
Рис. 3. Мультиспиральные компьютерные томограммы органов грудной клетки до (а) и после (б) установки бронхоблокатора.
а — определяется пневмоторакс справа, массивная подкожная эмфизема, б — через 1 мес после установки бронхоблокатора, пневмоторакс справа разрешен, верхняя доля правого легкого в состоянии ателектаза.
Бронхоблокаторы удаляли через 3—12 мес после установки при фибробронхоскопии с помощью щипцов для фибробронхоскопа или щипцов «крысиный зуб». Осложнений и трудностей при удалении не возникло. Во всех случаях после удаления блокатора диагностированы признаки эндобронхита, в том числе с фибринозными наложениями на слизистой оболочке бронхиального дерева и незначительным сужением просвета бронхов. При осмотре в динамике у 1 пациента выявлены рубцовые изменения бронхов, не вызывающие респираторных расстройств.
Окклюзия бронха у пациентов после других операций на легких
Распределение пациентов в зависимости от выполненного вмешательства представлено в табл. 5.

Таблица 5. Распределение больных в зависимости от хирургического вмешательства
Установка дополнительного блокатора потребовалась у 1 пациента. Во всех случаях отмечена положительная динамика с прекращением сброса воздуха и достижением расправления легкого. Один из пациентов с тяжелой травмой органов грудной клетки погиб из-за прогрессирования явлений полиорганной недостаточности.
Прекращение утечки воздуха произошло в течение 1-х суток после установки окклюдера у 13 пациентов (рис. 4, 5). В 2 случаях сброс прекратился в течение 2 сут после вмешательства. Положительный эффект подтвержден данными рентгенографии органов грудной клетки, при которой отмечен регресс пневмоторакса. Дренажи из плевральной полости извлекали на 2—3-и сутки после прекращения сброса воздуха. Выписку из стационара осуществляли на 3—4-е сутки после окклюзии. Средняя длительность нахождения блокатора в бронхе составила 16 сут (от 7 до 30 сут). Осложнений при удалении блокатора не отмечено. Во всех случаях зафиксированы явления эндобронхита различной степени выраженности с возникновением грануляционной ткани в месте контакта блокатора со слизистой оболочкой бронхиального дерева в 4 случаях.
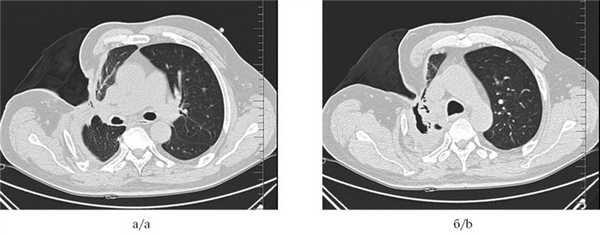
Рис. 4. Мультиспиральные компьютерные томограммы органов грудной клетки до установки клапанного бронхоблокатора (а и б): инфильтративные изменения ткани правого легкого; видны остаточная плевральная полость и торакостома.
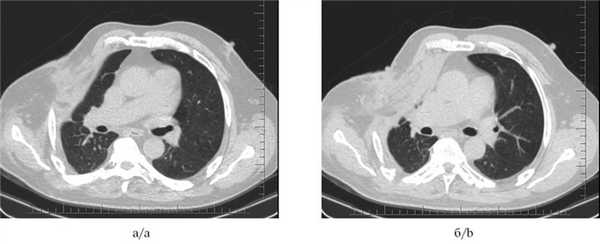
Рис. 5. Мультиспиральные компьютерные томограммы органов грудной клетки через 1 мес после установки бронхоблокатора и выполненного оперативного вмешательства (a и б): ателектаз легочной ткани; остаточная плевральная полость не определяется, торакостома ликвидирована.
Окклюзия бронха при спонтанном пневмотораксе
Во всех случаях показанием к установке клапанного бронхоблокатора являлся сброс воздуха. Осложнений при установке блокатора не было. В табл. 6 представлены данные о блокируемых бронхах.
Таблица 6. Распределение пациентов в зависимости от места установки блокатора
Дополнительную окклюзию не проводили. Клинически улучшение состояния с прекращением утечки воздуха отмечено в течение 1-х суток после установки блокатора у 14 пациентов (рис. 6). В 3 случаях утечка прекратилась в течение вторых суток после вмешательства. Положительный эффект блокации подтвержден данными рентгенографии органов грудной клетки, при которой отмечен регресс пневмоторакса. Дренажи из плевральной полости извлекали на 2—3-и сутки после прекращения сброса воздуха. Выписку из стационара осуществляли на 3—4-е сутки. Средняя длительность нахождения блокатора в бронхе составила 14 сут (от 6 до 28 сут). Осложнений при удалении блокатора не отмечено. Во всех случаях зафиксированы явления эндобронхита различной степени выраженности с возникновением грануляционной ткани в месте контакта блокатора со слизистой оболочкой бронхиального дерева в 5 случаях. При отсутствии эффекта от блокады у 1 пациента выполнена операция.
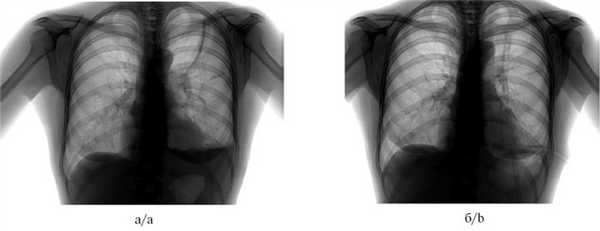
Рис. 6. Рентгенограмма органов грудной клетки пациента со спонтанным пневмотораксом до (а) и после (б) выполнения окклюзии бронха.
а — пневмоторакс слева, б — через 2 сут после окклюзии бронха, пневмоторакс разрешен.
Пиопневмоторакс
Пиопневмоторакс - заболевание плевры, развивающееся при одномоментном поступлении гноя и воздуха в плевральную щель из деструктивных легочных очагов. Пиопневмоторакс сопровождается резкой болью в груди, внезапной одышкой, кашлем, апноэ, цианозом, выраженной гипотонией, симптомами гнойной интоксикации. Диагноз пиопневмоторакса выставляется по данным рентгенографии легких, диагностической плевральной пункции. При пиопневмотораксе показаны торакоцентез с активным аспирационным дренированием, антибиотикотерапия, дезинтоксикационная терапия, при необходимости - хирургическая тактика (торакостомия, пневмоабсцессотомия, декортикация легкого и торакопластика и др.).
МКБ-10

Общие сведения
Пиопневмоторакс - особая форма бактериальной деструкции легких, характеризующаяся выходом гноя и воздуха в полость плевры и образованием легочно-плеврального свища. Пиопневмоторакс составляет до 38% случаев бактериальный деструкций легких; каждый пятый гангренозный абсцесс осложняется пиопневмотораксом. В пульмонологии пиопневмоторакс рассматривается как разновидность эмпиемы плевры. С учетом локализации пиопневмоторакс разделяют на тотальный (без сращений плевры) и ограниченный (осумкованный, при наличии плевральных спаек). Тотальный пиопневмоторакс может быть ненапряженным (простым) и напряженным, связанным с высоким давлением в плевральной полости из-за наличия клапанного механизма в области бронхоплеврального свища.
Причины
Пиопневмоторакс развивается при острых гнойно-деструктивных процессах в легких, осложняющих инфекционно-воспалительные заболевания, вызванные гноеродной микрофлорой: стафилококком, стрептококком, синегнойной палочкой; анаэробами (клебсиеллой, клостридией), а также микобактериями туберкулеза. Фоном, на котором возникает пиопневмоторакс, может служить врожденная нагноившаяся киста, абсцесс или гангрена легкого, кавернозный туберкулез, абсцедирующая пневмония, острый гнойный лобит.
Развитие пиопневмоторакса вызвано усилением воспалительного повреждения легких с формированием гнойного очага (нагноившейся кисты, абсцесса), глубокой деструкцией (каверны, некроза), разрушением ткани легкого, кортикального слоя и висцеральной плевры и вскрытием гнойника в плевральное пространство. В его течении различают стадии угрожающего прорыва, открытого легочно-плеврального свища (после перфорации очага некроза) и прикрытого легочно-плеврального свища (при склеивании краев свища с ближними участками плевры).
Интенсивность нагнетания гноя и воздуха в плевральную полость зависит от размера свища, абсцесса и сообщающегося с ними бронха, а также скорости резорбции газовой смеси плеврой. При быстром поступлении гноя и воздуха развивается синдром внутриплеврального напряжения с резким увеличением давления внутри плевры, одномоментным коллапсом легкого, смещением средостения, наступлением плевропульмонального шока. Сохранение плевробронхиального свища поддерживает доступ воздуха и гнойное воспаление плевры; прикрытые свищи могут рубцеваться или вновь открываться в плевральную щель.
Симптомы
Пиопневмоторакс может протекать в острой, мягкой и стертой клинической формах. Это определяется характером и степенью гнойно-деструктивного поражения легочной ткани, вирулентностью возбудителя, реакцией плевры на развитие воспаления. Наиболее бурное течение приобретает пиопневмоторакс, вызванный прорывом гангренозных абсцессов легкого. В клинике пиопневмоторакса выделяют 2 фазы - острых респираторных расстройств и напряженной субкомпенсации, протекающие на фоне выраженной интоксикации и температурной реакции.
Острая форма пиопневмоторакса начинается с резкой сильной боли в пораженной половине груди, внезапного приступа кашля, выраженной одышки, кратковременного апноэ. Отмечается нарастающая бледность и цианоз кожных покровов и слизистых, холодный липкий пот, резкая гипотония (до 50-70 мм.рт.ст), нитевидный пульс.
Симптомы простого и ограниченного пиопневмоторакса схожи с проявлениями эмпиемы плевры. В отсутствие клапанного механизма за счет компенсаторных реакций состояние больного постепенно стабилизируется: выравнивается пульс, приглушаются болевые симптомы. Без эвакуации гноя на первый план выходят проявления гнойной интоксикации, возможна высокая лихорадка с «гнойными» перепадами в пределах двух градусов, ознобы, проливной пот, потеря аппетита.
Для напряженного пиопневмоторакса характерно крайне тяжелое общее состояние вследствие острой дыхательной недостаточности. Больной беспокоен, принимает удобное вынужденное положение - сидя, опираясь руками о край кровати. Типично набухание шейных вен, учащение дыхания, может присутствовать клиника псевдоабдоминального синдрома с напряжением мышц передней брюшной стенки. При наличии клапанного механизма развивается подкожная эмфизема шеи, лица, грудной стенки, средостения. Стадия субкомпенсации не наступает. Нарастающая дыхательная и сердечно-сосудистая недостаточность в отсутствие медицинской помощи создают прямую угрозу для жизни.
При мягкой форме пиопневмоторакса преобладает субкомпенсированное течение, при быстром ограничении гнойной полости плевры происходит хронизация процесса. Стертые формы пиопневмоторакса могут протекать незаметно при выраженных местных и общих симптомах основного гнойно-деструктивного заболевания легких.
Диагностика
В постановке диагноза пиопневмоторакса определяющее значение имеют данные клинической картины, рентгенографии, полипозиционной рентгеноскопии и КТ легких, торакоскопии, трансторакальной пункции плевральной полости. При напряженном пиопневмотораксе определяется заметное отставание пораженной половины грудной клетки в дыхательном акте, расширение межреберных промежутков, внезапное появление коробочного звука на стороне спавшего легкого, ослабление дыхательных шумов и амфорический оттенок бронхиального дыхания.
Рентгенограмма при пиопневмотораксе характеризуется смещением органов средостения в здоровую сторону, наличием одного или нескольких горизонтальных уровней жидкости (гноя) в полости плевры, над которыми определяется резко выделяющийся воздушный пузырь. При неограниченном пиопневмотораксе наблюдается частичное или полное спадение легкого, при ограниченном процессе - вытянутые веретенообразные осумкованные гнойно-воздушные полости. Разделение листков висцеральной и париетальной плевры патогномонично для пиопневмоторакса и хорошо определяется при плеврографии после контрастного усиления.
Получение гноя и воздуха при торакоцентезе удостоверяет диагноз, предварительно поставленный пульмонологом или торакальным хирургом, а также позволяет провести микробиологическое исследование материала, взятого из плевральной полости. Необходимым этапом является дифференциальная диагностика пиопневмоторакса с острым инфарктом миокарда, ТЭЛА, бронхиальной астмой, стенокардией, прободной язвой, острым холециститом, субплевральным гангренозным абсцессом и нагноившейся кистой легкого.
Лечение
Лечение пиопневмоторакса проводится в условиях хирургического стационара и включает местные и общие мероприятия. При острой и осложненной форме показана экстренная плевральная пункция для эвакуации воздуха и снятия напряженного пневмоторакса, затем дренирование полости плевры с активной аспирацией гноя. При небольших закрытых гнойных полостях эффективно сочетание повторных промываний полости плевры растворами антимикробных препаратов с активным аспирационным дренированием. Возможна длительная катетеризация гнойника в легком через трахею и бронх с многократным лекарственным орошением. Для выведения больного из шокового состояния проводится инфузионная терапия, экстракорпоральная детоксикация (гемосорбция, плазмаферез), а также оксигенотерапия, вводятся сердечные гликозиды, кортикостероиды. Наряду с антибиотикотерапией при пиопневмотораксе применяются пассивная и активная иммунизация, иммунокоррекция.
Прогноз пиопневмоторакса серьезный и определяется тяжестью деструкции легкого. У детей, особенно в раннем возрасте, летальные случаи могут достигать 10-20%. При быстрой диагностике и правильном лечении исход в целом благоприятный. В отдаленной перспективе имеется риск необратимых изменений легочной ткани с развитием хронического неспецифического воспаления.
2. Сравнительная оценка результатов различных методов лечения пиопневмоторакса/ Бойко В.В., Лопатенко Д.Э.//Вестник КазНМУ. - 2014 - №4.
3. Применение клапанной бронхоблокации и санационной видеоторакоскопии в комплексном лечении пиопневмоторакса: Автореферат диссертации/ Швецов И. В. - 2010.
Пневмоторакс
Пневмоторакс (греч. pnéuma —воздух, thorax — грудная клетка) - скопление газа в плевральной полости, ведущее к спадению ткани легкого, смещению средостения в здоровую сторону, сдавлению кровеносных сосудов средостения, опущению купола диафрагмы, что, в конечном итоге вызывает расстройство функции дыхания и кровообращения. При пневмотораксе воздух может проникать между листками висцеральной и париетальной плевры через любой дефект на поверхности легкого или в грудной клетке. Проникающий в полость плевры воздух вызывает повышение внутриплеврального давления (в норме оно ниже, чем атмосферное) и приводит к спадению части или целого легкого (частичному или полному коллапсу легкого).



Причины пневмоторакса
В основе механизма развития пневмоторакса лежат две группы причин:
- закрытые травмы грудной клетки, сопровождающиеся повреждением легкого отломками ребер;
- открытые травмы грудной клетки (проникающие ранения);
- ятрогенные повреждения (как осложнение лечебных или диагностических манипуляций - повреждение легкого при постановке подключичного катетера, межреберной блокаде нерва, пункции плевральной полости);
- искусственно вызванный пневмоторакс - искусственный пневмоторакс накладывается с целью лечения туберкулеза легких, с целью диагностики — при проведении торакоскопии.
2. Заболевания легких и органов грудной полости:
- неспецифического характера - вследствие разрыва воздушных кист при буллезной болезни (эмфиземе) легких, прорыва абсцесса легкого в полость плевры (пиопневмоторакс), спонтанного разрыва пищевода;
- специфического характера - пневмоторакс вследствие разрыва каверн, прорыва казеозных очагов при туберкулезе.
Классификация пневмоторакса
Предложены несколько видов классификаций пневмоторакса по ведущему фактору.
По происхождению
Травматический пневмоторакс возникает в результате закрытых (без повреждения целостности кожных покровов) или открытых (огнестрельных, ножевых) травм грудной клетки, ведущих к разрыву легкого.
- 2. Спонтанный.
- первичный (или идиопатический)
- вторичный (симптоматический)
- рецидивирующий
Спонтанный пневмоторакс возникает внезапно в результате самопроизвольного нарушения целостности ткани легкого. Чаще спонтанный пневмоторакс встречается у мужчин в возрасте от 20 до 40 лет. Спонтанный пневмотракс может быть первичным, вторичным и рецидивирующим. Первичный пневмоторакс развивается, как правило, в результате буллезной болезни легких, врожденной слабости плевры, которая может легко разрываться при смехе, сильном кашле, физическом усилии, глубоком дыхании. Также к развитию идиопатического пневмоторакса может приводить ныряние, глубокое погружение в воду, полет в самолете на большой высоте.
Вторичный пневмоторакс возникает вследствие деструкции ткани легкого при тяжелых патологических процессах (абсцессе, гангрене легкого, прорыве туберкулезных каверн и др.).
В случае повторного возникновения говорят о рецидивирующем спонтанном пневмотораксе.
При искусственном пневмотораксе воздух специально вводится в плевральную полость для лечебно-диагностических целей.
По объему содержащегося в плевральной полости воздуха и степени спадения легкого
- Ограниченный (парциальный, частичный).
- Полный (тотальный).
Ограниченный пневмоторакс характеризуется неполным спадением легкого, тотальный - полным поджатием.
По распространению
При одностороннем пневмотораксе происходит частичное либо полное спадение правого или левого легкого, при двустороннем - поджатие обоих легких. Развитие тотального двустороннего пневмоторакса вызывает критическое нарушение дыхательной функции и может привести к гибели пациента в короткие сроки.
По наличию осложнений
- Осложненный (плевритом, кровотечением, медиастинальной и подкожной эмфиземой).
- Неосложненный.
- Закрытый.
- Открытый.
- Напряженный (клапанный).
При напряженном пневмотораксе формируется клапанная структура, пропускающая воздух в плевральную полость в момент вдоха и препятствующая его выходу в окружающую среду на выдохе, при этом объем воздуха в полости плевры постепенно нарастает. Клапанный пневмоторакс характеризуется следующими признаками: положительным внутриплевральным давлением (больше атмосферного), приводящим к выключению легкого из дыхания; раздражением нервных окончаний плевры, вызывающим развитие плевропульмонального шока; стойким смещением органов средостения, ведущим к нарушению их функции и сдавлению крупных сосудов; острой дыхательной недостаточностью.
Клиника пневмоторакса
Выраженность симптомов пневмоторакса зависит от причины заболевания и степени сдавления легкого.
Пациент с открытым пневмотораксом принимает вынужденное положение, лежа на поврежденной стороне и плотно зажимая рану. Воздух засасывается в рану с шумом, из раны выделяется пенистая кровь с примесью воздуха, экскурсия грудной клетки асимметрична (пораженная сторона отстает при дыхании).
Развитие спонтанного пневмоторакса обычно острое: после приступа кашля, физического усилия либо без всяких видимых причин. При типичном начале пневмоторакса появляется пронзительная колющая боль на стороне пораженного легкого, иррадиирующая в руку, шею, за грудину. Боль усиливается при кашле, дыхании, малейшем движении. Нередко боль вызывает у пациента панический страх смерти. Болевой синдром при пневмотораксе сопровождается одышкой, степень выраженности которой зависит от объема спадения легкого (от учащенного дыхания до выраженной дыхательной недостаточности). Появляется бледность или цианоз лица, иногда - сухой кашель.
Спустя несколько часов интенсивность боли и одышки ослабевают: боль беспокоит в момент глубокого вдоха, одышка проявляется при физическом усилии. Возможно развитие подкожной или медиастинальной эмфиземы - выход воздуха в подкожную клетчатку лица, шеи, грудной клетки или средостения, сопровождающийся вздутием и характерным хрустом при пальпации. Аускультативно на стороне пневмоторакса дыхание ослаблено или не выслушивается.
Примерно в четверти случаев спонтанный пневмоторакс имеет атипичное начало и развиваться исподволь. Боль и одышка незначительные, по мере адаптации пациента к новым условиям дыхания становятся практически незаметными. Атипичная форма течения характерна для ограниченного пневмоторакса, при незначительном количестве воздуха в полости плевры.
Отчетливо клинические признаки пневмоторакса определяются при спадении легкого более, чем на 30-40% . Спустя 4-6 часов после развития спонтанного пневмоторакса присоединяется воспалительная реакция со стороны плевры. Через несколько суток плевральные листки утолщаются за счет фибриновых наложений и отека, что приводит впоследствии к формированию плевральные сращений, затрудняющих расправление легочной ткани.
Осложнения пневмоторакса
Осложненное течение пневмоторакса встречается у 50% пациентов. Наиболее частыми осложнениями пневмоторакса являются:
При спонтанном и особенно клапанном пневмотораксе может наблюдаться подкожная и медиастинальная эмфизема. Спонтанный пневмоторакс протекает с рецидивами почти у половины пациентов.
Диагностика пневмоторакса
Уже при осмотре пациента выявляются характерные признаки пневмоторакса:
- пациент принимает вынужденное сидячее или полусидячее положение;
- кожные покровы покрыты холодным потом, одышка, цианоз;
- расширение межреберных промежутков и грудной клетки, ограничение экскурсии грудной клетки на пораженной стороне;
- снижение артериального давления, тахикардия, смещение границ сердца в здоровую сторону.
Специфические лабораторные изменения при пневмотораксе не определяются. Окончательное подтверждение диагноза происходит после проведения рентгенологического исследования. При рентгенографии легких на стороне пневмоторакса определяется зона просветления, лишенная легочного рисунка на периферии и отделенная четкой границей от спавшегося легкого; смещение органов средостения в здоровую сторону, а купола диафрагмы книзу. При поведении диагностической плевральной пункции получается воздух, давление в полости плевры колеблется в пределах нуля.

Лечение пневмоторакса
Первая помощь
Пневмоторакс является неотложным состоянием, требующим немедленной медицинской помощи. Любой человек должен быть готов оказать экстренную помощь пациенту с пневмотораксом: успокоить, обеспечить достаточный доступ кислорода, немедленно вызвать врача.
При открытом пневмотораксе первая помощь состоит в наложении окклюзионной повязки, герметично закрывающей дефект в стенке грудной клетки. Не пропускающую воздух повязку можно сделать из целлофана или полиэтилена, а также толстого ватно-марлевого слоя. При наличии клапанного пневмоторакса необходимо срочное проведение плевральной пункции с целью удаления свободного газа, расправления легкого и устранения смещения органов средостения.
Квалифицированная помощь
Пациенты с пневмотораксом госпитализируются в хирургический стационар (по возможности в специализированные отделения пульмонологии). Врачебная помощь при пневмотораксе состоит в проведении пункции плевральной полости, эвакуации воздуха и восстановлении в полости плевры отрицательного давления.
При закрытом пневмотораксе проводится аспирация воздуха через пункционную систему (длинную иглу с присоединенной трубкой) в условиях малой операционной с соблюдением асептики. Плевральная пункция при пневмотораксе проводится на стороне повреждения во втором межреберье по среднеключичной линии, по верхнему краю низлежащего ребра. При тотальном пневмотораксе во избежание быстрого расправления легкого и шоковой реакции пациента, а также при дефектах легочной ткани, в плевральную полость устанавливается дренаж с последующей пассивной аспирацией воздуха по Бюлау, либо активной аспирацией посредством электровакуумного аппарата.
Лечение открытого пневмоторакса начинается с его перевода в закрытый путем ушивания дефекта и прекращения поступления воздуха в полость плевры. В дальнейшем проводятся те же мероприятия, что и при закрытом пневмотораксе. Клапанный пневмоторакс с целью понижения внутриплеврального давления сначала превращают в открытый путем пункции толстой иглой, затем проводят его хирургическое лечение.
Важной составляющей лечения пневмоторакса является адекватное обезболивание как в период спадения легкого, так и в период его расправления. Для этого используют шейные вагосимпатические блокады. С целью профилактики рецидивов пневмоторакса проводят плевродез тальком, нитратом серебра, раствором глюкозы или другими склерозирующими препаратами, искусственно вызывая спаечный процесс в плевральной полости. При рецидивирующем спонтанном пневмотораксе, вызванном буллезной эмфиземой, показано хирургическое лечение (удаление воздушных кист).
Прогноз и профилактика
При неосложненных формах спонтанного пневмоторакса исход благоприятный, однако, возможны частые рецидивы заболевания при наличии патологии легких.
Специфических методов профилактики пневмоторакса не существует. Рекомендуется проведение своевременных лечебно-диагностических мероприятий при заболеваниях легких. Пациентам, перенесшим пневмоторакс, рекомендуется избегать физических нагрузок, обследоваться на ХНЗЛ и туберкулез. Профилактика рецидивирующего пневмоторакса состоит в хирургическом удалении источника заболевания.
2. Спонтанный пневмоторакс: причины его возникновения и лечение/ Фунлоэр И.С., Б.К. Жынжыров, М.А. Ашимов// Вестник КРСУ - 2016 - Т. 16, No11.
3. О спонтанном пневмотораксе/ Ясногородский О.О., Качикин А.С., Винарская В.А., Талдыкин И.М., Кернер Д.В.// Русский медицинский журнал. - 2014 - №13.
4. Спонтанный пневмоторакс: хирургическая тактика в современных условиях: Автореферат диссертации/ Письменный А.К. - 2002.
Закрытый пневмоторакс
Закрытый пневмоторакс - частичное или полное спадение легкого, обусловленное попаданием воздуха в плевральную полость; при этом плевральная полость не сообщается с внешней средой, а количество газа при дыхании не увеличивается. Проявляется болью в груди на стороне поражения, чувством нехватки воздуха, бледностью и цианозом кожных покровов, стремлением больного занять вынужденное положение, наличием подкожной эмфиземы. Диагноз закрытого пневмоторакса подтверждается аускультативно и рентгенологически. Лечебная помощь включает обезболивание, кислородотерапию, проведение плевральной пункции или дренирования.


По степени коллапса легкого в пульмонологии различают малый, или ограниченный (спадение легкого на 1/3 объема), средний (спадение на 1/2 объема) и тотальный пневмоторакс (спадение легкого более чем на половину). По сравнению с другими формами (открытым, клапанным), закрытый пневмоторакс имеет более благоприятное течение. Вместе с тем, двусторонний тотальный или напряженный пневмоторакс при неоказании своевременной помощи может привести к критической дыхательной недостаточности и летальному исходу.

Причины закрытого пневмоторакса
- Буллезная болезнь легких. В большинстве случаев к возникновению закрытого пневмоторакса приводит разрыв субплеврально расположенных воздушных кист при буллезной эмфиземе.
- Хронические бронхо-легочные заболевания: ХОБЛ, бронхоэктатическая болезнь, бронхиальная астма, туберкулез, стафилококковая деструкция легкого, пневмосклероз, муковисцидоз, пороки развития легких и др. В этих случаях происходит надрыв плевральных сращений или одиночных альвеол. Надрыв булл или спаек может быть спровоцирован физическим напряжением, натуживанием, кашлем или просто форсированным дыханием, однако нередко возникает в состоянии покоя.
Травматический пневмоторакс, как правило, является следствием закрытой травмы грудной клетки, сопровождающейся переломом ребер, разрывом легкого. К этой же группе иногда относят ятрогенный закрытый пневмоторакс, развивающийся при нарушении методики проведения плевральной пункции, трансторакальной тонкоигольной биопсии плевры, трансбронхиальной биопсии легкого, постановки подключичного катетера; баротравму при ИВЛ, сердечно-легочной реанимации. Наложение искусственного закрытого пневмоторакса (оперативная коллапсотерапия) используется как способ лечения кавернозного туберкулеза легких.
К развитию патологии предрасполагают: недоношенность (недоразвитие плевры, клетчатки средостения, соединительной ткани, бронхо-альвеолярных путей), пристрастие к курению, соединительнотканные дисплазии, отягощенная наследственность.
При закрытом пневмотораксе воздух входит в плевральную полость в момент травмы или повреждения легкого. При отсутствии клапанного механизма дефект в легочной ткани быстро закрывается, количество воздуха в плевральной полости не увеличивается, давление в ней не превышает атмосферное, флотация средостения отсутствует.
Напряженный пневмоторакс, являющийся осложнением клапанного пневмоторакса, по своему механизму может рассматриваться как закрытый. Вначале происходит поступательное нагнетание воздуха в плевральную полость через раневой канал в грудной стенке (наружный клапанный пневмоторакс) или поврежденные крупные бронхи (внутренний клапанный пневмоторакс). По мере увеличения количества воздуха и давления в плевральной полости раневой дефект спадается, что знаменует собой развитие напряженного пневмоторакса. В этом случае наблюдается дислокация структур средостения, сдавление ВПВ, жизнеугрожающие расстройства дыхания и кровообращения.
Симптомы закрытого пневмоторакса
Клиника закрытого пневмоторакса определяется болевыми явлениями, дыхательной недостаточностью и нарушением кровообращения, выраженность которых зависит от объема воздуха в плевральной полости. Заболевание чаще всего манифестирует внезапно, неожиданно для больного, однако в 20% случаев отмечается атипичное, стертое начало. При наличии небольшого количества воздуха клиническая симптоматика не развивается, а ограниченный пневмоторакс выявляется при плановом прохождении флюорографии.
В случае среднего или тотального закрытого пневмоторакса появляются резкие колющие боли в груди, иррадиирующие в шею и руку. Возникает одышка, сухой кашель, ощущение нехватки воздуха, тахикардия, цианоз губ, артериальная гипотония. Больной сидит, опираясь руками на кровать, лицо покрыто холодным потом. По мягким тканям лица, шеи, туловища распространяются подкожная эмфизема, обусловленная попаданием воздуха в подкожную клетчатку.
При напряженном пневмотораксе состояние пациента тяжелое или крайне тяжелое. Больной беспокоен, испытывает чувство страха из-за чувства удушья, жадно ловит ртом воздух. Увеличивается ЧСС, кожные покровы приобретают синюшную окраску, может развиваться коллаптоидное состояние. Описываемая симптоматика связана с полным коллапсом легкого и смещением средостения в здоровую сторону. При отсутствии неотложной помощи напряженный пневмоторакс может привести к асфиксии и острой сердечно-сосудистой недостаточности.
Диагностика закрытого пневмоторакса
Закрытый пневмоторакс может быть заподозрен пульмонологом на основании клинической картины и аускультативных данных, а окончательно подтвержден результатами рентгендиагностики. При осмотре определяется сглаживание межреберных промежутков, отставание половины грудной клетки на стороне поражения при дыхании; при аскультации - ослабление или отсутствие дыхательных шумов; при перкуссии - тимпанит; при пальпации мягких тканей с явлениями подкожной эмфиземы - характерный хруст.
С помощью рентгенографии легких удается выявить скопление свободного газа между коллабированной частью легкого и париетальной плеврой (при тотальном пневмотораксе - полный коллапс легкого с одновременным смещением средостения в здоровую сторону). Окончательным подтверждением диагноза служит получение воздуха при торакоцентезе. Непосредственные причины закрытого пневмоторакса уточняются после получения данных КТ грудной клетки или в процессе проведения диагностической торакоскопии.

КТ органов грудной клетки. Пневмоторакс в результате разрыва крупной буллы справа. Целостность плевры/грудной стенки не нарушена
Дифференциальная диагностика
Дифференцировать закрытый пневмоторакс следует от:
Лечение закрытого пневмоторакса
Малое количество воздуха в плевральной полости, не дающее симптомов, может рассасываться самостоятельно. Однако для исключения прогрессирования закрытого пневмоторакса необходим рентгенологический контроль. В клинически значимых случаях требуется госпитализация пациента в отделение торакальной хирургии или травматологии и немедленное оказание квалифицированной помощи. При транспортировке в клинику следует обезболить пациента, придать ему полусидячее положение, обеспечить ингаляции увлажненного кислорода, при артериальной гипотонии ввести вазотонические средства.
Последующее лечение закрытого пневмоторакса может производиться условно консервативным или оперативным методом. Первый метод предполагает проведение плевральной пункции с одномоментной эвакуацией воздуха либо дренирования плевральной полости с наложением дренажа по Бюлау или электровакуумного аппарата активной аспирации. Типичным местом для установки дренажа является II межреберье по среднеключичной линии.
В случае неэффективности пункционно-дренажного метода или неоднократных рецидивах закрытого пневмоторакса производится тораксокоспическое или открытое вмешательство, преследующее цель ликвидации первопричины патологии. Для недопущения повторных случаев заболевания осуществляется плевродез, приводящий к образованию сращений между листками плевры и облитерации плевральной щели.
Прогноз закрытого пневмоторакса
Прогноз закрытого пневмоторакса тесно связан с его первопричиной. Замечено, что идиопатический пневмоторакс протекает благоприятнее, чем симптоматический. Наиболее опасными являются напряженный и двусторонний пневмоторакс, приводящие к дыхательной и сердечно-сосудистой недостаточности.
К числу состояний, осложняющих закрытый пневмоторакс, относятся рецидив заболевания, плеврит, эмпиема плевры, внутриплевральное кровотечение, формирование так называемого ригидного легкого. При невыясненной или известной, но неустраненной причине закрытого пневмоторакса рецидивы на протяжении 3-х лет наблюдаются в половине случаев, после ликвидации причины - лишь в 5%.
2. Спонтанный пневмоторакс - этиопатогенез, патоморфология/Филатова А.С., Гринберг Л.М.//Уральский медицинский журнал - 2008.
Легочный свищ после экстраплеврального пневмоторакса. Ведение пациента после экстраплеврального пневмоторакса
Кафедра и клиника хирургии Института последипломного образования Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина
Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких
Журнал: Эндоскопическая хирургия. 2011;17(4): 10‑13
Корымасов Е.А., Бенян А.С. Повторные операции при длительном просачивании воздуха после видеоторакоскопических резекций легких. Эндоскопическая хирургия. 2011;17(4):10‑13.
Korymasov EA, Benian AS. Reoperations for continuous air leak after videothoracoscopic lung resections. Endoscopic Surgery. 2011;17(4):10‑13. (In Russ.).
Одно из наиболее частых осложнений после видеоторакоскопических резекций легких - длительное просачивание воздуха. Особенно очевидной представляется актуальность данной проблемы при диагностических резекциях с целью биопсии у пациентов с диффузными поражениями легких, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей. В послеоперационном периоде у этих пациентов применяются различные методы лечения: от консервативных и вспомогательных методов до повторных операций. Представленный опыт является попыткой иллюстрации общей характеристики видеоторакоскопических резекций легких, наиболее часто наблюдающихся осложнений, анализа их причин и введения лечебно-диагностического алгоритма при этих осложнениях.
В настоящее время в легочной хирургии отмечается тенденция к выбору вида операционного доступа в зависимости от объема резецируемой легочной ткани [1]. Видеоторакоскопические технологии прочно заняли свое место в хирургии буллезной эмфиземы и спонтанного пневмоторакса, округлых образований легких, патологических процессов в интерстициальной ткани легких [2]. Определяющими факторами выполнения эндоскопической операции при этом служат небольшой объем удаляемой легочной ткани и преимущественно краевой характер резекции [3]. Несмотря на то что параметры объема резецируемой ткани при открытых и видеоторакоскопических операциях существенно различаются, общей проблемой остается длительное просачивание воздуха, наблюдающееся у 3—25% пациентов [4]. Особую значимость данное осложнение приобретает при диагностических вмешательствах с целью биопсии у пациентов с диффузным поражением легких неясной этиологии, когда резекция на уровне заведомо пораженных тканей сопряжена с высоким риском персистенции бронхопульмональных свищей и развития послеоперационной эмпиемы плевры [5].
В данной работе представлена попытка определить роль и место повторных операций в тактике ведения пациентов после видеоторакоскопической резекции легкого при осложненном течении послеоперационного периода.
Материал и методы

В отделении торакальной хирургии кафедры и клиники хирургии ИПО Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина видеоторакоскопические операции выполняются с 1999 г. За этот период выполнены 267 видеоторакоскопических и 116 видеоассистированных резекций легких. Диагностические резекции легочной ткани с целью биопсии выполнялись при диффузных процессах в легких (248 пациентов). Целью таких операций была морфологическая верификация заболевания легких. В результате хирургической диагностики выявлены злокачественные процессы легких у 33 (13,3%) пациентов, туберкулез — у 12 (4,8%), хроническая обструктивная болезнь легких — у 28 (11,3%), различные виды диссеминированных и интерстициальных заболеваний легких — у 175 (70,6%). Распределение оперированных пациентов в зависимости от установленного диагноза представлено в табл. 1.

В качестве основного лечебного вмешательства видеоторакоскопические и видеоассистированные резекции легких были применены у 135 пациентов: у 98 — при буллезной эмфиземе легких, у 9 — при туберкуломах, у 18 — при доброкачественных новообразованиях и кистах легких, у 3 — при метастатическом поражении легких, у 2 — при паразитарном поражении легких. Распределение оперированных пациентов в зависимости от характера патологии представлено в табл. 2.
При выборе доступа между видеоторакоскопией и видеоассистированной операцией с миниторакотомией ориентировались на объем предполагаемой резекции и возможность использования эндоскопических режущих и сшивающих инструментов, а также на навыки и предпочтения оперирующего хирурга. Учитывали также, что по травматичности оба вида доступа почти не различаются. В любом случае видеоторакоскопия была первым этапом вмешательства с целью ревизии органов плевральной полости, оценки объема предполагаемой резекции и степени спаечного процесса. Затем в зависимости от размеров патологических объектов, их распространенности, локализации, объемов и способов резекции определяли необходимость выполнения вспомогательной миниторакотомии.
Для выполнения видеоторакоскопических резекций были применены линейные и артикуляционные сшиватели. Всего выполнено 38 стейплерных резекций легкого. Эндоскопические аппаратные резекции выполняли при буллезной эмфиземе и доброкачественных образованиях легких. При выполнении диагностических резекций с целью биопсии отдавали предпочтение бесшовной технологии резекции легкого, которую осуществляли с помощью гармонического ультразвукового скальпеля. Применение этой технологии также обосновано при удалении глубоко расположенных образований. Ультразвуковая резекция легкого была выполнена у 251 пациента преимущественно с интерстициальными заболеваниями. В большинстве случаев при резекции легкого, осуществляемой по краю долей, дополнительное прошивание легочной ткани не требовалось. Однако при локализации патологических очагов на поверхностях долей и при большой поверхности поражения резекцию дополняли эндоскопическими швами на легочную ткань. Видеоассистированные резекции легких через мини-доступ с применением ранорасширителя и сшивающих аппаратов УО-40, УДО-38 выполняли при значительном объеме поражения, обусловливающем необходимость удаления большой части легкого, а также при необходимости осуществления механического шва легочной ткани и в отсутствие эндоскопических сшивателей (у 94 пациентов).
По окончании этапа резекции принимали решение о необходимости укрепления линии легочной резекции с целью достижения аэростаза. Для этого выполняли аппликацию коллагеновых пластин ТахоКомб, которые накладывали на линию легочного шва и зону резекции в сухом виде, желтой маркированной стороной к ране и прижимали в течение 4—5 мин. Описанный способ герметизации был применен у 82 (21,4%) пациентов.
Результаты и обсуждение
Общая тактика ведения пациентов после видеоторакоскопической резекции легкого, а также такие частные ее вопросы, как применение вспомогательных методов или определение показаний к реторакоскопии, базируются на оценке расправления легкого в послеоперационном периоде. Основными объективными критериями расправления легкого являются степень просачивания воздуха по подводному дренажу, рентгенологические признаки выполнения легким всей плевральной полости, отсутствие или наличие подкожной эмфиземы. В качестве дополнительных критериев учитывали характер фоновой патологии легких, объем и уровень выполненной резекции при первой операции, методику резекции, степень дыхательной недостаточности, возраст пациента. Оценка всех критериев, проведенная с учетом фактора времени (число дней, прошедших после операции), направлена на оптимизацию тактики ведения пациентов с длительным просачиванием воздуха.
Среди 383 пациентов, оперированных в нашей клинике, длительное просачивание воздуха было отмечено у 90 (23,5%). При этом нами были выделены следующие понятия: «затянувшееся», «продленное» и «патологическое» просачивание воздуха. Затянувшимся считали просачивание воздуха более 3 сут (58 пациентов/15,1%), продленным — более 7 сут (21 пациент/5,5%), патологическим — более 10 сут (11 пациентов/2,9%).
У пациентов с затянувшимся и продленным просачиванием применяли вспомогательные методы купирования бронхопульмонального свища и послеоперационного пневмоторакса. Повторное дренирование плевральной полости при неадекватном функционировании существующих дренажей применено у 7 (1,8%) больных. С целью уменьшения объема плевральной полости 11 (2,9%) пациентам был наложен пневмоперитонеум. Плевроаспирация была использована у 24 (6,3%). Длительное дренирование у пациентов с малой остаточной полостью было предпринято в 3 наблюдениях (0,8%). Пломбировка остаточной полости аутологичной кровью позволила обтурировать послеоперационный бронхопульмональный свищ у 2 (0,5%) больных.
При сохранении патологического просачивания воздуха в сроки более 10 сут после операции и, как правило, неэффективности вспомогательных методов лечения течение послеоперационного периода считали осложненным. В подобной ситуации считали дальнейшее консервативное ведение неоправданным ввиду высокого риска развития перманентного бронхоплеврального свища и эмпиемы плевры. У 11 (2,9%) пациентов были выставлены показания к повторной операции с целью выявления и устранения причины послеоперационного пневмоторакса. Из них у 9 пациентов первой операцией была диагностическая видеоторакоскопия по поводу диффузных легочных диссеминаций неясной этиологии. Два пациента оперированы повторно после предшествующей видеоторакоскопической резекции по поводу буллезной эмфиземы. Патологическое просачивание воздуха после диагностических видеоторакоскопических резекций именно у данных пациентов, на наш взгляд, связано с основным заболеванием, по поводу которого выполнялась биопсия легкого. Краевая резекция при этом производилась на уровне заведомо пораженных тканей.
Характер исходной патологии у пациентов, которым были проведены повторные вмешательства, представлен в табл. 3.
При выборе доступа для повторного вмешательства ориентировались на выполнение реторакоскопии (у 9 пациентов) или видеоассистированной операции (у 2). Доступ в плевральную полость осуществляли через места ранее стоявших торакопортов. Выполнения дополнительных разрезов не потребовалось. Конверсия в торакотомию после предшествующей реторакоскопии была предпринята у одного больного вследствие неэффективности эндоскопических приемов устранения бронхопульмонального свища.
Наиболее частой находкой во время повторных операций были бронхопульмональные свищи в зоне резекции; они были обнаружены у 7 (1,8%) пациентов. У 5 из них во время первой операции была выполнена резекция с помощью ультразвукового скальпеля, у 2 — аппаратная резекция легкого (УО-40). Свищи располагались преимущественно на поверхностях долей, где силы растяжения легочной ткани выше. Происхождение бронхопульмональных свищей наиболее вероятно было связано с исходным состоянием легочной ткани на уровне резекции или техническими погрешностями при выполнении резекции. Визуализация зоны бронхопульмональных свищей во время повторной операции была возможна после выполнения полноценного пневмолиза в зоне резекции легкого. Как правило, наличие остаточной полости облегчает выполнение манипуляций. В наших наблюдениях все выявленные бронхопульмональные свищи имели паренхиматозное происхождение, т.е. являлись следствием несостоятельности на уровне кортикального слоя паренхимы легкого. У 4 больных свищи располагались поверхностно на уровне резекции, у 3 других — в глубине воронкообразной раны легкого.
У одного (0,3%) пациента после диагностической краевой резекции легкого также сформировался персистирующий бронхопульмональный свищ. Плановое гистологическое исследование позволило выявить неясной этиологии организующую пневмонию, что было неблагоприятным прогностическим фактором в плане возможности спонтанного закрытия свища. При повторной видеоторакоскопии причиной персистенции свища оказались плевролегочная спайка в непосредственной близи от патологической зоны и постоянная тракция легочной ткани при дыхании.
В одном (0,3%) наблюдении при реторакоскопии были выявлены буллы, не замеченные во время первой операции.
Неадекватное функционирование дренажей вследствие их миграции обнаружено при повторной операции у одного (0,3%) пациента, обтурация дренажа — также у одного (0,3%).
Окончательное распределение пациентов в зависимости от причины патологического просачивания воздуха было следующим:
Бронхопульмональный свищ в зоне резекции — 7, незамеченная неликвидированная во время первой операции причина пневмоторакса — 1; надрыв легкого из-за наличия спайки с грудной стенкой — 1; миграция дренажа — 1; обтурация дренажа — 1.
С целью устранения причины послеоперационного пневмоторакса у 7 пациентов выполнено прошивание зоны свища П-образными атравматичными швами. Несмотря на воспаление, отек и рыхлость легочной ткани, подобное прошивание достаточно эффективно и технически просто выполнимо.
У 2 больных выполнена аппаратная резекция края легкого, несущего свищ или буллу. На линию шва с целью ее укрепления во всех наблюдениях проводилась аппликация пластин ТахоКомб соответствующего размера.
У 2 пациентов с неадекватным функционированием дренажной системы соответствующее редренирование позволило ликвидировать послеоперационный пневмоторакс. Во всех случаях интраоперационно легкое расправлено с помощью гипервентиляции. Осложнений после повторных операций не отмечено. Средние сроки просачивания воздуха составили 1,5 сут, окончательного расправления легкого и удаления дренажей — 2,6 сут.
Заключение
Хирургическая тактика при длительном просачивании воздуха базируется на оценке расправления легкого в послеоперационном периоде. Объективными критериями расправления легкого являются: степень просачивания воздуха по подводному дренажу, рентгенологическая картина выполнения легким плевральной полости, отсутствие или наличие подкожной эмфиземы. Показания к реторакоскопии возникают в тех случаях, когда примененный лечебно-диагностический алгоритм оказывается неэффективен и имеются веские основания для хирургического устранения причины пневмоторакса, поскольку дальнейшее выжидание сопряжено с высоким риском развития послеоперационной эмпиемы плевры с бронхоплевральным свищем. Во время повторного видеоторакоскопического вмешательства можно визуализировать область бронхопульмонального свища, выполнить прошивание этой зоны, провести дополнительные мероприятия по обеспечению аэростаза, выполнить прицельное адекватное дренирование плевральной полости.
Читайте также:
- Содержание крови в легких. Резервная кровь в легких
- Давление в легочной артерии у торакальных больных. Оперативные вмешательства при легочной гипертензии
- Перикардит и тампонада сердца у гематологических больных
- Макроскопическое исследование опухолей мягких тканей. Получение препаратов сарком.
- Прогноз множественного рака тонкой кишки. Пример множественных опухолей тонкой кишки
