Хориоидальная неоваскуляризация (ХНВ) у ребенка
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Цель: Описать прогрессирование прогрессирование ПНВ в АХН1/ПХВ.
Дизайн: Проспективное лонгитюдное когортное исследование.
Методы: В исследование включались пациенты с диагнозом ПНВ, наблюдавшиеся ≥ 2 лет. В рамках исследования применялись методы мультимодальной визуализации, включающие в себя оптическую когерентную томографию, флуоресцеиновую и индоцианиновую зеленую ангиографию. Полученные изображение анализировались на предмет наличия хориоидальной неоваскуляризации (ХНВ), аневризм внутри/на краях ХНВ, также проводилась оценка субфовеальной толщины хориоидеи (СФТХ). Оценивались скорость прогрессирования ПНВ в АХН1/ПХВ и сопутствующие факторы риска.
Результаты: Всего в исследование было включено 37 глаз с ПНВ от 32 пациентов, средний период наблюдения составил 3.3±1.1 (2.0 - 5.2) года. На момент постановки диагноза ПНВ средний возраст был равен 59.7±8.7 (38.5 - 78.0) годам, среднее значение СФТХ составляло 357±92 (185 - 589) мкм. За период наблюдения, в среднем через 3.4±0.8 года (2.3 - 4.2 года), в 5 глазах (13.5 %) образовались аневризмы, определяемые как АХН1/ПХВ. Риск перехода в АХН1/ПХВ составлял 7,4 % на 3-й год, 13,6 % на 4-й год и 30,7 % на 5-й год. В среднем в год пациентам проводилось от 5,2 ± 4,0 до 8,1 ± 3,4 интравитреальных инъекций препаратов анти-VEGF, что привело к значительному снижению СФТХ до 317 ± 104 (от 122 до 589) мкм (p = 0,0007). Возраст на момент постановки диагноза ПНВ был значительно ниже в глазах, в которых АХН1/ПХВ развилось позже (54,0±5,6 (от 45,9 до 60,5) против 61,2±8,4 (38,5-78,0) лет, p=0,025). В конце наблюдения СФТХ в среднем снизилась на -14,0±17,6 (-55,9 до 23,1)% в группе ПНВ, в то время как данный показатель увеличился в среднем на 6,9±4,4 (0,00 до 10,8)% при прогрессировании до АХН1/ПХВ (р=0,0025).
Выводы: В рамках этой работы, переход в АХН1/ПХВ был отмечен в в 13,5 % глаз, а риск прогрессирования по оценке Каплана Мейера составил 7,4 % на 3-й год, 13,6 % на 4-й год и 30,7 % на 5-й год. Более молодой возраст при постановке диагноза ПНВ и устойчивое утолщение хориоидеи, несмотря на анти-VEGF терапию, могут являться факторами риска прогрессирования ПНВ в АХН1/ПХВ.
Хирургическое лечение
1. Анти-VEGF терапия (Препаратами Луцентис и Эйлеа):
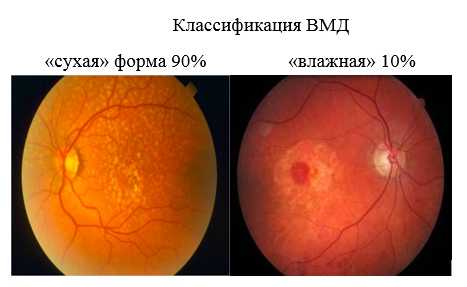
Возрастная макулярная дегенерация:
По данным Всемирной Организации Здравоохранения, возрастная макулярная дегенерация (ВМД) является одной из наиболее частых причин слепоты и слабовидения у лиц старшей возрастной группы. ВМД — хроническое дегенеративное нарушение, которым чаще всего страдают люди после 50 лет. В России заболеваемость ВМД составляет 15 на 1000 населения. Это социально значимое заболевание, занимает второе место среди причин инвалидности по зрению во всем мире.
ВМД проявляется прогрессирующим ухудшением центрального зрения и необратимым поражением макулярной зоны. Макулодистрофия — двустороннее заболевание (до 60% случаев поражаются оба глаза), однако, как правило, поражение более выражено и развивается быстрее на одном глазу, на втором глазу ВМД может начать развиваться через 2-5 лет. Очень часто пациент не сразу замечает проблемы со зрением, поскольку на начальном этапе заболевания всю зрительную нагрузку на себя берёт лучше видящий глаз.
ВАЖНО! При снижении остроты зрения как вдаль, так и на близком расстоянии; затруднениях, возникающих при чтении и письме; появлении перед глазом полупрозрачного фиксированного пятна, а также искажении контуров предметов, их цвета и контрастности — следует немедленно обратиться к врачу офтальмологу для диагностики, постановки точного диагноза и выбора метода лечения.
Высокоинформативным является самоконтроль зрительных функций каждого глаза в отдельности при помощи теста Амслера.
Факторы риска развития ВМД:
- Возраст старше 50 лет
- Пол (женщины)
- Наследственная предрасположенность
- Курение
- Частое употребление алкоголя
- Интенсивное воздействие света (УФ)
- Изменение антиоксидантного статуса (неправильное питание)
- Повышенный индекс массы тела
Симптомы «влажной» формы ВМД:
- Резкое снижение остроты зрения, отсутствие возможности улучшить зрение очковой коррекцией
- Затуманенность зрения, снижение контрастной чувствительности
- Выпадение отдельных букв или искривление строчек при чтении
- Искажение предметов (метаморфопсии)
- Появление темного пятна перед глазом (скотома)

Основная цель лечения влажной формы ВМД
Воздействовать на хориоидальную неоваскуляризацию, т.е. препятствовать росту новообразованных сосудов и повышенной проницаемости сосудистой стенки.
В настоящее время так называемая анти-VEGF терапия полностью изменила подходы к лечению ВМД, позволяя сохранить зрение и поддержать качество жизни миллионов людей во всем мире. Анти-VEGF терапия может не только уменьшить прогрессирование ВМД, но в некоторых случаях даже позволяет улучшить зрение. Лечение эффективно, но только в тех случаях, когда оно проведено до образования рубцовой ткани и до необратимой потери зрения.
Препараты для лечения возрастной макулярной дегенерации - ЛУЦЕНТИС (Lucentis) и ЭЙЛЕА (Eylea)
Первым препаратом для анти-VEGF терапии в виде интравитреальных инъекций, сертифицированным в России в 2008 для применения в офтальмологии, был ЛУЦЕНТИС, совершивший настоящую революцию в лечении ВМД и ставший «золотым стандартом». В Хабаровском филиале ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России Луцентис применяется с 2009г.
Частота приема и дозировка
Анти-VEGF терапия выполняется в условиях стерильной операционной врачом-офтальмологом.
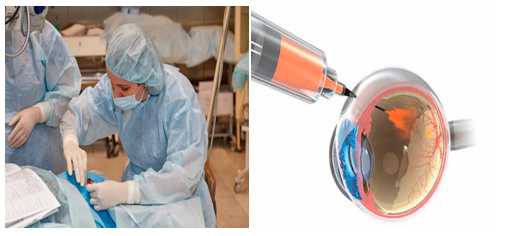
Луцентис (ранибизумаб) вводится интравитреально 0,5 мг (0,05 мл) в режиме, включающем 3 следующих друг за другом «загрузочных» интравитреальных введения данного препарата с последующим ежеквартальным мониторингом состояния глазного дна и возобновлением поддерживающей терапии в виде дополнительных интравитреальных инъекций при неполном регрессе, либо рецидивах экссудативно-геморрагической активности.
Интравитреальное введение Луцентиса позволяет остановить прогрессирование этого заболевания, а в ряде случаев улучшить функциональные и анатомические показатели. Современное оборудование в ХФ МНТК позволяет выявить это заболевание на самых ранних стадиях и предложить пациентам соответствующее лечение.
Эйлеа (афлиберцепт) вводится интравитреально 2мг (0,05 мл).
Терапию начинают с введения трех последовательных инъекций 1 раз в месяц, затем выполняют по потребности, в зависимости от активности процесса.
Сама процедура интравитреальных инъекций проводится в условиях операционной МНТК под местной капельной анестезией. Продолжительность процедуры 3-5 минут.
В ряде крупных международных испытаний и в реальной клинической практике были доказаны активность и безопасность препаратов Луцентис и Эйлеа. Результаты поистине впечатляют - у большинства пациентов не только остановилось прогрессирование заболевания, и сохранилась острота зрения, но этот показатель значительно улучшился.
Клинический случай: Пациент К., 76 лет
Как и любое другое оперативное вмешательство интравитреальное введение Луцентиса и Эйлеа может вызвать ряд осложнений, но процент их очень низок, что позволяет говорить об относительной безопасности этого метода лечения. Эффективность и безопасность - вот основные составляющие успеха этого метода во всем мире.
Миопическая хориоидальная неоваскуляризация (ХНВ)
Миопия — самое распространенное нарушение рефракции у людей трудоспособного возраста во всем мире. В России в структуре инвалидности патологическая миопия (ПМ) занимает 2 место. Частота инвалидности — 4,5 случая на 10000 населения.
Хориоидальная неоваскуляризация (ХНВ) — одно из самых серьезных осложнений ПМ. При миопической ХНВ 36% инвалидов имеют 1и 2 группу.
Жалобы предъявляемые пациентами с миопической ХНВ:
- Снижение зрения
- Искажение предметов (метаморфопсии)
- Появление темного пятна перед глазом (скотомы)
- Вспышки света или плавающие помутнения в поле зрения
Современные возможности лечения ХНВ при дегенеративной миопии - применение Анти-VEGF терапии - Луцентис и Эйлеа.
Кратность и длительность применения определяет лечащий врач.
Тромбоз (окклюзия) вен сетчатки
Тромбоз вен сетчатки - острое нарушение кровообращения в сосудах сетчатки. Заболевание это достаточно часто встречается (2,14 случая на 1000 человек) и может привести к стойкому и значительному снижению зрения, вплоть до слепоты. Окклюзии вен сетчатки нередко называют сосудистыми катастрофами. Основным клиническим симптомом тромбоза вен сетчатки является резкое безболезненное снижение зрения или выпадения полей зрения одного глаза. Чаще всего окклюзия вен сетчатки развивается на фоне артериальной гипертензии, атеросклероза, сахарного диабета, а также состояний, сопровождающихся нарушением вязкости крови (наследственные и приобретенные тромбофилии, лейкемия, прием диуретиков, противозачаточных препаратов и многое другое).
Наиболее типичной локализацией тромбоза является место выхода центральной вены сетчатки в толще зрительного нерва (окклюзия центральной вены сетчатки) и артериовенозный перекрест 1-го или 2-го порядка (окклюзия ветви центральной вены сетчатки). В результате предрасполагающих факторов, в месте пересечения вены сетчатки с артерией, происходит компрессия вены, локальное замедление кровотока в ней и формирование тромба, частично или полностью закрывающего просвет сосуда. Происходит резкое нарушение или прекращение венозного оттока по пораженной вене. Это приводит к резкому нарушению перфузии тканей сетчатки, гипоксии (кислородному голоданию), ишемии (появлению участков микроинфарктов сетчатки), повышению сосудистой проницаемости, появлению кровоизлияний и развитию отека сетчатки.
Макулярный отек - главное осложнение, приводящее к снижению зрения.
Диагностика тромбоза вен сетчатки.
Постановка диагноза не составляет большого труда. Для этого необходим осмотр глазного дна врачом-офтальмологом при помощи специальных диагностических линз на широком зрачке. Для выявления тяжести поражения и определения наиболее подходящей лечебной тактики, возможно проведение дополнительных диагностических методов, таких как оптическая когерентная томография (ОКТ) и ангио-ОКТ.
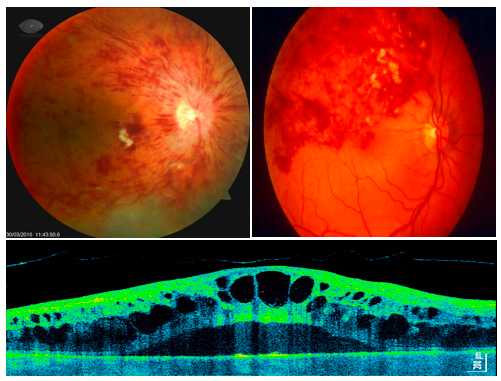
Лечение:
Лечение должно быть начато сразу после постановки диагноза.
Учитывая тот факт, что в подавляющем большинстве случаев заболевание возникает на фоне скачка артериального давления, необходима нормализация его уровня. Стабилизация соматического состояния является залогом успешного лечения. Необходимо определить параметры свертывающей системы крови.
Согласно современным мировым стандартам, в максимально ранние сроки после свершившегося тромбоза, необходимо провести интравитреальное введение специального препарата, направленного на подавление макулярного отека сетчатки. В настоящее время существует 3 основных препарата, обладающих высокой эффективностью в отношении макулярного отека на фоне окклюзии вен сетчатки: анти-VEGF препараты: Луцентис и Эйлеа, а также внутриглазной имплантат с дексаметазоном Озурдекс. При легкой степени нарушений сетчатки для восстановления или улучшения зрения может быть достаточно одной инъекции анти-VEGF препарата или внутриглазного имплантата. В тяжелых случаях могут потребоваться неоднократные инъекции препаратов, которые необходимо комбинировать или сочетать с лазерной коагуляцией сетчатки. Интравитреальное введение вышеперечисленных препаратов проводится в условиях стерильной операционной МНТК, под местной капельной анестезией.
Необходимо помнить, что своевременная диагностика и вовремя начатое адекватное лечение значительно повышает шансы на восстановление зрения при тромбозе вен сетчатки.
При запоздалом и неправильном лечении возможно развитие атрофии зрительного нерва, неоваскулярной глаукомы и рубцовых изменений сетчатки.
Диабетическая ретинопатия
Диабетический макулярный отек (ДМО) выявляется у 27% пациентов с не менее чем 9 летним стажем СД1 типа, и у 28% с не менее чем 20 летним стажем СД2 типа. При отсутствии лечения 32% больных с «клинически значимым ДМО» имеют 3-летний риск серьезной потери центрального зрения.
Основными направлениями лечения ДМО в настоящее время являются:
- Нормализация гликемии, АД и липидного профиля
- Лазеркоагуляция сетчатки
- Интравитреальное введение анти-VEGF-препаратов*
- Интравитреальное введение кортикостероидов (имплантат Озурдекс)
- Эндовитреальная хирургия
*«Загрузочная» фаза при лечении ДМО для луцентиса составляет 3 или более ежемесячные инъекции, для афлиберцепта -5, затем препараты вводятся по показаниям в зависимости от активности процесса.
Субретинальная неоваскулярная мембрана при центральной серозной хориоретинопатии.
Центральная серозная хориоретинопатия (ЦСХР) — заболевание заднего полюса глаз широко распространенное во всем мире. Оно занимает четвертое место среди заболеваний сетчатки после возрастной макулярной дегенерации, диабетической и посттромботической ретинопатии и чаще встречается у молодых пациентов.
Жалобами таких пациентов является наличие «пятна», размытости перед пораженным глазом, снижение зрения.
Так же в ряде случаев, это заболевание может вызвать рост новообразованных сосудов - субретинальную неоваскулярную мембрану (СНМ), при котором значительно снижается острота зрения.
Для лечением развившейся СНМ используется интравитреальное введение препарата Ранибизумаб (Луцентис). Режим лечения подбирают индивидуально для каждого пациента, основываясь на активности заболевания. Некоторым пациентам может потребоваться только одна инъекция в течение первого года лечения, другим же могут потребоваться более частые инъекции, включая ежемесячные.
2. Кросслинкинг роговичного коллагена:
В 2014г. в отделении был внедрен способ лечения пациентов с кератоконусом и тяжелыми эпителиально-эндотелиальными дистрофиями роговицы — кросслинкинг роговичного коллагена. Методика перекрестного связывания коллагена, разработанная G. Wollensak, T. Seiler, в 2003 г., основана на эффекте фотополимеризации стромальных волокон под воздействием фоточувствительной субстанции (раствор рибофлавина) и низких доз ультрафиолетового излучения. Перекрестное связывание коллагена приводит к биомеханической стабилизации роговицы, в основе которой лежит увеличение числа интра - и интерфибриллярных ковалентных связей.
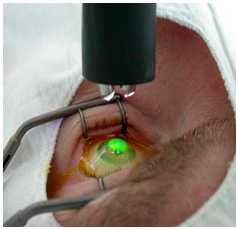
Кросслинкинг роговичного коллагена эффективный метод, позволяющий добиться биомеханической стабилизации и остановки прогрессирования заболевания.
Традиционным способом проводим лечение пациентов на 1-2 стадиях кератоконуса.
Методом трансэпителиального кросслинкинга (модифицированный трансэпителиальный метод ионофореза, разработанный в Уфимском НИИ глазных болезней, способствующий проникновению рибофлавина в роговицу без удаления эпителия, и последующему проведению кросслинкинга роговичного коллагена) - с тяжелыми эпителиально-эндотелиальными дистрофиями (ЭЭД) различного генеза.
3. Реваскуляризирующие операции:
С 1995 г. в ХФ МНТК внедрены и успешно применяются по настоящее время при заболеваниях сетчатки и зрительного нерва операции с использованием биоматериала серии «Аллоплант», разработанные во Всероссийском центре глазной и пластической хирургии профессором Э.Р. Мулдашевым (г. Уфа).
Аллоплант — уникальный биоматериал, который стимулирует поражённые ткани и органы самостоятельно восстанавливаться. Происходит процесс самооздоровления за счёт регенерации тканей, усиленного роста новых здоровых клеток.
Полученные коллективом Всероссийского Центра глазной и пластической хирургии научные результаты и их практическая реализация позволили на основе трансплантационной технологии Аллоплант развить концепцию регенеративной хирургии. Аллоплант одобрен Министерством Здравоохранения Российской Федерации.
При использовании различных видов биоматериалов Аллоплант можно стимулировать регенерацию кровеносных и лимфатических сосудов, роговицы, склеры, кожных покровов, конъюнктивы, нервов, паренхимы печени, слизистой оболочки ЖКТ и т.д.
За последние три десятилетия Аллоплант был успешно использован при лечении диабетической ретинопатии, ретинопатии недоношенных, пигментного ретинита, атрофии и невритов зрительного нерва, увеитов, тромбозов вен сетчатки, бельм, травм, кератитов, миопии, ожогов и врожденных дефектов. Аллоплант широко применяется в офтальмологии, пластической хирургии, стоматологии, грудной хирургии, нейрохирургии, проктологии, ортопедии, травматологии, хирургии печени, гинекологии и т.д.
Биоматериалы Аллоплант - изготавливаются из кадаверных тканей человека.

Механизм лечебного действия Аллопланта:
- стимуляция локальной воспалительной реакции — приток крови к тканям
- формирование новообразованных сосудов из склеры - улучшение метаболизма
- стимуляция роста лимфатических сосудов — выведение из глаза продуктов метаболизма.
Виды АЛЛОПЛАНТОВ, применяемых при лечении заболеваний заднего отрезка глаза:
- Аллоплант для реваскуляризации хориоидеи
- Аллоплант для реваскуляризации зрительного нерва
- Аллоплант для аутолимфосорбции
- Аллоплант для стимуляции фагоцитоза, васкулогенеза
- Аллоплант для лечебного ретросклеропломбирования.
Применение Аллопланта при различной офтальмологической патологии:
- реваскуляризация зрительного нерва (частичная атрофия зрительного нерва, дегенеративная миопия)
- реваскуляризация хориоидеи (дистрофии сетчатки)
- аутолимфосорбция (гемофтальм, увеиты, субатрофия глазного яблока)
- введение стимуляторов васкулогенеза (частичная атрофия зрительного нерва, дегенеративная миопия)
- введение стимулятора фагоцитоза («влажная» форма возрастной макулодистрофии, макулярный отек)
- биостимуляция роговицы (дистрофии роговицы)
Аллоплант дает возможность лечить болезни, считающиеся «безнадежными». Он провоцирует организм на усиленное производство собственных здоровых клеток, гасит воспаление, стимулирует иммунитет.
Для ЛЕЧЕНИЯ в отделении комплексно-реабилитационного лечения Пациенту необходимо иметь при себе:
- Направление от офтальмолога по месту жительства по форме 057/у-04. Внимание! Отсутствие данного направления может быть причиной отказа в оказании плановой медицинской помощи по ОМС.
- Паспорт (свидетельство о рождении), документы, удостоверяющие льготы (оригинал и копию).
- Пригласительное письмо.
- Полис обязательного медицинского страхования (оригинал и копию).
- Страховое свидетельство государственного пенсионного страхования
- СНИЛС (оригинал и копию).
- Справка из бухгалтерии о наименовании учреждения для правильного оформления листка нетрудоспособности (не более 29 символов) — для работающих граждан.
- Результаты обследования и заключения специалистов:
— Общий анализ крови + тромбоциты (действителен 10 дней)
— Свертываемость и длительность кровотечения, ПТИ (действителен 1 месяц). Для пациентов, получающих варфарин — МНО
— Анализ крови на сахар (действителен 10 дней)
— ЭКГ с описанием (при патологии — заключение кардиолога) (действительна 1 месяц)
— Результат флюорографии органов грудной клетки (действителен 1 год)
Консультации специалистов (иметь при себе бланки анализов, оригиналы или ксерокопии):
— Заключение терапевта, эндокринолога (если получает препараты, указать название и дозировку — действительно 1 месяц)
После прохождения комплексного обследования в диагностическом отделе ХФ МНТК “Микрохирургия глаза” и консультации врача определяются показания к оперативному лечению.
При наличии показаний операция будет выполнена на следующий рабочий день. Иногородним пациентам необходимо заранее позаботится о проживании в гостиницах г. Хабаровска
ВНИМАНИЕ. Точную стоимость платного лечения можно будет сказать только после очной консультации, когда будет определено состояние глаз пациента и составлен план лечения.
Оптическая когерентная томография в диагностике хориоидальной неоваскуляризации у детей
Цель. Сообщить о случаях хориоидальной неоваскуляризации (ХНВ) у детей и описать связанные с данной патологией структурные и гемодинамические изменения сетчатки, выявленные по данным оптической когерентной томографии (ОКТ) и ОКТ-ангиографии (ОКТА).
Методы. Обследовано 6 детей (4 девочки, 2 мальчика) в возрасте от 7 до 17 лет с ХНВ, ассоциированной с патологической миопией, посттравматическим разрывом хориоидеи и аномалиями диска зрительного нерва. Активность неоваскулярных комплексов оценивали по данным офтальмоскопии, ОКТ и ОКТА. Максимальный срок наблюдения 4 года.
Результаты. Выявлено 7 случаев ХНВ. У одного ребёнка процесс был двусторонний. Миопические и посттравматическая мембраны были локализованы суб- и юкстафовеолярно и представляли собой мембраны 2-го типа. У детей с аномалиями диска зрительного нерва мембраны 1-го и смешанного (1-го и 2-го) типов располагались экстрафовеолярно. Снижение остроты зрения определялось локализацией мембран, выраженностью отёка и тяжестью дистрофических изменений сетчатки. На ОКТ в проекции активных мембран визуализировались субретинальная жидкость и гиперрефлективный материал, соответствующий кровооизлияниям. На ОКТА выявлялась сеть мелких капилляров с большим количеством петель и анастамозов. Интравитреальные инъекции ингибиторов ангиогенеза выполнены в 5 случаях. Стойкий эффект после однократной инъекции наблюдался в 2 случаях. Возврат активности мембран в 3 случаях позволил обосновать повторное введение ингибиторов ангиогенеза. Наряду со снижением активности ХНВ были выявлены прогрессирующие дистрофические изменения пигментного эпителия вокруг мембраны.
Заключение. Продемонстрирована высокая чувствительность ОКТ для раннего выявления структурных и гемодинамических нарушений сетчатки, определения активности неоваскулярных комплексов, прогнозирования исходов заболевания и оценки эффективности лечебных мероприятий. Прогрессирование дистрофических изменений пигментного эпителия сетчатки в ответ на терапию ингибиторами ангиогенеза обусловливает необходимость длительного наблюдения за детьми и определения оптимальной стратегии лечения ХНВ в детском возрасте.
Ключевые слова
Полный текст
Об авторах
Светлана Ивановна Жукова
Федеральное государственное автономное учреждение «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» имени академика С.Н. Фёдорова» Министерства здравоохранения Российской Федерации
канд. мед. наук, врач-офтальмолог
Россия, 664033, Иркутск, ул. Лермонтова, д. 337
Дмитрий Юрьевич Самсонов
Игорь Владимирович Злобин
Список литературы
- Bressler N.M. Age-related macular degeneration is the leading cause of blindness // JAMA. 2004. Vol. 291, No. 15. P. 1900-1901. doi: 10.1001/jama.291.15.1900
- Friedman D.S., O’Colmain B.J., Munoz B., et al. Prevalence of age-related macular degeneration in the United States // Arch Ophthalmol. 2004. Vol. 122, No. 4. P. 564-572. doi: 10.1001/archopht.122.4.564
- Resnikoff S., Pascolini D., Etya’ale D., et al. Global data on visual impairment in the year 2002 // Bull World Health Organ. 2004. Vol. 82, No. 11. P. 844-851.
- Bird A.C., Bressler N.M., Bressler S.B., et al. An international classification and grading system for age-related maculopathy and age-related macular degeneration. The International ARM Epidemiological Study Group // Surv Ophthalmol. 1995. Vol. 39, No. 5. P. 367-374. doi: 10.1016/s0039-6257(05)80092-x
- Li Y.H., Cheng C.K., Tseng Y.T. Clinical characteristics and antivascular endothelial growth factor effect of choroidal neovascularization in younger patients in Taiwan // Taiwan J Ophthalmol. 2015. Vol. 5, No. 2. P. 76-84. doi: 10.1016/j.tjo.2015.03.001
- Miller D.G., Singerman L.J. Vision loss in younger patients: a review of choroidal neovascularization // Optom Vis Sci. 2006. Vol. 83, No. 5. P. 316-325. doi: 10.1097/01.opx.0000216019.88256.eb
- Spaide R.F. Choroidal neovascularization in younger patients // Curr Opin Ophthalmol. 1999. Vol. 10, No. 3. P. 177-181. doi: 10.1097/00055735-199906000-00005
- Cohen S.Y., Laroche A., Leguen Y., et al. Etiology of choroidal neovascularization in young patients // Ophthalmology. 1996. Vol. 103, No. 8. P. 1241-1244. doi: 10.1016/s0161-6420(96)30515-0
- Sears J., Capone A. Jr, Aaberg T.Sr., et al. Surgical management of subfoveal neovascularization in children // Ophthalmology. 1999. Vol. 106, No. 5. P. 920-924. doi: 10.1016/S0161-6420(99)00510-2
- Rich R., Vanderveldt S., Berrocalet A.M.. Treatment of Choroidal Neovascularization Associated with Best’s Disease in Children // J Pediatr Ophthalmol Strabismus. 2009. Vol. 46, No. 5. P. 306-311. doi: 10.3928/01913913-20090903-10
- Grewal D.S., Tran-Viet D., Vajzovic L., et al. Association of pediatric choroidal neovascular membranesat the temporal edge of optic nerve and retinochoroidal coloboma // Am J Ophthalmol. 2017. Vol. 174. P. 104-112. doi: 10.1016/j.ajo.2016.10.010
- Rotruck J. A Review of Optic Disc Drusen in Children // Int Ophthalmol Clin. 2018. Vol. 58, No. 4. P. 67-82. doi: 10.1097/iio.0000000000000236
- Аверьянов Д.А., Алпатов С.А., Жукова С.И., и др. Оптическая когерентная томография в диагностике глазных болезней / под ред. проф. А.Г. Щуко, проф. В.В. Малышева. М.: ГЕОТАР-Медиа, 2010. 126 с.
- Ong S.S., Hsu S.T., Grewal D., et al. Appearance of pediatric choroidal neovascular membranes on optical coherence tomography angiography // Graefes Arch Clin Exp Ophthalmol. 2020. Vol. 258, No. 1. P. 89-98. doi: 10.1007/s00417-019-04535-4.
- Veronese C., Maiolo C., Huang D., et al. Optical coherence tomography angiography in pediatric choroidal neovascularization // Am J Ophthalmol Case Rep. 2016. Vol. 2. P. 37-40. doi: 10.1016/j.ajoc.2016.03.009
- House R.J., Hsu S.T., Thomas A.S., et al. Vascular findings in a small retinoblastoma tumor using OCT angiography // Ophthal Retina. 2019. Vol. 3, No. 2. P. 194-195. doi: 10.1016/j.oret.2018.09.018
- Hsu S.T., Chen X., House R.J., et al. Visualizing macular microvasculature anomalies in 2 infants withtreated retinopathy of prematurity // JAMA Ophthalmol. 2018. Vol. 136, No. 12. P. 1422-1424. doi: 10.1001/jamaophthalmol.2018.3926
- Hsu S.T., Chen X., Ngo H.T, et al. Imaging infant retinal vasculature with OCT angiography // Ophthalmol Retina. 2018. Vol. 3, No. 1. P. 95-96. doi: 10.1016/j.oret.2018.06.017
- Hsu S.T., Finn A.P., Chen X., et al. Macular microvascular findings in familial exudative vitreoretinopathy on optical coherence tomography angiography // Ophthalmic Surg Lasers Imaging Retina. 2019. Vol. 50, No. 5. P. 322-329. doi: 10.3928/23258160-20190503-11
- Wong Y.L., Saw S.M. Epidemiology of pathologic myopia in Asia and worldwide // Asia Pac J Ophthalmol. 2016. Vol. 5, No. 6. P. 394-402. doi: 10.1097/APO.0000000000000234
- Gao L.Q., Liu W., Liang Y.B., et al. Prevalence and characteristics of myopic retinopathy in a rural Chinese adult population: The Handan Eye Study // Arch Ophthalmol. 2011. Vol. 129, No. 9. P. 1199-204. doi: 10.1001/archophthalmol.2011.230
- Ohno-Matsui K., Jonas J.B., Spaide R.F. Macular Bruch membrane holes in choroidal neovascularization-related myopic macular atrophy by swept-source optical coherence tomography // Am J Ophthalmol. 2016. Vol. 162. P. 133-139.e1. doi: 10.1016/j.ajo.2015.11.014
- Traboulsi E.I., Jurdi-Nuwayhid F., Torbey N.S., et al. Aniridia, atypical iris defects, optic pit and the morning glory disc anomaly in a family // Ophthalmic Paediatr Genet. 1986. Vol. 7, No. 2. P. 131-135. doi: 10.3109/13816818609076122
- Safari A., Jafari E., Borhani-Haghighi A. Morning glory syndrome associated with multiple sclerosis // Iran J Neurol. 2014. Vol. 13, No. 3. P. 177-180.
- Steinkuller P.G. The morning glory disk anomaly: Case report and literature review // J Pediatr Ophthalmol Strabismus. 1980. Vol. 17, No. 2. P. 81-87.
Дополнительные файлы
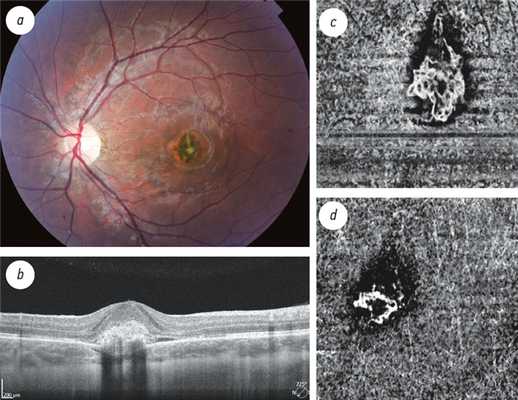
1. Рис. 1. Посттравматическая хориоидальная неоваскуляризация у мальчика 7 лет: а — фото глазного дна; b — структурная оптическая когерентная томограмма; оптическая когерентная томография-ангиография, 3 × 3 мм; c — уровень хориокапилляров: до лечения; d — 2-е сутки после лечения (объяснение в тексте)
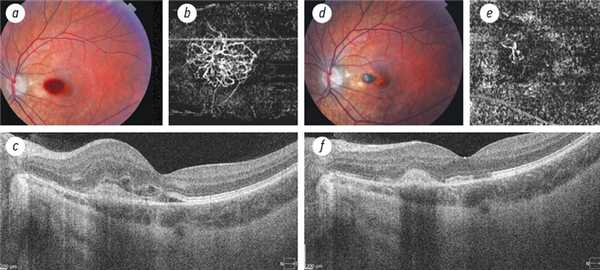
2. Рис. 2. Хориоидальная неоваскуляризация у пациентки 16 лет с патологической миопией, переднезадняя ось — 27,6 мм, острота зрения до лечения — 0,2, после лечения — 0,9: a — фото глазного дна; оптическая когерентная томография-ангиография, 3 × 3 мм: b — уровень наружной сетчатки, c — структурная оптическая когерентная томография до лечения; d — фото глазного дна; оптическая когерентная томография-ангиография, 3 × 3 мм: е — уровень наружной сетчатки, f — структурная оптическая когерентная томография через 2 месяца после повторной инъекции ингибиторов ангиогенеза (объяснение в тексте)
3. Рис. 3. Хориоидальная неоваскуляризация у пациентки 17 лет с патологической миопией, переднезадняя ось — 30,2, острота зрения — 0,05 оставалась неизменной на протяжении всего периода наблюдения: а — фото глазного дна при первичном обращении; b — через 2 месяца; с — структурная оптическая когерентная томография; d — оптическая когерентная томография-ангиография, 3 × 3 мм, уровень наружной сетчатки (объяснение в тексте). Стрелками указана площадь хориоретинальной дистрофии
4. Рис. 4. Хориоидальная неоваскуляризация, ассоциированная с друзами диска зрительного нерва у девочки 12 лет. Динамическое наблюдение за пациенткой в течение 3 месяцев: a-c — фото глазного дна; d-f — структурная оптическая когерентная томография; g-i — оптическая когерентная томография-ангиография 6 × 6 мм, уровень наружной сетчатки (объяснение в тексте)
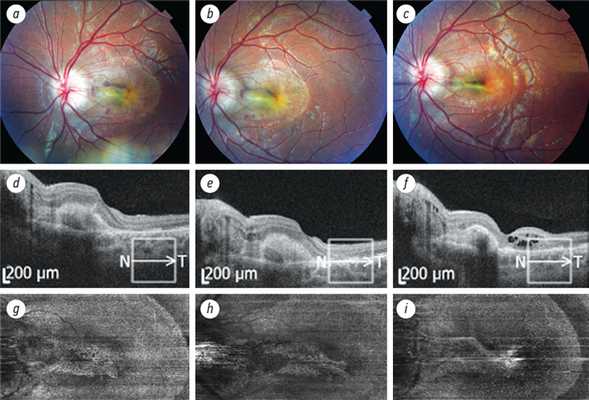
5. Рис. 5. Хориоидальная неоваскуляризация у девочки 9 лет с друзами диска зрительного нерва: а — фото глазного дна правого глаза; b — оптическая когерентная томография-ангиография 3 × 3 мм, уровень хориокапилляров; c — структурная оптическая когерентная томография до лечения; d — фото диска зрительного нерва правого глаза; е — аутофлюоресценция; f — структурная оптическая когерентная томография после лечения (объяснение в тексте)

6. Рис. 6. Хориоидальная неоваскуляризация у девочки 9 лет с друзами диска зрительного нерва на парном глазу: а — фото диска зрительного нерва; b — оптическая когерентная томография-ангиография 3 × 3 мм, уровень хориокапилляров; c — структурная оптическая когерентная томография левого глаза (бъяснение в тексте). Стрелкой указан изменённый (в результате разрыва) пигментный эпителий
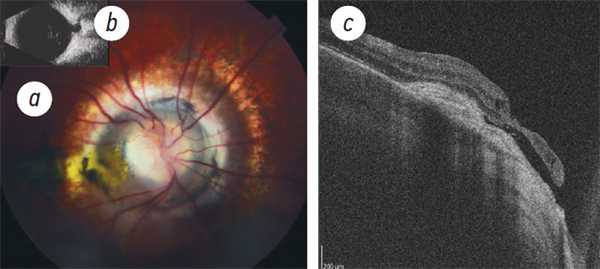
7. Рис. 7. Хориоидальная неоваскуляризация у мальчика 13 лет с синдром «утреннего сияния»: а — фото глазного дна; b — ультразвуковой скан; c — структурная оптическая когерентная томография
© Жукова С.И., Самсонов Д.Ю., Злобин И.В., 2021
Эта статья доступна по лицензии Creative Commons Attribution 4.0 International License.
Механизмы формирования и клинические особенности хориоидальной неоваскуляризации при центральной серозной хориоретинопатии
Введение и цель. В современной литературе имеются лишь единичные публикации о формировании хориоидальной неоваскуляризации (ХНВ) при ЦСХР как об одном из наиболее серьёзных осложнений заболевания. Кроме того, зачастую ХНВ при ЦСХР расценивают как один из вариантов возрастной макулярной дегенерации, не устанавливая причины развития процесса. Определили цель - выявление механизмов формирования и клинических особенностей хориоидальной неоваскуляризации при ЦСХР.
Материал и методы. Обследовано 68 пациентов с ЦСХР в возрасте от 35 до 54 лет. В объём диагностического обследования, кроме стандартных методов диагностики больных с ЦСХР, для оценки ретинального и хориоидального кровотока включена оптическая когерентная томография сетчатки в режиме ангиографии.
Результаты. Выявлено, что при ЦСХР хориоидальная неоваскуляризация может развиваться по двум путям, имеющим разные причины формирования и, в соответствии с ними, различные клинические формы течения.
В случае прогрессирования хориоидальной ишемии при хронической форме у 17,3% пациентов формируется ХНВ.
При острой ЦСХР после фокальной лазеркоагуляции точки ликеджа при избыточной лазерной энергии возможно формирование индуцированной ХНВ.
Выводы. Наиболее значимым моментом профилактики ХНВ является компенсация соматических нарушений и эмоционального статуса, позволяющая уменьшить либо компенсировать уровень хориоидальной ишемии. С целью профилактики ятрогенной неоваскуляризации необходимо строгое соблюдение методики проведения фокальной лазеркоагуляции с учётом степени пигментации сетчатки.
Ключевые слова: центральная серозная хориоретинопатия, хориоидальная неоваскуляризация, хориоидальная ишемия, фокальная лазеркоагуляция.
7.1. Хориоидальная неоваскуляризация
В настоящее время сохраняет свою актуальность проблема правильного диагностического распознавания хронической ЦСХ и экссудативной формы ВМД. Такая необходимость определена высокой распространенностью последнего заболевания и инвалидизирующим характером течения с необратимой потерей центрального зрения [2, 3, 6].
В основе экссудативной формы ВМД лежит хориоидальная неоваскуляризация (ХНВ), развивающаяся из хориокапилляров с прорастанием через дефекты в мембране Бруха [3]. В зависимости от локализации новообразованных сосудов принято выделять несколько типов ХНВ. При I типе ХНВ неоваскуляризация располагается под РПЭ (скрытая = оккультная ХНВ). Для II типа ХНВ характерно прорастание патологических сосудов в субретинальное пространство (классическая ХНВ). В последнее время ученые выделяют редкий III тип ХНВ - ретинальную ангиоматозную пролиферацию и полипоидную хориоидальную васкулопатию (ПХВ) [18, 30, 65, 66].
Несмотря на то что ЦСХ и экссудативная (неоваскулярная) форма ВМД являются результатом различных патогенетических механизмов и ведут к различным функциональным зрительным результатам, оба состояния характеризуются поражением макулярной области с развитием патологических процессов на уровне РПЭ и хориоидальных сосудов. Это определяет сходство клинической картины двух патологий, затрудняет правильную интерпретацию диагностических данных, требуя прицельного изучения и тщательного сравнения.
Так ВМД чаще всего поражает население старше 60 лет, распространенность ее экссудативной формы увеличивается с возрастом, достигая 10% у лиц от 65 до 74 лет и 25% - после 75 лет [1, 67], в отличие от ЦСХ, характерной для более молодого работоспособного населения [4].
Стоит отметить, что для пациентов с ХНВ I и II типов присущи сходные с ЦСХ макулярные симптомы, такие как появление положительной центральной скотомы, метаморфопсий, «затуманивание» и снижение остроты центрального зрения. При наличии оккультной ХНВ (I тип) основной жалобой, как правило, являются метаморфопсии. Однако для ЦСХ искривления предметов не характерны и, как правило, наблюдаются при длительно текущих, хронических, рецидивирующих формах, сопровождающихся атрофическими изменениями РПЭ и фоторецепторов в центральной макулярной области.
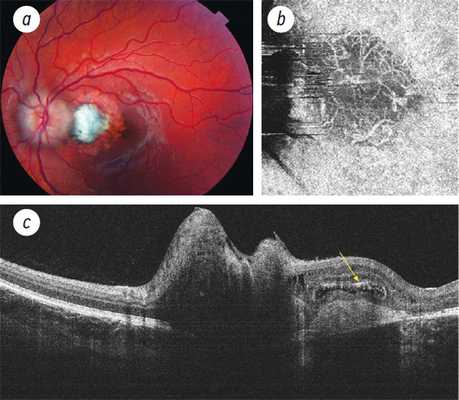
При офтальмоскопии на зону ХНВ, как правило, указывает обнаружение слегка приподнятого очага серовато-зеленого или пурпурно-желтого цвета (характерно для оккультной ХНВ) или появление субретинального ореола (при классической ХНВ) (рис. 7.1) [3]. Иногда область неоваскуляризации окружает пигментированный контур. Но зачастую ХНВ может не выявляться офтальмоскопически.
Необходимо сказать, что типичные признаки ХНВ связаны с активным просачиванием жидкости из новообразованных сосудов. В результате на глазном дне развивается серозная ОНЭ и/или ОПЭ, кистовидный макулярный отек, появляются отложения «твердых» экссудатов и субретинальные геморрагии (рис. 7.1-7.2).
Однако выраженность экссудативных проявлений при оккультной ХНВ (I тип) может быть несущественной, что затрудняет своевременное распознавание патологии, нередко ведет к постановке ошибочного диагноза хронической ЦСХ и требует проведения комплекса прицельных диагностических исследований. Среди них первостепенную роль отводят ангиографическим методам визуализации.
В выявлении классической ХНВ высокую информативность представляет ФАГ. Гиперфлюоресценция неоваскулярной мембраны начинается с ранней фазы исследования, быстро нарастая по интенсивности (рис. 7.3а). При этом ветвление неоваскулярных сосудов может создавать картину «кружева» или «спицы колеса», придавая границам ХНВ четкий, ажурный характер. Иногда на снимках ФАГ визуализируется питающий ствол. Для поздних фаз исследования ХНВ характерен экстравазальный выход красителя с просачиванием в субретинальное пространство. Однако при наличии оккультной ХНВ интерпретация снимков ФАГ затруднена, что связано с отсутствием четкого контрастирования. В поздних фазах исследования в пределах серозной отслойки отмечается диффузное просачивание красителя и точечная гиперфлюоресценция в виде «булавочных головок» (pinpoints)(рис. 7.3б) [5].
В таких случаях наиболее информативно проведение ICGA. При этом показательны снимки поздних фаз, на которых отчетливо визуализируется нарастающая локальная гиперфлюоресценция новообразованных сосудов оккультной ХНВ.
Проведение микропериметрии в области патологии определяет появление абсолютной центральной скотомы, в отличие от ЦСХ, при которой наблюдается относительное снижение центральной светочувствительности.
Диагностическую ценность в распознавании ХНВ при ВМД представляет проведение EDI-ОКТ.
Помимо серозной ОНЭ и ОПЭ можно выявить локальные дефекты в мембране Бруха и неоваскулярную мембрану в виде очага средней рефлективности, расположенного под РПЭ (ХНВ I типа) и/или в субретинальном пространстве (ХНВ II типа). Немаловажным диагностическим критерием является и оценка толщины хориоидеи. Так при ХНВ, осложнившей течение ВМД, отмечается выраженное истончение сосудистой оболочки [2, 7, 27], в отличие от ЦСХ с характерным утолщением хориоидеи.
Необходимость правильной и своевременной дифференциальной диагностики экссудативной ВМД и хронической ЦСХ определена выбором оптимального метода лечения и функциональным зрительным прогнозом. В случае выявления ХНВ, осложняющей течение ВМД, предпочтительны интравитреальные инъекции ингибиторов ангиогенеза (anti-vascular endothelial growth factor - анти-VEGF), применение которых при ЦСХ патогенетически не обосновано.
7.1.2. Пахихориоидальная неоваскулопатия
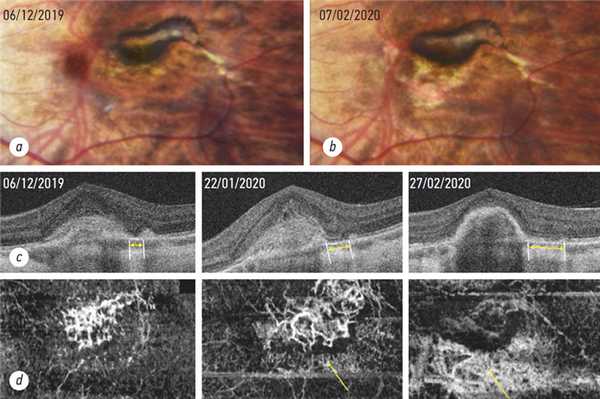
Мультимодальная визуализации структур ХРК с помощью современных методов исследования привела к выделению новой клинической сущности ХНВ - пахихориоидальной неоваскулопатии (рис. 7.4-7.5) [39]. Предполагается, что природой этого состояния является ХНВ I типа, развивающаяся в исходе длительно существующей, хронической ЦСХ. Также отмечены случаи формирования данной ХНВ и на фоне пахихориоидальной пигментной эпителиопатии, часто наблюдаемой в контрлатеральном асимптомном глазу пациентов с ЦСХ (рис. 7.5) [14, 39, 60]. Для пахихориоидальной неоваскулопатии типично развитие ХНВ на фоне увеличенной толщины хориоидеи и дилатированных хориоидальных сосудов (рис. 7.6), что сопровождается появлением хориоидальной гиперпроницаемости. Также для патологии характерны аномалии РПЭ, не связанные с локализацией ХНВ. Такие изменения ХРК позволяют предположить, что в основе клинической сущности данного заболевания лежит сходный с ЦСХ пахихориоидальный процесс - хориоидальный застой. В связи с этим в настоящее время патологию относят к спектру пахихориоидальных заболеваний, включающих ЦСХ, пахихориоидальную пигментную эпителиопатию и ПХВ.
Стоит отметить, что пахихориоидальная неоваскулопатия часто маскируется как неоваскулярная ВМД, составляя до ¼ диагностированных случаев [13, 39]. Однако для данной патологии в сравнении с ВМД характерен более молодой возраст пациентов и полное отсутствие друз и/или дистрофических изменений.
Наблюдения показывают, что длительное течение пахихориоидальной неоваскулопатии может сопровождаться появлением полипов и развитием ПХВ [39, 60]. Так, Freund K.B. с соавторами выявил 56,4% случаев ПХВ, связанных с пахихориоидальной неоваскулопатией [43, 60]. Однако полипоидные поражения принято считать проявлениями длительно существующего ХНВ I типа при ВМД. Так, Miyake M. с коллегами выявил 42,9% случаев неоваскулярной ВМД, осложненных развитием ПХВ [39]. В связи с этим необходимо дифференцировать ПХВ, развивающуюся на фоне ХНВ I типа при ВМД, и ПХВ, осложняющую пахихориоидальную неоваскулопатию.
Распознавание этих двух состояний играет принципиально важное значение не только для определения этиологии процесса, но и для выбора оптимальной тактики ведения пациентов. Случаи с пахихориоидальной неоваскулопатией обладают большим периодом ремиссии и более резистентны к анти-VEGF-препаратам, что объясняется более низкими уровнями VEGF-фактора в водянистой влаге глаз таких пациентов, самоограниченным характером течения заболевания и медленным развитием ХНВ в сравнении с неоваскуляризацией при ВМД [39, 58]. Поэтому в терапии пахихориоидальной неоваскулопатии, особенно осложненной развитием полипоидных поражений, предпочтительна комбинация фотодинамической терапии (ФДТ) с интравитреальным введением анти-VEGF-препаратов.
Читайте также:
- Функции фосфокреатина. Анаэробный механизм получения энергии
- Хроническая обструктивная болезнь легких ( ХОБЛ ) : определение, эпидемиология ( распространенность ).
- Модельнолитой протез на ZL-аттачменах. Тактика с оставшимися зубами
- Соединяющие элементы мостовидных протезов. Особенности
- Роль глюкокортикоидов в иммунитете и аллергии. Действие кортизола на клетку
