Ингибиторы синтеза ранних белков вирусов. Ингибиторы синтеза нуклеиновых кислот вирусов.
Добавил пользователь Alex Обновлено: 28.01.2026
Внедряется в одну цепь ДНК, встраиваясь между основаниями. Это приводит к локальному изменению ДНК.
В очень высоких концентрациях ингибирует ДНК-полимеразу
Связываясь с ДНК, генерируют образование свободных радикалов, вследствие чего структура ДНК изменяется.
Ингибиторы синтеза РНК
Ингибирует РНК-полимеразы, следовательно синтез всех видов РНК.
Связывает РНК полимеразой тормозит транскрипцию
Тормозит связывание тимидилового нуклеотида прерывая синтез вирусной ДНК
Ингибиторы биосинтеза белков
Вызывает преждевременную терминацию, включаясь в С-концевой участок синтезированной ППЦ
Ингибирует пептидилтрансферазу бактерий
Нарушают процесс считывания информации с мРНК. АМК, включаемая в белок не соответствует кодону мРНК. В результате синтезируется аномальный белок и бактерии гибнут
Нарушает связывание аатРНК с А-участком бактериальной рибосомы
Нарушает функционирование малой субъединицы рибосомы бактерий
Тормозит синтез пептидов клеточной стенки бактерий
Вирусы и токсины
Внедряются в клетку хозяина, включаются в ДНК и прекращают синтез всех видов ДНК, РНК и белков у человека
Альфа-аманитин (из бледной поганки)
Вызывает АДФ-рибозилирование FЭ2 (фактора элонгации 2)
Рицин (из клещевины обыкновенной)
Фермент, удаляет аденин из 28SРНК большой субъединицы рибосомы и ингибирует синтез белков у эукариот. Компонент касторового масла
В ответ на заражение вирусами, стимулируют синтез ферментов, способных разрушать мРНК вирусов и прекращать синтез белков. Стимулируют синтез фермента - протеинкиназы и инактивируют FЭ2
Великолепная девятка
Цель современной фармацевтической отрасли — создание эффективных лекарственных средств, которые позволяют пациентам сохранять активность и высокое качество жизни даже при неизлечимых заболеваниях. Примером этого стало открытие средств для антиретровирусной терапии, которая перевела изначально смертельную ВИЧ-инфекцию в хроническое контролируемое заболевание. И одними из первых представителей этого класса стали нуклеозидные ингибиторы обратной транскриптазы ВИЧ.
Общая информация
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ (НИОТ) — первый класс антиретровирусных препаратов, одобренных американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов FDA [1]. НИОТ активны в отношении ВИЧ-1 (наиболее распространённого серотипа вируса) и ВИЧ-2. Несмотря на то что препараты этой группы менее эффективны против вируса иммунодефицита, чем ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), они играют центральную роль в антиретровирусной терапии и остаются важной частью процесса лечения [4].
В группу нуклеозидных ингибиторов обратной транскриптазы входят 9 препаратов:
- зидовудин;
- диданозин;
- ламивудин;
- эмтрицитабин;
- абакавир;
- ставудин;
- тенофовира дизопроксила фумарат;
- тенофовира алафенамид;
- залцитабин.
Фармакологическое действие
Нуклеозидные ингибиторы обратной транскриптазы представляют собой модифицированные аналоги нуклеозидов (тимидина, аденина, цитилина, гуанина), которые фосфорилируются в организме под влиянием клеточных киназ. Все НИОТ — пролекарства: после превращения в соответствующие трифосфаты они ингибируют активность обратной транскриптазы ВИЧ [1].
Вирус иммунодефицита человека реплицируется за счёт преобразования своей одноцепочечной РНК в двухцепочечную ДНК, которая встраивается в ДНК клеток хозяина. В этом решающем для репликации вируса преобразовании, в отличие от нормальной клеточной транскрипции нуклеиновых кислот, участвует фермент под названием «обратная транскриптаза». Наряду с двумя другими — интегразой и протеазой — он находится внутри капсида вируса иммунодефицита человека [1].
Известно, что обратная транскриптаза проявляет три эффекта:
- обеспечивает синтез односпиральной комплементарной ДНК (кДНК) на матрице вирионной РНК;
- участвует в синтезе второй спирали ДНК ВИЧ;
- гидролизует РНК в составе гибридного комплекса РНК-ДНК.
Таким образом, обратная транскриптаза позволяет транскрибировать РНК ВИЧ в одноцепочечную и, в конечном счёте, в двухцепочечную провирусную ДНК и включать её в геном клетки-хозяина 2.
Нуклеозидные ингибиторы обратной транскриптазы, ингибируя активность обратной транскриптазы ВИЧ, препятствуют образованию ДНК на матрице вирусной РНК, блокируя ранние стадии цикла размножения вируса. Немаловажно, что способность препаратов этой группы ингибировать обратную транскриптазу ВИЧ в сотни раз выше по сравнению со способностью подавлять ДНК-полимеразу человека [2]. Поэтому НИОТ активны именно в инфицированных ВИЧ Т-клетках и макрофагах.
Устойчивость к НИОТ
Резистентность к нуклеозидным ингибиторам обратной транскриптазы возникает по одному из двух механизмов: нарушение включения в цепь провирусной ДНК или удаление провирусной ДНК из цепи [4, 5]. Мутации, приводящие к устойчивости, обычно развиваются постепенно. Как правило, необходимо накопление сразу нескольких мутаций для развития клинически значимой резистентности. Исключение — мутация M184V, которая гарантирует высокий уровень устойчивости к нескольким препаратам, в частности, к ламивудину и эмтрицитабину.
Известно несколько мутаций, приводящих к развитию устойчивости к НИОТ:
- мутации, которые выборочно нарушают включение в цепь провирусной ДНК — M184V, Q151M и K65R;
- мутации аналога тимидина, связанные с устойчивостью к зидовудину — M41L, D67N, K70R, L210W, T215Y, T215F, K219Q, K219E.
Фармакокинетика НИОТ
Пероральная биодоступность нуклеозидных ингибиторов обратной транскриптазы колеблется в пределах от 25 % до 93 %, причём самые низкие показатели характерны для двух средств — тенофовира и диданозина. Пища не оказывает значимого влияния на абсорбцию НИОТ. Исключение составляет диданозин, который принимают натощак. Остальные препараты можно принимать независимо от приёма пищи.
Большинство НИОТ выводятся через почки и требуют корректировки дозы у больных с почечной недостаточностью. Исключение — абакавир: его назначают в обычной дозе независимо от клиренса креатинина.
НИОТ не метаболизируются системой цитохрома Р450, поэтому лекарственные взаимодействия для них не характерны. В клинически значимые взаимодействия вступает лишь диданозин: при приёме с тенофовиром биодоступность диданозина увеличивается, поэтому целесообразно использовать более низкие дозы во избежание развития серьёзных побочных эффектов. Похожая реакция развивается и при одновременном приёме диданозина с рибавирином (у больных с сочетанным ВИЧ и вирусным гепатитом С). В подобных случаях этого сочетания препаратов следует избегать [4].
Побочные эффекты НИОТ
Неблагоприятные реакции нуклеозидных ингибиторов обратной транскриптазы включают митохондриальную токсичность, в частности, лактоацидоз, панкреатит, периферическую нейропатию, стеатоз печени и липоатрофию [4].
Митохондриальная токсичность обусловлена связыванием НИОТ с ферментом митохондриальной ДНК-полимеразы гамма человека, что ведет к переходу нормального аэробного метаболизма в анаэробный и нарушению клеточного дыхания. Афинность связывания НИОТ с митохондриальной ДНК-полимеразой гамма позволяет прогнозировать развитие потенциальных побочных эффектов. В порядке убывания афинности (а, следовательно, повышения профиля безопасности) НИОТ можно расположить так: залцитабин, диданозин, ставудин, ламивудин/эмтрицитабин, зидовудин, абакавир и тенофовир [6, 7].
Отдельные побочные эффекты, характерные для НИОТ, включают подавление активности костного мозга, миопатию, головную боль при приёме зидовудина и реакцию системной гиперчувствительности при приёме абакавира. Приём абакавира и диданозина также связан с повышенным риском сердечно-сосудистых событий [8].
На начальных этапах терапии НИОТ может регистрироваться повышенный обмен костной ткани и потеря костной массы в позвоночнике и бедренной кости, причём она может составлять около 6 % в течение 1 года после начала лечения [9].
В клинических исследованиях у больных, получающих комбинированную терапию элвитегравир + кобицистат + тенофовира алафенамид + эмтрицитабин, было выявлено большее увеличение уровня общего холестерина и липопротеинов высокой плотности по сравнению с пациентами, получавшими другие схемы антиретровирусной терапии [9].
Пациентам с тяжёлой почечной недостаточностью не рекомендуется принимать тенофовира алафенамид, однако при умеренной форме заболевания препарат может применяться. По всей вероятности, алафенамиду присуща меньшая токсичность для почек и менее выраженное снижение плотности костной ткани по сравнению со схемами, содержащими тенофовир, которые использовались раньше [10].
Особенности отдельных НИОТ
Первый синтезированный антиретровирусный препарат, аналог тимидина. При использовании в составе монотерапии резистентность к нему развивается быстро за счёт последовательного накопления мутаций. При включении препарата в состав комбинированной терапии наряду с ламивудином и эмтрицитабином восприимчивость к нему увеличивается. Выпускается в парентеральной и пероральной формах. Применяется для лечения ВИЧ-инфекции как часть комбинированного режима, а также антенатально у матери и в качестве монотерапии новорождённых [1, 11].
Активность сопоставима с зидовудином. Обладает коротким периодом полураспада, однако проявляет более длительный внутриклеточный эффект по сравнению с зидовудином, что обеспечивает пролонгированную антиретровирусную активность. Лучше принимать натощак или не менее чем через 2 часа после еды [1, 11].
Ламивудин и эмтрицитабин
Ламивудин стал первым аналогом нуклеозидов, рекомендованным для терапии хронического гепатита B в составе монотерапии, а также для лечения сочетанного гепатита B и вируса иммунодефицита человека инфекции в составе с тенофовиром. Устойчивость развивается через 1 год терапии у 30 % пациентов и через 5 лет терапии — у 70 % пациентов.
Эмтрицитабин имеет аналогичную с ламивудином структуру, переносимость, эффективность и уровень резистентности, поэтому эти два НИОТ не используют в комбинации [1, 11].
Выделяется в ряду НИОТ высокой терапевтической эффективностью. Обычно хорошо переносится, но у 8 % пациентов могут возникать реакции гиперчувствительности, особенно в начале лечения [1, 11].
Тенофовир, вводимый перорально в качестве пролекарства тенофовира фумарата, эффективен против вируса гепатита B [1,11].
Ингибирует обратную транскриптазу и дополнительно включается в вирусные ДНК, прекращая удлинение цепи. Применение препарата ограничено из‑за связанного с ним аномального перераспределения жира с лица и конечностей на туловище, шею, грудь и живот — липоатрофии [1, 11].
Широко используется для лечения хронического гепатита B, активен в отношении штаммов, устойчивых к ламивудину. Вводится перорально. Как правило, хорошо переносится. Резистентность развивается гораздо реже, чем при применении ламивудина (через 5 лет лечения у 30 % пациентов). Это связывают с гибкостью молекулы адефовира. Терапевтические дозы при гепатите B недостаточны для эффективного лечения ВИЧ-инфекции, поэтому ВИЧ-статус должен быть определён/подтверждён до начала приёма препарата при вирусе гепатита B [1, 11].
Бойцы невидимого фронта
Пандемия COVID-19 повлияла на многое, в том числе и на спрос в аптеке. И в этом апреле вместо традиционных антигистаминных препаратов и средств для похудения в лидеры продаж выбиваются средства индивидуальной защиты, антисептики, иммуномодуляторы и противовирусные. Самое время еще раз освежить в памяти то, как работают лекарственные средства, проявляющие активность в отношении респираторных вирусов, и то, о чем важно предупредить покупателей с соответствующими запросами.

Классификация противовирусных препаратов
Противовирусные лекарственные средства — очень разнородная фармакологическая группа, в которую входят препараты для лечения различных вирусных инфекций: от ОРВИ и «простуды на губах» (герпеса) до гепатита С и ВИЧ-инфекции. Но первостольникам чаще всего приходится сталкиваться с противовирусными, активными в отношении респираторных вирусов, включая грипп. Препараты этого класса подразделяют на три основные подгруппы:
- Блокаторы М2‑каналов — римантадин, амантадин
- Ингибиторы нейраминидазы — осельтамивир, занамивир
- Другие препараты — имидазолилэтанамид пентандиовой кислоты, инозина пранобекс, кагоцел, тилорон, умифеновир, интерферон альфа-2b.
Рассмотрим каждую из этих подгрупп подробней.
Блокаторы М2‑каналов
Оба представителя этого класса — римантадин и амантадин — являются производными адамантана. Сегодня в качестве противовирусного препарата используется только первый. Римантадин, впервые синтезированный в 1963 году, показан для раннего лечения и профилактики гриппа, вызванного вирусом гриппа А, у взрослых и детей старше 7 лет. Механизм его действия основан на блокировании особых ионных М2‑каналов вируса, что приводит к нарушению его способности проникать в клетки и высвобождать рибонуклеопротеид. Таким образом ингибируется самая важная стадия репликации вирусов — высвобождение вирусного генома в клетке [1].
Немаловажно, что в процессе применения блокаторов М2‑каналов возможно развитие резистентности. Ее частота к 5‑м суткам лечения может достигать 30 % [1]. Так, известно, что все 100 % штаммов гриппа H3N2, а также возбудителей свиного гриппа, вызвавших эпидемию в 2009 году, были резистентны к этому препарату [2]. Из-за устойчивости возбудителей к римантадину целесообразность его применения в последние годы вызывает всё больше вопросов у специалистов.
Побочные эффекты
Нельзя сказать, что римантадин имеет благоприятный профиль безопасности. Он вызывает ряд нежелательных реакций со стороны желудочно-кишечного тракта и нервной системы. Согласно выводам исследования Кокрановского сотрудничества, в котором изучалась активность и безопасность амантадина и римантадина, препараты этой группы должны использоваться только в чрезвычайных ситуациях, когда другие средства не проявляют терапевтического эффекта [3].
О чем напомнить покупателю?
Отпуская римантадин, следует обратить внимание покупателя на возможные лекарственные взаимодействия. Известно, что при совместном применении римантадина с препаратами, которые очень часто используются для лечения гриппа и ОРВИ, — парацетамолом и аскорбиновой кислотой, — всасывание противовирусного средства снижается примерно на 11 % [4].
Кроме того, уместно напомнить потребителю, что при появлении изменений в самочувствии, в частности, тахикардии, бессонницы, непривычной головной боли, одышки, тошноты, рвоты и других побочных эффектов, нужно немедленно сообщить о них врачу [4].
Будьте внимательны — в зависимости от торгового наименования, препараты римантадина отпускаются как по рецепту, так и без него.
Ингибиторы нейраминидазы
Нейраминидаза, находящаяся на поверхности вирусов гриппа типа А и В, — это один из ключевых ферментов, участвующих в их репликации. Несмотря на то что генетическая структура вирусов гриппа и, соответственно, сама нейраминидаза постоянно меняются, аминокислотная последовательность активного участка фермента остается постоянной, что делает ее оптимальной мишенью для противовирусной терапии [1].
Ингибирование нейраминидазы нарушает способность вирусов проникать в здоровые клетки, тормозит выход вирионов из инфицированных клеток и уменьшает их устойчивость к инактивирующему действию слизистого секрета дыхательных путей. Это останавливает дальнейшее распространение вируса в организме. Кроме того, ингибиторы нейраминидазы уменьшают выработку провоспалительных цитокинов, препятствуя таким образом развитию местной воспалительной реакции и ослабляя проявления вирусной инфекции (лихорадку, недомогание и так далее) [1].
Немаловажно, что частота резистентности вирусов гриппа А и В к ингибиторам нейраминидазы составляет около 2 %. В настоящее время существует два препарата этой группы — осельтамивир и занамивир. Первый предназначен для приема внутрь, а второй используется только ингаляционно.
Эффективность обоих ингибиторов нейраминидазы доказана в масштабных клинических исследованиях. Так, у пациентов с подтвержденным диагнозом гриппа на фоне приема осельтамивира тяжесть заболевания, которую оценивали по суммарному индексу симптомов, снижалась на 38 % по сравнению с теми, кто получал плацебо. Препарат снижает частоту осложнений (бронхита, пневмонии, синусита, среднего отита) примерно на 50 % (у пациентов молодого возраста без сопутствующих заболеваний) [4]. В соответствии с рекомендациями ВОЗ, применение осельтамивира — главный метод борьбы с гриппом в случае пандемии [5].
Профилактическая активность осельтамивира также подтверждена в клинических исследованиях. Доказано, что его прием значительно уменьшал частоту выделения вируса и предотвращал его передачу от одного члена семьи к другому. Заболеваемость гриппом у здоровых (непривитых) взрослых осельтамивир снижает на 76 % (при приеме в течение 42 дней — это максимальная длительность сезонной профилактики), а у пожилых пациентов (привитых) — на 92 % [1].
Занамивир также облегчает течение гриппа, снижает количество осложнений (на 22 % по сравнению с плацебо), уменьшает частоту применения антибиотиков. Процент эффективной защиты занамивира в качестве препарата для профилактики заболевания составляет 67-79 % по сравнению с плацебо [4].
Осельтамивир применяется для лечения и профилактики гриппа у взрослых и детей старше 1 года, а занамивир — у взрослых и детей старше 5 лет. Оба препарата отпускаются по рецепту врача.
На фоне приема ингибиторов нейраминидазы могут появляться тошнота и рвота, однако, как правило, эти реакции возникают в первые два дня после начала лечения и в подавляющем большинстве случаев — однократно.
О чем рассказать покупателю?
- Ингибиторы нейраминидазы можно принимать независимо от приема пищи. Однако осельтамивир переносится лучше, если его принимать во время еды.
- Препараты этой группы наиболее активны против вируса гриппа при раннем приеме: чтобы достичь хорошего терапевтического ответа, важно принимать их не позднее 2 суток после начала симптомов. Поэтому, если врач их выписал, важно начать лечение немедленно.
- Для профилактики принимать осельтамивир также важно не позднее 2 суток после контакта с больными.
Другие противовирусные препараты
К этой подгруппе можно отнести ряд препаратов, активных в отношении респираторных вирусов. Они могут проявлять как прямой противовирусный эффект, так и работать за счет модуляции иммунного ответа.
Имидазолилэтанамид пентандиовой кислоты — отечественный противовирусный препарат, активный компонент которого является низкомолекулярным соединением, выделенным из нервной ткани морского моллюска. Разрешен к применению с 2008 года. В эксперименте продемонстрировал эффективность в отношении штаммов вируса гриппа А, В, аденовирусной инфекции, парагриппа и респираторно-синцитиальной инфекции [6].
По данным ряда исследований, противовирусные свойства препарата основаны на способности подавлять репродукцию вируса на этапе ядерной фазы. Он также активирует систему интерферона, увеличивая его содержание в крови до физиологической нормы, и проявляет ряд других эффектов, обеспечивающих повышение иммунного ответа.
Применяют для лечения гриппа и других ОРВИ у взрослых и детей старше 13 лет. Отпускают без рецепта врача.
Инозина пранобекс — синтетическое производное пурина, оказывающее иммуностимулирующее и неспецифическое противовирусное действие. In vivo активен в отношении вирусов простого герпеса, цитомегаловируса, вируса кори, вирусов гриппа А и В, полиовирусов и некоторых других. Механизм противовирусного действия связан с блокированием вирусной РНК и ингибированием фермента, участвующего в репликации вирусных частиц. Препарат подавляет биосинтез вирусной РНК и трансляцию вирусных белков, а также повышает продукцию интерферонов-альфа и гамма [4].
Показан к применению для лечения инфекций, вызванных чувствительными возбудителями у взрослых и детей старше 3 лет. Показание off-label, то есть не указанное в инструкции по применению, но используемое в клинической практике, — терапия острых и хронических респираторных вирусных инфекций [7]. Препарат относится к Rx-группе.
Кагоцел — высокомолекулярное соединение, синтезированное на основе соли карбоксиметилцеллюлозы и природного полифенола, получаемого из растительного сырья (хлопчатника). По данным производителя, основной механизм действия — индуцирование образования позднего интерферона, который представляет собой смесь интерферонов-альфа и бета, обладающих высокой противовирусной активностью. Как сообщает компания-производитель, препарат активирует выработку интерферонов практически во всех клетках, принимающих участие в иммунном ответе [8].
Показания к применению — профилактика и лечение гриппа и других респираторных инфекций у взрослых и детей старше 3 лет, а также лечение герпетической инфекции у взрослых. Отпускается без рецепта врача.
Тилорон — еще один низкомолекулярный синтетический индуктор синтеза интерферона, оказывающий противовирусное действие. По данным инструкций по применению, препарат стимулирует образование интерферонов альфа, бета и гамма. Активен в отношении различных вирусных инфекций, гепатита и герпеса. Механизм противовирусного действия связан с ингибированием трансляции вирус-специфических белков в инфицированных клетках, за счет чего подавляется репродукция вирусных частиц.
Показания к применению — лечение и профилактика гриппа, других ОРВИ, а также лечение ряда других вирусных инфекций (герпеса, цитомегаловирусной инфекции и др.) у взрослых и детей старше 7 лет.
Будьте внимательны — в зависимости от ТН и дозировки, препарат может иметь рецептурный отпуск.
Умифеновир — отечественный препарат, проявляющий противовирусный эффект. Механизм действия основан на препятствовании слияния липидной оболочки вируса с клеточными мембранами. Кроме того, препарат имеет умеренные иммуномодулирующие свойства, обеспечивающие повышение устойчивости организма к вирусным инфекциям.
Доказано, что умифеновир подавляет in vitro вирусы гриппа А и В, в том числе высокопатогенные их подтипы, а также вирусы-возбудители ОРВИ (риновирус, аденовирус, респираторно-синцитиальный вирус, вирус парагриппа). Доказана активность умифеновира в отношении коронавируса SARS (9), который на 79,5 % идентичен возбудителю нынешней пандемии SARS-CoV-2 [1]). Сегодня в клинических испытаниях изучается эффективность препарата в отношении возбудителя COVID-19.
В отечественных временных клинических рекомендациях по лечению пациентов с COVID-19 указывается, что умифеновир может применяться при коронавирусной инфекции SARS-CoV-2, однако имеющиеся на настоящий момент сведения о результатах терапии с его применением не позволяют сделать однозначный вывод о его эффективности или неэффективности [11].
Согласно инструкции по применению, умифеновир показан для профилактики и лечения гриппа А и В, других ОРВИ, в том числе осложненных бронхитом и пневмонией, а также тяжелого острого респираторного синдрома, ассоциированного с коронавирусной инфекцией, у взрослых и детей старше 2 лет. Отпускается без рецепта врача.
Интерфероны — биологически активные белки, которые синтезируются клеткой в ходе защитной реакции. Посредством рецепторов интерфероны действуют на другие клетки, повышая устойчивость организма к вирусам. По способу получения выделяют лейкоцитарные, лимфобластоидные и рекомбинантные интерфероны. Последние наиболее широко применяются в практике фармспециалистов (интерферон альфа-2b) [1].
Механизм противовирусного действия интерферонов заключается в подавлении синтеза вирусных белков и их репликации, а также индуцировании резистентности клеток к вирусным инфекциям. Препараты интерферонов альфа не обладают специфичностью — их противовирусная активность распространяется на различные вирусы, в том числе и респираторные [1].
Есть данные об активности интерферона альфа-2b в отношении SARS. Было доказано, что препарат обеспечивает выработку собственного интерферона, синтез которого блокирует коронавирус [12]. Сегодня местные формы интерферона (интраназальные и ингаляционные) включены в российские, китайские и испанские рекомендации по лечению COVID-19 в качестве препаратов для профилактики инфекции у взрослых (включая беременных женщин) и детей, а также для терапии легких форм заболевания у больных младше 60 лет [13]. Большинство ТН интерферона альфа-2b отпускается без рецепта.
Как правило, все перечисленные препараты хорошо переносятся, что подтверждается принадлежностью большинства из них к безрецептурной группе. Отпуская их, стоит напомнить клиенту, что эффективность противовирусных средств наиболее велика при раннем лечении — чтобы достичь оптимального терапевтического ответа, важно начинать принимать их уже в первые часы или дни (как правило, до 2 суток) после появления симптомов заболевания. То же правило действует и в отношении профилактики — максимальная защита достигается, если препарат начинать принимать как можно раньше после контакта с больным.
Обнадеживающая стратегия борьбы с SARS-CoV-2: ингибиторы синтеза пиримидинов + аналоги нуклеозидов

В недавнем исследовании, опубликованном в Nature, Дэвид С. Шульц с соавт. продемонстрировали новый высокоэффективный метод терапии для борьбы с вирусом SARS-CoV-2. Суть его в комбинации ингибиторов биосинтеза пиримидинов с противовирусными средствами-аналогами нуклеозидов [1].
К 10 февраля 2022 года число зараженных вирусом SARS-CoV-2 достигло 400 млн человек по всему миру, смертность составила 5,79 миллиона человек. Симптомы, развивающиеся у пациентов, зараженных SARS-CoV-2, варьируются от легких до тяжелых клинических исходов. Несмотря на то, что ряд вакцин и препаратов уже вошли в клиническую практику, эффективная противовирусная терапия против постоянно эволюционирующего вируса по-прежнему отсутствует.
SARS-CoV-2 является представителем семейства одноцепочечных РНК-вирусов с положительной цепью. Вирус реплицирует свою РНК с помощью фермента РНК-зависимой РНК-полимеразы (RdRp, от англ. RNA-dependent RNA polymerase). Препараты-аналоги нуклеозидов могут тормозить этот этап, встраиваясь в растущую цепь вирусной РНК благодаря ферменту RdRp, и тогда процесс репликации РНК вируса вынужденно прекращается или же настолько изменяется, что в конечном итоге все равно останавливается [2]. Сейчас аналоги нуклеозидов постепенно занимают нишу крупного класса одобренных противовирусных препаратов. Из-за крайне консервативной структуры фермента RdRp у различных вирусов считается, что некоторые аналоги нуклеозидов могут оказаться эффективными для ингибирования SARS-CoV-2.
В условиях in vivo, основной клеточной мишенью SARS-CoV-2 является респираторный эпителиоцит. Авторы воспользовались клеточной линией респираторного эпителия человека Calu-3 для скрининга библиотеки низкомолекулярных соединений, в которой были и одобренные препараты, и препараты, проходящие клинические испытания, и препараты с противовирусной активностью с хорошо известными молекулярными мишенями [3]. После всесторонней оценки эффективности и токсичности каждого соединения учеными были отобраны 122 вещества, около 13 % из которых относились к аналогам нуклеозидов (включая такие препараты, как ремдесивир и молнупиравир, которые уже одобрены для использования при лечении SARS-CoV-2) [4, 5]. Чтобы определить широту противовирусной активности этих аналогов нуклеозидов, был проведен ряд испытаний с группой клеточных линий, которых заражали вирусом SARS-CoV-2. Было обнаружено, что в зависимости от типа клеток разные аналоги нуклеозидов проявляли свою специфическую противовирусную активность. Например, туберкулин проявлял противовирусную активность в клетках линии Calu-3, Caco-2 и Huh7.5, но оказался токсичным для клеток линий A549-Ace2 и Vero. Напротив, тиогуанин и 6-меркаптопурин проявили свою активность в клетках Calu-3 и A549-Ace2, однако подобного не наблюдалось в клетках Caco-2 или Vero. Препараты ремдесивир и молнупиравир проявили самую высокую противовирусную активность. Поскольку ремдесивир является аналогом аденозина, а молупиравир — аналогом цитозина, предполагалось, что комбинация ремдесивира и молнупиравира окажется примером противовирусного синергизма, однако, согласно результатам дальнейших исследований, был сделан вывод о наличии лишь аддитивного эффекта.
Аналоги нуклеозидов могут действовать как синтетические аналоги при репликации ДНК или РНК. Кроме того, некоторые аналоги нуклеозидов также действуют как антиметаболиты, расходуя пул дезоксинуклеотидов, необходимых для репликации ДНК, или ингибируя ферменты биосинтеза нуклеозидов путем связывания с метаболическими ферментами и конкурируя с природными лигандами для ингибирования синтеза РНК. Поэтому считается, что антиметаболиты действуют как противовирусные широкого спектра действия.
Существует два пути биогенеза нуклеозидов в клетках: синтез de novo и т. н. путь спасения. Синтез de novo обеспечивает достаточное количество энергии для репликации вируса, в отличие от пути спасения. Основываясь на этом, исследователи провели скрининг ряда соединений, которые ингибируют ферменты биосинтеза нуклеозидов. В результате они обнаружили два ингибитора DHODH (фермент дигидрооротатдегидрогиназа — прим. перев.), задействованных в процессе синтеза пиримидина de novo, BAY-2402234 и Brequinar, а также ингибитор UMPS — пиразофурин.
Удивительно, но ингибиторы DHODH при совместном применении с ремдесивиром и молнупиравиром демонстрируют поразительный синергизм. Применение комбинированной терапии (ингибиторов DHODH в сочетании с ремдесивиром и молнупиравиром) продемонстировало положительные результаты против различных штаммов SARS-CoV-2 (альфа, бета, гамма и дельта). Несомненно, такие результаты внушают надежду на разработку новых препаратов для лечения SARS-CoV-2 (см. рис. 1).
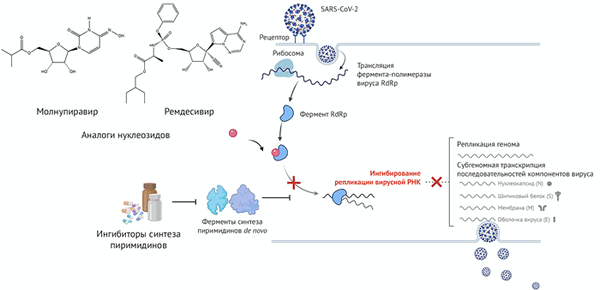
Рисунок 1 | Ингибиторы биосинтеза пиримидинов и противовирусные препараты-аналоги нуклеозидов синергически ингибируют репликацию вируса SARS-CoV-2 условиях in vitro и in vivo
Комбинация ингибиторов биосинтеза пиримидина с противовирусными-аналогами нуклеозидов представляет собой новый шаг к победе над вновь возникающими штаммами SARS-CoV-2.
С конца 2019 года эта катастрофа в той или иной степени влияет на весь мир; хотя некоторые вакцины и лекарственные препараты проходят клинические испытания, необходимость разработки эффективных лекарственных средств или методов лечения для борьбы с SARS-CoV-2 является крайне актуальной проблемой вследствие постоянных мутаций вируса (благодаря которым повышается вирулентность SARS-CoV-2, его способность ускользания от действия вакцин) и неэффективности существующих лекарственных препаратов. После скрининга противовирусной активности 18 000 лекарств в условиях естественной инфекции SARS-CoV-2 в эпителиальных клетках воздухоносных путей человека командой Дэвида С. Шульца была выявлена противовирусная активность и селективность действия ремдесивира и молнупиравира в отношении SARS-CoV-2. Также исследователи доказали, что комбинация ремдесивира и молнупиравира с ингибиторами DHODH является эффективной для торможения репликации вируса и снижения интенсивности воспаления после заражения SARS-CoV-2. Такая комбинированная терапия представляет собой новое направление лечения SARS-CoV-2 и новых штаммов этого вируса. Согласно данным исследователей, Паксловид (препарат, содержащий ингибитор протеазы SARS-CoV-2) в сочетании с молнупиравиром или ремдесивиром демонстрирует аддитивный противовирусный эффект против бета- или дельта-штаммов SARS-CoV2. Таким образом, существует много потенциальных комбинаций, эффективность которых необходимо проверить в ходе клинических испытаний. Ведь благодаря этим комбинациям появляется реальный шанс изменить ход развития этой ужасной пандемии. Как можно более скорое преодоление последствий пандемии SARS-CoV-2 является одной из самых важных задач здравоохранения, а применение комбинированной противовирусной терапии может открыть второй фронт на пути к победе в этой войне.
Ингибиторы синтеза белка
Один из путей выяснения тонких молекулярных механизмов синтеза нуклеиновых кислот и белков в клетках - использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не влияя на клетки организма человека. Некоторые препараты, действительно, оказывают такое избирательное действие, взаимодействуя с белками рибосом прокариот и выключая бактериальный синтез белка. Однако многие из них являются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена с целью выяснения молекулярного механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза - пуромицин. Он представляет собой аналог концевого участка аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с А-центром пептидил-тРНК с образованием пептидил-пуромицина :
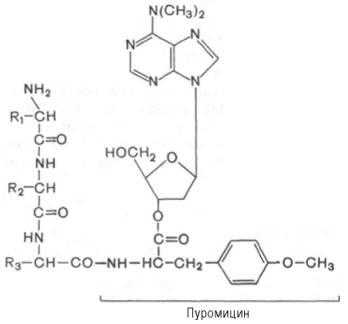
Пептидил-пуромицин не несет на себе триплета антикодона и поэтому тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин оказывает тормозящее действие на синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ин-гибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полиме-раза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать, кроме того, на недавно открытое противовирусное действие рифамицина; в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Это дает основание предположить, что данный антибиотик найдет применение в клинической онкологии при лечении опухолей, вызываемых вирусами.
Одним из мощных ингибиторов синтеза вирусной РНК оказался азидотимидин (3'-азидо-2',3'-дидезокситимидин), синтезированный еще в 1964 г. в надежде на его противоопухолевый эффект. Было показано, что вирус иммунодефицита человека (ВИЧ) содержит РНК-й геном, в составе которого имеются как стандартные гены ретровирусов, так и необычные небольшие гены со множеством функций. Последние, в частности, подвержены мутациям с высокой скоростью вследствие низкой точности репликации, вызванной свойствами обратной транскриптазы. Эта вирусная обратная транскриптаза иммунодефицита человека оказалась наделенной значительно большим сродством к азидотимидину, чем к природному дезокситимидинтрифосфату (dTТФ). Азидотимидин конкурентно тормозит связывание dTТФ, вызывая тем самым терминацию (окончание) синтеза вирусной РНК.
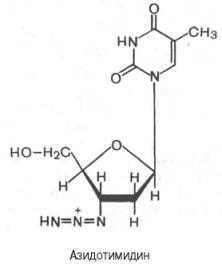
Выяснены некоторые детали механизма действия ряда других антибиотиков, используемых при лечении тифозных инфекций. Так, хлорам-феникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий; на этот процесс в 80S рибосоме он не действует. Тормозит синтез белка в 80S рибосоме (без поражения процесса в 70S рибосоме) циклогексимид - специфический ингибитор транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделенным способностью катализировать реакцию АДФ-рибозилирования фактора элонгации эукариот (eEF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомного механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т.е. тормозят синтез белка в клетках животных.
Полученные к настоящему времени данные о механизме действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 14.2 (по Харперу с небольшими изменениями).
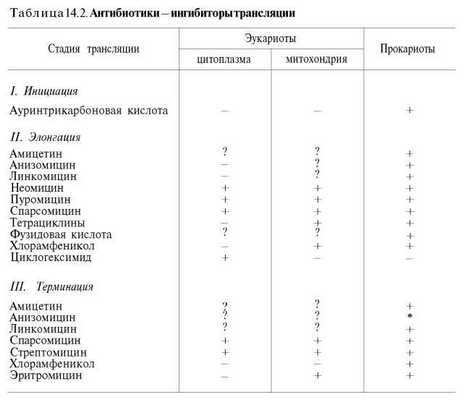
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и соответственно изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
Следует отметить, однако, что организм располагает мощными механизмами защиты. Подобные изменения генетического аппарата быстро распознаются специфическими ферментами - рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Читайте также:
