Инсулин и глюкоза мозга. Влияние инсулина на обмен жиров
Добавил пользователь Alex Обновлено: 21.01.2026
Основным источником энергии для клеток организма является глюкоза. Глюкоза образуется при всасывании углеводов, которые человек получает с пищей.
Когда человек не ест, нормальный уровень глюкозы крови поддерживается за счет использования запасов углеводов, которые есть в организме (гликоген печени) и синтеза глюкозы из белков. Часто спрашивают, если человек не ест, почему у него повышается глюкоза крови, откуда она берется. Ответ: из гликогена печени и распада белков. Однако запасов гликогена мало (примерно 90 грамм), а синтезировать глюкозу из белка организму крайне невыгодно, поэтому при голодании организм начинает «экономить» глюкозу и отключает ее поступление в часть органов. Т.е. при голодании глюкоза поступает только в критически важные органы (мозг, сосуды, почки, нервы).
Не пропускает глюкозу в ткани при голодании инсулин. Образно говоря, на клетках некоторых органов «висит замок», который открывается инсулином. Когда инсулин открывает замок, глюкоза поступает в клетку. Эти ткани являются инсулинозависимыми, глюкоза может попасть в них только тогда, когда инсулин «даст разрешение». Инсулинозависимыми тканями являются мышцы, жировая ткань.
Но в некоторые органы глюкоза попадает без инсулина, там нет замков, дверь для глюкозы всегда открыта. Эти органы называются инсулинНЕзависимыми. Смысл действия инсулина: есть еда, можем прокормить всех, инсулин открывает двери в клетки для глюкозы. Нет еды, значит, будем кормить только самые важные органы, инсулин закрывает двери для глюкозы в менее важных органах (можно оставить «голодными» мышцы и жир, но мозг нельзя).
Но что происходит, когда нет инсулина или он дефектный? Тогда глюкоза из углеводов пищи попадает в кровь, но не может поступить в ткани. Даже если уровень глюкозы в крови высокий, инсулинозависимые ткани голодают, дверь для глюкозы в клетке закрыта на замок, ключа нет или он сломан («голод среди изобилия»).
И в то же время в инсулинНЕзависимые ткани глюкоза поступает в излишних количествах. А что излишне, то нездорово. Глюкоза начинает связываться с белками этих тканей и повреждать их. Именно из-за этого при диабете и происходит повреждение органов-мишеней (нервов, сосудов, почек и др.).
Как происходит секреция инсулина в норме?
Минимальное количество инсулина в организме вырабатывается всегда (это называется базальная секреция инсулина). Когда человек поел, всасываются углеводы, в кровь поступает глюкоза, происходит выброс инсулина (это называется пищевой или прандиальный пик), двери открываются, глюкоза идет в клетку.
В норме секреция инсулина в ответ на прием пищи происходит в 2 фазы: первую быструю фазу (1-3 минуты) и вторую медленную (до 25-30 минут).
Поговорим про инсулин
Инсулин — это гормон поджелудочной железы, который главным образом воздействует на обмен веществ, причем в основном — на концентрацию глюкозы в крови. В своих тканях-мишенях он влияет как на мембранные, так и на внутриклеточные процессы. Некоторые из его эффектов перечислены в ниже.
Эффекты инсулина

Мембранные эффекты
- Стимуляция транспорта глюкозы (и некоторых других моносахаридов)
- Стимуляция транспорта аминокислот (особенно аргинина)
- Стимуляция транспорта жирных кислот
- Стимуляция поглощения клеткой К+ и Mg2+
Внутриклеточные эффекты
- Стимуляции синтеза РНК и ДНК
- Стимуляция синтеза белка
- Усиленная стимуляция гликогенсинтазы (гликогенез)
- Стимуляция глюкокиназы
- Ингибирование глюкозо-6-фосфатазы
- Стимуляция липогенеза
- Ингибирование липолиза (ингибирование синтеза цАМФ)
- Стимуляция синтеза жирных кислот
- Активация Mg2+-стимулируемой Na+/K+-АТФазы
Механизм действия инсулина и влияние его на обмен
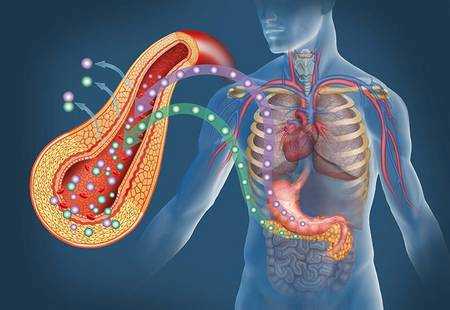
Инсулин и глюкоза
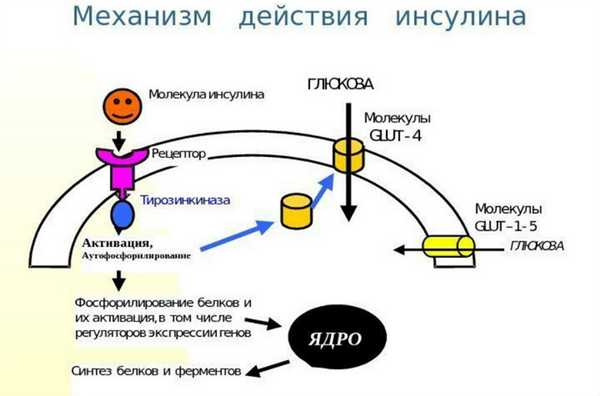
Попав в клетку, глюкоза быстро превращается в глюкозо-6-фосфат, поэтому ее внутриклеточная концентрация остается крайне низкой. Уровень глюкозы в артериальной крови в норме поддерживается в пределах 4-8 ммоль/л (72-144 мг/100 мл), так что по обе стороны клеточной мембраны всегда существует градиент ее концентраций. Несмотря на это, однако, простая диффузия обеспечивает поступление в большинство клеток лишь небольшого количества глюкозы, которого явно недостаточно для удовлетворения их метаболических потребностей (даже при возрастании концентрационного градиента, как это имеет место при высокой гипергликемии). В присутствии же инсулина проникновение декстрозы в клетки резко усиливается. Это действие инсулина проявляется лишь при наличии концентрационного градиента глюкозы, конкурентно ингибируется другими моносахаридами (например, галактозой) и следует кинетике насыщаемого процесса. Таким образом, гормон стимулирует процесс облегченной диффузии декстрозы, который осуществляется при участии чувствительных к гормону белковых транспортеров глюкозы (GLUT), расположенных на клеточной мембране. Эти транспортеры способны переносить глюкозу через клеточную мембрану в обоих направлениях, но ее поток зависит от концентрационного градиента, который направлен из внеклеточного пространства во внутриклеточное. В разных клетках найдены многочисленные GLUT, но инсулинозависимым является только один из этих белков — GLUT4, и именно он присутствует в мембранах клеток скелетных и сердечных мышц, а также жировой ткани.
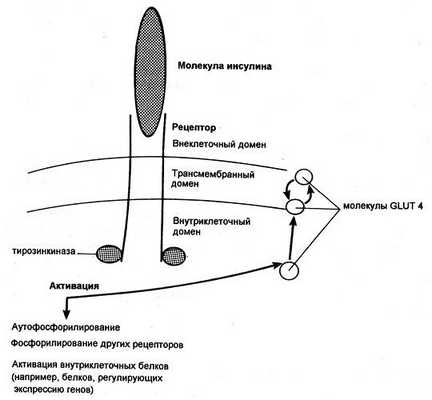
Димерный рецептор инсулина и последствия инсулиновой активации тирозинкиназы (GLUT — транспортер глюкозы)
Некоторые ткани полностью удовлетворяют свои потребности в глюкозе за счет инсулиннезависимых механизмов. Например, в клетки печени и центральной нервной системы декстроза попадает с помощью инсулиннезависимых GLUT, и поглощение этими тканями зависит только от ее уровня в крови. Кроме того, мембрану эритроцитов, клеток почек и кишечника глюкоза пересекает вместе с ионами натрия, которые поступают в клетки путем пассивной диффузии по градиенту концентрации.
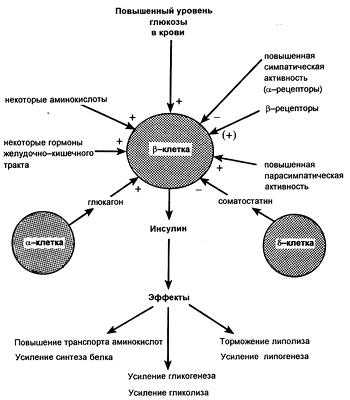
Регуляция продукции инсулина
Инсулин влияет и на внутриклеточные процессы обмена веществ. В печеночных и других клетках он стимулирует синтез гликогена, повышая активность гликогенсинтазы, что ускоряет включение гликозильных остатков в гликоген. Гормон поджелудочной железы повышает также активность печеночной глюкокиназы; этот фермент катализирует фосфорилирование глюкозы (с образованием глюкозо-6-фосфата). Одновременно гормон ингибирует печеночную фосфатазу, которая дефосфорилирует глюкозо-6-фосфат, с образованием свободной глюкозы. Такие изменения активности печеночных ферментов обусловливают снижение продукции декстрозы и наряду со стимуляцией поглощения ее периферическими клетками определяют гипогликемию, возникающее под влиянием инсулина. Возрастающая под действием последнего утилизация глюкозы в тканях обеспечивает сохранение запасов других внутриклеточных энергетических субстратов, таких как жиры и белки.
Белки и инсулин
Инсулин стимулирует не только активный транспорт аминокислот в периферические клетки, но и непосредственно синтез белка. Поскольку эти два эффекта могут не зависеть друг от друга, гормон влияет, очевидно, не только на клеточную мембрану, но и на внутриклеточные процессы. Стимуляции синтеза белка предшествует возрастание активности мРНК. Поскольку гормон с трудом проходит сквозь мембраны клеток, в механизме его ядерного эффекта должен принимать участие второй посредник. Синтез белка под действием инсулина усиливается и вследствие возрастания количества поступающих в клетку аминокислот. С другой стороны, возрастание утилизации глюкозы замедляет распад белка. Ускорение синтеза и замедление распада белка под влиянием гормона приводят к увеличению белковых запасов в интрацеллюлярном секторе.
Все эти эффекты определяют важнейшую роль инсулина в регуляции процессов роста и развития.
Инсулин и жир
Инсулин стимулирует поглощение и окисление глюкозы клетками жировой ткани. Он также стимулирует синтез липопротеиновой липазы в эндотелиальных клетках. Этот фермент катализирует гидролиз триглицеридов, связанных с липопротеинами крови, и способствует поступлению жирных кислот в адипоциты. Наряду с прямой стимуляцией липогенеза в печени и жировой ткани это приводит к увеличению запасов жира. Кроме того, инсулин ингибирует опосредуемый цАМФ липолиз, тормозя гормончувствительную внутриклеточную липопротеиновую липазу.
Инсулин и калий
Присутствие инсулина необходимо для поддержания внутриклеточной концентрации ионов калия; этот эффект, по всей вероятности, является следствием прямого влияния гормона на клеточную мембрану.
Синдром инсулинорезистентности при абдоминальном ожирении
Какова причины ожирения? Что входит в понятие инсулинорезистент- ного синдрома? Каковы принципы лечения абдоминального ожирения? Ожирение в настоящее время является одним из наиболее распространенных хронических заболеваний. Эпидемиологические исс
Какова причины ожирения?
Что входит в понятие инсулинорезистент- ного синдрома?
Каковы принципы лечения абдоминального ожирения?
Ожирение в настоящее время является одним из наиболее распространенных хронических заболеваний. Эпидемиологические исследования свидетельствуют о стремительном росте числа больных ожирением во всех странах. Ожирением (ИМТ > 30) страдают от 9 до 30% взрослого населения развитых стран мира. Наряду со столь высокой распространенностью ожирение является одной из основных причин ранней инвалидизации и летальности больных трудоспособного возраста.
 |
| Рисунок 1. Для лечения абдоминального ожирения рекомендуется диета, богатая грубоволокнистой клетчаткой |
Пациенты с ожирением имеют повышенный риск развития сахарного диабета второго типа (СД 2), артериальной гипертонии, сердечно-сосудистых заболеваний, смертность от которых является самой высокой в развитых странах.
Ожирение — это гетерогенное заболевание. Несомненно, избыточное накопление жировой ткани в организме не всегда приводит к развитию тяжелых сопутствующих осложнений. До сих пор остается спорным вопрос о взаимосвязи между развитием ожирения, риском развития сердечно-сосудистых заболеваний и смертности от них.
Тем не менее существует много больных с избыточной массой тела или незначительно выраженным ожирением с дислипидемией и другими метаболическими нарушениями. Это, как правило, больные с избыточным отложением жира преимущественно в абдоминальной области. Как показывают эпидемиологические исследования, эти больные имеют очень высокий риск развития СД 2, дислипидемии, артериальной гипертонии, ишемической болезни сердца и других проявлений атеросклероза.
Результаты изучения взаимосвязи топографии жировой ткани и метаболических нарушений позволили рассматривать абдоминальное ожирение как самостоятельный фактор риска развития СД 2 и сердечно-сосудистых заболеваний.
Именно характер распределения жировой ткани в организме определяет риск развития сопутствующих ожирению метаболических осложнений, что необходимо принимать во внимание при обследовании пациентов с ожирением.
В клинической практике для диагностики абдоминального ожирения используется простой антропометрический показатель отношения окружности талии к окружности бедер (ОТ/ОБ). Коэффициент ОТ/ОБ у мужчин > 1,0, у женщин > 0,85 свидетельствует о накоплении жировой ткани в абдоминальной области.
С помощью КТ- или МР-томографии, позволивших более детально изучить топографию жировой ткани в абдоминальной области, были выделены подтипы абдоминального ожирения: подкожно-абдоминальный и висцеральный и показано, что больные с висцеральным типом ожирения имеют самый высокий риск развития осложнений. Обнаружено также, что избыточному накоплению висцеральной жировой ткани, как при ожирении, так и при нормальной массе тела, сопутствует инсулинорезистентность и гиперинсулинемия, которые являются основными предикторами развития СД 2. Более того, показано, что избыточное отложение висцеральной жировой ткани сочетается с атерогенным липопротеиновым профилем, который характеризуется: гипертриглицеридемией, повышением уровня хл-ЛНП, аполипопротеина-В, увеличением мелких плотных частиц ЛНП и снижением концентрации хл-ЛВП в сыворотке крови. Сопровождается также нарушениями со стороны свертывающей системы крови, проявляющимися склонностью к тромбообразованию.
Как правило, у больных с абдоминальным ожирением вышеперечисленные нарушения развиваются рано и длительно протекают бессимптомно, задолго до клинической манифестации СД 2, артериальной гипертонии, атеросклеротических поражений сосудов.
Однако не всегда инсулинорезистентность приводит к развитию НТГ и СД 2, но у этих больных имеется очень высокий риск развития атеросклероза. Если же происходит манифестация СД 2 у больных с абдоминальным ожирением, то суммарный риск развития сердечно-сосудистых заболеваний значительно возрастает.
Несмотря на то что выявление висцерального типа ожирения наиболее эффективно с помощью КТ- и МР-томографии, высокая стоимость этих методов ограничивает их применение в широкой практике. Но исследования подтвердили тесную корреляцию между степенью развития висцеральной жировой ткани и величиной окружности талии (ОТ). Выявлено, что ОТ, равная 100 см, косвенно свидетельствует о таком объеме висцеральной жировой ткани, при котором, как правило, развиваются метаболические нарушения и значительно возрастает риск развития СД 2. Поэтому величина ОТ может считаться надежным маркером избыточного накопления висцеральной жировой ткани. Измерение ОТ при обследовании больных с ожирением позволяет легко выделить пациентов с высоким риском развития СД 2 и сердечно-сосудистых заболеваний.
Окружность талии > 100 см в возрасте до 40 лет и > 90 см в возрасте 40-60 лет как у мужчин, так и у женщин является показателем абдоминально-висцерального ожирения.
Метаболические и клинические нарушения, в основе которых лежат инсулинорезистентность и компенсаторная гиперинсулинемия, объединены в понятие синдрома инсулинорезистентности, известного также как синдром Х или метаболический синдром.
Впервые в 1988 году Г. Ривен, представив описание инсулинорезистентного синдрома, который он обозначил как синдром Х, подтвердил значение инсулинорезистентности в качестве основы составляющих синдрома. Вначале он не включил ожирение в число обязательных признаков синдрома. Однако более поздние работы, как автора, так и других исследователей, показали тесную связь абдоминального ожирения, особенно обусловленного избыточным развитием висцеральной жировой ткани, с синдромом инсулинорезистентности, и подтвердили определяющую роль ожирения в развитии резистентности периферических тканей к действию инсулина. По данным Ривена, инсулинорезистентность имеют также около 25% лиц без ожирения и с нормальной толерантностью к глюкозе, ведущих малоподвижный образ жизни. Как правило, состояние инсулинорезистентности у них сочетается с дислипидемией, идентичной той, которая имеется у больных с СД 2, и повышенным риском развития атеросклероза.
Основные составляющие синдрома инсулинорезистентности представлены на рисунке 2.
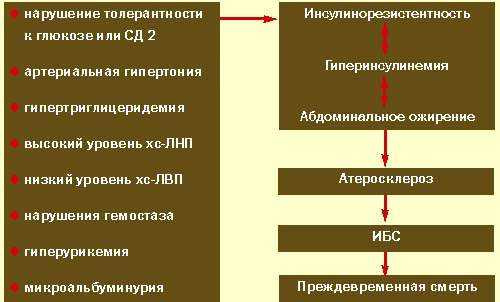 |
| Рисунок 2. Синдром инсулинорезистентности при абдоминальном ожирении |
Как уже говорилось, основу синдрома инсулинорезистентности при абдоминальном ожирении составляет инсулинорезистентность и сопутствующая ей компенсаторная гиперинсулинемия. Инсулинорезистентность определяется как снижение реакции инсулиночувствительных тканей на физиологические концентрации инсулина. Доказано, что инсулинорезистентность есть результат взаимодействия генетических, внутренних и внешних факторов, среди последних наиболее важными являются избыточное потребление жира и гиподинамия. В основе инсулинорезистентности лежит нарушение как рецепторных, так и пострецепторных механизмов передачи инсулинового сигнала. Клеточные механизмы инсулинорезистентности могут быть различны в разных тканях. Так, к примеру, снижение числа инсулиновых рецепторов обнаруживается на адипоцитах и, значительно в меньшей степени, в мышечных клетках. Снижение же активности тирозинкиназы инсулинового рецептора выявляется как в мышечных, так и в жировых клетках. Нарушения транслокации внутриклеточных транспортеров глюкозы, GLUT-4, на плазматическую мембрану наиболее выражены в адипоцитах. Более того, как свидетельствуют исследования, инсулинорезистентность при ожирении развивается постепенно, в первую очередь в мышцах и печени. И только на фоне накопления большого количества липидов в адипоцитах и увеличения их размеров развивается состояние инсулинорезистентности в жировой ткани, которое способствует дальнейшему усилению инсулинорезистентности. Действительно, в целом ряде работ показано, что стимулированное инсулином поглощение глюкозы снижается при прогрессировании ожирения. С помощью клэмп-метода выявлена также прямая зависимость между степенью развития абдоминально-висцеральной жировой ткани и выраженностью инсулинорезистентности.
Какие же патофизиологические механизмы обуславливают столь тесную взаимосвязь между инсулинорезистентностью и ожирением, особенно абдоминально-висцерального типа? В первую очередь, конечно, это генетические факторы, которые влияют как на развитие инсулинорезистентности, так и на функциональные возможности b-клеток.
В последние годы было обнаружено, что сама жировая ткань, обладая эндокринной и паракринной функциями, секретирует вещества, влияющие на чувствительность тканей к инсулину. Увеличенные адипоциты секретируют большое количество цитокинов, особенно TNF-a, и лептина. TNF-a нарушает взаимодействие инсулина с рецептором, а также влияет на внутриклеточные переносчики глюкозы (GLUT-4) как в адипоцитах, так и в мышечной ткани. Лептин, являясь продуктом ob-гена, секретируется исключительно адипоцитами. У большинства больных ожирением имеется гиперлептинемия. Предполагается, что лептин в печени может тормозить действие инсулина, влияя на активность PEPCK-фермента, ограничивающего скорость глюконеогенеза, а также оказывает в жировых клетках аутокринное действие и тормозит стимулированный инсулином транспорт глюкозы.
Жировая ткань висцеральной области обладает высокой метаболической активностью, в ней происходят как процессы липогенеза, так и липолиза. Среди гормонов, участвующих в регуляции липолиза в жировой ткани, ведущую роль играют катехоламины и инсулин: катехоламины через взаимодействие с a- и b-адренорецепторами, инсулин через специфические рецепторы. Адипоциты висцеральной жировой ткани имеют высокую плотность b-адренорецепторов, особенно b3-типа, и относительно низкую плотность a-адренорецепторов и рецепторов к инсулину.
 |
| Рисунок 3. Абдоминальное ожирение рассматривается как самостоятельный фактор риска развития сахарного диабета второго типа и сердечно- сосудистых заболеваний |
Интенсивный липолиз в висцеральных адипоцитах приводит к избыточному поступлению свободных жирных кислот (СЖК) в портальную систему и печень, где под влиянием СЖК нарушается связывание инсулина гепатоцитами. Нарушается метаболический клиренс инсулина в печени, что способствует развитию системной гиперинсулинемии. Гиперинсулинемия, в свою очередь, через нарушение ауторегуляции инсулиновых рецепторов в мышцах усиливает инсулинорезистентность. Избыток СЖК стимулирует глюконеогенез, увеличивая продукцию глюкозы печенью. СЖК являются также субстратом для синтеза триглицеридов, тем самым приводя к развитию гипертриглицеридемии. Возможно, СЖК, конкурируя с субстратом в цикле глюкоза — жирные кислоты, тормозят поглощение и утилизацию глюкозы мышцами, способствуя развитию гипергликемии. Гормональные нарушения, сопутствующие абдоминальному ожирению (нарушение секреции кортизола и половых стероидов), в свою очередь также усугубляют инсулинорезистентность.
В настоящее время синдрому инсулинорезистентности отводится ведущая роль в эпидемии СД 2, метаболического варианта артериальной гипертонии, сердечно-сосудистых заболеваний.
Согласно данным, представленным ВОЗ, число больных с инсулинорезистентным синдромом, имеющих высокий риск развития СД 2, составляет в Европе 40-60 млн. человек. Результаты Quebec Cardiovascular Study, опубликованные в 1990 году, подтвердили атерогенную природу дислипидемии при синдроме инсулинорезистентности. В условиях инсулинорезистентности происходит изменение активности липопротеинлипазы и печеночной триглицеридлипазы, приводящее к увеличению синтеза и секреции ЛОНП, нарушению их элиминации. Происходит увеличение уровня липопротеидов, богатых триглицеридами, концентрации плотных малых частиц ЛНП и снижение холестерина ЛВП, повышение синтеза и секреции аполипопротеина-В. В нарушении метаболизма липидов при абдоминальном ожирении большое значение имеет повышение постпрандиального уровня СЖК и триглицеридов. Если в норме инсулин угнетает высвобождение СЖК из жировых депо после приема пищи, то в условиях инсулинорезистентности этого торможения не происходит, что и приводит к увеличению уровня СЖК в постпрандиальный период. Снижается также тормозящее действие инсулина на высвобождение ЛОНП в печени, вследствие чего нарушается баланс между ЛОНП, поступающими из кишечника, и ЛОНП, высвобождающимися из печени. Нарушения липидного обмена, в свою очередь, усиливают состояние инсулинорезистентности. Так, к примеру, высокий уровень ЛНП способствует снижению числа инсулиновых рецепторов.
В последние годы в медицинскую практику введено такое понятие, как атерогенная метаболическая триада у больных с абдоминальным ожирением, которое включает: гиперинсулинемию, гиперлипопротеинемию-В, высокий уровень мелких плотных частиц ЛНП. Доказано, что совокупность этих нарушений создает более высокую вероятность развития атеросклеротических поражений у больных с инсулинорезистентностью, чем известные традиционные факторы риска. Доступными для клинициста маркерами этой триады являются величина окружности талии и уровень триглицеридов в крови.
Хотя вопрос о механизмах развития артериальной гипертонии в рамках синдрома инсулинорезистентности до сих пор дискутируется, несомненно, что комплексное воздействие инсулинорезистентности, гиперинсулинемии и нарушений липидного обмена играют важную роль в механизмах повышения артериального давления у больных с абдоминальным ожирением. Такие эффекты инсулина, как стимуляция симпатической нервной системы, пролиферации гладкомышечных клеток сосудистой стенки, изменения трансмембранного ионного транспорта, имеют определяющее значение в развитии артериальной гипертонии.
Инсулинорезистентность и гиперинсулинемия в большой степени обуславливают нарушения со стороны свертывающей системы крови, особенно снижение факторов фибринолиза, повышение уровня PAI-1, которому в последние годы придается большое значение в процессах атерогенеза у больных с абдоминальным ожирением и инсулинорезистентностью.
Таким образом, представленные данные указывают на значимость сочетанных нарушений, наблюдаемых у больных с абдоминальным ожирением в рамках синдрома инсулинорезистентности, а именно инсулинорезистентности, гиперинсулинемии, нарушений обмена глюкозы и липидов в развитии артериальной гипертонии, СД 2 и атеросклероза. Поэтому ранняя диагностика и лечение абдоминального ожирения — это в первую очередь профилактика, предупреждение или отсрочка манифестации СД 2 и атеросклеротических поражений сосудов. В связи с этим актуально проведение диспансерных осмотров населения с целью выявления групп повышенного риска, больных с абдоминальным ожирением, комплексная оценка их состояния с использованием современных методов исследования. Оценке степени риска развития сопутствующих абдоминальному ожирению осложнений помогает тщательно собранный семейный и социальный анамнез, позволяющий выявить больных с наследственной предрасположенностью и особенностями образа жизни, предопределяющими развитие абдоминального ожирения и инсулинорезистентности. В схему обследования больных необходимо включать не только антропометрические измерения — ИМТ, ОТ, ОТ/ОБ, но и определение маркеров синдрома инсулинорезистентности: уровень триглицеридов, аполипопротеина-В и инсулина натощак.
В связи с тем что избыточное накопление висцеральной жировой ткани является одним из основных патогенетических факторов формирования синдрома инсулинорезистентности, ведущее место в комплексном лечении больных должны занимать мероприятия, направленные на уменьшение массы абдоминально-висцерального жира: гипокалорийное питание в сочетании с регулярными физическими нагрузками. Рацион составляется с учетом массы тела, возраста, пола, уровня физической активности и пищевых пристрастий больного. Ограничивается потребление жира до 25% суточной калорийности, животных жиров не более 10% общего количества жира, холестерина до 300 мг в сутки. Рекомендуется также ограничение потребления быстроусвояемых углеводов и введение в рацион питания большого количества пищевых волокон. Полезны ежедневные аэробные нагрузки средней интенсивности. Снижение массы висцеральной жировой ткани, как правило, приводит к улучшению чувствительности к инсулину, уменьшению гиперинсулинемии, улучшению показателей липидного и углеводного обмена и снижению артериального давления. Однако за счет применения исключительно немедикаментозных методов лечения у больных с синдромом инсулинорезистентности и абдоминальным ожирением, даже на фоне снижения массы тела, не всегда удается компенсировать нарушения липидного и углеводного обмена и уменьшить инсулинорезистентность и гиперинсулинемию. Поэтому перспективным подходом к лечению данной группы больных является включение в арсенал средств лечения медикаментозных препаратов, способных воздействовать на инсулинорезистентность.
Для больных с выраженной дислипидемией, не поддающейся коррекции диетотерапией, можно рассматривать вопрос о назначении гиполипидемических препаратов (группы статинов или фибратов). Однако перед назначением этих препаратов следует тщательно взвесить целесообразность пожизненного лечения больных, возможный риск развития побочных реакций и потенциальную пользу от лечения. Это касается прежде всего больных с синдромом инсулинорезистентности и дислипидемией без клинических проявлений атеросклеротических поражений сосудов и высокого риска их развития.
Назначая симптоматическую терапию — гипотензивными и мочегонными препаратами — больным с абдоминальным ожирением, необходимо учитывать влияние этих препаратов на показатели липидного и углеводного обмена.
Что такое инсулин?

Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 19.09.2020
- Reading time: 3 минут чтения
Инсулин - это гормон, вырабатываемый поджелудочной железой, который необходим для метаболизма углеводов и, в меньшей степени, жиров. Благодаря инсулину энергия (глюкоза) из пищи переносится из крови в клетки. Таким образом снижается уровень сахара в крови и обеспечивается питание клеток.
Когда уровень инсулина в норме, уровень сахара в крови в норме. Когда инсулин слишком низкий (или не работает должным образом), диагностируется диабет. Когда уровень инсулина высокий, а уровень сахара в норме, мы говорим об инсулинорезистентности.
Диабет 1 типа, диабет 2 типа и инсулинорезистентность - это проблемы со здоровьем, которые связаны с инсулином - гормоном, необходимым для жизни. Он нужен организму в строго определенном количестве. Опасны как дефицит инсулина, так и его чрезмерный избыток.
Какую роль инсулин играет в организме? Когда следует проверять его уровень? Что происходит, когда инсулина слишком мало или слишком много?
Как действует инсулин
Инсулин - это гормон, понижающий уровень сахара в крови. Его образно называют ключом, открывающим клетки энергии из пищи. Источником энергии для организма являются углеводы. Энергия из простых углеводов проникает в кровь практически сразу после еды, сложные углеводы сначала нужно расщепить на простые сахара - глюкозу в процессе пищеварения. Она циркулирует в крови и попадает в клетки только в присутствии инсулина. Без инсулина клетки не могут получать энергию из пищи, даже если в крови много глюкозы.
Механизм действия инсулина
Отсюда взаимосвязь между уровнем сахара и инсулином. Когда этот гормон отсутствует, глюкоза не попадает в клетки, она остается в крови, что приводит к гипергликемии. Состояние диагностируют в лабораторных исследованиях или с помощью глюкометра.
Важно отметить, что инсулин не снижает уровень сахара в крови до нуля, то есть не вся энергия из пищи поступает в клетки. Строго определенное количество сахара остается в крови и является топливом, необходимым для работы мозга. Мозгу постоянно нужна глюкоза, это орган, не зависящий от действия инсулина, он забирает сахар из крови без этого гормона.
Вот почему в крови здорового человека содержится определенное количество сахара, которое в лабораторных условиях дает результат в диапазоне 70-99 мг/дл глюкозы натощак.
Инсулин - это белок. Поэтому его следует принимать в виде подкожной инъекции . Таблеток инсулина не существует, потому что они перевариваются в пищеварительном тракте.
Подкожная инъекция инсулина
Инсулин и глюкагон
Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови. После обильной еды с большим количеством углеводов уровень этого гормона в кровотоке значительно увеличивается. Между приемами пищи и ночью уровень инсулина ниже.
Гормон, противоположный инсулину, - это глюкагон, повышающий уровень сахара в крови. В здоровом организме эти два гормона остаются в равновесии. Глюкагон высвобождается, когда сахар в крови начинает слишком низко падать (например, ночью), а инсулин - когда сахар в крови начинает слишком сильно повышаться.
Благодаря сбалансированной секреции этих двух гормонов, у здорового человека уровень сахара остается нормальным как после обильной еды, так и в результате многочасового голодания.
Инсулин - анаболический или строительный гормон, благодаря которому можно выращивать клетки (неиспользованная глюкоза превращается в жир). Высокий уровень инсулина в организме, типичный для инсулинорезистентности, способствует увеличению избыточного веса.
Когда не хватает инсулина
Отсутствие или тяжелая недостаточность инсулина означает диабет типа 1. Это заболевание диагностируется по заметно повышенному уровню сахара в крови (гипергликемия). Его лечение заключается в восполнении дефицита инсулина. Причина нехватки инсулина у пациентов с диабетом 1 типа - это разрушение иммунной системой бета-клеток поджелудочной железы (аутоиммунное заболевание).
Сегодня на рынке представлено множество препаратов инсулина. Инсулин животного происхождения ушел в прошлое, сегодня применяются так называемый человеческий инсулин и аналог инсулина.
Симптомы нехватки инсулина:
- Очень сильная жажда;
- Отхождение большого количества мочи; - клетки голодают, не могут получать энергию из крови, организм начинает сжигать жир, что приводит к потере веса.


До того как был «изобретен» инсулин, диабет 1 типа считался смертельным заболеванием. Пострадавшие пациенты гибли от крайнего недоедания. Поскольку теперь инсулин производят в лабораториях, и он доступен всем, диабет 1 типа перешел в разряд хронических заболеваний.
Когда слишком много инсулина
Избыток инсулина тоже вреден для организма. Мы имеем дело с высоким уровнем инсулина в крови при:
Инсулинорезистентность - это нарушение обмена веществ, диабет 2 типа - это заболевание, которое возникает в результате инсулинорезистентности, поэтому эти проблемы можно обсуждать вместе. Они отличаются тем, что гликемия нормальна при инсулинорезистентности и повышена при диабете 2 типа.
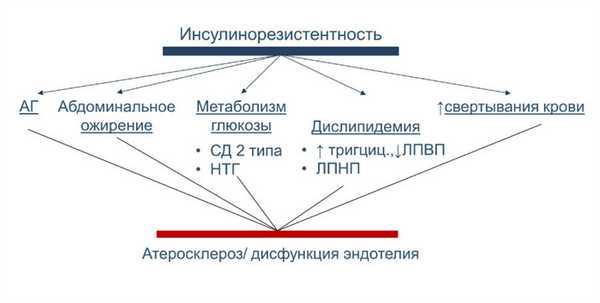
Инсулинорезистентность
Высокая концентрация инсулина возникает, когда поджелудочная железа вынуждена производить избыточный инсулин. Когда это происходит? Когда клетки организма нечувствительны к инсулину (другими словами - устойчивы к нему). Чтобы преодолеть это сопротивление, поджелудочная железа вырабатывает повышенное количество гормона, что дает побочные эффекты:
- Инсулин стимулирует аппетит;
- Как анаболический гормон, он способствует увеличению веса.
Выработка большого количества инсулина ложится нагрузкой на поджелудочную железу, она перестает быть эффективной в этом процессе. Поэтому на основе инсулинорезистентности развивается диабет 2 типа.
Инсулиновая теория ожирения и низкоуглеводная диета - где правда?

Врач гинеколог-эндокринолог. Стаж 23+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 2000 руб.
- Запись опубликована: 15.07.2020
- Reading time: 4 минут чтения
Диеты с низким содержанием углеводов по-прежнему популярны среди большой группы любителей здорового образа жизни. Чаще всего этот тип питания рекомендуется диетологами для снижения уровня жира в организме, поддержания веса, лечения углеводных расстройств, нейродегенеративных и аутоиммунных заболеваний.
Что такое низкоуглеводная диета
Согласно классификации Американской диабетической ассоциации (ADA), низкоуглеводная диета (анг. low-carbohydrates diet lub potocznie low-carb diet ) включает 130 граммов углеводов в день, что составляет менее 26% от общего ежедневного потребления энергии.
Пионерами низкоуглеводной диеты были известные врачи - Роберт Аткинс и Вольфганг Лутц. Также эффективность низкоуглеводного типа питания активно пропагандировал Гари Таубс, физик и журналист по образованию. Таубс опубликовал несколько книг о питании, которые чрезвычайно популярны во всем мире, особенно востребована книга «Почему мы толстеем и как с этим бороться?».
Эти авторы в своей деятельности руководствовались теорией инсулинового ожирения, которая предполагает, что диета, богатая углеводами, связана с увеличением секреции инсулина - гормона, отвечающего за регулирование уровня глюкозы в крови и накопление жировых отложений в организме.
Находит ли эта популярная теория подтверждение достоверными научными данными и каково реальное влияние долгосрочного соблюдения этой диеты на здоровье? Остальная часть статьи обсуждает эти аспекты в свете ранее опубликованных научных работ.

Низкоуглеводная диета
Гипотеза инсулинового ожирения
Среди тех, кто интересуется здоровым образом жизни, включая таких специалистов, как диетологи, эндокринологи, квалифицированные персональные тренеры, утвердилось убеждение, что углеводы являются основным макроэлементом, который отвечает за накопление жировых отложений.
По мнению сторонников гипотезы инсулинового ожирения, оно связано с избыточной секрецией инсулина бета-клетками островков Лангерганса поджелудочной железы. Более того, большая группа сторонников низкоуглеводных диет считает, что следуя этой модели питания, очень сложно прийти к увеличению веса и ожирению, а некоторые даже считают, что это просто невозможно из-за значительного снижения уровня инсулина в сыворотке крови.
Согласно инсулиновой гипотезе ожирения, в результате снижения секреции инсулина наблюдается повышенное выделение свободных жирных кислот из жировой ткани, повышенное окисление жиров, повышенный расход энергии и большая потеря избыточного жира в организме по сравнению с диетическим уменьшением жира. Инсулин является анаболическим гормоном, который отвечает за регулирование уровня сахара в крови, но также оказывает ингибирующее (подавляющее) влияние на липолиз, то есть расщепление триацилглицеролов, и стимулирует липогенез и, следовательно, синтез и накопление триглицеридов.
Стоит отметить, что у здоровых людей концентрация инсулина в сыворотке естественным образом увеличивается после приема пищи, особенно богатой белками и углеводами, а затем явно снижается. Что означает, что энергия, поступающая с потребляемой пищей, фактически сохраняется, но также регулярно используется позже для энергетических целей в результате текущей деятельности и расхода энергии.
Поэтому, принимая во внимание первый закон термодинамики, который включает энергетический баланс на целый день, если количество калорий, потребляемых в виде пищи, не превышает общую энергию, расходуемую в течение дня, большинство процессов будут поддерживать естественный баланс и не будет никакого увеличения веса, независимо от пропорции потребления макроэлементов.
Чтобы точно проверить эту связь, было проведено исследование, результаты которого были опубликованы в журнале Cell Metabolism. В этом исследовании д-р Кевин Холл и его коллеги отметили, что сокращение поступления углеводов в рационе на самом деле привело к снижению секреции инсулина, увеличению окисления жирных кислот и потере телесного жира (53 ± 6 г в день).
Однако снижение содержания жира в рационе не привело к значительным изменениям в секреции инсулина и окислении жирных кислот, в то время как в организме субъектов наблюдалась явно большая потеря жира (89 ± 6 г в день), чем при соблюдении диеты с низким содержанием углеводов.
Цитируемая работа показывает, что потеря веса в случае диеты с уменьшенным запасом углеводов происходила главным образом из-за потери воды, в то время как жирные кислоты, используемые организмом в энергетических целях, происходили главным образом из пищи, не из лишнего жира. Кроме того, низкоуглеводная диета способствовала увеличению катаболизма белка в организме участников исследования с ожирением.
Гипотеза инсулинового ожирения
Следует также упомянуть, что два года назад в Американском журнале Clinical Nutrition были опубликованы результаты другого исследования команды ученых под руководством доктора Кевина Холла.
Это исследование отличалось от предыдущего следующими факторами:
- длилось намного дольше - 8 недель;
- включало в себя физические нагрузки - 90 минут аэробных упражнений на велотренажере в день;
- обеспечивало большее снабжение энергией наряду с диетой.
Ученые сравнивали кетогенную диету со стандартным распределением макронутриентов в диете с преобладанием углеводов.
Авторы цитируемого исследования пришли к выводу, что, хотя кетогенная диета не имеет явного преимущества перед углеводной диетой в контексте сокращения запасов жира, она способствует незначительному увеличению расхода энергии, потере мышечной массы тела, повышению экскреции воды, а также расщеплению белка в организме.
Стоит отметить, что оба исследования финансировались Гэри Таубсом - ведущим разработчиком низкоуглеводных диет в мире, упомянутым в 2012 году фондом Nutrition Science Initiative (NuSI), целью которого является сбор средств для надежных научных исследований роли углеводов. в эпидемии ожирения.
На основании результатов научной работы, а также принимая во внимание другие исследования, проведенные в связи с этим, следует учитывать, что ограничение потребления углеводов и, следовательно, снижение концентрации инсулина в сыворотке крови не обязательно приводит к максимальному сжиганию накопленного жира.
Таким образом, представляется, что рост распространенности ожирения в мире может быть обусловлен, в частности, увеличением потребления продуктов питания с высокой степенью переработки, в том числе рафинированных углеводов. В этом случае механизмы действия отличаются от тех, что предложены сторонниками инсулиновой теории ожирения, так как такие диеты могут привести к большему общему потреблению энергии, за счет усиления вкуса и стимуляции аппетита или уменьшения чувства сытости.
Инсулин и потребление отдельных макроэлементов
Изучая инсулиновую гипотезу, стоит обратить внимание на то, как человеческий организм реагирует на потребление пищи, богатой белками, жирами и углеводами, а точнее, как реагирует постпрандиальный инсулин на поступление определенных макроэлементов с пищей.

Инсулин и макроэлементы
По мнению подавляющего большинства сторонников низкоуглеводной диеты, инсулин вырабатывается в большем количестве островковыми клетками поджелудочной железы в ответ на потребление пищи, богатой сахаридами, и в гораздо меньшем количестве в ответ на потребление белковых продуктов. Также его секреция незначительна после употребления жирной пищи.
Делая обзор доступной в настоящее время профессиональной литературы, следует отметить, что со значительным увеличением сывороточного инсулина связан не только большой запас углеводов. Также в некоторых случаях может привести к более высокому выбросу инсулина по сравнению с сахаридами белок, что наблюдалось в многочисленных научных исследованиях, проведенных до настоящего времени.
Существуют убедительные данные, свидетельствующие о том, что белки усиливают секрецию инсулина, что, по-видимому, в наибольшей степени связано с инсулинотропным действием аминокислот. Таким образом, стимулируется высвобождение этого анаболического гормона.
По этой причине для людей, выбирающих силовые тренировки, главной целью которых является формирование тела и увеличение мышечной массы, запас углеводов сразу после выполнения упражнения гораздо менее важен, чем обеспечение организма полноценным белком.
Более того, инсулин не является необходимым для накопления жировой ткани, потому что основную роль в увеличении синтеза триацилглицерина играет стимулирующий ацилирование белок-ASP, явное увеличение которого наблюдается после приема пищи с высоким содержанием жиров.
Как следует из информации, представленной учеными к настоящему времени, многие очень важные аспекты в инсулиновой теории ожирения, несомненно, были пропущены, что не означает, что потребление углеводов и концентрация инсулина в сыворотке не имеют значения для регуляции содержания жира в организме. Дело скорее в том, что их роль сложнее, чем та, которую широко пропагандируют сторонники этой гипотезы.
Читайте также:
