Оценка пользы кломифена при бесплодии и причины его неэффективности
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Клостилбегит (кломифен) представляет собой один из классов селективных модуляторов эстрогеновых рецепторов (СМЭР). Механизм действия Клостилбегита основан на селективном воздействии на эстрогеновые рецепторы гипоталамо-гипофизарной системы, в связи с чем рецепторы блокируются для эстрогенов и по механизму обратной связи происходит усиление секреции гонадотропинов (фолликулостимулирующего и лютеинизирующего гормонов), что воздействуя на фолликулы в яичниках вызывает стимуляцию их функции (стимуляцию овуляции). Существуют указания на то, что блокада эстрогеновых рецепторов гипоталамуса приводит к усилению выработки гонадолиберинов, обеспечивая тем самым более высокий уровень регуляции гипоталамо-гипофизарно-яичниковой системы.
Клостилбегит имеет определенные особенности фармакокинетики: хорошая всасываемость при пероральном приеме, длительный (до 7 дней) период полувыведения за счет активного связывания с белками плазмы крови.
Показания для применения препарата
Показанием для применения Клостилбегита является бесплодие, связанное с отсутствием овуляции (N97.0 по классификации МКБ X). С учетом длительного опыта (несколько десятилетий) использования этого препарата для лечения ановуляции, хорошо изучены плюсы и минусы применения данного препарата, разработаны различные схемы стимуляции овуляции.
Плюсы и минусы препарата
Основными плюсами применения Клостилбегита для достижения беременности являются:
- низкая стоимость,
- широкая доступность,
- пероральный путь приема,
- высокая эффективность (при отсутствии кломифен-резистентности),
- малое число возможных осложнений при лечении бесплодия (низкая частота многоплодной беременности, низкая частота развития синдрома гиперстимуляции яичников).
Однако, несмотря на очевидные плюсы, у Клостилбегита существуют существенные минусы, ограничивающие его применение при лечении бесплодия. Основными негативными факторами при использовании Клостилбегита являются:
- антиэстрогенный эффект, который может приводить к нарушению функции эндометрия, нарушению свойств цервикальной слизи и вагинального эпителия.
- у части пациенток гипоэстрогенное состояние может вызывать вазомоторные реакции (приливы),
- применение СМЭР повышает риск тромботических осложнений любых локализаций.
Возвращаясь к механизму стимуляции функции яичников при использовании Клостилбегита (стимуляция секреции гонадотропинов на фоне блокады эстрогеновых рецепторов гипоталамо-гипофизарной системы) важно понимать, что применение Клостилбегита при гипогонадизме (гипопитуитаризме) неэффективно, так как усиления секреции гонадотропинов не будет наблюдаться в виду их отсутствия. В этой ситуации показано применение собственное препаратов гонадотропинов. Таким образом, стимуляция овуляции Клостилбегитом эффективна только при нормогонадотропной ановуляции.
Клостилбегит может являться препаратом первой линии терапии при необходимости стимуляции овуляции у пациенток с синдромом поликистозных яичников (при отсутствии кломифен-резистентности).
Применяемые дозировки
Клостилбегит обычно назначают в дозе 50-100 мг/сут в течение 5 дней, как правило, с 5 по 9 день менструального цикла. Существует множество схем стимуляциии подходов к назначению данного препарата: изолированное назначение, в комбинации с триггером овуляции, в комбинации с гонадотропинами и т.д. Выбор той или иной схемы обусловлен предполагаемыми целями стимуляции овуляции: монофолликулярный рост для восстановления естественной фертильности и инсеминации, мультифолликулярный рост в «мягких» схемах стимуляции и модифицированных протоколах программы экстракорпорального оплодотворения (ЭКО).
Важным аспектом назначения Клостилбегита является ультразвуковой мониторинг как фолликулогенеза, так и состояния эндометрия. При неудовлетворительной толщине эндометрия по данным УЗИ возможно применение препаратов эстрогенов после окончания приема Клостилбегита. Как правило, применение препаратов эстрогенов позволяет добиться необходимой толщины эндометрия к предполагаемому периоду имплантации.
Клостилбегит при бесплодии
Клостилбегит при лечении бесплодия является недорогим высокоэффективным препаратом первой линии терапии нормогонадотропной ановуляции. Важным положительным моментом его применения является возможность перорального приема. Однако применение данного препарата связано с определенным риском развития осложнений и должно осуществляться только врачом, по возможности, с применением ультразвукового мониторинга фолликулогенеза и развития эндометрия. В подавляющем большинстве случаев негативное антиэстрогенное воздействие Клостилбегита на толщину эндометрия можно скорректировать применением препаратов эстрогенового ряда после окончания приема Клостилбегита в планируемом фертильном цикле.
Оценка пользы кломифена при бесплодии и причины его неэффективности
Кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
Кафедра эндокринологии Первого МГМУ им. И.М. Сеченова
Терапия бесплодия у пациенток с ожирением: современный взгляд на проблему
Журнал: Проблемы репродукции. 2012;(3): 37‑41
Подзолкова Н.М., Колода Ю.А., Подзолков А.В. Терапия бесплодия у пациенток с ожирением: современный взгляд на проблему. Проблемы репродукции. 2012;(3):37‑41.
Podzolkova NM, Koloda IuA, Podzolkov AV. INFertility Therapy in obese patients: modern trends. Russian Journal of Human Reproduction. 2012;(3):37‑41. (In Russ.).
Статья посвящена актуальным вопросам лечения бесплодия у пациенток с ожирением. Освещены вопросы медикаментозной терапии с позиции доказательной медицины. Представлены результаты собственных исследований и данные крупных мета-анализов и систематических обзоров.
Вопросы диагностики и лечения бесплодного брака относятся к числу актуальных проблем современной медицинской науки и практики. Частота бесплодного брака в России составляет 15—17% при том, что показатель, равный 15%, является критическим, и проблема бесплодия приобретает государственное значение. Наряду с проблемой бесплодия в последние годы отмечается неуклонный рост ожирения. По предварительным данным, в России не менее 30% трудоспособного населения имеют избыточную массу тела и 25% — ожирение. Эти данные в совокупности с данными других стран позволяют говорить о существовании глобальной «эпидемии» ожирения [8].
При ожирении в 2—5 раз чаще возникают различные формы нарушений менструального цикла, такие как олигоменорея и аменорея, повышается частота маточных кровотечений и патологии эндометрия. Ожирение, особенно андроидного типа, является одним из главных факторов риска развития яичниковой гиперандрогении, при этом более чем у 1 /3 женщин может формироваться синдром поликистозных яичников (СПКЯ). При ожирении примерно в 3 раза чаще отмечается ановуляторное бесплодие. Частота бесплодия у женщин с ожирением составляет 33,6% по сравнению с 18,6% женщин с нормальной массой тела. Также значительно снижается эффективность различных видов терапии, направленной на восстановление фертильности. В случае же наступления беременности при ожирении значительно возрастает риск ранних потерь беременности, частота которых достигает 40—50%.
В основе развития метаболических и гормональных нарушений при ожирении лежит инсулинорезистентность. Инсулинорезистентность выявляется у 88% больных с андроидным типом ожирения и у 32% больных при гиноидном типе ожирения (в основном, III—IV степени) [2]. Развитие инсулинорезистентности генетически детерминировано [4]. Пострецепторные дефекты передачи сигнала инсулина (нарушение аутофосфорилирования β-субъединицы инсулинового рецептора и снижение активности тирозинкиназы, усиление фосфорилирования серина в субстрате инсулинового рецептора-1 (IRS-1), уменьшение активности фосфатидилинозитол-3-киназы (PI3-K) снижают чувствительность тканей к инсулину и инсулинзависимую утилизацию глюкозы тканями, что может привести к нарушению толерантности к глюкозе и сахарному диабету (СД) 2-го типа (СД2) [6]. Для поддержания концентрации глюкозы на нормальном уровне компенсаторно развивается гиперинсулинемия. Инсулин совместно с инсулиноподобными факторами роста -1, 2 (ИФР 1,2) приводят к повышению концентрации ЛГ и усиливают ЛГ-зависимый синтез андростендиона тека- и стромальными клетками. Кроме того, они независимо от ЛГ напрямую стимулируют выработку андрогенов текаклетками. Гиперинсулинемия вызывает преждевременную чувствительность клеток гранулезы к ЛГ, вызывая лютеинизацию мелких фолликулов. Это приводит к остановке роста антральных фолликулов и их атрезии. Инсулин также способен подавлять продукцию сексстероидсвязывающих глобулинов, что приводит к повышению концентрации свободных андрогенов. В конечном итоге развивается состояние, характеризующееся гиперандрогенемией и ановуляцией, формируются поликистозные яичники, что и становится основной причиной бесплодия [4].
Обязательным этапом в терапии бесплодия у пациенток с ожирением и хронической ановуляцией является снижение массы тела. В некоторых странах, например в Великобритании и Новой Зеландии, многие страховые компании даже отказываются оплачивать попытки ЭКО женщинам с ожирением до тех пор, пока они не нормализуют массу тела [17].
Результаты влияния снижения массы тела на репродуктивную функцию обнадеживающие. Своевременная коррекция массы тела часто приводит к нормализации цикла, а у многих больных без применения какой-либо дополнительной терапии и к восстановлению фертильности [8]. Для восстановления цикличности менструальной функции нередко бывает достаточно снижения массы тела на 10—15%. По данным M. Hollmann [22], на фоне снижения массы тела без назначения какой-либо другой терапии у 80% женщин восстанавливается менструальная функция, у 29% из них наступает беременность без стимуляции овуляции. R. Pasquali и соавт. [35] оценивали эффекты снижения массы тела у 20 женщин с ожирением, гиперандрогенией и олиго-ановуляцией. До назначения диеты средний индекс массы тела (ИМТ) составлял 32 кг/м 2 , наблюдалась аменорея >3 мес и повышенная концентрация андростендиона, тестостерона и дегидроэпиандростерона сульфата. Женщинам была назначена гипокалорийная диета от 1000 до 1500 калорий в день. Средняя потеря массы тела составила 9,7 кг. При этом наблюдалось значительное снижение ЛГ, уровня инсулина натощак и тестостерона. После снижения массы тела большинство циклов стали овуляторными, а у многих из ранее бесплодных женщин наступила беременность.
Однако зачастую снижение массы тела трудно достигнуть только диетой и физическими нагрузками. В большинстве случаев после снижения массы тела она нарастает вновь. Нередко возникает необходимость присоединения медикаментозной терапии.
Для лечения метаболического синдрома в настоящее время используют как препараты, направленные на снижение массы тела, так и препараты, повышающие чувствительность к инсулину (сенситайзеры инсулина). Существует мнение, что при наличии ожирения без сопутствующей гипергликемии натощак предпочтение следует отдавать препаратам, снижающим массу тела, а назначение сенситайзеров инсулина оправдано при наличии признаков инсулинорезистентности, о чем свидетельствует повышение индекса Homa более 2,5 (рассчитывают по формуле: инсулин натощак (мкЕД/мл) × глюкоза натощак (ммоль/л)/22,5) [3].
Упражнения, низкокалорийная диета и медикаментозная терапия, направленная на снижение массы тела и повышение чувствительности тканей к инсулину, помогают скорректировать эндокринные нарушения, сопровождающие ожирение и инсулинорезистентность, и повысить таким образом эффективность терапии бесплодия при ожирении [16].
По данным метаанализа A. Nieuwenhuis-Ruifrok и соавт. [31], использование метформина при ожирении и СПКЯ приводит к значимому снижению ИМТ, при этом больший эффект наблюдается при использовании более высоких доз (>1500 мг/сут) и при более длительном применении (более 8 нед).
В 2011 г. опубликован метаанализ по сравнению метформина и тиазолидиндионов у пациенток с СПКЯ. Результаты показали, что тиазолидиндионы лучше влияют на концентрацию свободного тестостерона и ДГЭА-сульфата, а метформин в большей степени снижает уровень триглицеридов и индекс массы тела. Препараты в одинаковой степени влияют на концентрацию ЛГ, ФСГ, общего холестерина и инсулина. Различий по частоте овуляции и частоте наступления беременности выявлено не было [27].
В случаях, когда терапия, направленная на снижение массы тела и повышение чувствительности к инсулину, не приводит к восстановлению овуляции и наступлению беременности, проводят ее стимуляцию. Препаратом первой линии при СПКЯ является селективный модулятор эстрогеновых рецепторов — кломифена цитрат. Механизм действия этого препарата основан на блокаде рецепторов эстрадиола в гипоталамусе, а возможно и в гипофизе, в связи с чем по механизму отрицательной обратной связи усиливается выброс ГнРГ и увеличивается продукция ЛГ и ФСГ, причем ЛГ в большей степени. Это соответственно стимулирует рост и созревание фолликулов в яичнике [9]. Эффективность восстановления овуляции при терапии кломифеном, по данным литературы [8], колеблется от 60 до 85%, однако частота наступления беременности невысока (35—40%). Женщины с ановуляторным бесплодием демонстрируют меньшую чувствительность к различным методам стимуляции овуляции при наличии избыточной массы тела. В одном когортном исследовании 270 женщинам с СПКЯ проводили стимуляцию овуляции кломифеном. Спустя 6 мес терапии у пациенток с ИМТ, равным 18—24 кг/м 2 , овуляция наступила почти в 80% случаев, в то время как у пациенток с ИМТ≥35 кг/м 2 — лишь в 12% [11]. Пациенткам с избыточной массой тела для успешной стимуляции также требуются более высокие дозы кломифена [23, 32]. Инсулинорезистентность у пациенток с СПКЯ также приводит к нарушению синтеза прогестерона лютеинизированными клетками гранулезы, что требует обязательной поддержки лютеиновой фазы [19].
При отсутствии реакции яичников на введение кломифена в течение 3 мес терапию следует считать неэффективной, а пациентку — кломифенрезистентной. Резистентность к терапии кломифеном можно прогнозировать при наличии следующих факторов риска: возраст старше 30 лет, ИМТ >25 кг/м 2 , увеличение объема яичников по данным УЗИ >10 мм 2 , уровень ЛГ >15 МЕ, уровень эстрадиола менее 150 пмоль/л [1]. При добавлении метформина к кломифену у резистентных к нему женщин уровень овуляции может увеличиться. В исследовании C. Batukan и соавт. [12] при использовании кломифена у 24 женщин с СПКЯ и ожирением частота овуляции составила 28,2%, а частота наступления беременности — 4,2%. Добавление метформина привело к увеличению этих показателей до 57,9 и 65,2% соответственно. Результаты систематического обзора E. Moll и соавт. [30] подтверждают, что добавление метформина у кломифенрезистентных пациенток с СПКЯ повышает частоту родов живым плодом. Одно из последних рандомизированных исследований (H. Abu Hashim и соавт., [10]) показало, что у кломифенрезистентных женщин эффективность (оцениваемая по частоте наступления беременности) комбинации метформина с кломифена цитратом сопоставима с лапароскопическим дриллингом яичников.
Результаты последнего Кокрановского мета-анализа [37] показали, что использование метформина при СПКЯ в качестве монотерапии и при комбинации с кломифена цитратом повышает частоту овуляции и частоту наступления беременности, но не влияет на частоту родов живым плодом. Авторы метаанализа считают, что для уточнения влияния метформина на частоту родов живым плодом требуется проведение дополнительных крупных проспективных рандомизированных исследований.
При неэффективности непрямой индукции овуляции проводят терапию гонадотропными гормонами. Показано, что индукция овуляции гонадотропинами у пациенток с ожирением требует более высоких доз гонадотропинов [23]. При сочетании ожирения с СПКЯ суммарные дозы гонадотропинов на цикл стимуляции также выше, чем у пациенток с низкой массой тела с СПКЯ [32]. Сопутствующая инсулинорезистентность нарушает яичниковый ответ на стимуляцию с высоким риском развития синдрома гиперстимуляции яичников (СГЯ) и большей частотой отмены цикла [20].
Частота наступления беременности при использовании мочевых и рекомбинантных гонадотропинов сопоставима и равняется 43—45%. Иногда для повышения эффективности стимуляции овуляции у пациенток с ожирением, сопутствующей инсулинорезистентностью и гиперандрогенией, в комбинации с гонадотропинами также используют метформин. Мета-анализ M. Costello и соавт. [14] по назначению метформина во время прямой индукции овуляции у пациенток с СПКЯ показал, что дополнительное назначение метформина при индукции овуляции гонадотропинами не повышает частоту наступления беременности (ОШ=3,46; 95% ДИ: 0,98—12,2). Более поздние исследования (J. Cheng и соавт., [13]) показали, что добавление метформина при прямой индукции овуляции снижает потребность в гонадотропинах и повышает частоту наступления беременности. Для того, чтобы делать окончательные выводы, требуются новые крупные высококачественные исследования и их мета-анализы.
В случае неэффективности вышеуказанных методов лечения, а также при наличии трубного и/или мужского фактора бесплодия методом выбора становятся вспомогательные репродуктивные технологии (ВРТ). Однако программы ВРТ у пациенток с ожирением имеют свои особенности.
Мы изучили эффективность программ ВРТ у пациенток с избыточной массой тела и ожирением в зависимости от типа распределения жировой ткани и наличия метаболических и эндокринных нарушений [6].
Полученные данные согласуются с данными литературы. Так, P. Wass и соавт. [39] показали, что при лечении методом ЭКО у пациенток с андроидным типом распределения жировой ткани частота наступления беременности в 2 раза ниже, чем у пациенток с феминным ожирением. Низкая частота имплантации и, как следствие, более низкая частота наступления беременности у пациенток с метаболическим синдромом и СПКЯ, по-видимому, связаны с влиянием гиперандрогении, гиперинсулинемии и, возможно, гиперлептинемии на ранние этапы имплантации [26, 28].
В основной группе в отличие от контрольной при избыточной массе тела и ожирении отмечалось статистически значимое повышение уровня иммунореактивного инсулина (ИРИ) (в 1,3 раза) и лептина (в 1,4 раза). У пациенток с СГЯ эти показатели увеличились в той же степени, таким образом, уровень ИРИ и лептина в конце стимуляции не отражает риск развития СГЯ. У пациенток с прогрессирующей, замершей беременностью и при отсутствии наступления беременности степень увеличения лептина и ИРИ оказалась такой же. Таким образом, измерение этих показателей в конце стимуляции, с практической точки зрения, смысла не имеет. Однако выявление базальной инсулинорезистентности позволяет сформировать группы риска по ненаступлению беременности и прекращению ее развития (частота инсулинорезистентности, согласно индексу HOMA, у пациенток с прогрессирующей беременностью составила 14,3%, в подгруппе, где беременность не наступила, — 33,3%, а при неразвивающейся беременности — 66,6%, различий по степени гиперинсулинемии выявлено не было).
Для повышения эффективности программ ВРТ у пациенток с инсулинорезистентностью было предложено проводить стимуляцию суперовуляции на фоне сенситайзеров инсулина. Так, P. Fedorcsak и соавт. [18] назначали метформин в дозе 1500 мг/сут за 3 нед до назначения бусерелина на 21-й день цикла и в течение всей стимуляции рекомбинантным ФСГ. При использовании метформина число полученных ооцитов увеличилось на 10%, однако доза гонадотропинов не снижалась. В двух рандомизированных проспективных исследованиях использование метформина до и во время ЭКО/ИКСИ не улучшило параметры индукции суперовуляции, не изменилось число ооцитов, отсутствовало влияние на частоту наступления беременности и самопроизвольных абортов [24, 33]. Однако в рандомизированном исследовании (T. Tang и соавт., [36]), включающем 101 цикл ЭКО/ИКСИ, прием метформина до дня пункции фолликулов значимо улучшил частоту наступления клинической беременности на пункцию (38% против 16%) и на перенос (44% против 20,4%). При этом наблюдалось значимое снижение частоты тяжелого СГЯ (3,8% против 20,4%). Результаты последнего кокрановского метаанализа [38] показали, что дополнительное назначение метформина до и во время программы ЭКО/ИКСИ у пациенток с СПКЯ не повышает частоту родов живым плодом (ОШ=0,77, 95% ДИ: 0,27—2,18) и частоту наступления беременности (ОШ=0,71, 95% ДИ: 0,39—1,28), но снижает риск развития СГЯ (ОШ=0,27, 95% ДИ: 0,16—0,47).
Также изучалось назначение метформина во время беременности. Проспективное рандомизированное контролируемое исследование показало двукратное снижение частоты невынашивания беременности по сравнению с лапароскопическим дриллингом яичников пациенток с ожирением и СПКЯ [34]. Однако два более поздние рандомизированные контролируемые исследования [25, 29] не подтвердили положительного влияния метформина на частоту невынашивания беременности. Одно из последних проспективных плацебо-контролируемых исследований продемонстрировало, что использование метформина (в дозе 1700—3000 мг/сут) у пациенток с СПКЯ и инсулинорезистентностью до и во время беременности (до 37-й недели) позволяет снизить частоту невынашивания беременности, частоту гестационного диабета и гестационной гипертензии [15].
Результаты мета-анализа C. Gilbert и соавт. [21] показали, что использование метформина в I триместре беременности у пациенток с СПКЯ или CД не повышает частоту пороков развития. Тем не менее назначение метформина во время беременности в рутинной клинической практике пока не рекомендуется до получения окончательных результатов.
Таким образом, терапия бесплодия у пациенток с ожирением представляет определенные трудности и требует индивидуального подхода. С каждым годом появляются новые исследования и мета-анализы, позволяющие принимать взвешенное решение и проводить эффективное и безопасное лечение у таких пациенток.
Московский областной НИИ акушерства и гинекологии;
кафедра акушерства и гинекологии ФУВ МОНИКИ им. М.Ф. Владимирского
Московский областной НИИ акушерства и гинекологии
Новые подходы к индукции овуляции у резистентных к кломифену пациенток при реализации программ, рассчитанных на восстановление естественной фертильности
Журнал: Российский вестник акушера-гинеколога. 2010;10(6): 45‑49
Краснопольская К.В., Кабанова Д.И., Слесаренко О.Ю. Новые подходы к индукции овуляции у резистентных к кломифену пациенток при реализации программ, рассчитанных на восстановление естественной фертильности. Российский вестник акушера-гинеколога. 2010;10(6):45‑49.
Krasnopol'skaia KV, Kabanova DI, Slesarenko OIu. New approaches to inducing ovulation in clomiphene-resistant patients in the implementation of natural fertility recovery programs. Russian Bulletin of Obstetrician-Gynecologist. 2010;10(6):45‑49. (In Russ.).
Проведена контролируемая стимуляция овуляции у 48 больных с ановуляторным бесплодием, обусловленным гипоталамо-гипофизарной дисфункцией, в первой попытке кломифенцитратом; при раннем выявлении признаков резистентности к кломифену в этом же цикле были применены препараты рекомбинантного ФСГ (рФСГ); в отсутствие эффекта был использован повышающий ("step up") протокол с применением низких начальных доз рФСГ во второй и третьей попытках. У 12 пациенток с гипоталамо-гипофизарной недостаточностью был использован только "традиционный" протокол индукции овуляции с применением менотропинов. Представлены новые данные о терапевтической эффективности, безопасности и экономической целесообразности последовательного использования комбинации рФСГ с кломифенцитратом и низкодозового повышающего "step up"-протокола с рФСГ, позволяющие рассматривать эти две схемы как оправданную альтернативу протоколу с традиционной дозировкой гонадотропинов, назначаемому резистентным к кломифену пациенткам в повторных циклах индукции овуляции.
Согласно современным представлениям, при реализации программ, ставящих целью восстановление естественной фертильности (ВЕФ) при лечении ановуляторного (эндокринного) бесплодия, центральное место занимают индукторы овуляции. Применение кломифенцитрата (КЦ) с целью стимуляции овуляции является наименее затратным, достаточно простым и относительно безопасным (по критерию угрозы развития синдрома гиперстимуляции яичников - СГЯ) методом у пациенток с ановуляторным бесплодием без признаков гипоталамо-гипофизарной и яичниковой недостаточности (при базальном уровне фолликулостимулирующего гормона - ФСГ в интервале от 3 до 12 МЕ и Е2 > 100 пмоль/л) [2, 3]. Однако одним из недостатков КЦ как индуктора овуляции является резистентность к кломифену, т.е. отсутствие ответа яичников [4, 10].
Следует отметить, что наличие резистентности к КЦ принято констатировать в отсутствие доминантного фолликула при УЗИ, проводимом через 5-6 дней после последнего приема КЦ, на основании чего рекомендуется использование препаратов гонадотропинов (ГТ), назначение которых возможно не ранее следующего цикла индукции овуляции [3, 10]. Однако на практике ультразвуковые признаки отсутствия эффекта от применения КЦ можно наблюдать в более ранние сроки (через 1-3 дня после отмены приема КЦ), что позволяет сразу же перейти к применению ГТ, т.е. в том же «стартовом» цикле, в котором назначается КЦ. Весьма вероятно, что такое последовательное использование КЦ и ГТ (комбинация КЦ+рекомбинантного ФСГ - рФСГ) в одном и том же «стартовом» протоколе может повысить эффективность первой попытки индукции овуляции, что позволит избежать повторной стимуляции ГТ, при которой прогнозируемый расход препаратов ФСГ превышает то их количество, которое может быть использовано в «стартовом» протоколе. В случае неэффективности данной схемы стимуляции целесообразно переходить к использованию ГТ. Вопрос о наиболее эффективной и безопасной схеме применения ГТ с целью ВЕФ остается открытым.
По данным ряда авторов, использование в циклах внутриматочной инсеминации спермой мужа «step up»-протокола, включающего низкие стартовые дозы ГТ, является, с одной стороны, наиболее безопасным с учетом критериев риска развития СГЯ и многоплодия, а, с другой стороны, наиболее экономичным (за счет снижения курсовой дозы гонадотропинов) по сравнению как с «классической» схемой применения ГТ, так и со «step down»-протоколом [1, 5-9]. С учетом указанных преимуществ «step up»-протокола с применением ГТ представляется целесообразным его назначение и у резистентных к кломифену больных при реализации программ ВЕФ.
Исходя из изложенного, целью настоящего исследования стала оценка клинической эффективности в программах ВЕФ последовательного применения комбинации КЦ+рФСГ и «step up»-протокола с низкими стартовыми дозами ГТ у резистентных к кломифену пациенток с ановуляторным бесплодием без признаков гипоталамо-гипофизарной недостаточности.
Материал и методы исследования
В исследование были включены 60 пациенток с ановуляторным бесплодием в возрасте моложе 38 лет, которые были разделены на 2 группы с учетом наличия признаков либо гипоталамо-гипофизарной дисфункции (ГГД), либо гипоталамо-гипофизарной недостаточности (ГГН), определявших выбор протокола индуцируемого фолликулогенеза.
В группе А, включавшей 48 больных с ГГД (ФСГ в интервале от 3 до 12 МЕ и Е2>100 пмоль/л), выполняли две серии контролируемой стимуляции овуляции (КСО), которые назначали до- и после лечебно-диагностической гистеро- и лапароскопии.
При проведении первой серии КСО в первой попытке индукции овуляции всем больным группы А назначали КЦ в течение 5 дней (со 2-3-го по 6-7-й день цикла) в дозе 100 мг/сут. При раннем выявлении признаков резистентности к кломифену продолжали стимуляцию препаратами рФСГ (фоллитропин-β и фоллитропин-α) в этом же цикле. Во второй и третьей попытках стимуляции яичников у женщин с подтвержденной в «стартовом» протоколе резистентностью к комбинации КЦ+рФСГ использовали повышающий («step up») протокол с применением низких начальных доз рФСГ.
Сохранение бесплодия после первой серии КСО являлось показанием к лечебно-диагностической лапароскопии и гистероскопии, после чего вновь выполняли не менее трех стимуляций (вторая серия КСО) в соответствии с алгоритмом, который применяли и до использования эндоскопических лечебных процедур. В отсутствие беременности в результате повторной серии КСО пациенткам группы А рекомендовали продолжение лечения с применением экстракорпорального оплодотворения (ЭКО).
Ранним признаком резистентности к кломифену, служившим обоснованием для назначения рФСГ в «стартовом» цикле с КЦ, мы считали отсутствие хотя бы одного фолликула диаметром более 9 мм на 1-й день после отмены КЦ или прирост диаметра лидирующего фолликула в периоде между 1-м и 3-м днями после отмены КЦ менее 2 мм.
У пациенток, резистентных к лечению описанной комбинацией КЦ+рФСГ, во всех последующих циклах при выполнении первой и второй серий КСО применяли низкодозовый повышающий «step up»-протокол с рФСГ со следующими параметрами:
- начальная доза рФСГ 50-75 МЕ;
- продолжительность одного «шага» 7 сут,
- число «шагов» не более 3;
- «шаговые подъемы» суточной дозы рФСГ - сначала 1,5- и затем 2-кратное увеличение начальной дозы («шаговые подъемы» применяемой дозы рФСГ проводили только в случаях констатации недостаточного стимулирующего эффекта исходной дозировки препарата, применявшейся не менее 1 нед).
При сопоставлении результатов лечения с применявшимися протоколами контролируемой стимуляции учитывали частоту наступления маточной беременности (ЧНБ), параметры индуцируемого фолликулогенеза (среднее число созревающих фолликулов и % монофолликулярного ответа), среднюю курсовую дозу ФСГ (в протоколах с применением ГТ), частоту развития синдрома гиперстимуляции яичников (СГЯ), эктопической беременности (ЭБ) и многоплодия.
Полученные данные обрабатывали статистически с использованием компьютерной программы «Биостат».
Результаты исследования и обсуждение
Особого внимания заслуживают результаты, характеризующие терапевтическую эффективность применения комбинации КЦ+рФСГ и низкодозового протокола с рФСГ в режиме «step up», использовавшихся у резистентных к кломифену пациенток без признаков ГГН. Проведенное исследование позволило установить, что применение комбинации КЦ+рФСГ в первой попытке КСО у 12 пациенток с ранними УЗ-признаками резистентности к кломифену обеспечило адекватный фолликулогенез у 10 (83,3%) и наступление беременности у 4 (33,3%) из этих больных (см. табл. 1). Данные наблюдения подтверждают возможность обеспечения адекватного фолликулогенеза (и соответственно наступления беременности) у пациенток с низкой чувствительностью к КЦ путем дополнительного назначения рФСГ уже в первом стимулированном цикле.
Низкодозовый протокол с рФСГ в режиме «steр up», применявшийся у 8 резистентных к кломифену пациенток, начиная со второй попытки индукции овуляции (в первой попытке КСО у этих лиц использовалась комбинация КЦ+рФСГ), обеспечил достаточно высокую терапевтическую эффективность по критериям ЧНБ на СЦ (14,8%) и ЧНБ на пациентку (50%). Эти результаты подтверждают возможность успешного преодоления ановуляторного бесплодия у не менее 50% резистентных к кломифену больных, сохраняющих инфертильность даже после использования комбинации КЦ+рФСГ.
Таким образом, из полученных результатов следует, что последовательное использование комбинации КЦ+рФСГ (в 1-й попытке КСО) и низкодозового протокола с рФСГ в режиме «step up» (во всех последующих попытках КСО) обеспечило наступление беременности у 2 /3 резистентных к кломифену больных (у 8 из 12 пациенток, не чувствительных к КЦ). Эти данные позволяют заключить, что комбинация КЦ+рФСГ и низкодозовый протокол с рФСГ в режиме «step up» имеют очевидное показание к использованию в клинических ситуациях, свидетельствующих об отсутствия стимулирующего эффекта КЦ у больных с ановуляторным бесплодием без признаков ГГН.
У 12 больных с эндокринным бесплодием на фоне ГГН при всех попытках индукции овуляции был использован только традиционный протокол с менотропинами, т.е. с препаратами, содержащими ФСГ и ЛГ, начальная доза которых зависела от степени снижения Е2. Результаты применения данного протокола характеризовались достаточно высокой терапевтической эффективностью (ЧНБ на пациентку = 41,7%, ЧНБ на СЦ = 10,9%), достоверно превосходившей показатели терапевтической эффективности использования протокола с КЦ у больных без признаков ГГН (см. табл. 2). Из полученных результатов также следует, что применение менотропинов при эндокринном бесплодии на фоне ГГН обеспечивает эффект, вполне сопоставимый с таковым при использовании протоколов с рФСГ (в комбинации с КЦ и в режиме «step up») у больных с ановуляторным бесплодием без признаков ГГН. Эти данные указывают на то, что по сравнению со схемой, предусматривающей применение только КЦ, любые протоколы с ГТ обладают несопоставимо бо`льшим терапевтическим потенциалом при индукции овуляции, причем не зависящим от наличия или отсутствия признаков ГГН.
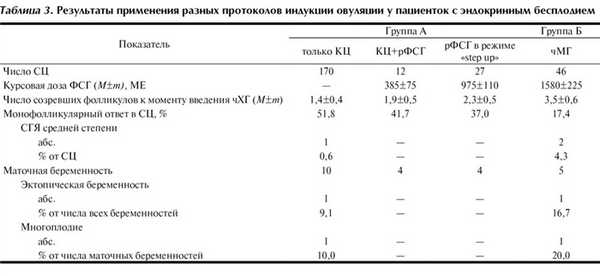
При оценке параметров стимулированных циклов было установлено (табл. 3), что протоколы, предусматривавшие применение комбинации КЦ - КЦ+рФСГ и рФСГ в режиме «step up», обеспечивали индукцию овуляции, более приближающейся к физиологическим процессам по сравнению с таковой при использовании схемы с чМГ. Это выражалось в том, что при применении первых трех протоколов отмечалось в 1,5-2,5 раза меньшее среднее число зрелых фолликулов к моменту введения триггера овуляции чХГ: 1,4±0,4 (в циклах с КЦ), 1,9±0,5 (в циклах с КЦ+рФСГ) и 2,3±0,5 (в циклах с рФСГ в режиме «step up») против 3,5±0,6 в циклах с чМГ (р<0,05). Следствием «менее агрессивного» стимулирующего воздействия на фолликулогенез первых трех протоколов было и то, что на фоне их применения частота монофолликулярного ответа была в 2-3 раза выше (соответственно 51,8, 41,7 и 37,0%), чем при использовании «традиционной» схемы с чМГ (17,4%).
Такие осложнения, как среднетяжелый СГЯ, многоплодная и ЭБ встречались в единичных случаях.
Заслуживает внимания, что схемы, предусматривавшие использование комбинации КЦ+рФСГ и применение ФСГ в режиме «step up», обеспечивали существенное снижение курсовой дозы ФСГ (соответственно 385±75 и 975±110 МЕ; р<0,05) по сравнению с количеством ГТ, расходуемых в «традиционном» протоколе с чМГ (1580±225 МЕ).
Перечисленные факты позволяют заключить, что протоколы индукции овуляции с использованием комбинации КЦ+рФСГ и рФСГ в режиме «step up» по критериям физиологичности и безопасности заметно превосходят «традиционный» протокол с чМГ и при этом позволяют обеспечить существенное (2-3-кратное) снижение расходуемой курсовой дозы ГТ. Последнее имеет очевидное позитивное значение для снижения общей затратности программ ВЕФ при лечении пациенток с ановуляторным бесплодием, поскольку в тактике ведения таких больных приходится достаточно часто (при констатации резистентности к кломифену) использовать дорогие препараты ГТ.
Отдельно следует подчеркнуть, что наша рекомендация о целесообразности применения для индукции овуляции у резистентных к кломифену пациенток комбинации КЦ+рФСГ и рФСГ в режиме «step up» распространяется только на больных с ановуляторным бесплодием без признаков ГГН (ФСГ не менее 3 МЕ/л, Е2>100 пмоль/л) и без повышения уровня ФСГ (ФСГ не более 12 МЕ/л). У женщин с признаками ГГН (с аномально низким уровнем ФСГ) или с вероятным ограничением овариального резерва (отражаемым аномально высокими уровнями ФСГ), по мнению многих специалистов [3, 10] и нашему убеждению, протоколы стимуляции должны быть более «агрессивными». Такая «агрессивность» подразумевает применение высокой начальной дозы ГТ (150-300 МЕ) и ее незамедлительное увеличение в отсутствие адекватного ответа, отслеживаемого в процессе ежедневных мониторинговых оценок активности индуцируемого фолликулогенеза. Это означает, что назначение пациенткам с ГГН или с ограниченным овариальным резервом КЦ и «мягко действующих» схем с ГТ в виде комбинации КЦ+рФСГ или низкодозового «step up»-протокола с рФСГ не имеет никакого логического обоснования и не должно использоваться на практике.
Однако надо отметить, что, по нашим наблюдениям, среди лиц с ановуляторным бесплодием, включаемых в программы ВЕФ, преобладают (составляют 4 /5) пациентки с уровнем ФСГ в интервале от 3 до 12 МЕ, т.е. больные без признаков как ГГН, так и яичниковой недостаточности. Это указывает на потенциально высокую востребованность применявшихся в нашей работе двух «мягких» низкодозовых схем с рФСГ, которые могут быть с успехом использованы именно у такого контингента больных во всех случаях констатации резистентности к кломифену вместо более агрессивной (и более затратной) «традиционной» схемы с гонадотропинами.
Выводы
1. Последовательное использование комбинации КЦ+рФСГ и протокола с рФСГ в низкодозовом повышающем «step-up»-режиме обеспечивает наступление беременности у 2 /3 резистентных к кломифену пациенток, что позволяет рассматривать эти схемы как оправданную альтернативу «традиционному» протоколу с общепринятой начальной дозой ГТ, широко используемому в повторных циклах индукции овуляции после подтверждения нечувствительности к КЦ.
2. Применение для индукции овуляции у резистентных к кломифену пациенток вместо «традиционного» протокола с ГТ новых схем, предусматривающих комбинирование КЦ с рФСГ и назначение рФСГ в повышающем режимe, обеспечивает 2-3-кратное снижение необходимой курсовой дозы ФСГ и в 2-3 раза увеличивает частоту монофолликулярного ответа. Указанные эффекты применявшихся протоколов индуцируемого фолликулогенеза способствуют существенному снижению затратности этапа контролируемой стимуляции, а также уменьшают риск развития СГЯ и многоплодной беременности.
ФГУ Эндокринологический научный центр, Москва
Лечение олигоспермии у мужчин с бесплодием
Журнал: Проблемы эндокринологии. 2010;56(1): 31‑34
Роживанов Р.В., Парфенова Н.С., Курбатов Д.Г. Лечение олигоспермии у мужчин с бесплодием. Проблемы эндокринологии. 2010;56(1):31‑34.
Rozhivanov RV, Parfenova NS, Kurbatov DG. Treatment of oligospermia in male infertility. Problemy Endokrinologii. 2010;56(1):31‑34. (In Russ.).
С целью оценки эффективности гормональной стимуляционной терапии у бесплодных мужчин с олигозооспермией были обследованы 22 пациента, получающих терапию кломифена цитратом или хорионическим гонадотропином в течение 3 мес. У всех пациентов лечение привело к статистически значимому увеличению секреции тестостерона. В группе кломифена цитрата выявлено статистически значимое увеличение количества сперматозоидов в 1 мл эякулята и процента их морфологически нормальных форм. Отмечалось статистически незначимое увеличение подвижности А+В. У половых партнерш 2 пациентов наступила беременность. В группе гонадотропина были выявлены статистически значимое увеличение количества сперматозоидов в 1 мл эякулята, а также статистически незначимое увеличение процента их морфологически нормальных форм. Увеличения подвижности А+В выявлено не было. У партнерши одного пациента наступила беременность. В обеих группах у пациентов с азооспермией сперматозоиды в эякуляте не появились. Таким образом, оба вида терапии являются эффективными в плане увеличения количества сперматозоидов. Терапия кломифена цитратом увеличивает число их морфологически нормальных форм. Оба вида терапии при азооспермии неэффективны. Нормализация уровня общего тестостерона является дополнительным преимуществом терапии.
По многочисленным данным литературы, концентрация сперматозоидов в эякуляте здоровых мужчин, проживающих в технологически развитых странах, в течение последних 50 лет постоянно снижалась. Это привело к тому, что нижняя граница нормы содержания сперматозоидов по рекомендациям ВОЗ была уменьшена с 40 до 20 млн/мл [1]. При этом распространенность мужского бесплодия в настоящее время в различных регионах мира прогрессивно увеличивается. В Российской Федерации на долю мужского фактора отводится от 15 до 30% случаев бесплодных браков [2]. При этом в большинстве случаев мужское бесплодие связано со снижением количества и качества сперматозоидов.
В связи с перечисленным часто возникает вопрос о необходимости применения методов лечения, направленных на увеличение количества сперматозоидов в эякуляте, в том числе гормональной стимулирующей терапии. Однако данные об ее эффективности противоречивы [3—6], поэтому нами было предпринято исследование, целью которого являлась оценка эффективности применения у мужчин с олигозооспермией и бесплодием двух препаратов, используемых для стимуляции сперматогенеза: антиэстрогена — кломифена цитрата, и хорионического гонадотропина.
Материал и методы
В проспективное пилотное несравнительное исследование были включены 22 бесплодных мужчин с олиго-/азооспермией (концентрация сперматозоидов ≤20 млн/мл) в сочетании с нормальными или пониженными уровнями лютеинизирующего и фолликулостимулирующего гормонов. Критериями исключения пациентов из исследования являлись сахарный диабет, гипотиреоз, тиреотоксикоз, гиперкортицизм, гиперпролактинемия, опухоли, острые или хронические заболевания печени, обтурационные формы бесплодия, генетически обусловленное бесплодие, наличие урологических и/или инфекционно-воспалительных заболеваний в стадии обострения, варикоцеле, прием других гормональных препаратов, заболевания почек с почечной недостаточностью, тромбозы в анамнезе и/или повышенная свертываемость крови, а также воздействие профессиональных и/или бытовых токсичных факторов.
В группе кломифена (12 пациентов в возрасте 34 (30; 39) лет) был назначен кломифена цитрат ежедневно перорально в дозе 50 мг на период 3 мес. У 5 пациентов этой группы до терапии был выявлен гипогонадизм (уровень общего тестостерона менее 11,0 нмоль/л).
В группе гонадотропина (10 мужчин в возрасте 32 (30; 34) лет) был назначен хорионический гонадотропин внутримышечно 1 раз в 3 дня на период 3 мес. Доза препарата считалась адекватной при повышении уровня общего тестостерона до нормы и/или на 50% от исходных значений после 3—5 инъекций препарата и составляла от 1000 до 2000 ЕД на одну инъекцию. У 6 пациентов этой группы также на момент начала исследования был выявлен гипогонадизм. Следует отметить, что у 2 из них олигоспермия и гипогонадизм были обусловлены хирургическим лечением соматотропиномы и гормонально неактивной аденомы гипофиза, причем давность развития гипогонадизма не превышала 1 года.
В процессе исследования в динамике проводили определение концентрации общего тестостерона. Уровни тестостерона (норма 11,0—33,0 нмоль/л) определяли на автоматическом хемилюминесцентном анализаторе Vitros ECi (Johnson and Johnson, Великобритания) методом усиленной хемилюминесценции. Сперматологическую диагностику осуществляли в соответствии с рекомендациями ВОЗ (2001) [1].
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica (StatSoft Inc. США, версия 6.0). Сравнение зависимых групп по количественным признакам осуществляли непараметрическим методом с использованием критерия Вилкоксона. Статистически значимыми считали различия при p
Результаты и обсуждение
У всех пациентов, включенных в исследование, лечение привело к статистически значимому увеличению уровня тестостерона (см. таблицу).
У 4 гипогонадных пациентов группы кломифена и у всех гипогонадных пациентов группы гонадотропина лечение привело к полной коррекции гипогонадизма.
В группе кломифена у 10 пациентов с олигозооспермией отмечалось улучшение основных параметров сперматогенеза. Было выявлено статистически значимое увеличение количества сперматозоидов в 1 мл эякулята с 13,8 (2,7; 17,0) до 34,7 (20,0; 67,5) млн, р=0,005 (рис. 1) Рисунок 1. Количество сперматозоидов в 1 мл эякулята, млн (3 мес терапии). и числа их морфологически нормальных форм от 1,5% (0,0; 10,0) до 5,2% (3,0; 14,0); р=0,012 (рис. 2). Рисунок 2. Количество морфологически нормальных форм, % (3 мес терапии). Кроме того, отмечалось увеличение подвижности А+В от 9,5% (2,0;18,4) до лечения до 15,0% (7,5;19,0) на фоне терапии, однако данное увеличение не было статистически значимым, р=0,052 (рис. 3). Рисунок 3. Количество подвижных сперматозоидов А+В, % (3 мес терапии).
У 2 пациентов с азооспермией, несмотря на улучшение гормонального профиля, сперматозоиды в эякуляте не появились.
У 8 из 12 пациентов на фоне терапии кломифена цитратом олигозооспермия была устранена. У партнерш 2 пациентов наступила беременность.
В группе гонадотропина у 8 пациентов также отмечалось улучшение некоторых параметров сперматогенеза. Так, было выявлено статистически значимое увеличение количества сперматозоидов в 1 мл эякулята от 1,8 (0;20,0) до 7,3 (0,15;33,0) млн; р=0,049 (рис. 4), Рисунок 4. Количество сперматозоидов в 1 мл эякулята, млн (3 мес терапии). а также отмечалось небольшое увеличение числа их морфологически нормальных форм от 0 (0,0;1,0) до 1,5% (0;8,0), но это увеличение не являлось статистически значимым, р=0,09 (рис. 5). Рисунок 5. Количество морфологически нормальных форм, % (3 мес терапии). Однако увеличения подвижности А+В на фоне терапии выявлено не было (рис. 6). Рисунок 6. Количество подвижных сперматозоидов А+В, % (3 мес терапии).
У одного пациента с олигоспермией, несмотря на устранение гипогонадизма, произошло ухудшение показателей спермограммы. Так, показатели количества сперматозоидов в 1 мл эякулята, их морфологически нормальных форм и подвижности А+В у этого пациента составили до терапии 14,3, 2 и 3,5% соответственно, а на фоне терапии — 1,5%, 0 и 0. Еще у одного пациента с тяжелой олигоспермией показатели спермограммы не изменились.
У 4 из 10 пациентов на фоне терапии хорионическим гонадотропином олигозооспермия была устранена. У партнерши одного пациента наступила беременность.
В процессе исследования не было отмечено значимых побочных эффектов препаратов, никто из пациентов из исследования не выбыл.
1. Терапия как кломифена цитратом, так и хорионическим гонадотропином является эффективной в плане увеличения количества сперматозоидов у ряда пациентов с олигоспермией при нормальной или сниженной продукции лютеинизирующего и фолликулостимулирующего гормонов. Оба вида терапии при азооспермии неэффективны в связи с исходной выраженностью нарушения сперматогенеза.
2. Терапия кломифена цитратом увеличивает число морфологически нормальных форм сперматозоидов.
3. Отсутствие выраженного влияния стимуляционной терапии на подвижность и морфологию сперматозоидов может объясняться многофакторностью патогенеза астенотератозооспермии, что обусловливает необходимость тщательного дополнительного обследования пациентов и дальнейшего пристального наблюдения за ними.
4. Ввиду небольшого объема выборки достоверно судить об эффективности стимуляционной терапии в плане увеличения способности к зачатию не представляется возможным, поэтому необходимы дальнейшие исследования.
5. Нормализация уровня общего тестостерона у пациентов с гипогонадизмом является дополнительным преимуществом стимуляционной терапии.
Эффективность лечения кломифеном
Применение стандартной минимальной дозы кломифена в первом цикле лечения всем больным следует рассматривать как функциональную пробу. Отсутствие реакции (монофазная базальная температура, плохо выраженный симптом зрачка и низкие показатели цервикального числа) в течение 30 дней после отмены кломифена у больных с ановуляцией нужно расценивать как сниженную чувствительность к препарату.
Оптимальным для оценки эффективности первого курса лечения кломифеном (кломифеновая проба) является определение концентрации эстрогенов и гонадотропинов в плазме. Эти показатели позволяют дифференцированно изменить реакцию отдельных звеньев ГГЯС (гипоталамо-гипофизарно-яичниковая система).
Однако в широкой клинической практике применение таких видов оценки затруднительно и для пациенток, и для врачей, поэтому большое значение приобретает оценка биологической эффективности препарата по данным, характеризующим общее состояние больной: показателям цервикального числа на 5-10-й день цикла после отмены препарата (кломифена), продолжительности гипертермической фазы базальной температуры и времени появления менструально-подобной реакции.
Отсутствие или недостаточная эффективность лечения кломифеном в первом цикле приема препарата служит показанием к увеличению дозы в следующем цикле лечения. Во втором цикле лечения общая доза кломифена составляет 500 мг (5 дней по 100 мг). Препарат также назначают с 5-го спонтанного или "наведенного" гестагенами либо комбинированными препаратами цикла.
В случаях удовлетворительных показатели цервикального числа, достаточной продолжительности гипертермической фазы (не менее 12 дней), отсутствия беременности, но наступления менструально-подобной реакции в первом цикле приема кломифена второй цикл повторяют в той же дозе, что и первый.
Неудовлетворительные показатели или отсутствие эффекта во втором цикле свидетельствуют о недостаточной реакции ГГЯС и указывают на необходимость применения 750 мг кломифена в третьем цикле терапии.
Если и после этого реакция недостаточна или отсутствует, то лечения кломифеном следует повторить в течение следующих трех циклов в той же дозе 750 мг (по 3 таблетки в день с 5-го по 9-й день цикла).
В случае отсутствия эффекта после шести циклов лечения терапия должна быть отменена ввиду неэффективности кломифена у данной пациентки.
Отсутствие эффекта от лечения кломифеном может быть связано с недостаточной концентрацией эстрогенов в организме и сниженной чувствительностью ГГС к антиэстрогенному действию кломифена. Отсутствие реакции может быть также обусловлено недостаточно точной диагностикой, например если не исключена гиперпролактинемия, недостаточность яичников или стертые формы дисфункции щитовидной железы и надпочечников.
Одной из причин отсутствия стимулирующего действия кломифена может быть хронический воспалительный процесс в половых органах в подострой стадии, когда распознавание его затруднено вследствие отсутствия клинических проявлений заболевания, нормальной картины крови и нормальной температуры тела.
Как и все другие виды гормональной терапии, пробный курс лечения кломифеном является одновременно методом уточнения диагноза. Неэффективность терапии может быть расценена как один из признаков неточности диагноза.
Т. Пшeничникoвa
"Эффективность лечения кломифеном" и другие статьи из раздела Бесплодие в браке
Читайте также:
- Аномалия диска зрительного нерва типа утреннего сияния
- Влияние ротового дыхания на челюсти. Зубочелюстной аппарат при ротовом дыхании
- Сосудистые звездочки (телеангиэктазии): причины, симптомы и лечение
- Компьютерная томография (КТ) костей. Диагностические возможности
- Этапы и техника удаления лимфоузла на шее
