Источники гемопоэтических стволовых клеток - периферическая кровь (ПСКК)
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Как проходит заготовка кроветворных стволовых клеток
Трансплантация ГСК - это вид лечения, который применяют, когда ни лекарства, ни операции, ни «химия», ни лучевая терапия не дают возможности добиться полного излечения.
Костный мозг - это не какая-то страшная субстанция, для извлечения кото-рой надо дробить кости.
Смысл проведения трансплантации ГСК заключается в том, чтобы собственное кроветворение больного было полностью заменено донорским.
Для трансплантации ценен не сам по себе костный мозг, а гемопоэтические стволовые клетки крови (клетки - предшественницы кроветворения), содержащиеся в нем. Эти клетки в небольшом количестве имеются и в периферической крови. Поэтому забор этих клеток может производиться двумя путями - непосредственно из костного мозга или из периферической крови. Примерно за 2 недели перед донацией ГСК донор проходит полное медицинское обследование.
Традиционным источником ГСК для трансплантации является костный мозг. Он используется в этих целях уже более 30 лет. Заготовка костного мозга (аспирация) выполняется под общей анестезией, хотя возможно применение перидурального обезболивания. Костный мозг берут из тазовых костей специальными иглами с широким просветом. Количество забираемого костного мозга зависит от веса пациента, обычно это количество определяют из расчета 14 мл костномозговой взвеси на 1 кг веса пациента. Но это не костный мозг в чистом виде, а его смесь с кровью. Взятие костного мозга длится около 1,5-2 часов, забирают при этом не более 5% от общего объема костного мозга донора. Такого количества вполне хватает, чтобы обеспечить кроветворение пациента на всю жизнь.
Сама потеря костного мозга при этом донором не ощущается, и его объём полностью компенсируется в течение двух недель. Незначительно снижается уровень гемоглобина в крови, но и он полностью восстанавливается за полторы - две недели. Почти всегда в первые два-три дня после взятия костного мозга донор испытывает болевые ощущения в тазовых костях, которые легко проходят под действием обычных обезболивающих препаратов. Кроме того, донор может испытывать неприятные ощущения после наркоза, такие как подташнивание, сонливость, слабость. Как правило, вечером в день операции донор может уйти из клиники домой.
Если источником гемопоэтических стволовых клеток служит периферическая кровь, донору приходится проходить пятидневный подготовительный период. В течение пяти дней подкожно вводится специальный препарат, стимулирующий выход стволовых гемопоэтических клеток в кровоток. На четвертый и пятый день донор проходит процедуру афереза, длящуюся по 3 - 5 часов в день, в зависимости от количества стволовых клеток, которое необходимо получить. Во время этой процедуры кровь откачивается специальным насосом из локтевой вены, проходит через специальный аппарат - клеточный сепаратор, и возвращается донору. Во время каждого прохождения через аппарат отбирается только небольшое стволовых клеток, поэтому таких циклов совершается очень много. Всего за процедуру через сепаратор проходит 10 - 15 литров крови, из которых в аппарате остается всего 150-250 мл. Остальные компоненты крови возвращаются донору.
При подготовке к аферезу самыми частыми побочным явлениям являются ломота и боли в костях, возникающие примерно у половины доноров в период стимуляции. Ростовые факторы стимулируют деление клеток в костном мозге, костный мозг увеличивается в объеме и давит изнутри на кости - отсюда и неприятные ощущения. Еще одно возможное последствие - незначительная потеря тромбоцитов во время процедуры афереза. Часть тромбоцитов просто отбирается сепаратором вместе с гемопоэтическими клетками. Возможны также обострения аутоиммунных заболеваний. Поэтому люди, страдающие аутоиммунными болезнями (ревматоидным артритом, системной красной волчанкой, псориазом) не допускаются до этого вида донорства.

Донор после консультации с медиком может сам выбрать, каким способом у него возьмут гемопоэтические клетки.
Трансплантация костного мозга и стволовых клеток периферической крови
Костный мозг - это мягкое губчатое вещество, находящееся внутри костей. Костный мозг содержит незрелые клетки, которые называются гемопоэтическими или кровеобразующими стволовыми клетками. Гемопоэтические стволовые клетки отличаются от эмбриональных стволовых клеток. Эмбриональные стволовые клетки могут давать начало любым клеткам организма, а гемопоэтические стволовые клетки - только клеткам крови.
Гемопоэтические стволовые клетки способны делиться или дифференцироваться в один из трех видов клеток крови: лейкоциты, защищающие организм от инфекций; эритроциты, доставляющие клеткам организма кислород; или тромбоциты, принимающие участие в свертывании крови. Основная часть гемопоэтических стволовых клеток находится в костном мозге, но некоторые клетки, которые называются стволовыми клетками периферической крови, находятся в кровяном русле. Кроме того, гемопоэтические стволовые клетки содержатся в пуповинной крови. Для трансплантации можно использовать клетки из всех этих источников.
Что такое трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови - это процедуры, с помощью которых в организме пациента восстанавливают стволовые клетки, разрушенные высокими дозами химиотерапии и/или лучевой терапии. Существует три вида трансплантации:
- При аутогенной трансплантации пациенту пересаживают его собственные стволовые клетки
- При сингенной трансплантации пациенту пересаживают стволовые клетки, взятые у однояйцового близнеца
- При аллогенной трансплантации пациенту пересаживают стволовые клетки, взятые у его брата, сестры или родителей. Кроме того, возможно использование стволовых клеток человека, не являющегося родственником пациента (неродственный донор).
Зачем при лечении рака применяется трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови применяются в лечении рака, потому что это дает возможность использовать высокие дозы химиотерапии и/или лучевой терапии. Чтобы лучше понять, зачем при лечении рака используют трансплантацию костного мозга и трансплантацию стволовых клеток периферической крови, нужно иметь представление о том, как действуют химиотерапия и лучевая терапия.
Химиотерапия и лучевая терапия в основном воздействуют на клетки, которые быстро делятся. Эти методы используются для лечения рака, потому что раковые клетки делятся чаще, чем большинство здоровых клеток. Но так как клетки костного мозга тоже часто делятся, высокие дозы химиопрепаратов и лучевой терапии могут серьезно повредить или вообще разрушить костный мозг пациента. А без здорового костного мозга организм не способен вырабатывать клетки крови, необходимые для доставки кислорода, защиты от инфекций и предотвращения кровотечений. При трансплантации костного мозга и трансплантации стволовых клеток периферической крови стволовые клетки крови пациента, разрушенные в процессе лечения, замещаются здоровыми. Таким образом, пересадка здоровых стволовых клеток позволяет восстановить способность костного мозга вырабатывать клетки крови, необходимые пациенту.
При некоторых формах лейкоза основным фактором, определяющим эффективность лечения, становится реакция «трансплантат против опухоли», которая развивается после аллогенной трансплантации костного мозга и стволовых клеток периферической крови. Это осложнение возникает, когда лейкоциты донора (трансплантат) признают раковые клетки, которые остаются в организме пациента после химиотерапии и/или лучевой терапии (опухоль) чужими и начинают их атаковать. (Это осложнение аллогенной трансплантации, которое называется «трансплантат против хозяина»).
При каких видах рака применяется трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови чаще всего применяются для лечения лейкоза и лимфомы. Причем, они наиболее эффективны, когда лейкоз или лимфома находятся в стадии ремиссии (симптомы рака отсутствуют). Кроме того, трансплантация костного мозга и трансплантация стволовых клеток периферической крови применяются при лечении других видов рака, таких как нейробластома (этот вид рак возникает в незрелых нервных клетках и чаще всего поражает младенцев и детей) и множественная миелома. Проводятся клинические исследования для изучения эффективности трансплантации костного мозга и трансплантации стволовых клеток периферической крови при лечении других типов рака.
Как подбираются донорские стволовые клетки при аллогенной и сингенной трансплантации?
Чтобы свести к минимуму возможные побочные эффекты, врачи стремятся использовать для трансплантации стволовые клетки, как можно более совместимые с собственными стволовыми клетками пациента. У каждого человека на поверхности клеток имеется индивидуальный набор белков - антигены тканевой совместимости (синоним - антигены главного комплекса гистосовместимости, или HLA-антигены). Этот набор белков можно определить с помощью специального анализа крови.

В большинстве случаев успех аллогенной трансплантации зависит от того, насколько HLA-антигены стволовых клеток донора совместимы с HLA-антигенами стволовых клеток пациента. Чем больше совместимых HLA-антигенов, тем больше вероятность, что организм пациента не отторгнет пересаженные стволовые клетки донора. Если стволовые клетки пациента и донора хорошо совместимы, у пациентов реже развивается осложнение, известное как реакция «трансплантат против хозяина».
Вероятность совместимости с пациентом по HLA-антигенам гораздо выше у близких родственников, особенно у братьев и сестер. Но HLA-совместимые брат или сестра имеются только у 25 - 35% пациентов. Шанс получить HLA-совместимые стволовые клетки от неродственного донора несколько выше и составляет около 50%. Среди неродственных доноров HLA-совместимость значительно лучше, когда донор и пациент принадлежат к одной и той же расе и этнической группе. Хотя в целом количество доноров увеличивается, у людей из некоторых этнических и расовых групп меньше шансов найти совместимого донора. Чтобы облегчить поиск подходящего неродственного донора, создаются реестры доноров-добровольцев.
Так как однояйцовые близнецы имеют одинаковые гены, у них одинаковый набор HLA-антигенов. Поэтому организм пациента не отторгнет трансплантат от однояйцового близнеца. Однако однояйцевые близнецы рождаются нечасто, и сингенная трансплантация проводится редко.
Как получают костный мозг для трансплантации?
Стволовые клетки, используемые для трансплантации, берутся из костного мозга (губчатой ткани, которая находится внутри крупных костей). Процедура получения костного мозга, которая называется «забор костного мозга», одинакова для всех типов трансплантации (аутогенной, сингенной и алогенной). Она проводится в операционной под общей анестезией (т.е. донор во время процедуры спит). Возможно использование спинномозговой (перидуральной) анестезии, которая вызывает потерю чувствительности ниже пояса. Игла прокалывает кожу и вводится в тазобедренную кость, (в редких случаях - в грудину), и костный мозг всасывается в шприц. Вся процедура занимает около часа.
Затем полученный костный мозг обрабатывают, чтобы удалить кровь и фрагменты кости. Если трансплантация не проводится немедленно, в полученный костный мозг добавляется консервант, и он замораживается, чтобы сохранить стволовые клетки до тех пор, пока они понадобятся. Эта методика называется криоконсервированием. Стволовые клетки могут храниться замороженными в течение многих лет.
Как получают стволовые клетки периферической крови для трансплантации?
Стволовые клетки периферической крови, используемые для трансплантации, получают из кровяного русла. Эта процедура называется аферез или лейкаферез. За 4 - 5 дней до афереза донору дают препарат, который увеличивает количество стволовых клеток, выделяемых в кровяное русло. При аферезе кровь забирают из вены на руке или через центральный венозный катетер. Кровь проходит через аппарат, который отбирает стволовые клетки. Затем кровь возвращается к донору, а отобранные стволовые клетки сохраняются. Аферез обычно продолжается 4 - 6 часов. Затем стволовые клетки замораживаются, пока их не введут пациенту.
Как получают стволовые клетки из пуповины для трансплантации?
Стволовые клетки также можно получить из пуповинной крови. Для этого мать должна до рождения ребенка связаться с банком пуповинной крови. Банк пуповинной крови может запросить, чтобы она заполнила анкету и предоставила пробу крови.
Банки пуповинной крови бывают общественные и коммерческие. Общественные банки пуповинной крови принимают пуповинную кровь и предоставляют стволовые клетки другим совместимым лицам в своей сети. В отличие от них, коммерческие банки пуповинной крови хранят пуповинную кровь только для данной семьи до того, как она понадобится ребенку или другому члену семьи.
После рождения ребенка и разрезания пуповины кровь со стволовыми клетками извлекается из пуповины и плаценты. Эта процедура не опасна для матери и ребенка. Если мать согласна, пуповинная кровь обрабатывается и замораживается для хранения в банке пуповинной крови. Из пуповины и плаценты можно получить только небольшое количество крови, поэтому полученные стволовые клетки обычно используются для детей и взрослых некрупного телосложения.
Существует ли риск, связанный со сдачей костного мозга?
Забор костного мозга не представляет проблем для донора, поскольку берется лишь небольшое количество костного мозга. Наибольший риск, связанный с донорством костного мозга - это использование во время процедуры анестезии. В течение нескольких дней возможны болезненные ощущения в месте, из которого забирался костный мозг. Кроме того, донор может ощущать усталость. Через несколько недель организм донора полностью восстанавливает костный мозг. Однако время, необходимое донору для восстановления, индивидуально. Некоторые люди возвращаются к нормальной жизни через 2 - 3 дня, а другим может понадобиться до 3 - 4 недель, чтобы полностью восстановиться.
Существует ли риск, связанный со сдачей стволовых клеток периферической крови?
Аферез доставляет минимальный дискомфорт. Во время проведения афереза человек может почувствовать головокружение, озноб, потерю чувствительности в области губ, судороги в руках. В отличие от забора костного мозга, при сдаче стволовых клеток периферической крови анестезия не требуется. Препарат, который дается донору, чтобы стимулировать выделение стволовых клеток из костного мозга в кровеносное русло, может вызвать боль в костях и мышцах, головную боль, утомляемость, тошноту, рвоту и/или бессонницу. Эти побочные эффекты обычно прекращаются через 2 - 3 дня после приема последней дозы препарата.
Как проходит процедура трансплантации стволовых клеток?
После курса лечения с применением высоких доз химиотерапии и/или лучевой терапии пациент получает стволовые клетки через внутривенный катетер, как при обычном переливании крови. Процедура трансплантации стволовых клеток длится от 1 до 5 часов.
Принимаются ли какие-либо особые меры, если пациент одновременно является донором (аутогенная трансплантация)?
Желательно, чтобы стволовые клетки, используемые для аутогенной трансплантации, содержали минимальное количество раковых клеток. Поэтому перед трансплантацией полученные стволовые клетки иногда очищают, чтобы избавиться от раковых клеток. Процедура очистки сводит к минимуму вероятность возвращения рака. Поскольку очистка может повредить некоторые здоровые стволовые клетки, у пациента забирается большее количество клеток для трансплантации, чтобы после очистки осталось достаточно здоровых клеток.

Что происходит после пересадки стволовых клеток пациенту?
После попадания в кровяное русло стволовые клетки перемещаются в костный мозг и начинают вырабатывать лейкоциты, эритроциты и тромбоциты. Этот процесс называется «приживление». Приживление обычно происходит в течение 2 - 4 недель после трансплантации. Врачи контролируют этот процесс с помощью регулярных анализов крови. Полное восстановление функций иммунной системы занимает намного больше времени - до нескольких месяцев при аутогенной трансплантации и до 1 - 2 лет при аллогенной и сингенной трансплантации. Врачи проводят различные анализы крови, чтобы подтвердить, что новые клетки крови вырабатываются и рак не вернулся. Понять, насколько хорошо работает новый костный мозг, помогает аспирация костного мозга (забор небольшого образца костного мозга для исследования под микроскопом).
Каковы возможные побочные эффекты трансплантации костного мозга и трансплантации стволовых клеток периферической крови?
В обоих случаях основной риск - это повышенная восприимчивость к инфекциям и кровотечения (вследствие предыдущего лечения с применением высоких доз химиотерапии и/или лучевой терапии). Иногда для предотвращения или лечения инфекций назначаются антибиотики. Также возможно переливание тромбоцитарной массы (для профилактики кровотечений) и эритроцитарной массы (для лечения анемии). Кроме того, после трансплантации костного мозга или стволовых клеток периферической крови пациенты в течение непродолжительного времени могут ощущать такие побочные эффекты, как тошнота, рвота, утомляемость, отсутствие аппетита, стоматит, выпадение волос, кожные реакции.
Возможные долгосрочные побочные эффекты включают осложнения от химиотерапии и лучевой терапии, предшествующих трансплантации: бесплодие, катаракта (помутнение хрусталика глаза, приводящее к потере зрения), вторичный рак (метастазы), повреждение печени, почек, легких и/или сердца.
При аллогенной трансплантации иногда развивается осложнение, известное как реакция «трансплантат против хозяина». Это происходит, если лейкоциты донора (трансплантат) принимают клетки пациента (хозяин) как чужие и атакуют их. При этом чаще всего поражается кожа, печень и кишечник. Это осложнение может развиться в течение нескольких недель после трансплантации (острая реакция «трансплантат против хозяина») или намного позже (хроническая реакция «трансплантат против хозяина»). Чтобы предотвратить это осложнение, пациентам могут назначаться препараты, подавляющие иммунную систему. Кроме того, стволовые клетки донора могут подвергнуть специальной обработке, чтобы удалить лейкоциты, которые вызывают реакцию «трансплантат против хозяина». Такая процедура называется «очищение от Т-клеток костного мозга».
Реакция «трансплантат против хозяина» может протекать очень тяжело. В этом случае назначают стероиды и другие препараты, подавляющие иммунитет. Однако некоторые исследования показывают, что если при лейкозе развивается реакция «трансплантат против хозяина», то вероятность того, что рак вернется, низка. В настоящее время проводятся клинические исследования, чтобы найти способы предотвращать и лечить реакцию «трансплантат против хозяина».
Вероятность возникновения и тяжесть осложнений очень индивидуальны и зависят от лечения, назначенного пациенту. Такие вопросы нужно в каждом конкретном случае обсуждать с лечащим врачом.
Что такое «мини-трансплантация»?
Мини-трансплантация, или трансплантация после миелоаблативных (не разрушающих костномозговое кроветворение) режимов - это вид алогенной трансплантации. При мини-трансплантации используют меньшие, не такие токсичные дозы химиотерапии и/или лучевой терапии, чтобы подготовить пациента к аллогенной трансплантации. Такие дозы химиопрепаратов и облучения уничтожают не весь костный мозг пациента, а только некоторую его часть. Кроме того, они уменьшают количество раковых клеток и подавляют иммунную систему пациента, предотвращая отторжение трансплантата.
В отличие от обычной трансплантации костного мозга и трансплантации стволовых клеток периферической крови, после мини-трансплантации в организме пациента некоторое время могут существовать и клетки донора, и клетки пациента. Когда клетки донора начинают приживаться, они могут вызвать реакцию «трансплантат против опухоли» и начать разрушать раковые клетки, которые не были уничтожены с помощью противораковых препаратов и/или лучевой терапии. Чтобы усилить реакцию «трансплантат против опухоли», иногда пациенту делают инъекции лейкоцитов донора. Эта процедура называется «инфузия донорских лейкоцитов».
Что такое «тандемная трансплантация»?
Тандемная трансплантация - это вид аутогенной трансплантации. В настоящее время проводятся клинические исследования для изучения и использования этого метода при лечении некоторых видов рака, включая множественную миелому и герминогенные опухоли. При тандемной трансплантации пациент проходит два последовательных курса высокодозированной химиотерапии с трансплантацией стволовых клеток. Обычно перерыв между двумя курсами составляет несколько недель или месяцев. Исследователи надеются, что этот метод поможет предотвратить рецидивы рака в будущем.
Подходы к мобилизации гемопоэтических стволовых клеток: литературный обзор
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия;
2) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
Одним из этапов проведения высокодозной химиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток является их мобилизация в периферическую кровь. Основная цель мобилизации - сбор достаточного количества CD34+-клеток. От эффективности ее проведения зависит планирование последующей тактики лечения. Выбор подхода к мобилизации зависит от конкретной клинической ситуации, результатов мобилизации. Ее безуспешность является значимой клинической проблемой. Комбинация плериксафора и Г-КСФ значительно повышает эффективность мобилизации, однако высокая стоимость плериксафора ограничивает его клиническое применение. Эффективным способом мобилизации также является химиомобилизация. С учетом ее преимущества и недостатков выбор оптимального режима химиомобилизации может стать возможным решением проблемы безуспешной мобилизации. В данном литературном обзоре представлены основные подходы к мобилизации CD34+-клеток, применяемые в клинической практике, факторы риска безуспешности мобилизации, пути решения этой проблемы, данные эффективности новых режимов химиомобилизации цитарабином и этопозидом.
Введение
Высокодозная химиотерапия (ВДХТ) с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК) является эффективной опцией лечения пациентов с онкогематологическими заболеваниями. Однако курс ВДХТ ассоциирован с развитием тяжелой гематологической токсичности и возможным присоединением жизнеугрожающих инфекций. Трансплантация собственных гемопоэтических стволовых клеток позволяет восстанавливать функцию костного мозга и избегать реакции «трансплантат против хозяина». Существует два основных способа получения CD34+-клеток: аспирация костного мозга и лейкаферез периферических стволовых клеток крови (ПСКК). Реинфузия ПСКК по сравнению с аспиратом костного мозга характеризуется более коротким сроком приживления трансплантата и восстановления функции костного мозга [1]. Таким образом, ПСКК становится основным источником гематопоэтической стволовой клетки, а мобилизация CD34+-клеток в периферическую кровь - важным этапом проведения ВДХТ.
Основная цель мобилизации - сбор достаточного для аутоТГСК количества стволовых клеток крови (СКК). Безуспешность мобилизации существующих режимов достигает 40% [2]. При невозможности афереза достаточного количества CD34+-клеток вариантом консолидации достигнутого ответа становится аллогенная трансплантация костного мозга, сопряженная с проблемой поиска донора, развитием более тяжелых осложнений. Выбор оптимального подхода к мобилизации должен учитывать не только эффективность режима, но и минимизацию осложнений, числа аферезов, затрат мобилизации.
Подходы к мобилизации СКК
Мобилизация СКК в периферическую кровь возможна двумя путями: на стабильном кроветворении и химиомобилизация (см рисунок). Мобилизация на стабильном кроветворении включает использование цитокинов после завершения лечебного курса химиотерапии (ХТ). При химиомобилизации аферез ПСКК осуществляется в период восстановления сразу после лечебного или отдельного курса ХТ, проводимого с мобилизационной целью. В случае безуспешности мобилизации или у пациентов с неблагоприятными факторами риска сбора недостаточного количества ПСКК используется плериксафор.
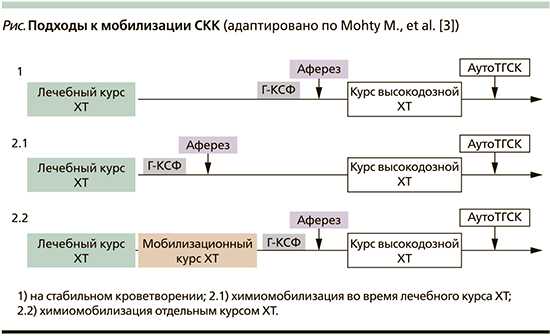
Мобилизация на стабильном кроветворении
При мобилизации на стабильном кроветворении филграстим назначается в дозе 10 мкг/кг в течение 4-5 дней с последующим определением числа CD34+-клеток в периферической крови [2].
Актуальным остается вопрос о режиме дозирования гранулоцитарного колониестимулирующего фактора (Г-КСФ).
N. Kröger et al. [4] изучили разницу в режимах назначения филграстима 10 мкг/кг однократно или 5 мкг/кг дважды в сутки. По результатам исследования применение 5 мкг/кг 2 раза в сутки было ассоциировано с бóльшим числом собранных CD34+-клеток и меньшим числом необходимых процедур афереза по сравнению с применением 10 мкг/кг 1 раз в сутки. Однако позже R. Carrion et al. [5] не доказали преимуществ применения филграстима 5 мкг/кг дважды в сутки. Токсичность оказалась ниже в группе режима 10 мкг/кг однократно. Отсутствие статистически значимых различий в режиме дозировки также доказано при мобилизации ПСКК у здоровых доноров [6].
Применение длительно действующей пегилированной формы филграстима тоже доказало свою эффективность 7. По данным систематического обзора 2017 г., изучившего эффективность мобилизации ПСКК пэгфилграстимом по сравнению с филграстимом, преимуществ использования длительно действующей формы выявлено не было [10]. Применение пэгфилграстима не входит в американские, европейские и отечественные клинические рекомендации для мобилизации на стабильном кроветворении при проведении аутологичной трансплантации.
ГМ-КСФ (сарграмостим, молграмостим) для мобилизации ПСКК на стабильном кроветворении в сегодняшней практике не используется. В проспективных рандомизированных исследованиях ГМ-КСФ по сравнению с Г-КСФ доказал меньшую эффективность мобилизации, более длительный период посттрансплантационного восстановления кроветворения, более частую необходимость трансфузий гемокомпонентов, применения антибиотикотерапии и эп.
Елхова С.С. , Филатова Л.В. , Зюзгин И.С. , Волчёнков С.А. , Ковязин А.К. , Моталкина М.С. , Чудиновских Ю.А. , Семиглазова Т.Ю.
Источники гемопоэтических стволовых клеток - периферическая кровь (ПСКК)

Сегодня трансплантация костного мозга и гемопоэтических стволовых клеток периферической крови один из эффективных методов лечения злокачественных заболеваний крови и тяжелых состояний, вызванных угнетением костного мозга облучением, химиотерапией или действием токсичных веществ. К нему прибегают тогда, когда стандартная химиолучевая терапия и операции недостаточно эффективны и добиться ремиссии заболевания другими путями нельзя. В этом случае неправильно работающий костный мозг заменяют донорским.
Гемопоэтические стволовые клетки костного мозга - уникальный материал. Они являются предшественницами всех клеток крови и иммунной системы в организме. Они могут бесконечно долго размножаться и давать зрелое потомство. Их потенциал к размножению и созреванию бесконечно велик. Будучи пересаженными реципиенту даже в небольших количествах, гемопоэтические стволовые клетки способны полностью восстановить кроветворение и иммунитет.
Источниками этих клеток могут быть костный мозг и периферическая кровь. Больше всего костного мозга содержится в костях скелета: тазовых костях, грудине и позвоночнике. На протяжении нескольких десятилетий источником гемопоэтических стволовых клеток (ГСК) был только костный мозг, поэтому большинство существующих ныне западных регистров и называются регистрами доноров костного мозга.
В конце прошлого века было показано, что с помощью специальных препаратов ГСК можно на короткое время «мобилизовать» из костного мозга в кровь, из которой их достаточно легко получить с помощью специальных сепараторов. Обе процедуры по получению ГСК представляют собой достаточно серьёзную медицинскую манипуляцию.
В случае получения ГСК из периферической крови - это аферез (изъятие малыми порциями крови из вены с фильтрацией ГСК и последующим возвращением всей оставшейся крови донору), для сбора костного мозга делаются проколы тазовых костей специальными иглами под общей анестезией в условиях операционной. Еще одним источником гемопоэтических стволовых клеток является пуповинная кровь.
Если источником гемопоэтических стволовых клеток является костный мозг, то донора госпитализируют в клинику. Процедура взятия костного мозга проходит под общим наркозом под строгим контролем врача анестезиолога. Костный мозг берут из тазовых костей специальными иглами с широким просветом. В течение 1,5-2 часов через два маленьких разреза в коже делают около ста проколов кости и забирают при этом около литра жидкого костного мозга. Это составляет не более 5% от общего объема костного мозга донора. Такого количества вполне хватает, чтобы обеспечить кроветворение пациента на всю жизнь. Сама потеря костного мозга донором при этом не ощущается, и его объем полностью компенсируется в течение двух недель. Незначительно снижается уровень гемоглобина в крови, но и он полностью восстанавливается за полторы - две недели. Почти всегда в первые два-три дня после взятия костного мозга донор испытывает болевые ощущения в тазовых костях, которые легко проходят под действием обычных обезболивающих препаратов. Кроме того, донор может испытывать неприятные ощущения после наркоза, такие как подташнивание, сонливость, слабость. Как правило, на следующий день после операции донор может уйти из клиники домой.
Если источником гемопоэтических стволовых клеток служит периферическая кровь, донору приходится проходить пятидневный подготовительный период. В течение пяти дней подкожно вводится специальный препарат, стимулирующий выход стволовых гемопоэтических клеток в кровь. На четвёртый и/или пятый день донору проводится процедура афереза длительностью 3-5 часов в зависимости от количества стволовых клеток, которое необходимо получить. Во время этой процедуры кровь забирается из вены, проходит через специальный аппарат - клеточный сепаратор и возвращается донору. Во время каждого прохождения через аппарат отбирается только небольшое количество стволовых клеток, поэтому для получения достаточного для пересадки объема такие циклы повторяются. Всего за процедуру через сепаратор проходит 7 - 15 литров крови, из которых в аппарате остается всего 50-200 мл. Остальные компоненты крови возвращаются донору. Технически процедура аналогична тромбоцитаферезу.
В период подготовки к аферезу самыми частыми побочным явлениям являются ломота и боли в костях, возникающие примерно у половины доноров во время стимуляции. Ростовые факторы стимулируют деление клеток в костном мозге, костный мозг увеличивается в объеме, что и вызывает неприятные ощущения. Еще одно возможное последствие - незначительная потеря тромбоцитов во время процедуры афереза. Часть тромбоцитов просто отбирается сепаратором вместе с гемопоэтическими стволовыми клетками. Возможны также обострения аутоиммунных заболеваний. Поэтому люди, страдающие аутоиммунными болезнями (ревматоидным артритом, системной красной волчанкой, псориазом и др), не допускаются до этого вида донорства. Донор после консультации с врачом может сам выбрать, каким способом у него возьмут гемопоэтические клетки.
Донор костного мозга подбирается по признаку иммунологической совместимости с больным. Это означает, что белки, входящие в состав так называемого HLA-комплекса, должны у донора и больного совпадать полностью или почти полностью. Иначе неизбежны тяжелые иммунные осложнения после трансплантации. Напротив, совпадение группы крови и резус-фактора у донора и пациента при этом не обязательно.
Прежде всего, донора костного мозга пытаются подобрать среди родственников больного - поскольку совместимость определяется генетически, то вероятность найти совместимого донора выше всего среди братьев и сестер больного, к сожалению, она составляет не более 10-20%. Но если в семье пациента поиск не приведет к успеху, то приходится искать неродственного донора. Сама процедура вхождения в регистр потенциальных доноров стволовых гемопоэтических клеток ни к чему не обязывает. Это лишь подтверждение желания сдать гемопоэтические стволовые клетки и спасти ближнего, которому необходима пересадка.
Вероятность того, что данный конкретный донор подойдет кому-то из нуждающихся по показателям тканевой совместимости, сравнительно невелика. Если все же это происходит, то представители регистра доноров костного мозга связываются с потенциальным донором и спрашивают его согласия на сдачу гемопоэтических стволовых клеток.
В случае согласия донора проводится повторное, расширенное высокоточное типирование. Когда результаты повторного типирования подтверждают, что донор действительно подходит человеку, ожидающему пересадки костного мозга, потенциального донора еще раз запрашивают о согласии на донорство, обследуют на наличие вирусных инфекций и согласовывают время заготовки стволовых гемопоэтических клеток.
Отказаться от донорства стволовых гемопоэтических клеток можно практически на любом этапе, но не позднее, чем за 10 дней до намеченной даты трансплантации костного мозга. Отказ в последнюю минуту практически равносилен убийству человека, ожидающего пересадки костного мозга, который уже получил интенсивную химиотерапию, полностью уничтожившую его кроветворную и иммунную систему. Причины для отказа могут быть самыми разными: нездоровье, нехватка времени, страх.
Перед трансплантацией костного мозга пациент проходит определенную подготовку. Цель подготовки - подавить иммунитет и костный мозг реципиента, чтобы предотвратить отторжение пересаженных клеток, а также максимально уничтожить опухолевые клетки (в том случае, если пациент страдает злокачественным новообразованием). Для этого реципиент получает настолько интенсивную химиотерапию, что восстановление собственного кроветворения и иммунитета уже невозможно. Если трансплантация костного мозга в этот момент не произойдет, пациент погибнет. Сроки проведения химиотерапии рассчитываются таким образом, что к тому моменту, когда донор отдает свои гемопоэтические клетки, реципиент уже готов их принять.
Сама трансплантация по процедуре напоминает обычное переливание крови, за которым следует длительный, около 20 дней, период ожидания приживления пересаженных стволовых гемопоэтических клеток. И до момента приживления, и многие месяцы после него возможно развитие разнообразных осложнений. Поэтому в течение длительного периода после трансплантации костного мозга пациент вынужден находиться под пристальнейшим наблюдением врачей, в любую минуту готовых к проведению интенсивной терапии.
Россияне генетически отличаются от американцев и европейцев, данные которых и представлены главным образом в зарубежных регистрах. Самым подходящим донором для российского пациента может стать именно россиянин. Чем больше доноров с российской кровью будет представлено в регистрах доноров костного мозга, тем больше шансов у людей с российскими корнями найти подходящего донора. В России до настоящего времени не существует официально опубликованного перечня медицинских противопоказаний к донорству гемопоэтических стволовых клеток, поскольку до сих пор он законодательно не разработан и не утвержден. Однако этот перечень во многом совпадает с перечнем медицинских противопоказаний к донорству крови.
Трансплантация гемопоэтических стволовых клеток: процедура, прогноз
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Трансплантация гемопоэтических стволовых клеток (ТГСК) - быстро развивающаяся технология, которая потенциально может позволить добиться излечения при злокачественных заболеваниях крови (лейкемии, лимфомы, миелома) и других гематологических заболеваниях (например, первичный иммунодефицит, апластическая анемия, миелодисплазия). Трансплантация гемопоэтических стволовых клеток может быть аутогенной или аллогенной; можно использовать стволовые клетки, выделенные из периферической или пуповинной крови. Периферическая кровь как источник ГСК чаще используется, чем костный мозг, особенно при аутогенной трансплантации гемопоэтических стволовых клеток. Поскольку стволовые клетки из периферической крови выделить легче, количество нейтрофилов и тромбоцитов восстанавливается быстрее. ТГСК, полученных из пуповинной крови, разрешена только у детей, поскольку количество ГСК невелико.
Процедура трансплантации гемопоэтических стволовых клеток
Для выделения костномозговых стволовых клеток аспирируется 700-1500 мл (максимально 15 мл/кг) костного мозга из заднего гребня подвздошной кости донора; при этом используется местная или общая анестезия. Для выделения стволовых клеток из периферической крови донору вводят рекомбинантные факторы роста (гранулоцит-колониестимулирующий фактор или гранулоцит-макрофаг-колониестимулирующий фактор) для стимуляции пролиферации и мобилизации стволовых клеток с последующей стандартной флеботомией через 4-6 дней. Затем для идентификации и выделения стволовых клеток производится флюоресцентная сортировка клеток.
Стволовые клетки вводятся в течение 1 -2 часов посредством центрального венозного катетера большого диаметра. При трансплантации гемопоэтических стволовых клеток в случае злокачественных заболеваний крови реципиенту назначают иммуносупрессивные препараты [например, циклофосфамид 60 мг/(кгхдень) внутривенно в течение 2 дней с тотальным облучением всего тела, бусульфан 1 мг/кг перорально 4 раза в день в течение 4 дней и циклофосфамид без тотального облучения] для индуцирования ремиссии и супрессии иммунной системы, чтобы не произошло отторжения трансплантата. Подобные схемы используются при аллогенной трансплантации гемопоэтических стволовых клеток, даже когда при данном злокачественном заболевании это не показано, для снижения частоты случаев отторжения и рецидива; при аутогенной трансплантации гемопоэтических стволовых клеток такая схема не показана. Немиелоаблативный иммуносупрессивный режим может снизить риск заболевания и смерти и полезен у пожилых пациентов, пациентов с сопутствующими заболеваниями и восприимчивых к эффекту «трансплантат против опухоли» (например, с множественной миеломой).
После трансплантации реципиент получает колониестимулирующие факторы для уменьшения продолжительности посттрансплантационной лейкопении, профилактический курс препаратов для защиты от инфекций и, при аллогенной трансплантации гемопоэтических стволовых клеток - профилактический курс иммуносупрессантов продолжительностью до 6 месяцев (обычно метотрексат и циклоспорин) для предупреждения реакции со стороны донорских Т-лимфоцитов по отношению к молекулам МНС реципиента (болезнь «трансплантат против хозяина» БТПХ, graft vs host disease - GVHD). Если пациент не лихорадит, от приема антибиотиков широкого спектра действия обычно воздерживаются. Приживление трансплантата обычно происходит через 10-20 дней после трансплантации гемопоэтических стволовых клеток (раньше в случае трансплантации стволовых клеток из периферической крови) и определяется по абсолютному числу нейтрофилов больше 500 х 10 6 /л.
Читайте также:
