История изучения внеклеточного матрикса (ВКМ)
Добавил пользователь Morpheus Обновлено: 01.02.2026
Матрикс - это решетка из высокополимерных сахаров
- основное вещество межклеточного пространства.
Внеклеточный матрикс - это зона трансмиссии -
передачи информации (сигналов) от регуляторных
систем организма к клетками.
• Раньше считалось, что матрикс играет роль некоего каркаса,
выполняя в мозге вспомогательную роль. Но исследования
последнего десятилетия доказали, что матрикс способен
воздействовать на сигнальные функции мозга, это активная
материя, способная влиять на информационные и
когнитивные функции мозга
• участвует в поддержании целостности ткани и образует
упорядоченный пространственный остов внутри которого
клетки могут перемещаться и взаимодействовать друг с
другом
• Он влияет на развитие, миграцию, пролиферацию,
метаболизм клеток
Структурная и молекулярная организация ВКМ в ЦНС является
гетерогенной и зависит от типа клеток и субклеточных доменов, которые
связываются с матриксом. В большинстве случаев компоненты
внеклеточного матрикса :
1. Несульфатированный и несвязанный ковалентно с белком
гликозаминогликан
• гиалуроновая кислота
2. ковалентно связанные с белком гликозаминогликаны в составе
протеогликанов
• хондроитин сульфат протеогликанов — версикана, бревикана,
нейрокана, аггрекана, и фосфакана;
• гепаран сульфат протеогликаны — синдеканы, глипиканы, агрин и
перлекан;
3. гликопротеины — тенасцин-С и тенасцин-Я, фибронектин,
ламинины, и тромбоспондины. В дополнение к вышеупомянутым
основным компонентам, ВКМ содержит широкий спектр секретируемых
ростовых факторов и других (таМсеПи1аг) белков, которые регулируют
взаимодействия клеток между собой и с матриксом.
В центральной нервной системе существует несколько форм внеклеточного
матрикса. К ним относятся:
1.
Перинейрональные сети, которые окружают тела клеток, проксимальные
дендриты и начальные сегменты аксонов некоторых нейронов;
2.
Перисинаптический матрикс в нейропиле;
3.
Базальная мембрана, входящая в состав капилляров и посткапиллярных
венул и являющаяся неотъемлемой частью гематоэнцефалического барьера в
ассоциации с перицитами, периваскуляр-ной микроглией и астроцитами;
4.
Небольшие области в стенках боковых желудочков мозга, активирующие
ростовые факторы в нишах роста нейральных стволовых клеток;
5.
Синаптический матрикс
Роль внеклеточтого матрикса (ВКМ) в синаптической
пластичности:
1. Нейроны и глиальные клетки секретируют молекулы ВКМ во
внеклеточное пространство;
2. Расщепление молекул ВКМ внеклеточными протеазами;
3. Молекулы ВКМ и продукты их протеолиза активируют ВКМ
рецепторы и влияют на ионные каналы;
4. Активация ВКМ рецепторов влияет на фосфорилирование,
экзо- и эндоцитоз постсинаптических рецепторов;
5. Активация ВКМ рецепторов влияет на актиновый цитоскелет.
Функции молекул внеклеточного матрикса
1. Выполняют механическую поддержку клеток в головном мозге.
2. Осуществляют сигнальные функции
3. Формируют адгезивный субстрат, осуществляют миграцию клеток и
морфогенез во время развития, внося вклад в процессы роста нейритов,
направленного движения конуса роста, формирования и стабилизация
синаптических контактов.
4. Во взрослом состоянии внеклеточный матрикс принимает участие во
многих патофизиологических процессах.
5. Структура и молекулярный состав внеклеточного матрикса важны
также для электрической передачи сигналов в мозге, модуляции
синаптической трансмиссии и регуляции синаптической пластичности.
6. Композиция внеклеточного матрикса определяет и диффузию ионов,
нейромедиаторов, других нейроактивных субстанций во внеклеточном
пространстве.
Матриксные импланты
Выполняют каркасную, заполняя место дефекта, трофическую
функции, поддерживают жизнеспособность стимулируют
регенерацию, размножение и дифференцировку клеток, а также
могут служить системой адресной доставки лекарств.
Кто рубит коллагеновый лес
Обзор
Автор
Редактор
Статья на конкурс «био/мол/текст»: Окружение, в котором «живет» клетка, влияет на все аспекты ее существования. Поэтому любые изменения в этом окружении неизбежно отразятся и на самой клетке — элементарной единице живого организма. Как говорится, ломать — не строить. Проще всего изменить окружение клетки (кроме прямого физического разрушения) химическим путем, «включив» специальные белки — матриксные металлопротеиназы (ММП). Это семейство протеолитических ферментов, которые специфически разрушают многочисленные компоненты клеточного окружения и тем самым способствуют ряду важных функций организма — от обеспечения миграции клеток до заживления ран.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Дремучий коллагеновый лес
Ни для кого не секрет (и, честно говоря, это просто следует из названия), что все многоклеточные организмы состоят из клеток. Но для многих невдомек, что эти клетки окружает. Часто клетки в организме ошибочно представляют себе как плотно уложенные кирпичики, накрепко сцементированные между собой.
На самом деле это справедливо (да и то лишь отчасти) для клеток эпителиальной ткани, что выстилает полости нашего тела, слизистые оболочки внутренних органов, дыхательной системы, пищеварительного тракта и мочеполовых путей, а также образует большинство желез организма. В остальных же случаях клетки, как правило, располагаются не так близко друг к другу, а в случае крови (это же тоже ткань, хоть и жидкая!) клетки вообще практически не связаны и относительно свободно переносятся по всему организму, выполняя свои физиологические функции. Некоторые клетки даже могут самостоятельно передвигаться и проникать в ткани, ориентируясь на биологические, химические и физические аттрактанты (примерно так же ориентируются в пространстве одноклеточные эукариоты — протисты).
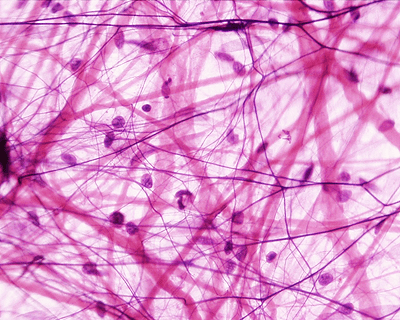
Можно сказать, что клетки нашего организма (за исключением самых первых в эмбриогенезе — бластомеров) окружены субстанцией, поддерживающей их на определенном месте относительно других клеток организма. Субстанцией, интегрирующей все клетки, ткани и органы нашего тела в отдельные кластеры, а уже затем в единую систему, называемую организмом. Клетки можно сравнить с грибами, растущими в лесу — некоторые, как опята, грузди или лисички, растут скученно (эпителиальная, мышечная ткани), а некоторые — порознь, как боровики и белые грибы (соединительная, нервная ткани) (рис. 1). Как известно из школьного курса биологии, грибы вступают в очень тесный симбиотический контакт с деревьями, поэтому на рост грибов влияет состояние леса, в котором они растут, а рост леса, в свою очередь, зависит от грибов*. Клетки в нашем организме тоже живут в «лесу», который прямо или косвенно влияет на их рост, и который растет благодаря им. Этот лес — внеклеточный матрикс (рис. 2). Быстро пройдемся по видовому разнообразию матрикса.
Внеклеточным матриксом (далее ВКМ) называют все внеклеточные структуры ткани с белками и полисахаридами, входящими в его состав. «Деревья» клеточного леса можно разделить на несколько групп: гликопротеины, протеогликаны и гиалуроновая кислота.
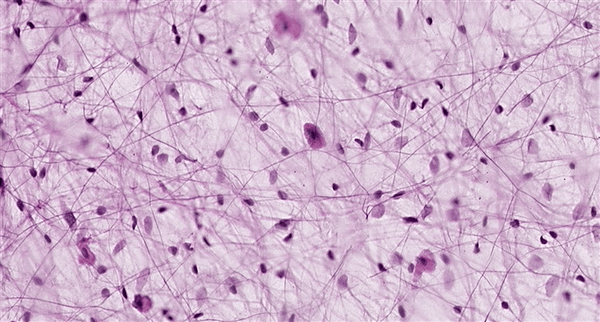
Рисунок 1. «Коллагеновый лес». На фото представлена так называемая рыхлая соединительная ткань. Тонкие нити представляют собой волокнистые компоненты внеклеточного матрикса, а клетки как бы «подвешены» на них. Рисунок с сайта StudyBlue.
Особо стоит выделить гликопротеин под названием коллаген, ведь это самый распространенный белок не только во внеклеточном матриксе, но и во всем организме человека. Можно сказать, что наши клетки действительно живут в самом настоящем «коллагеновом лесу». Коллаген обеспечивает структурную поддержку ткани, придает ей твердость и стойкость. Вторым замечательным гликопротеином ВКМ является эластин. Он, в противоположность коллагену, наоборот придает ткани упругость и растяжимость; находится, соответственно, там, где эта растяжимость больше всего нужна (гладкая мышечная ткань; стенки артерий, легких, связок).
Особняком стоит подкласс гликопротеинов, называемый протеогликанами. Протеогликаны — особые белковые молекулы с очень высокой степенью гликозилирования (насыщенностью углеводами) (около 90-95% массы белка), соединенные с молекулами гликозаминогликанов. Гликозилирование обусловливает исключительную способность протеогликанов накапливать воду и полезные вещества, вроде факторов роста. Они в чем-то похожи на сфагнум — подстилку болота.
Третий основной компонент клеточного леса — гиалуроновая кислота. Ее главное отличие от всех остальных гликозаминогликанов в том, что она не подвергается сульфированию и синтезируются на клеточной стенке. Не обладая большой склонностью к образованию комплексов с другими компонентами ВКМ, гиалуроновая кислота тем не менее выполняет ряд важных функций. Так, гиалуроновая кислота необходима для поддержания гидродинамики тканей, играет важную роль в процессах миграции и пролиферации клеток.
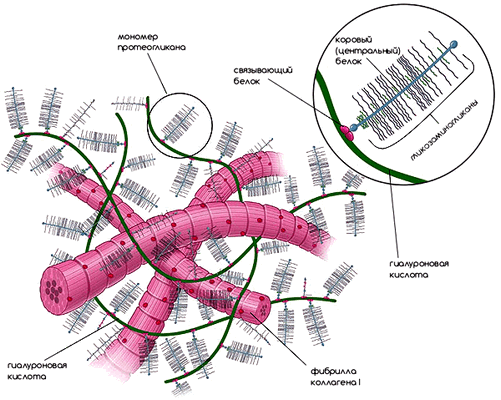
Рисунок 2. Внеклеточный матрикс. Компоненты внеклеточного матрикса органично переплетаются друг с другом и образуют каркас для клеток. Рисунок из [1].
На границе клетка—ВКМ существуют интересные белки — интегрины и фибронектины. Первые как бы находятся и в клетке, и вне ее, называясь трансмембранными, а вторые соединяют внешние концы интегринов. Это те белки, через которые ВКМ может прямо влиять на жизнь клетки (заставить ее делиться, двигаться, умереть и т.д.) [1].
ВКМ выполняет интегрирующую функцию по отношению ко всем клеткам организма. Можно сказать, что ВКМ «склеивает» вместе клетки и органы многоклеточного организма. Даже эпителиальная ткань, чьи клетки словно сшиты и плотно прилегают друг к другу, также интегрирована в общую организменную среду через особую прослойку ВКМ, называемую базальной ламиной.
Не всё так спокойно в коллагеновом лесу
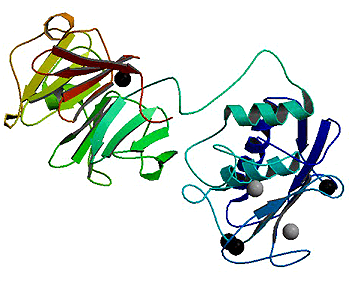
Рисунок 3. Структура коллагеназы ММП-1, полученная методом рентгенкристаллографии. Рисунок с сайта Protein Data Bank.
Коллагеновый лес систематически вырубают. Не подчистую, конечно же, к тому же на месте поваленных деревьев появляются новые (не без участия окружающих клеток), и экологическое равновесие не нарушается. Но зачем кому-то вырубать лес, а главное, кто его вырубает?
ВКМ, конечно, выполняет доброе дело, поддерживая клетки, ткани и органы, но протиснуться сквозь дебри коллагеновых волокон среднестатистической клетке довольно проблематично, а двигаться клеткам порой приходится очень много, особенно тем, что защищают организм от интервентов. Да что там говорить, даже очень активной раковой клетке необходимо как-то метастазировать и буквально прорубать себе путь. Клеткам необходима помощь тех, кто мог бы снаружи разрушать коллаген и прочие молекулы ВКМ и отцеплять клетку от внешних волокон. Эту роль лесорубов в организме многоклеточных животных выполняют несколько крупных семейств молекул, из которых самой многочисленной является семейство матриксных металлопротеиназ (далее ММП) (рис. 3) 3.
В семейство ММП входит более 20 ферментов. Это семейство способно расщеплять почти все компоненты внеклеточного матрикса соединительных тканей. ММП сопровождают нас на протяжении всей нашей жизни — от момента прикрепления эмбриона к матке до самой смерти. Структура ММП незатейлива и мало отличается в целом по группе, однако функции разных ММП могут порой отличаться довольно сильно. Основой протеиназы являются два домена: про-домен и каталитический домен (рис. 4) [2, 6].
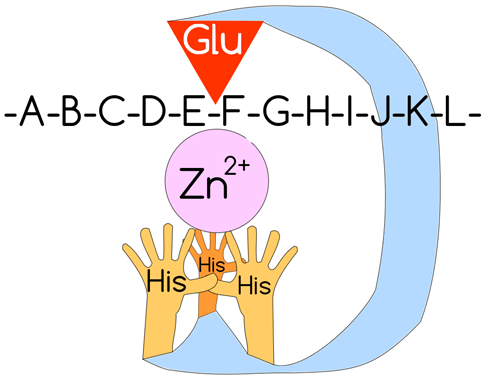
Рисунок 4. Схематическое строение активного центра ММП. Три «гистидиновые руки» удерживают ион цинка и координируют его относительно остатка глутаминовой кислоты. «-A-B-C-D-E-F-G-H-I-J-K-L-» — последовательность аминокислот белка. Суть протеолиза ММП в разрушении пептидной связи — «дефиса» между двумя буквами.
Про-домен нужен ММП чтобы активироваться лишь в нужный для клетки момент. Действительно, если мы начнем беспорядочно рубить коллаген налево-направо, от этого будет мало толку (скорее, организм превратится в бесформенную массу). Поэтому на про-домене также располагается так называемый «цистеиновый переключатель», который предотвращает доступ воды к иону цинка, тем самым оберегая ММП от активации. Каталитический же домен обусловливает собственно реакцию разрушения белка, и в типичной ММП содержит в своем активном сайте ион цинка (Zn 2+ ) (поэтому матриксные металлопротеиназы имеют приставку металло-), который как бы удерживается на весу тремя гистидиновыми «руками», которые координируют цинк [3, 6]. Кратко механизм катализируемой протеолитической реакции изображен на рисунке 5.
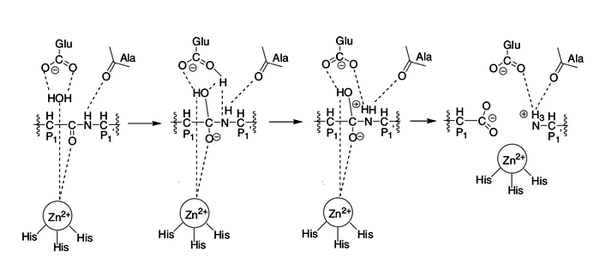
Рисунок 5. Механизм реакции протеолиза при участии ММП. Пептидная связь расщепляемого белка ориентируется на активный цинковый центр. Карбонильная группа атакуется молекулой воды, которая связана водородными связями с глутаминовой кислотой и также сориентирована на активный цинковый центр. Молекула воды жертвует протон остатку глутаминовой кислоты, который переносит его к атому азота расщепляемой пептидной связи [3]. Рисунок из [2].
Рисунок 6. ММП разрушают внеклеточный матрикс.
Кроме того, за исключением некоторых представителей, ММП имеют гибкую богатую аминокислотой пролином шарнирную область и карбокси-(C)-концевой гемопексин-подобный домен, чья функция заключается в специфичном распознавании субстрата. Другие домены «протеазоспецифичны» и выполняют специфические функции. Например, четыре мембранные ММП (ММП-14, -15, -16 и -24) имеют так называемый трансмембранный цитозольный домен, который позволяет закрепляться им на поверхности мембраны клетки и «рубить» по мере того, как клетка продвигается вперед [6].
Без дровосеков никуда
Так как ВКМ представлен практически во всех тканях в более или менее выраженной степени, ММП простирают свои цинко-глутаминовые щупальца на все ткани организма. Такое фундаментальное значение определяет роли, выполняемые ММП — как положительные, так и отрицательные.
Миграция клеток
На первый взгляд клетки человека кажутся статичными — движутся разве что форменные элементы крови. Однако на самом деле в организме постоянно происходят миграции клеток (от эпителиальных и мезенхимальных, до нервных и костных), причем на довольно приличные для клетки расстояния.
Замечательным примером служит миграция клеток нервного гребня (рис. 7). Нервный гребень — совокупность клеток позвоночных животных на определенной стадии эмбриогенеза, выделяющаяся из краевых отделов нервного желобка во время его замыкания в нервную трубку. В процессе индивидуального развития организма клетки нервного гребня мигрируют порой в самые неожиданные места и на очень далекие расстояния.
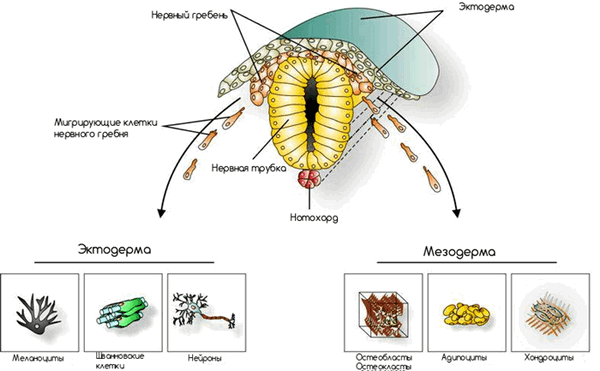
Рисунок 7. Схематическое расположение клеток нервного гребня на этапе эмбриогенеза. Рисунок с сайта Билефельдского университета.
Есть три основных пути миграции:
- Вниз, образуя симпатические и парасимпатические ганглии, вещество надпочечников.
- Также вниз, но с образованием спинальных ганглиев.
- Прямо под эктодерму, радиально в стороны от нервной трубки с образованием меланоцитов (специализированных клеток кожи, вырабатывающих пигмент меланин) [7].
Движение клетки является многоэтапным процессом. Сначала клетка должна сменить свою стратегию поведения с прикрепительного (адгезивного) на миграционный. Затем следует активация двигательной функции цитоскелета клетки, изменение адгезивных сайтов и адгезивных молекул на поверхности клетки и «вырубка» ВКМ для устранения физических барьеров. Отдельная роль отводится хемоаттрактантам (химическим веществам, по которым клетка ориентируется в пространстве), так как именно они будут вести клетку в нужном направлении. Очевидно, что главным препятствием для клетки является тот самый коллагеновый лес, которым она окружена со всех сторон. Ключевая роль здесь отводится ММП, которые как раз и прочищают путь для клетки [2, 4, 6].
ВКМ управляет делением клеток и их запрограммированной смертью
Давно известно, что взаимодействия между ВКМ и молекулами на поверхности клетки регулируют поведение клетки. Опосредованную роль в фундаментальных клеточных процессах, таких как деление, апоптоз (запрограммированная клеточная смерть), дифференцировка и жизнь клетки вообще играют ММП. Хотя исследований на эту тему довольно мало, достоверно известно, что их опосредованная роль заключается в изменении окружения клетки и в специфических взаимодействиях с молекулами на поверхности клетки.
Были проведены эксперименты на разных культурах клеток, и во всех результаты оказались схожими — подавление (ингибирование) ММП приводило к уменьшению пролиферативной активности клеток (они просто меньше делились) и увеличению общего содержания компонентов ВКМ. Можно считать, активность ММП может быть необходима для запуска пролиферативного сигнала.
В то же время ММП могут вызвать запрограммированную смерть клетки — апоптоз. Протеиназы или «неправильные» молекулы ВКМ (т.е. поврежденные или бракованные) могут привести к такому исходу возможно из-за того, что они изменяют сигналы, которые приходят на интегрины [5, 6].
Морфогенез тканей
Морфогенез — возникновение и развитие органов, систем и частей тела организмов в онтогенезе (индивидуальном развитии) и филогенезе (историческом развитии). ММП принимают непосредственное участие в морфогенезе тканей, и неправильное функционирование и пространственное расположение ММП могут существенным образом влиять на процессы тканеобразования, приводя к печальным последствиям. В большинстве случаев возможны вариации активности ММП, что приводит к появлению в процессе онтогенеза различных морфологических структур.
Эксперименты на адипоцитах (клетках жировой ткани), помещенных на базальную мембрану, показали, что они мигрируют и самоорганизуются в большие многоклеточные кластеры. Эти клетки секретируют ММП-2, а ингибирование ММП приводит к подавлению миграции клеток и организации их в трехмерные структуры (рис. 8) [6].
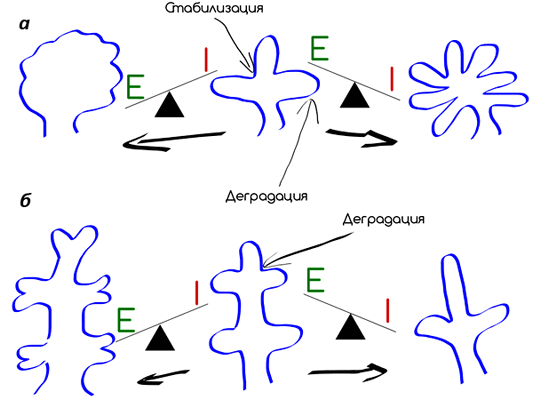
Рисунок 8. «Разветвление» эпителия в процессе морфогенеза зависит от баланса протеиназ и ингибитора протеиназ. а — Подчелюстной железистый эпителий разветвляется с образованием стабилизированных коллагеновых расщелин, сопряженное с ростом эпителия, проникающего дальше. В этом случае высокая активность протеаз приводит к меньшему ветвлению, а высокая активность ингибитора наоборот — к большему ветвлению. б — Эпителий почек ветвится почкованием, которое требует активности протеаз для того, чтобы прорости в окружающую мезенхиму. В этом случае, высокая активность протеаз будет приводить к повышенному уровню ветвления, а высокая активность ингибирования — к пониженному.
Заживление ран
Заживление кожи — комплексный процесс, в который вовлечены несколько подпроцессов: миграция клеток, деградация ВКМ и реорганизация ткани (рис. 9).
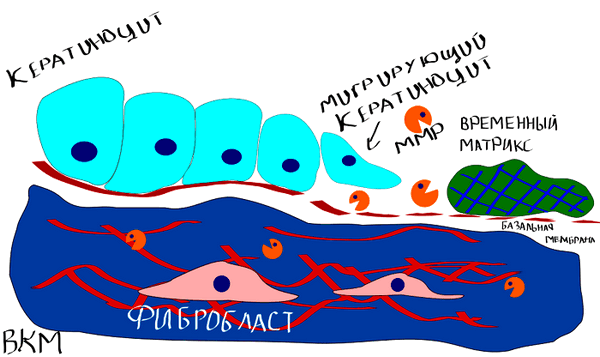
Рисунок 9. Заживление раны на коже. Кератиноциты на самом краю раны должны мигрировать внутрь нее, дабы рана смогла зарасти новыми клетками кожи. Затем богатый фибрином временный матрикс (так называемая «корочка», которая лежит на ране) должен быть разрушен. Дерма также вносит свой вклад в затягивании раны, стягивая ВКМ. Сам же процесс миграции кератиноцитов, как уже можно было догадаться, также опосредован ММП [5, 6].
Заключение
Взаимодействия клеток с внеклеточным матриксом все более интересуют исследователей по всему миру. Очевиден прикладной аспект таких исследований — причиной многих заболеваний является нарушение баланса между деградацией и синтезом компонентов внеклеточного матрикса. Например, характер ремоделирования поврежденных тканей сердца после инфаркта миокарда определяет будущую судьбу человека — нарушение тонкого баланса может повлечь как неправильную работу главной насосной станции нашего тела, так и полную ее остановку. Регуляция процесса ремоделирования сердечной ткани есть перспективное направление исследований в регенеративной медицине*, которое позволит несколько сократить потребность в серьезных хирургических вмешательствах [8].
* — Действительно, в последние годы роль микроокружения в развитии всех клеток (в том числе и раковых) внезапно настолько хорошо осозналась, что и само развитие рака, и потенциальные пути его полного излечения начинают искать не только в «сошедших с ума» клетках, но и в их непосредственном окружении: «Опухолевые разговоры, или Роль микроокружения в развитии рака» [9]. — Ред.
Очевидна роль ремоделирования внеклеточного матрикса при метастазировании опухолей — миграция клеток опухоли на большие расстояния невозможна просто напропалую, опухолевой клетке нужны как ориентиры в пространстве, так и средства для расчистки всего, что попадается ей на пути. Отталкиваясь от этого факта можно заключить, что подавления метастазирования рака можно достичь путем ловких манипуляций характером ремоделирования ВКМ в зоне опухоли [10].
Но за всей прикладной «мишурой» скрывается фундаментальный смысл. Попытки напечатать целый паренхимный (вроде почки, печени, где важна микроструктура) орган «from scratch» не увенчались успехом из-за нерешенной проблемы васкуляризации (построение кровеносной сети внутри органа). Эта проблема может быть решена, если научиться создавать органы так, как они появлялись на начальных этапах нашего индивидуального развития в ходе эмбриогенеза. А здесь уже, несомненно, решающую роль играет динамическое изменение клеточного окружения, естественно, не без участия матриксных металлопротеиназ.
Тот, кто сможет в процессе индукции собрать все частные сведения о построении тканей и органов в нашем теле и сможет объяснить, как все мельчайшие функциональные составные части нашего тела влияют друг на друга и образуют сложнейший из возможных ансамблей в нашей жизни, сможет раскрыть одну из величайших тайн современной биологии.
Что такое внеклеточный матрикс и почему его все изучают
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Что такое внеклеточный матрикс?
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислотаи особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» .
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов. иллюстрация Компоненты ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90-95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5-10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа [2]! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы. Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением».
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ.
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Почему так важно изучать внеклеточный матрикс?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
- на уровне костей — к несовершенному остеогенезу,
- на уровне кожи — к синдрому Элерса—Данлоса, при котором кожа становится слишком эластичной,
- на уровне мышечной ткани — к врожденной мышечной дистрофии (CMD).
Из всех типов генетических нарушений ВКМ лучше всего изучена врожденная миодистрофия. Это заболевание развивается из-за нескольких мутаций, нарушающих работу мышц. В результате мутации в гене ITGA7, кодирующем интегрины мышечных клеток, нарушается связь клеток с ВКМ. Это гибельно для мышечной ткани: потеря связей с ВКМ запускает апоптоз — программируемую смерть клеток.
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак — например, рак предстательной железы.
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника). По мере ее развития возникает фистулизация и фибростеноз кишечника
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга.
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными. О том, как именно ГК «дразнит» раковые клетки, мы поговорим в разделе «Что нового мы узнали о внеклеточном матриксе за последний год?»
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген. Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости.
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
Что нового мы узнали о внеклеточном матриксе за последний год?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1 [4]. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов.
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» [1].
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов. иллюстрация Елены Беловой
Компоненты ВКМ
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением» [3].
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса [4]. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ [5].
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях [6]. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям [7]. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак [8] — например, рак предстательной железы [9].
Эффекты регуляции нейронной активности молекулами внеклеточного матрикса мозга (ВКМ)
Исследование роли внеклеточного матрикса мозга в регуляции нейронной активности, информационных функций нейронной сети и возникновении нейродегенеративных заболеваний.
Описание проекта
Проект посвящен разработке математической модели взаимодействия нейронов и глиальных клеток с молекулами внеклеточного матрикса. Недавние исследования показали существование различных механизмов регуляции нейронной активности, в частности связанные с молекулами внеклеточного матрикса мозга (ВКМ). ВКМ представляет собой совокупность молекул, синтезируемых и секретируемых нейронами и глиальными клетками. В ЦНС ВКМ образует перинейрональные сети, которые окружают тела клеток, дендриты и аксоны (рисунок 1 A). В состав ВКМ входят различные ростовые факторы, белки адгезии, ковалентно связанные с белком глюкозаминогликаны, в составе хондроитин сульфат протеогликанов, гепаран сульфат протеогликаны и гликопротеины. В зрелом мозге матрикс поддерживает важные физиологические процессы, такие как синаптическая пластичность и гомеостаз. Одним из возможных путей модификации ВКМ являются внеклеточные протеазы, которые секретируются пре- и постсинаптическими терминалями. Предполагается, что развитие нейродегенеративных заболеваний, к примеру эпилепсии и шизофрении, связано с нарушением активности ВКМ. Медленные изменения ВКМ на протяжении длительного периода времени (часы, дни и месяцы) и интеграция нейрональной активности позволяют предполагать, что ВКМ принимает важное участие в процессах обучения и памяти. На основе экспериментальных данных была предложена математическая модель регуляции нейронной активности молекулами внеклеточного матрикса мозга (Kazantsev, Gordleeva, Stasenko, & Dityatev, 2012) (рисунок 1 B). Установлено, что воздействие внеклеточных факторов (специфических молекул матрикса) приводит к эффективному регулированию средней частоты нейрональной активности на больших временных масштабах (сотни секунд и выше). Эти факторы обеспечивают формирование двух петель обратной связи: отрицательной - понижающей возбудимость нейрона при увеличении частоты спонтанных колебаний и положительной - увеличивающей чувствительность нейрона к входным воздействием при снижении частоты входных воздействий ниже критического уровня. Кроме того, учет активности внеклеточной среды приводит к бистабильности - сосуществованию двух устойчивых уровней частоты колебаний. Это позволяет утверждать, что внеклеточная среда может играть существенную роль в формировании и поддержании памяти.
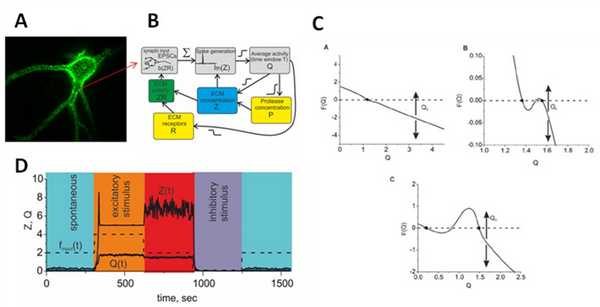
Рисунок 1
- A - Экспериментально полученное изображение перинейрональной сети.
- B - Схема математической модели регуляции нейронной активности в мозге.
- С - Баланс средней активности нейрона определяется взаимодействием регуляторных механизмов ВКМ. В зависимости от величин коэффициентов обратных связей могут наблюдаться 3 режима нейрональной активности (2 из которых бистабильны).
- D - Ответ нейронной сети в присутствии ВКМ на биполярный стимул в случае бистабильного режима.
Текущие задачи проекта включают:
- Исследование устойчивости стационарных состояний нейрона в условиях взаимодействия с ВКМ в зависимости от параметров функций активации различных компонентов ВКМ
- Исследование эффекта активации внеклеточных протеаз на устойчивость стационарных состояний нейрона
- Разработка модели сетевой сигнализации, способной формировать следы памяти за счет активации ВКМ
Работа выполняется при поддержке грантов:
- Грант Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих учёных в российских образовательных учреждениях высшего профессионального образования (№11.G34.31.0012 от 28 ноября 2010 г.)
- Грант федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009 - 2013 годы (№ 14.B37.21.0194 от 20.07.12).
Координатор проекта:
Научные руководители:
д.ф.-м.н. Казанцев Виктор Борисович д.б.н. Дитятев Александр Эдуардович
Коллектив исполнителей:
Казанцев Виктор Борисович Стасенко Сергей Викторович Гордлеева Сусанна Юрьевна Семьянов Алексей Васильевич Дитятев Александр Эдуардович
Вакансии
Студент биологической специальности, выполнение курсовой/дипломной работы. Разработка и компьютерный расчет биофизической модели ВКМ Студент физико-математической специальности (РФ, ФФ, ВМК, ВШОПФ), выполнение курсовой/дипломной работы. Разработка теории устойчивости ВКМ и компьютерное моделирование нейронной сети с ВКМ опосредованной обратной связью.
Читайте также:
- Длительность послеоперационного курса антибиотиков
- Активность туберкулеза при резекции легких. Послеоперационная активность туберкулеза
- Перелом средней трети ключицы. Диагностика и лечение
- История сексологии. Истоки сексологии.
- Психотропный эффект морфина. Влияние галоперидола и аминазина на эмоциональное состояние
