Кровь при патологии наружных покровов. Подтверждение инфекционного диагноза
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
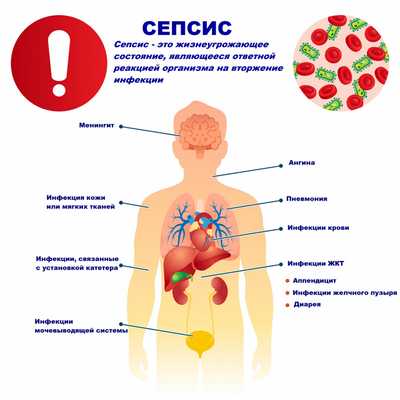
Сепсис - это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок - это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
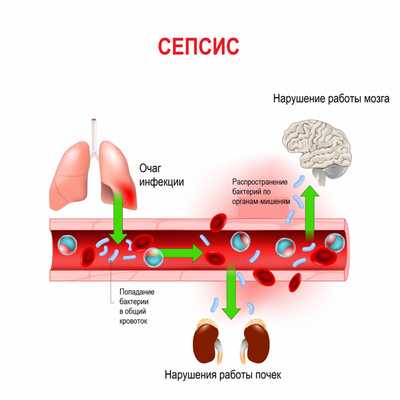
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
Первичный гнойно-воспалительный очаг может возникать прямо у места входных ворот или во внутренних органах. В норме иммунные клетки организма быстро очищают кровь от чужеродных агентов. Но при ослабленном иммунитете инфекционный процесс распространяется и генерализуется, формируются вторичные септические очаги. Бактерии, «путешествуя» по крово- и лимфотоку, активно производят токсины, что приводит к интоксикации и может стать причиной инфекционно-токсического (септического) шока.
В ответ на внедрение возбудителя вырабатываются цитокины - особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) - развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический - развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) - развивается в результате первичной инфекции в полости рта;
- оториногенный - развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный - при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный - развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) - сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) - системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов - 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Диагностика сепсиса
Для постановки диагноза «сепсис» необходимо наличие установленного или предполагаемого очага инфекционного процесса и два или более признака синдрома системной воспалительной реакции.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин - один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном ка�.
Диагностика инфекционных заболеваний
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Идентификация - это комплекс бактериологических методов изучения бактерий, позволяющий определить вид микроорганизма. В Лаборатории «Ситилаб» идентификация большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства: на бланке результата исследования в виде наименования микроорганизма или его рода, например, Streptococcus pneumoniae (пневмококк) или Eschrichia coli (кишечная палочка).
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
В Лаборатории «Ситилаб» определение чувствительности выделенной чистой культуры большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства к широкому спектру современных антибактериальных препаратов (от 6 до 32 препаратов, в зависимости от выделенного микроорганизма) с определением минимальной ингибирующей концентрации (МИК). На бланке результатов определения чувствительности к антибактериальным препаратам обозначение R указывает на резистентность, I - умеренную чувствительность, S - чувствительность микроорганизма к данному препарату.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
1. Обнаружение с диагностической целью антител в сыворотке крови обследуемого. В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, гомологичных применяемому антигену; отрицательный результат указывает на отсутствие таковых. Достоверные результаты получают при исследовании «парных» сывороток крови больного, взятой в начале заболевания (3-7-й день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Раневая инфекция
Раневая инфекция - это комплекс общих и местных патологических проявлений, возникающих при развитии инфекции в случайных или операционных ранах. Патология проявляется болью, ознобом, лихорадкой, увеличением регионарных лимфатических узлов и лейкоцитозом. Края раны отечные, гиперемированные. Наблюдается выделение серозного или гнойного отделяемого, в отдельных случаях образуются участки некроза. Диагноз выставляется на основании анамнеза, клинических признаков и результатов анализов. Лечение комплексное: вскрытие, перевязки, антибиотикотерапия.
МКБ-10
Общие сведения
Раневая инфекция - осложнение раневого процесса, обусловленное развитием патогенной микрофлоры в полости раны. Все раны, в том числе и операционные, как в гнойной хирургии, так и в травматологии считаются первично загрязненными, поскольку какое-то количество микробов попадает на раневую поверхность из воздуха даже при безукоризненном соблюдении правил асептики и антисептики. Случайные раны загрязнены сильнее, поэтому в таких случаях источником инфекции обычно является первичное микробное загрязнение. При операционных ранах на первый план выступает эндогенное (из внутренней среды организма) или внутригоспитальное (вторичное) инфицирование.
Причины
В большинстве случаев возбудителем инфекции в случайных ранах становится стафилококк. Редко в качестве основного возбудителя выступает протей, кишечная и синегнойная палочка. В 0,1% случаев встречается анаэробная инфекция. Через несколько дней пребывания в стационаре флора меняется, в ране начинают преобладать устойчивые к антибактериальной терапии грамотрицательные бактерии, которые обычно становятся причиной развития раневой инфекции при вторичном инфицировании как случайных, так и операционных ран.
Раневая инфекция развивается в случае, когда количество микробов в ране превышает некий критический уровень. При свежих травматических повреждениях у ранее здорового человека этот уровень составляет 100 тыс. микроорганизмов на 1 г ткани. При ухудшении общего состояния организма и определенных особенностях раны этот порог может существенно снижаться.
К числу местных факторов, повышающих вероятность развития раневой инфекции, относится присутствие в ране инородных тел, сгустков крови и некротических тканей. Также имеет значение плохая иммобилизация при транспортировке (становится причиной дополнительной травмы мягких тканей, вызывает ухудшение микроциркуляции, увеличение гематом и расширение зоны некроза), недостаточное кровоснабжение поврежденных тканей, большая глубина раны при малом диаметре раневого канала, наличие слепых карманов и боковых ходов.
Общее состояние организма может провоцировать развитие раневой инфекции при грубых расстройствах микроциркуляции (централизация кровообращения при травматическом шоке, гиповолемические расстройства), нарушениях иммунитета вследствие недостаточного питания, нервного истощения, химических и радиационных поражений, а также хронических соматических заболеваний. Особенно значимы в таких случаях злокачественные новообразования, лейкемия, уремия, цирроз, сахарный диабет и ожирение. Кроме того, снижение сопротивляемости инфекции наблюдается при проведении лучевой терапии и при приеме ряда лекарственных средств, в том числе - иммунодепрессантов, стероидов и больших доз антибиотиков.
Классификация
В зависимости от преобладания тех или иных клинических проявлений гнойные хирурги выделяют две общие формы раневой инфекции (сепсис без метастазов и сепсис с метастазами) и несколько местных. Общие формы протекают тяжелее местных, вероятность летального исхода при них повышается. Самой тяжелой формой раневой инфекции является сепсис с метастазами, который обычно развивается при резком снижении сопротивляемости организма и раневом истощении вследствие потери больших количеств белка.
К числу местных форм относятся:
- Инфекция раны. Является локализованным процессом, развивается в поврежденных тканях с пониженной сопротивляемостью. Зона инфицирования ограничена стенками раневого канала, между ней и нормальными живыми тканями есть четкая демаркационная линия.
- Околораневой абсцесс. Обычно соединен с раневым каналом, окружен соединительнотканной капсулой, отделяющей участок инфекции от здоровых тканей.
- Раневая флегмона. Возникает в случаях, когда инфекция выходит за пределы раны. Демаркационная линия исчезает, процесс захватывает прилежащие здоровые ткани и проявляет выраженную тенденцию к распространению.
- Гнойный затек. Развивается при недостаточном оттоке гноя вследствие неадекватного дренирования или зашивании раны наглухо без использования дренажа. В подобных случаях гной не может выйти наружу и начинает пассивно распространяться в ткани, образуя полости в межмышечных, межфасциальных и околокостных пространствах, а также в пространствах вокруг сосудов и нервов.
- Свищ. Образуется на поздних стадиях раневого процесса, в случаях, когда на поверхности рана закрывается грануляциями, а в глубине сохраняется очаг инфекции.
- Тромбофлебит. Развивается через 1-2 мес. после повреждения. Является опасным осложнением, обусловлен инфицированием тромба с последующим распространением инфекции по стенке вены.
- Лимфангит и лимфаденит. Возникают вследствие других раневых осложнений, исчезают после адекватной санации основного гнойного очага.
Симптомы раневой инфекции
Как правило, патология развивается спустя 3-7 дней с момента ранения. К числу общих признаков относится повышение температуры тела, учащение пульса, ознобы и признаки общей интоксикации (слабость, разбитость, головная боль, тошнота). В числе местных признаков - пять классических симптомов, которые были описаны еще во времена Древнего Рима врачом Аулусом Корнелиусом Сельсусом: боль (dolor), местное повышение температуры (calor), местное покраснение (rubor), отек, припухлость (tumor) и нарушение функции (functio laesa).
Характерной особенностью болей является их распирающий, пульсирующий характер. Края раны отечны, гиперемированы, в полости раны иногда имеются фибринозно-гнойные сгустки. Пальпация пораженной области болезненна. В остальном симптоматика может варьироваться в зависимости от формы раневой инфекции. При околораневом абсцессе отделяемое из раны нередко незначительное, наблюдается выраженная гиперемия краев раны, резкое напряжение тканей и увеличение окружности конечности. Образование абсцесса сопровождается снижением аппетита и гектической лихорадкой.
При раневых флегмонах выявляется существенное повышение местной температуры и резкое ухудшение состояния больного, однако рана выглядит относительно благополучно. Формирование гнойного затека также сопровождается значительным ухудшением состояния пациента при относительном благополучии в области раны. Температура повышается до 40 градусов и более, отмечаются ознобы, вялость, адинамия и снижение аппетита. Гнойное отделяемое отсутствует или незначительное, гной выделяется только при надавливании на окружающие ткани, иногда - удаленные от основного очага инфекции. При свищах общее состояние остается удовлетворительным или близким к удовлетворительному, на коже формируется свищевой ход, по которому оттекает гнойное отделяемое.
Осложнения
Осложнения обусловлены распространением инфекции. При гнойных тромбофлебитах общее состояние ухудшается, в зоне поражения определяются умеренные признаки воспаления, при расплавлении стенки вены возможно формирование флегмоны или абсцесса. Лимфангит и лимфаденит проявляются болезненностью, отечностью мягких тканей и гиперемией кожи в проекции лимфатических узлов и по ходу лимфатических сосудов. Отмечается ухудшение общего состояния, ознобы, гипертермия и повышенное потоотделение. При сепсисе состояние тяжелое, кожа бледная, наблюдается снижение АД, выраженная тахикардия, бессонница и нарастающая анемия.
Лечение раневой инфекции
Лечение заключается в широком вскрытии и дренировании гнойных очагов, а также промывании раны антисептиками. В последующем при перевязках используются сорбенты и протеолитические ферменты. В фазе регенерации основное внимание уделяется стимуляции иммунитета и защите нежных грануляций от случайного повреждения. В фазе эпителизации и рубцевания при больших, длительно незаживающих ранах выполняют кожную пластику.
Прогноз и профилактика
Прогноз определяется тяжестью патологии. При небольших ранах исход благоприятный, наблюдается полное заживление. При обширных глубоких ранах, развитии осложнений требуется длительное лечение, в ряде случаев возникает угроза для жизни. Профилактика раневой инфекции включает в себя раннее наложение асептической повязки и строгое соблюдение правил асептики и антисептики в ходе операций и перевязок. Необходима тщательная санация раневой полости с иссечением нежизнеспособных тканей, адекватным промыванием и дренированием. Пациентам назначают антибиотики, проводят борьбу с шоком, алиментарными нарушениями и белково-электролитными сдвигами.
Порфирия
Порфирия: причины появления, симптомы, диагностика и способы лечения.
Определение
Порфирии (от греч. porphyreis - пурпурный) - это ряд заболеваний обмена веществ, при которых нарушается образование гема, представляющего собой комплексное соединение порфиринов с двухвалентным железом. В результате в организме происходит накопление порфиринов (пигментов, представляющих собой производные порфина) или их предшественников. К счастью, эти патологии встречаются относительно редко ‒ не более 7-12 случаев на 100 000 человек.
Причины появления порфирии
В подавляющем большинстве случаев причиной порфирий становятся генетические мутации, обусловливающие неполноценность активности того или иного фермента, участвующего в синтезе гема. Исключением является поздняя кожная порфирия (спорадическая форма), которая развивается на фоне заболеваний печени (алкогольного гепатита, вирусного гепатита С) или длительной интоксикации тяжелыми металлами.
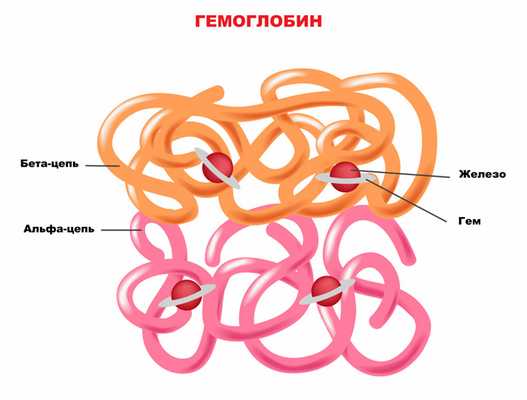
Наследование порфирий происходит по аутосомно-доминантному (наследуется одна нормальная и одна измененная копия гена, причем измененная копия доминирует и «подавляет» нормальную, в результате чего развивается генетическое заболевание) или аутосомно-рецессивному типу (болезнь Гюнтера). Синтез гема проходит 8 последовательных этапов, за каждый из которых отвечает конкретный фермент, кодируемый определенным геном. Соответственно, для каждой формы порфирии существует специфичный ферментативный дефект.
Наибольшее количество гемов образуется в печени и костном мозге. В печени гемы входят в состав белков, участвующих в клеточном дыхании, расщеплении токсичных свободных радикалов и «обезвреживании» различных ксенобиотиков (чужеродных химических веществ, попадающих в организм извне). В костном мозге гемы необходимы для синтеза гемоглобина.
Результатом снижения активности ферментов становится торможение синтеза гемов, что ведет к накоплению его токсичных промежуточных метаболитов.
Провоцирующими факторами развития порфириновой болезни становятся:
- избыточная инсоляция;
- недостаточное питание и скудный рацион;
- систематические стрессы;
- чрезмерное употребление алкоголя;
- вирусные и бактериальные инфекции;
- хронические интоксикации солями тяжелых металлов.
- Беременность.
В отдельных случаях манифестация патологического процесса может произойти на фоне приема некоторых лекарственных препаратов: антибиотиков, антиконвульсантов, нестероидных противовоспалительных средств, пероральных контрацептивов.
В основу разных классификаций порфирий положены различные критерии: клиническая симптоматика, локализация нарушения метаболизма порфиринов или тканевая тропность.
Современная классификация порфирий весьма разветвленная:
I. Эритропоэтические порфирии.
- Эритропоэтическая уропорфирия (врожденная эритропоэтическая порфирия, или болезнь Гюнтера).
- Эритропоэтическая протопорфирия:
- манифестная форма;
- латентная форма.
- Эритропоэтическая копропорфирия.
- Пирролопорфирия (острая перемежающая порфирия, доминантная порфирия шведского типа):
- манифестная форма;
- латентная форма.
- Протокопропорфирия (варигатная, или смешанная порфирия, доминантная порфирия Южно-Африканского типа):
- кожная форма;
- острая форма без кожных проявлений;
- комбинированная форма с кожными и острыми проявлениями;
- латентная форма.
- Урокопропорфирия (поздняя кожная порфирия):
- манифестная приобретенная (симптоматическая) форма (развивается при интоксикациях гексахлорбензолом, опухолях печени и других патологических состояниях;
- манифестная наследственная форма (развивается у лиц с наследственной предрасположенностью);
- латентная наследственная форма (выявляется у родственников больных).
- Наследственная копропорфирия.
- Неклассифицированная печеночная порфирия.
- Гепатоэритропоэтическая порфирия.
- Неклассифицированная печеночная порфирия, протекающая с клиническим синдромом световой оспы.
- Патологические состояния, сопровождающиеся геморрагическим синдромом и нарушениями порфиринового обмена печеночного типа.
- КТ, МРТ преходящих различий плотности и интенсивности печени (ПРПП, ПРИП)
- Перенашивание беременности: причины, симптомы и лечение
- Синдром Клиппеля-Фельдстейна (Klippel-Feldstein)
- Эффективность кюрет и скейлеров в стоматологии. Эффективность ручной чистки корней зубов
- Тромбофлебит при венепункции. Обработка места венопункции
Симптомы порфирии
Сроки дебюта рассмотренных выше форм заболевания различны: эритропический тип проявляется в возрасте 3-5 лет, острый печеночный — в 14-16 лет, хронический печеночный — после 40 лет. После манифестации патологии пациенты сталкиваются со специфической симптоматикой.
При острых формах порфирии больные жалуются на сильные боли в животе, задержку стула, учащенное сердцебиения, повышение артериального давления, изменение цвета мочи (от розового до красно-бурого).
Тяжесть состояния пациента в основном обусловлена неврологическими симптомами - болью и снижением чувствительности по всему телу, прогрессирующей мышечной слабостью, судорожными припадками, различными психическими расстройствами (тревожностью, психомоторным возбуждением, бредом).
При поздней кожной форме на участках кожного покрова, подвергающихся постоянному воздействию солнечного света, формируется гиперпигментация, в результате чего кожа приобретает землистый или бронзовый оттенок.
Выраженными симптомами этой формы порфирии являются везикулезные и буллезные высыпания, которые покрыты корками, шелушение кожи, медленно заживающие эрозии, милиумы.
Кроме того, могут отмечаться явления гипертрихоза (избыточного оволосения) лобно-височной области лица, фотосенсибилизация.
При эритропоэтических порфириях наблюдаются признаки светочувствительности, причем даже более отчетливые, чем при поздней кожной порфирии. Пациент испытывает сильную боль, если на кожный покров попадают прямые солнечные лучи. Обширные эрозии оставляют после себя атрофичексие рубцы, что приводит к обезображиванию внешнего вида больного. В результате множественных атрофических рубцов на коже кистей рук развиваются контрактуры. Избыточное количество порфиринов приводит к тому, что зубная эмаль приобретает красновато-коричневый цвет (эритродонтия), моча становится красной или розовой.
Специфический признак эритропоэтической порфирии - утолщение, огрубение и уплотнение кожи периоральной и периорбитальной зон, крыльев и спинки носа, тыльной поверхности кистей.
Диагностика порфирии
При постановке диагноза учитывается наличие данного заболевания у близких родственников, возраст больного, обстоятельства возникновения симптомов (инсоляция, прием лекарств или алкоголя, голодание, инфекции, беременность).
- Общеклинический № и биохимический анализ крови: АЛТ, АСТ, непрямой билирубин, сывороточное железо, ферритин.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Бактериальная инфекция по анализу крови
Общий анализ крови (ОАК) - это лабораторный метод, позволяющий объективно оценить качественный и количественный состав клеток крови для диагностики различных заболеваний. Подсчет количества лейкоцитов (WBC), процентное соотношение лейкоцитов (лейкоцитарная формула) и СОЭ (скорость оседания эритроцитов) - основные параметры, отражающие активность вирусных и бактериальных инфекций.
Лейкоциты WBC - «белые рыцари» иммунной системы. Лейкопоэз (образование лейкоцитов) происходит в красном костном мозге. В зависимости от морфологических особенностей (размер клетки, форма ядра, наличие специфических гранул) и функции, которую они выполняют, лейкоциты разделяют на две группы: гранулоциты (нейтрофильные, базофильные и эозинофильные лейкоциты), агранулоциты (моноциты, лимфоциты).
· Нейтрофилы (NE) В сосудистом русле в норме циркулируют два типа NE: палочкоядерные (молодые) и сегментоядерные (зрелые). Более юные элементы гранулоцитарного ряда выходят в кровь из красного костного мозга только при патологии. Основная функция NE- уничтожение микроорганизмов, путем распознавания, активного захвата, и переваривания микробного агента (фагоцитоз). Нейтрофилы участвуют во всех этапах воспалительного процесса.
· Эозинофилы (EO)- ведущие форменные элементы в борьбе с паразитами (простейшие, гельминты), принимают участие в аллергических реакциях.
· Базофилы (BA)- принимают участие в аллергических реакциях, а также в регуляции кровообращения посредством секреции гормоноподобных веществ: гистамин, серотонин и гепарин.
· Лимфоциты (LYM)- играют центральную роль во всех иммунологических реакциях организма. Благодаря рецепторам на поверхности клеток, они способны различать "свое" и "чужое". Основная функция LYM- синтез защитных антител и обеспечение иммунной памяти.
· Моноциты (MON)- агранулоцитарные клетки, которые находятся в крови несколько суток, затем покидают кровоток перемещаясь в ткани, где выполняют свою функцию как макрофаги, фагоцитируя частицы более крупных размеров, чем нейтрофилы, а иногда и целые микробные агенты.
· Плазматические клетки (Плазмоциты)- клетки лимфоидной ткани, развивающиеся из клеток - предшественниц В-лимфоцитов, ответственные за выработку антител, в ответ на стимуляцию чужеродными антигенами. В норме в крови плазмоциты не циркулируют.
· СОЭ- определяется интенсивностью и скоростью склеивания эритроцитов в кровеносном русле. Этот параметр косвенно указывает на наличие патологического процесса, например, воспаления, в организме.
Для расшифровки анализа все перечисленные показатели важно оценивать в комплексе, а не по-одному. К тому же, для правильной интерпретации изменений в ОАК необходимо учитывать возрастные особенности лейкоцитарной формулы.
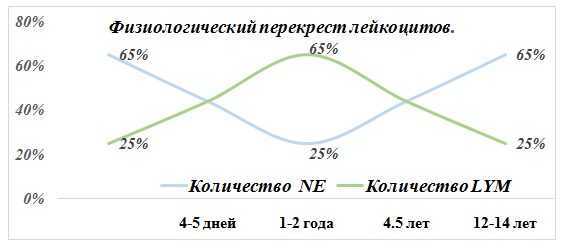
При рождении ребенка количество нейтрофилов(NE) преобладает над содержанием лимфоцитов (LYM). На 4-5 дни величина NE и LYM находится приблизительно на одном уровне (Первый перекрест). Далее, начиная со 2-го месяца жизни ребенка, число NE снова уменьшается, а LYM - возрастает, следом показатель NE нарастает, а LYM снижается. Затем, в 4 года количество клеток примерно одинаково (Второй перекрест). Наконец, к четырнадцатилетнему возрасту, процентное соотношении лейкоцитов (WBC) соответствует показателям взрослого человека.
В таблице представлены показатели процентного соотношения WBC.
Признаки бактериальной инфекции по анализу крови.
Человеческий организм постоянно сталкивается с внешними угрозами в виде патогенных микроорганизмов. При подготовке к возможному повреждению в крови быстро образуется мобильный пул циркулирующих нейтрофилов, в результате ускоренного выхода гранулоцитов из красного костного мозга, прекращения выхода нейтрофилов в ткани и мобилизацией пристеночного пула элементов.
При острых бактериальных инфекциях количество этих элементов в крови резко увеличивается, могут появляться менее зрелые клетки. (Сдвиг влево). Интенсивное разрушение зрелых нейтрофилов в тканях приводит к активной продукции костным мозгом более юных клеток. В крови увеличивается количество как самих лейкоцитов, так и отдельной фракции - нейтрофилов.
Чем выше количество этих клеток, тем более активен воспалительный процесс в организме. Нередко эти изменения помогают выявить признаки бактериальной инфекции по анализу крови у взрослых. При воспалительном процессе бактериальной этиологии, характерно повышение в плазме крови некоторых воспалительных белков (фибриногена, церулоплазмина, иммуноглобулинов). Некоторые из этих белков присоединяются к эритроцитам, следовательно, СОЭ увеличивается в разы.
Анализ крови при вирусной инфекции.
Вирусу для репликации необходима полноценная клетка организма, которую он использует как полигон для производства собственного генома, поэтому вирус находит и поражает определенные клетки, содержащие на своей поверхности специфические рецепторы. Для того, чтобы клетки иммунной системы могли отличать инфицированную клетку от здоровой и уничтожить ее, в качестве «метки зараженности» выступают белки главного комплекса гистосовместимости класса I (MHC I). Так активируются Т-лимфоциты, имеющие на своей поверхности определенные рецепторы, с помощью которых они распознают меченные, а значит инфицированные клетки.
В связи с этим, при острых вирусных заболеваниях в ОАК увеличиваться количество лимфоцитов и/или моноцитов. Общее количество лейкоцитов обычно снижено или в пределах возрастной нормы.
Однако при патологическом процессе вирусной этиологии анализ крови может соответствовать и нормальным показателям здорового человека, а при течении бактериального процесса количество лейкоцитов и абсолютное число нейтрофилов не всегда являются надежным маркером. Именно поэтому для назначения эффективного и адекватного лечения каждый случай должен оцениваться врачом индивидуально.
Кроме того, в настоящее время можно защитить себя и своих родных от многих вирусных и бактериальных инфекций с помощью эффективной и безопасной вакцинации.
Автор: врач-ординатор Университетской клиники H-Clinic Пушик Елена Павловна
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич
Читайте также:
