Макроскопическое исследование опухолей мягких тканей. Получение препаратов сарком.
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Понятие «саркомы мягких тканей» объединяет большое количество новообразований, различных по клиническим и морфологическим признакам. В связи с небольшим числом случаев заболеваний, разнообразием гистологических вариантов и локализацией сарком мягких тканей, определяющих биологическое поведение, клиническое течение и особенности лечения, все пациенты с данным заболеванием должны концентрироваться в отделении, занимающимся лечением сарком.
Что такое саркомы?
Саркомы мягких тканей - это злокачественные новообразования, которые возникают из мягких тканей. Они объединяются в одну группу ввиду сходства их гистопатологических характеристик и клинических проявлений, а также течения опухолевого процесса. Часто рецидивируют с ранним появлением гематогенных метастазов.
Статистика
0,2-2,6% — занимают в структуре онкозаболеваний злокачественные опухоли мягких тканей.
Локализация, % от всех случаев
Конечности — до 60%, в том числе руки — 46%, 13% - ноги.
Голова и шея — 5-10%
Забрюшинное пространство - 13-25%.
Классификация
Выделяют опухоли и опухолеподобные образования следующих тканей и структур:
- фиброзной
- жировой
- мышечной
- лимфоидной
- синовиальной
- мезотелия
- кровеносных сосудов
- плюрипотентной мезенхимы
- эмбриональных структур.
Кроме этого рассматривают опухоли экстрагонадного зародышевого происхождения, опухоли неясного гистогенеза и неопухолевые или сомнительные опухолевые поражения.
Этиология и патогенез
Причины появления сарком мягких тканей не выявлены. Факторы, повышающие риск развития этой патологии:
- Болезнь Педжета (деформирующий остоз);
- Болезнь Рекленгхаузена (нейрофиброматоз);
- Синдром Гарднера (диффузный полипоз толстой кишки);
- Синдром Вернера (множественный эндокринный аденомтаоз);
- Прием анаболических стероидов.
Клиническое течение злокачественных опухолей мягких тканей характеризуется вариабельностью.
К общим признакам сарком мягких тканей относят частые местные рецидивы. Почему саркомы часто рецидивируют? Это объясняют следующими причинами:
- Отсутствие истинной капсулы;
- Склонность к инфильтративному росту;
- Мультицентричный рост.
Клинические симптомы сарком мягких тканей
Симптомы зависят от локализации опухоли. Чаще всего больные обращаются к врачу, обнаружив у себя безболезненную опухоль.
Выраженный болевой синдром наблюдается при поражении надкостницы и кортикального слоя кости, а также при сдавлении опухолью нервных стволов. Присоединение неврологической симптоматики и сосудистых расстройств возможно при сдавлении или прорастании опухолью магистральных сосудов и нервов.
Диагностика сарком мягких тканей
Диагностические исследования включают в себя:
— Осмотр опытного специалиста, врача-онколога; На фото можно увидеть, как выглядит саркома мягких тканей:
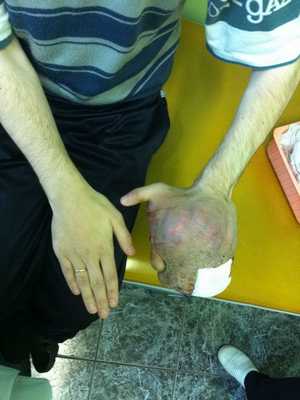
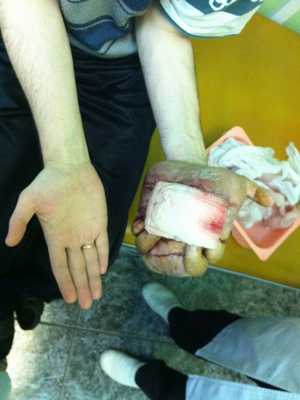
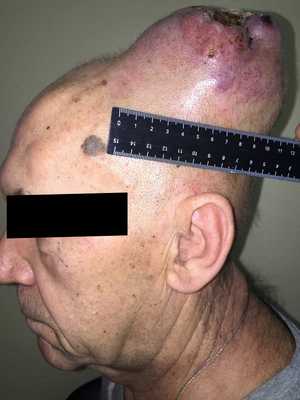
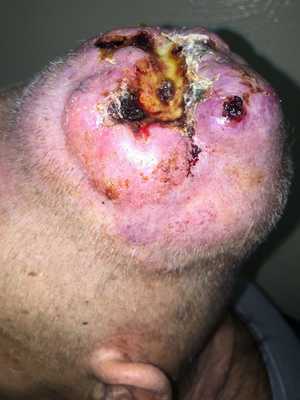
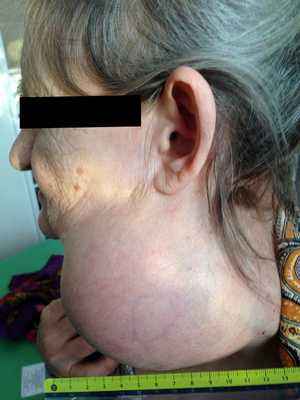
— Рентгенологическое исследование. Позволяет визуализировать тень опухоли, деформацию прилежащих к опухоли фасциальных перемычек, выявить изменения в костях;
— УЗИ опухолей мягких тканей. Это метод диагностики как первичного очага, так и поражения региональных зон. Позволяет определить границы опухоли, связь с окружающими органами, структуру опухоли;
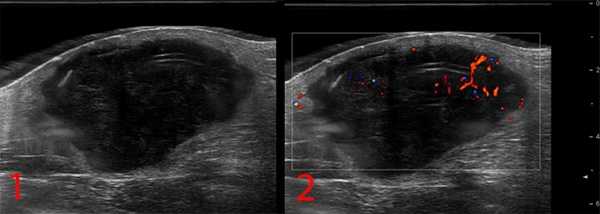
Рисунок №1. Саркома мягких тканей бедра. УЗ-картина в серошкальном и сосудистом режимах визуализации
— КТ первичной опухоли, органов грудной клетки и брюшной полости;
— МРТ первичной опухоли
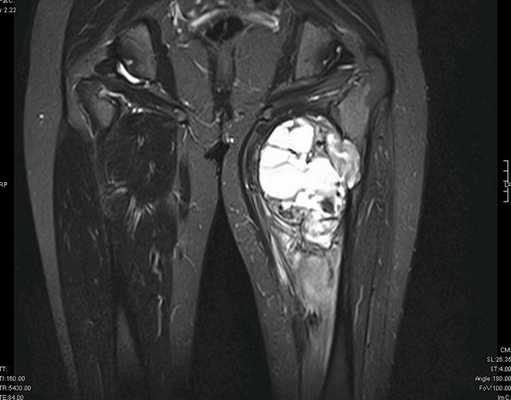
Рисунок №2. Саркома мягких тканей верхней трети левого бедра
— Морфологическая верификация (пункционная биопсия, трепан-биопсия) является самым важным методом диагностики.
После получения результатов осмотра, лабораторной и инструментальной диагностики врач-онколог определяет тактику ведения пациента, согласно современным рекомендациям.
Общие принципы лечения сарком мягких тканей
Лечение сарком мягких тканей должно быть многокомпонентным. Для определения тактики лечения пациента собирается консилиум врачей.
Основной метод:
Дополнительные методы:
Предоперационная лучевая терапия в комбинации с хирургическим лечением позволяет снизить количество рецидивов за счет снижения злокачественного потенциала опухоли и уменьшение ее объема.
Применяется интраоперационная лучевая терапия, т.е. облучение опухоли во время операции с целью подавления субклинических очагов и наращивания лучевой дозы.
В комбинации с хирургическим лечением также применяется химиотерапия. Была отмечена тенденция к улучшению показателей выживаемости, однако данный метод не считается стандартом в лечении сарком мягких тканей.
Лечение после операции
Послеоперационная лучевая терапия выполняется с целью предупреждения развития рецидивов и диссеминирования заболевания.
Химиотерапия является основным методом лечения диссеминированного процесса при мягкотканых саркомах.
Саркома мягких тканей — прогноз выживаемости
Прогностические факторы тесно связаны со стадией болезни, радикализмом операции и морфологическим типом опухоли.
Процент выживаемости при саркомах мягких тканей зависит от размера опухоли, глубины поражения, степени злокачественности. Также очень важен такой фактор, как ответ опухоли на специальное лечение.

Авторская публикация:
ГАФТОН ИВАН ГЕОРГИЕВИЧ
врач-онколог
НИИ онкологии им Н.Н. Петрова
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки:
Публикации по теме:
Методами терапии детей и подростков с мягкотканными саркомами и редкими опухолями мягких тканей являются операция ?, лучевая терапия ?, химиотерапия ?, либо комбинация этих видов лечения.
Набор методов лечения в том или ином случае зависит от анамнеза пациента и его особенностей, тактика лечения определяется лечащим врачом или консилиумом и является индивидуальной.
Саркомы мягких тканей
Термином "саркомы мягких тканей" обозначают группу злокачественных опухолей, возникающих во внескелетных мягких и соединительных тканях. Подобные опухоли объединяются в одну группу ввиду сходства их гистопатологических характеристик и клинических проявлений, а также течения опухолевого процесса.
Злокачественные опухоли мягких тканей составляют 0,2-2,6% в общей структуре злокачественных новообразований человека. Почти все злокачественные опухоли мягких тканей являются саркомами, которые составляют 0,7% всех злокачественных опухолей человека. В Республике Казахстан абсолютное число вновь выявленных заболеваний в 1993 г. составило 235, в 2002 г. - 192.
Чаще всего эти опухоли отмечаются в возрасте 20-50 лет. У детей в структуре онкологической заболеваемости саркомы составляют 10-11%. Преимущественная локализация сарком мягких тканей - конечности (до 60%), причем примерно 46% - нижние конечности и около 13% - верхние. На туловище эти опухоли локализуются в 15-20% случаев, на голове и шее - в 5-10%. На забрюшинное пространство приходится 13-25%.
Протокол «Саркомы мягких тканей».
Пользователи протокола: рай.онколог, врач-онколог поликлиники диспансера, врач-онколог стационара диспансера.
Не имеем финансовую или другую заинтересованность в теме обсуждаемого документа. Не имели в последние 4 года отношения к продаже, производству или распространению препаратов, оборудования и т.п.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Согласно с морфологическими кодами ICD-O по системе TNM классифицируются следующие гистологические типы опухолей:
Гистологические типы опухолей, не включаемые в классификацию TNM: ангиосаркома, саркома Капоши, дерматофибросаркома, фиброматоз (десмоидная опухоль), саркома исходящая из твердой мозговой оболочки, головного мозга, полых или паренхиматозных органов (за исключением саркомы молочной железы).
Регионарными лимфатическими узлами являются узлы, соответствующие локализации первичной опухоли. Поражение регионарных лимфатических узлов наблюдается редко и в случае, когда их состояние невозможно определить клинически или патологоанатомически, они классифицируются как N0 вместо NX или pNX.
Правила классификации. Должно быть гистологическое подтверждение диагноза, позволяющее определить гистологический тип опухоли и степень злокачественности.
* поверхностная опухоль локализуется исключительно выше поверхностной фасции без инвазии в фасцию; глубокая опухоль локализуется либо исключительно ниже поверхностной фасции или поверхностно по отношению к фасции, но с инвазией или прорастанием через нее. Саркомы забрюшинного пространства, средостения и таза классифицируют как глубокие опухоли
R2 - макроскопическая остаточная опухоль.
Резюме
С аркома мягких тканей
Диагностика
Диагностические критерии (описание достоверных признаков заболевания в зависимости от степени тяжести процесса)
Жалобы: появление и постепенный рост опухолевого образования мягких тканей. Появление и нарастание болевого синдрома. Нарушение движений в конечности.
Физикальное обследование: наличие опухоли мягких тканей. Пальпаторно болезненность. Видимое нарушение функции конечности.
Показания для консультации онколога: наличие опухолевого образования мягких тканей. Наличие рентгенологических (УЗИ, КТ) данных опухолевого поражения мягких тканей.
- биохимический анализ крови (общий белок, креатинин, мочевина, билирубин, трансаминазы, щелочная фосфатаза, ионы - Na, K, Ca, Cl, глюкоза);
- морфологическая верификация заболевания с установлением гистологического типа и степени дифференцировки опухоли (трепано- или открытая биопсия):
- при небольших или глубокозалегающих опухолях трепанобиопсию выполняют под ультрасонографическим или рентгенографическим контролем;
- при ножевой биопсии разрез не должен затруднять последующий выбор варианта оперативного вмешательства;
- цитологическое исследование (не заменяет гистологической верификации диагноза):
- мазков-отпечатков материала, взятого с помощью ножевой или трепанобиопсии;
- ультразвуковое исследование органов брюшной полости;
- артериография (выполняется при локализации опухоли в области прохождения крупных магистральных сосудов);
Дифференциальный диагноз
| № | Доброкачественные опухоли костей / агрессивное течение | Злокачественные опухоли костей |
| 1. | Фиброма | Фибросаркома |
| 2. | Липома | Липосаркома |
| 3. | Нейрофиброматоз | Рабдомиосаркома |
| 4. | Гемангиома | Злокачественная мезенхимома |
| 5. | Злокачественная гистиоцитома |
Лечение
Цель лечения: удаление опухоли, профилактика отдаленного метастазирования и пораженных лимфоузлов (при их наличии).
Хирургический метод в качестве самостоятельного вида используется при лечении первичных высокодифференцированных опухолей (Т1а) при условии возможности выполнения радикального хирургического вмешательства. В остальных случаях лечение комбинированное или комплексное, ведущим и решающим компонентом которого является хирургическое удаление опухоли.
Лечебная программа строится с учетом гистологической степени злокачественности, распространения процесса, размеров и локализации опухоли.
- оперативные вмешательства по поводу сарком мягких тканей выполняются под наркозом или проводниковой анестезией (при наличии противопоказаний к наркозу);
- границы резекции тканей отмечаются металлическими скобками (для планирования послеоперационной лучевой терапии и при нерадикальном удалении опухоли).
Простое иссечение - используется исключительно в качестве этапа морфологической диагностики злокачественных опухолей.
Широкое иссечение. При этой операции опухоль удаляют в пределах анатомической зоны, в едином блоке с псевдокапсулой и отступя от видимого края опухоли на 4-6 см и более. Широкая местная резекция применяется при опухолях низкой степени злокачественности, поверхностных, располагающихся выше поверхностной фасции, в коже, подкожной клетчатке (небольшие фибросаркомы, липосаркомы, десмоиды, дерматофибросаркомы). Эту операцию не выполняют при саркомах высокой степени злокачественности.
Радикальная операция. Эта операция предпринимается при глубоко располагающихся саркомах высокой степени злокачественности. Она предусматривает удаление опухоли и окружающих ее нормальных тканей с включением в единый блок фасций и неизмененных окружающих мышц, которые удаляются полностью с отсечением у места прикрепления. При необходимости производят резекцию сосудов, нервов, костей, прибегая одномоментно к соответствующим реконструктивным пластическим операциям на сосудах, нервах, костях, суставах.
Органосохраняющие и функционально-щадящие хирургические вмешательства при местно-распространенных злокачественных опухолях мягких тканей конечностей выполняются исключительно в рамках комбинированного и комплексного лечения. Контроль радикальности оперативного вмешательства осуществляют путем срочного интраоперационного гистологического исследования краев отсечения опухоли от нормальных тканей.
Ампутации и экзартикуляции. Ампутация и экзартикуляция конечности показаны в случаях, когда выполнение радикальной сберегающей операции не представляется возможным из-за массивного поражения (вовлечение в опухолевый процесс суставов, костей, магистральных сосудов и нервов на большом протяжении) и/или при неэффективности курсов неоадъювантного лечения.
Лучевая терапия используется в рамках комбинированного и комплексного лечения. Применяется лучевая терапия с использованием глубокофокусной R-терапии, электронного пучка или Υ-терапии, как правило, в виде предоперационного или послеоперационного курса в СОД 50-70 Гр в режиме классического фракционирования. Выбор источника облучения и энергии электронного пучка определяется локализацией и глубиной залегания опухоли.
Для равномерного подведения дозы облучения ко всей заинтересованной зоне применяются многопольные методики облучения с использованием приспособлений для формирования оптимальных дозных полей. Границы полей облучения должны превышать размеры опухоли на 3-4 см. При больших размерах опухоли и/или высокой степени злокачественности поле облучения должно включать до 10 см тканей проксимальнее и дистальнее границ опухоли. В этом случае после достижения СОД 45-50 Гр поле облучения сокращается до размеров опухоли.
При опухолях, локализующихся на конечностях, для снижения вероятности развития лучевого остеонекроза используются дополнительные косые поля, выходящие за пределы облучаемых тканей. В идеальном случае с целью уменьшения выраженности фиброза, контрактуры мышц и отека, следует исключить из поля облучения до 1/3 окружности конечности. Минимальная ширина необлучаемых тканей должна составлять: на предплечье 2 см, на голени 3 см, на бедре 4 см.
Послеоперационная лучевая терапия проводится при получении гистологического заключения о высокой степени злокачественности и мультицентрическом росте опухоли (если не проводилась предоперационная лучевая терапия), а также при условно радикальном или нерадикальном удалении опухоли. Начало проведения лучевой терапии не позднее 4-х недель после выполнения оперативного вмешательства.
Если предоперационная лучевая терапия не проводилась, в зону облучения включают ложе удаленной опухоли (границы отмечаются танталовыми скрепками во время операции), окружающие ткани с отступом от краев отсечения на 2 см и послеоперационный рубец (СОД 60 Гр). При наличии остаточной опухоли, которая должна быть маркирована титановыми скрепками во время операции, эта зона дополнительно локально облучается до СОД не менее 70 Гр.
В послеоперационном периоде возможно дополнительное использование брахитерапии в ложе опухоли. При самостоятельной брахитерапии рекомендуемая СОД 45 Гр, которая подводится в течение 4-6 дней.
При нерезектабельности опухоли проводится лучевая терапия по радикальной программе в СОД 70 Гр в режиме классического фракционирования.
1. IА стадия (T1а,Т1b N0, NX M0 - низкая степень злокачественности): широкое иссечение опухоли в пределах анатомической зоны.
2. IB стадия (T2a, Т2b N0, NX M0 - низкая степень злокачественности): хирургическое удаление опухоли (T2a широкое иссечение, Т2b радикальная операция) + курс послеоперационной лучевой терапии (необходимость определяется результатами окончательного гистологического исследования);
3. При местно-распространенной опухоли, когда невозможно выполнить на первом этапе радикальное хирургическое лечение, проводится курс предоперационной лучевой терапии.
4. С целью повышения эффективности неоадъювантного лечения при планировании органосохраняющего оперативного вмешательства в систему лечения включают методы регионарной химиотерапии (внутриартериальное введение химиопрепаратов).
5. При образовании обширного раневого дефекта после хирургического удаления опухоли, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики:
- пластика перемещенными островковыми лоскутами на сосудистых ножках, аутотрансплантация комплексов тканей с использованием микрохирургической техники.
6. При невозможности выполнения органосохраняющего лечения, обусловленной местной распространенностью опухолевого процесса и неэффективностью неоадъювантного лечения, проводится ампутация конечности.
- при образовании обширного раневого дефекта после хирургического удаления опухоли, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики.
- пред- или послеоперационная лучевая терапия (предпочтение следует отдавать проведению лучевой терапии в условиях локальной СВЧ-гипертермии) + хирургическое удаление опухоли (T2a широкое иссечение, Т2b радикальная сохранная операция) + 3-4 курса адъювантной полихимиотерапии;
- с целью повышения эффективности неоадъювантного лечения при планировании органосохраняющего оперативного вмешательства, в систему лечения включают методы регионарной химиотерапии (в/венное или внутриартериальное введение химиопрепаратов);
- при образовании обширного раневого дефекта, который невозможно устранить сведением краев раны, выполняется один из видов первичной пластики;
- при невозможности выполнения органосохраняющего лечения в связи с местной распространенностью опухоли и отсутствием клинического эффекта после проведения неоадъювантного лечения проводится ампутация конечности.
- комплексное лечение проводится по принципам лечения сарком мягких тканей I-III стадий с учетом степени дифференцировки опухоли и местного распространения опухолевого процесса;
- хирургический компонент предусматривает, кроме вмешательства на первичном очаге (органосохраняющая или органоуносящая операция), типичную регионарную лимфодиссекцию, которая выполняется одномоментно с операцией на первичной опухоли (одноблочно или поэтапно) либо в отсроченном порядке (в зависимости от зоны поражения и общего состояния больного).
- проводится паллиативное и симптоматическое лечение по индивидуальным программам с включением полихимиотерапии и/или лучевой терапии;
- хирургические вмешательства выполняются с целью уменьшения опухолевой массы или по санитарным показаниям (ампутация конечности).
1. Метотрексат - 7-12 г/м 2 в/в с фолинатом кальция либо фолинатом натрия. 4 курса с интервалом 2 нед.
Саркома мягких тканей
Саркома мягких тканей - это группа редких злокачественных новообразований мезодермального происхождения, которые развиваются из жировой клетчатки, мышечной и фиброзной ткани, оболочек периферических нервов. Клинические проявления опухоли включают локальное уплотнение, болевой синдром и нарушение функции органа на поздних стадиях заболевания. Для диагностики применяются методы визуализации (УЗИ, КТ, МРТ), гистологическая верификация, лабораторные исследования. Комплексное лечение саркомы требует проведения радикальных хирургических вмешательств, лучевой терапии, полихимиотерапии и таргетной терапии.
МКБ-10



Общие сведения
Хотя мягкие ткани занимают 50% веса тела, распространенность сарком невелика. В мире они составляют 1-2,5% от всех видов злокачественных опухолей у взрослых, до 15% - у детей. В России ежегодно диагностируется более 10 тыс. новых эпизодов болезни, что составляет 1% от всей онкопатологии или 30 случаев на 1 млн. населения. Несмотря на постоянное развитие онкологии, терапия сарком мягких тканей (СМТ) остается недостаточно эффективной. Большую актуальность имеет разработка таргетных препаратов и иммунотерапии для повышения результативности и радикализма лечения.

Причины
Точные этиологические факторы развития саркомы пока не установлены. В научной онкологии ведутся диспуты по поводу роли химических канцерогенов (инсектициды, гербициды, хлористый винил) и неблагоприятного радиационного фона. Среди предрасполагающих факторов называют генетические болезни: нейрофиброматоз, синдромы Гарднера и Ли-Фраумени. Некоторые авторы к причинам СМТ причисляют хроническую лимфедему.
Патогенез
Развитие саркомы подчиняется классическим законам патофизиологии опухолевого роста. Клетки новообразования отличаются утратой верхнего лимита Хайфлика и отсутствием контактного торможения, что обуславливает их неконтролируемые циклы деления. Опухолевая ткань имеет метаболический и энергетический атипизм, высокую способность к анаэробному гликолизу и развитию в условиях гипоксии.
Для сарком характерна интенсивная васкуляризация. Процессы ангиогенеза играют решающую роль в развитии и метастазировании опухолей, определяют их агрессивный инвазивный рост. Образование сосудов контролируется VEGF - фактором роста эндотелия, который признан важнейшим промоутером ангиогенеза. Он активизируется на фоне клеточной гипоксии, связывается со специфическими рецепторами и вызывает пролиферацию эндотелиальных клеток.
Самые распространенные гистологические подтипы сарком мягких тканей включают злокачественные фиброзные гистиоцитомы (28%), липосаркомы (15%), лейомиосаркомы (12%) и неклассифицируемые саркомы (11%). Реже встречаются рабдомиосаркомы (5-6%), фибросаркомы (3%). В практической онкологии широко используется клиническая классификация TNM, согласно которой существует 4 стадии заболевания:
- Iстадия. Характеризуется размером первичной опухоли до 5 см, низким уровнем злокачественности клеток, отсутствием регионарных и отдаленных метастазов.
- IIстадия. Устанавливается при любом размере поверхностной опухоли или глубоком новообразовании диаметром менее 5 см. Любые признаки метастазирования отсутствуют.
- IIIстадия. Определяется при появлении метастазов в регионарных лимфатических узлах либо при диаметре глубокой опухоли свыше 5 см без признаков метастазирования.
- IVстадия. Регистрируется при образовании метастазов саркомы в регионарных лимфоузлах или любых других органах тела.

Симптомы саркомы мягких тканей
К типичным локализациям новообразования относят нижние конечности и висцеральные органы (по 26%), в 23% случаев опухоли располагаются ретроперитонеально или интраабдоминально. Около 12% СМТ расположены на верхних конечностях, 8% - на грудной клетке, не более 5% - в области головы и шеи. Клиническая картина сарком мягких тканей разнообразна, определяется их размерами, локализацией, стадией болезни и степенью злокачественности клеток.
При локализации опухоли в поверхностных мягких тканях пациенты самостоятельно обнаруживают новообразование, которое постепенно разрастается, приобретает плотную структуру. Некоторые больные ошибочно принимают симптомы за признак травмы и не обращаются к врачу. Позже в пораженном отделе тела возникают боли, онемение, покалывание. При крупных образованиях человек испытывает неудобства при ходьбе, ношении одежды.
При длительном существовании новообразования его поверхность изъязвляется, кровоточит, нагнаивается. Опухоль малоподвижна, при ее ощупывании удается определить участки размягчения (распада). В тяжелых случаях пораженная конечность теряет свою функциональность. При саркомах брюшной и грудной полости основным признаком выступают боли, которые имитируют заболевания соответствующих органов.
Осложнения
Саркомы склонны к бурному росту и быстрому метастазированию. При поздней диагностике образования в 100% случаев присутствует поражение близлежащих лимфатических узлов. В отдаленное метастазирование в основном вовлекаются легкие. Независимо от локализации СМТ у больных развивается клинический синдром раковой интоксикации, осложняющийся иммунной недостаточностью, нарушениями функций внутренних органов.
Ведущую проблему при СМТ составляет отложенное начало лечения опухоли, которое сопряжено с худшим прогнозом выживаемости. Несвоевременная диагностика обусловлена как поздней обращаемостью пациентов, так и отсутствием онкологической настороженности у терапевтов и специалистов вторичного звена (гастроэнтерологов, пульмонологов, ортопедов-травматологов).
Обследование при подозрении на саркому мягких тканей требует проведения расширенного комплекса инструментальных и специализированных лабораторных методов. Диагностика выполняется под руководством врача-онколога в специализированном отделении. План исследований различается с учетом локализации новообразования, однако базовая программа при всех видах СМТ включает следующие методы:
- УЗИ мягких тканей. Методика эффективна для обнаружения поверхностно расположенных новообразований в любой части тела. Благодаря неинвазивности и безопасности сонография назначается на первом этапе постановки диагноза пациентам с подозрительными образованиями.
- Рентгеновская визуализация.КТ брюшной полости, легких, головного мозга и других органов определяет висцеральное расположение первичной опухоли или ее метастазов. Широко применяется КТ мягких тканей нижних и верхних конечностей.
- Магнитно-резонансная томография.МРТ более информативна при визуализации мягких тканей и внутренних органов, поэтому рекомендуется в рамках уточняющей диагностики.
- Сцинтиграфия костей. Исследование назначается всем пациентам с подозрением на метастатическое поражение скелета. Результаты сцинтиграфии необходимы для быстрого обнаружения вторичных костных опухолей любой локализации.
- Гистологический анализ. При морфологическом исследовании материала аспирационной биопсии или образца резецированной опухоли определяют ее морфологические характеристики: степень злокачественности, тип мутировавших клеток, наличие иммунологических маркеров.
- Лабораторная диагностика. Для оценки общего состояния здоровья онкологического пациента применяются клинический и биохимический анализы крови, коагулограмма. Обязательно проводят измерение уровня онкомаркеров.
Дифференциальная диагностика
Основные трудности при постановке диагноза возникают при дифференцировке доброкачественных и злокачественных образований мягких тканей. Клинико-инструментальные данные имеют ограниченную ценность, поэтому подтвердить СМТ удается только гистологическим исследованием. Опухоль также необходимо отличать от:

Лечение саркомы мягких тканей
Консервативная терапия
Предоперационная лучевая терапия и химиотерапия используются для уменьшения размеров новообразования, расширения возможностей оперативного вмешательства и уменьшения риска интраоперационного метастазирования. При определении дозы облучения руководствуются международными протоколами с учетом клинической ситуации у конкретного пациента. Единые стратегии лечения пока не разработаны.
Адъювантная химиотерапия используется как ведущий метод лечения распространенных форм саркомы мягких тканей, когда нет возможности провести радикальную операцию. Для повышения эффективности применяются комбинированные режимы AI, GemTax, MAID и другие. В группе пациентов старше 65 лет методом выбора признана монотерапия препаратами антрациклинового ряда.
Хирургическое лечение
Оперативное вмешательство - основной этап радикального лечения поверхностно расположенных сарком. Чаще всего к помощи хирургов прибегают при локализации опухоли на конечностях, где удается ее полностью резецировать с адекватным косметическим результатом. Преимущество отдается органосохраняющим операциям, которые проводятся в 10% случаев. Ампутации и экзартикуляции выполняются при отсутствии менее травматичных альтернатив.
При СМТ по возможности соблюдается принцип радикальности вмешательства, который предполагает одномоментное удаление образования в мышечно-фасциальном футляре. Такой вариант имеет наилучший отдаленный прогноз выживаемости. Пациентам с терминальными стадиями саркомы рекомендованы нерадикальные и паллиативные операции, направленные на улучшение качества жизни.
Экспериментальное лечение
При саркомах мягких тканей применяется таргетная терапия ингибиторами ангиогенеза. Лечение проводится моноклональными антителами, которые угнетают биологическую активность VEGF, уменьшают васкуляризацию опухоли и препятствуют ее инвазивному росту. Анти-VEGF терапия снижает сосудистую проницаемость и внутриопухолевое давление, что делает новообразование более чувствительным к классической химиотерапии.
Прогноз и профилактика
Для контроля состояния здоровья и предупреждения рецидивов пациентам показано динамическое наблюдение после окончания комбинированного лечения. В течение 2-х лет посещения врача планируются каждые 3 месяца, затем переходят на осмотры раз в полгода на протяжении еще 3-х лет. Обследование включает опрос, сдачу комплекса анализов, УЗИ послеоперационного рубца и КТ органов грудной клетки.
Уровень 5-летней выживаемости пациентов с саркомой, выявленной на I стадии, составляет 60%. При запоздалой диагностике показатели успешности терапии снижаются до 10%. Прогностически неблагоприятными признаны размеры СМТ 5 см и более, возраст пациента старше 60 лет, высокая степень злокачественности. Первичная профилактика включает неспецифические меры: отказ от вредных привычек, употребление антиканцерогенных веществ, регулярные чек-апы здоровья.
2. Практические рекомендации по лекарственному лечению сарком мягких тканей/ А.А. Феденко, А.Ю. Бохян, В.А. Горбунова, А.Н. Махсон, В.В. Тепляков// RUSSCO. Версия 2017.
3. Таргетная терапия в лечении сарком мягких тканей/ А.А. Феденко//Практическая онкология. - 2013. - №2.
4. Современные подходы к лечению сарком мягких тканей/ М.Д. Алиев// Практическая онкология. - 2004. - №4.
Макроскопическое исследование опухолей мягких тканей. Получение препаратов сарком.
1 ГБОУ ВПО «Тюменская государственная медицинская академия» Минздравсоцразвития России, Тюмень, Россия
Научная литература, посвященная проблеме хирургического лечения саркомы мягких тканей, содержит противоречивые мнения относительно иссечения кожного лоскута над опухолью. Хирургической метод лечения сарком мягких тканей сопровождается частым развитием локального рецидива. Это послужило основанием для поиска новых методов и схем в лечении сарком мягких тканей. Применение комбинированного лечения больных с саркомами мягких тканей при локализации на конечностях расширило рамки органосохранных операций, значительно снизило процент локальных рецидивов опухоли. Большое внимание в современной литературе уделяется прогностическим факторам, влияющим на клинические результаты лечения сарком мягких тканей.

1. Алиев М.Д., Соловьев Ю.Н., Хараташвили Т.К. и др. Хондросаркома кости. - М. : Инфра-М, 2006. - 216 с.
2. Алиев М.Д., Мехтиева Н.И., Бохян Б.Ю. Факторы прогноза сарком мягких тканей // Вопр. онкологии. - 2005. - Т. 51. - № 3. - С. 288-299.
3. Горбунова В.А., Феденко А.А. Трабектедин: новые возможности химиотерапии диссеминированных сарком мягких тканей // Реферативный журнал «РМЖ». - 2009. - 29 апреля.
4. Кешта Р.А., Степанова Е.В. Экспрессия молекулярно-биологических маркеров и их прогностическая значимость при синовиальной саркоме // Актуал. вопр. клин. онкологии. - 2002. - Т. 4. - № 4. - С. 34-37.
5. Краевский Н.А., Смольянников А.В., Саркисов Д.С. Патолого-анатомическая диагностика опухолей человека : руководство : в 2 т. - М. : Медицина, 1993. - 1248 с.
6. Arce F.P., Pinto J., Portero I. et al. Cutaneous metastases as initial manifestation of dedifferentiated chondrosarcoma of bone. An autopsy case with review of the literature // J. Cutan. Pathol. - 2000. - Vol. 27 (5). - P. 262-267.
7. Bruns J., Fiedler W., Werner M., Delling G. Dedifferentiated chondrosarcoma fatal disease // J. Cancer Res. Clin. Oncol. - 2005. - Vol. 131 (6). - P. 333-339.
8. Delaney T.F., Spiro I., Suit H.D. et al. Neoadjuvant chemotherapy and radiotherapy for large extremity soft tissue sarcomas // Proc. ASTRO. - 2001. - Vol. 51. - P. 148.
9. Doganavsargil B., Argin M., Sezak M. et al. Dedifferentiated chondrosarcoma of the thumb: a case report // Arch. Orthop. Trauma Surg. - 2009. - Vol. 129 (2). - P. 161-166.
10. Evans H.L., Ayala A.G., Romsdahl M.M. Prognostic factors in chondrosarcoma of bone: a clinicopathologic analysis with emphasis on histologic grading // Cancer. - 1977. - Vol.40. - P.818-831.
12. Fletcher C.D.M., Unni K.K., Mertens F. Pathology and Genetics of Tumors of Soft Tissue and Bone. Lyon, France: IARC Press; 2002. World Health Organization Classification of Tumours. - Vol. 5. - Р. 70.
13. Le Cesne A et al. Phase II study of ET-743 in advanced soft tissue sarcomas: a European Organisation for the Research and Treatment of Cancer (EORTC) soft tissue and bone sarcoma group trial // J Clin.Oncol. - 2005. - Vol. 23. - P. 576-84.
14. Martinez N., Sanchez-Beato M., Carnero A., et al. Transcriptional signature of Ecteinascidin 743 (Yondelis, Trabectedin) in human sarcoma cells explanted from chemo-naive patients // Mol Cancer Ther. - 2005. - Vol. 4. - P. 814-23.
16. O'Sullivan B., Davis A., Group C.S. et al. Effect on radiotherapy field sizes in recently completed Canadian Sarcoma Group and NCL Canada Clinical Trials Group randomized trial comparing pre-operative and post-operative radiotherapy in extremity soft tissue sarcoma // Int. J. Radiat. Oncol. Biol. Phys. (abstr.). - 1999. - Vol. 45. - Р. 238.
17. Pisters P.W.T., Patel S.R., VarmaD.G.K. et al. Preoperative chemotherapy for stage IIIB extremity soft tissue sarcoma: long-term results from a single institution // J. Clin. Oncol. - 1997. - Vol. 15. - P. 3481-3487.
18. Schöffski P., Huygh G., Clement P. et al. Tumor control and objective responses : single-center experience with Ecteinascidin-743 (ET-743, Yondelis), an active compound for the treatment of patients with advanced soft tissue and bone sarcomas. Proc ASCO 2005 : 23 ; (abstract 9027).
19. Xu X.L., Li B., Sun X.L., Li L.Q. Clinical significance of mdm2 and p53 expression in orbital rhabdomyosarcoma // Zhonghua Yan Ke Za Zhi. - 2004. - Vol. 40. - № 11. - P. 755-759.
Саркомами мягких тканей являются злокачественные мезенхимальные опухоли (за исключением опухолей ретикулоэндотелиальной системы и опорной ткани), а также нейроэктодермальные новообразования из периферической нервной системы. В настоящее время описано более 30 различных гистологических типов сарком мягких тканей. Критерии точного определения клеточного источника той или иной опухоли остаются предметом споров между гистопатологами [5]. Из понятия «мягкотканные саркомы» исключены опухоли средостения, орбит и забрюшинного пространства. В клиниках ряда зарубежных стран к мягкотканным саркомам отнесены и опухоли средостения, и опухоли забрюшинного пространства ввиду их сходного гистогенеза. Саркомы мягких тканей встречаются сравнительно редко, составляя 0,2-2,6% по отношению ко всем злокачественным новообразованиям человека [2; 3; 5].
Показатель заболеваемости составляет 1,7 чел. у мужчин и 1,6 чел. у женщин на 100 000 населения. У 60% больных саркома мягких тканей поражает конечности, из них более чем у двух третей пациентов опухоль локализуется на нижних конечностях [4; 7; 10; 19]. По данным различных авторов, особенностью сарком мягких тканей является частое гематогенное метастазирование от 24 до 52,6% и значительно реже - лимфагенное от 2,9 до 10% [1; 2; 9; 11].
Долгое время единственным вариантом лечения больных с саркомами мягких тканей являлся хирургический метод, который остается наиболее распространенным и в настоящее время. После местного иссечения, проведенного в качестве самостоятельного метода лечения, высока частота локальных рецидивов: от 38,8 до 81,1% [1; 12; 15; 18]. Удаление саркомы мягких тканей в пределах ее псевдокапсулы сопровождается рецидивированием опухоли приблизительно у 90% больных, при широком местном иссечении опухоли (с небольшими участками окружающих ее здоровых тканей) отмечается 40%-ная частота рецидивов. Авторы этих работ отмечают, что радикальное местное иссечение опухоли (удаление в пределах анатомической структуры или мышечной группы либо ампутация) сопровождается локальными рецидивами в пределах 10-15% случаев [8; 13; 16].
Нет единого мнения относительно границ резекции здоровых тканей. Петерсон Б.Е. (1976), указывает, что границы захвата здоровых тканей должны быть в пределах 5-8 см от края опухоли. Другие не определяют конкретные границы иссечения окружающих опухоль тканей. Опухоль удаляется широко вместе с окружающими ее тканями так, чтобы не видеть ее поверхность [1; 17]. По мнению Sugarbaker P.H., Malawer M.M. (1992), саркома мягких тканей должна иссекаться с 2-3-сантиметровым захватом здоровых тканей. Указанные авторы, к сожалению, трактуют границы иссечения окружающих опухоль мягких тканей без учета локализации [4; 6].
Локализация саркомы в области крупных суставов или в дистальных участках конечностей изначально исключает 6-сантиметровый захват окружающих тканей в единый блок с опухолью. В данной клинической ситуации интраоперационная диагностика отсутствия опухолевой инфильтрации по линии резекции дает возможность более экономного иссечения, особенно подлежащих здоровых тканей. В последнем утверждении неоспоримым фактором радикализма хирургического вмешательства служит контрольное иссечение краев раны для микроскопического исследования. При отсутствии опухолевого роста в крае резекции радикализм является достигнутым. Микроскопическое исследование линии резекции должно производиться до закрытия послеоперационной раны, так как опухолевая инфильтрация по линии резекции сопровождается высоким риском локальных повторных рецидивов [11; 13; 16; 18; 19].
Научная литература, посвященная проблеме хирургического лечения саркомы мягких тканей, содержит противоречивые мнения относительно иссечения кожного лоскута над опухолью. James C., Harvey M.D., Edward J., Beattie M.D. (1996) рекомендуют проводить иссечение кожного лоскута над опухолью с послеоперационным рубцом и биопсионным каналом при поверхностно залегающих саркомах мягких тканей, а также в случаях инфильтрации кожи опухолью без учета зон облучения в предоперационном и послеоперационном периодах [1].
Применение васкулизированых лоскутов позволяет пластировать раневые дефекты на конечностях и туловище практически любых размеров, хотя и не исключает возникновение осложнений, влияющих на сроки и возможность проведения адъювантной лучевой терапии.
Хирургической метод лечения сарком мягких тканей сопровождается частым развитием локального рецидива. Этот факт послужил причиной поиска новых методов и схем в лечении сарком мягких тканей [3; 15].
Применение комбинированного лечения больных с саркомами мягких тканей при локализации на конечностях расширило рамки органосохранных операций, значительно снизило процент локальных рецидивов опухоли.
В последние годы возрастает интерес к применению облучения саркомы мягких тканей перед оперативным вмешательством. Однако до настоящего времени нет доказательств того, что предоперационная лучевая терапия обладает преимуществом по отношению к послеоперационной лучевой терапии. Теоретической основой предоперационной лучевой терапии сарком мягких тканей является «стерилизация» псевдокапсулы опухоли, девителизация анаплазированых клеток, что позволяет выполнить оперативное вмешательство с высокой степенью абластичности [15; 19].
Комбинированное лечение (предоперационная лучевая терапия и операция) сарком мягких тканей позволяет снизить частоту локальных рецидивов опухоли до 19%, а в группе больных после хирургического лечения частота локальных рецидивов составила 41% [1; 2]. Местные рецидивы саркомы мягких тканей у больных, при отсутствии в краях резекции опухолевого роста, составили 6%. При положительном локальном контроле на опухолевый рост в крае резекции рецидивы появились у 18% больных, подвергнутых комбинированному лечению с предоперационной лучевой терапией 50 Гр [6; 9; 12].
Послеоперационную лучевую терапию проводят в случаях, когда локальный опухолевый процесс осложняется распадом, кровотечением или присоединением гнойно-септического осложнения. Преимуществом метода послеоперационной лучевой терапии сарком мягких тканей является то, что после удаления опухоли уменьшается объем облучаемых тканей.
Не существует анатомических ориентиров, с помощью которых хирург мог бы оценить адекватность проведенного оперативного вмешательства. Не всегда имеется достаточный резерв здоровых тканей, который мог бы быть дополнительно включен в единый блок с удаляемой опухолью. Встает вопрос дополнительного воздействия на микроскопические остатки опухолевой ткани. С этой целью применяется интраоперационная лучевая терапия электронным пучком в сочетании с пред- или послеоперационной лучевой терапией. Проведение интраоперационной лучевой терапии исключает дополнительную лучевую нагрузку на здоровые ткани, что дает возможность подведения высокой дозы к мишени. Перспективным видится применение нейтронной терапии сарком мягких тканей [2; 5; 15; 17].
Следует отметить, что успехи в лечении локального опухолевого процесса при саркомах мягких тканей путем внедрения новых способов оперативного вмешательства и лучевой терапии не отразились на пятилетней выживаемости больных [3; 5; 11].
Химиотерапия в настоящее время используется как в комплексном лечении, так и как самостоятельный метод лечения больных с метастазами саркомы мягких тканей в другие органы. Монохимиотерапия все больше уступает место полихимиотерапии. В практике чаще всего при лечении больных с саркомами мягких тканей применяются следующие схемы полихимиотерапии: CAPO, CyVADIC, CyVADact, VAC-II, VAC, MAID, ACM и другие. Общая эффективность от применения полихимиотерапии составляет 35-45% (Переводчикова Н.И., 1996) [1; 3]. Сделан вывод, что началом лечения при высокозлокачественных саркомах мягких тканей является адъювантная полихимиотерапия для подавления субклинических метастазов опухоли, учитывая неблагоприятный прогноз жизни в данной группе больных (Мороз Л.В., Горбунова В.А., 1976; Ozaki T., Sugihara S., Hamada M., Nakagawa Y., Inoue H., 1993) [1; 3].
На основании данных рандомизированных исследований можно полагать, что частота местных рецидивов у больных, получивших хирургическое лечение и химиотерапию, аналогична отмечаемой при сочетанном применении хирургического и лучевого методов лечения (Antman K., Suit H., Amato D. еt al., 1984).
Все большую популярность приобретает проведение неоадъювантной химиотерапии с контрольным микроскопическим исследованием биоптата опухоли. Положительный ответ саркомы мягких тканей на данную схему полихимиотерапии позволяет планирование лекарственной терапии и в послеоперационном периоде.
Результаты полихимиотерапии рецидивных сарком менее оптимистичны из-за первичной или приобретенной резистентности опухолевых клеток к множеству цитостатических и цитотоксических препаратов. Феномен множественной лекарственной резистентности в последнее время интенсивно изучается, особенно после выделения гена MDR 1. Продуктом данного гена является трансмембранный гликопротеин (P-гликопротеин), который участвует в процессе элиминации токсических продуктов и химиопрепаратов из опухолевой клетки (Филов В.А., Гершанович М.Л., Акимов М.А., Акимов А.А., 1998) [3].
В настоящее время используется комплексное лечение больных с саркомами мягких тканей, что в итоге значительно расширило рамки органосохраняющих операций.
Другой метод лечения нерезектабельных сарком мягких тканей - предоперационная лучевая терапия с изолированной перфузией конечности. Изолированная перфузия конечности проводилась с применением комбинации химиопрепаратов и интерферона. Достичь желаемого результата не удалось, большая часть сарком после окончания лечения не подлежала хирургическому лечению. Отмечена высокая частота осложнений самого лечения [1].
Большое внимание в настоящее время уделяется прогностическим факторам, влияющим на клинические результаты при саркомах мягких тканей. Многофакторный анализ показал, что определяющими из них являются гистологический вариант и размер опухоли, ее локализация, наличие или отсутствие метастазов в регионарные лимфатические узлы, состояние края резекции после широкого иссечения саркомы, локальные рецидивы.
Локализация и размер опухоли определяют частоту локальных рецидивов саркомы мягких тканей. Размер опухоли и ее локализация прямо пропорциально влияют на процент местных рецидивов Локализация саркомы вблизи сустава, на стопе и кисти определяет высокий риск местного рецидива независимо от способа лечения [2; 9; 15].
Резекция сосудов при вовлечении их в опухолевый процесс с последующим протезированием сопровождается частым локальным рецидивом саркомы мягких тканей - 40%. Частота рецидивирования после сохранных операций в области плеча составляет 74,2%, предплечья - 71,2%, кисти 70,4%, крупных суставов - 84,8%, бедра - 67,2%, голени - 78,9%, стопы - 71,8%, груди - 71,4%, спины - 60%, поясницы - 92,6%, брюшной стенки - 48,6% [2; 15; 19].
Спорным остается вопрос зависимости частоты возникновения локального рецидива саркомы мягких тканей от гистологического варианта и степени злокачественности опухоли. В ретроспективном обзоре Zagars G.K., Goswitz M,S., Pollack A. (1996) осветили результаты лечения 112 больных липосаркомой мягких тканей. Они отметили, что плеоморфная липосаркома характеризовалась высокой частотой локальных рецидивов - 37% и низкой десятилетней выживаемостью - 41% [3].
Определяющим фактором, влияющим на 5-летнюю выживаемость больных, является гистологический вариант опухоли и степень ее злокачественности. Низкодифференцированные саркомы в 8 раз увеличивают риск смерти.
Размер, в большей степени время удвоения опухоли, косвенным образом свидетельствуют о степени злокачественности опухоли до ее верификации. Неблагоприятным прогностическим фактором, отрицательно влияющим на 5-летнюю выживаемость, является размер опухоли более 5 см при саркоме низкой степени дифференцировки.
Как отмечается практически во многих публикациях, около 80% рецидивов (как местных, так и отдаленных метастазов) возникает в первые два года после основного этапа лечения первичной опухоли [1; 3; 7; 15]. Авторы не подразделяют локальные рецидивы опухоли на какие либо группы по срокам возникновения, причинам, объединяющим их. При одном и том же гистологическом типе саркомы время возникновения рецидива может быть обусловлено не только объемом неиссеченной части опухоли, но и условиями ее микроокружения после того или иного способа лечения. По данным противоречивым выводам нет единого мнения [2; 8; 13; 17].
В заключение можно отметить, что на первом месте среди факторов, влияющих на продолжительность жизни больных с выявленными саркомами мягких тканей, стоит степень дифференцировки опухоли. Размер опухоли при высокодифференцированных саркомах в большей степени определяет прогноз качества жизни больного, из-за более частого местного рецидивирования после удаления первичной опухоли. При низкодифференцированных саркомах размер опухоли влияет как на продолжительность жизни больного, так и на качество жизни больного. Накопившийся мировой опыт лечения больных с саркомами мягких тканей определил алгоритм лечения [1; 3].
Мотивом начала лечебного процесса является подтверждение микроскопическим исследованием факта наличия злокачественной опухоли у больного в мягких тканях. Заключительным методом обследования больного перед началом лечения является биопсия опухоли, которая выполняется только при размере ее более 3 см. Опухоли меньших размеров подвергаются пункционной биопсии или непосредственно широкой эксцизии.
Данный алгоритм лечения больных с саркомами мягких тканей включает как обязательный компонент окончательной диагностики эффективности хирургического лечения контроль на наличие или отсутствие опухолевой инфильтрации по линии резекции.
Таким образом, изучение представленных выше научных работ позволило выявить нерешенность ряда вопросов: до настоящего времени нет единой тактики лечения больных после хирургического лечения сарком мягких тканей с нарушением принципов онкологического радикализма, нет единого мнения о влиянии локальных рецидивов саркомы мягких тканей на прогноз жизни больных, не изучена периодичность появления локальных рецидивов и факторов, влияющих на них. Мнения по объему широкого иссечения сарком мягких тканей в зависимости от размера, гистологического варианта и локализации опухоли остаются разноречивыми, нет единого мнения по схемам и тактике лечения больных первичными и рецидивными саркомами мягких тканей.
Все вышесказанное оставляет еще не решенной проблему лечения больных саркомами мягких тканей для клинической онкологии и требует ее дальнейшего изучения.
Саркома Юинга: диагностика и лечение
Саркома Юинга - злокачественное новообразование, поражающее, в первую очередь, костную ткань, реже может образовываться из соединительной, жировой, мышечной или из тканей периферических нервов.
Болезнь названа в честь Джеймса Юинга, который впервые ее описал в 1921 году на заседании Общества патологов Нью-Йорка.
Наиболее частые локализации саркомы Юинга:
- кости таза,
- бедренная кость,
- большеберцовая и малоберцовая кости,
- ребра,
- лопатка,
- позвоночник
- плечевая кость.
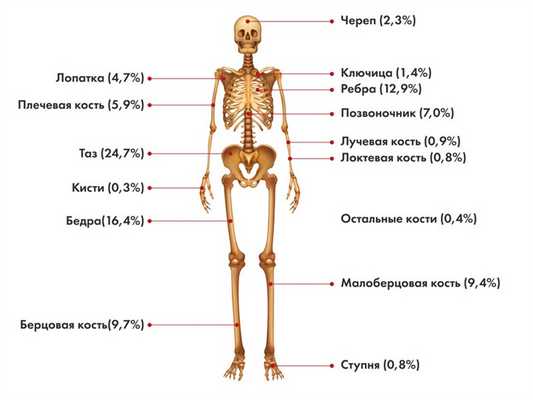
Локализация первичной опухоли саркомы Юинга
Чем отличается саркома Юинга от остеосаркомы
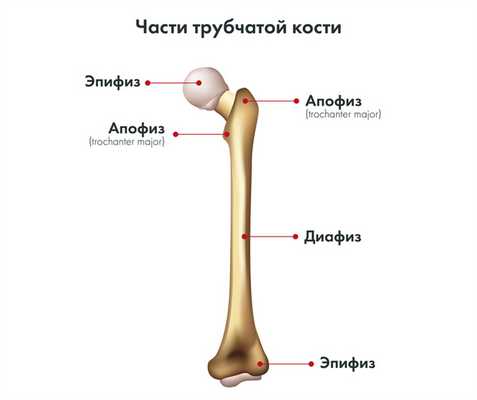
В отличие от остеосаркомы, которая, как правило, поражает длинные кости конечностей, саркома Юинга поражает плоские кости. В трубчатых костях опухоль в большинстве случаев локализуется в диафизе и имеет тенденцию к распространению на эпифизы кости.
Распространенность заболевания
Саркомы семейства Юинга встречаются крайне редко. По частоте заболевания они занимают второе место среди злокачественных новообразований костной системы у детей, что составляет около 10-15%.
Злокачественное образование данной группы редко возникает у детей младше 5 лет и взрослых старше 30 лет. Больше половины, страдающих саркомой Юинга, - дети и подростки в возрасте от 10 до 18 лет. Пик заболеваемости приходится на подростковый возраст - 12 -17 лет.
Отмечались случаи развития саркомы Юинга у грудных детей, у детей младшего возраста, у школьников и даже у очень пожилых людей.
По статистике заболевание в соотношении 1,5:1 чаще встречается у мальчиков, чем у девочек.
Имеет место и этническая принадлежность: значительно чаще эта опухоль возникает у подростков европеоидной расы по сравнению с детьми негроидной и монголоидной рас.
Причины возникновения саркомы Юинга
В настоящее время нет общепризнанных причин, потенциально приводящих к появлению саркомы Юинга. Однако стоит выделить факторы, которые в той или иной степени имеют отношение к канцерогенезу сарком группы Юинга:
- хромосомные изменения: в 85% случаев цитогенетический анализ показывает транслокацию на 22-й хромосоме. Этот ген также называется геном саркомы Юинга (в зарубежной литературе можно встретить термин EWS-ген);
- риск возникновения саркомы Юинга выше у пациентов, ранее уже перенесших онкологические заболевания с применением лучевой терапии;
- в некоторых источниках говорится о связи предшествующей травмы и возникновения в будущем опухоли.
Клиническая картина
Длительное время саркома Юинга никак себя не проявляет. От момента появления первых болевых ощущений до установления диагноза проходит от нескольких недель до нескольких месяцев, и лишь по мере разрастания опухоли начинают спонтанно возникать болезненные ощущения.
Основным и наиболее частым симптомом является локальная боль и припухлость в месте распространения опухоли. Она усиливается при физической нагрузке, практически не снимается анальгетическими и нестероидными противовоспалительными препаратами, полностью не проходит даже в ночное время.
Отек над пораженной областью сопровождается нарушением функции конечности и близлежащего сустава.
Врач или родитель может самостоятельно нащупать образование. При пальпации отмечается болезненность.
Местный осмотр пораженной конечности
Размеры опухоли имеют тенденцию к быстрому увеличению. Поражение периферических нервов может вызвать появление неврологической симптоматики.
Стоит отметить зависимость клинических проявлений от локализации новообразования. Опухоль в области позвоночника проявляет себя различными двигательными нарушениями по типу парезов или параличей. Если опухоль растет в тазовых костях или в районе груди, или же в бедренных костях, то долгое время она не даёт явных симптомов и остается незамеченной.
К синдрому общей опухолевой интоксикации относятся симптомы:
- повышение температуры тела до субфебрильных и фебрильных цифр;
- потеря аппетита и снижение веса вплоть до кахексии, т.е. крайнего истощения организма;
- слабость,
- ребенок становится более капризным, эмоционально лабильным;
- на более поздних стадиях возможно развитие анемии.
Диагностика саркомы Юинга
Обязательные диагностические мероприятия включают в себя:
- тщательный сбор анамнеза, анализ жалоб пациента, клинический осмотр;
- лабораторные методы диагностики: клинический анализ крови, биохимический анализ крови (мочевина, креатинин, электролиты, повышение уровня С-реактивного белка, ЛДГ, щелочная фосфатаза, оценка функции печени и почек), коагулограмма, общий анализ мочи (возможно наличие незначительной урат- или оксалатурии);
- инструментальные методы диагностики: ЭКГ, ЭхоКГ;
- рентгенография пораженного сегмента скелета в 2-х стандартных проекциях;
- МРТ очага с контрастированием позволит наиболее точно определить локализацию, размеры, связь опухоли с окружающими тканями, распространение образования по костномозговому каналу;
- рентгенография и КТ органов грудной клетки в прямой и боковой позициях для оценки наличия метастазов;
- УЗИ брюшной полости, забрюшинного пространства, периферических лимфатических узлов, пораженного сегмента;
- необходимо провести остеосцинтиграфию с Технецием-99, что позволит выявить другие очаги в костях и наличие или отсутствие в них метастазов;
- трепанобиопсию костного мозга или аспирационную биопсию необходимо проводить для определения поражение костного мозга, поскольку саркома Юинга имеет особенность метастазировать в костный мозг;
- гистологическое исследование биопсийного материала - обнаружение мелких синих злокачественных мономорфных клеток округлой̆ формы, которые имеют различные степени нейральной дифференцировки.
Рентгенологические признаки саркомы Юинга:
- поражение кости без четких границ, так называемый симптом «изъеденная молью», чаще распространяется по костномозговому каналу;
- «луковичный периостит» - многослойный периостит, сочетающийся с игольчатым;
- наличие мягкотканного компонента однородной структуры;
- в 5% случаев встречается патологический перелом.
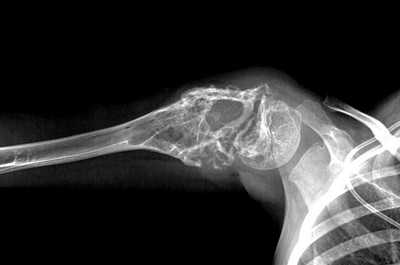
Саркома Юинга плечевой кости
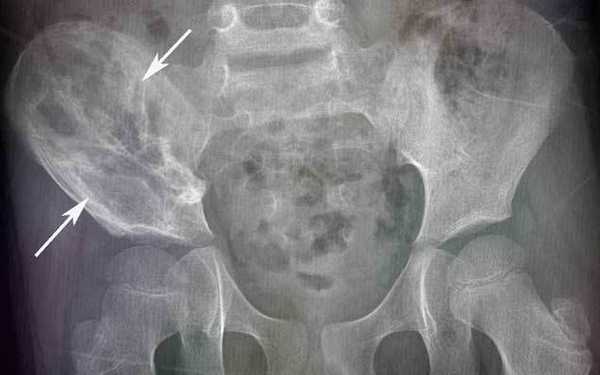
Саркома Юинга подвздошной кости
Лечение пациентов с саркомой Юинга
Лечение включает в себя три основных составляющих:
1. Многокомпонентная химиотерапия, подразделяющаяся на индукционную (предоперационную) и консолидирующую (послеоперационную).
Основные препараты, которые применяются при лечении опухолей семейства Юинга: винкристин, доксорубицин, ифосфамид, циклофосфамид, этопозид, дактиномицин.
2. Лучевая терапия проводится в дозах 40-45 Гр при микроскопических остаточных опухолях и 50-60 Гр при наличии макроскопических изменений.
3. Хирургическое лечение - локальный способ удаления опухоли, который полностью зависит от расположения, распространения и взаимосвязи с окружающими мягкими тканями новообразования. Оперативное вмешательство обеспечивает наилучший местный контроль над опухолью.
Лечение первичных пациентов необходимо проводить в специализированных учреждениях с участием детского онколога, детского хирурга, морфолога, врача лучевой диагностики, радиотерапевта.
После проведения полного диагностического обследования, получения заключения гистологического и цитологического исследований, консультаций всех специалистов определяется тактика лечения.
Стандартно проводят от 4 до 6 циклов индукционной химиотерапии в течение 12-24 недель, затем - хирургическую операцию, после которой возобновляют лекарственную терапию.
В послеоперационный период начинают консолидирующую химиотерапию, которую проводят аналогично индукционной. Назначают от 6 до 10 циклов, которые повторяются каждые 3 недели. Все режимы лечения основаны на комбинациях из 4-6 перечисленных препаратов.
Лучевую терапию всегда проводят в комплексе с химиотерапией и хирургическим этапом лечения, отдельно этот метод лечения не используется.
Доза облучения зависит от индивидуальных особенностей организма, самой опухоли, ее расположения и распространения, гистологического варианта и всегда подбирается радиотерапевтом.
Саркомы семейства Юинга характеризуется высокой чувствительностью к химиотерапии и лучевой терапии.
Хирургический этап лечения сарком Юинга является обязательным.
Современные методы хирургического вмешательства позволяют проводить так называемые органосохраняющие операции, избегая калечащих методов.
Широко распространены эндопротезирование длинных трубчатых костей, мелких суставов, резекция костей таза с этапами восстановления целостности тазового кольца, вертебрэктомии с восстановлением целостности позвоночного столба, резекции грудной клетки с восстановлением механической и дыхательной функций.
Калечащие операции проводят крайне редко и лишь в условиях отсутствия эффекта на получаемое специфическое лечение и наличие рецидивов. В этих случаях возможно использование экзопротезов.
В целом продолжительность лечения составляет от 8 до 12 месяцев.
Завершающий этап лечения заключается в реабилитации, которую проводят как в случае органосохраняющей операции, так и после калечащей. Реабилитационные мероприятия позволяют улучшить качество жизни пациента, адаптировать его к новым условиям жизни.
Наблюдение, объем и сроки обследования
После успешного завершения полного комплексного лечения пациенты должны наблюдаться у детского онколога с периодичностью:
- 1 раз в 1,5-2 месяца в течение первого года,
- в течение второго года - 1 раз в 3 месяца,
- затем - 1 раз в 6 месяцев на протяжении последующих 2 лет и в дальнейшем - 1 раз в год до общей продолжительности 5 лет.
Основные мероприятия диспансерного этапа:
- общий анализ крови, биохимический анализ крови;
- рентген пораженного отдела;
- рентген области эндопротеза;
- УЗИ органов брюшной полости;
- УЗИ послеоперационной области;
- КТ грудной клетки 1 раз в 6 месяцев;
- МРТ всего тела 1 раз в год.
Пациент состоит на учете пожизненно.
- Федеральные клинические рекомендации «Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома Юинга» (утв. Минздравом России).
- Детская онкология: Клинические рекомендации по лечению пациентов с солидными опухолями. / под редакцией М. Ю. Рыкова, В. Г. Полякова. — М.: ГЭОТАР-Медиа, 2017. — 368 с.
- Детская онкология. Национальное руководство / под ред. М Д Алиева [и др.]. — М.: Издательская группа РОНЦ, Практическая медицина, 2012. — 684 с.: ил.
Автор:
Ефизова Е.В., клинический ординатор НМИЦ онкологии им. Н. Н. Петрова

Под редакцией:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова
Читайте также:
- Методика двухрядной Swive-FiberChain реконструкции вращательной манжеты плечевого сустава при полном разрыве
- Первичный остеоартроз коленного сустава: атлас фотографий
- Фосфолипиды как вторичные посредники. Система кальций-кальмодулин как вторичный посредник
- Физиологические изменения молочной железы в норме
- Укладка при рентгенограмме черепа и нижней челюсти в аксиальной ПЗ проекции по методу Тауна
