Механизм действия и применение ингибиторов протеинкиназ
Добавил пользователь Валентин П. Обновлено: 28.01.2026
1 таблетка, покрытая пленочной оболочкой, содержит:
действующее вещество: рибоциклиб (в виде рибоциклиба сукцината) - 200,00 мг (254,40 мг);
вспомогательные вещества: целлюлоза микрокристаллическая, гипролоза пизкозамещенная, кросповидон (тип А), магния стеарат, кремния диоксид коллоидный;
оболочка: премикс оболочки белый, премикс оболочки черный, премикс оболочки красный;
премикс оболочки белый: поливиниловый спирт (частично гидролизованный), титана диоксид (Е 171), тальк, лецитин соевый, камедь ксантановая;
премикс оболочки черный: поливиниловый спирт (частично гидролизованный), краситель железа оксид черный (Е172), тальк, лецитин соевый, камедь ксантановая;
премикс оболочки красный: поливиниловый спирт (частично гидролизованный), краситель железа оксид красный (Е172), тальк, лецитин соевый, камедь ксантановая.
Описание:
круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, светлого серовато-фиолетового цвета, со скошенными краями. На одной стороне нанесена гравировка «RIC», на другой - «NVR».
Фармакотерапевтическая группа:
противоопухолевое средство, протеинкиназы ингибитор.
Код ATX:
Фармакологические свойства
Механизм действия
Рибоциклиб - селективный ингибитор циклин-зависимых киназ (CDK) 4 и 6. Эти киназы активизируются при образовании комплекса с D-циклинами и играют основную роль в сигнальных путях, регулирующих клеточный цикл и пролиферацию клеток. Комплекс циклин D-CDK4/6 регулирует прогрессию клеточного цикла путем фосфорилирования белка ретинобластомы (pRb).
In vitro рибоциклиб подавлял фосфорилирование белка Rb, что приводило к остановке клеточного цикла в фазе G1 и снижению пролиферации клеток в клеточных линиях рака молочной железы. In vivo монотерапия рибоциклибом в хорошо переносимых дозах вызывала регрессию опухоли, коррелируя с ингибированием фосфорилирования белка Rb. В исследованиях in vivo с использованием моделей с полученным от пациента ксенотрансплантатом рака молочной железы положительного по рецепторам эстрогена, комбинация рибоциклиба и ингибиторов ароматазы (например, летрозол) приводила к более выраженному ингибированию опухолевого роста по сравнению с каждым препаратом в отдельности. После прекращения применения препарата возобновление опухолевого роста отмечалось через 33 дня. Кроме того, оценивалась противоопухолевая активность комбинации рибоциклиба в сочетании с фулвестрантом в исследованиях in vivo у иммунодефицитных мышей, несущих ксенотрансплантанты эстроген-обогащенного рака молочной железы ZR751. Комбинация рибоциклиба и фулвестранта приводила к полному ингибированию опухолевого роста.
Фармакодинамика
По данным биохимического анализа рибоциклиб ингибирует ферментные комплексы СDК4/циклин-D1 и СDК6/циклин-D3 в концентрации 0,01 (4,3 нг/мл) и 0,039 мкмоль (16,9 нг/мл), которая обеспечивает 50% ингибирование (IC50) соответственно.
В исследованиях на клеточных линиях рибоциклиб ингибирует СDК4/6-опосредованное фосфорилирование белка Rb при средней IC50, составляющей 0,06 мкмоль (26 нг/мл). Рибоциклиб останавливает прогрессию клеточного цикла в фазе G1/S при средней IC50, составляющей 0,11 мкмоль (47,8 нг/мл) (определено методом проточной цитометрии). Рибоциклиб также ингибирует пролиферацию клеток при значении IC50, составляющем 0,8 мкмоль (34,8 нг/мл) (оценено по степени интеркаляции бромодезоксиуридина (BrdU)). Сходные значения IC50, полученные при анализах целевой модуляции, клеточного цикла и пролиферативной активности подтверждают, что блокада фосфорилирования белка Rb рибоциклибом непосредственно приводит к остановке перехода клеточного цикла из G1-фазы в S-фазу с последующим ингибированием пролиферации клеток. При анализе на панели клеточных линий рака молочной железы с известным статусом рецепторов эстрогена (ER), рибоциклиб демонстрировал более высокую эффективность в отношении клеточных линий с ER-положительным статусом, чем с ER-отрицательным.
Электрофизиология сердца
Для оценки влияния рибоциклиба на интервал QTc у пациентов с распространенным раком были собраны серии электрокардиограмм (ЭКГ), проведенных трижды после применения однократной дозы при достижении равновесного состояния. Анализ взаимосвязи фармакокинетики и фармакодинамики проводился, в общей сложности, у 997 пациентов, получавших лечение рибоциклибом в диапазоне доз от 50 до 1200 мг, включая 193 пациентов, получавших лечение рибоциклибом в дозе 600 мг. Данный анализ позволил предположить, что рибоциклиб вызывал зависимое от концентрации увеличение интервала QTc.
После приема рибоциклиба в рекомендуемой дозе 600 мг в комбинации с ингибиторами ароматазы или фулвестрантом рассчитанное среднее изменение QTcF относительно исходного значения составляло 22,00 мсек [90% Доверительный Интервал (ДИ): 20,56, 23,44] и 23,7 мсек [90% ДИ: 22,31, 25,08], соответственно, по сравнению с 34,7 мсек [90% ДИ: 31,64, 37,78] для комбинации рибоциклиба с тамоксифеном при геометрическом среднем значении максимальной концентрации в плазме крови (Cmax) в равновесном состоянии (см. раздел «С осторожностью»).
Фармакокинетика
Фармакокинетические параметры рибоциклиба были изучены у пациентов с распространенными солидными опухолями или лимфомами после приема внутрь суточных доз от 50 мг до 1200 мг. Здоровые добровольцы получали перорально однократные дозы в диапазоне от 400 мг до 600 мг или повторные дозы 400 мг ежедневно (8 дней).
Всасывание
После приема внутрь рибоциклиба у пациентов с распространенными солидными опухолями и лимфомами Сmах рибоциклиба в плазме крови достигалась через 1-4 часа (время достижения максимальной концентрации, Тmах). Наблюдалось небольшое сверхпропорциональное увеличение экспозиции (Cmax и площади под кривой “концентрация-время” (AUC)) рибоциклиба в изучаемом диапазоне доз (от 50 мг до 1200 мг). После повторного приема 1 раз/сут равновесное состояние обычно достигалось через 8 дней, рибоциклиб аккумулировал со средним геометрическим отношением, составляющим 2,51 (диапазон: от 0,972 до 6,40).
Влияние нищи
По сравнению с приемом натощак, прием внутрь рибоциклиба в таблетках, покрытых пленочной оболочкой, в однократной дозе 600 мг с высококалорийной пищей с высоким содержанием жира, не оказывает влияния на скорость и степень всасывания рибоциклиба (Cmax среднее геометрическое отклонение (СГО): 1,00; 90% ДИ: 0,898, 1.11; AUCinf СГО: 1,06; 90%ДИ: 1,01, 1,12) (см. раздел «Взаимодействие с другими лекарственными средствами»).
Распределение
Связывание рибоциклиба с белками плазмы крови человека in vitro составляло приблизительно 70% и не зависело от концентрации (от 10 нг/мл до 10 000 нг/мл). Рибоциклиб равномерно распределялся между эритроцитами и плазмой крови со средним отношением кровь/плазма in vivo 1,04. По данным анализа популяционной фармакокинетики кажущийся объем распределения в равновесном состоянии (Vss/F) составлял 1090 л.
Метаболизм
В исследованиях in vitro и in vivo показано, что у человека рибоциклиб подвергается экстенсивному метаболизму в печени главным образом при участии изофермента CYP3A4. После приема рибоциклиба внутрь в однократной дозе 600 мг [ 14 С] у человека пути первичного метаболизма рибоциклиба включали окисление (деалкилирование, С и/или N-оксигенацию, окисление (-2Н)) и их комбинации. Первичные метаболиты рибоциклиба подвергались конъюгации путем N-ацетилирования, сульфатирования, связывания с цистеином, гликозилирования и глюкуронизации. Рибоциклиб был основным фармакологически активным соединением, присутствующим в плазме крови (43,5%). Основные циркулирующие метаболиты: метаболит М13 (CCI284, N-гидроксилирование), М4 (LEQ803, N-деметилирование) и Ml (вторичная глюкуронизация), на каждое представленное соединение приходилось 9,39%, 8,60% и 7,78% общей радиоактивности и 21,6%, 19,8% и 17,9% экспозиции рибоциклиба соответственно. Клиническая активность (фармакологические свойства и безопасность) рибоциклиба была преимущественно обусловлена неизмененным веществом, при этом циркулирующие метаболиты не имели существенного значения.
Рибоциклиб подвергался экстенсивному метаболизму, количество неизмененного вещества составляло 17,3% и 12,1% в кале и моче соответственно. Метаболит LEQ803 в значительном количестве определялся в кале, его количество составляло 13,9% и 3,74% принятой дозы в кале и моче соответственно. Другие метаболиты определялись и в кале, и в моче в небольших количествах (
Выведение
В равновесном состоянии при применении дозы 600 мг у пациентов с распространенным раком геометрическое среднее значение эффективного периода полувыведения из плазмы крови (на основании соотношения аккумуляции) составляло 32,0 часа (63% CV) и геометрическое среднее значение кажущегося клиренса (CL/F) при приеме внутрь составляло 25,5 л/ч (66% CV). Геометрическое среднее значение кажущегося конечного периода полувыведения рибоциклиба из плазмы крови (Т1/2) находится в пределах от 29,7 до 54,7 часов и геометрическое среднее значение CL/F рибоциклиба в диапазоне от 39,9 до 77,5 л/ч при дозе 600 мг во всех исследованиях у здоровых добровольцев.
Рибоциклиб выводится главным образом через кишечник и в небольшой степени почками. У 6 здоровых добровольцев мужского пола после приема однократной дозы [ 14 С] рибоциклиба, 91,7% общей введенной радиоактивной дозы определялось в течение 22 дней; в основном выведение происходило через кишечник (69,1%), 22,6% дозы выводилось почками.
Линейность/нелинейность
Сверхпропорциональное увеличение экспозиции (Cmax и AUC) рибоциклиба наблюдалось как после однократного приема, так и после приема повторных доз в диапазоне от 50 мг до 1200 мг. Анализ данных ограничивается малым размером выборки в большинстве когорт, получающих определенные дозы, с наибольшим количеством данных, поступающих из когорты, получавшей дозу 600 мг.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени легкой степени (класс А по классификации Чайлд-Пью) коррекция дозы не требуется; коррекция дозы необходима у пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по классификации Чайлд-Пью), рекомендуется начальная доза 400 мг. По данным фармакокинетического исследования у пациентов с нарушением функции печени, нарушение функции печени легкой степени не влияет на экспозицию рибоциклиба. Средняя экспозиция рибоциклиба увеличивалась менее чем в 2 раза у пациентов с нарушениями функции печени средней (СГО: 1,50 для Сmах; 1,32 для AUCinf) и тяжелой степени тяжести (СГО: 1,34 для Сmах; 1,29 для AUCinf). По данным популяционного фармакокинетического анализа, который включал 160 пациентов с нормальной функцией печени и 47 пациентов с нарушением функции печени легкой степени тяжести, нарушения функции печени легкой степени не влияли на экспозицию рибоциклиба, что подтверждает данные специальных исследований у пациентов с нарушениями функции печени.
Влияние возраста, пола и расы
Популяционный фармакокинетический анализ показал, что возраст, масса тела, пол и расовая принадлежность не оказывали клинически значимого влияния на системную экспозицию рибоциклиба, при котором могла бы потребоваться коррекция дозы.
Пациенты в возрасте >65 лет
Из 334 пациентов, которые получали рибоциклиб в исследовании III фазы (в группе, получавшей рибоциклиб плюс летрозол), 150 (44,9%) пациентов были в возрасте >65 лет и 35 (10,5%) пациентов были в возрасте >75 лет. Не наблюдалось существенных различий в отношении безопасности и эффективности рибоциклиба между этими пациентами и пациентами более молодого возраста.
Показания к применению
Препарат Рисарг показан для лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) местнораспространеннного или метастатического рака молочной железы в комбинации с ингибитором ароматазы или фулвестрантом у женщин в качестве начальной гормональной терапии или у женщин, получавших гормональную терапию ранее.
Противопоказания
Повышенная чувствительность к рибоциклибу или любому из вспомогательных компонентов препарата.
Детский возраст до 18 лет (эффективность и безопасность не доказана).
Беременность и период грудного вскармливания.
С осторожностью
Следует соблюдать осторожность при применении препарата Рисарг у пациентов с нейтропенией 3-4 степени, с нарушениями функции почек тяжелой степени, у пациентов с гепатобилиарной токсичностью, у пациентов с наличием или значительным риском удлинения интервала QT (синдромом удлинения интервала QT, неконтролируемыми или клинически значимыми заболеваниями сердца, в том числе недавно перенесенным инфарктом миокарда, хронической сердечной недостаточностью, нестабильной стенокардией и брадиаритмией, нарушениями водно-электролитного баланса), при одновременном применении с лекарственными средствами, удлиняющими интервал QTc, с мощными ингибиторами изофермента CYP3A, при применении с субстратами изофермента CYP3A с узким терапевтическим индексом. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF (см. раздел «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Исследования на животных
В исследованиях эмбриофетального развития у крыс и кроликов беременные животные получали перорально рибоциклиб в дозах до 1000 мг/кг/сут и 60 мг/кг/сут соответственно в течение периода органогенеза.
Для организма беременных крыс доза 1000 мг/кг/сут была летальной. При дозе 300 мг/кг/сут наблюдалась незначительная, не являющаяся негативной, тенденция к снижению прибавки массы тела таких животных и фетотоксичность, о которой свидетельствует снижение массы тела плодов в сочетании с изменениями скелета, которые рассматривались как временные и/или связанные с более низкой массой тела плодов. При дозах 50 или 300 мг/кг/сут отсутствовало влияние на эмбриофетальную смертность или нежелательное воздействие на морфологию плода. При изучении воздействия на беременных крыс считалось, что доза, при которой не наблюдалось неблагоприятных эффектов (NOAEL), составляла 300 мг/кг/сут. При изучении воздействия на эмбриофетальное развитие считалось, что доза, при которой не наблюдалось эффектов (NOEL), составляла 50 мг/кг/сут.
У кроликов при дозах >30 мг/кг/сут отмечено нежелательное влияние на эмбриофетальное развитие, что проявлялось увеличением числа аномалий плода (пороков развития, внешних аномалий, изменения внутренних органов и скелета) и роста плода (снижение массы тела плода). Эти данные включали уменьшение долей легких, развитие дополнительных сосудов на дуге аорты, диафрагмальную грыжу, отсутствие добавочной доли или (частичное) слияние долей легких, уменьшение добавочной доли легкого (30 и 60 мг/кг), экстра/рудиментарное 13-е ребро, деформация подъязычной кости, уменьшение числа фаланг большого пальца. Данных о эмбриофетальной смертности выявлено не было. NOEL для беременного животного составляла не менее 30 мг/кг/сут, для эмбриофетального развития - составляла 10 мг/кг/сут.
При дозе 300 мг/кг/сут у крыс и 30 мг/кг/сут у кроликов, системная экспозиция в организме беременного животного (AUC) составляла 13 800 нг х ч/мл и 36 700 нг х ч/мл, что было в 1,5 раза ниже, чем достигавшаяся у пациентов при максимальной рекомендуемой дозе 600 мг/сут.
Женщины с сохраненным репродуктивным потенциалом
Женщинам с сохраненным репродуктивным потенциалом следует рекомендовать использование эффективных методов контрацепции (вероятность возникновения беременности <1%) во время терапии препаратом Рисарг и не менее чем в течение 21 дня после окончания приема препарата. До начала лечения препаратом Рисарг следует провести тест на возможную беременность.
Фертильность
В исследовании фертильности у самок крыс рибоциклиб не влиял на репродуктивную функцию, фертильность или ранние стадии эмбриогенеза при любой дозе до 300 мг/кг/сут (вероятно, при экспозиции ниже или равной клинической экспозиции пациентов при максимальной рекомендуемой дозе рибоциклиба 600 мг/сут на основании AUC).
Изучение фертильности у крыс-самцов не проводилось, однако в токсикологических исследованиях сообщалось об атрофических изменениях в семенниках у крыс и собак при экспозиции, которая была меньше или эквивалентна экспозиции у человека при максимальной рекомендуемой ежедневной дозе 600 мг/сут, на основании AUC. Не имеется достаточных клинических данных о влиянии препарата Рисарг на фертильность. Потенциальное влияние препарата Рисарг на фертильность мужчин и женщин неизвестно. По данным исследований на животных препарат Рисарг может нарушать фертильность у мужчин с сохраненным репродуктивным потенциалом.
Способ применения и дозы
Лечение препаратом Рисарг следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.
Для женщин в пре-, перименопаузе применение комбинированного режима эндокринной терапии и рибоциклиба необходимо сочетать с функцией овариальной супрессии агонистами гонадотропин-рилизинг гормона (ГнРГ).
Режим дозирования
Общая целевая популяция
Рекомендуемая доза препарата Рисарг для приема внутрь составляет 600 мг (3 таблетки, покрытые пленочной оболочкой по 200 мг) 1 раз в сутки последовательно в течение 21 дня, с последующим перерывом в приеме препарата в течение 7 дней. Полный цикл составляет 28 дней.
Применение препарата Рисарг не зависит от приема пищи. При возникновении рвоты у пациента после применения препарата Рисарг или при пропуске очередного приема, не следует принимать дополнительную дозу препарата в этот день. Следующую назначенную дозу необходимо принять в обычное время. Таблетки препарата Рисарг следует проглатывать целиком (не разжевывать, не разламывать и не делить перед проглатыванием). Не следует принимать поврежденные таблетки (разломанные, с трещинами или другими признаками повреждения).
Коррекция дозы
Для коррекции тяжелых или непереносимых нежелательных лекарственных реакций (НЛР) может потребоваться временная отмена, уменьшение дозы или полная отмена препарата Рисарг.
Указания по снижению (при необходимости) рекомендуемой дозы при НЛР перечислены в таблице 1.
Ингибиторы киназ при ревматоидном артрите: реальность и перспективы

Статья посвящена возможностям применения ингибиторов тирозинкиназ в лечении ревматоидного артрита (РА). Представлен первый препарат из новой подгруппы таргетных синтетических базисных противовоспалительных препаратов - пероральный ингибитор янус-киназ тофацитиниб. Приводятся данные исследований ORAL START, ORAL SOLO и ORAL STEP по применению тофацитиниба у трех категорий пациентов: больные, ранее не получавшие метотрексат (МТ); пациенты, не ответившие на МТ и другие базисные противовоспалительные препараты (БПВП); пациенты, недостаточно ответившие на ингибиторы ФНО-альфа. Результаты исследований позволяют заключить, что тофацитиниб может назначаться как после неудач терапии БПВП и генно-инженерными биологическими препаратами, так и потенциально в качестве препарата 1-го ряда при РА. По мнению автора, тофацитиниб является весьма перспективным препаратом, который может стать важнейшим звеном стратегии активного лечения больных РА для достижения клинической ремиссии. Тем не менее необходимо проведение дальнейших исследований и накопление результатов практического применения препарата.
Терапия ревматоидного артрита (РА) за последние годы претерпела очень существенные изменения. Это касается как стратегии лечения - ранняя активная терапия, терапия по принципам лечения до достижения цели (Treat to target), так и непосредственно спектра используемых лекарственных средств. Несомненно, наиболее ярким событием последних 15 лет было внедрение класса генно-инженерных биологических препаратов (ГИБП) - сначала ингибиторов ФНО-альфа (инфликсимаб, этанерцепт, адалимумаб и др.), затем биологических препаратов с иными механизмами действия. Ввиду ярко выраженного и быстро развивающегося (особенно при использовании ингибиторов ФНО-альфа) противовоспалительного эффекта у пациентов, резистентных к терапии синтетическими базисными противовоспалительными препаратами (БПВП), биологическая терапия сразу заняла свое место в терапии РА. Именно сочетание новой стратегии ведения больных с появлением ГИБП позволило поставить достижение ремиссии в качестве основной цели лечения при РА.
К сожалению, широкое практическое применение ГИБП показало, что они не решают полностью проблему резистентности к терапии [1]. Сегодня хорошо известно, что среди пациентов, недостаточно отвечающих на синтетические БПВП (метотрексат, лефлуномид и пр.), ингибиторы ФНО-альфа высокоэффективны лишь у 60-70% больных [2], похожие результаты были получены и для других ГИБП. Большинство ГИБП наиболее активно действует в комбинации с метотрексатом (МТ), в то время как в монотерапии не превосходит его по выраженности клинического ответа. Исключением является лишь антагонист интерлейкина-6 (ИЛ-6) тоцилизумаб, который представляет собой моноклональное антитело (мАТ) к рецептору ИЛ-6. Кроме того, существует проблема вторичной лекарственной резистентности к биологическим молекулам, которая связана в первую очередь с продукцией антител к препарату (особенно часто к моноклональным антителам (мАТ)) и приводит к потере эффекта на фоне продолжающейся терапии. Пациенты могут быть переведены на терапию иными ГИБП, однако восстановление ответа на терапию достигается не всегда [3]. Исходя из современной стратегии лечения РА, реальным успехом терапии может считаться достижение стойкой клинической ремиссии или как минимум стабильно низкой активности болезни. Как считает ряд авторов, в среднем от 40 до 60% больных недостаточно отвечают ни на синтетические, ни на биологические противоревматические препараты [4]. Часть проблем связана с тем, что ГИБП требуют парентерального пути введения (подкожного или внутривенного), что связано с риском постинъекционных/постинфузионных реакций, а также ведет к удорожанию и усложнению процесса лечения. Таким образом, существует потребность в разработке антиревматических лекарственных средств с другими механизмами действия и в иных лекарственных формах.
Одним из наиболее интересных направлений представляется использование модулирования внутриклеточных сигнальных путей. Если ГИБП воздействуют преимущественно на цитокины, их рецепторы или другие биологически активные молекулы, находящиеся снаружи или на поверхности клеток, то внутриклеточные сигнальные пути связаны с передачей сигнала через цитоплазму клетки к ее ядру.
РА характеризуется активацией нескольких различных типов иммунных клеток, которые инфильтрируют суставы, что приводит к хроническому пролиферативному воспалению и в конечном счете к деструкции суставных тканей. Успешная активация иммунных клеток требует передачи внешних раздражителей через их поверхностные рецепторы. После того как рецептор соединяется с его лигандом, таким как провоспалительный цитокин, аутоантиген или иммунный комплекс, конформационные изменения приводят к активации внутриклеточных киназ, ферментов, прикрепленных к рецептору. Эти ферменты активируют внутриклеточные молекулы, запуская целый каскад реакций, который приводит к транскрипции генов, кодирующих эффекторные молекулы.
Киназы (от греч. kinéo — двигаю, перемещаю) - группа ферментов, относящихся к классу трансфераз; переносят фосфатные группы с аденозинтрифосфорной кислоты (АТФ) на разные субстраты, преимущественно на гидроксильную группу спиртов, углеводов или аминокислот [5]. Протеинкиназы — подкласс киназ, которые модифицируют другие белки путем фосфорилирования остатков аминокислот. Новая категория препаратов, действие которых направлено на цитоплазматические протеинкиназы, была разработана относительно недавно. Было показано, что препараты это группы эффективны при лечении онкологических и некоторых иммунных заболеваний. Наиболее ярким примером может служить ингибитор тирозинкиназы иматиниб (хорошо известный как Гливек), применяющийся для лечения хронического миелолейкоза.
В случае РА киназы играют центральную роль в активации аберрантного иммунного ответа и, следовательно, могут являться мишенью для лечения. Учитывая особенности энзимных систем, терапевтический эффект можно получить, используя низкомолекулярные ингибиторы, подходящие для создания пероральных, а не парентеральных, как в случае с ГИБП, лекарственных препаратов.
Среди большого числа протеинкиназ при РА за последние годы активно изучались митоген-активированная фосфокиназа p38 (p38 МАРК), селезеночная тирозинкиназа (Syk) и янус-киназы (JAK) [6].
Одной из первых киназ, которые рассматривались как мишени при РА, была p38 MAPK. Активация МАРК индуцируется различными внеклеточными стимулами и может привести к гиперпродукции ФНО-альфа и интерлейкина-1 моноцитами, а также ИЛ-6, т. е. провоспалительных цитокинов, играющих важную роль в патогенезе РА. Несмотря на хорошее теоретическое обоснование, клинические исследования ингибиторов p38 MAPK (pamapimod, VX-702, SCIO-469) показали только снижение С-реактивного белка (СРБ) при отсутствии достоверного клинического улучшения [6].
Syk является тирозинкиназой, которая связана непосредственно с поверхностными рецепторами, в том числе с рецептором B-клеток, Fcγ-рецептором на макрофагах, тучных клетках и нейтрофилах [7]. Клинические исследования ингибитора Syk фостаматиниба (fostamatinib, R788) ведутся не только при РА, но и при различных онкологических заболеваниях [8]. При РА фостаматиниб участвовал в клинических испытаниях, включающих пациентов, недостаточно ответивших как на MT, так и на ГИБП. Исследования терапии препаратом при неэффективности МТ продемонстрировали уровень ответа по критериям ACR20 - 67-72%, ACR50 - 43-57% и ACR70 - 28-40% достоверно выше, чем на плацебо [9]. В группе больных с недостаточным ответом на ГИБП фостаматиниб не показал эффективности [10], однако последующий анализ данных дает возможность предположить, что продолжение исследований в этой группе пациентов целесообразно [9]. Одной из проблем, связанных с применением ингибитора Syk, оказалась безопасность и переносимость терапии: нежелательные явления встречались достаточно часто, наиболее распространенными среди них были желудочно-кишечные эффекты (гастралгии, диарея), артериальная гипертензия, нейтропения и гепатотоксичность.
К настоящему времени наиболее многообещающие клинические результаты при РА были достигнуты в отношении ингибитора JAK тофацитиниба (CP-690,550).
JAK (янус-киназы, Janus kinase, названы так благодаря присутствию в одной молекуле двух киназных доменов, обращенных в разные стороны - подобно изображениям древнеримского бога Януса) - одна из разновидностей тирозин-киназ. JAK - это часть внутриклеточной сигнальной системы JAK-STAT, состоящий из янус-киназ и сигнального белка-трансдуктора и активатора транскрипции STAT (Janus Kinases — Signal Transducer and Activator of Transcription). Ферменты из группы JAK ассоциированы с рецепторами цитокинов. При соединении цитокина с рецептором янус-киназы фосфорилируют сигнальные молекулы STAT с участием аденозинтрифосфата (АТФ). Активированные таким образом белки STAT проникают в ядро клетки, где самостоятельно или с участием других белковых факторов индуцируют транскрипцию тех генов, которые должны индуцироваться данным цитокином [11]. Таким образом, JAK-STAT-система передает информацию от внеклеточных сигналов через трансмембранные рецепторы непосредственно к промоторам генов-мишеней в ядре клетки. Семейство JAK состоит из 4 белков: JAK1, JAK2, JAK3 и TYK2. В целом их функция заключается в передаче сигналов от интерферонов и цитокинов, в частности ИЛ-6 [12], и обеспечении ответа на эти сигналы функциональной активации клеток-мишеней - пролиферации, дифференциации, миграции, апоптоза и др.
Сигнальная система JAK-STAT играет важную роль при многих патологических процессах, в частности при полицитемии (когда наблюдается мутация JAK2 [13]) и других гематологических заболеваниях, а также при аутоиммунной патологии, в частности при реакциях «трансплантат против хозяина» [14], при бронхиальной астме [15] и РА.
Тофацитиниб (ТОФА) - низкомолекулярное вещество, пероральный обратимый конкурент АТФ-связывающего сайта JAK, обладает химической структурой, подобной АТФ. ТОФА обратимо ингибирует JAK1 и JAK3 и обладает функциональной специфичностью по сравнению с JAK2. Тем самым обеспечивается прерывание сигнального пути с участием JAK-STAT-системы; сигнал, подаваемый цитокином, не передается в ядро клетки, и биологические эффекты цитокина не осуществляются (рис. 1). Обратимость ингибиции JAK является фактором, положительно влияющим на безопасность препарата, т. к. в эксперименте у животных при глубоком подавлении этого сигнального пути развивалась тяжелая, опасная для жизни патология. Таким образом, ТОФА представляет собой низкомолекулярный препарат для перорального приема (стандартная дозировка составляет 5 мг 2 раза в день, при необходимости возможно применение дозы 10 мг 2 раза в день), который, в отличие от обычных синтетических БПВП, относится к области таргетной терапии и по своим фармакологическим эффектам во многом сходен с ГИБП, в частности, ряд особенностей механизма действия делает его близким к тоцилизумабу.
Исследования ТОФА в 3-й фазе клинических испытаний при РА были проведены на очень большом клиническом материале в рамках 6 контролируемых исследований серии ORAL (рис. 2), в которых изучались основные клинические ситуации, в которых может потребоваться применение нового противовоспалительного/иммуномодулирующего препарата: больные, ранее не получавшие МТ (МТ-наивные), - 1 исследование; пациенты, не ответившие на МТ и другие БПВП, - 4 исследования; пациенты, недостаточно ответившие на ингибиторы ФНО-альфа (и-ФНО), - 1 исследование [16]. Суммарно в этих исследованиях приняли участие 4 267 пациентов. Безопасность применения ТОФА изучалась на еще более обширной выборке: база данных включала к апрелю 2013 г. 5 674 больных, 12 669 пациенто-лет опыта применения, из них наблюдение в продленных фазах исследований прошли: >2 лет 3 166 больных, >3 лет 2 153 больных, >4 лет 567 больных. При этом по основным показателям (развитие инфекций, кардиоваскулярных событий и злокачественных опухолей) результаты на терапии ТОФА были сопоставимыми с известной статистикой в отношении ГИБП.
Все исследования ТОФА достигли своих первичных конечных точек, продемонстрировали хороший клинический эффект препарата в сочетании с удовлетворительной безопасностью [16].
Наиболее интересен опыт применения ТОФА в проблемных случаях: монотерапия МТ, недостаточный ответ на и-ФНО.
Как уже говорилось ранее, в монотерапии у пациентов, не получавших ранее МТ (т. н. МТ-наивных), только один ГИБП (тоцилизумаб) продемонстрировал превосходство над МТ (6-месячное рандомизированное исследование AMBITION) [17]. Для других ГИБП превосходство по клинической эффективности над МТ в монотерапии не доказано. Принципиальное значение такого рода исследований состоит в возможности продемонстрировать, что новые препараты сами по себе превосходят «старые» по клинической эффективности.
Двойное слепое рандомизированное исследование фазы 3 ORAL START [18] по изучению эффективности и безопасности 2-х дозировок ТОФА в сравнении с МТ у пациентов с РА, не получавших ранее МТ, было посвящено решению именно этой достаточно сложной задачи.
Критериями включения были активный тяжелый и среднетяжелый РА с наличием таких неблагоприятных прогностических факторов, как ≥3 рентгенологических эрозий в суставах кистей и стоп либо положительные тесты на ревматоидный фактор или антицитруллиновые антитела, ≥6 болезненных и ≥6 припухших суставов, СОЭ > 28 мм/ч или СРБ > 7 мг/л, отсутствие терапии МТ в анамнезе. Из средств сопутствующей терапии разрешались нестероидные противовоспалительные препараты (НПВ), низкие дозы глюкокортикоидов (ГК) и аминохинолиновые препараты в стабильной дозе, если были назначены заранее. Всего было включено 958 больных, рандомизированных в соотношении 2 : 2 : 1 на группы, получавшие терапию ТОФА 5 мг 2 раза в день, ТОФА 10 мг 2 раза в день и МТ 10 мг/нед. с повышением дозы до 20 мг/нед. Группы включали в основном пациентов в развернутой стадии РА, которые были сопоставимы по основным характеристикам (табл. 1). Лечение продолжалось в течение 12 мес., из которых первые 6 мес. занимала двойная слепая фаза, а в следующие 6 мес. продолжалось наблюдение пациентов на прежней терапии.
В исследовании ORAL SOLO [22] принимали участие больные с активным РА, имевшие в анамнезе терапевтическую неудачу - недостаточный ответ или непереносимость как минимум одного синтетического или биологического БПВП с отменой всех БПВП (кроме аминохинолиновых препаратов). С исследованием ORAL START это исследование объединяет применение ТОФА в монотерапии, однако группа сравнения получала плацебо с последующим переходом на активный препарат. Критерии включения в отношении активности РА были аналогичны критериям в ORAL START. Пациенты были рандомизированы в соотношении 4 : 4 : 1 : 1 на группы терапии: ТОФА в дозе 5 мг дважды в день в течение 6 мес.; ТОФА в дозе 10 мг два раза в день в течение 6 мес.; плацебо в течение 3 мес., после чего переход на ТОФА 5 мг два раза в день в течение 3 мес.; плацебо в течение 3 мес. с последующим переходом на ТОФА 10 мг дважды в день в течение 3 мес. Сравнения с плацебо в течение первых 3 мес. проводились с комбинированными данными из этих двух групп плацебо.
Другая проблемная группа больных РА - пациенты с недостаточным ответом на первый ГИБП, которым в большинстве случаев является один из и-ФНО. В такой ситуации задача врача заключается в том, чтобы выбрать адекватную замену первому биологическому препарату, что на практике бывает непросто осуществить, поскольку, несмотря на большое число публикаций на эту тему, точных общепринятых рекомендаций не существует, а смена одного за другим ГИБП не оправдана с точки зрения безопасности лечения и фармакоэкономики. Эта задача должна была быть решена в исследовании ORAL STEP [19]. Критерии включения в это исследование в отношении показателей активности и неблагоприятного прогноза были схожими с критериями в исследовании ORAL START, но дополнительно пациенты должны были иметь в анамнезе неэффективность или непереносимость как минимум одного из и-ФНО, который применялся согласно одобренной инструкции. Больные были рандомизированы на 2 группы ТОФА 5 мг 2 раза в день, ТОФА 10 мг 2 раза в день и 2 группы плацебо в соотношении 2 : 2 : 1 : 1. Во всех 4 группах больные получали ТОФА или плацебо в комбинации с МТ. Период двойного слепого лечения составлял всего 3 мес., по истечении которых все больные из групп плацебо переводились на активный препарат - ТОФА 5 мг 2 раза в день или ТОФА 10 мг 2 раза в день. В исследование было включено 399 больных. Группы были сопоставимы по основным характеристикам (табл. 2).
После добавления согласно протоколу через 3 мес. в группы плацебо активного препарата у этих пациентов наблюдалось быстрое улучшение, они «догоняли» больных, получавших лечение ТОФА с самого начала, и к концу 6-го мес. исследования достоверные различия между группами по ответу на терапию исчезали (рис. 6). Это наблюдение дополнительно подтверждает эффективность ТОФА и говорит о том, что отсроченная, но своевременная коррекция терапии также позволяет добиться хороших результатов.
Исследования ORAL START, ORAL SOLO и ORAL STEP позволяют заключить, что ТОФА достоверно эффективнее, чем МТ в монотерапии, и достоверно эффективнее плацебо у больных РА с отменой и-ФНО из-за недостаточной эффективности (на фоне продолжающейся терапии МТ) по следующим критериям:
√ ответ на лечение,
√ индивидуальные показатели активности болезни,
√ достижение низкой активности болезни и ремиссии.
В настоящее время ТОФА является первым из препаратов, модулирующих внутриклеточные сигнальные пути, который одобрен для применения в клинической практике в целом ряде стран: США, Мексике, Колумбии, Перу, Аргентине, Швейцарии, Кувейте, Объединенных Арабских Эмиратах, Японии, Макао. В России ТОФА также получил одобрение фармакологического комитета в 2013 г. и доступен под торговым наименованием Яквинус.
ТОФА открывает новую главу в лечении РА, свидетельством чему является проект изменения номенклатуры БПВП, разработанный профессором J. Smolen et al. [23]. В этом проекте (рис. 7), помимо общепринятого разделения БПВП на синтетические (сБПВП, в России обычно называются просто БПВП) и биологические (бБПВП, в РФ используется термин ГИБП), предлагается подразделять сБПВП на 2 подгруппы: обычные синтетические БПВП (осБПВП), к которым относятся МТ, лефлуномид и др., и таргетные синтетические (тсБПВП), к которым среди разрешенных к клиническому применению средств относится ТОФА, а также находящиеся на разных стадиях клинических испытаний другие препараты, влияющие на внутриклеточные сигнальные пути. Справедливости ради нужно отметить, что тсБПВП не единственная новая подгруппа БПВП в этой номенклатуре, вторая - биологические биоаналоги (ббБПВП), или биосимиляры, также активно развивающаяся фармакологическая группа.
В целом ТОФА является весьма перспективным препаратом, который может стать важнейшим звеном стратегии активного лечения больных РА для достижения клинической ремиссии. Препарат имеет ряд преимуществ по сравнению с ГИБП, в первую очередь уникальный механизм действия и возможность перорального приема. При этом очевидно, что осторожность в отношении препарата не может быть излишней: необходимо проведение пострегистрационных исследований 4-й фазы и накопление результатов практического применения тофацитиниба в рамках регистра больных РА.
Ингибиторы янус-киназ: перспективы применения при ревматоидном и псориатическом артрите и других ревматических заболеваниях
Ингибиторы янус-киназы подавляют внутри-клеточную сигнальную систему JAK/STAT, которая опосредует действие многочисленных цитокинов и факторов роста, играющих ключевую роль в патогенезе ревматических заболеваний. В отличие от генно-инженерных биологических препаратов (ГИБП), они предназначены для приема внутрь и не вызывают образование нейтрализующих антител. В ревматологии ингибиторы янус-киназ применяют в комбинации со стандартными базисными противовоспалительными препаратами (БПВП) у больных РА, не отвечающих на лечение БПВП или ГИБП, однако возможна и монотерапия тофацитинибом или барицитинибом, если одновременное применение БПВП по каким-то причинам невозможно или нежелательно (плохая переносимость, противопоказания). В исследовании ORAL Shift монотерапия тофацитинибом, которую проводили после отмены метотрексата у пациентов с РА, достигших низкой активности заболевания на фоне приема двух препаратов, по эффективности не уступала комбинированной терапии тофацитинибом и метотрексатом. В плацебо-контролируемых исследованиях установлена эффективность тофацитиниба в лечении псориатического артрита и псориаза, а также воспалительных заболеваний кишечника. Кроме того, эффективность и безопасность ингибиторов янус-киназ изучаются у больных анкилозирующим спондилитом и другими аутоиммунными заболеваниями.
Генно-инженерные препараты (ГИБП) в настоящее время применяют для лечения ревматоидного артрита (РА) и других заболеваний преимущественно в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов (БПВП). ГИБП представляют собой моноклональные антитела, растворимые рецепторы или гибридные молекулы, которые блокируют функцию различных цитокинов, таких как фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-1b, ИЛ-6, ИЛ-17, ИЛ-23, или Т- и В-клеток, играющих ключевую роль в патогенезе ревматических заболеваний. В последние годы большой интерес у исследователей и разработчиков лекарственных средств вызывает изучение внутриклеточных сигнальных систем, опосредующих действие цитокинов и факторов роста, которое привело к появлению нового класса лекарственных препаратов, получивших название таргетных БПВП. Пока к этой группе относят только ингибиторы янус-киназ, оказывающие действие на внутриклеточную систему JAK/STAT, которая включает в себя янус-киназы (JAK1, JAK2, JAK3 и тирозинкиназу 2) и белок-трансдуктор и активатор транскрипции (STAT - signal transducer and activator of transcription) 2. При взаимодействии цитокина с соответствующим рецептором JAK фосфорилируют белки STAT, которые индуцируют транскрипцию генов, опосредующих действие цитокинов.
Тактика применения ингибиторов янус-киназ для лечения ревматодного артрита
В рекомендациях Европейской антиревматической лиги (EULAR) 2016 г. лечение РА было предложено начинать с монотерапии стандартными БПВП, прежде всего метотрексатом, дозу которого следует быстро увеличить до 25-30 мг/нед в случае хорошей переносимости [5]. Если в течение 6 мес не удается добиться низкой активности или ремиссии РА, то при наличии неблагоприятных прогностических факторов (сохраняющаяся высокая активность заболевания, аутоантитела, ранние эрозии, отсутствие ответа на два БПВП) к терапии целесообразно присоединить ГИБП или ингибитор янус-киназ. При выборе между последними предпочтение было отдано ГИБП, учитывая больший опыт их применения в клинической практике.
Недавно были опубликованы обновленные рекомендации EULAR по лечению РА [6]. В целом стратегия лечения этого заболевания не претерпела особых изменений, в частности препаратом первой линии по-прежнему остается метотрексат. Тем не менее, изменения коснулись выбора препаратов второй линии. В новой версии рекомендаций повышена роль ингибиторов янус-киназ, т.е. сегодня при выборе тактики дальнейшей терапии у пациентов, не ответивших на метотрексат или другие стандартные БПВП, нет оснований отдавать предпочтение именно ГИБП и рассматривать таргетные БПВП как препараты “резерва". Основанием для пересмотра рекомендаций EULAR послужили результаты клинических исследований, подтвердивших высокую эффективность и благоприятный профиль безопасности ингибиторов янус-киназ в лечении РА, а также накопление опыта их применения в клинической практике. Так, к апрелю 2019 года в мире тофацитиниб получали более 200 000 больных РА.
Исследование ORAL-Step проводилось по сходному протоколу, однако в него были включены 399 больных РА, не ответивших на лечение ингибиторами ФНО-α [9]. Через 3 мес после начала лечения частота ответа по критериям АКР20 у больных, получавших тофацитиниб в дозах 5 или 10 мг два раза в сутки в сочетании с метотрексатом, составила 41,7% и 48,1%, соответственно, и достоверно превышала частоту ответа у пациентов, продолжавших прием метотрексата в комбинации с плацебо (24,4%). Динамика счета HAQ-DI и частота ремиссии РА также были достоверно выше в обеих группах тофацитиниба.
В целом результатых этих и других исследований в рамках программы ORAL показали, что при недостаточной эффективности стандартных БПВП присоединение тофацитиниба позволяет значительно уменьшить активность РА, в том числе у больных, не ответивших на лечение ГИБП.
Сходные результаты были получены при изучении эффективности барицитиниба у пациентов с РА, не ответивших на лечение стандартными БПВП (исследования RA BEAM и RA BUILD) и/или ГИБП (RA BEACON) [10,11]. В исследовании RA-BEAM, в которое были включены 1307 больных РА, не отвечавших на метотрексат, через 12 недель частота ответа по критериям АКР20 при лечении барицитинибом в дозе 4 мг один раз в сутки и метотрексатом (70%) достоверно превышала таковую при применении метотрексата в сочетании не только с плацебо (40%, p<0,001), но и адалимумабом (61%, p=0,01). Частота ремиссии РА, которую оценивали на основании счета SDAI через 12 недель, в группе барицитиниба также была выше, чем в группе плацебо, и сопоставимой с таковой в группе адалимумаба.
Недавно были опубликованы результаты клинических исследований 3 фазы, подтвердивших эффектив ность упадацитиниба в лечении активного РА у пациентов, не ответивших на стандартные БПВП (исследование SELECT NEXT) или ГИБП (исследование SELECT BEYOND) [12,13]. В обоих исследованиях комбинированная терапия ингибитором янус-киназ и стандартным БПВП по эффективности превосходила плацебо в сочетании с БПВП. Например, в исследовании SELECT BEYOND через 12 недель частота ответа по критериям АКР20 в группах упадацитиниба в дозах 15 и 30 мг/сут составила 65% и 56%, соответственно, а в группе плацебо - 28%.
Таким образом, результаты рандомизированных клинических исследований свидетельствуют о том, что у больных РА умеренной или высокой активности ингибиторы янус-киназ могут рассматриваться как препараты второй и третьей линии и использоваться при недостаточной эффективности или плохой переносимости как метотрексата или других стандартных БПВП, так и ГИБП.
Монотерапия ингибиторами янус-киназ при РА
ГИБП и таргетные БПВП рекомендуется применять в сочетании с метотрексатом или другими стандартными БПВП. Однако результаты различных регистров, которые проводятся в Европе и США, свидетельствуют о том, что около трети больных РА получают ГИБП в виде монотерапии, что может быть связано с плохой переносимостью БПВП, наличием противопоказаний к их назначению или сопутствующих заболеваний [1416]. По данным регистра Swiss RA (SCQM-RA), в который были включены более 3000 пациентов с РА, факторами, ассоциировавшимися с назначением монотерапии ГИБП, были пожилой возраст, сопутствующие заболевания, длительность РА и более высокая его активность, низкий индекс массы тела, а также опыт применения ГИБП в анамнезе [14]. Сходные данные были получены и в регистре Британского общества ревматологов [17]. Создается впечатление, что врачи назначают монотерапию ГИБП больным РА, лечение которых представляет собой более сложную задачу.
Данные наблюдательных исследований, проводившихся в обычной клинической практике, свидетельствуют о том, что от 10 до 77% больных РА прекращают прием метотрексата из-за нежелательных эффектов [18]. Основным фактором риска развития нежелательных явлений при лечении метотрексатом является низкая скорость клубочковой фильтрации, которая приводит к снижению клиренса метотрексата и повышению его концентрации в сыворотке. Не все пациенты сообщают врачу о том, что они не принимают метотрексат в комбинации с ГИБП, например, из-за легких нежелательных явлений или нежелания отказываться от приема алкоголя. По данным исследования, проводившегося в Канаде на основании анализа аптечных баз данных, около трети больных РА не приобретали выписанные им БПВП, в том числе метотрексат, в течение 6 мес после назначения ГИБП [19]. С одной стороны, приведенные данные свидетельствуют о том, что в клинической практике ревматологам следует строже контролировать сделанные назначения, но с другой стороны, очевидно существование группы больных РА, у которых применение препаратов второй-третьей линии возможно только в виде монотерапии.
Как тофацитиниб, так и барицитиниб разрешено назначать в виде монотерапии. Эффективность монотерапии тофацитинибом изучалась в трех исследованиях, в том числе ORAL Strategy, ORAL Start и ORAL Solo. В двойное слепое, плацебо-контролируемое исследование ORAL Solo были включены 611 больных РА, у которых сохранялась активность заболевания несмотря на лечение стандартными БПВП или ГИБП [20]. Через 3 мес после начала монотерапии тофацитинибом в дозах 5 или 10 мг два раза в сутки частота ответа по критериям АКР20 (59,8% и 65,7%, соответственно) была достоверно выше, чем в контрольных группах больных, получавших плацебо (26,7%; p<0,001). Кроме того, лечение тофацитинибом по сравнению с плацебо привело к более значительному снижению счета HAQ-DI и увеличению частоты достижения низкой активности РА. Через 3 мес частота ремиссии РА достоверно не отличалась между группами сравнения, однако через 6 мес (после 3 мес всех пациентов групп плацебо переводили на прием тофацитиниба) она достигла 14,2% в группе тофацитиниба 10 мг.
В исследовании ORAL Strategy у 1146 больных РА, не ответивших на метотрексат, сравнивали эффективность монотерапии тофацитинибом и комбинированной терапии метотрексатом с тофацитинибом или адалимумабом [21]. В этом исследовании частота ответа по критериям АКР50 через 6 мес в группе больных, получавших монотерапию тофацитинибом в дозе 10 мг два раза в сутки, была несколько ниже, чем в группах сравнения (38% против 46% и 44%, соответственно), хотя разница между ними не достигла статистической значимости.
В исследовании RA BEGIN была сопоставлена эф фективность монотерапии барицитинибом или меторексатом и комбинированной терапии барицитинибом и метотрексатом у 588 больных РА [22]. Через 24 недели монотерапия ингибитором янус-киназ по эффективности, которую оценивали на основании частоты ответа по критериям АКР20, превосходила монотерапию метотрексатом (77% и 62%, соответственно; p<0,01) и вызывала значительное снижение активности заболе вания и улучшение физической функции, а также задерживала прогрессирование рентгенологических изменений суставов. Следует отметить, что в это исследование включали первичных пациентов с РА, которые не получали ранее БПВП. В настоящее время применение ингибиторов янус-киназ, как и ГИБП, в качестве препаратов линии не рекомендуется.
В целом приведенные данные свидетельствуют о том, что монотерапия ингибиторами янус-киназ может проводиться у пациентов с активным РА, не ответивших на лечение стандартными БПВП или ГИБП, если применение метотрексата или других БПВП невозможно изза побочных эффектов или противопоказаний. Более того, в рекомендациях EULAR указано, что монотерапия ингибиторами янус-киназ может иметь преимущества перед монотерапией ГИБП (за исключением тоцилизумаба) [3].
Исследование ORAL-Shift
У части больных РА применение современных антиревматических препаратов в сочетании со стандартными БПВП позволяет достичь стойкой ремиссии, что позволяет обсуждать возможность уменьшения интенсивности иммуносупрессивной терапии. Очевидные достоинства такого подхода включают в себя снижение риска нежелательных явлений и затрат и улучшение приверженности к терапии [25]. Из экономических соображений эксперты EULAR в таких случаях рекомендуют отменять ГИБП и продолжать монотерапию стандартными БПВП [4]. Следует отметить, что полная отмена ГИБП более чем у половины пациентов приводит к развитию обострения РА 26, поэтому на первом этапе можно попытаться снизить дозу препарата или увеличить интервалы между его введениями. Факторы, позволяющие предсказать сохранение достигнутого ответа на лечение после прекращения введения ГИБП, включают в себя ранний РА, глубину и длительность ремиссии [28].
Высокая частота рецидивов РА после отмены ГИБП позволяет обсуждать целесообразность альтернативного подхода к ослаблению интенсивности иммуносупрессивной терапии путем отмены БПВП. Доводом в пользу подобной практики может служить и тот факт, что ГИБП или таргетные БПВП чаще всего назначают пациентам, у которых стандартные БПВП оказываются недостаточно эффективными. В рандомизированном исследовании TARA были сопоставлены результаты постепенной отмены (в течение 6 мес) стандартных БПВП или ингибиторов ФНО-α у 189 больных РА, у которых была достигнута ремиссия заболевания на фоне комбинированной терапии двумя препаратами [29]. Полной отмене БПВП предшествовало последовательное двукратное снижение дозы в два раза под контролем активности РА, в то время как ингибитор ФНО-α отменяли после увеличения интервала между введениями в два раза и последующего снижения дозы. Через 1 год кумулятивная частота рецидивов РА (33% и 43% после отмены БПВП и ингибиторов ФНО-α, соответ ственно) и значения счета DAS, HAQ-DI и EQ-5D достоверно не отличались между группами, хотя обращала на себя внимание тенденция к увеличению риска развития рецидива после отмены ГИБП по сравнению с БПВП. В отдельных исследованиях изучали результаты отмены стандартных БПВП у пациентов, получавших их в комбинации с ингибиторами ФНО-α или ИЛ-6. Например, в исследованиях COMP-ACT и JUST-ACT монотерапия тоцилизумабом после отмены метотрексата по эффективности не уступала продолжающейся комбинированной терапии тоцилизумабом и метотрексатом у пациентов с РА, достигших низкой активности заболевания [30,31].
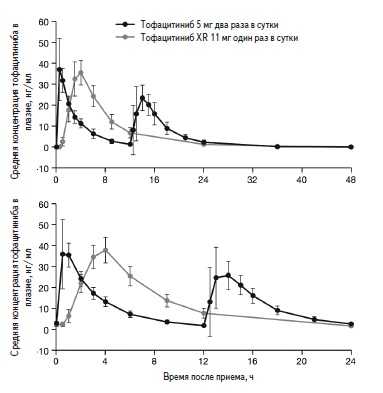
Рис. 1. Кривые зависимости концентрации тофацитиниба в плазмеотвременипослеодногократного (вверху)имногократного (5 дней; внизу) применения тофацитиниба XR и стандартноготофацитиниба.
Эффективность тофацитиниба в лечении псориатического артрита
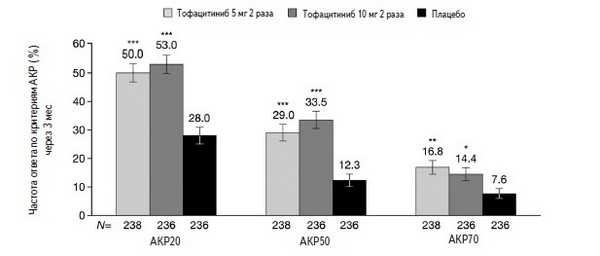
Рис. 3. ЧастотаответапокритериямАКРна лечение тофацитинибом у больных ПсА, не ответивших на стандартные БПВП или ГИБП в исследованиях ORAL Broaden иORAL Beyond. *p
Перспективы применения ингибиторов янус-киназ при анкилозирующем спондилите
Ингибиторы янус-киназ модулируют активность ИЛ17, ИЛ-21, ИЛ-23 и ФНО-α, которые играют ключевую роль в патогенезе анкилозирующего спондилита (АС), что открывает перспективы их применения при этом заболевании. Эффективность тофацитиниба в различных дозах (2, 5 и 10 мг два раза в сутки) в лечении АС изучалась в плацебо-контролируемом 16-недельном исследовании 2 фазы у 206 больных, не ответивших на нестероидные противовоспалительные препараты или плохо переносивших эти препараты [37]. По частоте ответа по критериям ASAS20 через 12 недель (первичный показатель эффективности) тофацитиниб в дозе 5 мг два раза в сутки достоверно превосходил плацебо (80,8% и 41,2%, соответственно, p<0,01). В группах тофацитиниба 2 и 10 мг два раза в сутки частота ответа по критериям ASAS20 также была выше (51,9% и 55,8%, соответственно), чем в группе плацебо, однако разница между ними не достигла статистической значимости. Преимущество тофацитиниба перед плацебо было подтверждено при анализе различных вторичных показателей эффективности, таких как частота ответа по критериям ASAS40, ASAS5/6, BASDAI50 и др. Лечение тофацитинибом было более эффективным у больных с высоким содержанием С-реактивного белка. Спектр нежелательных эффектов оказался сходным с таковым при применении тофацитиниба по другим показаниям. Результаты исследования обосновывают дальнейшее изучение эффективности тофацитиниба в лечении АС в исследованиях 3 фазы.
Заключение
Читайте также:
