Механизм гидролиза АТФ актином после полимеризации
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Биологическая подвижность и полимеризация актина (Клячко Н.Л. , 2000), БИОЛОГИЯ
Дана новая информация о механизме полимеризации актина, лежащей в основе многих проявлений биологической подвижности. Рассмотрен путь передачи внеклеточного сигнала на полимеризующийся актин, включающий G-белки, WASP и Arp2/3-комплекс. Приведены примеры эксплуатации подвижными патогенными бактериями механизма полимеризации актина в клетках хозяина.
И ПОЛИМЕРИЗАЦИЯ АКТИНА
Институт физиологии растений им. К.А. Тимирязева Российской академии наук, Москва
Полимеризация актина важна для многих процессов в клетке, она подвержена строгой пространственной и временной регуляции. Актиновые микрофиламенты вместе с микротрубочками и промежуточными филаментами образуют динамичную сеть в цитоплазме клеток, так называемый цитоскелет, который не только определяет форму клетки и пространственную организацию ее компонентов, но и лежит в основе разнообразных типов внутриклеточной и клеточной подвижности.
Из статей, опубликованных ранее в "Соросовском Образовательном Журнале", можно узнать об общей организации цитоскелета, его составе, основных формах движения клеток животных и работе молекулярных моторов, то есть молекул, умеющих превращать химическую энергию гидролиза АТФ в механическую работу при сокращении мышц, перемещении органелл и т.п. 1. Одним из примеров такого моторного белка, участвующего в движении по нитям полимерного актина, является миозин. Взаимодействие актина и миозина приводит к сокращению мышц. Оно также лежит в основе перемещения органелл и молекул вдоль нитей актина, который в данном случае играет роль рельсов для перемещения, в то время как моторный белок служит паровозом.
Однако некоторые формы движения осуществляются без участия специализированных моторов: они основаны на процессе полимеризации актина. Само по себе быстрое удлинение нитей актина приводит к возникновению движущей силы в направлении роста этих нитей. Быстрая полимеризация актина происходит, например, при перемещении клеток фибробластов и некоторых низших грибов с помощью специализированных выростов - псевдоподий в сторону привлекательного для них сигнала или в направлении от отталкивающего сигнала (положительный и отрицательный таксис).
До недавнего времени механизм быстрой локальной полимеризации актина в клетках оставался неясным. Еще не так давно Ю.М. Васильев писал о полимеризации актина в местах выбрасывания псевдоподий подвижными клетками животных: "Вероятно, под мембраной в этих местах концентрируются какие-то белки, вызывающие полимеризацию новых микрофиламентов, но пока природу этих белков мы еще точно не знаем" [1, с. 39]. В последние годы сделано несколько открытий, позволивших узнать больше о таких белках и заполнить брешь в цепи событий, происходящих на пути от внеклеточного сигнала до конечного результата, а именно движения. Описанию этих новых фактов и посвящена данная статья.
НОВОЕ О ПОЛИМЕРИЗАЦИИ АКТИНА
Актин: мономеры и полимеры
Актин присутствует в клетке как в форме мономерного белка с молекулярным весом 42 кД, так и в виде длинных нитей и их пучков, связанных с другими элементами цитоскелета и мембранами. Мономеры актина имеют грушевидную форму, и при их полимеризации возникает спирально закрученная полярная нить с различающимися концами: заостренным (минус) и оперенным (плюс) концом (рис. 1). Такие названия появились в связи с тем, что при взаимодействии актиновых нитей с фрагментами молекулы моторного белка миозина образуется комплекс, имеющий под электронным микроскопом стреловидную форму. При этом острие стрелы указывает на заостренный конец, а ее оперение обращено в сторону противоположного конца филамента.
Полимеризация актина происходит в две стадии. Первая стадия носит название "нуклеация", то есть создание ядра (nucleus) или затравки из первых трех мономеров актина. Димер (комплекс двух мономеров) является нестабильной структурой и легко разрушается. Именно нуклеация определяет общую скорость полимеризации. Вторая стадия, удлинение нити, протекает легче, с большей скоростью.
В пробирке мономерный актин может присоединяться и диссоциировать с обоих концов нити, но присоединение происходит быстрее к плюс-концу. Процесс непрерывного присоединения мономеров к оперенному (плюс) концу и их диссоциации с заостренного (минус) конца, то есть непрерывный круговорот мономеров (от англ. treadmilling - бесконечная, монотонная механическая работа) (см. рис. 1).
В живой клетке процесс полимеризации актина может быть не похож на treadmilling, то есть на круговорот мономеров в пробирке, поскольку полярные концы актинового филамента могут быть несвободными. В клетке присутствуют десятки так называемых актинсвязывающихся белков, которые сильно влияют на процесс полимеризации актина. Некоторые из них могут блокировать активно растущий оперенный плюс-конец, так называемые кэп-белки (от англ. cap - шапочка), прекращая таким образом полимеризацию уже существующих нитей и освобождая мономерный актин для построения новых нитей. Другие белки могут разрезать нити актина, формируя тем самым новые фрагменты с заостренными и оперенными концами. Существуют белки, связывающие мономеры актина и таким образом делающие их недоступными для полимеризации (например, профилин), белки, деполимеризующие актин, и т.п.
Актин - крайне консервативный белок, состоящий практически из одинаковых аминокислот у всех исследованных организмов. Однако помимо такого консервативного классического актина в клетках имеется много так называемых актиноподобных белков (actin-related proteins, Аrp), гомология которых с актином составляет всего от 30 до 60%. Различают несколько подсемейств таких белков: Аrp1, Аrp2, Аrp3 и др. Области гомологии этих белков с актином расположены главным образом в центральной части белковой глобулы. Поэтому долгое время считали, что эти белки неспособны к полимеризации, а также и совместной полимеризации с актином. Однако в последнее время становится ясно, что такое утверждение не вполне верно. Так, было обнаружено, что Аrp1 (центрактин) может полимеризоваться вместе с актином в составе так называемого динактинового комплекса, участвующего в перемещении органелл по микротрубочкам. Аrp2 и Аrp3 поодиночке действительно не взаимодействуют с актином. Однако недавно было показано, что эти два белка входят в состав так называемого Arp2/3-комплекса, содержащего помимо Аrp2 и Аrp3 белков еще пять или шесть (в зависимости от организма) субъединиц, не имеющих гомологии ни с одним из белков в компьютерных базах данных (рис. 2, а). Этот сложно устроенный комплекс был впервые выделен из амебы Acanthamoeba castellanii. Впоследствии было показано, что Arp2/3-комплекс очень консервативен и присутствует у всех исследованных эукариотных организмов от дрожжей до человека (для растений таких данных пока нет). В живых клетках этот комплекс накапливается в местах, где происходит быстрая полимеризация актина, например в разного рода псевдоподиях, в кортикальном слое цитоплазмы у дрожжей, в хвосте подвижных патогенных бактерий.
Оказалось, что Arp2/3-комплекс имеет повышенное сродство к минус-концам актиновых филаментов, а именно гетеродимер Arp2-Arp3 может служить матрицей, на которой происходит образование новых актиновых нитей (нуклеация) (рис. 2, а). Кроме того, комплекс может присоединяться к боковым сторонам нитей и таким образом обеспечивать их ветвление (рис. 2, б ). Интересно, что боковые нити актина отходят от основной нити строго под углом 70?, образуя жесткую сеть. Быстро растущие плюс-концы нитей актина обращены в сторону периферии клеток, например к мембране псевдоподия (рис. 2, б ). При этом создается движущая сила, толкающая мембрану вперед, в направлении перемещения клетки.
Концентрация Arp2/3-комплекса в клетках в 40-100 раз меньше, чем концентрация мономеров актина, но она достаточно велика, чтобы заблокировать все заостренные концы нитей, например у Acanthamoeba. Это, конечно, не означает, что treadmilling (круговорот мономеров) актина никогда не происходит в живых клетках. Напомним, во-первых, что комплекс характерен не для всех субпопуляций актина, и, во-вторых, возможно, что при определенных физиологических условиях он может диссоциировать от актиновых полимеров.
Сродство Arp2/3-комплекса к актину не слишком велико, и он ускоряет полимеризацию актина всего в 2-3 раза. Оказывается, для более эффективного функционирования сам комплекс должен быть активирован. Роль активаторов комплекса играют другие белки.
Движение патогенной бактерии Listeria
Первый белок, играющий роль активатора Arp2/3-комплекса, был обнаружен у патогенной бактерии Listeria monocytogenes, которая может вызывать опасные для жизни человека заболевания, такие, как энцефалит. Эта бактерия способна с большой скоростью перемещаться в цитоплазме клеток хозяина. Однако она не имеет жгутиков, и в ее клетке, как и у других прокариот, нет собственного актинового цитоскелета. Эта бактерия-паразит приспособилась использовать для перемещения актин эукариотной клетки, в которой она живет. L. monocytogenes научилась быстро полимеризовать актин хозяина вблизи одного из своих полюсов. В результате в ее кильватере образуется "хвост кометы" из непрерывно полимеризующегося актина, что и создает движущуюся силу для перемещения бактерии (рис. 3, вставка).
Оказалось, что на поверхности этой бактерии вблизи одного из ее полюсов имеется белок ActA, который умеет присоединять и активировать Arp2/3-комплекс и как следствие - во много раз ускорять полимеризацию актина. Пространственно процесс ограничен областью вблизи поверхности бактерии. Это достигается совместным действием многих актинсвязывающих белков, которые блокируют концы растущих филаментов актина, обеспечивают их ветвление, деполимеризацию и т.д. Растущие нити актина, по-видимому, направлены быстро растущими оперенными плюс-концами в сторону движения бактерии (точно так же, как это происходит при образовании псевдоподий в клетках эукариот) и толкают бактерию вперед.
Недавно M.-F. Carlier и ее сотрудники воссоздали процесс движения бактерии в системе in vitro, состоящей только из очищенных цитоскелетных белков. Ученые также определили степень необходимости каждого из белков - участников этого процесса. Помимо актина для моделирования процесса движения оказались необходимы всего три компонента: Arp2/3-комплекс, актиндеполимеризующий фактор и кэп-белки. Еще три белка были полезны, но необязательны для поддержания движения. Скорость движения бактерий составила 2-4 мкм/мин, то есть была не намного меньше, чем в клеточных экстрактах.
Таким образом, на предметном стекле был воспроизведен процесс движения патогенной бактерии Listeria и изучен его молекулярный механизм. Показано, что бактерия использует для передвижения полимеризацию актина цитоплазмы клетки-хозяина, активируя его с помощью собственного мембранного белка ActA.
РЕГУЛЯЦИЯ ПОЛИМЕРИЗАЦИИ АКТИНА
В КЛЕТКАХ ЭУКАРИОТ
Если полимеризация актина вблизи поверхности патогенной бактерии происходит конститутивно (без внешнего сигнала), то в подвижных клетках эукариот (например, в псевдоподиях фибробластов) или в зонах внутриклеточной подвижности, основанной на полимеризации актина, перестройка актинового цитоскелета обычно происходит в ответ на внеклеточный сигнал (свет, химический стимул). Уже давно известны начальные и конечные звенья в передаче этого сигнала. Внеклеточный сигнал воспринимается мембранным рецепторным белком и затем передается на так называемые G-белки, небольшие белки, способные связывать ГТФ, изменять свою конформацию и благодаря этому передавать сигналы на другую белковую молекулу. Гидролиз ГТФ до ГДФ G-белком возвращает его в неактивную конформацию. Некоторые такие G-белки (Rho, Rac и Cdc42) в итоге передают сигнал на актиновый цитоскелет, что приводит к быстрой полимеризации актина в зонах образования ламеллоподий и филоподий (разные типы псевдоподий) или волокон натяжения, пересекающих клетку пучков актиновых нитей. Промежуточные звенья в этой системе передачи сигнала до недавнего времени не были выяснены. Теперь стало очевидным, что полимеризации актина предшествует взаимодействие его мономеров с Arp2/3-комплексом, который затем должен быть активирован какими-то белками по аналогии с ActA-белком Listeria. Начались поиски таких белков в клетках животных и дрожжей, которые вскоре увенчались успехом. Было найдено несколько гомологичных белков. Первый из открытых белков получил название WASP, поскольку был найден у больных Wiscott-Aldrich-синдромом - наследуемой болезнью человека. Для этих белков характерно сложное доменное строение: они содержат домены связывания с белками и другими регуляторными молекулами (рис. 4, а). Показано, что эти белки, в частности, могут связывать Arp2/3-комплекс, мономерный актин, профилин, G-белки, сигнальную молекулу - фосфатидилинозитол-4,5-бисфосфат. Функциональное назначение разных доменов различно. Так, на С-конце WASP-белка рядом расположены домены связывания мономерного актина и Arp2/3-комплекса. Это обеспечивает их пространственное сближение и может облегчать процесс полимеризации актина. На N-конце WASP-белка расположены домены связывания G-белков и других сигнальных молекул. Благодаря этому WASP и его аналоги могут служить посредниками при действии многих факторов и участвовать в передаче сигнала (на участке между G-белками и Arp2/3-комплексом), активирующего полимеризацию актина.
Сами белки семейства WASP, по-видимому, в свою очередь, нуждаются в активации. Так, было показано, что С-концевые фрагменты этих белков более активны в стимуляции полимеризации актина, чем целые белки. Это может означать, что белки из семейства WASP могут существовать в клетке в неактивной конформации (рис. 4, б ) и только взаимодействие сигнальных молекул (G-белки, фосфоинозитолфосфатиды) с N-концевой частью этих белков переводит их в активную конформацию.
Итак, WASP-белки и Arp2/3-комплекс составляют те центральные звенья в цепи передачи внеклеточного сигнала, вызывающего полимеризацию актина, которые до недавнего времени были белыми пятнами в наших знаниях (рис. 5). Любопытно, что, если патогенная бактерия Listeria, о которой шла речь выше, сама синтезирует мембранный белок ActA (гомолог WASP), активирующий Arp2/3-комплекс эукариотной клетки, другая патогенная бактерия, возбудитель дизентерии Shigella flexneri, продвинулась еще дальше в степени эксплуатации механизма полимеризации актина клетки хозяина: ее мембрана содержит белок, который умеет присоединять WASP-белок хозяина (а не имитировать его активность), вклиниваясь в сигнальную цепь хозяина и активируя Arp2/3-комплекс с помощью Cdc42 (G-белок). Более того, если покрыть WASP-белком микроскопические стеклянные бусинки, то они тоже сумеют собирать актин вблизи своей поверхности и перемещаться в клеточных экстрактах без участия каких-либо моторных белков, только благодаря полимеризации актина.
Для выполнения актиновым цитоскелетом множества функций в клетке необходимо, чтобы сборка и организация актиновых нитей происходили в нужное время и в нужном месте. В последние десять лет шли интенсивные исследования с использованием генетических, биохимических и цитологических подходов для выяснения путей передачи внеклеточного сигнала к местам активной полимеризации актина. За это время был открыт Arp2/3-комплекс, служащий матрицей для нуклеации нитей актина и обнаружено несколько белков, регулирующих его активность. В последние годы было предпринято много усилий, чтобы понять механизм, с помощью которого G-белки семейства Rho регулируют состояние актинового цитоскелета, и практически заполнена брешь в цепи передачи внеклеточного сигнала на цитоскелет с участием G-белков. Важные для расшифровки этого пути передачи сигнала уроки были извлечены из изучения подвижности патогенных бактерий внутри эукариотической клетки и воспроизведения этого движения в модельных системах. Очевидно, что новые детали пространственной и временной регуляции сборки и организации актинового цитоскелета будут выяснены в последующие годы.
1. Васильев Ю.М. Клетка как архитектурное чудо. 1. Живые нити // Соросовский Образовательный Журнал. 1996. ╧ 2. С. 36-43.
2. Васильев Ю.М. Клетка как архитектурное чудо. 2. Цитоскелет способный чувствовать и помнить // Там же. ╧ 4. С. 4-10.
3. Тихонов А.Н. Молекулярные моторы. 2. Молекулярные основы биологической подвижности // Там же. 1999. ╧ 6. С. 17-24.
4. Welch M.D. The World According to Arp: Regulation of Actin Nucleation by the Arp2/3 Complex // Trends Cell Biol. 1999. Vol. 9. P. 423-427.
5. Machesky L.M., Cooper J.A. Bare Bones of the Cytoskeleton // Nature. 1999. Vol. 401. P. 542-543.
Рецензент статьи О.Н. Кулаева
Нелла Леопольдовна Клячко, доктор биологических наук, ведущий научный сотрудник Института физиологии растений им. К.А. Тимирязева РАН. Область научных интересов - пространственная организация белоксинтезирующего аппарата и его взаимодействие с цитоскелетом растительной клетки. Автор более 80 научных публикаций.
Гидролиз АТФ в мышечных волокнах
Описано протекание реакции гидролиза АТФ в мышечных волокнах. Показано, что именно реакция гидролиза АТФ приводит к ацидозу, то есть «закислению» мышцы, а не гликолиз.
Реакция гидролиза АТФ в мышечных волокнах
Непосредственным источником энергии при мышечной деятельности является АТФ (аденозинтрифосфат), который находится в саркоплазме. Освобождение энергии происходит в результате реакции гидролиза АТФ.
Определение
Гидролиз АТФ - реакция, протекающая в мышечных волокнах, при которой происходит взаимодействие АТФ с водой (гидролиз).
В результате гидролиза 1 моль АТФ выделяется энергия, равная 30 кДж.
Энергия, выделяемая в результате гидролиза АТФ в мышечных волокнах, расходуется на: сокращение мышечных волокон (взаимодействие белков актина и миозина) и на их расслабление (работу кальциевого и натрий-калиевого насосов).
Ацидоз (закисление) мышечных волокон
Фосфорная кислота (Н3РО4) в саркоплазме достаточно быстро диссоциирует на ионы водорода и неорганический фосфат (остаток фосфорной кислоты). Накопление ионов водорода вызывает ацидоз мышцы, то есть ее «закисление». При этом рН саркоплазмы сдвигается в кислую сторону и может достигать значений рН=6,4-6,5.
В настоящее время доказано, что именно реакция гидролиза АТФ приводит к ацидозу, то есть «закислению» мышцы, а не гликолиз. Так, по данным Robergs R.A.(2001) в течение трех минутной физической нагрузки субмаксимальной интенсивности высвобождение ионов водорода посредством гидролиза АТФ составляет 215 ммоль/кг, а гликолиза только 129 ммоль/кг, рис.1.
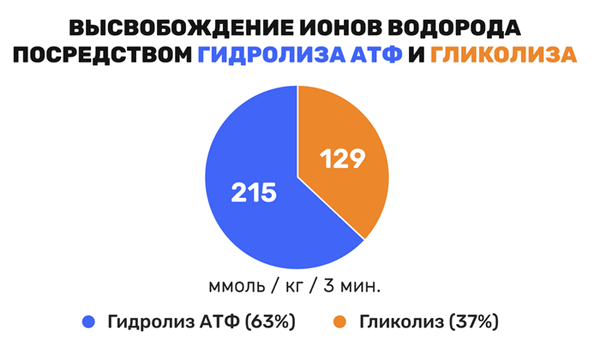
Рис.1. Высвобождение ионов водорода посредством гидролиза АТФ и гликолиза
Фермент АТФ-аза
Гидролиз АТФ ускоряется ферментом АТФ-азой Этот фермент расположен на миозиновых головках толстого филамента. Молекула миозина имеет большой отрицательный заряд. Ионы кальция (Ca 2+ ), выделяющиеся из саркоплазматического ретикулума при сокращении мышечного волокна, повышают АТФ-азную активность миозина и скорость гидролиза АТФ.
Содержание АТФ в мышечных волокнах незначительное и составляет 5 ммоль/кг сырой массы мышц. Оно поддерживается на относительно постоянном уровне, так как повышение концентрации АТФ в скелетных мышцах вызывает угнетение АТФ-азы и снижению сократительной способности миозина. Снижение концентрации АТФ ниже 2 ммоль/кг сырой массы приводит к нарушению работы кальциевого насоса и процесса расслабления мышц.
Активность фермента АТФ-азы лежит в основе разделения мышечных волокон на типы: медленные (I тип), промежуточные (IIA тип) и быстрые (IIB тип). В медленных мышечных волокнах активность этого фермента низкая, а в быстрых - высокая. Активность АТФ-азы миозина связана с типом (изоформой) миозина, содержащегося в данном волокне. Это обстоятельство позволяет посредством гистохимических методов определить какой именно миозин содержится в то или ином мышечном волокне.
Болезненные ощущения в мышцах во время тренировки
Гидролиз АТФ, приводящий к накоплению в саркоплазме кислых продуктов, активирует работу антитранспортера, который выкачивает из мышечного волокна в тканевую жидкость ионы водорода и закачивает в мышечное волокно ионы натрия. «Закисление» тканевой жидкости воздействует на болевые рецепторы (ноцицепторы), чувствительные к изменению рН. В результате спортсмены ощущают в скелетных мышцах жжение и боль.
Ресинтез АТФ
Дано определение ресинтеза АТФ. Описаны основные пути ресинтеза АТФ в мышечных волокнах: креатинфосфатный, гликолитический, миокиназный и тканевое дыхание. Описаны количественные критерии путей ресинтеза АТФ, соотношение между различными путями ресинтеза АТФ при мышечной работе, а также между путями ресинтеза АТФ и зонами относительной мощности.
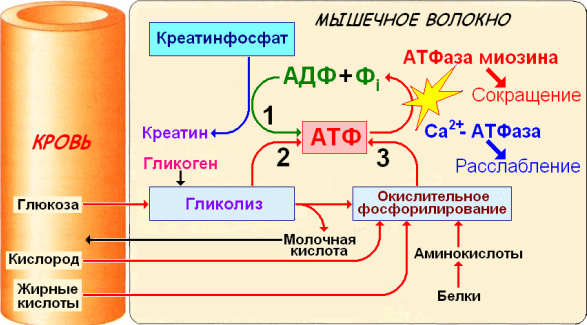
Ресинтез АТФ в мышечных волокнах
Ресинтез АТФ - синтез АТФ из различных энергетических субстратов во время физической работы в мышечных волокнах.
Формула ресинтеза АТФ выглядит следующим образом:
Пути ресинтеза АТФ
Ресинтез АТФ может осуществляться двумя путями:
- с участием кислорода (аэробный путь).
- без участия кислорода (анаэробный путь);
Аэробный путь (тканевое дыхание, аэробное или окислительное фосфорилирование) - основной способ образования АТФ в мышечных волокнах. Он протекает в митохондриях мышечных волокон. В результате тканевого дыхания выделяется 39 молекул АТФ. Окисляемое вещество распадается до углекислого газа и воды.
Анаэробный ресинтез АТФ
Анаэробные пути ресинтеза АТФ являются дополнительными способами образования АТФ в мышечных волокнах в тех случаях, когда основной путь получения АТФ - тканевое дыхание не может обеспечить мышечную деятельность необходимым количество кислорода. Эти механизмы ресинтеза АТФ активно функционируют в начале выполнения физических упражнений, когда тканевое дыхание не полностью «развернулось», а также при физических нагрузках высокой мощности.
Анаэробный ресинтез АТФ в мышечных волокнах возможен посредством нескольких механизмов:
- - ресинтез АТФ из креатинфосфата; - ресинтез АТФ из гликогена мышц;
- Миокиназный (аденилаткиназный) ресинтез АТФ - ресинтез АТФ из АДФ при значительном накоплении в мышечных волокнах АДФ. Рассматривается как аварийный механизм, обеспечивающий ресинтез АТФ, когда другие пути ресинтеза АТФ невозможны.
Количественные критерии путей ресинтеза АТФ
Существуют количественные критерии путей ресинтеза АТФ. К ним можно отнести: максимальную мощность, время развертывания, время сохранения или поддержания максимальной мощности, метаболическую ёмкость (табл. 1).
- Максимальная мощность - максимальное количество АТФ, которое может образоваться в единицу времени при функционировании данного пути ресинтеза АТФ.
- Время развертывания - минимальная длительность, необходимая для выхода ресинтеза АТФ на свою максимальную мощность.
- Время сохранения или поддержания максимальной скорости - длительность функционирования данного пути ресинтеза АТФ с максимальной мощностью.
- Метаболическая ёмкость - количество АТФ, которое может образоваться во время мышечной работы за счёт данного пути ресинтеза АТФ.
Таблица 1. Количественные критерии основных путей ресинтеза АТФ (С.С. Михайлов, 2009)
Соотношение между различными путями ресинтеза АТФ
При любой мышечной работе функционируют все три основных механизма ресинтеза АТФ, но включаются они последовательно. В первые секунды ресинтез АТФ осуществляется за счет креатинфосфатной реакции, затем включается гликолиз. По мере продолжения работы на смену гликолизу приходит тканевое дыхание (рис.1). Эта смена механизмов ресинтеза АТФ приводит к уменьшению суммарной выработки АТФ.
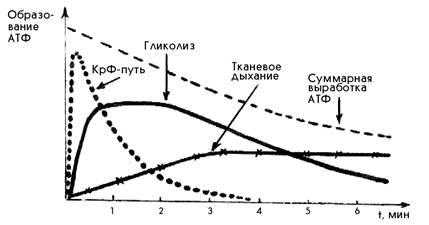
Рис.1. Включение путей ресинтеза АТФ при выполнении физической работы (С.С. Михайлов, 2009)
Пути ресинтеза АТФ и зоны относительной мощности
В.С. Фарфель приводит следующее соотношение мощности работы и основной системы энергообеспечения (табл.2)
Таблица 2. Зоны мощности работы и основная система энергообеспечения (В.С. Фарфель)
| Мощность работы | Основная система энергообеспечения | Типичное время работы |
| Максимальная | Креатинфосфатная реакция | до 20 с |
| Субмаксимальная | Гликолиз | до 5 мин. |
| Большая | Гликолиз+ тканевое дыхание | до 30 мин. |
| Умеренная | Тканевое дыхание | Более 30 мин. |
J.T. Cramer (2008) приводит несколько иное соотношение зон мощности и основных систем энергообеспечения (табл.3)
Таблица 3. — Зоны относительной мощности и основная ситема энергообеспечения (J.T. Cramer, 2008)
АТФ (Аденозинтрифосфат)
АТФ (Аденозинтрифосфорная кислота)
Что такое АТФ?
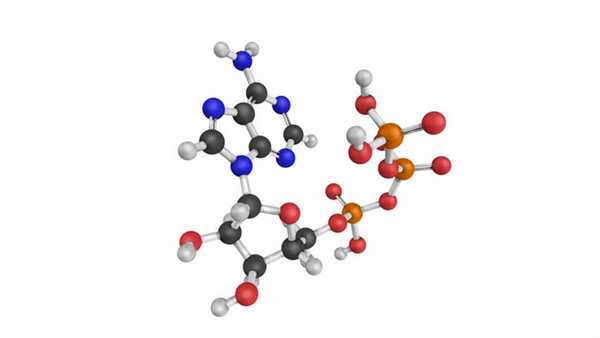
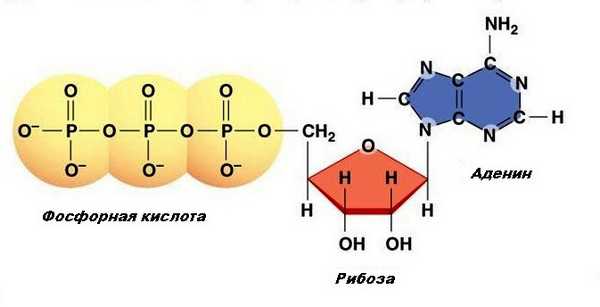
АТФ (аденозинтрифосфат, аденозинтрифосфорная кислота) - основное макроэргическое соединение организма[1]. Состоит из аденина (азотистого основания), рибозы (углевод) и трех последовательно расположенных фосфатных остатков, причем второй и третий фосфатные остатки присоединяются макроэргической связью. Структура АТФ выглядит следующим образом (рис.1).

Рис. 1. Структура АТФ
История открытия АТФ
АТФ был открыт(а) в 1929 году немецким биохимиком Карлом Ломаном (Karl Lohmann) и, независимо Сайрусом Фиске (Cyrus Fiske) и Йеллапрагада Субба Рао (Yellapragada Subba Rao) из Гарвардской медицинской школы. Однако структура АТФ была установлена только спустя несколько лет. Владимир Александрович Энгельгардт в 1935 году показал, что для сокращения мышц необходимо присутствие АТФ. В 1939 году В. А. Энгельгардт совместно со своей женой М. Н. Любимовой предъявили доказательства, что миозин проявляет ферментную активность при этом расщепляется АТФ и высвобождается энергия. Фриц Альберт Липманн (Fritz Albert Lipmann) в 1941 году показал, что АТФ является основным переносчиком энергии в клетке. Ему принадлежит фраза «богатые энергией фосфатные связи». В 1948 году Александр Тодд (Alexander Todd) (Великобритания) синтезировал АТФ. В 1997 году Пол Д. Бойер (Paul D. Boyer) и Джон Э. Уокер (John E. Walker) получили Нобелевскую премию по химии за разъяснение ферментативного механизма, лежащего в основе синтеза АТФ.
Содержание АТФ в мышечных волокнах
Количество АТФ в тканях организма человека относительно невелико, поскольку он (она) в тканях не запасается. В мышечных волокнах содержится 5 ммоль на кг сырой ткани или 25 ммоль на кг сухой мышечной ткани.
Гидролиз АТФ
Непосредственным источником энергии при мышечной деятельности является АТФ, который (ая) находится в саркоплазме мышечных волокон. Освобождение энергии происходит в результате реакции гидролиза АТФ.
Гидролиз АТФ - реакция, протекающая в мышечных волокнах, при которой АТФ, взаимодействуя с водой распадается на АДФ и фосфорную кислоту (Н3РО4). При этом выделяется энергия. Гидролиз АТФ ускоряется ферментом АТФ-азой. Этот фермент находится на каждой миозиновой головке толстого филамента.
Реакция гидролиза АТФ имеет следующий вид:
В результате гидролиза 1 моль АТФ выделяется энергия, равная 42-50 кДж (10-12 ккал). Скорость протекания реакции гидролиза повышают ионы кальция. Следует отметить, что АДФ (аденозиндифосфат) в мышечных волокнах выполняет роль универсального акцептора (приёмника) высокоэнергетического фосфата и используется для образования АТФ.
Фосфорная кислота (Н3РО4) в саркоплазме мышечных волокон достаточно быстро диссоциирует на ионы водорода и остаток фосфорной кислоты. В настоящее время доказано, что именно реакция гидролиза АТФ приводит к ацидозу, то есть закислению мышцы, а не гликолиз АТФ, в результате которого образуется молочная кислота (или более точно — лактат).
Фермент АТФ-аза расположен на миозиновых головках, что играет существенную роль в сокращении мышечных волокон. Активность фермента АТФ-азы лежит в основе классификации мышечных волокон на медленные (I тип), промежуточные (IIA тип) и быстрые (IIB тип).
Химическая энергия, выделяемая в результате гидролиза в мышечных волокнах, расходуется на: сокращение мышечных волокон (взаимодействие белков актина и миозина) и на их расслабление (работу кальциевого и натрий-калиевого насосов). При взаимодействии с актином одна молекула миозина за одну секунду гидролизует 10 молекул АТФ.
Запасы АТФ в мышечных волокнах невелики и могут обеспечить выполнение интенсивной работы в течение 1-2 с. Дальнейшая мышечная деятельность осуществляется благодаря быстрому восстановлению (ресинтезу) АТФ, поэтому при сокращении мышечных волокон в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию и ресинтез АТФ, восполняющий запасы АТФ в мышечных волокнах.
Ресинтез АТФ
Ресинтез АТФ - синтез АТФ в мышечных волокнах из различных энергетических субстратов во время физической работы. Его формула выглядит следующим образом:
- без участия кислорода (анаэробный путь);
- с участием кислорода (аэробный путь).
Если в саркоплазме мышечных волокон недостаточно АТФ, то затрудняется процесс их расслабления. Возникают судороги.
Видео про гидролиз и ресинтез АТФ
Литература
- Михайлов С.С. Спортивная биохимия. - М.: Советский спорт, 2009.- 348 с.
- Волков Н.И., Несен Э.Н., Осипенко А.А., Корсун С.Н. Биохимия мышечной деятельности.- Киев: Олимпийская литература, 2000.- 504 с.
[1] Макроэргические соединения - химические соединения, содержащие связи, при гидролизе которых происходит освобождение значительного количества энергии.
Похожие записи:
Распределение масс в теле человека
Описаны особенности распределения масс в теле человека. Дано понятие геометрии масс тела человека. Показано, что на…
Центр масс и центр тяжести тела
Описаны: центр масс (ЦМ) и центр тяжести (ЦТ) твердого тела. Приведены различные определения ЦМ и ЦТ тела. Показано…
Момент силы и плечо силы
Дано определение момента силы и плеча силы. Определение плеча и момента силы рассмотрено на примерах ОДА человека при…
Метаболический стресс. Накопление лактата в мышцах
Описан механизм влияния метаболического стресса (накопления лактата) на гипертрофию мышечных волокон. Показано, что накопление лактата приводит к…
Механическое повреждение мышечных волокон
Описаны механизмы механического повреждения мышечных волокон при силовой тренировке, приводящие к гипертрофии скелетных мышц. Показано, что механическое повреждение…
Механическое напряжение (механотрансдукция) в скелетных мышцах
Описаны процессы передачи механического напряжения в скелетных мышцах. Показано, что механическое напряжение, возникающее вследствие сокращения скелетных…
научная статья по теме ВНУТРИКЛЕТОЧНЫЙ ТРАНСПОРТ, ОСНОВАННЫЙ НА ПОЛИМЕРИЗАЦИИ АКТИНА (ОБЗОР) Химия

Текст научной статьи на тему «ВНУТРИКЛЕТОЧНЫЙ ТРАНСПОРТ, ОСНОВАННЫЙ НА ПОЛИМЕРИЗАЦИИ АКТИНА (ОБЗОР)»
БИОХИМИЯ, 2014, том 79, вып. 9, с. 1135 - 1147
ВНУТРИКЛЕТОЧНЫЙ ТРАНСПОРТ, ОСНОВАННЫЙ НА ПОЛИМЕРИЗАЦИИ АКТИНА
Обзор © 2014 С.Ю. Хайтлина
Поступила в редакцию 17.04.14
Наряду с внутриклеточным перемещением частиц (груза) по микротрубочкам в клетке существуют две актин-зависимые транспортные системы. В одной из них, актомиозиновой, транспортером является миозин, который перемещает груз по актиновым микрофиламентам. Этот транспорт обеспечивается гидролизом АТФ в моторном домене молекулы миозина, индуцирующим конформационные изменения молекулы, в результате которых миозин движется вдоль нити актина. Другая актин-зависимая транспортная система клетки не связана с миозином или другими моторными белками. Эта система основана на полимеризации актина, которая имеет однонаправленный характер, определяемый гидролизом АТФ в полимерах актина, и инициируется белками, связанными с поверхностью переносимых частиц. Обязательными компонентами актин-зависимого транспорта являются белки семейства WASP/SCAR и комплекс белков Arp2/3. Кроме того, актин-зависимые транспортные системы часто содержат динамин и кортактин. Показано, что с помощью системы актиновых филаментов, формирующихся на поверхности частицы, так называемого «ко-метоподобного хвоста», двигаются внутри клетки патогенные бактерии, перемещаются макропиноцитоз-ные везикулы, клатриновые окаймленные пузырьки и фагосомы, и это движение воспроизводится в бесклеточной системе, содержащей экстракт ооцитов лягушки. Формирование кометоподобной структуры, способной транспортировать везикулу от плазматической мембраны в глубь клетки, детально исследовано с помощью электронной микроскопии высокого разрешения в сочетании с электронной томографией. Похожий механизм обеспечивает движение везикул, содержащих мембранные рафты, обогащенные сфинго-липидами и холестерином, изменение положения ядерного веретена при мейозе и другие процессы. В настоящем обзоре рассмотрены современные представления о полимеризации актина и ее регуляции актин-связывающими белками и показано, как эти механизмы реализуются в актин-зависимой транспортной системе клетки.
КЛЮЧЕВЫЕ СЛОВА: цитоскелет, актин, Arp2/3, динамин, внутриклеточные везикулы, «кометоподобные хвосты».
Внутриклеточный транспорт связывают, прежде всего, с перемещением частиц (груза) по микротрубочкам. Вместе с тем, в клетках существует две актин-зависимые транспортные системы. В первой из них, актомиозиновой, транспортером является миозин, который взаимодействует с актиновыми микрофиламентами. Так же, как при скольжении мышечного миозина по нитям актина, перемещение немышечных изо-форм миозина по актиновым микрофиламентам осуществляется за счет АТФ-зависимого взаимодействия моторного домена (головки) миозина с актином, гидролиза АТФ, связанного в моторном домене миозина, и конформационных изменений в шейном домене молекулы миозина, индуцированных гидролизом АТФ. Однако, в отличие от мышечного миозина, немышечные
Памяти Георгия Петровича Пинаева
миозины, как правило, имеют короткие хвостовые домены, которые не образуют нитей, но содержат структурные мотивы, способствующие взаимодействию миозина с другими белками и липидами, т.е. прикреплению груза [1—3]. Наиболее изученным моторным белком этой транспортной системы является миозин V [3—6], структурно и функционально сходный с моторными белками тубулиновой транспортной системы кинезином и динеином [7, 8]. Это сходство позволяет миозину V перемещаться не только по актиновым филаментам, но и по микротрубочкам [9—11]. Предполагается, что, в отличие от транспортной системы, состоящей из микротрубочек и кинезина/динеина, которая перемещает груз на длинные расстояния, транспорт по актиновым филаментам является локальным [6].
Еще одна актин-зависимая транспортная система не связана с миозином или другими моторными белками. Эта система основана на перемещении частиц с помощью «кометоподоб-ного хвоста», образующегося на поверхности частицы в результате полимеризации актина, которая имеет направленный характер, определяемый гидролизом АТФ в полимерах актина, и инициируется белками, связанными с поверхностью переносимых частиц. Обязательными компонентами актин-зависимого транспорта являются белки семейства МА8Р/8саг и комплекс белков Агр2/3 и/или динамин и кортактин [12, 13]. Показано, что с помощью «кометопо-добного хвоста» перемещаются макропиноци-тозные везикулы (пиносомы) [14, 15], клатрино-вые окаймленные пузырьки [16], эндосомы и лизосомы в ооцитах шпорцевой лягушки Хепорш и в бесклеточной системе, содержащей экстракт ооцитов этой лягушки [17]. Похожий механизм обеспечивает движение везикул, содержащих мембранные рафты, обогащенные сфинголипидами и холестерином [18], и изменение положения ядерного веретена при мейозе [19—21]. В настоящем обзоре рассмотрены современные представления о полимеризации актина и ее регуляции актин-связывающими белками и показано, как эти механизмы реализуются в актин-зависимой транспортной системе клетки.
ПОЛИМЕРИЗАЦИЯ АКТИНА И ДИНАМИКА АКТИНОВЫХ НИТЕЙ
Динамика актиновых структур клетки основана на важнейшем свойстве актина — его способности к обратимой полимеризации. Актин в растворе — это глобулярный белок (О-актин). Молекула актина образована двумя доменами, разделенными глубокой щелью, в которой находятся прочно связанный катион, Са2+ или М^2+, и нуклеотид, АТФ или АДФ [22] (рис. 1, а, врезка). Поэтому актин относится к семейству АТФ-связывающих белков, в котором и обмен нукле-отида, и гидролиз АТФ играют функциональную роль. При физиологических условиях мономеры актина ассоциируют друг с другом, образуя двуспиральный полимер (нить актина, микрофиламент, Б-актин) [23]. Структура этого полимера описывается или как два спиральных длинношаговых тяжа, нековалентно ассоциированных друг с другом, или как одна короткоша-говая спираль [24] (рис. 1, а, б). Так как все мономеры актина ориентированы в одном направлении, нити актина полярны. Морфологически полярность нитей легко определяется при взаи-
модействии F-актина с миозином или его фрагментами, в результате которого образуются так называемые «стреловидные структуры», направление которых определяет «оперенный конец» стрелы (barbed end, плюс-конец) и «стреловидный конец» (pointed end, минус-конец) нити, соответствующие ее быстрому и медленному удлинению (рис. 1, в) [25].
Полимеризация актина происходит как поликонденсация, первый этап которой, нуклеа-ция — это взаимодействие мономеров, приводящее к возникновению зародышей полимеризации. Устойчивыми зародышами полимеризации являются тримеры актина, которые удлиняются вплоть до установления равновесия (рис. 2, а). Удлинение нитей актина сопровождается необратимым гидролизом связанного АТФ (рис. 2, б) и освобождением неорганического фосфата. В результате гидролиза АТФ изменяется конфор-мация субъединиц актина, и связи между ними ослабляются [26]. Прямые измерения скорости ассоциации и диссоциации мономеров на концах нитей показали, что АТФ-О-актин эффективно присоединяется к быстрому (плюс-концу) нити, а АДФ-О-актин диссоциирует от медленного (минус-конца) (рис. 2, в). При этом происходит медленное «перемещение» субъединиц актина от быстрого к медленному концу нити, так называемый тредмиллинг (treadmilling) [27].
Полимеризация актина в клетке активно регулируется множеством актин-связывающих белков, определяющих ее локализацию, длину нитей и продолжительность их жизни или взаимодействующих с мономерами, поддерживая пул глобулярного актина и состояние связанного нуклеотида [28—30]. Для актин-зависимого транспорта, основанного на полимеризации актина, наиболее важными являются белки-нукле-аторы и, в частности, комплекс Arp2/3 (Actin-Related Proteins), состоящий из семи белков, в том числе Arp2 и Arp3, структура которых сходна со структурой актина, и вспомогательных белков, обеспечивающих связь с активаторами (рис. 2, г). Модельные эксперименты показали, что для взаимодействия с актином комплекс Arp2/3 должен быть активирован. В клетке эту функцию осуществляют белки семейства WASP/ /Scar. Активированный Arp2/3 инициирует полимеризацию актина или взаимодействует с нитью актина, при этом Arp2 и Arp3 являются первыми субъединицами новой нити. Когда комплекс Arp2/3 связан с нитью актина, он служит нуклеа-тором новых нитей, медленный конец которых блокирует. Это приводит к образованию сети актиновых филаментов, расположенных под углом 70° друг к другу, связанных Y-образными контак-
тами [31]. Таким образом, геометрия комплекса Агр2/3 определяет образование ветвистых (денд-ритоподобных) структур, которые оказались похожими на подмембранные структуры, выявляемые в кортикальном цитоскелете на переднем крае движущихся клеток (рис. 2, д) [32]. Оказалось также, что такие структуры могут обеспечивать внутриклеточный транспорт, что впервые было обнаружено при исследовании патогенных бактерий, которые двигаются в цитоплазме клеток эукариот с помощью пучка актиновых нитей, похожего на хвост кометы.
ВНУТРИКЛЕТОЧНОЕ ПЕРЕДВИЖЕНИЕ БАКТЕРИЙ С ПОМОЩЬЮ «КОМЕТОПОДОБНОГО ХВОСТА»
Инвазию эукариотических клеток бактериями можно наблюдать с помощью флуоресцентной и электронной микроскопии (рис. 3). Попав
на поверхность нефагоцитирующей эукариоти-ческой клетки, патогенные бактерии Listeria monocytogenes и Shigella flexneri индуцируют массивные перестройки кортикального цитоскеле-та и образование фагосом, внутри которых бактерии проникают в клетку. Затем бактерии лизи-руют мембрану фагосомы и выходят в цитоплазму. Следующей стадией процесса является нук-леация актиновых филаментов на поверхности бактерий и образование на апикальном конце бактерии «кометоподобного хвоста» — пучка ак-тиновых филаментов, который используется бактериями для движения внутри клетки [33]. Скорость этого движения равна скорости полимеризации актина [34]. Если в результате движения бактерии оказываются около клеточной мембраны, они инициируют образование прот-рузий, при контакте кото
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Читайте также:
- Болезни экспансии нестабильных нуклеотидных повторов. Примеры
- Характеристика мужчины-альфонса. Кто такие альфонсы?
- Изменения плаценты при беременности. Тромбоз межворсинчатого пространства плаценты
- Причины неврологических осложнений прививок (вакцинации) у ребенка
- Аэробное дыхание. Особенности аэробного дыхания. Цикл Кребса.