Методика исследования спонтанного нистагма. Проверка тоногенных реакций
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Рассмотрены клиническая картина болезни Меньера, описаны стадии заболевания и подходы к лечению. Несмотря на множество средств и способов, используемых при лечении болезни Меньера, до настоящего времени не существует единой лечебной тактики, поиски идеаль
Clinical representation of Meniere's disease was considered, stages of the disease and approaches to the treatment were described. Inspite of the number of means and ways used , in Menier's disease treatment, until now there is no universal strategy of treatment, searching for a perfect method is going on.
Болезнь Меньера — негнойное заболевание внутреннего уха, характеризующееся увеличением объема эндолимфы (лабиринтной жидкости) и повышением внутрилабиринтного давления, в результате чего возникают рецидивирующие приступы прогрессирующей глухоты (чаще односторонней), шума в ушах, системного головокружения, нарушения равновесия и вегетативных расстройств.
Впервые симптомокомплекс, характеризующийся тугоухостью, шумом в ушах и периодически возникающим головокружением, был подробно описан Проспером Меньером (Prosper Meniere) в 1861 г. в докладе «Об особом виде тяжелой глухоты, зависящей от поражения внутреннего уха» на заседании французской Академии медицинских наук. Тогда же это состояние получило название «болезнь Меньера». На основании четырнадцатилетнего опыта обследования больных с подобным симптомокомплексом, результатов аутопсий и данных экспериментов по перерезке полукружных каналов у голубей, опубликованных в 1824 г. физиологом Пьером Флурансом (Jean Pierre Marie Flourens), П. Меньер высказал предположение, что это заболевание связано с внутренним ухом [1]. Позднее, в 1938 г., Hallpike и Cairns доказали, что в основе болезни Меньера лежит эндолимфатический гидропс [2].
Болезнью Меньера страдают преимущественно представители европеоидной расы независимо от пола. Средний возраст больных колеблется от 20 до 50 лет, но болезнь может встречаться и у детей. Несколько чаще заболевание встречается у лиц интеллектуального труда и у жителей крупных городов.
Несмотря на неугасающий многие годы интерес ученых-медиков к данной проблеме, этиология заболевания до конца не выяснена. Существуют несколько теорий развития болезни Меньера. Так, по анатомической теории, болезнь Меньера может быть связана с патологией строения височной кости, в частности, с пониженной пневматизацией клеток сосцевидного отростка и гипоплазией вестибулярного канала, при этом малых размеров эндолимфатический мешок неправильно расположен позади лабиринта.
Согласно генетической теории, наследственная передача болезни Меньера была выявлена более полувека назад, причем результаты последних исследований (М. Verstreken, Бельгия) свидетельствуют об аутосомно-доминантном типе наследования. Полагают, что особую роль играет участок DFNA9 гена СОСН.
Иммунологическая теория подтверждается обнаружением иммунных комплексов в эндолимфатическом мешке у пациентов с болезнью Меньера.
В пользу сосудистой теории свидетельствует частое сочетание болезни Меньера с мигренью, что было замечено еще самим П. Меньером.
Согласно аллергической теории, частота аллергических реакций у больных болезнью Меньера выше, чем среди населения в целом. Так, из 734 больных болезнью Меньера, обследованных M. J. Derebery (США), 59% заявили, что они страдают установленной или предполагаемой аллергией на агенты, переносимые по воздуху, а 40% — установленной или предполагаемой аллергией к пищевым продуктам (тогда как частота аллергических реакций среди всего населения США составляет примерно 20%).
По метаболической теории при болезни Меньера в эндолимфатическом пространстве происходит задержка калия. Это вызывает калиевую интоксикацию волосковых клеток и вестибулярного нейроэпителия, в результате чего развиваются тугоухость и головокружение. Многие авторы склоняются к полиэтиологичности данного заболевания и выделяют «факторы вызывающие» и «факторы предрасполагающие» [3].
Клиническая картина болезни Меньера в подавляющем большинстве случаев (80-90%) характеризуется односторонним поражением с возможным «вовлечением в патологический процесс» и второго лабиринта. В этом случае следует говорить о «двустороннем заболевании» [4, 5].
Дебютировать болезнь Меньера может как с вестибулярных, так и со слуховых (снижение слуха, заложенность уха, ушной шум) симптомов. В первые 2-3 года заболевания тугоухость может быть флюктуирующей (преходящей) с практически полным восстановлением слуха в межприступном периоде. С годами слух постепенно снижается, вплоть до полной глухоты.
Головокружение при болезни Меньера тягостное — системное, сопровождающееся спонтанным нистагмом, атаксией, координаторными расстройствами, выраженными вегетативными проявлениями (гиперсаливация, гипергидроз, флюктуации артериального давления, диспептические расстройства). Продолжительность приступа продолжается от нескольких минут до дней (status meniericus). Выраженность головокружения также может быть различной: от легких «предвестников» до бурной реакции, во время которой больные принимают вынужденное положение на боку, соответствующему больному уху (или направлению быстрого компонента спонтанного нистагма). Атаксия и координаторные нарушения могут сохраняться в течение нескольких дней после приступа. В первые годы заболевания (до 3 лет) между приступами при проведении вестибулометрии, как правило, регистрируется экспериментальная вестибулярная норморефлексия. Позднее, в период ремиссии, регистрируется вестибулярная гипорефлексия на пораженной, а затем и на противоположной стороне. Обычно через 10 и более лет выраженность вестибулярных проявлений уменьшается.
При классическом течении болезни Меньера выделяют три стадии заболевания:
I — преобладающим симптомом является головокружение, нередко сопровождающееся тошнотой и рвотой. Могут наблюдаться бледность и потливость. Обычно приступу головокружения предшествует чувство давления в ухе или соответствующей половине головы, длящееся от 20 мин до нескольких часов. Между приступами слух нормальный.
II — развивается сенсоневральная тугоухость с преимущественным понижением звуковосприятия на низких частотах. Приступы головокружения достигают максимальной выраженности с последующей тенденцией к уменьшению тяжести проявлений.
III — отмечается прогрессивное понижение слуха с развитием двусторонней глухоты. Эпизоды головокружения уменьшаются и затем полностью исчезают; тем не менее может сохраняться атаксия, особенно в темноте.
Американская академия отоларингологии и хирургии головы и шеи (AAO-HNS) (1995 год) определяет «очевидную» болезнь Меньера следующим образом:
- два или более возникающих самопроизвольно приступа головокружения продолжительностью 20 мин и более;
- потеря слуха, подтвержденная данными аудиологических исследований, по меньшей мере в одном случае;
- шум в ушах или ощущение заложенности в причинном ухе;
- другие причины исключены [6].
Диагностика классической формы болезни Меньера основывается на характерных клинических проявлениях и данных аудиометрии. Трудности в постановке диагноза могут быть связаны с тем, что многие пациенты, у которых болезнь начинается с приступов головокружения, не могут четко описать свои жалобы. Кроме того, существует ряд заболеваний и состояний, сопровождающихся вестибулярными расстройствами [7]:
- доброкачественное пароксизмальное позиционное головокружение;
- вертебробазилярная недостаточность;
- вестибулярный нейронит;
- черепно-мозговая травма;
- фистула лабиринта;
- инфекционный лабиринтит;
- последствия отохирургических вмешательств;
- отосклероз;
- мостомозжечковые опухоли;
- рассеянный склероз;
- побочные проявления лекарственных препаратов;
- острый гнойный средний отит;
- гипервентиляция.
Расстройства, которые могут проявляться головокружением и слуховыми симптомами, представлены в таблице.
Окончательный диагноз болезни Меньера ставят на основании результатов дегидратационных тестов (в ответ на медикаментозную дегидратацию понижаются пороги звуковосприятия на низких частотах и улучшается слуховое восприятие речи), экстра- и транстимпанальной электрокохлеографии (характерная для эндолимфатического гидропса кривая) [9]. Регистрируется суммационный потенциал (СП) и потенциал действия (ПД). Нарушение соотношения значений амплитуд СП/ПД (р > 0,3) является характерным признаком гидропса лабиринта, записи вестибулярных вызванных миогенных потенциалов (характерно отсутствие пиков Р13, N23 — график в виде прямой).
Обследование больных с болезнью Меньера должно включать ряд обязательных тестов. К традиционным равновесным тестам, диагностически довольно надежным, относятся проба Ромберга, проба Унтербергера, проба Бабинского-Вейля, указательная проба Барани. Перечисленные исследования в последние годы несколько утратили свое значение, поскольку в специализированных клиниках используют специальное оборудование для вестибулометрии и усложненные тесты. Кроме того, в «батарею тестов» входят: выявление спонтанной отоневрологической симптоматики, калорические тесты (тепловой и холодовой), вращательный тест Барани, тест плавного слежения, тест саккад, исследование оптокинетического нистагма.
Лечение болезни Меньера является эмпирическим, поскольку нет единого взгляда на этиопатогенез данного заболевания. Все существующие в настоящее время способы и методы лечения направлены на облегчение переносимости больными приступов головокружения, но не изменяют значительно течение процесса и не предотвращают развитие тугоухости [7]. Однако индивидуальная, подбираемая с учетом сопутствующих заболеваний терапия может замедлить развитие тугоухости, уменьшить выраженность ушного шума, уменьшить частоту и выраженность головокружения [5].
При лечении острого приступа болезни Меньера применяют в основном медикаментозную и, при наличии условий, карбогено- или оксигенотерапию. Используют седативные препараты и средства, улучшающие мозговое кровообращение (прохлорперазин, прометазин, циннаризин, диазепам) [7], дегидратационные средства. В остром периоде целесообразно вводить препараты парентерально или в свечах. Целесообразно проведение заушных новокаиновых блокад [4].
Одной из наиболее известных схем купирования острого приступа болезни Меньера является схема, разработанная И. Б. Солдатовым и Н. С. Храппо (1977): глюкоза 40% — 20,0 в/в, Пипольфен 2,5% — 2,0 в/м (или Аминазин 2,5% — 1,0 в/м), атропина сульфат 0,1% — 1,0 п/к (или платифиллина гидротартрат 0,2% — 2,0 п/к), кофеин-бензоат натрия 10% — 1,0 п/к; горчичники на шейно-затылочную область, грелка к ногам [9]. Иногда к означенной схеме добавляют ксантинола никотинат 15% — 2,0 в/м или циннаризин, либо винпоцетин [4]. Лечение в межприступном периоде (поддерживающая терапия) должно быть комплексным и довольно активным. Показаны средства, предотвращающие развитие или уменьшающие эндолимфатический гидропс: диуретики (фуросемид, амилорид, гидрохлортиазид), вазодилататоры (аналог гистамина — бетагистина дигидрохлорид), препараты, улучшающие мозговое кровообращение (циннаризин, пропранолол), кортикостероиды, а также немедикаментозное лечение — вестибулярная реабилитация, иглорефлексотерапия.
По современным представлениям, бетагистина дигидрохлорид имеет три уровня действия:
- на кохлеарный кровоток;
- на центральный вестибулярный аппарат;
- на периферический вестибулярный аппарат.
Являясь слабым агонистом Н1-рецепторов и активным блокатором Н3-рецепторов, данный препарат стимулирует постсинаптические гистаминовые рецепторы. Именно Н3-антагонистическим эффектом бетагистина дигидрохлорида объясняют эффект нормализации возбуждения вестибулярных ядер в подкорковых структурах центральной нервной системы и вазоактивную составляющую действия этого препарата [11, 12]. Следует подчеркнуть избирательность вазоактивного действия бетагистина дигидрохлорида [11], который улучшает микроциркуляцию внутреннего уха и проницаемость капилляров, а также нормализует давление эндолимфы в лабиринте, не приводя к выраженному снижению артериального давления. Препарат также положительно влияет на передачу нервного импульса в медиальных и латеральных вестибулярных ядрах и периферических вестибулярных рецепторных образованиях [13]. Опыт многих клиницистов свидетельствует о том, что бетагистина дигидрохлорид уменьшает интенсивность головокружений, сокращает длительность эпизодов головокружений, делает их более редкими. Препарат эффективен как для купирования приступов головокружений и профилактики их рецидивов, так и для уменьшения субъективного ушного шума.
Следует отметить целесообразность использования бетагистина дигидрохлорида у пациентов с болезнью Меньера и в постоперационном периоде — головокружение, как правило, исчезает на 3-4 день после операции [5].
Особняком стоит использование аминогликозидов, обладающих токсическим действием в отношении клеток нейроэпителия внутреннего уха. Метод может использоваться на поздних стадиях БМ при двустороннем поражении и применяется у лиц, которым противопоказано хирургическое лечение. Интратимпанальное введение аминогликозидов достаточно эффективно и возможно при одностороннем поражении [14].
При явной неэффективности консервативного лечения целесообразны различные хирургические вмешательства, как щадящие (слухосохраняющие), так и деструктивные. Деструктивные методы показаны при тяжелых инвалидизирующих формах болезни Меньера. Выделяют 5 групп:
1 — вмешательства на автономной нервной системе (хорд- и хордплексусэктомия);
2 — перерезка сухожилий мышц барабанной полости;
3 — декомпрессивные операции на внутреннем ухе;
4 — деструктивные операции на лабиринте;
5 — деструктивные операции на преддверно-улитковом нерве [5].
К слухосохраняющим операциям относятся:
- шунтирование эндолимфатического мешка — наиболее распространенное хирургическое вмешательство при БМ;
- саккулотомия — декомпрессивная операция на сферическом мешочке;
- пересечение вестибулярного нерва с целью прекращения афферентной импульсации, что способствует исчезновению вестибулярных расстройств.
При безуспешности щадящих видов хирургических вмешательств проводят деструктивные операции:
- лабиринтэктомия;
- кохлеосаккулотомия;
- вестибулярная нейрэктомия.
Следует отметить, что операции на автономной нервной системе и перерезка сухожилий мышц барабанной полости малоэффективны, а декомпрессивные и деструктивные хирургические вмешательства, как правило, приводят к глухоте на оперированное ухо и возобновлению приступов головокружений в отдаленные сроки в связи с фиброзным заращением созданных соустий; деструктивные операции на преддверно-улитковом нерве выполняются в отделениях нейрохирургии.
В настоящее время применяется такой метод хирургического лечения, как лазеродеструкция горизонтального полукружного канала, которая позволяет добиться избавления от приступов головокружения в ближайшие и отдаленные сроки, сохранить слух и задержать развитие гидропического процесса в другом ухе при одностороннем процессе.
Однако, несмотря на обилие научных работ, посвященных болезни Меньера, множество средств и способов, используемых при ее лечении, проблема, по существу, остается нерешенной, поскольку до настоящего времени не существует единой, признанной всеми ведущими специалистами лечебной тактики. Поиски идеального метода лечения болезни Меньера продолжаются.
Литература
- Meniere M. P. Pathologie auriculare. Maladies de l’orielle interne offrant les symptomes de la congestion cerebrale apoplectiforme // Gaz. Med. de Paris. 1861. T. 16. P. 88-89.
- Hallpike C. S., Cairns H. Observation on the pathology of Meniere’s syndrome // J. Laryngol. Otol. 1938. Vol. 53. P. 625-655.
- Сагалович Б. М., Пальчун В. Т. Болезнь Меньера. М.: ООО «Медицинское информационное агентство», 1999. 525 с.
- Бабияк В. И., Ланцов А. А., Базаров В. Г. Клиническая вестибулология. СПб: «Гиппократ», 1996. 336 с.
- Патякина О. К. Лечебная тактика при вестибулогенном головокружении // Consilium medicum. Приложение. 2001. С. 9-12.
- Monsell E. M. New and revised reporting guidelines from the Committee on Hearing and Equilibrium. American Academy of Otolaryngology — Head and Neck Surgery Foundation, Inc. Otolaryngology — Head and Neck Surgery. 1995. 113 (3). Р. 176-8.
- Нурмухаметова Е. Диагностика и лечение болезни Меньера // Русский медицинский журнал. 1998. № 20. С. 1346-1347.
- Bronsteind A. M., Lempert Th. Dizzines. Cambridge University Press, 2007. P. 215.
- Gibson W. P. R, Prasher D. K., Kilkenny G. P. G. Diagnostic significance of transtympanic electrocochleography in Meniere’s diseas // Ann. Otol. Rhinol. Laryngol. 1983. Vol. 92. P. 155-159.
- Солдатов И. Б., Храппо Н. С. Методы лечения болезни Меньера // Журн. ушн., нос. и горл. бол. 1977. № 6. с. 8-14.
- Timmerman H. Рharmakoterapy of vertigo: any news to be expected? // Acta Otolaryngol. 1994, Suppl 513, 28-32.
- Van Cauwenberge P. B., De Moor S. E. G. Physiopathology of H 3-receptors and pharmacology of betahistine // Acta Otolaryngol. 1997. Suppl. 526. P. 43-46.
- Arrang J. M., Garbarg M., Quach T. T., Toung M. D. T., Yeramian E., Schwarts J. C. Actions of betahistine at histamine receptors in the brain // Eur Pharmacol. 1985. Vol. 11. P. 73-84.
- Pfleiderer A. G. The current role of local intratympanic Gentamicin therapy in the management of unilateral Meniere’s disease // Clin Otolaryngol. 1998. Vol. 23 (1). P. 34-41.
О. В. Зайцева, кандидат медицинских наук
ФГБУ НКЦ оториноларингологии ФМБА России, Москва
Исследование спонтанных вестибулярных реакций. Исследование нистагменных реакций
Нистагм является одним из наиболее ценных количественных показателей характеристики состояния вестибулярной функции. Его исследование достаточно распространено в физиологии, теоретической и прикладной медицине. Изучение разных показателей нистагма у многих больных помогает решить задачу вестибулярной диагностики. Среди ряда форм и видов проявлений нистагма в практической деятельности представляют интерес его главные разновидности — спонтанный, позиционный, прессорный и оптокинетический нистагм.
Для получения точных данных о параметрах нистагма в настоящее время все более значительное распространение приобретают объективные методы его регистрации, в частности электронистагмография. Однако внедрение электронистагмографии в амбулаторно-поликлинических учреждениях задерживается из-за высокой стоимости аппаратуры, необходимости выделения дополнительного персонала для ее обслуживания, создания специальных камер, оборудованных заземленными контурами, а также из-за больших затрат времени для расшифровки полученных данных.
В отличие от электронистагмографии и других объективных методов пистагмометрии традиционные приемы выявления и оценки нистагма, хотя и уступают в точности инструментальным измерениям, поскольку базируются исключительно на визуальном наблюдении исследователя, однако не нуждаются в аппаратуре, доступны в любых условиях работы и остаются наиболее популярными в клинической практике.
Исследование спонтанного нистагма проводится следующим образом. Обследуемому предлагают сесть на стул лицом к свету и следить глазами (не поворачивая головы) за перемещением указательного пальца исследователя. Палец держат на расстоянии 30—30 см от глаз больного на их уровне. Отмечают, движутся ли у обследуемого глазные яблоки, когда он смотрит прямо перед собой, следит за движением пальца вправо-влево, вниз. Для более удобного наблюдения за нистагмом больному надевают очки с линзами +20 дптр, предложенные Н. Frenzel (1938).
На внутренней стороне оправы вмонтированы миниатюрные лампочки, питающиеся от карманных аккумуляторов. Такие очки, освещающие и увеличивающие глаза, дают возможность уловить наименьшие движения, которые не удается обнаружить при простом визуальном осмотре. Кроме того, очки не позволяют больному фиксировать взгляд на окружающих предметах, что может воспрепятствовать появлению нистагма. Необходимо избегать крайних отведений глаз, поскольку у больного при этом могут появиться кратковременные нистагмовые движения (учредительный нистагм) из-за усталости глазных мышц или слабой фиксации взгляда.
С помощью нистагмометрии определяют, при каком отведении глаз возникает спонтанный нистагм, в какую сторону он направлен, его интенсивность, ритм, амплитуду.
Направление нистагма определяется по его быстрому компоненту. Медленная фаза характеризует, в сущности, состояние лабиринта, его ответ на раздражение рецепторов полукружных каналов, вызванное заболеванием. По направлению эта фаза совпадает с реакцией отклонения рук и туловища. Различают горизонтальный, горизонтально-ротаторный и вертикальный нистагм (рис. 28).
Рис. 28. Разновидности нистагма (по направлению): а — горизонтальный; 6 — горизонтально-ротаторный; в — диагональный; г — ротаторный; д — вертикальный
Выделяют 3 степени интенсивности спонтанного нистагма (рис. 29): нистагм, возникающий при крайнем отведении глаз в сторону быстрого компонента, — слабая (I) степень; при прямом взгляде вперед — средней силы (II) степень; при взгляде в сторону медленного компонента — сильная (III) степень. Нистагм III степени, как правило, обнаруживают при условии выраженного раздражения лабиринта.
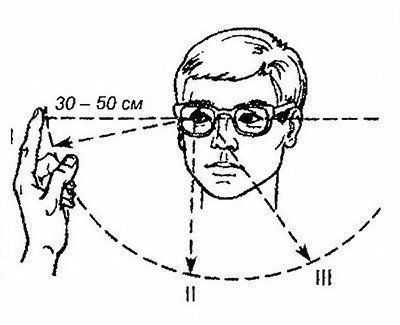
Рис. 29. Определение интенсивности спонтанного нистагма: I, II, III — степени интенсивности нистагма (нистагм вправо)
По амплитуде (размах колебаний глазных яблок) различают 3 градации спонтанного нистагма: мелкоразмашистый, среднеразмашистый и крупноразмашистый. Нистагм, обусловленный поражением лабиринта, характеризуется горизонтальным или горизонтально-ротаторным направлением, реже ротаторным и почти не бывает вертикальным.
Вертикальный нистагм (кверху или книзу) расценивается как признак ретролабиринтного поражения вестибулярного анализатора — вестибулярных ядер и ведущих путей преимущественно в области верхних отделов ромбовидной ямки или среднего мозга. Нистагм ротаторного характера может наблюдаться также при условии локализации патологического очага в нижних отделах ромбовидной ямки и направлен он в сторону поражения.
В начальной стадии заболевания спонтанный нистагм направлен в сторону пораженного лабиринта. Такой нистагм может длиться несколько часов (редко — 2—3 дня). В случае дальнейшего развития процесса нистагм изменяет свое направление в здоровую сторону и длится до тех пор, пока не состоится компенсация со стороны ЦНС. Компенсаторные механизмы развиваются в течение 2—4 нед. Таким образом, по направлению нистагма в некоторой степени можно судить о стороне поражения лабиринта.
Продолжительность спонтанного нистагма считается ценным клиническим показателем, имеющим значение в диагностике вестибулярных нарушений и прогнозировании результатов лечения. Нистагм, связанный с поражением лабиринта, длится обычно не более 2—3 нед и постепенно слабеет вплоть до полного исчезновения. Более продолжительный нистагм характерен для поражения центральных звеньев вестибулярной системы и часто свидетельствует о локализации процесса в области задней черепной ямки.
Спонтанный нистагм бывает разной интенсивности и амплитуды в зависимости от вестибулярных нарушений. При поражении лабиринта наблюдается нистагм преимущественно I и II степени; чаще он бывает мелкоразмашистым или среднеразмашистым. Крупноразмашистый нистагм III степени наблюдается в основном при центральном поражении вестибулярного анализатора, особенно если патологический процесс локализуется на уровне задней черепной ямки и в надтенториальном пространстве и влияет на стволовые вестибулярные образования.
В острой стадии заболевания нистагм сопровождается всеми другими признаками вестибулярной дисфункции — головокружением, вегетативными расстройствами, нарушением статического равновесия и походки.
Методика исследования спонтанного нистагма. Проверка тоногенных реакций
Республиканский научно-практический центр неврологии и нейрохирургии Министерства здравоохранения Республики Беларусь, Минск
ГУ "Республиканский научный и клинический центр неврологии и нейрохирургии" Минздрава Беларуси, Минск, Беларусь
Диагностика латентной вестибулярной дисфункции на основе характеристик провокационного нистагма
Цель исследования - разработать новый метод диагностики латентной вестибулярной дисфункции, оценить с его помощью особенности спонтанного нистагма, провокационного нистагма, вестибулоокулярного оптокинетического рефлексов у операторов движущихся систем, определить их диагностическое и прогностическое значение. Исследование проведено у 95 пациентов, включало клиническое исследование вестибулярной функции. Представлен анализ параметров спонтанного и провокационного нистагма, вестибулоокулярного рефлекса и оптокинетического нистагма в группах исследования. Установлено, что при синдроме минимального неврологического дефицита высока доля пациентов с положительным тестом Вальсальвы - 83,33%, при периферическом вестибулярном синдроме и синдроме вертеброгенной вестибулярной дисфункции в анамнезе достоверно велика (p
Изучение латентной вестибулярной дисфункции (ВД) у лиц, подвергающихся динамическим факторам авиационного и космического полета, а также у операторов подвижных систем, является актуальным. В настоящее время в авиакосмической физиологии накоплен большой экспериментальный материал, посвященный изучению вестибулярного аппарата в условиях действия на организм ускорений, однако в литературе до сих пор нет указаний на исследования, в которых проводилось бы одновременное многофакторное физиологичное исследование вестибулярной функции [1—3].
Рост числа головокружений обусловлен увеличением сосудистой патологии, травматизма, интоксикации алкоголем и антибиотиками, а также патологии шейного отдела позвоночника [1, 3, 4, 6]. ВД значительно ухудшает качество жизни пациентов, лишает их возможности вести привычный образ жизни и качественно выполнять профессиональные обязанности [6—9]. Несмотря на большую встречаемость пациентов с жалобами на головокружение, подходы к освидетельствованию остаются малоизученным вопросом. В практической деятельности врача-отоневролога и экспертов встречаются трудности в объективной количественной оценке степени выраженности вестибулярных нарушений, что в ряде случаев приводит к ошибкам при решении вопросов о стадии ВД и в ее экспертной оценке. Диагностика латентной ВД у лиц с вегетативной неустойчивостью и минимальным неврологическим дефицитом — важная клиническая задача. Современная диагностика вестибулярных нарушений должна базироваться на комплексных данных инструментальных исследований и определять прогностическое значение полученных результатов.
Цель исследования — разработка нового метода диагностики латентной ВД у военнослужащих и операторов движущихся систем на основе исследования спонтанного, провокационного нистагма, вестибулоокулярного и оптокинетического рефлексов, определение их диагностического и прогностического значения.
Пациенты и методы
В основу метода выявления провокационного нистагма положено минимальное физиологичное воздействие на вестибулярный аппарат. Пациент располагался в стационарном кресле. Для проведения ЭНГ электроды накладывали у наружных углов глаз, индифферентный электрод закрепляли на коже лба [2, 11].
Программа исследования включала следующие тесты:
1. Калибровка горизонтальных движений глаз.
3. Исследование нистагма с применением гипервентиляции (ГВ). Испытуемый с закрытыми глазами и одновременной регистрацией ЭНГ глубоко дышал открытым ртом в течение одной минуты, далее в течение следующей минуты нистагм регистрировали при обычном дыхании с закрытыми глазами.
4. Исследование нистагма при пробе де Клейна и его изменений при ГВ. Пациент с закрытыми глазами поворачивал голову вправо и запрокидывал к правому плечу, в течение 30 с регистрировалась ЭНГ. Далее проводили ГВ в течение 1 мин, после чего опять регистрировали ЭНГ в течение 1 мин. Затем пациент возвращал голову в исходное положение и после трехминутного отдыха выполнял тест в другую сторону [12, 14].
5. Исследование нистагма при пробе Вальсальвы. Пациент, сидя в кресле с закрытыми глазами, делал глубокий вдох, закрывал нос и рот и как бы пытался сделать энергичный выдох, во время которого воздух попадал в слуховые трубы. Движения глаз при этом регистрировали на ЭНГ в течение 20 с, далее регистрация нистагма продолжалась 20 с после пробы [13, 14].
6. Синокаротидный тест. Пациенту с закрытыми глазами записывали фоновую ЭНГ 10 с, затем производили попеременное давление (через 1 1 /2—2 с) пальцами руки (указательным и большим) на область верхней трети кивательной мышцы, несколько ниже угла нижней челюсти, в течение 20 с. С 21-й секунды движения глаз регистрировали на ЭНГ 15—20 с. Затем пациент в исходном положении после трехминутного отдыха выполнял тест с другой стороны [15].
Положительным функциональный тест (пп. 3—6) считали при появлении после стимуляции нистагма частотой выше 0,3—0,4 Гц или П-волн.
7. Исследование вестибулоокулярного рефлекса (ВОР) основано на способности стабилизировать взор при поворотах головы. Пациент, сидя в стационарном кресле, закрывал глаза и совершал активные вращения головой вправо и влево от центральной линии на 45°. Траекторию поворотов головы регистрировали посредством датчика угловой скорости, размещенного на специальном оголовье. Определяли коэффициент реактивности ВОР как соотношение скорости поворота головы и скорости противовращения глаз [16].
8. Исследование реакции подавления ВОР производили путем фиксации взора на объекте, движущемся вместе с головой испытуемого: пациенту, находящемуся в стационарном кресле, надевалось оголовье, снабженное объектом зрительной фиксации, расположенным центрально, после чего он фиксировал взор на указанном объекте и совершал активные вращения головой вправо и влево от центральной линии на 45°.
9. Исследование оптокинетического нистагма (ОКН) проводили при оптокинетической стимуляции (ОКС) на мониторе с диагональю 19". Обследуемый находился на расстоянии 30 см от монитора с фиксацией головы в центральном положении. Скорость ОКС была 20°/с, линейные размеры полос были постоянными, продолжительность регистрации 30 с в каждую сторону. При анализе ОКН учитывались: направление нистагма, коэффициенты асимметрии разнонаправленных реакций (КА, КАСМФ), который рассчитывался как отношение разности показателей разнонаправленных реакций к их сумме, коэффициент эффективности оптокинетической стимуляции (ОКС), который определяли как отношение частоты ОКС к частоте циклов ОКН за 10 с [17—19].
10. Повторная калибровка после выполнения программы обследования для исключения дрейфа усилителя прибора.
Анализ данных нистагмограмм с применением функциональных нагрузочных тестов и статистическая обработка полученных результатов в группах обследования проводилиcь на основе пакета Statistica 6.0 (StatSoft, США) и Biostat 4.03 (Россия). Методы статистического описания и анализа подбирались в зависимости от характера и типа распределения данных. Для проверки гипотезы о различии выборок (групп обследования) использованы расчет критерия Стьюдента (t) — сравнение двух независимых групп для параметрических количественных данных. Для непараметрических данных использованы: критерий Манна—Уитни (U-test), критерий Краскела—Уоллиса, критерий Уилкоксона. Наличие связи между признаками определяли непараметрическим корреляционным анализом Спирмена, с помощью критерия хи-квадрат (χ 2 ). Статистически значимыми принимали различия при величине ошибки меньше 5% (p<0,05). При расчете таких показателей, как чувствительность (Se), специфичность (Sp) и прогностическая значимость, рассчитывалось отношение правдоподобия (likelihood ratio — LR) для положительного результата (LR+) и отрицательного результата теста (LR-).
Результаты и обсуждение
Был проведен сравнительный анализ частоты выявления нистагма при провокационных тестах в основной и контрольной группах. Установлено, что при выявлении спонтанного нистагма в группах обследования значимых отличий не имеется: 10 (16,7%) случаев в основной группе и 7 (20%) в контрольной группе (p>0,05). Необходимо уточнение его этиологии с помощью функциональных нагрузочных тестов.
В основной группе отношение правдоподобия пробы де Клейна составило LR+=1,92, пробы де Клейна с гипервентиляцией — LR+=3,08, пробы Вальсальвы — LR+=2,83, синокаротидного теста — LR+=2,33, пробы ГВ — LR+=3,25 по сравнению с выявлением спонтанного нистагма. Таким образом, в основной группе эти провокационные тесты являются достоверно более информативными, чем исследование спонтанного нистагма.
Функциональные тесты выявили провокационный нистагм в основной группе чаще: при синдроме вегетативной неустойчивости положительная проба ГВ составила 19 случаев из 27 (70,4%): LR+=2,38, проба Вальсальвы — 13 (48,1%): LR+=1,63, проба де Клейна с ГВ — 20 (74,4%): LR+=2,41. При синдроме минимальной неврологической дисфункции доля положительного теста Вальсальвы составила 10 случаев из 12 (83,3%): LR+=2,5. Синокаротидный тест провоцирует нистагм у пациентов с периферическим вестибулярным синдромом и вертеброгенной ВД в анамнезе и составляет 8 случаев из 10 (80%): LR+=2,45.
Затем анализировались реакции подавления нистагма путем вращения головой с фиксацией взора на движущемся вместе с головой предмете.
В основной группе у 8 (13,33%) пациентов выявлено нарушение подавления ВОР. Из них в одном случае у пациентов с синдромом вегетативной неустойчивости, в 5 случаях с синдромом минимального неврологического дефицита и в 2 случаях с вертеброгенной ВД в анамнезе. Полная двусторонняя реакция подавления ВОР отмечена в 52 случаях (86,67%). В контрольной группе только у 1 испытуемого выявлено нарушение подавления ВОР и в 34 случаях (97,1%) реакция подавления ВОР полная.
На основании проведенного обследования пациентов основной и контрольной групп и разработанных критериев латентной формы ВД (спонтанный и провокационный нистагм) нами разработан метод выявления и экспертной оценки латентной ВД у лиц с пароксизмальными состояниями и минимальным неврологическим дефектом в анамнезе (патент РБ №12586), который предусматривает:
1. В норме спонтанный нистагм отсутствует. Нистагмом считается нистагменная реакция частотой выше 0,3—0,4 Гц. Наличие спонтанного нистагма или при отсутствии спонтанного нистагма выявление его при закрытых глазах указывает на наличие ВД. Он может возникать как при поражении периферического отдела, так и при поражении центральных звеньев вестибулярного аппарата [1—3, 16].
Таких испытуемых, у которых частота нистагма ниже этих значений, можно считать здоровыми. Остальные нуждаются в более тщательном оториноларингологическом, неврологическом и инструментальном обследовании.
2. Проба с ГВ основана на создании гиперкапнии в тканях ствола головного мозга с гипоксией мозговой ткани и указывает на ВД, обусловленную вегетативной неустойчивостью. По данным литературы, регистрация П-волн свидетельствует о высокой вегетативной дизрегуляции и указывает на более глубокое поражение вестибулярных структур ствола головного мозга [9, 10, 12, 25].
При выявлении провокационного нистагма в данной пробе пациент нуждается в дополнительном обследовании: электрокардиографии (ЭКГ) и мониторинге артериального давления (АД), исследовании вариабельности сердечного ритма.
3. Проба де Клейна позволяет выявить экстравазальную цервикальную компрессию позвоночной артерии и оплетающей ее симпатической сети. Положительная проба де Клейна характерна для заднего шейного симпатического синдрома или синдрома позвоночной артерии. ГВ значительно повышает информативность пробы де Клейна [20, 21].
При выявлении провокационного нистагма в данной пробе пациент нуждается в дополнительном обследовании: рентгенографии шейного отдела позвоночника (ШОП), ультразвуковой допплерографии брахиоцефальных артерий (УЗДГ БЦА), МР-ангиографии головного мозга.
4. Проба с задержкой дыхания и создания избыточного давления в грудной и брюшной полостях (проба Вальсальвы) основана на создании гиперкапнии в тканях ствола головного мозга и затруднении венозного оттока из полости черепа с гипоксией мозговой ткани. При проведении пробы у пациентов с вегетативными нарушениями регистрируется нистагм как объективный признак латентной ВД в структуре синдрома вегетативной неустойчивости и минимальном неврологическом дефекте [22, 23].
При выявлении провокационного нистагма в данной пробе пациент нуждается в дополнительном обследовании: ЭКГ и АД-мониторинге, исследовании вариабельности сердечного ритма, эхокардиоскопии.
5. Синокаротидный тест. Установлено появление провокационного нистагма у пациентов с повышенной реактивностью синокаротидной зоны и склонностью к липотимиям и пароксизмальным состояниям [15, 24].
При выявлении провокационного нистагма в данной пробе пациент нуждается в дополнительном обследовании: ЭКГ и АД-мониторинг, рентгенография ШОП, УЗДГ БЦА, КТ/МРТ головного мозга.
6. У лиц с пароксизмальными состояниями и минимальным неврологическим дефектом в анамнезе реакции подавления ВОР путем фиксации взора на стационарном объекте хорошие, симметричные. Нарушение реакции подавления ВОР указывает на более глубокую заинтересованность структур головного мозга.
7. У лиц с пароксизмальными состояниями и минимальным неврологическим дефектом в анамнезе и у практически здоровых пациентов контрольной группы коэффициенты асимметрии ОКН не превышают 10% и являются практически симметричными.
Диагноз вестибулярной дисфункции устанавливается при наличии провокационного нистагма в 2 и более функциональных тестах.
Таким образом, допуск здоровых лиц с неблагоприятным анамнезом (наличие указаний о явлениях укачивания в полете, в транспорте, наличие липотимических состояний, предчувствие падения) или при наличии жалоб на головокружение, в экспертных целях на допуск к управлению транспортными средствами, работе на высоте, у огня и воды, у движущихся механизмов решается индивидуально после комплексного обследования, включающего вестибулометрию с функциональными нагрузочными тестами и дополнительные инструментальные методы исследования.
Кафедра оториноларингологии лечебного факультета РГМУ, Москва
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва
Научно-исследовательский испытательный центр авиационно-космической медицины и военной эргономики 4-го ЦНИИ МО РФ, Москва
Диагностическая значимость клинических методов исследования глазодвигательных реакций при головокружении
Журнал: Вестник оториноларингологии. 2015;80(2): 8‑11
Цель исследования — определение диагностической значимости физикальных вестибулярных тестов, направленных на оценку глазодвигательных реакций для определения уровня поражения вестибулярного анализатора при первичном осмотре пациента с головокружением. На основании результатов исследования была отмечена целесообразность использования очков Френзеля для выявления скрытого спонтанного нистагма и для проведения дополнительных проб. Исследование вестибулоокулярного рефлекса должно начинаться с теста поворота головы, а при сомнительном результате следует проводить тест динамической остроты зрения. Тесты плавного слежения, зрительных саккад и оптокинетического нистагма следует проводить в полном объеме. Тест субъективной зрительной вертикали должен быть использован на более поздних этапах диагностики при детальном исследовании вестибулярной функции. Позиционные маневры являются необходимой частью обследования пациента с патологией вестибулярного анализатора, так как обладают чрезвычайно высокой диагностической значимостью для выявления доброкачественного пароксизмального позиционного головокружения.
По данным литературы, постоянное головокружение и нарушения равновесия испытывают около 5% населения, при этом доля пациентов с головокружением на приеме у врача общей практики составляет 5—10%, у невролога — 10—20% [1, 2]. При обследовании этого контингента больных на амбулаторном этапе оказания медицинской помощи только в 20% случаев удается установить окончательный диагноз [3]. Сложность диагностики объясняется тем, что головокружение, нарушение равновесия и координации являются лишь симптомами множества заболеваний, различных по этиологии и патогенезу, затрагивающих как периферический, так и центральный отделы вестибулярного анализатора [4, 5]. В связи с этим первоочередной задачей врача любой специализации, обследующего пациента с головокружением, является определение уровня поражения вестибулярного анализатора.
Ввиду сложности организации и большого количества центральных связей вестибулярного анализатора для его исследования разработано достаточно много разнообразных тестовых процедур. По диагностической значимости исследование глазодвигательной функции у пациентов с головокружением и расстройством равновесия стоит на втором месте после сбора жалоб и анамнеза [4]. Однако большинство существующих глазодвигательных тестов, применяемых при клиническом осмотре, не стандартизированы [6, 7]. Проведение же всех существующих тестовых процедур и использование всего комплекса сложного диагностического оборудования при обследовании каждого пациента с головокружением ведет к значительным неоправданным временны́м и финансовым затратам [4].
Цель исследования — определение чувствительности, специфичности и диагностической значимости физикальных вестибулярных тестов, направленных на оценку глазодвигательных реакций, а также разработка оптимального набора диагностических проб для определения уровня поражения вестибулярного анализатора при первичном осмотре пациента с головокружением.
Пациенты и методы
Проведено обследование 42 пациентов, страдающих верифицированными вестибулярными расстройствами различного генеза, находившихся на лечении в ЛОР-отделении, отделении неврологии и обратившихся в консультативно-диагностический центр ГКБ № 1 им. Н.И. Пирогова. Больные были разделены на три группы в зависимости от уровня поражения вестибулярного анализатора. В 1-й группе (26 (62%) больных, из них 10 мужчин, 16 женщин; средний возраст 49,3±12,5 года) был выявлен периферический тип поражения вестибулярного анализатора, обусловленный такими нозологическими формами, как болезнь Меньера, вестибулярный нейронит, доброкачественное пароксизмальное позиционное головокружение (ДППГ), перилимфатическая фистула, а также двусторонняя токсическая вестибулопатия. Во 2-й группе (8 (19%) больных, из них 2 мужчин, 6 женщин; средний возраст 66,0±6,7 года) имело место поражение центрального отдела вестибулярного анализатора, обусловленное острым нарушением мозгового кровообращения в вертебрально-базилярной системе (6 случаев) и новообразованием мозжечка (2 случая). В 3-ю группу (8 (19%) больных, из них 6 мужчин, 2 женщины, средний возраст 64,3±10,2 года) были включены пациенты со смешанной патологией вестибулярного анализатора. Помимо этого, была сформирована контрольная группа здоровых добровольцев без патологии вестибулярного анализатора (32 человека, из них 16 мужчин, 16 женщин; средний возраст 23±3,3 года). Количественный состав групп, а так же нозологий, вошедших в 1-ю группу, представлен в табл. 1.

Таблица 1. Количественное распределение пациентов и здоровых добровольцев в группах
Диагноз пациентов был верифицирован в результате применения следующих методов исследования: видеонистагмография, битермальная калорическая проба, тональная пороговая аудиометрия, импедансометрия, дегидратационная проба или электрокохлеография, методы нейровизуализации и ультразвуковой диагностики. Кроме того, пациенты при необходимости были консультированы неврологом, офтальмологом, терапевтом.
Всем больным и лицам контрольной группы проводили оценку чувствительности и специфичности следующих методик исследования глазодвигательных реакций: исследования явного спонтанного нистагма, скрытого спонтанного нистагма в очках Френзеля и с применением видеонистагмографии (ВНГ), исследования вестибулоокулярного рефлекса (ВОР) с помощью теста поворота головы и оценки динамической остроты зрения (ДОЗ), исследование зрительных саккад, плавного слежения, оптокинетического нистагма (ОКН), подавления ВОР, теста энергичного встряхивания головы, пробы Вальсальвы, маневров Дикса—Холлпайка и МакКлюра—Панини (roll-тест), теста субъективной зрительной вертикали (СЗВ).
Для каждого из вышеперечисленных тестов нами были рассчитаны показатели чувствительности (Sp) и специфичности (Se). На основании полученных значений Sp и Se мы определили прогностическую значимость тестов, рассчитав отношение правдоподобия (likelihood ratio — LR) для положительного результата (LR+).
Результаты и обсуждение
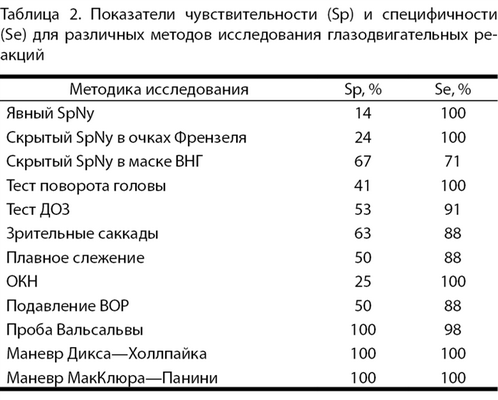
Таблица 2. Показатели чувствительности (Sp) и специфичности (Se) для различных методов исследования глазодвигательных реакций
Исследование ВОР выполнялось нами с помощью теста поворота головы и теста ДОЗ. Во время выполнения теста поворота головы ВОР был нарушен только у пациентов с периферической или смешанной патологией вестибулярного анализатора. При периферической патологии нарушение ВОР выявлялось в 38,5% случаев, а при смешанной — в 50% случаев. Исследование ВОР с помощью теста ДОЗ показало, что при совершении непрерывных поворотов головы пациента снижение остроты зрения более чем на две строки встречается как при периферической (53,8%) и смешанной (50%) патологии, так и в одном случае при чисто центральном нарушении, когда тест поворота головы оставался нормальным. Нарушение ВОР при тесте поворота головы выявляется только при достаточно выраженном угнетении лабиринта (при этом тест ДОЗ нарушен в 100% случаев). При исследовании же ДОЗ нарушения ВОР выявляются в большем количестве случаев, однако могут изредка выявляться и при чисто центральной патологии. В контрольной группе при выполнении этих тестов отклонений не было. Таким образом, тест ДОЗ обладает большей чувствительностью, но меньшей специфичностью по сравнению с тестом поворота головы (см. табл. 2).
При выполнении обоих тестов статистически значимой корреляции со степенью асимметрии «по лабиринту» после проведения калорической пробы выявлено не было, что, вероятно, связано с различной давностью патологических состояний, а, следовательно, с различной выраженностью процессов центральной компенсации.
Для центрального поражения вестибулярной системы специфичны следующие тесты: исследование зрительных саккад, плавного слежения, ОКН и подавление ВОР. Отклонения при выполнении этих тестов свидетельствуют о различной локализации патологического процесса центрального происхождения [4, 8, 9]. В нашем исследовании плавное слежение, как и подавление ВОР, было нарушено у 28,6% пациентов, при этом среди пациентов с периферическим расстройством у 15% (у всех этих пациентов имелся скрытый спонтанный нистагм II или III степени), при смешанных расстройствах — у 25 и у 75% пациентов с центральной патологией. Зрительные саккады были нарушены у 28,6% пациентов, при этом у последних с периферическим расстройством — 1 случай (нарушение в сторону нистагма), при смешанных расстройствах — 25% случаев и 100% случаев при центральном типе поражения. При исследовании ОКН нарушения были выявлены у 9,5% пациентов, причем все из них с центральной патологией. В контрольной группе вышеуказанные тесты выполнялись без нарушений.
Помимо вышеперечисленных тестов, существуют также дополнительные, проводимые в очках Френзеля: тест энергичного встряхивания головы и проба Вальсальвы.
При выполнении теста энергичного встряхивания головы нистагм выявляли у 6 пациентов с периферическим поражением вестибулярного анализатора, причем направление этого нистагма было аналогичным направлению скрытого спонтанного нистагма, выявляемого при ВНГ. У 2 пациентов нистагма не выявлено, однако возникло субъективное ощущение головокружения, что расценивалось нами как отрицательный результат. Для оценки значимости данного теста его сравнивали с исследованием нистагма в очках Френзеля и при ВНГ. Были получены следующие результаты: при отсутствии спонтанного нистагма в очках Френзеля, но при наличии его при ВНГ, тест энергичного встряхивания головы был положительным в 40% случаев.
Проба Вальсальвы была положительна у всех пациентов с подтвержденной впоследствии хирургически фистулой лабиринта как при чисто периферическом поражении, так и при смешанной патологии, когда фистула являлась периферической составляющей. Мы считали пробу положительной, если она проявлялась субъективным ощущением головокружения даже при отсутствии нистагма [2]. Среди остальных пациентов лишь в одном случае, при центральном типе поражения вестибулярного анализатора, пациент предъявил жалобу на ощущение легкого головокружения.
При тесте СЗВ отклонения вертикальной линии более чем на 2°, что считается значимым результатом, имело место у 61,1% пациентов с различным уровнем поражения вестибулярного анализатора [10, 11]. При периферической патологии значимое отклонение выявлялось у 58,3% пациентов, причем отклонение было направлено в сторону угнетенного лабиринта. Необходимо отметить, что у пациентов с ДППГ отклонение, превышающее нормальное значение, выявлено не было. При центральной патологии отклонение вертикали более 2° возникло у 75% пациентов, при этом вертикаль отклонялась в одну сторону, когда при выполнении статокинетических проб выявлялась тенденция к отклонению в одну сторону, или в обе стороны. При смешанной патологии нарушения теста СЗВ были выявлены лишь в двух случаях. В контрольной группе отклонение вертикали не превышало 2°.
В исследовании использовали такие общепринятые позиционные тесты, как маневр Дикса—Холлпайка и маневр МакКлюра—Панини (roll-test) [5, 8, 12, 13]. Они всегда были положительны при выявлении ДППГ с поражением заднего или горизонтального полукружных каналов даже при смешанной патологии. При любой другой этиологии дисфункции вестибулярного анализатора эти пробы оставались отрицательными. Необходимо также отметить, что в одном случае у пациента с поражением горизонтального полукружного канала при выполнении маневра Дикса—Холлпайка был получен кратковременный невыраженный горизонтальный нистагм, направленный в сторону пораженного лабиринта, что впоследствии подтвердилось при выполнении маневра МакКлюра—Панини. Тем не менее это не снижает диагностическую ценность маневра Дикса—Холлпайка, так как выявленный в данном случае нистагм не характерен для поражения заднего или переднего полукружного канала. В случаях поражения заднего полукружного канала roll-test всегда был отрицательным. Таким образом, подтвердилась высокая чувствительность и специфичность этих маневров (см. табл. 2).
Отношения правдоподобия положительного результата показывают, что из двух основных методов исследования скрытого спонтанного нистагма метод ВНГ (LR+=1,58) значительно уступает очкам Френзеля (LR+=14,65). Это связано с тем, что метод ВНГ, хотя и имеет более высокую чувствительность, обладает значительно меньшей специфичностью. Поэтому при исследовании только с применением ВНГ довольно высока вероятность ложноположительного заключения о вестибулопатии. Среди методов исследования ВОР как тест поворота головы, так и тест ДОЗ показали хороший результат, однако у теста поворота головы он значительно выше — LR+=41, тогда как для ДОЗ — LR+=5,82. Высок результат и у пробы Вальсальвы — LR+=58,14. Для позиционных маневров Дикса—Холлпайка и МакКлюра—Панини показатель LR+ составил 100, что еще раз подтверждает их высокую диагностическую значимость (табл. 3).

Таблица 3. Показатели отношения правдоподобия положительного результата (LR+) для различных методов исследования глазодвигательных реакций
Таким образом, на основании нашего исследования были сделаны следующие выводы:
1. При проведении клинического исследования вестибулярной функции при первичном осмотре высокую целесообразность имеет использование очков Френзеля. Они позволяют устранить фиксацию взора при оценке нистагма и обладают большей специфичностью по сравнению с исследованием скрытого спонтанного нистагма с помощью ВНГ, что позволяет избежать ложноположительных результатов. В очках Френзеля также возможно проведение таких важных дополнительных тестов, как проба Вальсальвы и тест энергичного встряхивания головы. Оба эти теста обладают достаточно высокой чувствительностью и не требуют больших временны́х затрат на их выполнение.
2. Исследование ВОР крайне важно и должно, на наш взгляд, начинаться с теста поворота головы. При отрицательном результате, если у врача остаются сомнения, тест поворота головы должен быть подкреплен тестом ДОЗ.
3. Тесты плавного слежения, зрительных саккад, ОКН и подавления ВОР, несмотря на их различную чувствительность, должны проводиться в полном объеме, так как направлены на выявление центральной патологии различной локализации, следовательно, не являются взаимоисключающими.
4. Необходимость исследования СЗВ на этапе рутинного обследования сомнительна, так как этот тест не подтвердил достаточную значимость в дифференцировке центрального и периферического поражения вестибулярного аппарата. Тест СЗВ может проводиться на более поздних этапах диагностики при детальном исследовании вестибулярной функции.
5. Позиционные маневры являются необходимой частью обследования пациента с патологией вестибулярного анализатора как обладающие чрезвычайно высокой чувствительность и специфичностью в диагностике ДППГ.
Читайте также:
