Методика катетеризации задней большеберцовой артерии путем ее выделения
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Ряд манипуляций выполняется для получения сосудистого доступа.
Катетеризация периферической вены
Потребности большинства пациентов во внутривенных инфузиях жидкости и лекарств могут быть удовлетворены с помощью чрескожного периферического венозного катетера. Если слепое чрескожное введение катетера затруднено, то ультразвуковой контроль обычно помогает успешно его установить. Венесекцию можно использовать в тех редких случаях, когда чрескожное введение катетера не представляется возможным. Типичными точками постановки катетера являются крупные вены рук и подкожные вены на лодыжке. Однако венесекция применяется редко из-за распространенной методики периферического введения центрального катетера (ПВЦК) и внутрикостного доступа Внутрикостная инфузия Ряд манипуляций выполняется для получения сосудистого доступа. Потребности большинства пациентов во внутривенных инфузиях жидкости и лекарств могут быть удовлетворены с помощью чрескожного периферического. Прочитайте дополнительные сведенияОбщие осложнения (например, местная инфекция, венозный тромбоз, тромбофлебит, интерстициальная экстравазация жидкости) могут быть минимизированы с помощью тщательного соблюдения стерильности во время введения и замены или удаления катетеров в течение 72 часов.
Катетеризация центральной вены
Пациентам, нуждающимся в безопасном и долгосрочном сосудистом доступе (например, для введения антибиотиков, химиотерапии и при полном парентеральном питании), а также пациентам и с плохим периферическим доступом, нужно установить центральный венозный катетер (ЦВК). ЦВК позволяет проводить вливание растворов, которые слишком концентрированы или обладают раздражающим действием на периферические вены, и осуществлять мониторинг центрального венозного давления Центральное венозное давление (ЦВД).
ЦВК может быть установлен через яремную, подключичную или бедренную вены или посредством периферических вен верхних конечностей (PICC линия). Хотя выбор типа катетера часто определяются клиническими характеристиками и особенностями пациента, яремный ЦВК или PICC линия, как правило, предпочтительнее, чем подключичный ЦВК (высокий риск кровотечения и пневмоторакса) или бедренный ЦВК (высокий риск инфекции). Во время остановки сердца растворы и лекарственные препараты, введенные через бедренный ЦВК, часто не циркулируют выше диафрагмы из-за повышенного внутригрудного давления, создаваемого сердечно-легочной реанимацией (СЛР). В этом случае может быть предпочтительным подключичный или внутреннеяремный доступ.
УЗИ контроль постановки внутреннего яремного катетера и PICC катетера теперь является стандартом и снижает риск осложнений. До постановки ЦВК коагулопатия должна быть купирована, насколько это возможно, также подключичный доступ не должен использоваться у пациентов с некупированной коагулопатией, поскольку в месте венопункции отсутствует возможность контроля и компрессии.
Тампон с хлоргексидином использует для подготовки кожи в правой паховой области. Для подготовки к установке центрального венозного катетера справа мы обрабатываем обширный участок кожи. После высыхания препарата помещаем наверх широкий стерильный материал. Стерильная простыня должна покрывать всю нижнюю половину тела, включая кровать между пациентом и медицинским работником. Теперь мы используем стерильный чехол, чтобы захватить ультразвуковой датчик, на который нанесен нестерильный ультразвуковой гель. Вы захватываете ультразвуковой датчик, а затем осторожно натягиваете стерильный чехол на датчик, чтобы иметь возможность использовать стерильный датчик для проведения ультразвукового исследования в режиме реального времени.
Теперь мы собираемся подготовить катетер. Устанавливаем безыгольные коннекторы на синий и белый порты катетера и собираемся использовать стерильный солевой раствор для промывки каждого из портов. Здесь мы промываем белый и синий порты катетера, на которых установлены коннекторы. На коричневый порт, который является дистальным портом, из которого будет выходить проводник, колпачок не устанавливаем, но после промывки этого порта мы должны зажать клипсой трубку катетера перед удалением шприца со стерильным физиологическим раствором.
Теперь приклеиваем стерильную этикетку на 1% лидокаин, для того, чтобы все шприцы имели стерильные идентификаторы. Затем на кожу наносят стерильный гель для ультрасонографии, и теперь мы смотрим на правую бедренную артерию и бедренную вену в поперечной проекции. Бедренная артерия находится слева вверху. При надавливании вы можете увидеть, что правая бедренная вена сдавливается, однако правая бедренная артерия, расположенная более поверхностно и левее, не сдавливается. Мы используем 1% лидокаин для местной анестезии кожи и подлежащих мягких тканей.
Теперь мы вводим проводящую иглу под углом 45 ° на ту же глубину от зонда, на которой находится вена. Мы вводим её таким образом, чтобы постепенно видеть продвижение иглы по вене, и сейчас мы наблюдаем возврат венозной крови. Мы собираемся захватить канюлю иглы и вытащить шприц, чтобы убедиться, в том, что эта кровь непульсирующая. Теперь мы собираемся ввести стерильный проводник через оболочку и через иглу. Мы собираемся повернуть зонд в продольном направлении, и мы видим, что проводник ввинчивается в вену по мере продвижения по игле.
В бедренной области проводник можно ввести даже на глубину 30 сантиметров. Теперь оболочка проводника извлекается, а сам проводник остается на месте. Теперь игла извлечена, и, оставив проводник на месте, вы все еще можете видеть на экране монитора УЗИ, что он расположен в вене. А сейчас зонд можно опустить и использовать стерильную марлю для того, чтобы точно отметить место введения, после чего можно использовать скальпель для надреза кожи над проводником. Теперь по проводнику вводят расширитель, и проводник захватывают на противоположном конце расширителя. Расширитель вводят вкручивающими движениями для расширения тракта, проходящего через подкожную ткань к бедренной вене.
Теперь расширитель извлекают, оставляя проводник на месте. Затем проводник снова вводят через центральный венозный катетер до тех пор, пока вы не сможете захватить проводник на противоположном конце коричневого или дистального порта катетера. Сейчас проводник захватывают возле дистального конца катетера, после чего катетер продвигают на всю длину. А сейчас проводник извлекают обратно в стерильную оболочку и полностью извлекают из тела. Как только проводник полностью извлечен, коричневый порт клипируют.
Теперь мы устанавливаем последний безыгольный колпачок на коричневый порт, снимаем с него клипсу, после чего можно осуществить забор крови в шприц и затем промыть весь просвет, соблюдая осторожность, чтобы не впустить воздух в порт. Сейчас белый и синий порты центрального венозного катетера промывают стерильным физиологическим раствором. Сейчас для обезболивания кожи, прилегающей к центральному венозному катетеру, используется местная анестезия, на месте введения накладывается пластырь с голубой стороной, направленной вверх. Это пластырь, пропитанный хлоргексидином, что позволяет минимизировать риск катетер-ассоциированных инфекций кровотока.
А теперь накладывают шов для фиксации катетера в двух местах. После этого для завершения процедуры на центральный венозный катетер накладывается стерильная окклюзионная повязка. В данном случае для фиксации центрального катетера используют инструментальное завязывание узла в двух точках.
Пациента помещают в положение Тренделенбурга [ph 00:15], а затем используют тампон с хлоргексидином для подготовки левой половины передней стенки грудной клетки до середины шеи, затем захватывая более обширную область, включая левое плечо. Для полного высыхания хлоргексидина нужно по крайней мере две минуты для достижения хорошего антисептического эффекта. Сейчас накладывают широкую стерильную простыню с отверстием в центре места установки катетера. Эта стерильная простыня должна покрывать голову и почти всю кровать.
Сейчас мы подготавливаем 1-процентный лидокаин, который мы будем использовать для местной анестезии. Так как все жидкости в стерильной области должны быть маркированы, после того, как шприц заполнен лидокаином, на него наклеивают стерильную этикетку с надписью "1-процентный лидокаин". Шприцы с физиологическим раствором уже предварительно маркированы и, следовательно, не нуждаются в нанесении дополнительной стерильной маркировки. Теперь мы одеваем стерильную оболочку на линейный датчик для того чтобы мы могли использовать ультразвук в режиме реального времени для ориентирования при установке этого подключичного катетера под ультразвуковым контролем. Стерильное покрытие должно покрывать всю стерильную простынь.
Теперь мы завяжем несколько стерильных резиновых лент, чтобы удерживать стерильную оболочку на месте. Сейчас мы используем стерильный физиологический раствор, чтобы промыть все порты катетера. При этом мы меняем классические игольчатые коннекторы на безигольные, которые накладываются на синий и белый порт этого катетера с тройным просветом. Коричневый порт катетера с тройным просветом является дистальным портом и останется без коннектора, потому что, в конечном итоге, проводник будет извлечен назад через этот коричневый порт. После того, как вы промойте коричневый порт, на него следует наложить клипсу перед тем, как извлечь шприц.
Теперь мы используем местную анестезию, чтобы обезболить кожу и подлежащую подкожную клетчатку в месте введения. Мы используем линейный датчик и технику enPlanE, чтобы видеть иглу на всем пути от кожи до аксилярной вены, которая визуализируется в продольной плоскости. В этот момент вы можете увидеть, что игла почти вошла в вену. В этот момент она как раз прошла через стенку и вы можете аспирировать пурпурную кровь, как это видно здесь. Затем захватывается канюля иглы, извлекается шприц, после чего J-образный проводник продевают через канюлю иглы, направляя изгиб в сторону к сердцу. Вы можете видеть, что по мере того, как мы постепенно вводим проводник через иглу, визуализируется прохождение иглы-проводника через вену. И проводник вводят на глубину 20 сантиметров от поверхности кожи.
Теперь оболочка снимается, после чего игла извлекается по проводнику. Затем, делают надрез кожи скальпелем в месте введения проводника, и мы убеждаемся в том, что проводник свободное перемещается по раневому каналу. Теперь по проводнику вводиться расширитель, который будут постепенно продвигать закручивающим движением для расширения подкожного тракта до подмышечной вены. Теперь расширитель извлекают, соблюдая осторожность, для того чтобы случайно не выдернуть проводник. А сейчас катетер вводят по проводнику и постепенно оттягивают проводник, пока его не можно будет захватить за пределами дистального коричневого порта.
Как только проводник можно будет захватить за пределами коричневого порта, вы можете ввести катетер на соответствующую глубину введения, которая, при катетеризации левой подключичной вены обычно составляет 16-17 сантиметров. Тем не менее, при использовании ультразвукового контроля вы введете катетер глубже еще на 3 дополнительных сантиметра. Таким образом, мы вводим этот катетер на глубину 19 см от поверхности кожи. Сейчас мы промываем все три порта - синий порт, белый порт и, наконец, коричневый порт стерильным физиологическим раствором.
Сейчас на место постановки катетера накладывают антимикробный импрегнированный пластырь или биопластырь, чтобы минимизировать риск катетер-ассоциированной инфекции кровотока. Мы используем еще немного 1-процентного лидокаина для местной анестезии, а затем накладываем несколько швов в двух точках для фиксации катетера на месте. Для фиксации катетера на месте можно использовать инструментальное завязывание узла. Теперь ми накладываем стерильную окклюзионную повязку с биопластырем, так чтобы место постановки катетера полностью визуализировалось в открытом окне, после чего ниже прикрепляют крылышки, чтобы сделать отверстие, через которое проходят три порта минимальным. И процедура завершена.
Тампон с хлоргексидином используют для обеззараживания правой половины передней стенки грудной клетки. Мы совершаем возвратно-поступательные движения тампоном, для того чтобы подготовить большую площадь передней стенки грудной клетки и правого плеча.
Теперь мы накладываем стерильную салфетку на область. Эта стерильная простыня покрывает всю кровать.
Теперь мы используем стерильный физиологический раствор для промывания всех трех портов катетера с тройным просветом. Мы можем заменить обычные коннекторы на катетере с тройным просветом на безигольные. Мы соединяем безыгольные коннекторы с белым и синим портом трёхпросветного катетера. Мы не будем соединять безыгольный колпачок с коричневым портом, являющимся дистальным портом трёхпросветного катетера, поскольку из этого отверстия, конечном итоге будет выходить проводник.
Когда мы промываем коричневый порт, как это показано здесь, необходимо зажать проводник, прежде чем отсоединить шприц.
Сейчас мы собираемся извлечь все необходимое нам оборудование, включая проводниковую иглу, стерильный проводник, скальпель и расширитель в том положении, чтобы их можно было легко схватить. J-образная кривая проводника, которая по подключичной линии следует к ногам, будет направлена в сторону сердца, как показано здесь для правой и левой стороны.
Теперь мы собираемся набрать в шприц 1%-й лидокаин с целью проведения местной анестезии кожи и надкостницы ключицы.
Все эти шприцы, содержащие стерильную жидкость, должны быть промаркированы на вашем стерильном поле. Стерильные шприцы с солевым раствором предварительно маркируются как хлорид натрия, но шприц с однопроцентным лидокаином не маркируется, следовательно, эти стерильные метки могут быть использованы для маркировки шприца с 1% лидокаином, как здесь показано.
Теперь мы используем обе наши руки, чтобы определить изгиб ключицы, основной ориентир, который необходимо определить при проведении установки подключичного катетера. После того, как вы нашли изгиб ключицы, вы определите место введения, находящиеся на расстоянии одного сантиметра в сторону дельтопекторальной борозды от изгиба ключицы. В это место мы вводим 1% лидокаин для местной анестезии, как показано здесь. Вводим настолько глубоко, пока не наступит анестезия надкостницы ключицы по ходу иглы.
Теперь иглу удаляют через проводник под тщательным контролем. Мы используем скальпель, чтобы разрезать кожу. А теперь мы продвигаем расширитель в подключичную вену через проводник для расширения хода под кожей подкожной клетчатки. Мы продвигаем расширитель вращательным движением до тех пор, пока он не окажется в центре расширителя для установки подключичной системы.
Теперь мы извлекаем расширитель, контролируя проводник. Сейчас мы вводим катетер через проводник, проводник будет выходить из коричневого порта катетера. Проводник следует ухватить за дистальный конец за коричневым портом, а затем катетер продвигается на соответствующую глубину введения, которая по правой подключичной линии составляет приблизительно 15 сантиметров от кожных покровов. Для постановки левой подключичной линии катетер следует продвигать на глубину около 17 сантиметров от поверхности кожи.
Теперь мы выводим проводник из катетера прямо внутрь оболочки проводника. Выполняя это действие, вы должны контролировать расположение катетера, чтобы убедиться, что катетер не выдернут, когда вы извлекаете проводник.
Теперь мы собираемся установить последний безыгольный коннектор на коричневый порт. Мы набираем кровь в этот коричневый порт до тех пор, пока вы не сможете увидеть ее в шприце, содержащем стерильный физиологический раствор. Затем порт промывают физиологическим раствором.
Теперь синий и белый порт будут промыты, и вам просто нужно будет отсасывать физиологический раствор до тех пор, пока вы не заметите небольшое количество крови в катетере в синем и белом канале. Затем промойте физиологическим раствором, чтобы смыть эту кровь.
Теперь мы используем бело-синюю центральную клипсу, расположенную примерно в двух сантиметрах от места введения, чтобы прикрепить центральный катетер к коже в четырех местах. Мы применяем 1% лидокаин, чтобы обезболить кожу в этих четырех местах.
Теперь мы прикрепляем пластырь Biopatch, представляющий собой пластырь, пропитанный хлоргексидином, синей стороной вверх к потолку над местом введения. Это снижает риск появления инфекций, ассоциированных с центральным венозным катетером.
Мы используем иглодержатель с изогнутой иглой для пришивания центрального катетера в этих четырех местах. Здесь для фиксации шва используют завязывание узла с помощью инструмента.
После того, как наложены швы на эти четыре участка, можно наложить стерильную окклюзионную повязку, в том числе и Biopatch, с окошком, в области места введения. Затем часть стерильной окклюзионной повязки, которая будет иметь три для отверстия центрального катетера, пройдет через эту выемку.
Затем вторая часть стерильной окклюзионной повязки с крылышками, которые пойдут под тремя портами центрального катетера центральной линии, чтобы полностью закрепить центральный катетер на месте. Затем стерильной ручкой, можно указать ваши инициалы, дату и время установки центрального катетера.
RU2611933C1 - Способ оперативного доступа для выделения и шунтирования передней большеберцовой артерии - Google Patents
Publication number RU2611933C1 RU2611933C1 RU2015142841A RU2015142841A RU2611933C1 RU 2611933 C1 RU2611933 C1 RU 2611933C1 RU 2015142841 A RU2015142841 A RU 2015142841A RU 2015142841 A RU2015142841 A RU 2015142841A RU 2611933 C1 RU2611933 C1 RU 2611933C1 Authority RU Russia Prior art keywords artery anterior tibial muscle tibial artery anterior Prior art date 2015-10-07 Application number RU2015142841A Other languages English ( en ) Inventor Михаил Викторович Плотников Original Assignee Государственное автономное учреждение здравоохранения "Республиканская клиническая больница Министерства здравоохранения Республики Татарстан" Priority date (The priority date is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the date listed.) 2015-10-07 Filing date 2015-10-07 Publication date 2017-03-01 2015-10-07 Application filed by Государственное автономное учреждение здравоохранения "Республиканская клиническая больница Министерства здравоохранения Республики Татарстан" filed Critical Государственное автономное учреждение здравоохранения "Республиканская клиническая больница Министерства здравоохранения Республики Татарстан" 2015-10-07 Priority to RU2015142841A priority Critical patent/RU2611933C1/ru 2017-03-01 Application granted granted Critical 2017-03-01 Publication of RU2611933C1 publication Critical patent/RU2611933C1/ru
Links
- Espacenet
- Global Dossier
- Discuss
- 210000002465 Tibial Arteries Anatomy 0.000 title claims abstract description 31
- 239000012528 membrane Substances 0.000 claims abstract description 21
- 210000002303 Tibia Anatomy 0.000 claims abstract description 15
- 210000003205 Muscles Anatomy 0.000 claims abstract description 13
- 210000002027 Muscle, Skeletal Anatomy 0.000 claims abstract description 9
- 210000001519 tissues Anatomy 0.000 abstract description 3
- 206010022114 Injury Diseases 0.000 abstract description 2
- 239000003814 drug Substances 0.000 abstract description 2
- 230000002349 favourable Effects 0.000 abstract description 2
- 230000000004 hemodynamic Effects 0.000 abstract description 2
- 230000000694 effects Effects 0.000 abstract 1
- 239000000126 substance Substances 0.000 abstract 1
- 210000001367 Arteries Anatomy 0.000 description 21
- 210000001699 lower leg Anatomy 0.000 description 13
- 210000003462 Veins Anatomy 0.000 description 7
- 210000003491 Skin Anatomy 0.000 description 6
- 210000001105 Femoral Artery Anatomy 0.000 description 5
- 210000002683 Foot Anatomy 0.000 description 5
- 210000003141 Lower Extremity Anatomy 0.000 description 5
- 230000001228 trophic Effects 0.000 description 5
- 210000003195 Fascia Anatomy 0.000 description 4
- 210000002414 Leg Anatomy 0.000 description 4
- 210000003137 Popliteal Artery Anatomy 0.000 description 4
- 230000003872 anastomosis Effects 0.000 description 4
- 210000003414 Extremities Anatomy 0.000 description 3
- 210000004304 Subcutaneous Tissue Anatomy 0.000 description 3
- 230000017531 blood circulation Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 210000000689 upper leg Anatomy 0.000 description 3
- 206010003210 Arteriosclerosis Diseases 0.000 description 2
- 210000003752 Saphenous Vein Anatomy 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 201000001320 atherosclerosis Diseases 0.000 description 2
- 238000002224 dissection Methods 0.000 description 2
- 201000002818 limb ischemia Diseases 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 210000000577 Adipose Tissue Anatomy 0.000 description 1
- 210000003423 Ankle Anatomy 0.000 description 1
- 229940064005 Antibiotic throat preparations Drugs 0.000 description 1
- 229940083879 Antibiotics FOR TREATMENT OF HEMORRHOIDS AND ANAL FISSURES FOR TOPICAL USE Drugs 0.000 description 1
- 229940042052 Antibiotics for systemic use Drugs 0.000 description 1
- 229940042786 Antitubercular Antibiotics Drugs 0.000 description 1
- 208000004205 Diabetic Angiopathy Diseases 0.000 description 1
- 208000005189 Embolism Diseases 0.000 description 1
- 229940093922 Gynecological Antibiotics Drugs 0.000 description 1
- 206010022562 Intermittent claudication Diseases 0.000 description 1
- 206010061255 Ischaemia Diseases 0.000 description 1
- 210000000587 Skeletal Muscle Fibers Anatomy 0.000 description 1
- 210000002435 Tendons Anatomy 0.000 description 1
- 229940024982 Topical Antifungal Antibiotics Drugs 0.000 description 1
- 206010068760 Ulcers Diseases 0.000 description 1
- 230000001154 acute Effects 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 238000002583 angiography Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003143 atherosclerotic Effects 0.000 description 1
- 230000003115 biocidal Effects 0.000 description 1
- 230000002308 calcification Effects 0.000 description 1
- 201000009101 diabetic angiopathy Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002692 epidural anesthesia Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229940079866 intestinal antibiotics Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000000629 knee joint Anatomy 0.000 description 1
- 238000000034 method Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 229940005935 ophthalmologic Antibiotics Drugs 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 230000002980 postoperative Effects 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000002278 reconstructive surgery Methods 0.000 description 1
- 200000000020 tissue injury Diseases 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000007631 vascular surgery Methods 0.000 description 1
Images
Classifications
- A — HUMAN NECESSITIES
- A61 — MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B — DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00 — Surgical instruments, devices or methods, e.g. tourniquets
Abstract
Изобретение относится к медицине, к области сосудистой хирургии. Выполняют тибиомедиальный доступ. Рассекают камбаловидную мышцу отступя от большеберцовой кости. Затем отделяют заднюю большеберцовую мышцу от межостной мембраны. Крестообразно рассекают межостную мембрану и мобилизуют переднюю большеберцовую артерию. Способ позволяет снизить траватизацию тканей, повысить надежность защиты шунта и разместить его в выгодном гемодинамическом положении. 4 ил., 1 пр.
Description
Изобретение относится к медицине, к области сосудистой хирургии, и может применяться для восстановления кровотока в голени и стопе при наличии единственной проходимой передней большеберцовой артерии на голени путем ее шунтирования.
Поражение дистального артериального русла нижних конечностей значительно ограничивает возможность и успешность хирургического лечения критической ишемии. При атеросклерозе поражение 2-х или всех артерий голени выявляется у 53,2% больных, а при тромбангиите - у 72,7% [1]. Консервативное лечение критической ишемии нижних конечностей малоэффективно и примерно у трети пациентов приводит к ампутации [2]. Существуют данные о снижении числа ампутаций за счет улучшения качества и количества реваскуляризирующих вмешательств [3]. Таким образом, выполнение реконструктивной операции при критической ишемии нижних конечностей является единственным шансом сохранения конечности.
Традиционный способ оперативного доступа при шунтировании передней большеберцовой артерии выполняется через кожный разрез на переднелатеральной поверхности голени вдоль проекционной линии, от середины расстояния между головкой малоберцовой кости и бугристостью большеберцовой кости до середины расстояния между внутренней и наружной лодыжкой. Рассекают собственную фасцию, тупо проникают в промежуток между передней большеберцовой мышцей и длинным рагзгибателем пальцев. Разделяют тонкую фасциальную пластинку. Артерия находится на межостной мембране [4]. Проведение шунта к передней большеберцовой артерией при данном доступе выполняется либо в подкожной клетчатке, либо через дополнительный тибио-медиальный доступ для контролируемого вскрытия межостной мембраны [4, 5]. Таким образом, шунт располагается либо по S-образной косой линии, либо по спирали к передней большеберцовой артерии, что может способствовать нарушению гемодинамики по шунту и привести к тромбозу. Кроме того, возникает необходимость в шунте большой длины, что при использовании для этих целей аутовены не всегда возможно, а расположение его в подкожном тоннеле не предохраняет от травм и сдавливания.
За прототип оперативного доступа для выделения и шунтирования передней большеберцовой артерии взят типичный тибио-медиальный доступ, используемый для выделения дистальной части подколенной артерии, задней большеберцовой и малоберцовой артерий. При этом доступе конечность согнута под углом около 30°, и несколько ротирована кнаружи. Разрез кожи длиной 10-12 см проводят в верхней трети голени параллельно и на 1-2 см кзади медиальному краю большеберцовой кости. Осторожно, без повреждения большой подкожной вены, расположенной в этой зоне, рассекают кожу, подкожную жировую клетчатку, фасцию голени. Для достижения адекватного операционного поля медиальную головку икроножной мышцы смещают вниз. Для обнажения бифуркации тибоперонеального ствола задней большеберцовой и малоберцовой артерий частично пересекают сухожильную часть камбаловидной мышцы у места прикрепления к большеберцовой кости. В результате обнажается задняя большеберцовая мышца, прикрепленная к межостной мембране, и задне-берцовые сосуды. Данный способ позволяет выделить только приустьевой отдел передней большеберцовой артерии до прободения ею межостной мембраны.
Сущность изобретения заключается в совокупности существенных признаков, обеспечивающих достижение искомого технического результата, состоящего в снижении травмирования тканей, надежной защите шунта прикрывающими тканями и гемодинамически выгодное его положение, при сокращении продолжительности операции шунтирования передней большеберцовой артерии и возможности ревизии всех артерий голени из одного хирургического доступа.
Сущность изобретения включает типичный тибио-медиальный доступ. Отделяют заднюю большеберцовую мышцу от межостной мембраны, крестообразно рассекают межостную мембрану и мобилизуют переднюю большеберцовую артерию.
Отделение задней большеберцовой мышцы от межостной мембраны необходимо для обнажения межостной мембраны.
Мобилизация передней большеберцовой артерии обеспечивает возможность ее шунтирования в этой же ране, что позволяет расположить шунт по ходу сосудистого пучка и спрямить его траекторию, уменьшая вероятность возникновения тромбоза. Глубина расположения шунта обеспечивает надежную его защиту прикрывающими тканями.
В предложенном способе мобилизации передней большеберцовой артерии исключены отрицательные аспекты типичного доступа к передней большеберцовой артерии, такие как необходимость дополнительного хирургического доступа для проведения шунта и его гемодинамически невыгодная позиция, что особенно актуально при использовании синтетических шунтов. Кроме того, способ обеспечивает возможность ревизии всех артерий голени из одного хирургического доступа.
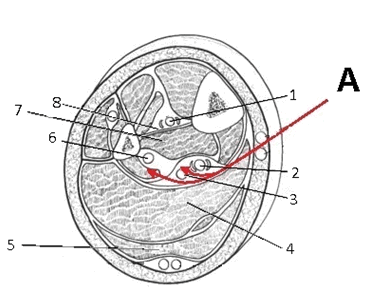
На фиг. 1 показан поперечный разрез голени, где А - траектория типичного тибио-медиального доступа к задней большеберцовой и малоберцовой артериям; 1 - передняя большеберцовая артерия; 2 - задняя большеберцовая артерия, 3 - вена, 4 - камбаловидная мышца, 5 - икроножная мышца, 6 - малоберцовая артерия, 7 - задняя большеберцовая мышца, 8 - межостная мембана;
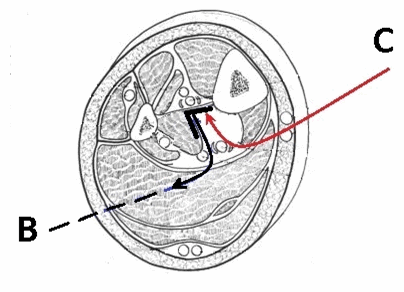
На фиг. 2 - В - место и направление отделения задней большеберцовой мышцы от межостной мембраны с последующим рассечением межостной мембраны, С - предлагаемая траектория доступа к передней большеберцовой артерии.
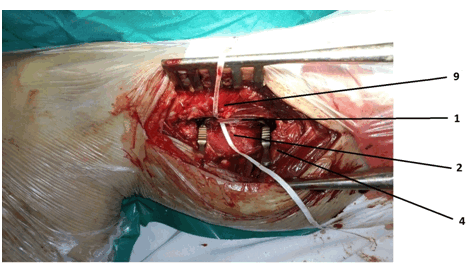
На фиг. 3 - фотоотчет этапа операции, где 9 - большеберцовая кость и волокна мышцы длинного сгибателя пальцев; 1 - передняя большеберцовая артерия (взята на держалку и продольно вскрыта для формирования анастомоза); 4 - фрагмент камбаловидной мышцы (после ее отсечения от большеберцовой кости); 7 - задняя большеберцовая мышца после мобилизации от межостной мембраны.
Пациент находится в положении лежа на спине, оперируемая конечность чуть согнута в коленном суставе и ротирована кнаружи. Кожный разрез производят в верхней и средней трети голени по медиальной поверхности, на 1,5-2 см кзади и параллельно краю большеберцовой кости. Рассекают подкожную клетчатку, собственную фасцию голени. Медиальную головку икроножной мышцы оттягивают вниз. Рассекают расположенную глубже камбаловидную мышцу, отступая на 0,5-1 см от ее прикрепления к большеберцовой кости. Обнажают задне-большеберцовые сосуды и заднюю большеберцовую мышцу. Для выделения передней большеберцовой артерии выполняют отделение задней большеберцовой мышцы от межостной мембраны, затем крестообразно рассекают межостную мембрану. Сразу за ней находится передняя большеберцовая артерия. Шунт располагают по ходу сосудистого пучка. Доступ можно осуществить и на более дистальном уровне голени. При этом техника и этапность выполнения доступа остается прежней.
Таким образом, доступ может быть использован для ревизии дистального сегмента подколенной артерии, задней большеберцовой и малоберцовой артерии, а по средствам дополнительных манипуляций, предлагаемых нами, может быть использован и для мобилизации передней большеберцовой артерии.
Больная М., 58 лет, поступила с диагнозом: диабетическая ангиопатия, облитерирующий атеросклероз артерий левой нижней конечности с окклюзией подколенной, задней большеберцовой, малоберцовой артерий голени IV стадии; трофическая язва передней поверхности голени.
На артериограммах правой нижней конечности установлена проходимость общей и проксимального, и среднего отдела поверхностной бедренной артерии, глубокой артерии бедра. Контрастирование подколенной артерии и задней большеберцовой артерии отсутствует, а малоберцовой артерии имеет фрагментарный характер. Передняя большеберцовая артерия в верхней трети голени заполнена контрастом слабо, на всем протяжении имеет многочисленные коллатерали и связь с артериями стопы (фиг. 4). С согласия больной выполнена ревизия берцовых артерий, шунтирование реверсированной аутовеной между проксимальным отделом поверхностной бедренной артерии и верхней третью передней большеберцовой артерии.
Операцию проводили 25.10.2013 г. под перидуральной анестезией. Тибио-медиальным доступом в верхней трети левой голени были рассечены кожа, подкожная клетчатка и фасция, мобилизована жоберова ямка, дистальный сегмент подколенной артерии. После отсечения камбаловидной мышцы от большеберцовой кости мобилизован тибиоперониальный ствол, устья малоберцовой и задней большеберцовой артерий. При ревизии вышеуказанные артерии признаны не пригодными для шунтирования. Здесь же выполнено отделение задней большеберцовой мышцы от межостной мембраны острым и тупым путем. Обнаженная межостная мембрана крестообразно вскрыта, мобилизована передняя большеберцовая артерия, которая не пульсировала, имела диаметр до 3-4 мм, стенка ее была с участками кальциноза. Выполнена системная гепаринизация, артерия взята на держалку, пережата. Выполнена продольная артериотомия 1 см. Проходимость артерии в дистальном направлении подтверждена катетером Фогерти 2F и наличием ретроградного кровотока.
По медиальной поверхности голени и бедра, из кожных разрезов был выполнен забор большой подкожной вены. Вена гидравлически дилатирована, притоки перевязаны. Диаметр дилатированной вены составил 4-5 мм. Из отдельного доступа на границе средней и верхней трети бедра, по передне-медиальной поверхности в проекции Гюнтерова канала, выделен проксимальный сегмент поверхностной бедренной артерии - артерия с умеренными атеросклеротическими изменениями, пульсирует. Сформирован дистальный анастомоз между реверсированной веной и передней большеберцовой артерией по типу «конец в бок». Затем вену провели вдоль магистральных артерий и вен голени и бедра, в бедренную рану. Сформирован проксимальный анастомоз с проксимальным сегментом поверхностной бедренной артерии по типу «конец в бок». Выполнена профилактика эмболии, пуск кровотока по шунту. Получена отчетливая пульсация аутовенозного шунта на всем протяжении и передней большеберцовой артерии дистальнее анастомоза. Контроль на гемостаз и инородные тела. Послойное ушивание ран. Активное дренирование. Асептические повязки.
В послеоперационный период пациентке вводили антибиотики, гепарины, дезагреганты. Проводилась санация трофического дефекта передней поверхности голени. На шестой день после операции, после очищения трофического дефекта голени, и появления активных грануляций, пациентке выполнена аутодерматопластика трофического дефекта. После реконструкции голень и стопа стали теплыми на ощупь, купировался болевой синдром, восстановлена пульсация на тыльной артерии стопы.
При осмотре через 5 месяцев после операции пульсация на тыльной артерии стопы сохранена, трофический дефект зажил, жалоб на перемежающуюся хромоту пациентка не предъявляла.
Предлагаемым способом было прооперировано одиннадцать пациентов, все с благоприятным отдаленным результатом.
1. Покровский А.В. Клиническая ангиология: руководство в 2-х томах / А.В. Покровский. - М.: Медицина, 2004. - с. 1700.
2. Norgren L Inter-society consensus for the management of peripheral arterial disease. Norgren L., Hiatt W.R., Dormandy J.A., Nehler M.R., Harris K.A., Fowkes F.G., Rutherford R.B.; TASC II Working Group. Int Angiol. 2007 Jun; 26 (2): 81-157.
Claims ( 1 )
Способ оперативного доступа для выделения и шунтирования передней большеберцовой артерии, отличающийся тем, что выполняют тибиомедиальный доступ, далее рассекают камбаловидную мышцу отступя от большеберцовой кости, затем отделяют заднюю большеберцовую мышцу от межостной мембраны, крестообразно рассекают межостную мембрану и мобилизуют переднюю большеберцовую артерию.
RU2015142841A 2015-10-07 2015-10-07 Способ оперативного доступа для выделения и шунтирования передней большеберцовой артерии RU2611933C1 ( ru )
Эмболэктомия по Fogarty
Когда речь идет о хирургическом лечении эмболии, то это чаще всего касается эмболии сосудов конечностей. Эмболэктомия, которую называют также «аппендэктомией» хирургов-ангиологов, должна производиться и хирургами общего профиля.
Диагноз эмболии сосудов конечностей в целом не является таким уж сложным. Симптомы развиваются мгновенно. Совершенно здоровый до того человек (у которого, само собой разумеется, имелась причина, вызвавшая возникновение эмболии) ощущает вдруг неожиданную острую боль в пострадавшей конечности. Эта боль возникает одновременно с эмболизацией. Артериальное кровообращение в этой конечности блокируется. Действие самого эмбола, вызывающее определенную реакцию окружающих тканей, а также ишемия и сопровождающие ее боли ведут к спазму сосудов. Конечность очень быстро приобретает трупную бледность. Стаз в подкожных венах вызывает характерную цианотичную венозную окраску, получившую название мраморной. Вслед за прекращением кровотока быстро развиваются функциональные ишемические нарушения. Эти нарушения сначала проявляются частичной потерей чувствительности и выпадением, а затем и полным отсутствием движений. Дистальная часть конечности постепенно становится холодной, ее объем сначала не изменен, а затем несколько уменьшается.
Артериальная эмболия должна дифференцироваться прежде от острой закупорки глубоких вен (phlegmasia coerulea dolens и синдром Paget-Schroetter). В различии механизмов происхождения этих двух процессов заложено различие их симптоматики. При эмболии приток крови блокируется, кровь оттекает от конечности, которая становится бледной и холодной. При закупорке глубоких вен страдает отток крови, в конечность продолжает поступать («накачиваться») артериальная кровь. Конечность становится отечной, увеличивается ее объем. На периферии сдавливается артериальное русло кровообращения. Таким образом, нарушение артериального кровообращения в данном случае только вторичное. Необходимо дифференцировать эмболию от острого артериального тромбоза, что часто сопряжено со значительными затруднениями. О тромбозе следует думать, если речь идет о пожилом больном, клиническая картина болезни носит подострый характер, а в анамнезе фигурирует атеросклероз или дисбазия. В случае серьезных подозрений относительно тромбоза показана ангиография, поскольку попытка «эмболэктомии», может оказаться безуспешной.
Цель производимой эмболэктомии заключается не только в сохранении конечности, но, восстанавливая кровообращение, нужно в полной мере сохранить функцию конечности.
Воздержаться от операции и приступать к консервативному лечению приходится в тех случаях,
а) когда общее состояние больного настолько тяжелое, что даже небольшое вмешательство может стать непереносимым (здесь следует заметить, что автору все же удалось у многих больных произвести успешную эмболэктомию через несколько часов после возникновения свежего инфаркта миокарда);
б) когда одновременно возникает массивная эмболия сосудов головного мозга с разрушением его вещества;
в) когда периферический и коллатеральный кровоток после возникновения эмболии не нарушен.
Для оценки жизнеспособности тканей конечности могут служить следующие симптомы: распространенный некроз, деструкция кожи на большой площади, выраженная ригидность мышц с мышечной контрактурой, в особенности, когда имеется септическое состояние. Все это делает эмболэктомию бесперспективной, так как конечность при этом не может быть спасена.
Опыт показывает, что эмбол почти всегда застревает в том месте, где сосуд дает бифуркационное ответвление или сужение. Таким образом, типичной локализацией для оседания эмболов являются следующие места на верхней конечности: пространство между лестничными мышцами, место деления плечевой артерии с отхождением глубокой плечевой артерии, место деления на лучевую и локтевую артерии; на нижней конечности места оседания эмболов находятся: на бифуркации брюшной части аорты, у места деления подвздошных артерий, наружной и внутренней, у места отхождения от бедренной артерии глубокой артерии бедра, у выхода из мышечного пространства отводящих мышц, где находится место разветвления на переднюю и заднюю большеберцовые артерии.
В настоящее время, когда производится непрямая эмболэктомия, точная локализация эмбола не имеет того значения, как во времена, когда производилась прямая эмболэктомия. Любой эмбол может быть достигнут и удален из определенных типичных участков.
Локализацию эмбола можно определить без особых трудностей путем обычных физикальных методов исследования. Если на одной из бедренных артерий пульсация может пальпироваться, а на другой она отсутствует, то тогда речь идет об эмболии подвздошной артерии.
Когда же отсутствует пульсация обеих бедренных артерий, то речь может идти об эмболе, который в виде наездника оседлал бифуркацию брюшной части аорты. Чувствительность в таком случае отсутствует уже на бедре. Если пульсация бедренной артерии сохранена, однако конечность ниже колена холодная, а на стопе нарушены чувствительность и движения, то речь идет о закупорке эмболом бедренной артерии и глубокой артерии бедра. Если эмбол закупоривает только поверхностную бедренную артерию, а глубокая артерия бедра свободна, то чувствительность и движения отсутствуют только на периферии. Обычно уровень закупорки эмболом располагается на один сегмент выше, чем характеризующие эту закупорку симптомы.
Техника операции
Оперативное вмешательство производится почти исключительно с применением катетера с баллончиком по методике Fogarty. Для облегчения выделения значительно фиксированного эмбола при поздних операциях может быть применена проволочная петля.
Катетер fogarty состоит из синтетической трубки длиною 80 см и диаметром 1-3 мм, на закругленном конце которого находится небольшой раздуваемый резиновый баллон. Его противоположный конец надевается на шприц, при помощи которого баллончик может быть раздут до необходимой величины.
Эмболэктомия сосудов верхних конечностей
Эмболэктомия сосудов верхних конечностей может быть беспрепятственно произведена под местной анестезией. На верхних конечностях эмболэктомия производится из следующих доступов.
Плечо больного, лежащего на операционном столе, укладывается на второй узкий столик. После предварительного обкладывания и местного обезболивания производится продольный разрез длиною около 8 см между внутренним мыщелком плечевой кости и средней линией плеча по продолжению средней борозды двухглавой мышцы. Кубитальная артерия проходит в сопровождении двух плечевых вен под растяжением сухожилия двухглавой мышцы. Это сухожилие двухглавой мышцы хорошо пальпируется и по нему можно легко определить правильное направление. Здесь, вблизи, сбоку от медиального мыщелка проходит срединный нерв. В виде одного из редко встречаемых вариантов строения можно видеть высокое деление кубитальной артерии, тогда в этом месте находят лучевую и локтевую артерии вместо одной локтевой. Артерия выделяется максимально на протяжении 4 см от его окружающих тканей и берется на «держалку». Выше деления артерии на лучевую и локтевую производится поперечная артериотомия примерно на 1/3 ширины сосуда.
На плече применяется наиболее тонкий размер катетера Fogarty. Сначала его вводят вверх по направлению подключичной артерии. Проводя катетер, можно ощутить, когда он проходит место, где располагается эмбол, некоторое препятствие. После удаления из катетера мандрена, придающего ему ригидность, раздувают резиновый баллон до тех пор, пока он не начинает слегка фиксировать катетер в просвете сосуда. Теперь можно начинать его извлечение, при котором раздутый баллон выталкивает за собой эмбол вместе с наслоившимся на него тромбом. Хирург этим инструментом работает подобно тому, как трубочист работает, очищая от сажи дымоходы. Очищая таким образом сосуд от эмбола, необходимо соблюдать следующее условие: сосуд постепенно сужается по направлению книзу, поэтому давление баллончика катетера должно несколько уменьшаться по направлению книзу, так как слишком большое его растяжение в сужающемся сосуде может повредить интиму, а это поврежденное место в дальнейшем может служить основанием для повторной закупорки (образование тромба, отслойка интимы) сосуда.
Необходимо следить за тем, чтобы катетер не разорвал дальше произведенный на артерии разрез. Кроме этого, большой ошибкой является, когда вследствие небрежно произведенного вмешательства вместе с катетером извлекается поврежденный и вырванный участок интимы.
За успешным удалением эмбола следует пульсирующее кровотечение. Следующим этапом катетеризации является прохождение сосудистого русла в дистальном направлении, вплоть до его конца. Зонд при его проведении в дистальном направлении обычно сразу же попадает в лучевую артерию, являющуюся по своему направлению как бы продолжением кубитальной. Легким надавливанием пальца по ходу сосуда можно переместить катетер в локтевую артерию. Если катетер возвращается без тромботических масс и восстанавливается хороший кровоток, то это является признаком для окончания катетеризации.
Разрез артерии закрывается непрерывным матрацным швом. При достаточно надежном затягивании нити при наложении узла создается надежный герметизм.
Эмболэктомия сосудов нижних конечностей
Для проведения эмболэктомии на нижних конечностях выделяется общая бедренная артерия под Пупартовой связкой. Больного укладывают на операционном столе на спину, под бедро подводится жесткая плоская подушечка, при помощи которой операционное поле хорошо приподнимается. Прохождение артерии соответстует линии Кена, соединяющей середину Пупартовой связки с медиальным мыщелком бедра.
Эмболэктомия из бедренной артерии с помощью катетера Фогарти
Несколько выше Пупартовой связки по проекции сосуда производится разрез длиною 10-12 см. При выделении сосуда необходимо дойти до места отхождения глубокой артерии бедра, ее следует иметь на всякий случай в поле зрения. На «держалки» берется бедренная артерия центральнее и дистальнее отхождения глубокой артерии бедра. Зажим можно наложить только в том случае, когда сосуд пульсирует под пальцами. Центральнее от отхождения глубокой артерии бедра и близко от этого места производится продольная артериотомия. При необходимости через это отверстие можно пройти катетером и в глубокую артерию бедра.
В случаях, когда определена эмболия бифуркации аорты, одновременно выделяются обе бедренные артерии. Через одну из бедренных артерий вводится катетер, а на другую накладывается зажим.
Сначала удаляются эмболы из центрального участка сосудистого русла, а когда восстанавливается пульсация, сосуд промывают пульсирующим током крови. Затем в дистальном направлении проходят катетером с раздуваемым баллончиком через поверхностную и глубокую бедренные артерии. После чего с этой стороны накладывается на сосуд зажим, и, если возникла необходимость, катетеризацию производят таким же образом на другой стороне. Перед зашиванием отверстий в сосудах вновь производят их промывание кровью. Таким повторным промыванием могут быть отмыты оставшиеся на бифуркации аорты или занесенные с другой стороны сгустки крови. Они могут находиться и в области, отжатой зажимами.
Разрез сосуда должен по возможности зашиваться простым непрерывным швом.
Эмболэктомия является одной из наиболее результативных и эффективных операций на сосудах. Эта операция связана с очень небольшим вмешательством, не причиняющим особой нагрузки для больного. В случае удачи хороший результат операции становится сразу же очевидным: отсутствовавший до этого пульс становится отчетливо пальпируемым, состояние больного улучшается, внешний вид конечности и ее функция тоже улучшаются и вскоре нормализуются.
Методика катетеризации задней большеберцовой артерии путем ее выделения
М.В. ПЛОТНИКОВ 1,2 , А.В. МАКСИМОВ 1,2
1 Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
2 Казанская государственная медицинская академия, 420012, г. Казань, ул. Бутлерова, д. 36
Представлены результаты применения оригинального хирургического доступа (заявка на изобретение №2015142841) к передней большеберцовой артерии у 36 пациентов с облитерирующим заболеванием периферических артерий в стадии критической ишемии. По данным ангиографии, передняя большеберцовая артерия являлась единственной артерией притока для выполнения реваскуляризации. В качестве кондуита при шунтировании использована аутовена по методике «in situ» ― 20, реверсированная аутовена ― 14 , PTFE-протез ― 2. Первичная проходимость шунтов составила 91,7%, вторичная проходимость ― 100%. Проходимость шунтов на сроке до 6 месяцев после вмешательства составила 97,1%. Предложенный нами хирургический доступ к передней большеберцовой артерии значительно снижает операционную травму, создает условия для надежной защиты шунта тканями, создает гемодинамически выгодное расположение, создает условия для ревизии всех артерий голени. Предложенный доступ для выделения и шунтирования единственной проходимой передней большеберцовой артерии может быть рекомендован в рутинной практике ангиохирурга.
Ключевые слова: облитерирующие заболевания периферических артерий, КИНК, инфраингвинальные артериальные реконструкции, берцовые артерии.
M.V. PLOTNIKOV 1,2 , A.V. MAKSIMOV 1,2
1 Republican Clinical Hospital of MH of RT, 138 Orenburgskiy Trakt, Kazan, Russian Fedration, 420064
2 Kazan State Medical Academy, 36 Butlerov Str., Kazan, Russian Federation, 420012
Optimization of surgical access for bypass arterial reconstructions to the tibial artery
The results of using of the original surgical access (application for invention № 2015142841) to the anterior tibial artery in 36 patients with obliterative peripheral arterial disease in the stage of critical ischemia. According to angiography, the anterior tibial artery was the only inflow artery to perform revascularization. The bypass conduit was made with autovein by «in situ» methodology ― 20, reverse autovein ― 14, PTFE-prosthesis ― 2. Primary patency of bypass grafts was 91.7%, secondary patency ― 100%. Patency of grafts up to 6 months after the intervention was 97.1%. The proposed surgical access to the anterior tibial artery significantly reduces surgical trauma, creates conditions for the reliable protection of the shunt with tissues, creates hemodynamically favorable location, creates conditions for revision of the leg arteries. The proposed access for the isolation and bypass surgery of the only passable anterior tibial artery may be recommended in routine practice.
Key words: PAD, CLI, infrainguinal arterial revascularization, tibial artery.
Введение
Критическая ишемия нижних конечностей (КИНК) по-прежнему является одной из наиболее актуальных проблем современной ангиохиругии [1]. Это обусловлено, прежде всего, тем, что развитие стадии КИНК у больных с окклюзирующей патологией артерий ассоциируется с высоким риском потери конечности и смерти [2].
Наиболее частой причиной развития КИНК является окклюзия артерий инфраингвинального сегмента [3]. При этом у 80% пациентов с КИНК для выполнения реваскуляризации конечности показана реконструкция берцовых артерий [4]. Несмотря на развитие эндоваскулярных технологий, в ряде случаев они по-прежнему уступают традиционным открытым шунтирующим операциям. Непосредственные технические или ранние клинические неудачи при эндоваскулярной реконструкции достигают 27%, против 3% при бедренно-подколенном шунтировании [5, 6]. Кроме того установлено, что лучшие отдаленные результаты при лечении пролонгированных поражений поверхностной бедренной и подколенной артерий демонстрируют шунтирующие операции [7]. Это определяет шунтирование с использованием аутовены как «золотой» стандарт лечения пациентов с КИНК при пролонгированных инфраингвинальных окклюзиях [8, 9].
Цель работы ― усовершенствование хирургического доступа для шунтирования передней большеберцовой артерии.
Материал и методы
Проведено 36 оперативных вмешательств по шунтированию единственной проходимой передней большеберцовой артерии. Возраст больных ― 62,4±2,7 года. 28 пациентов мужчины, 8 ― женщины. У всех пациентов установлена хроническая артериальная недостаточность нижних конечностей III-IV степени (по классификации Покровского А.В.). Этиологией окклюзирующего процесса у всех пациентов являлся атеросклероз, у 15 пациентов заболевание сопровождалось сахарным диабетом.
Для верификации диагноза пациентам выполнена дистальная ангиография. Пролонгированная окклюзия поверхностной бедерной артерии, подколенной артерии, задней и малоберцовых артерий установлена у 32 пациентов. Окклюзия подколенной артерии, задней и малоберцовых артерий, при проходимой поверхностной бедренной артерией до средней или нижней трети бедра, выявлена у 4 пациентов. Во всех случаях единственной артерией притока, для потенциальной реваскуляризации конечности, являлась передняя большеберцовая артерия. В трех случаях выявлены гемодинамически значимые стенозы аорто-бедренного сегмента.
Для выделения и формирования дистального анастомоза применялся разработанный нами оригинальный хирургический доступ к передней большеберцовой артерии (заявка на изобретение №2015142841) (рис. 1). За прототип оперативного доступа для выделения и шунтирования передней большеберцовой артерии взят типичный тибио-медиальный доступ, используемый для выделения дистальной части подколенной артерии, задней большеберцовой и малоберцовой артерий, модифицированный нами. Предлагаемый нами доступ включает типичные этапы тибио-медиального доступа. Конечность согнута под углом около 30° и несколько ротирована кнаружи. Разрез кожи длиной 10-12 см проводят в верхней трети голени параллельно и на 1-2 см кзади от медиального края большеберцовой кости. Осторожно, без повреждения большой подкожной вены, расположенной в этой зоне, рассекают кожу, подкожную жировую клетчатку, фасцию голени. Для достижения адекватного операционного поля медиальную головку икроножной мышцы смещают вниз. Для обнажения бифуркации тибоперонеального ствола, задней большеберцовой и малоберцовой артерий частично пересекают сухожильную часть камбаловидной мышцы у места прикрепления к большеберцовой кости. В результате выполненного типичного тибио-медиального доступа обнажается задняя большеберцовая мышца, прикрепленная с межостной мембране. Задняя большеберцововая мышца отделяется от межостной мембраны. Обнаженная таким образом межостная мембрана крестообразно рассекается и обнажается передняя большеберцовая артерия.
![screenshot_32]()
![screenshot_33]()
Рисунок 1. Типичный (слева) и оригинальный (справа) доступы к берцовым артериям. 1 ― передняя большеберцовая артерия, 2 ― задняя большеберцовая артерия, 3 ― вена, 4 ― камбаловидная мышца, 5 ― икроножная мышца, 6 ― малоберцовая артерия, 7 ― задняя большеберцовая мышца, 8 ― межостная мембана; А ― обозначена траектория типичного тибио-медиальный доступа к задней большеберцовой и малоберцовой артериям, В ― обозначено место и направление отделения задней большеберцовой мышцы от межостной мембраны с последующим рассечением межостной мембраны, С ― обозначена предлагаемая траектория доступа к передней большеберцовой артерии
Результаты
В трех случаях, где выявлено гемодинамически значимое поражение аорто-бедренного сегмента, перед реконструкцией инфранигвинального сегмента выполнена коррекция данного сегмента. В двух случаях выполнена рентгенэндоваскулярная ангиопластика со стентированием подвздошных артерий, в одном ― подвздошно-бедренное аллошунтирование. Данные вмешательства выполнялись симультанно с шунтирующей инфраингвинальной реконструкцией.
Во всех случаях доступ к передней большеберцовой артерии был выполнен независимо от конституциональных параметров пациента. В 22 случаях передняя большеберцовая артерия мобилизована в верхней трети, в 12 ― в средней трети и в 2 случаях ― в нижней трети голени (рис. 2).
![screenshot_34]()
Рисунок 2. Фотоотчет этапа операции, где 9 ― большеберцовая кость и волокна мышцы длинного сгибателя пальцев, 1 ― передняя большеберцовая артерия (взята на держалку и продольно вскрыта для формирования анастомоза), 2 ― задняя большеберцовая мышца ― поле мобилизации от межостной мембраны, 4 ― фрагмент камбаловидной мышцы (после ее отсечения от большеберцовой кости)
В 26 случаях артерией притока послужила глубокая артерия бедра, в 4 ― дистальный сегмент ПБА, в 6-ти ― бифуркация общей бедренной артерии. В качестве кондуита при шунтировании использована аутовена по методике «in situ» ― 20, реверсированная аутовена ― 14 , PTFE-протез диаметром 7 мм ― 2. В 2 случаях, благодаря возможности ревизии всех артерий голени из предложенного доступа, сформирован секвенциальный дистальный анастомоз с малоберцовой и передней большеберцовой артерией (рис. 3).
![screenshot_35]()
Рисунок 3. Дистальные секвенциальные анастомозы при бедренно-подколенном шунтировании по методике «in situ». Выделено: слева (дистальнее) ― анастомоз с малоберцовой артерией по типу «конец в бок», справа (проксимальнее) ― анастомоз с передней большеберцовой артерией по типу «бок в бок»
При изучении отдаленных результатов на сроке до 6 месяцев после вмешательства в водном случае верифицирован тромбоз шунта с развитием КИНК. Таким образом, проходимость шунтов спустя полгода составила 97,1%.
Традиционный способ оперативного доступа для мобилизации передней большеберцовой артерии выполняется по переднелатеральной поверхности голени в промежутке между передней большеберцовой мышцей и длинным рагзгибателем пальцев [10, 11]. Проведение шунта к передней большеберцовой артерии при данном доступе выполняется либо экстраанатомически в подкожной клетчатке по латеральной поверхности бедра и голени, либо через дополнительный тибио-медиальный доступ для контролируемого вскрытия межостной мембраны. Таким образом, шунт располагается либо по S-образной косой линии, либо по спирали к передней большеберцовой артерии, что может способствовать нарушению гемодинамики по шунту. Кроме того, возникает необходимость в шунте большей длины, что, при использовании для этих целей аутовены, не всегда возможно. Расположение шунта в подкожном тоннеле при его эстраанатомическом проведении по латеральной поверхности голени и бедра не предохраняет от травм и сдавливания.
Выделение передней большеберцовой артерии предложенным нами способом позволяет избежать дополнительного хирургического доступа и снизить травматичность операции в целом. Кроме того, применение предложенного доступа позволяет расположить кондуит вдоль сосудистого пучка без перегибов, что особенно актуально при использовании синтетических сосудистых протезов (рис. 4).
![screenshot_36]()
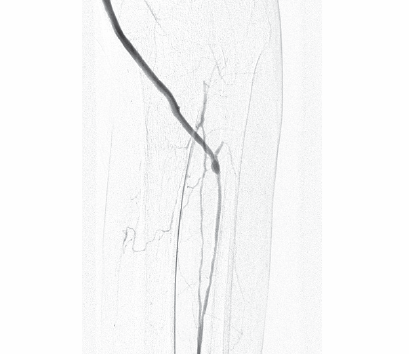
Рисунок 4. Ангиография после аутовенозного шунтирования по методике «in situ» в переднюю большеберцовую артерию
Зачастую, ввиду выраженного стено-окклюзирующего процесса, данные артерии не контрастируются при ангиографии даже при условии из проходимости. Таким образом, предлагаемый нами способ выделения передней большеберцовой артерии обеспечивает возможность ревизии всех артерий голени из одного хирургического доступа, что позволяет выполнить реваскуляризацию нескольких артерий, тем самым улучшить прогноз лечения.
Выводы
Предложенный нами хирургический доступ к передней большеберцовой артерии значительно снижает операционную травму, создает условия для надежной защиты шунта тканями и его гемодинамически выгодного расположения. Применение данного доступа сопровождается сокращением продолжительности операции и возможностью ревизии всех артерий голени из одного хирургического доступа, что позволяет рекомендовать данный доступ шунтирования единственной проходимой передней большеберцовой артерии для применения в рутинной практике ангиохирурга.
1. Белов Ю.В., Виноградов О.А., Ульянов Н.Д., Дзюндзя А.Н. Прогнозирование результатов реваскуляризирующих операций на артериях нижних конечностей на основе методов оценки регионарного кровотока // Кардиология и сердечно-сосудистая хирургия. ― 2014. ― 7 (5). ― С. 62-67.
2. Strom M., Konge L., Lönn L., et al. Amputation-free survival after crural percutaneous transluminal angioplasty for critical limb ischemia // Scandinavian Journal of Surgery. ― 2015. ― 0. ― P. 1-7.
3. Покровский А.В. Клиническая ангиология. ― М.: Медицина, 2004. ― 808 с.
4. Пшеничный В.Н., Штутин А.А., Иваненко А.А. и др. Эффективность двухуровневых инфраингвинальных реконструкций в лечении хронической критической ишемии нижних конечностей // Ангиология и сосудистая хирургия. ― 2012. ― 18 (3). ― С. 132-137.
5. Bradbury A.W., Adam D.J., Bell J., Forbes J.F. BASIL trial participants Bypass versus angioplasty in severe ischaemia of the leg (BASIL) trial: analysis of amputation free and overall survival by treatment // J. Vasc. Surg. ― 2010. ― 51 (Suppl 5). ― P. 18S-31S.
6. Bradbury A.W., Adam D.J., Bell J., et al. BASIL Trial Participants. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: A survival prediction model to facilitateclinical decision making // J. Vasc. Surg. ― 2010. ― 51 (5). ― P. 52S-68S.
7. Покровский А.В., Дан В.Н., Зотиков А.Е., и др. Что определяет успех артериальных реконструкций дистальнее паховой связки с точки зрения доказательной медицины? // Анналы хирургии. ― 2008. ― 1. ― С. 22-26.
8. Затевахин И.И., Шиповский В.Н., Золкин В.Н., и др. Отдаленные результаты открытых и эндоваскулярных операций в коррекции окклюзионно-стенотических поражений артерий бедренно-подколенного сегмента // Ангиология и сосудистая хирургия. ― 2011. ― 17 (3). ― С. 59-62.
9. Pennywell D.J., Tan T.W., Zhang W.W. Optimal management of infrainguinal arterial occlusive disease // Vascular Health and Risk Management. ― 2014. ― 10. ― С. 599-608.
10. Шалимов А.А., Дрюк Н.Ф. Хирургия аорты и магистральных артерий. ― Киев: Здоров’я, 1979. ― 384 с.
11. Белов Ю.В. Руководство по сосудистой хирургии с атласом оперативной техники. ― М., 2000. ― 464 с.1. Belov Yu.V., Vinogradov O.A., Ul’yanov N.D., Dzyundzya A.N. Predicting the results of revascularization operations on the arteries of the lower extremities based on regional blood flow assessment methods. Kardiologiya i serdechno-sosudistaya khirurgiya, 2014, 7 (5), pp. 62-67 (in Russ.).
2. Strom M., Konge L., Lönn L., et al. Amputation-free survival after crural percutaneous transluminal angioplasty for critical limb ischemia. Scandinavian Journal of Surgery, 2015, 0, pp. 1-7.
3. Pokrovskiy A.V. Klinicheskaya angiologiya [Clinical Angiology]. Moscow: Meditsina, 2004. 808 p.
4. Pshenichnyy V.N., Shtutin A.A., Ivanenko A.A. et al. Efficacy duplex infrainguinal reconstruction in the treatment of chronic critical limb ischemia. Angiologiya i sosudistaya khirurgiya, 2012, 18 (3), pp. 132-137 (in Russ.).
5. Bradbury A.W., Adam D.J., Bell J., Forbes J.F. BASIL trial participants Bypass versus angioplasty in severe ischaemia of the leg (BASIL) trial: analysis of amputation free and overall survival by treatment. J. Vasc. Surg, 2010, 51 (suppl 5), pp. 18S-31S.
6. Bradbury A.W., Adam D.J., Bell J. et al. BASIL Trial Participants. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: A survival prediction model to facilitateclinical decision making. J. Vasc. Surg, 2010, 51 (5), pp. 52S-68S.
7. Pokrovskiy A.V., Dan V.N., Zotikov A.E. et al. What determines the success of arterial reconstruction distal to the inguinal ligament in terms of evidence-based medicine? Annaly khirurgii, 2008, 1, pp. 22-26 (in Russ.).
8. Zatevakhin I.I., Shipovskiy V.N., Zolkin V.N. et al. Long-term results of open and endovascular operations in the correction of occlusive-stenotic lesions of the femoropopliteal arterial segment. Angiologiya i sosudistaya khirurgiya, 2011, 17 (3), pp. 59-62 (in Russ.).
9. Pennywell D.J., Tan T.W., Zhang W.W. Optimal management of infrainguinal arterial occlusive disease. Vascular Health and Risk Management, 2014, 10, pp. 599-608.
10. Shalimov A.A., Dryuk N.F. Khirurgiya aorty i magistral’nykh arteriy [Surgery of the aorta and main arteries]. Kiev: Zdorov’ya, 1979. 384 p.
11. Belov Yu.V. Rukovodstvo po sosudistoy khirurgii s atlasom operativnoy tekhniki [Guidelines for vascular surgery with an atlas of operative technique]. Moscow, 2000. 464 p.Читайте также: