Методика операции при эпимакулярной мембране (ЭММ). Рекомендации по удалению
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Эпимакулярный фиброз (ЭМФ) - заболевание, характеризующиеся появлением на поверхности сетчатки эпиретинальной мембраны (ЭРМ), что приводит к снижению остроты зрения, а также появлению искажений и вспышек перед глазами (2017) [1].
К данному заболеванию могут приводить различные патологические процессы, такие как увеит, отслойка сетчатки, диабетическая ретинопатия. Однако зачастую четкая этиология не прослеживается, т.е. ЭМФ является идиопатическим (2014) [2]. Патогенез данного заболевания до конца не выяснен, однако основными факторами риска являются возраст, гиперхолестеринемия, а также задняя отслойка стекловидного тела (2016) 4.
Оптическая когерентная томография обладает высокой чувствительностью и специфичностью и позволяют достоверно диагностировать ЭМФ. Хирургическое же лечение патологии макулярной области сопряжено с риском возникновения послеоперационных осложнений, например, появлением дефектов полей зрения (2013) [6], что диктует проведение периметрии таким пациентам как до, так и после хирургического лечения.
Поскольку консервативные методы терапии ЭМФ к настоящему моменту не разработаны, решение данной проблемы возможно исключительно хирургическим путем (2016) [7]. Классическим подходом к хирургическому лечению ЭМФ является витрэктомия с пилингом эпиретинальной мембраны (1978) [8]. Данный тип операций обеспечивает рост остроты зрения, а также низкий риск рецидивов после успешного проведения подобных вмешательств (2017) [9]. Основным преимуществом витрэктомии является полное элиминирование тракционных воздействий на макулу со стороны стекловидного тела. Кроме того, удаление стекловидного тела упрощает в дальнейшем удаление и самой ЭРМ.
Стандартом для данного типа операций на настоящий момент является инструментарий 25 либо 27G, что обеспечивает меньшую операционную травму и быстрое восстановление глаза после операции (2016) [10]. В ходе операции стекловидное тело контрастируется интравитреальным введением стероидов (например, триамценолоном), а эпиретинальных мембран - раствором красителей (например, бриллиантовой синий) (2016) [11].
Следует отметить, что выполнение витрэктомии сопровождается повышением риска развития катаракты, появлением ятрогенных разрывов сетчатки, изменениями слоя нервных волокон сетчатки, а также нарушением внутриглазной гидродинамики 12. Именно поэтому некоторые специалисты предпочитают выполнять пилинг эпиретинальной мембраны без витрэктомии (2011) [16]. В нашей клинике накоплен значительный опыт удаления ЭРМ по классической методике, однако удаление без витрэктомии до настоящего момента не выполнялось.
Одноцентровое открытое проспективное интервенционное клиническое исследование по оценке эффективности и безопасности удаления эпимакулярных мембран без витрэктомии.
Материал и методы
В исследование в общей сложности было включено 20 пациентов (20 глаз), среди них 15 женщин и 5 мужчин. Средний возраст участников исследования составил 68 лет с доверительным 95% интервалом от 66 до 70 лет. В исследование включались пациенты с ЭМФ, а также отсутствием значимых помутнений роговицы, хрусталика и стекловидного тела. Дополнительным критерием для включения было наличие задней отслойки стекловидного тела, подтвержденной эхографически.
Критериями исключения стали сквозные макулярные разрывы любых стадий, любые формы глаукомы, острой сосудистой патологии сетчатки, диабетической ретинопатии, а также отслойки сетчатки, воспалительные процессы, операции, травмы глаз в анамнезе. Таким образом, эпиретинальный фиброз был идиопатическим.
В ходе исследования применялось следующее оборудование: проектор для визометрии Tomey TCP-1000, бесконтактный тонометр Huvitz HNT-7000, биомикроскоп Topcon SL-1E, прибор для ультразвуковой эхографии глаза Tomey UD-6000, оптический когерентный томограф Cirrus HD-OCT 500, компьютерный периметр Humpfrey, Zeiss, микропериметр Centervue Maia. Хирургические вмешательства выполнялись одним хирургом с использованием стандартного сертифицированного оборудования (витреомашина Constellation, Alcon).
Хирургическое вмешательство выполнялось следующим образом: устанавливалось два 25G-порта, ЭРМ удалялась единым блоком с внутренней пограничной мембраной без окрашивания (среднее время вмешательства составило 8 минут). Тампонада витреальной полости силиконовым маслом либо газо-воздушной смесью ни в одном из случаев не выполнялась.
Проводился динамический мониторинг следующих офтальмологических показателей: максимально корригированная острота зрения (далее - МКОЗ), светочувствительность центральной зоны сетчатки, толщина сетчатки (в т.ч. слой нервных волокон в перипапиллярной области в различных секторах, далее - СНВС) по данным ОКТ, внутриглазное давление (далее - ВГД), размеры экскавации ДЗН, светочувствительность периферических зон сетчатки. Временные точки измерений: до операции, стандартный послеоперационный осмотр и выполнение ОКТ макулярной области в первые сутки после операции, контрольный осмотр через 7 дней, весь комплекс обследования через 1, 3, 6 и 12 мес. после вмешательства.
По показателю светочувствительности центральной зоны сетчатки также отмечается постепенный стабильный рост начиная с третьего месяца наблюдения. Общий прирост за 12 мес. наблюдения составил 2,21 дБ (p=0,008).
Толщина сетчатки прогрессивно снижалась в течение всего периода наблюдения (с 462,4±57,1 мкм исходно до 363,9±49,3 мкм через 12 мес., p=0,001). Наиболее быстрое снижение отмечается с третьего по шестой месяц наблюдения.
Наибольшее истончение СНВС регистрируется в височном секторе (с 81,75±20,0 до 65,8±16,9), именно с этой стороны и проводится удаление ЭРМ. В остальных секторах изменения незначительны.
Значимых изменений состояния экскавации ДЗН, показателей ВГД и светочувствительности периферии сетчатки выявлено не было. Изменения всех оцениваемых показателей представлены в табл.
Хирургическое лечение катаракты в дальнейшем не понадобилось ни одному из пациентов. У 6 из 20 прооперированных пациентов выявлен рецидив ЭРМ в сроки от 3 до 6 мес.
Вмешательство следует признать эффективным. Во всех случаях отмечено достоверное увеличение остроты зрения, светочувствительности центральной зоны сетчатки, а также уменьшение толщины центральной зоны сетчатки за счет элиминации тракционных воздействий ЭРМ и уменьшения интраретинального отека. Минимальным было влияние на ВГД, светочувствительность периферии сетчатки, ни в одном из случаев не прогрессировала катаракта.
Однако негативным следует признать значительное количество рецидивов заболевания. Данное осложнение, по всей видимости, может быть связано с неполным удалением ВПМ при удалении ЭРМ единым блоком с ней и при отсутствии окрашивания. Данный факт подтвердили повторные операции, которые проводились с использованием витрэктомии и окрашивания, которое выявило остатки ВПМ в области предшествовавшего вмешательства. Важность окрашивания, а также возможности рецидива мембран после удаления без витрэктомии отмечается и в других исследованиях (2017) [17, 18]. Следует отметить, что рецидив не сопровождался повторным снижением зрения, но у пациентов сохранялись жалобы на метоморфопсии.
Удаление эпимакулярной мембраны без витрэктомии эффективно (значительный рост остроты зрения, улучшение светочувствительности центральной зоны сетчатки, снижение толщины сетчатки), не оказывает негативного влияния на светочувствительность периферической сетчатки и внутриглазное давление, однако в 30% случаев сопряжено с рецидивированием, что связано со сложностью выполнения и в определенной степени ограничивает применение данного метода.
Методика операции при эпимакулярной мембране (ЭММ). Рекомендации по удалению
В данном обзоре подробно рассмотрены подходы к хирургическому лечению эпимакулярного фиброза. Во введении кратко описаны факторы риска и причины развития заболевания. Далее поэтапно разобраны ход операции, его возможные варианты. Приведено сравнение результатов 25 и 27G витрэктомии при эпиретинальном фиброзе (ЭРФ). Сравниваются результаты удаления эпиретинальных мембран (ЭРМ) без витрэктомии и с использованием субтотальной витрэктомии. При удалении ЭРМ без витрэктомии снижается риск развития катаракты, отслойки сетчатки, появления дефектов полей зрения, однако возрастает риск рецидивов заболевания. Далее приведены преимущества и недостатки удаления внутренней пограничной мембраны (ВПМ) во время операции. В частности, приведены данные метаанализа, который показывает, что острота зрения выше через 6 мес. после операции у пациентов, которым вместе с ЭРМ удалялась ВПМ, однако через 18 мес. ситуация становится обратной. Описаны возможности визуализации ЭРМ во время операции. Приведено сравнение результатов операций, включающих окрашивание ЭРМ с помощью ILM-Blue и MembraneBlue-Dual. Показана роль ОКТ в диагностике и лечении ЭРФ. Подробно разобраны возможные осложнения операции, такие как гемофтальм, перфорация сетчатки, катаракта, офтальмогипертензия, дефекты поля зрения. Данный обзор не содержит информацию о лечении сквозных макулярных разрывов.
Ключевые слова: эпиретинальный фиброз, эпиретинальная мембрана, витрэктомия, оптическая когерентная томография, внутренняя пограничная мембрана, осложнения, гемофтальм, отслойка сетчатки, катаракта, офтальмогипертензия, красители, поле зрения.
Surgical treatment of epirethinal fibrosis: a current state of the problem
S.A. Kochergin, D.G. Alipov
Russian Medical Academy of Continuous Professional Education, Moscow
This review discusses different approaches of surgical treatment of epiretinal fibrosis in detail. The introduction briefly describes the risk factors and causes of the disease. Each type of operation is analized as well as all the possible options. The results of 25 and 27G vitrectomy are compared, also in this review you can find the comparison of membrane removal without vitrectomy and after subtotal vitrectomy. When ERM is removed without vitrectomy, the risk of cataract appearing, retinal detachment, appearance of visual field defects decreases, but the risk of recurrence of the disease increases. In this article are also given the advantages and disadvantages of ILM-removing during the operation. In particular, the data of meta-analysis is described, that shows that patients’ who ERM was removed together with ILM visual acuity is higher 6 months after surgery, but after 18 months the situation becomes reverse. The possibilities for visualization of ERM during the operation are described. The article describes the features for visualization of ERM during surgery and a comparison of the results of operations involving ERM staining with ILM-Blue and MembraneBlue-Dual. The role of OCT in the diagnostics and treatment of ERF is shown. The possible surgery complications, such as hemophthalmia, retinal perforation, cataract, ocular hypertension, visual field defects are analized. This material does not include information about treatment of full macular hole.
Key words: epiretinal fibrosis, epiretinal membrane, vitrectomy, optical coherence tomography, internal limiting membrane, complications, intraocular hemorrhage, retinal detachment, cataract, ocular hypertension, dyes, visual field.
For citation: Kochergin S.A., Alipov D.G. Surgical treatment of epirethinal fibrosis: a current state of the problem //
RMJ “Clinical ophthalmology”. 2018;1:55-59.
Для цитирования: Хирургическое лечение эпимакулярного фиброза. Современное состояние проблемы. Клиническая офтальмология. 2018;19(1):55-59.
В обзоре рассмотрены подходы к хирургическому лечению эпимакулярного фиброза. Приведены методы диагностики и лечения эпимакулярного фиброза.
Введение
Эпимакулярный фиброз (ЭМФ) характеризуется образованием эпиретинальной мембраны (ЭРМ) - тонкой прозрачной пленки, появляющейся непосредственно над макулой [1].
По данным McCarty et al. [2], распространенность ЭМФ не превышает 2% среди пациентов в возрасте до 50 лет и достигает 20% среди пациентов 75 лет. Также развитию ЭМФ обычно способствует задняя отслойка стекловидного тела (СТ). В некоторых исследованиях было продемонстрировано, что дополнительным фактором риска развития ЭМФ является гиперхолестеринемия, которая в свою очередь является фоном для структурных изменений сосудов сетчатки [2, 3].
Показано, что болезнь может развиваться на фоне офтальмологических заболеваний, таких как диабетическая
ретинопатия, окклюзия вен сетчатки, отслойка сетчатки, а также после офтальмохирургических вмешательств. Однако в большинстве случаев ЭМФ является идиопатическим [4].
В связи со старением населения проблема диагностики и лечения ЭМФ в последнее время приобретает все большее значение [5, 6]. В настоящий момент единственным эффективным методом лечения ЭМФ является хирургическое вмешательство.
Особенности хирургического лечения
Хирургическое вмешательство при ЭМФ обычно подразумевает обеспечение доступа в витреальную полость посредством установки портов, субтотальную либо частичную витрэктомию, удаление ЭМФ и внутренней пограничной мембраны (ВПМ).
25G и 27G витрэктомия
Введение в клиническую практику витрэктомии с транс-
конъюнктивальными микроразрезами с использованием 25G или 27G инструментария привело к снижению числа послеоперационных осложнений, таких как ранняя послеоперационная гипотония и послеоперационный эндофтальмит, возможно, связанный с микрофильтрацией из относительно крупного 20G разреза [7]. При использовании 25 и 27G инструментария восстановление зрения в послеоперационном периоде происходит быстрее [8]. Для сравнения эффективности и безопасности 25G и 27G витрэктомии было проведено проспективное исследование, в которое было включено 66 пациентов (74 глаза). 25G витрэктомия была выполнена на 37 глазах 33 пациентов (группа 1), 27G витрэктомия была выполнена на 37 глазах 33 пациентов (группа 2). В исследовании оценивались внутриглазное давление (ВГД), острота зрения, толщина центральной зоны сетчатки и продолжительность операции. Средняя продолжительность операции в группе 2 была значимо больше, чем в группе 1. ВГД после операции снижалось в обеих группах (на 9,7 и 8,8 мм рт. ст. соответственно), а на 7-й день после операции возвращалось к прежнему значению. Разница в остроте зрения между группами через 1, 3 и 6 мес. после операции была статистически незначима ( [9].
Роль витрэктомии
При сравнении результатов хирургического удаления ЭМФ и ВПМ с использованием витрэктомии и без нее было показано, что хирургическое вмешательство без витрэктомии позволяет сократить время проведения операции с 19-30 до 7-10 мин, при этом отсутствуют пролиферативные изменения, нередко приводящие к отслойке сетчатки [10]. При сравнении результатов проведения трехпортовой витрэктомии и щадящей двухпортовой хирургии без витрэктомии было показано, что при проведении вмешательства без витрэктомии уменьшается риск развития осложнений: катаракты, дефектов полей зрения [10]. Сходные результаты были получены в исследовании, проведенном в Тамбовском филиале МНТК «Микрохирургия глаза» (2013) [11]. Однако, по данным некоторых исследователей, при удалении ЭРФ без витрэктомии и окрашивания частота рецидивов заболевания в 3,5 раза превышает подобные показатели при проведении хромовитрэктомии [12].
Пилинг ВПМ
Витрэктомия с пилингом ВПМ применялась в хирургическом лечении ЭМФ в течение многих лет, однако частота рецидивов после проведения успешного хирургического вмешательства варьирует от 10% до 16,3% [13]. H. Liu et al. [14] провели метаанализ данных исследований эффективности витрэктомии с пилингом ВПМ или без него у пациентов с идиопатическим ЭМФ. В метаанализ были включены данные, полученные в 8 исследованиях, результаты которых были опубликованы с 2005 по 2015 г. Все исследования были ретроспективными. Всего были включены данные о 418 пациентах, из которых у 200 была проведена витрэктомия с пилингом ВПМ, а у 218 - витрэктомия без пилинга. Острота зрения через ≤6 мес. и в период от 6 до 12 мес. у пациентов, которым проводилась витрэктомия с пилингом ВПМ, была значимо выше, чем у пациентов, которым не проводили пилинг, однако через 18 мес. острота зрения была выше у пациентов, которым пилинг ВПМ не проводился. Негативное влияние пилинга может быть связано с нерегистрируемым повреждением сетчатки за счет воздействия на Мюллеровские клетки, отростками которых и образована ВПМ.
В другом исследовании было показано, что проведение пилинга ВПМ позволяет избежать развития кистозного макулярного отека у 90% пациентов, в то время как при удалении ЭМФ без пилинга ВПМ кистозный макулярный отек развивается у 56% пациентов [15]. Благоприятные исходы пилинга могут быть объяснены наличием структуры, образованной отростками клеток Мюллера, между слоем нервных волокон сетчатки (СНВС) и ВПМ [16].
Для сравнения исходов хирургического вмешательства после удаления ЭМФ одновременно с пилингом ВПМ или без него было проведено рандомизированное контролируемое исследование, в которое было включено 102 пациента. Разница в остроте зрения между группой, в которой проводили пилинг ВПМ, и группой, в которой его не проводили, была статистически незначимой (р=0,84). Таким образом, авторы исследования полагают, что пилинг ВПМ не улучшает остроту зрения при удалении ЭМФ [17].
Визуализация
Визуализация сетчатки в ходе хирургического вмешательства осложнена в ряде случаев наличием катаракты. В таких случаях возможно одновременное удаление катаракты и ЭМФ. Для оценки исходов комбинированного хирургического вмешательства с проведением факоэмульсификации и витрэктомии A. Pollack et al. [18] в 2004 г. было проведено ретроспективное исследование. В него были включены данные о 42 пациентах, которым было проведено комбинированное хирургическое вмешательство. Проведение факоэмульсификации облегчает визуализацию заднего отдела глаза и связано с небольшим количеством осложнений (задние синехии - 9,5%, помутнение задней капсулы - 7,1%, смещение ИОЛ - 4,8%).
Хромовитрэктомия
Для визуализации СТ и избирательного контрастирования его структур используются различные биологические и синтетические красители. Это привело к созданию нового подхода к хирургии СТ - хромовитрэктомии, при котором красители вводятся интраоперационно. Данный метод позволяет лучше визуализировать СТ и витреоретинальный интерфейс, что облегчает удаление ЭМФ и ВПМ и снижает риск повреждения сетчатки во время проведения операции [19]. Так, M. Veckeneer et al. в 2014 г. [20] проведено многоцентровое исследование, в котором оценивалась эффективность окрашивания ВПМ и ЭРМ двумя красителями: ILM-Blue (0,025% бриллиантовый синий G, 4% полиэтиленгликоль) и MembraneBlue-Dual (0,15% трипановый синий, 0,025% бриллиантовый синий G, 4% полиэтиленгликоль). В исследование было включено 127 пациентов. В ходе хирургического вмешательства яркое окрашивание облегчало идентификацию и удаление ВПМ и ЭМФ. Острота зрения после хирургического вмешательства улучшилась у 83% пациентов, которым визуализация проводилась с помощью ILM-Blue, и у 88% пациентов, которым визуализация проводилась с помощью MembraneBlue-Dual. Таким образом, визуализация ЭМФ с помощью красителей позволяет упростить хирургическое вмешательство с увеличением остроты зрения после операции.
Оптическая когерентная томография
Помимо визуализации ЭМФ с помощью красителей возможна также визуализация с помощью ОКТ. Предоперационное проведение ОКТ позволяет хирургу оценить архитектуру и толщину сетчатки и ее анатомическое положение относительно подлежащих структур и гиалоидной ткани [21]. Необходимость в проведении ОКТ перед хирургическим вмешательством оценивалась в исследовании, в которое был включен 121 пациент (123 глаза) с идиопатическим ЭМФ. Доказано, что ОКТ позволяет выявить отслойку эпимакулярной мембраны. В данном исследовании частичная отслойка мембраны была выявлена в 94% случаев и чаще отмечалась в нижнем сегменте. Кроме того, по мнению ряда авторов, после проведения ОКТ нет необходимости в использовании красителей для визуализации мембраны [22]. В настоящее время появилась возможность интраоперационного проведения ОКТ, что позволяет осуществлять эффективный контроль удаления даже неокрашенных мембран [10].
Завершение операции
Хирургические вмешательства по поводу ЭРМ, не сопровождающихся макулярным разрывом, в настоящее время проводятся без тампонады витреальной полости силиконовым маслом либо газо-воздушной смесью. При использовании 25G и 27G витрэктомии ушивание склеростом часто не требуется.
Осложнения хирургического вмешательства
Кровоизлияние в стекловидное тело и под сетчатку, перфорация сетчатки
Для оценки частоты развития данных осложнений в ходе хирургического вмешательства при ЭМФ был проведен метаанализ данных 9 исследований. По данным метаанализа, при витрэктомии частота развития кровоизлияний во время операции составила 0,9% (2015) [23]. При проведении 23G витрэктомии частота ятрогенного повреждения сетчатки, по данным ряда исследований, составляет от 11 до 45% [9, 24]. В проспективном наблюдательном исследовании была проведена оценка факторов риска ятрогенного повреждения сетчатки во время 23G витрэктомии. В исследование были включены данные о 137 пациентах, которым проводилась 23G витрэктомия. Частота перфорации сетчатки во время отделения задней гиалоидной мембраны составила 18,2% [25]. По данным Британской национальной базы данных, наиболее частым осложнением в ходе витреоретинальных хирургических вмешательств является перфорация сетчатки (3,2%). Общая частота развития интраоперационных осложнений при удалении ЭМФ составила 8,55% (2013) [6].
Снижение остроты зрения
Наиболее частое осложнение после хирургического вмешательства по поводу ЭМФ, возможно, связано с тангенциальной тракцией на сетчатку при удалении ЭРМ, а также повреждением нейроэпителия послеоперационным отеком. Так, для оценки факторов риска развития данного осложнения L. Scheerlinck et al. [26] провели систематический обзор данных 19 исследований, в которых оценивалась острота зрения после хирургического удаления ЭМФ. Наиболее важными факторами, влияющими на остроту зрения после операции, являются острота зрения до операции, а также выраженность метоморфопсий. Толщина сетчатки в области центральной ямки не оказывает влияния на остроту зрения после операции [26]. Также доказано, что чем больше острота зрения до операции, тем больше она будет после операции [27].
Прогрессирующая ядерная катаракта
Это частое осложнение хирургического вмешательства, которое развивается у 12,5-63% пациентов после витрэктомии с пилингом ВПМ [27]. Частота развития катаракты после хирургического вмешательства, по мнению ряда авторов, зависит от метода выполнения витрэктомии. Так, в исследовании, в котором сравнивались эффективность и безопасность 25G и 20G витрэктомии, было показано, что частота развития катаракты после проведения 20G витр-
эктомии составляла 20%, а после проведения 25G витр-
эктомии - 6% (р<0,05) [28]. Возможно, данное осложнение связано с более вероятным повреждением передней гиалоидной мембраны при 20G витрэктомии из-за относительно большего интраокулярного ирригационного потока.
Влияние на гидродинамику глаза
Согласно данным одного из исследований, повышение ВГД в послеоперационном периоде отмечалось у 22% пациентов, которым проводилась 20G витрэктомия, и у 2% пациентов, которым проводилась 25G витрэктомия [28].
В исследовании, проведенном K. Mitsui et al., частота развития гипотонии после проведения 27G и 25G витрэктомии составляла 30% и 35% соответственно [29]. В исследовании, в котором сравнивались эффективность и безопасность 20G, 23G и 25G витрэктомии, было продемонстрировано снижение ВГД в раннем послеоперационном периоде у пациентов, которым проводили 23G и 25G витрэктомию, но разница не была статистически значимой. В то же время у пациентов, которым проводили 20G витрэктомию, отмечалось значимое повышение ВГД в первый день после операции по сравнению с таковым до операции [25]. Вероятно, объем и скорость удаления стекловидного тела влияют на гидродинамику глаза в послеоперационном периоде. Следует также отметить, что при выполнении субтотальной витрэктомии существует риск повреждения хрусталика [31].
Отслойка сетчатки
Является достаточно редким осложнением витрэктомии. Так, в исследовании, проведенном во Франции, было показано, что частота отслойки сетчатки после 23G витрэктомии у пациентов с ЭМФ составляла 2,1% и развивалась в среднем через 3,9 мес. после операции. Данное грозное осложнение может быть связано с необнаруженными интраоперационно ятрогенными микроперфорациями на периферии сетчатки, вызванными витрэктомией в области основания СТ [32].
Изменение состояния зрительного нерва
Так, R. Tadayoni et al. описали состояние зрительного нерва после операции по поводу ЭМФ как «разъединение волокон зрительного нерва». Авторы полагают, что изменение зрительного нерва связано с его повреждением при пилинге ВПМ либо с отделением задней гиалоидной мембраны от ДЗН [33]. Позднее подобные изменения волокон зрительного нерва были продемонстрированы при помощи ОКТ [34]. В исследовании, проведенном R.F. Spaide, было показано, что при проведении витрэктомии с пилингом ВПМ у всех пациентов с помощью ОКТ визуализировались «впадины» на внутреннем слое сетчатки по ходу волокон зрительного нерва. Автор полагает, что данная аномалия связана не с повреждением зрительного нерва, а с процессом заживления после операции [35].
Изменения в поле зрения
Развитие дефектов полей зрения после хирургического вмешательства по поводу ЭМФ связано с повреждением СНВС [36, 37]. При удалении эпимакулярных мембран может отмечаться концентрическое сужение полей зрения [37]. В исследовании, проведенном A. Uemuraet al., с участием 16 пациентов, которым выполнялась витрэктомия по поводу ЭМФ, было показано, что дефекты полей зрения отмечались у 57% пациентов, которым проводили витрэктомию с использованием индоцианина зеленого, в то время как у пациентов, которым хромовитрэктомия не проводилась, дефектов полей зрения не было. Очевидно, что токсичность красителя, приводящая к повреждению СНВС, является причиной развития дефектов полей зрения [38]. Подобных эффектов при применении MembraneBlue-Dual, трипанового синего, триамценолона ацетонида не выявлялось.
Заключение
Единственным методом лечения ЭМФ на данный момент является хирургический. В настоящее время применяются различные типы хирургического вмешательства, а также различные способы визуализации СТ и эпимакулярной мембраны, каждый из которых имеет свои преимущества и недостатки. После хирургического вмешательства по поводу ЭМФ необходимо тщательное наблюдение в послеоперационном периоде для своевременного выявления и коррекции осложнений. Совершенствование техники вмешательства, а также использование современного оборудования и расходных материалов позволяют минимизировать негативные эффекты от лечения, достигая максимально возможного визуального результата.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Удаление эпиретинальных мембран без витрэктомии
Цель. Оценить эффективность и безопасность удаления эпиретинальных мембран без витрэктомии.
Материал и методы. Проведена оценка результатов хирургического лечения 20 пациентов (20 глаз), которым эпиретинальная мембрана (ЭРМ) удалялась без витрэктомии. Удаление ЭРМ проводилось по следующей методике: установка двух 25G-портов, удаление эпиретинальной мембраны единым блоком с внутренней пограничной мембраной (ВПМ) без окрашивания. Проводился контроль остроты зрения, внутриглазного давления, толщины сетчатки в центральной зоне, а также толщины слоя нервных волокон сетчатки в различных секторах перипапиллярно, также проводился контроль экскавации ДЗН с помощью ОКТ. Светочувствительности макулярной зоны сетчатки определялась при помощи микропериметра Maia, а периферических зон - при помощи компьютерного периметра Humpfrey. Пациенты обследованы до операции, а также через 1, 3, 6 и 12 мес. после операции.
Результаты. Средний возраст пациентов в исследуемой группе составил 67,7±11,4 года. Средняя продолжительность хирургического вмешательства составила 8 минут. Статистически значимое увеличение остроты зрения было зафиксировано уже через месяц (0,378 против 0,286 до вмешательства, p=0,041), и в дальнейшем значение данного показателя продолжило нарастать, достигнув к концу периода наблюдения величины 0,63 (динамика за 12 мес. +0,344). Светочувствительность макулы возросла за 12 мес. на 2,21 дБ (p=0,008). Толщина сетчатки прогрессивно снижалась в течение всего периода наблюдения (с 462,4 мкм исходно до 363,9 мкм через 12 мес., p=0,01). Изменения других показателей были незначимыми.
У 6 пациентов из 20 был зафиксирован рецидив мембраны в сроки от 3 до 6 мес. Данное осложнение, по всей видимости, может быть связано с неполным удалением внутренней пограничной мембраны при удалении эпимакулярной мембраны единым блоком с ней и при отсутствии окрашивания.
Выводы. Удаление эпимакулярной мембраны без витрэктомии эффективно (значительный рост остроты зрения, улучшение светочувствительности центральной зоны сетчатки, снижение толщины сетчатки), не оказывает негативного влияния на светочувствительность периферической сетчатки и внутриглазное давление, однако сопряжено с рецидивированием, что связано со сложностью выполнения и в определенной степени ограничивает применение данного метода.
Ключевые слова: эпиретинальный фиброз, эпиретинальная мембрана, витрэктомия, оптическая когерентная томография, внутренняя пограничная мембрана, красители, поле зрения.
Операции при глаукоме — хирургическое лечение
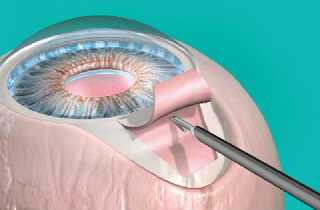
При постановке диагноза глаукома необходимо понимать, что это заболевание останется на всю жизнь, ведь определенная часть зрительного нерва уже пострадала. То есть, сказать: «Мне вылечили глаукому» — нельзя, даже после выполнения операции. Конечно, это не приговор, но забывать о заболевании не стоит.
Целью хирургического лечения глаукомы может быть: создание дополнительной системы оттока водянистой влаги, нормализация ее циркуляции либо снижение ее продукции. Операция позволяет избавить человека от применения медикаментозных средств (либо существенно снизить зависимость от них). Вопрос о проведении хирургического вмешательства решается при динамическом наблюдении за течением глаукомы. Для каждого пациента этот вопрос строго индивидуален, ведь учитывается форма и стадия заболевания, уровень ВГД, коэффициент оттока, состояния угла передней камеры, объем полей зрения, общее состояние пациента на данный момент времени.
Виды антиглаукомных операций
Непроникающие операции при глаукоме: непроникающая глубокая склерэктомия (НГСЭ)
В ходе вмешательства под верхним веком, в верхней части лимба и средних склеральных слоях моделируется карман размерами примерно 4×5 мм. Часть Шлеммова канала, включая его внутреннюю стенку, обнажается и удаляется. Также обнажается зона десцеметовой мембраны, прилегающая к лимбу, способная выступать фильтром внутриглазной жидкости. Чтобы эта операция выполняла свою функцию более долгий срок, в карман устанавливается дренаж из определенного материала (например, коллагеновый). Он не позволяет стенкам кармана склеиваться и препятствует рубцеванию в операционной зоне.
Как правило, такая операция становится первичным выбором хирурга в случае открытоугольной глаукомы. Ей отдается предпочтение, так как она максимально безопасна, благодаря отсутствию перепадов давления при целостности полости глаза. В этом случае, полость глаза не вскрывается, что дает возможность очень плавно снизить глазное давление. Дренажей, усиливающих результат операции и пролонгирующих ее действие, очень много.
При необходимости, в этом случае существует возможность очень удобной комбинации антиглаукомной операции и операции по удалению катаракты.
Вмешательство выполняется амбулаторно, период полной реабилитации составляет 1-2 дня. Правильное выполнение операции хирургом сводит риски потенциальных осложнений практически к нулю.
Проникающие антиглаукомные операции: трабекулэктомия
Эта операция также начинается с моделирования кармана в средних склеральных слоях. При этом, часть Шлеммова канала удаляется, глаз вскрывается, после чего в радужке моделируется специальное отверстие (колобома).
Отличие этой операции от непроникающей — во вскрытии глаза. В этом случае глаз вскрывается, а при непроникающей операции тонкая полупроницаемая десцеметова оболочка остается сохранной, делая глаз герметичным.
Трабекулэктомия - довольно старый тип операций. К ней прибегают, если глаукома уже достаточно развита, и существует необходимость в проведении операции повторно. В процессе ее выполнения также используются разные типы дренажей, которые будут препятствовать рубцеванию.
Опасность проникающих операций более высока, так как в послеоперационном периоде они могут вызвать гипотонию глаза (стойкое снижение ВГД), воспалительную реакцию и кровоизлияния, провоцировать появление катаракты. И все же, их эффективность значительно выше, так как результаты сохраняются более длительный срок.
Существует великое множество дренажей для антиглаукомных операций. Одна из их отличительных особенностей — материал изготовления: гидрогелевые, коллагеновые, металлические, пластиковые.
По форме они бывают прямоугольными, квадратными, овальными и треугольными. Дренажи могут быть однородными или пористыми, по форме напоминать трубочку или гвоздь.
Существуют также дренажи клапанные (Ахмеда или Мальтено), которые представляют собой систему трубочек с пластиковым «карманом», обеспечивающим отток из передней камеры глаза в пространство между оболочками. Внутри трубочек находятся клапаны, регулирующие ток внутриглазной жидкости.
Какой дренаж лучше? Здесь все очень индивидуально, ведь идеального дренажа нет. Все зависит от здравого смысла и опыта хирурга.
Операции, направленные на нормализацию циркуляции внутриглазной жидкости при закрытоугольной глаукоме: иридэктомия
Когда корень радужной оболочки блокирует угол передней камеры, ее можно вскрыть и восстановить отток жидкости из задней камеры в переднюю, сформировав отверстие в радужке. Инновационные возможности микрохирургии, сделали операцию лазерной иридэктомии практически не травматичной и абсолютно безопасной.
Циркуляцию внутриглазной жидкости также восстанавливает операция иридоциклоретракции и еще ряд похожих методов. Данный тип хирургического вмешательства в плане эффективности менее предсказуем, к тому же, в этом случае возможны некоторые осложнения: кровоизлияния внутрь глаза, возникновение и быстрое прогрессирование катаракты, воспалительный процесс хронического течения.
Операции, снижающие выработку внутриглазной жидкости: циклокриокоагуляция
При исходе глаукомы, в ее терминальной стадии, либо когда любые хирургические методы воздействия оказываются неэффективными, может быть выполнена циклокриокоагуляция. В этом случае, вырабатывающую внутриглазную жидкость зону не разрушают лазером, а «вымораживают».
В процессе операции, специальным криозондом на склеральную поверхность в проекции цилиарного тела наносят располагающиеся по кругу микроожоги. В этом месте из-за воздействия низких температур клетки ткани цилиарного тела атрофируются, и объем вырабатываемой водянистой влаги уменьшается. Значение применяемой тмпературы (-) 130° — 150°С, количество объектов 6-8, время экспозиции 1-2.
Говоря проще, это является попыткой сохранить глаз даже в том случае, когда он уже не видит.
Пластика Шлеммова канала (каналопластика)
Канал Шлемма является основным транспортным коллектором для отвода внутриглазной жидкости. Свое название он получил в честь Фридриха Шлемма — немецкого анатома XIX века. Данный канал способен отводить внутриглазную влагу из передней камеры в вены черепа со скоростью примерно 2-3 микролитра в минуту через многочисленные дренажные сеточки.
Канал представляет собой сосуд, пролегающий по кругу на границе роговицы и радужки в углу передней камеры, прямо в толще склеры. По своему строению, канал схож с лимфатическим сосудом. Внутренняя его часть, соприкасающаяся с внутриглазной жидкостью, покрыта трабекулярной (микропористой) сетью. На этом этапе водянистая влага встречает наибольшее сопротивление оттоку. При блокировке ствола канала либо его сетчатой структуры, возникает глаукома. Подобное возможно при диабете, атеросклерозе, травме, инфекционных процессах.
Выполнение операций на Шлеммовом канале подразумевает расширение его с помощью различных зондов и баллончиков. Кроме того, внутрь «по кругу» могут вводиться специальные нити, выполняться его рассечение или заполнение вязкими жидкостями (вискоканалостомия).
Правда, подобные операции дают очень недолгий эффект (в лучшем случае) из-за повторной закупорки или рубцевания. Хотя, проводимые в этом направлении исследования позволяют надеяться, на успех методики.
Когда необходимо делать операцию?
Хирургическое лечение - это альтернатива медикаментозной терапии, проводимой в начальных стадиях заболевания. Кроме того, это единственно возможный способ стабилизировать глаукомный процесс и сохранить зрение в развитой стадии и далеко зашедших случаях заболевания. Как правило, хирургическое вмешательство рекомендовано при отсутствии эффекта лечения медикаментозными препаратами и после применения методов лазерной хирургии. Реабилитационный период после антиглаукомной операции обычно минимален и сопровождается небольшими ограничениями. Таким образом, уже спустя несколько дней пациент может вести привычную жизнь и приступать к работе.
Субретинальная неоваскулярная мембрана (СНМ) и ее лечение
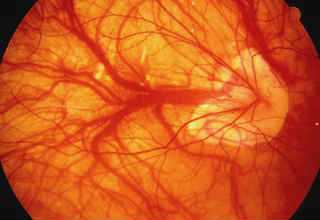
Основной причиной слабовидения и полной слепоты у лиц старшего и пожилого возраста, по данным эпидемиологических исследований, является возрастная макулярная дегенерация (ВМД). Заболевание имеет наследственную предрасположенность и, в первую очередь, поражает пигментный эпителий, а также хориокапилляры в центральной (макулярной) зоне сетчатой оболочки.
Подавляющее большинство (почти 90%) случаев утери зрения от ВМД обусловлено развитием экссудативной формы этого заболевания, по-другому называемой «влажной». Данная форма ВМД сопровождается чрезмерным ростом аномальных, новообразованных сосудов, прорастающих из хориокапиллярного слоя сосудистой оболочки сквозь дефекты в мембране Бруха под нейроэпителий и/или пигментный эпителий сетчатки. В офтальмологии подобное состояние получило название субретинальной (локализованной под сетчаткой) неоваскулярной мембраны (СНМ).
Новообразованные сосуды при СНМ имеют аномально слабую стенку, из-за чего под сетчатку начинает просачиваться жидкая часть крови, с отложением там липидов и холестерина. Зачастую эти сосуды рвутся, и возникают кровоизлияния, как правило, небольшие по объему и локальные, а в некоторых случаях и довольно значительные. Все это нарушает питание сетчатки и приводит к возникновению фиброза, когда прозрачная ткань сетчатки замещается соединительной. В исходе влажной формы ВМД формируется субретинальный рубец, из-за чего сетчатка перестает выполнять свои функции
К абсолютной слепоте центральная хориоретинальная дистрофия (ЦХРД) не приводит никогда. Но из-за появления в центральной части поля зрения темного пятна (абсолютной скотомы) у человека постепенно пропадает центральное зрение. Так как патологический процесс затрагивает лишь центральную часть (макулу), периферическое поле зрения остается сохранным. В исходе процесса остаточное зрение, как правило, составляет 0,1 (первая строчка таблицы) и пациент видит лишь «боковым зрением.
Патологический процесс всегда протекает индивидуально, но развитие СНМ «включает» временной фактор, который приобретает первостепенное значение. При этом, избежать полной потери зрения поможет только ранняя диагностика заболевания и своевременно начатое адекватное лечение, приводящее к длительной ремиссии или обратному развитию патологического процесса.
Методы лечения неоваскулярной мембраны
Среди методов лечения субретинальной неоваскулярной мембраны при влажной форме ВМД выделяют лазеркоагуляцию сетчатки (см. страницу «Операции на сетчатке глаза«) , транспупиллярную термотерапию (ТТТ), фотодинамическую терапию (ФДТ) и удаление СНМ хирургическим способом (см страницу «Хирургические операции на глазах«.
Однако за последние несколько лет терапия данного заболевания вышла на новый уровень, благодаря появлению эффективных лекарственных препаратов. Это препараты-ингибиторы выработки фактора эндотелиального роста сосудов (VEGF).
Ведь хотя причины возникновения СНМ до конца не изучены, из данных исследований последних лет ученые сделали вывод, что роль VEGF в ее развитии очень важна. Таким образом, фармакологические ингибиторы VEGF возможно являются новым и наиболее перспективным направлением в терапии данных патологий.

В современной клинической практике, сегодня уже широко применяют следующие препараты:
Мacugen® (Макуджен)
Это один из первых фармакологических ингибиторов VEGF, применяющийся в офтальмологии. Мacugen® или Макуджен (основное вещество пегаптаниб) позиционируется, как так называемый анти-VEGF аптамер. Лечение им помогает замедлить снижение остроты зрения пациентов с СНМ при влажной форме ВМД. Эффективность препарата сравнима с действием фотодинамической терапии. Он стал первым из препаратов данной группы, разрешенным FDA для интравитреального введения в полость стекловидного тела при лечении любых форм субретинальной неоваскулярной мембраны при возрастной макулодистрофии (2004 г.). Особенно хороший эффект от применения препарата Макуджен наблюдается на ранних стадиях ВМД.
Lucentis® (Луцентис)
Препарат Lucentis® или Луцентис (основное вещество ранибизумаб) действует как антиген-связующий фрагмент к VEGF антител мышей. Препарат является рекомбинантным, полученным одним из методов генной инженерии. Молекула ранибизумаба — высокоспецифичная часть антитела мыши к VEGF с низким молекулярным весом (48 кДа). Она может проникать сквозь все слои сетчатой оболочки к патологическому объекту блокируя рецепторы VEGF входящих в СНМ новообразованных сосудов. Lucentis — первый препаратом данной группы, терапия которым ведет к частичному восстановлению зрения, а не только к торможению его прогрессирующего снижения (стабилизация зрения в 95% случаев, повышение остроты зрения в 25-40% случаев). Положительные результаты клинических исследований позволили FDA утвердить Lucentis, как средство лечения субретинальной неоваскулярной мембраны при ВДМ (2006 г.).
Avastin™ (Авастин)
Бевацизумаб — действующее вещество препарата Avastin™ (Авастин), является полноразмерным антителом против любых изоформ (разновидностей) VEGF. Еще в 2004 году его стали активно использовать в онкологии при лечения рака прямой кишки и толстого кишечника.
Первый опыт применения Авастина у пациентов с влажной формой ВМД принадлежит американским исследователям Rosenfeld и Puliafito. Это произошло в 2005 году, когда положительные результаты от его применения были получены у пациентов с СНМ и прогрессирующим падением остроты зрения после поведения фотодинамической терапии и лечения Макудженом. Пациентам выполнялось 2-3 кратное введение Авастина внутривенно по 5 мг/кг с перерывом в две недели. При этом было достоверно зафиксировано проведением ОКТ повышение остроты зрения, а также уменьшение толщины сетчатки в зоне макулы.
Какое-то время целесообразность интравитреального введения препарата оставалась под сомнение. Ведь его молекулярная масса в несколько раз выше, чем у Макуджена и Луцентиса, и были сомнения насчет его способности проникать сквозь сетчатку. Но опубликованные в последующем результаты исследований убедительно доказали, что введенный в полость стекловидного тела бевацизумаб, легко проникать сквозь все слои сетчатой оболочки.
При внутривенном введении Авастина существует риск потенциально возможных побочных эффектов, уже описанных при применении его в онкологии. Среди них: повышение АД, носовые кровотечения, риск тромбоэмболии, протеинурия. Однако интравитреальные инъекции данного препарата буквально сводят на нет возможность возникновения указанных побочных эффектов, ведь применяемая доза в 400-500 раз меньше. В тоже время этот путь введения обеспечивает высокую концентрацию действующего вещества именно в месте поражения.
Введение Авастина в полость стекловидного тела осуществляют раз в 3-4 недели в дозировке 1,25 мг. По результатам многочисленных исследований такие инъекции повышают остроту зрения в 30-43% случаев и стабилизируют ее в 53-56% случаев. Положительный эффект от инъекций Авастина сводится к уменьшению толщины сетчатки в зоне макулы, что подтверждается данными ОКТ, а также к стабилизации объема СНМ и к уменьшению пропотевания флюоресцеина сквозь сосудистую стенку по данным ФАГ. Максимальная эффективность препарата бнаруживается с первых инъекций. При этом, степень выраженности ее не зависит проводимых ранее фотодинамической терапии и/или лечения Макудженом. По имеющимся данным, повторное ухудшение зрения, а также скопление в субретинальном пространстве жидкости после однократной инъекции Авастина возникает в 30% случаев примерно через 70-80 дней, что делает особенно актуальной своевременность следующей инъекции.
Наиболее частыми неприятными последствиями интравитреального введения Авастина бывают: транзиторная (преходящая) инъекция конъюнктивальных сосудов и кровоизлияние в зоне введения препарата. Возникновения системных побочных эффектов подобного способа введения до настоящего времени не отмечалось.
В странах Европы, как и в США показания к применению Авастина в офтальмологической практике до сих пор отсутствуют в официальном перечне и препарат применяется по т.н. системе «off-label». И все же, Авастин с каждым годом становится все более популярным в группе препаратов-ингибиторов VEGF. Не последнюю роль в этом играет и экономический фактор, ведь инъекции Авестина имеют самую низкую стоимость в сравнении со средствами аналогичного действия - Макудженом и Луцентисом, а также процедурами фотодинамической терапии.
За последние два года появилось немало публикаций с результатами исследований терапии препаратом Avastin у пациентов с субретинальной неоваскулярной мембраной при влажной форме ВМД. Однако, отдаленных результатов подобного лечения пока нет и ожидается не ранее, чем через 3-5 лет. Но все же, имеющийся уже сегодня высокий процент положительных результатов интравитреального введении группы ингибиторов VEGF говорит о том, что достаточно эффективный метод лечения экссудативной формы возрастной макулярной дегенерации наконец появился. Применение Авастина или какого-либо из иных препаратов-ингибиторов VEGF является сегодня методом выбора при лечении пациентов с ВМД, как альтернатива дорогостоящей процедуре фотодинамической терапии.
Читайте также:
- Техника, этапы операций по поводу несостоятельности тотального эндопротеза голеностопного сустава (операций спасения)
- Старческая глухота. Наследственные нарушения слуха у детей
- Эффективность вакцинации взрослых.
- Синдром Майера-Рокитанского-Кюстера (Mayer-Rokitansky-Kuster)
- Техника пальпации кишечника. Особенности пальпации кишок
