Методика удаления эпиретинальных мембран. Принципы пилинга ЭРМ
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Цель: Сравнить функциональные и анатомические исходы после проведения изолированного пилинга эпиретинальной мембраны (ЭРМ) и комбинированного варианта операции в сочетании с пилингом внутренней пограничной мембраны (ЭРМ/ВПМ) для лечения идиопатической эпиретинальной мембраны.
Дизайн: Систематический обзор и метаанализ.
Методы: В электронных базах Кокран CENTRAL, MEDLINE Ovid и Embase Ovid был проведен сравнительный поиск рандомизированных контролируемых клинических исследований, сравнивающих ЭРМ и ЭРМ/ВПМ. Независимым образом были отобраны два литературных обзора и проанализированы данные. Методологическое качество оценивалось с помощью инструмента Cochrane Risk of Bias. Данные были проанализированы в RevMan 5.3. Качество совокупности доказательств оценивалось с использованием метода оценки, разработки и оценки рекомендаций (GRADE).
Результаты: В данную работу было включено 7 исследований (387 глаз). На 207 глазах был проведен комбинированный вариант 207 (53%) ЭРМ/ВПМ. На 180 (47%) - изолированный ЭРМ. Послеоперационные значения остроты зрения (LogMAR) значительно не различалось между двумя вариантами операции с средним значением отклонения (MD) равным 0.02 (95% ДИ 0.04-0.09; p=0.45; I2=42%; n=101) спустя 1 месяц, 0.03 (95% ДИ 0.01-0.06; p=0.11, I2=15%; n=299; высокий уровень доказательности) спустя 3 месяца, 0.01 (95% ДИ 0.03-0.04; p=0.72; I2=21%; n=317; высокий уровень доказательности) спустя 6 месяцев и 0.01 (95% ДИ 0.02-0.04; p=0.49; I2=39%; n=234) спустя 12 месяцев. Вариант ЭРМ/ВПМ был ассоциирован с значительно более низким показателем повторного развития ЭРМ к 6-12 месяцу с относительным риском равным 0.16 (95% ДИ 0.04-0.64; p=0.01; I2=0%; n=155; средний уровень доказательности) и более высоким показателем центральной толщины макулы (в микронах) к 12 месяцу с MD равным 20.53 (95% ДИ 4.96-36.09; p=0.01; I2=12%; n=234).
Выводы: Оба варианта операции позволяли достигнуть одинаковые значения остроты зрения, несмотря на анатомические различия (центральная толщина макулы). Комбинированный вариант ЭРМ/ВПМ ассоциирован с значительно более низкой частотой повторного развития ЭРМ к 6-12 месяцу после операции и должен рассматриваться как приоритетный способ лечения данной патологии.
Удаление эпиретинальных мембран без витрэктомии
Эпимакулярный фиброз (ЭМФ) - заболевание, характеризующиеся появлением на поверхности сетчатки эпиретинальной мембраны (ЭРМ), что приводит к снижению остроты зрения, а также появлению искажений и вспышек перед глазами (2017) [1].
К данному заболеванию могут приводить различные патологические процессы, такие как увеит, отслойка сетчатки, диабетическая ретинопатия. Однако зачастую четкая этиология не прослеживается, т.е. ЭМФ является идиопатическим (2014) [2]. Патогенез данного заболевания до конца не выяснен, однако основными факторами риска являются возраст, гиперхолестеринемия, а также задняя отслойка стекловидного тела (2016) 3.
Оптическая когерентная томография обладает высокой чувствительностью и специфичностью и позволяют достоверно диагностировать ЭМФ. Хирургическое же лечение патологии макулярной области сопряжено с риском возникновения послеоперационных осложнений, например, появлением дефектов полей зрения (2013) [6], что диктует проведение периметрии таким пациентам как до, так и после хирургического лечения.
Поскольку консервативные методы терапии ЭМФ к настоящему моменту не разработаны, решение данной проблемы возможно исключительно хирургическим путем (2016) [7]. Классическим подходом к хирургическому лечению ЭМФ является витрэктомия с пилингом эпиретинальной мембраны (1978) [8]. Данный тип операций обеспечивает рост остроты зрения, а также низкий риск рецидивов после успешного проведения подобных вмешательств (2017) [9]. Основным преимуществом витрэктомии является полное элиминирование тракционных воздействий на макулу со стороны стекловидного тела. Кроме того, удаление стекловидного тела упрощает в дальнейшем удаление и самой ЭРМ.
Стандартом для данного типа операций на настоящий момент является инструментарий 25 либо 27G, что обеспечивает меньшую операционную травму и быстрое восстановление глаза после операции (2016) [10]. В ходе операции стекловидное тело контрастируется интравитреальным введением стероидов (например, триамценолоном), а эпиретинальных мембран - раствором красителей (например, бриллиантовой синий) (2016) [11].
Следует отметить, что выполнение витрэктомии сопровождается повышением риска развития катаракты, появлением ятрогенных разрывов сетчатки, изменениями слоя нервных волокон сетчатки, а также нарушением внутриглазной гидродинамики 14. Именно поэтому некоторые специалисты предпочитают выполнять пилинг эпиретинальной мембраны без витрэктомии (2011) [16]. В нашей клинике накоплен значительный опыт удаления ЭРМ по классической методике, однако удаление без витрэктомии до настоящего момента не выполнялось.
Одноцентровое открытое проспективное интервенционное клиническое исследование по оценке эффективности и безопасности удаления эпимакулярных мембран без витрэктомии.
Материал и методы
В исследование в общей сложности было включено 20 пациентов (20 глаз), среди них 15 женщин и 5 мужчин. Средний возраст участников исследования составил 68 лет с доверительным 95% интервалом от 66 до 70 лет. В исследование включались пациенты с ЭМФ, а также отсутствием значимых помутнений роговицы, хрусталика и стекловидного тела. Дополнительным критерием для включения было наличие задней отслойки стекловидного тела, подтвержденной эхографически.
Критериями исключения стали сквозные макулярные разрывы любых стадий, любые формы глаукомы, острой сосудистой патологии сетчатки, диабетической ретинопатии, а также отслойки сетчатки, воспалительные процессы, операции, травмы глаз в анамнезе. Таким образом, эпиретинальный фиброз был идиопатическим.
В ходе исследования применялось следующее оборудование: проектор для визометрии Tomey TCP-1000, бесконтактный тонометр Huvitz HNT-7000, биомикроскоп Topcon SL-1E, прибор для ультразвуковой эхографии глаза Tomey UD-6000, оптический когерентный томограф Cirrus HD-OCT 500, компьютерный периметр Humpfrey, Zeiss, микропериметр Centervue Maia. Хирургические вмешательства выполнялись одним хирургом с использованием стандартного сертифицированного оборудования (витреомашина Constellation, Alcon).
Хирургическое вмешательство выполнялось следующим образом: устанавливалось два 25G-порта, ЭРМ удалялась единым блоком с внутренней пограничной мембраной без окрашивания (среднее время вмешательства составило 8 минут). Тампонада витреальной полости силиконовым маслом либо газо-воздушной смесью ни в одном из случаев не выполнялась.
Проводился динамический мониторинг следующих офтальмологических показателей: максимально корригированная острота зрения (далее - МКОЗ), светочувствительность центральной зоны сетчатки, толщина сетчатки (в т.ч. слой нервных волокон в перипапиллярной области в различных секторах, далее - СНВС) по данным ОКТ, внутриглазное давление (далее - ВГД), размеры экскавации ДЗН, светочувствительность периферических зон сетчатки. Временные точки измерений: до операции, стандартный послеоперационный осмотр и выполнение ОКТ макулярной области в первые сутки после операции, контрольный осмотр через 7 дней, весь комплекс обследования через 1, 3, 6 и 12 мес. после вмешательства.
По показателю светочувствительности центральной зоны сетчатки также отмечается постепенный стабильный рост начиная с третьего месяца наблюдения. Общий прирост за 12 мес. наблюдения составил 2,21 дБ (p=0,008).
Толщина сетчатки прогрессивно снижалась в течение всего периода наблюдения (с 462,4±57,1 мкм исходно до 363,9±49,3 мкм через 12 мес., p=0,001). Наиболее быстрое снижение отмечается с третьего по шестой месяц наблюдения.
Наибольшее истончение СНВС регистрируется в височном секторе (с 81,75±20,0 до 65,8±16,9), именно с этой стороны и проводится удаление ЭРМ. В остальных секторах изменения незначительны.
Значимых изменений состояния экскавации ДЗН, показателей ВГД и светочувствительности периферии сетчатки выявлено не было. Изменения всех оцениваемых показателей представлены в табл.
Хирургическое лечение катаракты в дальнейшем не понадобилось ни одному из пациентов. У 6 из 20 прооперированных пациентов выявлен рецидив ЭРМ в сроки от 3 до 6 мес.
Вмешательство следует признать эффективным. Во всех случаях отмечено достоверное увеличение остроты зрения, светочувствительности центральной зоны сетчатки, а также уменьшение толщины центральной зоны сетчатки за счет элиминации тракционных воздействий ЭРМ и уменьшения интраретинального отека. Минимальным было влияние на ВГД, светочувствительность периферии сетчатки, ни в одном из случаев не прогрессировала катаракта.
Однако негативным следует признать значительное количество рецидивов заболевания. Данное осложнение, по всей видимости, может быть связано с неполным удалением ВПМ при удалении ЭРМ единым блоком с ней и при отсутствии окрашивания. Данный факт подтвердили повторные операции, которые проводились с использованием витрэктомии и окрашивания, которое выявило остатки ВПМ в области предшествовавшего вмешательства. Важность окрашивания, а также возможности рецидива мембран после удаления без витрэктомии отмечается и в других исследованиях (2017) [17, 18]. Следует отметить, что рецидив не сопровождался повторным снижением зрения, но у пациентов сохранялись жалобы на метоморфопсии.
Удаление эпимакулярной мембраны без витрэктомии эффективно (значительный рост остроты зрения, улучшение светочувствительности центральной зоны сетчатки, снижение толщины сетчатки), не оказывает негативного влияния на светочувствительность периферической сетчатки и внутриглазное давление, однако в 30% случаев сопряжено с рецидивированием, что связано со сложностью выполнения и в определенной степени ограничивает применение данного метода.
Цель. Оценить эффективность и безопасность удаления эпиретинальных мембран без витрэктомии.
Материал и методы. Проведена оценка результатов хирургического лечения 20 пациентов (20 глаз), которым эпиретинальная мембрана (ЭРМ) удалялась без витрэктомии. Удаление ЭРМ проводилось по следующей методике: установка двух 25G-портов, удаление эпиретинальной мембраны единым блоком с внутренней пограничной мембраной (ВПМ) без окрашивания. Проводился контроль остроты зрения, внутриглазного давления, толщины сетчатки в центральной зоне, а также толщины слоя нервных волокон сетчатки в различных секторах перипапиллярно, также проводился контроль экскавации ДЗН с помощью ОКТ. Светочувствительности макулярной зоны сетчатки определялась при помощи микропериметра Maia, а периферических зон - при помощи компьютерного периметра Humpfrey. Пациенты обследованы до операции, а также через 1, 3, 6 и 12 мес. после операции.
Результаты. Средний возраст пациентов в исследуемой группе составил 67,7±11,4 года. Средняя продолжительность хирургического вмешательства составила 8 минут. Статистически значимое увеличение остроты зрения было зафиксировано уже через месяц (0,378 против 0,286 до вмешательства, p=0,041), и в дальнейшем значение данного показателя продолжило нарастать, достигнув к концу периода наблюдения величины 0,63 (динамика за 12 мес. +0,344). Светочувствительность макулы возросла за 12 мес. на 2,21 дБ (p=0,008). Толщина сетчатки прогрессивно снижалась в течение всего периода наблюдения (с 462,4 мкм исходно до 363,9 мкм через 12 мес., p=0,01). Изменения других показателей были незначимыми.
У 6 пациентов из 20 был зафиксирован рецидив мембраны в сроки от 3 до 6 мес. Данное осложнение, по всей видимости, может быть связано с неполным удалением внутренней пограничной мембраны при удалении эпимакулярной мембраны единым блоком с ней и при отсутствии окрашивания.
Выводы. Удаление эпимакулярной мембраны без витрэктомии эффективно (значительный рост остроты зрения, улучшение светочувствительности центральной зоны сетчатки, снижение толщины сетчатки), не оказывает негативного влияния на светочувствительность периферической сетчатки и внутриглазное давление, однако сопряжено с рецидивированием, что связано со сложностью выполнения и в определенной степени ограничивает применение данного метода.
Ключевые слова: эпиретинальный фиброз, эпиретинальная мембрана, витрэктомия, оптическая когерентная томография, внутренняя пограничная мембрана, красители, поле зрения.
Методика удаления эпиретинальных мембран. Принципы пилинга ЭРМ
В данном обзоре подробно рассмотрены подходы к хирургическому лечению эпимакулярного фиброза. Во введении кратко описаны факторы риска и причины развития заболевания. Далее поэтапно разобраны ход операции, его возможные варианты. Приведено сравнение результатов 25 и 27G витрэктомии при эпиретинальном фиброзе (ЭРФ). Сравниваются результаты удаления эпиретинальных мембран (ЭРМ) без витрэктомии и с использованием субтотальной витрэктомии. При удалении ЭРМ без витрэктомии снижается риск развития катаракты, отслойки сетчатки, появления дефектов полей зрения, однако возрастает риск рецидивов заболевания. Далее приведены преимущества и недостатки удаления внутренней пограничной мембраны (ВПМ) во время операции. В частности, приведены данные метаанализа, который показывает, что острота зрения выше через 6 мес. после операции у пациентов, которым вместе с ЭРМ удалялась ВПМ, однако через 18 мес. ситуация становится обратной. Описаны возможности визуализации ЭРМ во время операции. Приведено сравнение результатов операций, включающих окрашивание ЭРМ с помощью ILM-Blue и MembraneBlue-Dual. Показана роль ОКТ в диагностике и лечении ЭРФ. Подробно разобраны возможные осложнения операции, такие как гемофтальм, перфорация сетчатки, катаракта, офтальмогипертензия, дефекты поля зрения. Данный обзор не содержит информацию о лечении сквозных макулярных разрывов.
Ключевые слова: эпиретинальный фиброз, эпиретинальная мембрана, витрэктомия, оптическая когерентная томография, внутренняя пограничная мембрана, осложнения, гемофтальм, отслойка сетчатки, катаракта, офтальмогипертензия, красители, поле зрения.
Surgical treatment of epirethinal fibrosis: a current state of the problem
S.A. Kochergin, D.G. Alipov
Russian Medical Academy of Continuous Professional Education, Moscow
This review discusses different approaches of surgical treatment of epiretinal fibrosis in detail. The introduction briefly describes the risk factors and causes of the disease. Each type of operation is analized as well as all the possible options. The results of 25 and 27G vitrectomy are compared, also in this review you can find the comparison of membrane removal without vitrectomy and after subtotal vitrectomy. When ERM is removed without vitrectomy, the risk of cataract appearing, retinal detachment, appearance of visual field defects decreases, but the risk of recurrence of the disease increases. In this article are also given the advantages and disadvantages of ILM-removing during the operation. In particular, the data of meta-analysis is described, that shows that patients’ who ERM was removed together with ILM visual acuity is higher 6 months after surgery, but after 18 months the situation becomes reverse. The possibilities for visualization of ERM during the operation are described. The article describes the features for visualization of ERM during surgery and a comparison of the results of operations involving ERM staining with ILM-Blue and MembraneBlue-Dual. The role of OCT in the diagnostics and treatment of ERF is shown. The possible surgery complications, such as hemophthalmia, retinal perforation, cataract, ocular hypertension, visual field defects are analized. This material does not include information about treatment of full macular hole.
Key words: epiretinal fibrosis, epiretinal membrane, vitrectomy, optical coherence tomography, internal limiting membrane, complications, intraocular hemorrhage, retinal detachment, cataract, ocular hypertension, dyes, visual field.
For citation: Kochergin S.A., Alipov D.G. Surgical treatment of epirethinal fibrosis: a current state of the problem //
RMJ “Clinical ophthalmology”. 2018;1:55-59.
Для цитирования: Хирургическое лечение эпимакулярного фиброза. Современное состояние проблемы. Клиническая офтальмология. 2018;19(1):55-59.
В обзоре рассмотрены подходы к хирургическому лечению эпимакулярного фиброза. Приведены методы диагностики и лечения эпимакулярного фиброза.
Введение
Эпимакулярный фиброз (ЭМФ) характеризуется образованием эпиретинальной мембраны (ЭРМ) - тонкой прозрачной пленки, появляющейся непосредственно над макулой [1].
По данным McCarty et al. [2], распространенность ЭМФ не превышает 2% среди пациентов в возрасте до 50 лет и достигает 20% среди пациентов 75 лет. Также развитию ЭМФ обычно способствует задняя отслойка стекловидного тела (СТ). В некоторых исследованиях было продемонстрировано, что дополнительным фактором риска развития ЭМФ является гиперхолестеринемия, которая в свою очередь является фоном для структурных изменений сосудов сетчатки [2, 3].
Показано, что болезнь может развиваться на фоне офтальмологических заболеваний, таких как диабетическая
ретинопатия, окклюзия вен сетчатки, отслойка сетчатки, а также после офтальмохирургических вмешательств. Однако в большинстве случаев ЭМФ является идиопатическим [4].
В связи со старением населения проблема диагностики и лечения ЭМФ в последнее время приобретает все большее значение [5, 6]. В настоящий момент единственным эффективным методом лечения ЭМФ является хирургическое вмешательство.
Особенности хирургического лечения
Хирургическое вмешательство при ЭМФ обычно подразумевает обеспечение доступа в витреальную полость посредством установки портов, субтотальную либо частичную витрэктомию, удаление ЭМФ и внутренней пограничной мембраны (ВПМ).
25G и 27G витрэктомия
Введение в клиническую практику витрэктомии с транс-
конъюнктивальными микроразрезами с использованием 25G или 27G инструментария привело к снижению числа послеоперационных осложнений, таких как ранняя послеоперационная гипотония и послеоперационный эндофтальмит, возможно, связанный с микрофильтрацией из относительно крупного 20G разреза [7]. При использовании 25 и 27G инструментария восстановление зрения в послеоперационном периоде происходит быстрее [8]. Для сравнения эффективности и безопасности 25G и 27G витрэктомии было проведено проспективное исследование, в которое было включено 66 пациентов (74 глаза). 25G витрэктомия была выполнена на 37 глазах 33 пациентов (группа 1), 27G витрэктомия была выполнена на 37 глазах 33 пациентов (группа 2). В исследовании оценивались внутриглазное давление (ВГД), острота зрения, толщина центральной зоны сетчатки и продолжительность операции. Средняя продолжительность операции в группе 2 была значимо больше, чем в группе 1. ВГД после операции снижалось в обеих группах (на 9,7 и 8,8 мм рт. ст. соответственно), а на 7-й день после операции возвращалось к прежнему значению. Разница в остроте зрения между группами через 1, 3 и 6 мес. после операции была статистически незначима ( [9].
Роль витрэктомии
При сравнении результатов хирургического удаления ЭМФ и ВПМ с использованием витрэктомии и без нее было показано, что хирургическое вмешательство без витрэктомии позволяет сократить время проведения операции с 19-30 до 7-10 мин, при этом отсутствуют пролиферативные изменения, нередко приводящие к отслойке сетчатки [10]. При сравнении результатов проведения трехпортовой витрэктомии и щадящей двухпортовой хирургии без витрэктомии было показано, что при проведении вмешательства без витрэктомии уменьшается риск развития осложнений: катаракты, дефектов полей зрения [10]. Сходные результаты были получены в исследовании, проведенном в Тамбовском филиале МНТК «Микрохирургия глаза» (2013) [11]. Однако, по данным некоторых исследователей, при удалении ЭРФ без витрэктомии и окрашивания частота рецидивов заболевания в 3,5 раза превышает подобные показатели при проведении хромовитрэктомии [12].
Пилинг ВПМ
Витрэктомия с пилингом ВПМ применялась в хирургическом лечении ЭМФ в течение многих лет, однако частота рецидивов после проведения успешного хирургического вмешательства варьирует от 10% до 16,3% [13]. H. Liu et al. [14] провели метаанализ данных исследований эффективности витрэктомии с пилингом ВПМ или без него у пациентов с идиопатическим ЭМФ. В метаанализ были включены данные, полученные в 8 исследованиях, результаты которых были опубликованы с 2005 по 2015 г. Все исследования были ретроспективными. Всего были включены данные о 418 пациентах, из которых у 200 была проведена витрэктомия с пилингом ВПМ, а у 218 - витрэктомия без пилинга. Острота зрения через ≤6 мес. и в период от 6 до 12 мес. у пациентов, которым проводилась витрэктомия с пилингом ВПМ, была значимо выше, чем у пациентов, которым не проводили пилинг, однако через 18 мес. острота зрения была выше у пациентов, которым пилинг ВПМ не проводился. Негативное влияние пилинга может быть связано с нерегистрируемым повреждением сетчатки за счет воздействия на Мюллеровские клетки, отростками которых и образована ВПМ.
В другом исследовании было показано, что проведение пилинга ВПМ позволяет избежать развития кистозного макулярного отека у 90% пациентов, в то время как при удалении ЭМФ без пилинга ВПМ кистозный макулярный отек развивается у 56% пациентов [15]. Благоприятные исходы пилинга могут быть объяснены наличием структуры, образованной отростками клеток Мюллера, между слоем нервных волокон сетчатки (СНВС) и ВПМ [16].
Для сравнения исходов хирургического вмешательства после удаления ЭМФ одновременно с пилингом ВПМ или без него было проведено рандомизированное контролируемое исследование, в которое было включено 102 пациента. Разница в остроте зрения между группой, в которой проводили пилинг ВПМ, и группой, в которой его не проводили, была статистически незначимой (р=0,84). Таким образом, авторы исследования полагают, что пилинг ВПМ не улучшает остроту зрения при удалении ЭМФ [17].
Визуализация
Визуализация сетчатки в ходе хирургического вмешательства осложнена в ряде случаев наличием катаракты. В таких случаях возможно одновременное удаление катаракты и ЭМФ. Для оценки исходов комбинированного хирургического вмешательства с проведением факоэмульсификации и витрэктомии A. Pollack et al. [18] в 2004 г. было проведено ретроспективное исследование. В него были включены данные о 42 пациентах, которым было проведено комбинированное хирургическое вмешательство. Проведение факоэмульсификации облегчает визуализацию заднего отдела глаза и связано с небольшим количеством осложнений (задние синехии - 9,5%, помутнение задней капсулы - 7,1%, смещение ИОЛ - 4,8%).
Хромовитрэктомия
Для визуализации СТ и избирательного контрастирования его структур используются различные биологические и синтетические красители. Это привело к созданию нового подхода к хирургии СТ - хромовитрэктомии, при котором красители вводятся интраоперационно. Данный метод позволяет лучше визуализировать СТ и витреоретинальный интерфейс, что облегчает удаление ЭМФ и ВПМ и снижает риск повреждения сетчатки во время проведения операции [19]. Так, M. Veckeneer et al. в 2014 г. [20] проведено многоцентровое исследование, в котором оценивалась эффективность окрашивания ВПМ и ЭРМ двумя красителями: ILM-Blue (0,025% бриллиантовый синий G, 4% полиэтиленгликоль) и MembraneBlue-Dual (0,15% трипановый синий, 0,025% бриллиантовый синий G, 4% полиэтиленгликоль). В исследование было включено 127 пациентов. В ходе хирургического вмешательства яркое окрашивание облегчало идентификацию и удаление ВПМ и ЭМФ. Острота зрения после хирургического вмешательства улучшилась у 83% пациентов, которым визуализация проводилась с помощью ILM-Blue, и у 88% пациентов, которым визуализация проводилась с помощью MembraneBlue-Dual. Таким образом, визуализация ЭМФ с помощью красителей позволяет упростить хирургическое вмешательство с увеличением остроты зрения после операции.
Оптическая когерентная томография
Помимо визуализации ЭМФ с помощью красителей возможна также визуализация с помощью ОКТ. Предоперационное проведение ОКТ позволяет хирургу оценить архитектуру и толщину сетчатки и ее анатомическое положение относительно подлежащих структур и гиалоидной ткани [21]. Необходимость в проведении ОКТ перед хирургическим вмешательством оценивалась в исследовании, в которое был включен 121 пациент (123 глаза) с идиопатическим ЭМФ. Доказано, что ОКТ позволяет выявить отслойку эпимакулярной мембраны. В данном исследовании частичная отслойка мембраны была выявлена в 94% случаев и чаще отмечалась в нижнем сегменте. Кроме того, по мнению ряда авторов, после проведения ОКТ нет необходимости в использовании красителей для визуализации мембраны [22]. В настоящее время появилась возможность интраоперационного проведения ОКТ, что позволяет осуществлять эффективный контроль удаления даже неокрашенных мембран [10].
Завершение операции
Хирургические вмешательства по поводу ЭРМ, не сопровождающихся макулярным разрывом, в настоящее время проводятся без тампонады витреальной полости силиконовым маслом либо газо-воздушной смесью. При использовании 25G и 27G витрэктомии ушивание склеростом часто не требуется.
Осложнения хирургического вмешательства
Кровоизлияние в стекловидное тело и под сетчатку, перфорация сетчатки
Для оценки частоты развития данных осложнений в ходе хирургического вмешательства при ЭМФ был проведен метаанализ данных 9 исследований. По данным метаанализа, при витрэктомии частота развития кровоизлияний во время операции составила 0,9% (2015) [23]. При проведении 23G витрэктомии частота ятрогенного повреждения сетчатки, по данным ряда исследований, составляет от 11 до 45% [9, 24]. В проспективном наблюдательном исследовании была проведена оценка факторов риска ятрогенного повреждения сетчатки во время 23G витрэктомии. В исследование были включены данные о 137 пациентах, которым проводилась 23G витрэктомия. Частота перфорации сетчатки во время отделения задней гиалоидной мембраны составила 18,2% [25]. По данным Британской национальной базы данных, наиболее частым осложнением в ходе витреоретинальных хирургических вмешательств является перфорация сетчатки (3,2%). Общая частота развития интраоперационных осложнений при удалении ЭМФ составила 8,55% (2013) [6].
Снижение остроты зрения
Наиболее частое осложнение после хирургического вмешательства по поводу ЭМФ, возможно, связано с тангенциальной тракцией на сетчатку при удалении ЭРМ, а также повреждением нейроэпителия послеоперационным отеком. Так, для оценки факторов риска развития данного осложнения L. Scheerlinck et al. [26] провели систематический обзор данных 19 исследований, в которых оценивалась острота зрения после хирургического удаления ЭМФ. Наиболее важными факторами, влияющими на остроту зрения после операции, являются острота зрения до операции, а также выраженность метоморфопсий. Толщина сетчатки в области центральной ямки не оказывает влияния на остроту зрения после операции [26]. Также доказано, что чем больше острота зрения до операции, тем больше она будет после операции [27].
Прогрессирующая ядерная катаракта
Это частое осложнение хирургического вмешательства, которое развивается у 12,5-63% пациентов после витрэктомии с пилингом ВПМ [27]. Частота развития катаракты после хирургического вмешательства, по мнению ряда авторов, зависит от метода выполнения витрэктомии. Так, в исследовании, в котором сравнивались эффективность и безопасность 25G и 20G витрэктомии, было показано, что частота развития катаракты после проведения 20G витр-
эктомии составляла 20%, а после проведения 25G витр-
эктомии - 6% (р<0,05) [28]. Возможно, данное осложнение связано с более вероятным повреждением передней гиалоидной мембраны при 20G витрэктомии из-за относительно большего интраокулярного ирригационного потока.
Влияние на гидродинамику глаза
Согласно данным одного из исследований, повышение ВГД в послеоперационном периоде отмечалось у 22% пациентов, которым проводилась 20G витрэктомия, и у 2% пациентов, которым проводилась 25G витрэктомия [28].
В исследовании, проведенном K. Mitsui et al., частота развития гипотонии после проведения 27G и 25G витрэктомии составляла 30% и 35% соответственно [29]. В исследовании, в котором сравнивались эффективность и безопасность 20G, 23G и 25G витрэктомии, было продемонстрировано снижение ВГД в раннем послеоперационном периоде у пациентов, которым проводили 23G и 25G витрэктомию, но разница не была статистически значимой. В то же время у пациентов, которым проводили 20G витрэктомию, отмечалось значимое повышение ВГД в первый день после операции по сравнению с таковым до операции [25]. Вероятно, объем и скорость удаления стекловидного тела влияют на гидродинамику глаза в послеоперационном периоде. Следует также отметить, что при выполнении субтотальной витрэктомии существует риск повреждения хрусталика [31].
Отслойка сетчатки
Является достаточно редким осложнением витрэктомии. Так, в исследовании, проведенном во Франции, было показано, что частота отслойки сетчатки после 23G витрэктомии у пациентов с ЭМФ составляла 2,1% и развивалась в среднем через 3,9 мес. после операции. Данное грозное осложнение может быть связано с необнаруженными интраоперационно ятрогенными микроперфорациями на периферии сетчатки, вызванными витрэктомией в области основания СТ [32].
Изменение состояния зрительного нерва
Так, R. Tadayoni et al. описали состояние зрительного нерва после операции по поводу ЭМФ как «разъединение волокон зрительного нерва». Авторы полагают, что изменение зрительного нерва связано с его повреждением при пилинге ВПМ либо с отделением задней гиалоидной мембраны от ДЗН [33]. Позднее подобные изменения волокон зрительного нерва были продемонстрированы при помощи ОКТ [34]. В исследовании, проведенном R.F. Spaide, было показано, что при проведении витрэктомии с пилингом ВПМ у всех пациентов с помощью ОКТ визуализировались «впадины» на внутреннем слое сетчатки по ходу волокон зрительного нерва. Автор полагает, что данная аномалия связана не с повреждением зрительного нерва, а с процессом заживления после операции [35].
Изменения в поле зрения
Развитие дефектов полей зрения после хирургического вмешательства по поводу ЭМФ связано с повреждением СНВС [36, 37]. При удалении эпимакулярных мембран может отмечаться концентрическое сужение полей зрения [37]. В исследовании, проведенном A. Uemuraet al., с участием 16 пациентов, которым выполнялась витрэктомия по поводу ЭМФ, было показано, что дефекты полей зрения отмечались у 57% пациентов, которым проводили витрэктомию с использованием индоцианина зеленого, в то время как у пациентов, которым хромовитрэктомия не проводилась, дефектов полей зрения не было. Очевидно, что токсичность красителя, приводящая к повреждению СНВС, является причиной развития дефектов полей зрения [38]. Подобных эффектов при применении MembraneBlue-Dual, трипанового синего, триамценолона ацетонида не выявлялось.
Заключение
Единственным методом лечения ЭМФ на данный момент является хирургический. В настоящее время применяются различные типы хирургического вмешательства, а также различные способы визуализации СТ и эпимакулярной мембраны, каждый из которых имеет свои преимущества и недостатки. После хирургического вмешательства по поводу ЭМФ необходимо тщательное наблюдение в послеоперационном периоде для своевременного выявления и коррекции осложнений. Совершенствование техники вмешательства, а также использование современного оборудования и расходных материалов позволяют минимизировать негативные эффекты от лечения, достигая максимально возможного визуального результата.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
ГБУ "Уфимский НИИ глазных болезней" АН Республики Башкортостан
ГБУ "Уфимский НИИ глазных болезней" АН РБ
ГБУ «Уфимский НИИ глазных болезней АН РБ», ул. Пушкина, 90, Уфа, 450008, Республика Башкортостан, Российская Федерация
Журнал: Вестник офтальмологии. 2018;134(1): 63‑69
Витреоретинальное вмешательство (ВРВ) является патогенетически обоснованным методом лечения при пролиферативной диабетической ретинопатии (ПДР), так как удаление стекловидного тела (СТ) и иссечение или сегментирование фиброглиальной ткани (ФГТ) разрывает цепь патологических процессов в диабетическом глазу [1].
Наиболее частыми осложнениями, с которыми сталкиваются витреоретинальные хирурги, является интраоперационное кровотечение в ходе выделения и иссечения ФГТ, распространение площади отслойки сетчатки (ОС) во время устранения тракционного компонента [2].
В последние годы активно разрабатываются и применяются новые методы борьбы с интра- и послеоперационными геморрагическими осложнениями [3]. Появился целый ряд публикаций как зарубежных, так и отечественных авторов, в которых приводятся данные об антивазопролиферативной терапии до ВРВ, показавшей себя эффективной в плане запустевания новообразованных сосудов, профилактики интра- и послеоперационных геморрагических осложнений, а также возможности максимального иссечения ФГТ [4—6].
Использование заместителей СТ для тампонады витреальной полости необходимо для надежного анатомического прилегания оболочек глаза, поддержания нормального офтальмотонуса, в том числе и для профилактики геморрагических осложнений [7]. В хирургии поздних стадий ПДР предпочтительным является использование силиконового масла (СМ) в связи с высоким риском вышеуказанных осложнений и нестабильным течением фонового заболевания у пациентов [8].
Также к возможным послеоперационным осложнениям относятся гипотония или офтальмогипертензия, вторичная неоваскулярная глаукома, пролиферация передней гиалоидной мембраны, субатрофия глазного яблока [2], в ряде случаев наблюдаются «особенности» в виде эпиретинальной мембраны (ЭРМ) [9, 10].

На сегодняшний день проведено достаточное количество исследований, посвященных выявлению частоты возникновения ЭРМ на фоне силиконовой тампонады при различных витреоретинальных патологиях (ВРП), например при регматогенной отслойке сетчатки (РОС), пролиферативной витреоретинопатии (ПВР), а также при их сочетании (табл. 1). Таблица 1. Исследования, посвященные выявлению частоты формирования ЭРМ после витрэктомии в сочетании и без пилинга внутренней пограничной мембраны (ВПМ) на фоне силиконовой тампонады при различной ВРП
В настоящее время в литературе описаны единичные исследования, посвященные возникновению ЭРМ при ПДР после витрэктомии [20]. В связи с этим весьма актуальным является изучение эффективности пилинга ВПМ при данной патологии.
Цель работы — сравнительный анализ морфофункциональных параметров сетчатки при проведении витрэктомии в сочетании и без пилинга ВПМ у пациентов с ПДР.
Материал и методы
Обследовано 55 пациентов (55 глаз) с компенсированным/субкомпенсированным сахарным диабетом (СД) 2-го типа, с идентичными клиническими проявлениями ПДР, которые характеризовались наличием тракционного синдрома со стороны ФГТ в макулярной области (МО), в проекции диска зрительного нерва (ДЗН) и/или вдоль сосудистых аркад. Тракционный отек МО и локальная тракционная ОС (только в местах плотного контакта ФГТ с сетчаткой) были диагностированы во всех случаях. По данным оптической когерентной томографии (ОКТ) в настоящее исследование были включены больные без признаков ЭРМ в МО.
Длительность СД 2-го типа в среднем составила 15,1±6,3 года, целевое значение гликированного гемоглобина на момент исследования равнялось или было меньше 7,84±1,79. Средний возраст пациентов составлял 57,3±5,6 года, из них женщин было 37 (67,2%), мужчин — 18 (32,8%).
Всем пациентам за 10—14 дней до ВРВ интравитреально вводили антивазопролиферативный препарат Ранибизумаб, в дозе 0,5 мг (0,05 мл) однократно.
Пациенты были разделены на две группы. В 1-ю группу включено 27 больных (27 глаз), которым была проведена 25 Gauge витрэктомия с последующей диатермо- и эндолазеркоагуляцией без пилинга ВПМ; 2-ю группу составили 28 пациентов (28 глаз), которым выполнен аналогичный объем вмешательства в сочетании с пилингом ВПМ.
ВПМ окрашивали с использованием красителя Membrane Blue Dual («Dorc», Нидерланды). Пилинг ВПМ выполняли циркулярно в пределах двух диаметров ДЗН. Во всех случаях ВРВ завершали тампонадой витреальной полости СМ — 5700 cS, Oxane («Bausch+Lomb», США).
Все пациенты через 3 мес после комбинированного ВРВ были приглашены на хирургическое лечение по поводу удаления СМ.
Витрэктомию проводили с применением «бима-нуальной»техники на микрохирургической системе «Constellation Vision System» («Alcon», США).
До лечения и на контрольных осмотрах через 1, 3 и 6 мес выполняли стандартное офтальмологическое обследование, включая ОКТ центральной зоны сетчатки (RetinaScan-3000, «NIDEK», Япония). МО протяженностью 6000 мкм тестировали в режиме «macula multi», включая область фовеа (150—300 мкм от центра), область парафовеа (2000—2500 мкм от центра) и толщину зоны «слой нервных волокон (СНВ) — ВПМ». Использовали фоторегистрацию глазного дна в режиме «color» и определение оптической плотности макулярного пигмента (ОПМП) в режиме «MPOD» с помощью немидриатической фундус-камеры VISUCAM 500 («Carl Zeiss Meditec AG», США).
Срок наблюдения составил 6 мес.
Для статистической обработки полученных результатов применяли методы описательной статистики, однофакторного дисперсионного анализа и апостериорного критерия Дункана (Duncan’s test) для множественного сравнения. Различия считали достоверными при уровне значимости меньше 0,05. Результаты описательной статистики в таблицах представлены в виде M±σ, где M — среднее значение, σ — стандартное отклонение.
Результаты и обсуждение
При выделении и иссечении ФГТ вследствие разрушения крупных новообразованных сосудов в обеих группах наблюдались преимущественно незначительные и умеренные интраоперационные геморрагические проявления — в 63,0 (17 глаз) и 53,0% (15 глаз) случаев соответственно, которые купировались повышением давления ирригационного потока до 50—55 мм рт.ст., эндолазер- и/или диатермокоагуляцией источника кровотечения. Также наблюдались выраженные геморрагические проявления, нередко сочетающиеся с распространением площади тракционной ОС, которые встречались в 37,0% случаев (10 глаз) в 1-й группе, в 47,0% случаев (13 глаз) во 2-й. Для их купирования, кроме вышеперечисленных гемостатических процедур, было использовано перфторорганическое соединение (ПФОС).
Экспозиция ПФОС составляла 1—2 дня, после чего была выполнена его замена на С.М. Пилинг ВПМ осуществляли после удаления ПФОС, перед тампонадой витреальной полости С.М. Анатомическое прилегание сетчатки было достигнуто у всех пациентов. Рецидивов О.С. в послеоперационном периоде не зафиксировано на протяжении всего срока наблюдения.
У всех пациентов до витрэктомии максимально корригированная острота зрения (МКОЗ) в среднем составляла 0,06±0,02 и не изменилась на фоне антивазопролиферативной терапии. Через 1 мес после операции у пациентов обеих групп МКОЗ незначительно улучшилась в среднем до 0,1±0,02, через 3 мес данный показатель в 1-й группе оставался неизменным, во 2-й — повысился до 0,15±0,02 (р1—2<0,05).
Уровень внутриглазного давления (ВГД) до операции в обеих группах в среднем составлял 17,64±4,58 мм рт.ст. На фоне силиконовой тампонады значения ВГД не превышали 20—22 мм рт.ст. Стабильный офтальмотонус сохранялся в течение всего срока наблюдения.
В раннем (с 1-го дня) и отдаленном (до 3 мес) послеоперационном периоде геморрагические проявления не наблюдались в связи с силиконовой тампонадой.
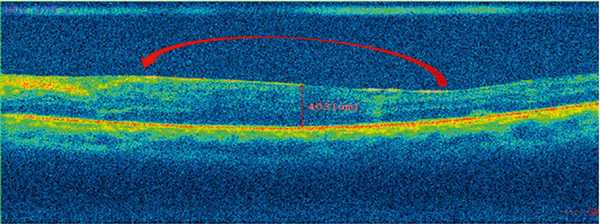
По данным ОКТ, средняя толщина зоны «СНВ — ВПМ» в МО до лечения у пациентов обеих групп составляла 25,38±3,11 мкм. В течение 3 мес на фоне силиконовой тампонады у пациентов 1-й группы толщина данной зоны увеличилась до 46,44±2,56 мкм (р
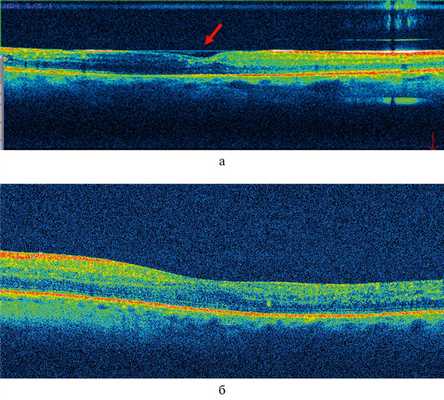
У пациентов 2-й группы была измерена только зона «СНВ» в связи с отсутствие ВПМ и в среднем составила 28,41±1,88 мкм (р1—2 <0,05). ЭРМ и тракционный отек МО не диагностировались ни в одном случае, однако у данных пациентов в период от 1 до 3 мес (до удаления СМ) на В-сканах ОКТ визуализировалась гиперрефлективная линия над МО (рис. 2, а). Рис. 2. В-скан ОКТ макулярной области пациента К. а — в течение 3 мес после витрэктомии в сочетании с пилингом внутренней пограничной мембраны на фоне силиконовой тампонады (красной стрелкой указано на гиперрефлективную линию над макулярной областью, без тракционного компонента); б — через 3 мес после витрэктомии в сочетании с пилингом внутренней пограничной мембраны, после удаления силиконового масла из витреальной полости. Ранее визуализируемая (рис. 2, а) гиперрефлективная линия над макулярной областью полностью отсутствует.
Средняя толщина сетчатки в области фовеа и парафовеа до витрэктомии у всех пациентов составляла 387,41±36 и 581,51±24 мкм соответственно. В течение 3 мес на фоне СМ у пациентов 1-й группы толщина МО в данных областях значительно увеличилась, составив в среднем 603,28±35 и 588,09±42 мкм соответственно (рр1—2<0,05).
Показатель ОПМП до ВРВ составлял в среднем 0,087±0,01 du, и в течение 3 мес прослеживалась тенденция к его увеличению до 0,114±0,01 du в 1-й группе (рр1—2<0,05).
Сходное и единственное на сегодняшний день исследование было проведено группой польских ученых (Z. Michalewska и соавт.) в 2013 г. [20]. Согласно его результатам, в группе пациентов с пилингом ВПМ в 20,7% случаев формировалась ЭРМ, тогда как у пациентов без выполнения пилинга она встречалась в 2,5 раза чаще (49,0%). Следует отметить, что в группе пациентов с удаленной ВПМ ЭРМ формировалась за пределами проведенного пилинга, при этом в пределах пилинга данные особенности не наблюдались в течение 18 мес. У больных, которым витрэктомию выполняли без пилинга ВПМ, ЭРМ формировалась на протяжении всей МО в сроки наблюдения до 54 мес. Ни в одном случае после ВРВ не отмечался диабетический макулярный отек (ДМО).
Результаты, полученные в ходе нашего исследования, противоречат данным польских офтальмологов, которые, на наш взгляд, имеют ряд несоответствий: остаются неизвестными диаметр проведенного пилинга ВПМ и метод проведения ОКТ для исследования МО за пределами пилинга (при условии, что диаметр пилинга ≥6,0 мм), особенности, связанные с удалением СМ, и метод пилинга комплекса «ЭРМ+ВПМ» после его удаления в соответствующей группе; настораживает отсутствие признаков ДМО в течение столь длительного послеоперационного периода наблюдения.
В связи с этим через 3 мес после витрэктомии пациенты обеих групп были госпитализированы на дополнительное ВРВ.
Всем пациентам 1-й группы было проведено удаление СМ с последующей воздушной тампонадой, однако только у 11 (40,7%) из 27 удалось провести пилинг ВПМ. Это было связано с выявлением противопоказаний для проведения пилинга ВПМ у 16 (59,3%) пациентов по данным ОКТ: у 5 (31,2%) из них был диагностирован отек МО в области фовеа/парафовеа более 600 мкм за счет выраженного тракционного компонента со стороны ЭРМ (рис. 3), Рис. 3. В-скан ОКТ макулярной области пациента С. через 3 мес после витрэктомии без пилинга внутренней пограничной мембраны на фоне силиконовой тампонады. Отек макулярной области (более 600 мкм) с тракционным компонентом со стороны эпиретинальной мембраны. у 11 (68,8%) — ретиношизис преимущественно внутренних слоев МО за счет тангенциальных тракций со стороны ЭРМ (рис. 4). Рис. 4. В-скан ОКТ макулярной области пациента Х. через 3 мес после витреоретинального вмешательства без пилинга внутренней пограничной мембраны на фоне силиконовой тампонады. Ретиношизис внутренних слоев макулярной области вследствие выраженного тракционного синдрома со стороны эпиретинальной мембраны.
Пилинг комплекса «ЭРМ+ВПМ» при данных состояниях грозил ятрогенным формированием макулярного отверстия, что оказало бы отрицательный эффект на морфофункциональные параметры центральной зоны сетчатки. Также в 1-й группе в течение оставшегося срока наблюдения (3 мес) у 3 пациентов произошли кровоизлияния в витреальную полость, которые были успешно купированы на фоне консервативной (рассасывающей) терапии.
Всем пациентам 2-й группы было проведено удаление СМ с последующей воздушной тампонадой. При контрольных осмотрах, по данным ОКТ, ранее визуализируемая гиперрефлективная линия полностью отсутствовала (см. рис. 2, б). После удаления СМ в этой группе в течение оставшегося срока наблюдения (3 мес) у 5 пациентов произошли кровоизлияния в витреальную полость в виде мазков гемы, которые успешно купировались на фоне консервативной терапии.
Повышение МКОЗ у пациентов 2-й группы объясняется удалением СМ, отсутствием ЭРМ и тракционного компонента в М.О. Несмотря на то что в данной группе удалось достичь близкую к нормальной толщину сетчатки в области фовеа и парафовеа, у 6 (21,4%) пациентов по данным ОКТ был диагностирован ДМО. Также отмечалось незначительное увеличение зоны «СНВ».
В обеих группах прослеживалась тенденция к повышению показателя ОПМП в сроки наблюдения до 6 мес.
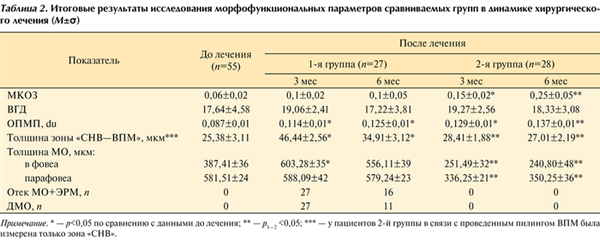
Итоговые результаты исследования морфофункциональных параметров сравниваемых групп представлены в табл. 2. Таблица 2. Итоговые результаты исследования морфофункциональных параметров сравниваемых групп в динамике хирургического лечения (M±σ) Примечание. * — p
Таким образом, мы пришли к мнению, что внутриглазная жидкость, попав под пузырь СМ, смещает его вверх из-за разницы в плотности, отграничивая от подлежащей сетчатки (в частности, от МО), тем самым формируя ретросиликоновое пространство. В случае пациентов 1-й группы именно это «пространство» сыграло ключевую роль в формировании ЭРМ, так как в основе ее патогенеза лежит механизм клеточной пролиферации, обусловленный миграцией ретинальных клеток (пигментного эпителия, глиальных клеток, клеток Мюллера, астроцитов, миофибробластов, моноцитов и макрофагов).
В данной ситуации ВПМ была субстратом (платформой) для миграции клеток на ее поверхность вследствие пролиферативного ответа на ВРВ. Тогда как граница СМ создавала препятствие для дальнейшей миграции клеток в витреальную полость. Также мы полагаем, что у пациентов 2-й группы мигрировавшие клетки задерживались в ретросиликоновом пространстве, однако в связи с отсутствием ВПМ не было платформы для их последующей пролиферации и формирования ЭРМ, что подтверждается ее отсутствием на сканах ОКТ после первичного и дополнительного ВРВ. Сложилось мнение, что они были удалены вместе с СМ или рассредоточились в витреальной полости после рассасывания воздушной среды.
Выводы
1. Проведение пилинга внутренней пограничной мембраны перед силиконовой тампонадой у пациентов с пролиферативной диабетической ретинопатией нивелирует риск формирования эпиретинальной мембраны в сроки наблюдения до 6 мес и способствует достижению лучших морфо-функциональных параметров по сравнению с показателями у больных без проведенного пилинга.
2. На фоне тампонады витреальной полости силиконовым маслом без пилинга внутренней пограничной мембраны в течение 3 мес формируется эпиретинальная мембрана с выраженным тракционным воздействием на макулярную область, устранение которой не всегда представляется возможным.
3. Если задняя гиалоидная мембрана служит морфологическим субстратом для новообразованных сосудов и образования фиброглиальной ткани, то, возможно, не удаленная в ходе витреоретинального вмешательства внутренняя пограничная мембрана служит платформой для формирования эпиретинальной мембраны вследствие миграции ретинальных клеток с их последующей пролиферацией.
Участие авторов:
Концепция и дизайн исследования: М.Б.
Сбор и обработка материала: М.К.
Написание текста: М.К.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Каланов Марат Римович — науч. сотр. отд-ния витреоретинальной и лазерной хирургии;
Читайте также:
