МРНК участвующие в синтезе антител. Методы изучения мРНК
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Введение
Рибонуклеиновая кислота (РНК) содержит генетическую информацию и используется организмом для кодирования конкретного интересующего белка. Результаты использования специфической разновидности РНК, а именно мРНК (матричная рибонуклеиновая кислота, или messenger RNA, - особый тип клеточных РНК, который содержит копию последовательности одного гена [1]) в качестве потенциальной технологии доставки генов in vivo были опубликованы в 1990 г., когда было показано, что прямая инъекция «свободной» мРНК приводила к экспрессии кодируемого белка in vivo [2]. Тем не менее ряд проблем препятствовал немедленному использованию in vitro транскрибированной мРНК в качестве простого средства для синтеза продукта in vivo, условно говоря, в виде простой инъекции. Эта проблема связана прежде всего с нестабильностью мРНК in vivo из-за почти повсеместного присутствия РНКаз. мРНК оказалась иммуногенной, стимулируя ответы с сопутствующим снижением трансляции мРНК. Прогрессом, который привел к быстрому наращиванию усилий по использованию мРНК в качестве платформы, было открытие K. Karikó и D. Weissman того факта, что использование модифицированных нуклеозидов приводит к снижению иммуностимулирующих эффектов транскрибируемой in vitro мРНК за счет уменьшения стимуляции Toll-подобных рецепторов [3]. Разработка средств доставки, в основном липосом/липонаносом, которые помогают стабилизировать мРНК и облегчают ее доставку в клетки и высвобождение из эндосом [4] (и, вероятно, действуют как адъюванты для кодируемого белка), также играет ключевую роль. Описание различных структурных вариантов липосом вы можете найти в ряде обзоров [5, 6].
Если кратко и предельно схематично описать механизм работы вакцин на основе мРНК [14], то следует обозначить несколько основных этапов: 1) создание молекулы мРНК, кодирующей S-гликопротеин SARS-CoV-2, и помещение ее в транспортную субстанцию (в нашем случае - липосому); 2) попадание липосомы в составе вакцины в организм человека; 3) слияние липосомы с клеткой, выход мРНК в цитоплазму, синтез рибосомами S-гликопротеина; 4) презентация антигенов - белковых компонентов S-гликопротеина или его отдельных структур на поверхности инфицированной клетки или специфических антиген-презентирующих клеток; 5) активация гуморального (синтез антител) и клеточного иммунитета (Т-клетки); 6) формирование иммунной памяти и ответ иммунной системы при последующей встрече с вирусом.
Молекула мРНК, в большей степени ее стабильность, т.е. время жизни, является краеугольным камнем эффективности вакцин, однако, как показывает практика, представления не только обывателей, но и научных работников и врачей идет по пути интуитивного упрощения, когда мРНК представляется стандартной структурной единицей, описание которой можно найти в любом учебнике по биологии или в сети Интернета, например в Википедии [15]. Структура молекулы мРНК, кодирующей S-гликопротеин SARS-CoV-2, представлена на рис. 1 и вполне очевидно визуально она не демонстрирует принципиальных различий с какой-либо другой мРНК. Однако не все так просто, и для стабилизации работы мРНК компаниям пришлось осуществить отбор среди ряда претендентов, внося ряд структурных изменений и оценивая их влияние на стабильность, иммуногенность и другие свойства продукта. В данной статье мы охарактеризуем структурные особенности мРНК в составе вакцины компании Pfizer/BioNTech (BNT162b2, или Tozinameran, или Comirnaty) [16, 17]. Это стало возможным благодаря тому, что в декабре 2020 г. на сайте Всемирной организации здравоохранения (ВОЗ) [18] была опубликована полная расшифровка генома мРНК в составе вакцины Pfizer/BioNTech, а затем на веб-сайте ученого и антрепренера Bert Hubert, основателя компании PowerDNS [19], была сделана попытка разобрать особенности структуры мРНК в составе вакцины указанной компании, и представляется практически полезным предпринять попытку воспроизвести наиболее интересные характеристики мРНК в составе вакцины Pfizer/BioNTech, что позволит нам четко понять, что процесс создания вакцин на основе мРНК - как минимум процесс создания инкорпорируемой молекулы рибонуклеиновой кислоты помимо других этапов синтеза и финализации продукта - отнюдь непростая задача.
Как молекулы РНК общаются с хроматином
Новость
Исследование контактов РНК с геномной ДНК позволило выявить не только новые функциональные группы прежде неизвестных РНК, но и разобраться в некоторых фундаментальных вопросах молекулярной биологии
Автор
Редактор
Несмотря на то, что лишь несколько процентов генов эукариот кодируют белки, транскрипция затрагивает почти все участки генома. В результате этого процесса образуется огромное количество всевозможных некодирующих РНК, причем функции большинства из них неизвестны. Тем не менее установлено, что некоторые некодирующие РНК участвуют в поддержании и регуляции пространственной организации генома. Исследователи из Института биологии гена Российской академии наук и с факультета биоинженерии и биоинформатики МГУ им. М.В. Ломоносова разработали новый метод, позволяющий изучать контакты молекул РНК с геномом, и с его помощью идентифицировали сотни видов РНК, ассоциированных с активным или неактивным хроматином. С помощью нового метода ученым даже удалось детально изучить кинетику образования мРНК и подтвердить гипотезу о котранскрипционном сплайсинге интронов.
В геномах эукариотических организмов закодировано огромное количество разнообразных некодирующих РНК. Хотя эти РНК, за рядом любопытных исключений , не служат матрицей для синтеза полипептидов, они задействованы во множестве важнейших биологических процессов, от регуляции активности ферментов до образования ядерных телец, однако функции большинства из них остаются неизученными.
О длинных некодирующих РНК, которые содержат транслируемые открытые рамки считывания, читайте в статье «Кодирующие некодирующие РНК» [1].
Многочисленные эксперименты показали, что некодирующие РНК участвуют в регуляции пространственной организации генома. Самой известной некодирующей РНК, напрямую влияющей на структуру хроматина, является РНК под названием XIST (от анг. X-inactive specific transcript) , которая обеспечивает гетерохроматинизацию одной из двух X-хромосом в клетках самок млекопитающих. Кроме того, особые энхансерные РНК способствуют сближению энхансера и соответствующего ему промотора, что играет важную роль в регуляции экспрессии генов. Любопытно, что архитектурный белок хроматина CTCF, который является важным регулятором пространственной организации генома у млекопитающих, взаимодействует с множеством некодирующих РНК. При этом стоит иметь в виду, что, поскольку в живой клетке геномная ДНК плотно покрыта белками, РНК, как правило, взаимодействуют с ДНК не напрямую, а опосредованно, через белки. Как же разобраться, с какими участками генома какие именно РНК взаимодействуют?
Red-C: новый метод для идентификации контактов РНК и геномной ДНК
Ученые из Института биологии гена РАН и с факультета биоинженерии и биоинформатики МГУ им. М.В. Ломоносова разработали новый метод, предназначенный для картирования контактов РНК с геномом [3]. Новый метод получил название Red-C от англ. RNA ends on DNA capture (дословно — «захват концов РНК на ДНК»). Сначала клетки, в которых исследуют контакты РНК с геномом, фиксируют формальдегидом, из-за чего формируются комплексы ДНК—белок—РНК, компоненты которых ковалентно сшиты друг с другом. Далее ДНК фрагментируют рестриктазой, а к молекулам РНК пришивают на 3′-концы особую нуклеотидную последовательность — адаптер (с одного конца одноцепочечный для сшивания с РНК, с другого — двухцепочечный), в состав которого входит биотинилированный нуклеотид (рис. 1). Затем проводят лигирование, и, если вблизи адаптера у конца молекулы РНК находится конец молекулы ДНК, то двухцепочечный конец адаптера и ДНК будут сшиты лигазой. Теперь нужно разрушить белок, который когда-то был посредником между контактирующими РНК и геномной ДНК, и выделить получившиеся химерные молекулы, включающие взаимодействующие РНК и ДНК, разделенные адаптером. ДНК далее дополнительно обрезают с помощью весьма хитрой рестриктазы MmeI, сайт узнавания которой специально включают в последовательность адаптера — с того конца, который соединяется с ДНК. В отличие от наиболее часто используемых рестриктаз, MmeI вносит разрыв не в ту же последовательность, которую распознает, а на расстоянии 20 нуклеотидов выше нее. Благодаря обработке MmeI получаются гибридные молекулы, на одном конце которых находится РНК, в середине — адаптер с биотинилированным нуклеотидом, а после него идет небольшой фрагмент геномной ДНК (около 20 нуклеотидов), который с этой РНК и взаимодействует в живой клетке. Поскольку в состав адаптера входит биотинилированный нуклеотид, такие химерные молекулы можно «вытянуть» из раствора за него, используя стрептавидин, обладающий высоким сродством к биотину. После дополнительной процедуры, включающей обратную транскрипцию (достраивание комплекса путем синтеза цепочки ДНК по матрице РНК), химеры амплифицируют и секвенируют, что позволяет определить последовательности РНК и ДНК, взаимодействующие в живой клетке.
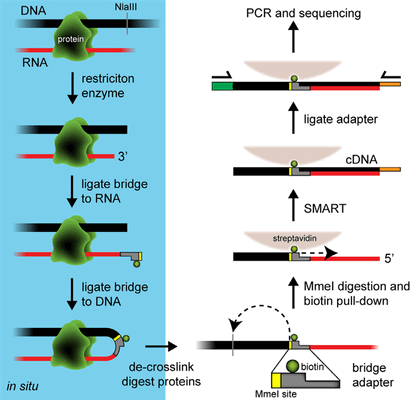
Рисунок 1. Схема протокола Red-C
Интерактом РНК и геномной ДНК
Используя Red-C, ученые изучили интерактом (совокупность всех взаимодействий) РНК и геномной ДНК в культуре клеток эритролейкемии человека (линия клеток K562). Оказалось, что наиболее интенсивно с геномной ДНК контактируют мРНК, а также длинные и очень длинные межгенные некодирующие РНК. Кроме того, с геномом взаимодействуют антисмысловые РНК, малые ядерные и ядрышковые РНК, микроРНК, пиРНК и некоторые другие виды некодирующих РНК . Существенную часть выявленных контактов не удалось отнести к какой-либо из ранее аннотированных РНК. Во многих случаях фрагменты таких неопознанных РНК в действительности принадлежали одному неизвестному транскрипту. Исследователи предложили называть «темную материю» неизвестных РНК, взаимодействующих с геномом, общим термином «X-РНК».
Об огромном разнообразии РНК рассказывает статья «Обо всех РНК на свете, больших и малых» [4]. — Ред.
Чтобы выяснить, насколько хорош метод Red-C для определения положения РНК в пространстве ядра, исследователи проанализировали, с какими областями генома наиболее активно взаимодействуют РНК того или иного вида. Выяснилось, что бóльшая часть мРНК локализуется неподалеку от гена, с которого они были считаны, то есть в месте своего синтеза. В самом деле, фиксация формальдегидом пришивает созревающий транскрипт к ДНК, на матрице которой он синтезируется. А вот некодирующая РНК MALAT1, которая локализуется в ядерных спеклах (ядерных тельцах, в которых проходит сплайсинг) и участвует в процессинге предшественников мРНК, располагается далеко от гена, с которого она была считана. Как и следовало ожидать, метод Red-C подтвердил, что РНК XIST покрывает всю X-хромосому, с которой она и считывается (разумеется, это делает не одна-единственная молекула РНК XIST, а множество ее молекул; у человека длина XIST составляет 17 т.п.о. [5]).
Но MALAT1 и XIST — редкие исключения среди некодирующих РНК, которые подробно изучены, в том числе и экспериментально, и их биология хорошо известна. А что насчет всего остального океана безымянных РНК, которым в плане изученности повезло меньше? Авторы работы провели систематический анализ предпочтений каждой РНК в плане взаимодействий с хромосомами, причем как на близком расстоянии, так и на большей дистанции. Для каждой РНК рассчитали плотность контактов с той хромосомой, с которой она транскрибируется, на определенных интервалах: сам ген, который кодирует РНК (интервал G), на расстоянии от 0 до 50 тысяч пар оснований (т.п.о.) от границ гена в обе стороны (интервал S), на расстоянии от 50 до 500 т.п.о. от границ гена (интервал M), на расстоянии от 500 тысяч до 5 миллионов п.о. от границ гена (интервал L) и на расстоянии свыше 5 миллионов п.о. от границ гена (интервал R) (рис. 2).
Рисунок 2. Интервалы, на которых рассчитывалась частота контактов для каждой РНК
Далее для каждого интервала рассчитывали относительную частоту попадания в него конкретного контакта путем деления общего числа контактов в интервале на количество контактов этой конкретной РНК с другими хромосомами. Оказалось, что почти все РНК наиболее часто взаимодействуют с тем геном, с которого они были считаны, однако количество контактов сильно различалось у разных видов РНК. Так, малые ядерные и ядрышковые РНК взаимодействуют со «своими» генами и прилежащими областями реже, чем РНК других видов. XIST тоже ведет себя нестандартно: вблизи своего гена плотность контактов у нее относительно невелика по сравнению с другими РНК, зато она активно взаимодействует с дальними участками X-хромосомы, с которой транскрибируется.
Информация о том, как часто РНК взаимодействует с разными участками генома, может многое рассказать о ее биологических функциях. Верно и обратное: биологические функции во многом определяют пространственную локализацию РНК. Например, РНК, участвующие в сплайсинге, активно контактируют со всеми хромосомами (оно и понятно: сплайсинг нужен генам на всех хромосомах), а уже не раз упомянутая XIST локализуется почти исключительно вблизи неактивной X-хромосомы, потому что она обеспечивает ее инактивацию. Для идентификации РНК, преимущественно взаимодействующих с определенными участками генома, ученые разработали алгоритм, распределяющий их на группы в зависимости от частот контактов РНК с геномом в разных интервалах: S+M и L, L и R, R и хромосомы, отличные от той, с которой была считана РНК (T на рисунке 1). С помощью этого алгоритма ученые идентифицировали 313 РНК, которые преимущественно взаимодействуют с участками генома вокруг «родного» гена, 30 XIST-подобных РНК, которые полностью «облепляют» хромосому, на которой они закодированы, 224 РНК, взаимодействующих буквально со всем геномом, а всего выявили 10 367 РНК, образующих 500 и более контактов с геномом.
Взаимодействие различных РНК с активным и неактивным хроматином
Еще один аспект исследования касался того, какие РНК предпочитают взаимодействовать с активным хроматином, а какие — с репрессированным. Для изучения этого вопроса исследователи воспользовались готовой аннотацией участков активного и неактивного хроматина в клетках K562. Авторы работы проанализировали, с какими участками генома наиболее активно взаимодействуют энхансерные РНК, то есть некодирующие РНК, которые считываются с участков генома, функционирующих как энхансеры. Оказалось, что РНК, считанные с сильных энхансеров, предпочтительнее взаимодействуют с сильными энхансерами на той же хромосоме, что, возможно, указывает на образование кластеров энхансеров в пространстве клеточного ядра. С активным хроматином наиболее интенсивно взаимодействуют сплайсосомные РНК, напрямую участвующие в реакциях сплайсинга, а очень длинные некодирующие РНК и X-РНК, напротив, тяготеют к репрессированному хроматину, расположенному на расстоянии до 10 миллионов пар оснований от границ генов, с которых эти РНК считываются. Авторы работы предположили, что очень длинные некодирующие РНК и X-РНК участвуют в сайленсинге (подавлении работы) соседних с ними генов.
Особенно интересна оказалась локализация микроРНК MIR3648 и MIR3687, которые вырезаются из транскрипта-предшественника рРНК. Эти микроРНК взаимодействуют с неактивным хроматином по всему геному и являются одними из самых многочисленных РНК репрессированного хроматина. Авторы исследования показали, что они ассоциированы с областями поздней репликации, практически не взаимодействуют с активно транскрибируемыми генами, а также весьма многочисленны в «генных пустынях» — областях генома, почти лишенных генов, — и бедной генами хромосоме 18. Похожую локализацию имеют и некоторые другие РНК, происходящие из длинного предшественника рРНК, хотя зрелые рРНК взаимодействуют и с активным, и с неактивным хроматином с одинаковой частотой. Возможно, это отчасти объясняет наличие гетерохроматинового «обрамления» вокруг ядрышка, ведь именно там накапливаются предшественники рРНК.
Red-C и модель сплайсинга
Исходя из данных, полученных с помощью Red-C, ученые оценили, как экзоны и интроны внутри мРНК взаимодействуют с хромосомой, с которой она была синтезирована, и с другими хромосомами. Оказалось, что мРНК не «сидит» на родном гене бóльшую часть времени, а активно взаимодействует с другими участками хромосомы на этапе ухода зрелого транскрипта от гена, с которого он был синтезирован, причем длинные мРНК более активно взаимодействуют со «своей» хромосомой, чем с другими — видимо, эти контакты устанавливаются во время долгой транскрипции. Любопытно, что мРНК более интенсивно взаимодействует с участками, локализованными ближе к концу, нежели началу гена. Вероятно, это связано с тем, что по ходу транскрипции РНК-полимераза «тащит» транскрипт за собой вдоль по ДНК.
Примечательно, что, хотя суммарное число контактов для интронов больше, чем для экзонов (вероятно, в силу того, что интроны, как правило, длиннее экзонов), на единицу длины экзоны устанавливают в два раза больше контактов, чем интроны. Первый экзон транскрипта обычно очень активно взаимодействует со всем «родным» геном, и после точки завершения транскрипции частота контактов резко падает. В случае первого интрона частота контактов снижается по мере приближения к концу гена, и резкого падения частоты контактов после терминатора транскрипции, как у первого экзона, не наблюдается. Вероятно, первый интрон удаляется еще во время транскрипции, а первый экзон «тащится» вслед за РНК-полимеразой вдоль всего гена до самого конца транскрипции. В то же время последний экзон и последний интрон демонстрируют сравнительно невысокие частоты контактов с участками собственного гена, что свидетельствуют о быстром высвобождении мРНК после завершения траснкрипции последних интрона и экзона.
Таким образом, полученные с помощью Red-C данные подтверждают представление о котранскрипционном сплайсинге интронов. Примечательно, что экзонные участки мРНК показывают повышенную частоту взаимодействия с участками ДНК, расположенными сразу за геном. Вероятно, РНК-полимераза II «волочит» новосинтезированную мРНК за собой уже после завершения транскрипции до того момента, пока в мРНК не будет внесен разрыв в сайт полиаденилирования.
В то же время популярная гипотеза образования петли из гена, когда промотор и терминатор пространственно сближаются, что могло бы облегчать повторную инициацию транскрипции, не нашла своего подтверждения в данных Red-C. Если бы промотор и терминатор гена действительно взаимодействовали друг с другом, а расположенная между ними часть гена сворачивалась в петлю, то первые интрон и экзон мРНК наиболее интенсивно взаимодействовали бы с концом гена, а последние интрон и экзон — наоборот, с началом гена. Однако ни одно, ни второе с помощью Red-C не подтвердилось.
Что дальше?
Уже первое применение Red-C на всего лишь одной линии клеток позволило не только выделить несколько интересных с функциональной точки зрения групп ранее неизвестных РНК, но и разобраться в таких фундаментальных вопросах молекулярной биологии, как сплайсинг и инициация транскрипции.
Первый автор статьи в Nucleic Acids Research Алексей Гаврилов комментирует результаты работы следующим образом:
В настоящее время мы ведем разработку нового метода, сочетающего технику Red-C с техникой иммунопреципитации хроматина. В основе метода лежит преципитация РНК-ДНК-белковых комплексов с использованием антител к интересующему белку. В первую очередь, мы проанализируем РНК-ДНК-взаимодействия, опосредованные белком CTCF. Мы надеемся, что полученные данные позволят идентифицировать спектры некодирующих РНК, принимающих участие в организации СTCF-зависимых петель хроматина, что поможет раскрыть механизмы формирования этих петель. Мы также предполагаем разработать метод, комбинирующий техники Red-C и DamID, и с его помощью идентифицировать РНК, контактирующие с участками ДНК, локализованными на периферии ядра. Эта работа может пролить свет на механизмы репрессии генов вблизи ядерной ламины.
Остается ожидать новых впечатляющих результатов, которые будут получены благодаря этим новым методам.
мРНКаааауу
Структура каждой матричной РНК уникальна, однако некоторые общие черты, такие как, например, поли(А)-хвост, у них всё-таки есть. Но и это не абсолютно: недавно обнаружилось, даже хвост у них может варьировать.
Редакторы
В классических учебниках молекулярной биологии структура мРНК эукариот охарактеризована весьма чётко — метилированный гуанин, связанный через трифосфатную группу с 5′-концом РНК (5′-кэп), 5′-нетранслируеамая область (НТО) с сайтом «посадки» рибосомы, кодирующая белóк последовательность, 3′-НТО и поли(А)-хвост. Наличие последнего считается критическим фактором — отщепление поли(А)-хвоста, или деаденилирование, вызывает деградацию мРНК. Однако последние работы показали, что поли(А) является не единственно возможной 3′-терминальной последовательностью — к этому «хвосту» может быть дополнительно присоединён поли(У)-«хвостик» различной длины.
Известно, что матричная РНК (мРНК) является главным посредником между ДНК и белок-синтезирующим аппаратом. У прокариотических организмов только что транскрибированная мРНК функционально активна и начинает транслироваться немедленно. У эукариот же после транскрипции пре-мРНК подвергается созреванию. Только правильно созревшая мРНК транспортируется из ядра в цитоплазму и служит матрицей для синтеза белка.
Поскольку количество вновь синтезированного белка прямо пропорционально количеству содержащейся в цитоплазме соответствующей мРНК, регуляция времени жизни последней является критическим фактором, регулирующим скорость синтеза белкá. Нарушения этой регуляции ведут к катастрофическим процессам, — в частности, потере контроля над основными процессами в клетке и трансформации клетки в раковую. Поэтому любая мРНК имеет схожую структуру — кодирующая область в центре и регуляторные фрагменты по краям (рис. 1).
Рисунок 1. Строение мРНК эукариот. Любая мРНК начинается с кэпа (от англ. cap — шапка, кепка) — метилированного остатка гуанина, который присоединён нестандартной связью (через три фосфатных группы). Наличие кэпа критично для функционирования мРНК в клетке. За ним следует 5′-нетранслируемая область (НТО), которая не кодирует белóк: её функция — «узнавание» рибосомы и регулирование трансляции. Сама кодирующая область начинается после «стартового» нуклеотидного триплета АUG и заканчивается стоп-кодоном (UGA или другими). За стоп-кодоном следует 3′-НТО, которая также важна для регуляции синтеза белка. Заканчивается вся молекула поли(А)-хвостом, который, как оказалось, всё-таки может состоять не только из аденозинов, но также включать остатки уридина (см. текст).
Основной механизм регуляции известен: на 3′-конце каждой мРНК находится регуляторная последовательность, состоящая практически полностью из одного нуклеотида — аденозина (А), из-за чего она и получила название поли(А)-хвост. Её длина регулируется рядом ферментов — она может и удлиняться, и обрезаться. Известно, что почти всегда длина поли(А)-хвоста определяет время жизни (точнее, полураспада) всей молекулы. Когда поли(А)-хвост укорачивается настолько, что не может более выполнять свои функции (связывать регуляторный комплекс белков), происходит отрезание кэпа ферментом Dcp1. Стандартная схема распада мРНК начинается с постепенного деаденилирования 3′-конца экзонуклеазой PARN. После этого мРНК уже не может участвовать в инициации транскрипции, и расщепляется экзонуклеазами.
Кстати, поли(А) несёт ещё и вторую, дополнительную функцию регуляции трансляции, неожиданно красивую по своей логичности. Если рибосома не встречает стоп-кодона (например, при мутации или сдвиге рамки считывания), то после трансляции некодирующей области рибосома доходит до поли(А)-хвоста, и последний транслируется в виде поли-лизинов на С-конце мутантного белка. Эта поли-лизиновая последовательность является нефизиологической, и резко нарушает трехмерную структуру белка. Дефектные белки быстро распознаются протеасомами и расщепляются. Вслед за этим распознаётся и деградирует сама мутантная мРНК [1].
В общем, наличие и функции поли(А)-хвоста неоспоримо важны. Но недавно оказалось, что не только поли(А) выполняет роль такого регулятора. Было открыто явление уридинилирования 3′-конца мРНК, т. е. модификация поли(А)-хвоста поли-уридином (поли(У)) [2]. Обнаружилось, что поли(А)-хвост может модифицироваться одним или многими остатками уридина, что, по-видимому, ведёт к инициации расщепления мРНК. Такой механизм уже обнаружен у ряда организмов (одноклеточных водорослей Chlamydomonas reinhardtii, дрожжей Schizosaccharomyces pombe, лягушки Xenopus laevis, цветкового растения Arabidopsis thaliana) и, вероятно, будет обнаружен и у многих других.
Такая распространённость заставляет взглянуть на поли-уридинилирование мРНК как на универсальный второй путь регуляции «жизни» мРНК в клетке. Сведений пока ещё очень мало, но уже открыта белковая машинерия, обеспечивающая «пришивку» уридина к мРНК, — это семейство терминальных уридиниловых терминаз (TUTases, PUPases) [3]. Ранее было известно, что они модифицируют некоторые малые ядерные РНК (например U6) и таким образом стабилизируют их структуру и время жизни. Однако в случае мРНК, модификация её «поверх» поли(А) уридином (достаточно всего нескольких нуклеотидов) вызывает узнавание мРНК специальным комплексом вызывающих деградацию ферментов — Lsm1-7, — которые запускают процесс деградации мРНК по стандартной схеме: деаденилирование, декэпирование и экзонуклеазное расщепление. И хотя наличие нескольких уридинов на 3′-конце может показаться не очень важной деталью, всё-таки это не так. Для этого сделаем короткий экскурс в методы современной молекулярной биологии.
Основной подход к исследованию мРНК базируется на методе обратной транскрипции (рис. 2), происходящем из открытия Д. Балтимором, Р. Дульбекко и Г. Теминым явления обратной транскрипции у вирусов (Нобелевская премия по физиологии и медицине, 1975). Ими был описан фермент обратная транскриптаза, который, используя молекулу РНК в качестве матрицы, строит вторую, комплементарную, цепь, но уже ДНК. Такая одноцепочечная комплементарная ДНК получила название кДНК (cDNA). Лабораторными методами эту кДНК можно «умножить» в миллионы раз и сохранить для последующего анализа. На методе обратной транскрипции базируются многие современные методы исследования для анализа клеточной системы транскрипции-трансляции.
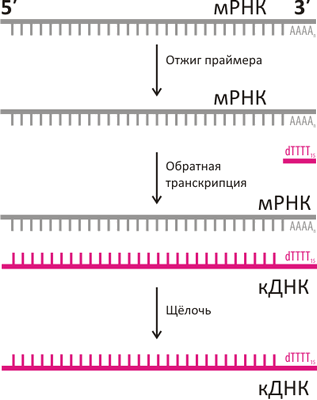
Рисунок 2. Схема обратной транскрипции
Однако тут есть один нюанс — чтобы обратная транскрипция началась, нужна короткая стартовая «затравка» (праймер), которая была бы комплементарна 3′-концу РНК (рис. 2). До сегодняшнего дня в качестве универсального праймера в основном использовался олигонуклеотид поли(Т), комплементарный поли(А)-хвосту. Теперь, когда оказалось, что поли(А)-хвост не столь уж инвариантен, возникает вопрос: является ли «универсальный» поли(Т)-праймер настолько уж универсальным? В свете описанного открытия, возможно, он может не связываться и не выявлять целые пулы мРНК с уридинами на 3′-конце, которые оказываются фактически «невидимыми» для традиционных алгоритмов в молекулярной биологии. А если учесть, что метод обратной транскрипции на основе поли(Т) и последующая ПЦР-диагностика являются сейчас основными инструментами для определения экспрессии генов, открытие альтернативных 3′-концов может вызвать необходимость пересмотреть истинность целых массивов данных, которые сегодня считаются исходной базой для молекулярных исследований.
Что необходимо знать о мРНК-вакцинах: 5 позиций
В результате беспрецедентной скорости в разработке новых вакцин, миру были представлены первые клинически одобренные мРНК-вакцины для борьбы с пандемией Covid-19 - одна из них произведена Pfizer и BioNTech, другая - компанией Moderna. Испытания показали эффективность этих вакцин на уровне не менее чем 94%.
1. Технология мРНК вакцин не так молода, как кажется
Классический механизм работы вакцин (например, против полиомиелита и гриппа) заключается в презентации иммунной системе инактивированных частиц вируса. Другие вакцины (например, против гепатита B) используют отдельно взятый белок, являющийся частью инфекционного агента, чтобы вызвать схожий иммунный ответ.
мРНК-вакцины работают по другому принципу, "обманывая" иммунную систему таким образом, что РНК (в основном матричная мРНК) кодирует белок, который продуцируется в клетке путем трансляции и представляется иммунной системе; он действует как антиген. Иммунная система учится избирательно бороться с клетками, экспрессирующими такие антигены, такими как клетки-хозяева, инфицированные вирусами, или опухолевые клетки.
Хотя вакцины от Pfizer/BioNTech и Moderna - первые препараты, одобренные в клинической практике, сама технология мРНК-вакцин существует относительно давно. Первые испытания в онкологии с использованием схожих технологий берут свое начало еще в 2011 году.
2. мРНК-вакцины не изменяют ДНК
Существуют абсолютно необоснованные опасения, что мРНК-вакцины способны изменять ДНК. На самом же деле мРНК не входит в ядро клетки, а после своего введения биодеградирует в течение нескольких дней. Именно поэтому для формирования полноценного иммунного ответа необходимо 2 инъекции препарата.
3. мРНК-вакцины имеют высокую специфичность
Вирус SARS-CoV-2 имеет достаточно сложную структуру и его различные части стимулируют иммунную систему на образование нейтрализующих антител, которые не всегда способны эффективно элиминировать инфекцию. мРНК-вакцины стимулируют иммунный ответ к спайк-белку вируса, являющегося только частью вирусной мембраны.
4. Разработчики и эксперты не "срезали углы" во время клинических испытаний
Испытания вакцин начались с доклинической фазы, проводимой на животных, а затем постепенно переходили на 1-ую, 2-ую и 3-ю фазы. Например, 3-я фаза вакцины от Pfizer/BioNTech включает более 40 000 человек, исследования эффективности и безопасности будут продлжаться следующие 2 года.
Основные проблемы, связанные с использованием вакцины, обычно возникают в первые 2 месяца. Тем не менее, не исключены редкие побочные эффекты на больших выборках в миллионы людей, поэтому за вакцинированными необходимо пристальное наблюдение, особенно с учетом инновационной природы технологии.
5. Вакцина запускает воспалительные реакции
Частично вакцина работает путем индуцирования локальных иммунных реакций, поэтому воспалительные признаки в месте инъекции и небольшой дискомфорт в первые дни - вполне нормальное явление.
МРНК участвующие в синтезе антител. Методы изучения мРНК
Ма́тричная рибонуклеи́новая кислота́ (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков [1] . мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов. Самые длинные мРНК отмечены у (+)оц РНК-содержащих вирусов, например пикорнавирусов, однако следует помнить, что у этих вирусов мРНК образует весь их геном.
ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то мРНК — временная рабочая копия чертежа, выдаваемая в сборочный цех. Следует отметить, что ДНК не содержит чертежи взрослого организма, а больше похожа на «рецепт» по его изготовлению.
Гипотеза о значении РНК в синтезе белков была высказана Торбьёрном Касперссоном (Torbjörn Caspersson) на основе исследований 1937—1939 гг., в результате которых было показано, что клетки, активно синтезирующие белок, содержат большое количество РНК. Подтверждение гипотезы было получено Юбером Шантренне (Hubert Chantrenne).
Содержание
«Жизненный цикл»
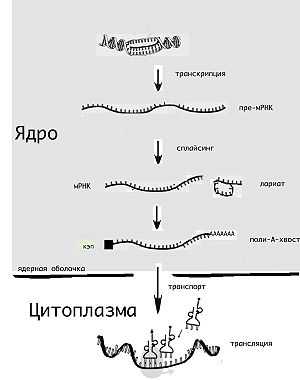
Жизненный цикл молекулы мРНК начинается её «считыванием» с матрицы ДНК (транскрипция) и завершается её деградацией до отдельных нуклеотидов. Молекула мРНК в течение своей жизни может быть также «отредактирована» перед синтезом белка (трансляцией). Эукариотические молекулы мРНК часто требуют сложной обработки и транспортировки из ядра — места синтеза мРНК, на рибосомы, где происходит трансляция, в то время как прокариотические молекулы мРНК этого не требуют и синтез РНК у них сопряжён с синтезом белка. [2] .
Транскрипция
Транскрипцией называют процесс копирования генетической информации с ДНК на РНК, в частности на мРНК. Транскрипция осуществляется ферментом РНК-полимеразой, строящей, согласно принципу комплементарности, копию участка ДНК на основании одной из цепей двойной спирали. Этот процесс как у эукариот, так и у прокариот организован одинаково. Основное различие между про- и эукариотами состоит в том, что у эукариот РНК-полимераза во время транскрипции ассоциируется с мРНК-обрабатывающими ферментами, поэтому у них обработка мРНК и транскрипция могут проходить одновременно. Короткоживущие необработанные или частично обработанные продукты транскрипции называются пре-мРНК; после полной обработки — зрелая мРНК.
Обработка эукариотической пре-мРНК
В то время как мРНК прокариот (бактерий и архей), за редкими исключениями, сразу готовы к трансляции и не требуют специальной обработки, эукариотические пре-мРНК требуют более интенсивной обработки. В процессе сплайсинга из пре-мРНК удаляются не кодирующие белок последовательности (интроны), на 5' конец молекулы добавляется специальный модифицированный нуклеотид (кэп), на 3' конец добавляются несколько аденинов, так называемый полиадениновый хвост. Кэп узнаётся факторами инициации, белками, отвечающими за присоединение к мРНК рибосомы, полиадениновый хвост связывается с со специальным белком. Обычно эти посттранскрипционные изменения мРНК эукариот обозначают термином «процессинг мРНК». Полиаденилирование необходимо для транспорта большинства мРНК в цитоплазму и защищает молекулы мРНК от быстрой деградации (увеличивает время их полужизни). Лишенные поли-А участка молекулы мРНК (например, вирусные) быстро разрушаются в цитоплазме клеток эукариот рибонуклеазами.
Сплайсинг
Схема сплайсинга, в процессе которого пре-мРНК созревает в зрелую РНК. Зелёный — нетранслируемые участки (UnTranslated Regions, UTR), синий — интроны, красный — транслируемые (кодирующие белок) участки.
Сплайсинг — это процесс, в котором из пре-мРНК удаляются участки некодирующей белок последовательности, называемые интронами; последовательности, которые остаются, включают в себя кодирующие белки нуклеотиды, и называются экзонами. Иногда продукты сплайсинга пре-мРНК могут быть соединены разными способами, позволяя одному гену кодировать несколько белков. Этот процесс называется альтернативным сплайсингом. Сплайсинг обычно производится РНК-белковым комплексом, который называется сплайсосома, но некоторые молекулы мРНК также могут катализировать сплайсинг без участия белков(см. рибозимы) [3] .
Транспорт
Другое различие между эукариотами и прокариотами — транспорт мРНК. Из-за того, что эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны быть выведены из ядра в цитоплазму [4] . Зрелые мРНК распознаются по наличию модификаций и покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам.
Трансляция
Поскольку прокариотическая мРНК не нуждается в обработке и транспортировке, трансляция рибосомой может начаться немедленно после транскрипции. Следовательно, можно сказать, что трансляция у прокариот совмещена с транскрипцией и происходит ко-транскрипционно.
Эукариотическая мРНК должна быть обработана и доставлена из ядра в цитоплазму, и только тогда может быть транслирована рибосомой. Трансляция может происходить как на рибосомах, находящихся в цитоплазме в свободном виде, так и на рибосомах, ассоциированных со стенками эндоплазматического ретикулума. Таким образом, у эукариот трансляция не совмещена напрямую с транскрипцией.
Регуляция трансляции
Так как у прокариот транскрипция совмещена с трансляцией, прокариотическая клетка может быстро реагировать на изменения в окружающей среде путём синтеза новых белков, то есть регуляция происходит, в основном, на уровне транскрипции. У эукариот из-за необходимости в редактировании и транспорте мРНК ответ на внешние стимулы занимает больше времени. Поэтому их синтез белка интенсивно регулируется на посттранскрипционном уровне. Не всякая зрелая мРНК транслируется, поскольку в клетке существуют механизмы регуляции экспрессии белков на пост-транскрипционном уровне, например, РНК-интерференция.
Некоторые мРНК в действительности содержат два тандемных терминаторных кодона (стоп-кодона) - часто это кодоны различного типа на конце кодирующей последовательности [5] .
Разрушение
По прошествии некоторого времени, определяемого её нуклеотидной последовательностью, в частности, длиной полиаденинового участка на 3' конце молекулы, мРНК разрушается на составляющие её нуклеотиды с участием РНКаз. Как правило, разрушение начинается с удаления кэпа на 5' конце, полиаденинового хвоста на 3' конце и затем нуклеазы одновременно разрушают мРНК в 5' ->3' и 3' ->5' направлении. мРНК, в которой сигнал завершения синтеза белка, стоп-кодон, в результате ошибки транскрипции находится в середине кодирующей последовательности, подвержена особой быстрой форме деградации, НМД (nonsense-mediated decay).
Строение зрелой мРНК
Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5' кэп», 5' нетранслируемая область, кодирующая (транслируемая) область, 3' нетранслируемая область и 3' полиадениновый «хвост».
5' Кэп
5' кэп (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5' (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5'-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [6] . Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5'- и/или 3'-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию [7] .
3' полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3' «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме [8] .
Читайте также:
