Оценка влияния опухоли на организм. Морфология патоморфоза опухолевых болезней.
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Цель исследования - определить факторы-предикторы достижения полного лекарственного патоморфоза (pCR) при неоадъювантной химиотерапии первично-операбельного рака молочной железы (РМЖ). Материалы и методы. Проанализирована частота достижения pCR при различных клинических факторах и биологических характеристиках карцином у 164 пациенток (24-76 лет; медиана возраста - 47 лет), получивших лечение в ФГБУ «РОНЦ им Н.Н.Блохина» в период с 2004 по 2016 г. Результаты. Факторами-предикторами достижения pCR при первично-операбельном РМЖ являлись гормононегативный статус опухоли, наличие гиперэкспрессии (или амплификации) HER2, высокий уровень Ki-67 и G3 степень дифференцировки опухоли (p ×
Об авторах
О А Павликова
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
И В Колядина
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России; ФГБУ «Российский онкологический научный центр им. Н.Н.Блохина» Минздрава России
Д В Комов
д-р мед. наук, проф., зав. хирургическим отд-нием диагностики опухолей ФГБУ «РОНЦ им. Н.Н.Блохина» 115478, Россия, Москва, Каширское ш., д. 23
Я В Вишневская
канд. мед. наук, вед. науч. сотр. отд-ния патологической анатомии ФГБУ «РОНЦ им. Н.Н.Блохина» 115478, Россия, Москва, Каширское ш., д. 23
И В Поддубная
акад. РАН, д-р мед. наук, проф., зав. каф. онкологии ФГБОУ ДПО РМАНПО, ФГБУ «РОНЦ им. Н.Н.Блохина» 125993, Россия, Москва, ул. Баррикадная, д. 2/1; 115478, Россия, Москва, Каширское ш., д. 23
Список литературы
© ООО "Консилиум Медикум", 2017
Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial 4.0 International License.
Важнейшие клинико-морфологические проявления опухолей
Далеко не всегда, особенно на ранних стадиях развития, опухоль проявляет себя клинически. По мере роста опухоли появляется определенная симптоматика, которую можно разделить на несколько групп.
1. Местное воздействие первичного опухолевого узла:
А. Сдавление опухолью окружающих тканей, сосудов и соседних органов с нарушением их функции, например, нарушение оттока секрета желез, нарушения крово- и лимфообращения.
Б. При экзофитном типе роста опухоли в полом органе — стеноз (сужение) и обструкция (закрытие) просвета с нарушением продвижения содержимого;
В. При инвазивном типе роста — деструктивные изменения тканей,
которые могут привести к развитию кровотечения (врастание в стенку и аррозия сосудов), перфорации полого органа, формирование свищевых ходов и т.д.
2. Нарушение гемостаза:
А. Повышение свертываемости крови (из-за неустойчивого кровотока и повреждения эндотелиальной выстилки). Характерный синдром — илеофеморальный тромбоз.
Б. Риск развития тромбоэмболий.
В. Развитие хронического ДВС-синдрома (особенно в терминальной стадии развития онкологического заболевания) с тенденцией к спонтанным кровоизлияниям вследствие истощения компонентов коагуляции.
3. Метастазирование.
4. Системные неметастатические воздействия (обменные, эндокринные и иммунные нарушения):
А. Железодефицитная анемия.
Б. Анорексия (отсутствие аппетита и частично связанная с этим потеря массы тела) и раковая кахексия.
Раковая кахексияпредставляет собой снижение массы тела, возникающее при значительном уменьшении жировых депо и ферментном расщеплении мышечных белков. При кахексии отмечается резкое истощение больных. Их кожа становится сухой и дряблой. Жировые депо практически отсутствуют. Мышцы уменьшены в объеме, дряблые, атрофичные, буроватого цвета (бурая атрофия скелетных мышц). Внутренние органы, в частности сердце, заметно уменьшены в размере и массе. Уменьшение сердца сопровождается извитостью коронарных артерий, сохраняющих естественную длину. В кардиомиоцитах накапливается липофусцин (бурая атрофия миокарда). Бурая атрофия также характерна для печени. Отмечаются расстройства пигментного обмена: кроме накопления липофусцина в скелетных мышцах, кардиомиоцитах, гепатоцитах, слабо выраженный меланоз кожи, приобретающей сероватый оттенок, ярко оранжевая окраска остатков жировой ткани жировых депо (из-за конденсации липохромов).
Г. Паранеопластические синдромы
Паранеопластический синдром(греч. «para» — около + неоплазма) — общее название синдромов, обусловленных опосредованным (гуморальным и др.) влиянием опухоли на обменно-эндокринные процессы, механизмы иммунитета и функциональную активность других регуляторных систем организма.
К паранеопластическим синдромам относят:
— гиперкальциемию из-за остеолиза, вызванного метастатическим, реже первичным поражением костей, например при миеломе, и выработкой какой-либо некостной опухолью гуморальных субстанций, приводящих к поступлению кальция в кровь (например, паратгормона при раке легкого).
— эндокринопатии. Встречается синдром Иценко-Кушинга(при опухолях передней доли гипофиза, раке легкого, толстой кишки, эндометрия),гиперкальциемия и остеопорозпри опухолях паращитовидных желез, раке легкого. Гиперпродукция гастрина при некоторых опухолях поджелудочной железы (гастриномах) приводит к развитиюсиндрома Золлингера-Эллисона (гипертрофия и множественные эрозии и язвы слизистой оболочки желудка и двенадцатиперстной кишки с развитием желудочно-кишечных кровотечений).
— иммунопатологические процессы с иммунокомплексными, антительными и цитотоксическими механизмами развития, приводящие к развитию васкулитов, нейропатий, миопатий и дерматопатий (дерматомиозит).
Иногда к паранеопластическим синдромам относят анемию, гиперкоагуляцию, кахексию, лихорадку. Если их учитывать, то паранеопластические синдромы встречаются более, чем у половины больных со злокачественными опухолями.
Паранеопластические синдромы часто бывают первыми клиническими симптомами опухоли и поэтому имеют важное диагностическое значение.
Вторичные изменения в опухоляхпредставлены очагами некроза и кровоизлияний, воспалением, ослизнением, склерозом, отложением солей кальция (петрификация), разрастанием костных структур (оссификация), формированием кист.
Иногда эти изменения происходят в связи с применением лучевой терапии и химиотерапии и являются признаком терапевтического патоморфоза, поэтому при направлении биоптата или удаленной опухоли в патологоанатомическое отделение обязательно указывают проводимое лечение.
Доброкачественные и злокачественные опухоли
Опухоль - патологический очаг роста видоизмененной ткани в различных органах и структурах организма. Опухоли бывают доброкачественными и злокачественными. Они отличаются скоростью и характером роста, клеточным строением и влиянием на организм.
Акции
Полное обследование на онкологические заболевания для мужчин и женщин.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
Опухоль (tumor, новообразование) - патологический очаг роста видоизмененной ткани в различных органах и структурах организма. Причины возникновения новообразований - бесконтрольное деление, рост и дифференцировка клеток. Опухоли бывают доброкачественными и злокачественными.
Доброкачественное новообразование - скопление клеток, характеризующееся медленным неинвазивным ростом, наличием капсулы, отсутствием или минимальным общим влиянием на организм. Клеточный состав доброкачественной опухоли качественно и функционально максимально схож с клетками здоровой ткани, из которой она развилась.
Злокачественные опухоли (cancer, рак) характеризуются быстрым инвазивным ростом, значительным отрицательным влиянием на организм. Клетки злокачественных новообразований активно делятся, по строению и функциям они отличаются от нормальных клеток, вплоть до невозможности определения - из какой ткани возник первичный очаг.
Виды доброкачественных и злокачественных опухолей
Доброкачественные новообразования появляются из клеток различных тканей, классифицируются и именуются по этому признаку. В их названии сочетаются латинское наименование ткани, из которой она возникла, и суффикс -ома, обозначающий опухоль.
Классификация доброкачественных опухолей
- . Состоит из клеток и волокон соединительной ткани. Часто встречается подкожная фиброма, новообразования этого типа в грудных железах, матке, яичниках. Если в состав опухоли входят и другие ткани, это отражается в названии: фиброаденома, фибромиома, фибролипома. . Доброкачественное образование, аналогичное по структуре жировой ткани. Его характерная особенность - наличие капсулы. Липомы нередко бывают болезненными, могут достигать значительных размеров. Чаще локализуются на поверхности кожи, но встречаются и на внутренних органах. Ангиолипомой называют липому, внутри которой прорастают кровеносные сосуды.
- Эпителиома. Развивается из плоскоклеточного эпителия кожи или слизистых оболочек. К доброкачественным эпителиомам относится базальноклеточная опухоль (базалиома).
- Хондрома. Одиночная или множественная доброкачественная опухоль бугорчатой структуры, развивающаяся из хрящевой ткани. Характеризуется очень медленным ростом, зачастую не проявляется никакими симптомами.
- Остеохондрома. Крупное неподвижное образование, развивающееся на костях вблизи крупных суставов.
- Остеома. Новообразование из костной ткани, возникшее в результате дефекта закладки скелета при эмбриогенезе. Может быть единичной или множественной, очень редко озлокачествляется.
- Миома. Капсулированное образование плотной консистенции, развивающееся из мышечной ткани. Часто наблюдается в матке. Может быть единичной, множественной, мелкой или крупного размера. Рабдомиома - новообразование из поперечнополосатой мышечной ткани, лейомиома - из гладкой. . Представляет собой красное или синее родимое пятно с расширенными капиллярами. Часто располагается на кожных покровах, значительно реже - на внутренних органах.
- Ангиома. Доброкачественная врожденная сосудистая опухоль. Образуется из венозных, артериальных или капиллярных сосудов. Часто локализуется на слизистых оболочках ротовой полости, губах, щеках. Множественные ангиомы могут разрастаться до больших размеров и причиняют эстетический дискомфорт. В случае развития новообразования в головном мозге существует опасность тромбоза, кровоизлияния. Частое травмирование или УФ-облучение увеличивают риск озлокачествления ангиомы.
- Лимфангиома. Болезненная припухлость, состоящая из расширенных лимфатических сосудов. Возникает в период внутриутробного развития, останавливается в росте и регрессирует после рождения.
- Ганглиома. Доброкачественная опухоль из нервной ткани. Нередко располагается в головном мозге и вызывает опасные для жизни симптомы. Характеризуется высоким риском озлокачествления.
- Невринома. Опухолевые образования в виде узелков на спинных, периферических, иногда - черепных нервах. Вызывают неврологическую симптоматику.
- Неврома. Доброкачественная опухоль, локализующаяся на различных структурах нервной системы. Для нее характерен болевой синдром.
- Менингиома. Образование, которое развивается в оболочках головного мозга. При значительной величине и быстром росте может сопровождаться различными признаками - слепотой, глухотой, изменением сознания.
- Нейрофиброма. Доброкачественное образование из оболочек нервов. Имеет характерный вид «кофейных пятен» на коже практически в любой области тела. Опухоли округлые, мягкой консистенции, безболезненные, в редких случаях могут вырастать до огромных размеров.
- Папиллома. Развивается из эпидермальных клеток. Папилломы на слизистых оболочках называются кондиломами. . Гормонозависимая и гормонопродуцирующая опухоль из железистой ткани. Нередко развивается в простате. Встречается и в других железах - молочных, щитовидной, сальных, слюнных, гипофизе.
- Киста. Полостное образование округлой формы без четких границ, заполненное жидкостью. Бывает врожденной и приобретенной, развивается в брюшной полости, головном мозге, костях, на внутренних и наружных половых органах.
- Невус (родинка). Доброкачественное образование, присутствующее практически у каждого человека. При частом травмировании и УФ-облучении существует риск их озлокачествления.
- Тератома. Врожденное новообразование, развивающееся на стадии эмбриогенеза. Локализуется в яичниках у женщин, в яичках у мужчин, в крестцово-копчиковой области у детей, а также в мозге. Включает различные ткани, ногти, волосы, фрагменты кишечника и других органов. Склонна к малигнизации.
Классификация злокачественных новообразований
Злокачественные опухоли делятся на две группы: эпителиального происхождения - рак (карцинома, cancer) и соединительнотканного - саркома.
При высокодифференцированных новообразованиях, когда возможно определить вид ткани, из которой развился рак, название уточняют: плоскоклеточный ороговевающий, фолликулярный, папиллярный cancer, аденокарцинома. При низкодифференцированных опухолях применяется конкретизация по опухолевой форме клеток: мелкоклеточный, перстневидноклеточный рак
Такой же подход используется при классификации сарком. Если злокачественная опухоль высокодифференцированная, ее название повторяет название ткани, из которой она развилась: мио-, фибро-, липосаркома и т. д.
Признаки доброкачественной и злокачественной опухолей
Развитию доброкачественных и злокачественных новообразований сопутствуют разные симптомы.
Симптоматика доброкачественных опухолей
Доброкачественное образование чаще растет медленно. Первым его проявлением, если опухоль располагается на видимых местах кожи и слизистых оболочек, обычно бывает небольшая припухлость (шишка), зачастую подвижная, не спаянная с кожей, безболезненная. Кожный покров на ее поверхности обычного цвета и структуры, не воспален.
Такие опухоли крайне редко оказывают общее отрицательное влияние на организм только в случае, если достигают значительных размеров, сдавливают лежащие рядом органы, сосуды или нервы. Если новообразование располагается в головном или спинном мозге, оно может быть опасным, так как вызывает сбой важных функций - зрения, слуха, обоняния, дыхания, или неврологическую симптоматику - нарушение двигательных функций, осязания, расстройство функций тазовых органов.
В основном доброкачественные опухоли доставляют пациентам психологический и физический дискомфорт из-за нахождения на видных местах тела, сдавливания одеждой, натирания, периодического травмирования.
Признаки злокачественных опухолей
Злокачественные новообразования растут быстро, при нахождении на коже или слизистых оболочках они зачастую выглядят как бугристые изъязвленные наросты, язвы с неровными краями и поверхностью, кровоточащим дном. В основном они плотные, мало- или неподвижные, спаяны с кожей. Для раковых опухолей характерна болезненность. Может наблюдаться увеличение регионарных лимфоузлов (расположенных рядом с первичным очагом).
Злокачественные опухоли оказывают негативное влияние на организм. Оно обусловлено как опухолевой интоксикацией, так и быстрым инвазивным ростом образования, прорастанием сосудов и нервов. Пациенты отмечают следующие симптомы:
- слабость, вялость, быстрая утомляемость;
- незначительное повышение температуры тела;
- потеря аппетита, извращение вкуса, тошнота, рвота;
- снижение массы тела;
- болевой синдром;
- кахексия - истощение.
Симптоматика будет зависеть и от того, в каком месте расположено злокачественное новообразование. Для опухолей пищевода характерны затруднение глотания, поперхивание, пищеводные кровотечения. При образованиях в дыхательных путях и легких отмечаются затруднение дыхания, кашель, одышка. Новообразования ЖКТ вызывают диспепсические расстройства, желудочные и кишечные кровотечения.
Отличия доброкачественных и злокачественных опухолей
Доброкачественные и злокачественные новообразования отличаются по ряду признаков - скорости и характеру роста, клеточному строению, влиянию на организм. Для удобства восприятия сравнительную характеристику доброкачественных и злокачественных опухолей можно представить в виде таблицы.
| Характеристика | Доброкачественная опухоль | Злокачественная опухоль |
| Скорость роста | медленная | быстрая |
| Характер роста | экспансивный - опухоль растет в капсуле, раздвигая окружающие ткани | инвазивный - новообразование прорастает окружающие ткани, расположенные рядом сосуды и нервы |
| Поверхность | чаще ровная, гладкая | бугристая |
| Граница | четкие | нет четких границ |
| Консистенция | мягко- или плотноэластичная | чаще твердые, неравномерной консистенции |
| Спаянность с кожей | не связаны с кожей | определяется спаянность с кожным покровом |
| Подвижность | сохранена | чаще отсутствует |
| Нарушение целостности кожи | не нарушает целостность кожи | возможны изъязвления |
| Дегенеративные изменения в ткани опухоли | отсутствуют или минимальные | возможны кровоизлияния в ткань опухоли, некрозы |
| Кровоснабжение новообразования | нормально сформированные кровеносные сосуды | атипичное кровоснабжение по типу капиллярного |
| Состояние регионарных лимфоузлов | не изменены | поражены |
| Общее влияние на организм | редко, при образованиях значительных размеров, сдавливающих расположенные рядом органы, сосуды,нервы, либо при образованиях в головном и спинном мозге | ухудшение общего состояния, опухолевая интоксикация |
| Кахексия (истощение) | нет | присутствует, в большинстве случаев на поздних стадиях |
| Степень дифференциации клеток | высокая, клетки внешне и функционально схожи со здоровыми | низкая, клетки значительно отличаются по строению и функции от нормальных |
| Энергообмен | в норме | ускорен |
| Метастазирование | не метастазируют | метастазы в регионарные лимфоузлы, отдаленные метастазы гемато- и лимфогенным путем |
| Вероятность рецидива | отсутствует, за исключением опухолей с основанием (т. н. «ножкой») | существует |
| Стабилизация процесса | возможна | нет |
| Прогноз | благоприятный | при своевременной диагностике и лечении - выздоровление (длительная ремиссия), при выявлении на поздних стадиях - ухудшение качества и уменьшение продолжительности жизни вплоть до летального исхода |
Диагностика доброкачественных и злокачественных опухолей
Самостоятельно отличить доброкачественное новообразование от злокачественного затруднительно, поэтому при любых признаках опухолевого процесса следует как можно быстрее обратиться к врачу. Ранняя диагностика и вовремя начатое лечение существенно повышают шансы на успех терапии. Поводом для обращения к доктору должны стать не только непосредственно обнаруженная на теле опухоль, но и другие симптомы, не имеющие явного объяснения: постоянная слабость, быстрая утомляемость, потеря веса, тошнота, болевой синдром, одышка, осиплость голоса, маточные кровотечения и др.
Первый этап диагностики, помимо осмотра и сбора анамнеза, включает общие исследования. К ним относятся:
- общий анализ крови, мочи;
- биохимический анализ крови;
- рентген или ФЛГ органов грудной клетки; , КТ или МРТ пораженной области.
Дополнительно, в зависимости от места локализации образования, могут быть назначены маммография, ФГДС, анализ кала на скрытую кровь, колоноскопия, ректороманоскопия, анализ крови на гормоны и другие исследования.
Основной способ дифференциальной диагностики доброкачественных и злокачественных опухолей - гистологическое исследование. Ему может подвергаться кусочек ткани, взятый при диагностической биопсии, жидкое содержимое кисты, непосредственно удаленное новообразование. Помимо гистологического анализа, применяются другие методы - цитологический, иммуногистохимический.
При некоторых доброкачественных или злокачественных опухолях шансы на излечение существенно повышает самодиагностика. Так, женщинам рекомендуется ежемесячно проводить самообследование груди, всем людям без исключения следует периодически осматривать имеющиеся или вновь появляющиеся родинки. Именно в этих зонах легко самостоятельно заметить даже малейшие изменения.
Может ли доброкачественная опухоль стать злокачественной?
Процесс перерождения доброкачественной опухоли в злокачественную называется малигнизацией. Ему подвержены не все доброкачественные новообразования. Некоторые не озлокачествляются никогда, какие-то из доброкачественных опухолей имеют более высокий риск малигнизации, другие - менее. Так, миомы, липомы, фибромы меньше подвержены озлокачествлению. Чаще перерождаются в рак аденомы, полипы в желудке, кишечнике.
Провоцирующие факторы для малигнизации разные, они зависят в том числе от вида доброкачественных образований, их расположения. В целом их можно разделить на внешние факторы - УФ-излучение, радиоволны, химические вещества, токсины, вирусы, механические повреждения, и внутренние - генетическая предрасположенность, гормональный, иммунный сбой.
Основные этапы превращения доброкачественной опухоли в злокачественную:
- дисплазия - трансформация здоровых клеток в атипичные;
- возникновение специальной микросреды, способствующей быстрому размножению клеток;
- активное деление измененных клеток, увеличение их количества;
- формирование стволовой линии - основы злокачественной опухоли, клеточный состав которой может изменяться;
- рак in situ - развитие злокачественного образования без внедрения в окружающие ткани;
- инвазия и появление метастазов.
Основной способ профилактики перерождения доброкачественных опухолей в злокачественные - это их ранняя диагностика, наблюдение и, при необходимости, удаление. Важно минимизировать воздействие внешних канцерогенных факторов, придерживаться здорового образа жизни, правильного питания, отказаться от вредных привычек.
Михайлов Алексей Геннадьевич оперирующий онколог, врач высшей квалификационной категории, к.м.н. стаж: 21 год
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Морфологическая диагностика опухолей: сдвиг в сторону молекулярно-генетического анализа
Александр Иванцов, кандидат медицинских наук,
Максим Клещёв, кандидат медицинских наук,
Екатерина Кулигина, кандидат биологических наук,
НМИЦ онкологии им. Н. Н. Петрова МЗ РФ (Санкт-Петербург)
«Природа» №6, 2018
Диагностика онкологических заболеваний начинается с морфологического анализа фрагмента пораженного органа, который зафиксирован в формалине, обезвожен в спиртах восходящей плотности и заключен в парафин. Данная процедура позволяет выполнить срез толщиной 3 мкм и поместить его на стекло, затем окрасить ядра клеток и другие базофильные структуры ярко-синим щелочным красителем гематоксилином, а цитоплазму — розовым кислым красителем эозином. Окрашивание позволяет четко визуализировать основные элементы клетки. Затем сопоставляют микроскопический «пейзаж» исследуемого образца с эталонным, на котором зафиксирована характерная для конкретной анатомической области гистологическая структура. О присутствии инвазивного неопластического процесса свидетельствуют утрата типичной гистоархитектоники и клеточных молекулярных структур, наличие полиморфных неорганизованных клеток (рис. 1).
Рис. 1. Рак толстой кишки: утрата типичной гистологической структуры в ходе неопластического процесса
Помимо установления самого факта злокачественной трансформации для назначения индивидуализированной терапевтической схемы важно как можно раньше определить гистологический тип опухоли и оценить стандартные маркеры агрессивности (степень дифференцировки, митотическая активность и т. д.). В пределах одного органа патологический процесс может развиваться по совершенно разным сценариям, вовлекать разнообразные клетки и структуры. Например, среди злокачественных новообразований легкого насчитывают, по современным представлениям, более шести гистологических типов, для каждого из которых необходимы свои терапевтические подходы (рис. 2) [1]. Мелкоклеточный рак легкого отличается стремительным течением, ранним метастазированием и очень плохим прогнозом. Карциноидные опухоли, происходящие из клеток диффузной нейроэндокринной системы, имеют наилучший прогноз; это единственный тип карцином легкого, который, как ныне считается, никак не связан с курением. Саркома легких — агрессивная опухоль, развившаяся из клеток соединительнотканных структур легкого. Аденокарциномы состоят преимущественно из железистых клеток и имеют периферическую локализацию. Опухоли этого типа зачастую развиваются у некурящих людей. Они могут нести активирующие мутации в генах EGFR, ALK и ROS1, которые являются терапевтической мишенью для действия таргетных препаратов — ингибиторов тирозинкиназ.
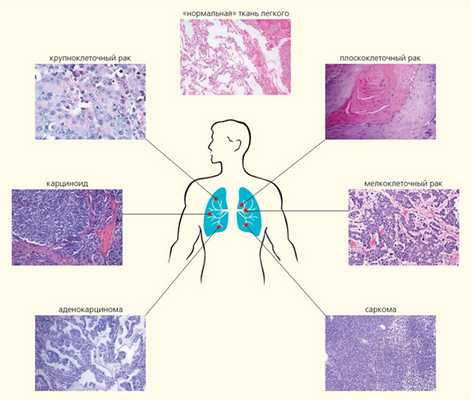
Рис. 2. Гистологические типы рака легкого: мелкоклеточный рак (14%); плоскоклеточный (эпидермоидный) рак (20%); аденокарцинома (38%); крупноклеточный рак (3%); карциноид (5%); мезенхимальные, в том числе саркомы и лимфомы (5%); опухоли смешанных типов — плоскоклеточный и аденокарцинома, аденокарцинома и мелкоклеточный и т.д. (15%)
Чтобы безошибочно установить гистологический тип опухоли в затруднительных ситуациях, вызванных, к примеру, маленьким размером образца или утратой опухолевыми клетками способности к образованию специфических структур (низкая степень дифференцировки), или выявить некоторые специфические характеристики новообразования, морфологи используют иммуногистохимическое окрашивание (ИГХ). Этот метод сформировался еще в середине 1980-х годов [2] и сразу стал одним из наиболее востребованных в клинической онкологии (рис. 3). Появление такого диагностического теста, например, существенно изменило роль патоморфологического исследования в лечении рака молочной железы: именно от результатов ИГХ-анализа на рецепторы к эстрогенам (ER) и прогестерону (PgR), которые синтезируется опухолевыми клетками при этом заболевании, зависит назначение эндокринной терапии. В настоящее время антагонисты эстрогенов, замедляющих деление клеток рака молочной железы, принимают примерно 70% пациенток [3]. С помощью ИГХ можно также обнаружить увеличение синтеза онкобелка HER2/neu (от англ. human epidermal growth factor receptor — рецептор эпидермального фактора роста, или трансмембранная рецепторная тирозинкиназа). Опухоли, вырабатывающие HER2/neu, оказались чувствительными к терапевтическим ингибиторам этой тирозинкиназы, и назначение соответствующих лекарственных препаратов (например, трастузумаба) основано на результатах тестов, в числе которых и ИГХ-анализ [4].
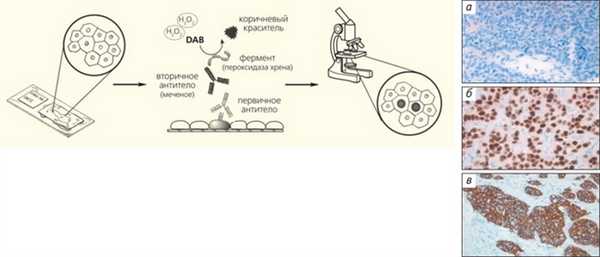
Рис. 3. Схема иммуногистохимического (ИГХ) метода и примеры его применения. Первичные антитела связываются с искомым антигеном (гормоном или его рецептором) и становятся видны в световой микроскоп благодаря соединению с вторичными антителами, мечеными ферментом, при этом пероксидазная активность выявляется с помощью 3,3-диаминобензидина (DAB). Справа приведены примеры оценки рецепторного статуса карцином молочной железы: ИГХ-реакция с антителами к рецепторам эстрогенов (а — негативная реакция, б — ядерное окрашивание, 100% клеток) и с антителами к HER2/neu (в — мембранное окрашивание, оценка 3+)
Диагностику опухолей сегодня невозможно представить без сочетания традиционного морфологического и молекулярно-генетического анализа. Первые мутации, ассоциированные с ответом опухолей на терапию, были обнаружены в прошлом десятилетии. Уже сейчас онкологические клиники применяют десятки молекулярных тестов, предназначенных для персонализации лечения. Еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречается у пациентов с аденокарциномой легкого. Таким образом, актуальной задачей стала дифференциальная диагностика между аденокарциномой и другими гистологическими разновидностями. Маркером первичных аденокарцином является ядерный белок TTF-1 [5]. Если ядра раковых клеток демонстрируют положительное окрашивание (рис. 4), то патоморфолог ставит диагноз «аденокарцинома», и в этом случае пациенту целесообразно подвергнуться молекулярному тестированию на предмет наличия в опухоли мутаций EGFR.
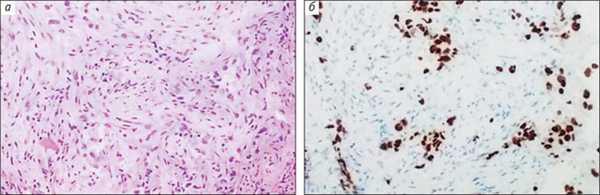
Рис. 4. Низкодифференцированная аденокарцинома легкого (а, среди фиброзной ткани отдельно расположенные опухолевые клетки) и положительная ИГХ-реакция с антителом к TTF-1 в ядрах опухолевых клеток (б)
В клиническом исследовании изучали эффективность EGFR-ингибитора (гефитиниба) на самом первом этапе лечения пациентов с мутацией EGFR [6]. Чтобы включить в исследование 25 больных, нам потребовалось проанализировать образцы тканей более 500 пациентов с раком легкого, что связано с низкой частотой этой мутации, которая в общей выборке больных не превышает 6-7%. Результаты исследования поражают воображение: эффект от препарата наблюдался у всех без исключения пациентов, в то время как аналогичный показатель при назначении стандартной терапии обычно не составляет 20-30% (рис. 5).
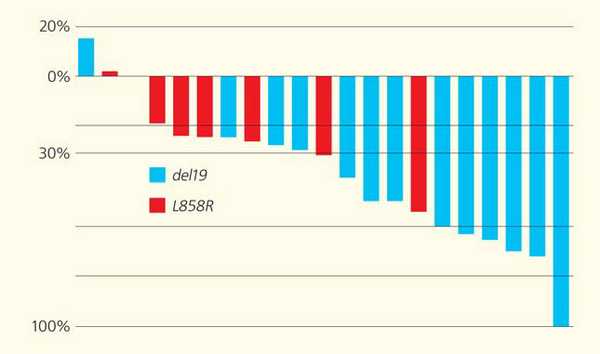
Рис. 5. Снижение размеров опухолевых очагов (%) в ответ на применение EGFR-ингибитора (гефитиниба) у пациентов с активирующими мутациями в гене EGFR: делецией 19-го экзона (19del) и заменой в 21-м экзоне (L858R) [6]
В настоящее время патоморфология переживает фундаментальные изменения. В стройную систему знаний, накопленных десятилетиями в рамках классической цитологии, гистологии и патологической анатомии, интегрируются новейшие представления о молекулярной патологии раковых клеток. Все это дает основания говорить о появлении новой дисциплины — молекулярной патологии [7]. Многие современные алгоритмы принятия врачебных решений уже ориентируются не столько на гистологические разновидности рака, сколько на молекулярные характеристики клеток. Однако роль патолога по-прежнему остается ведущей, поскольку именно он интегрирует все полученные сведения (микроскопические и молекулярные) в общий «портрет» опухоли.
Важность молекулярной морфологии в онкологии будет возрастать в ближайшем будущем, поскольку молекулярная диагностика больше не представляет собой однократное исследование, выполняемое только на этапе постановки диагноза. Многие современные технологии лечения рака предусматривают мониторинг характеристик опухолевых клонов на протяжении всех этапов онкологической медицинской помощи. В этом десятилетии большую популярность приобрели методы «жидкой биопсии», основанные на идентификации фрагментов опухолевых клеток в периферической крови. Другой важный аспект развития морфологии — ее интеграция с различными методами компьютерного анализа, искусственного интеллекта. На наших глазах морфология опухолей превращается из относительно консервативного раздела онкологии в одну из самых динамично развивающихся дисциплин современной медицины.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 16-04-00921).
Литература
1. Wistuba I., Brambilla E., Noguchi M. Chapter 17: Classic Anatomic Pathology and Lung Cancer // IASLC Thoracic Oncology. Pass H. I., Ball D., Scagliotti G. V. (eds) Aurora, Colorado, 2014; 217-240.
2. Taylor C. R., Burns J. The demonstration of plasma cells and other immunoglobulin-containing cells in formalin-fixed, paraffin-embedded tissues using peroxidase-labelled antibody // J. Clin. Pathol. 1974; 27(1): 14-20.
3. Pertschuk L. P., Tobin E. H., Gaetjens E. et al. Histochemical assay of estrogen and progesterone receptors in breast cancer: correlation with biochemical assays and patients’ response to endocrine therapies // Cancer. 1980; 46(12 Suppl): 2896-2901.
4. Pegram M. D., Lipton A., Hayes D. F. et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment // J. Clin. Oncol. 1998; 16: 2659-2671.
5. Stenhouse G., Fyfe N., King G. et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma // J. Clin. Pathol. 2004; 57(4): 383-387. DOI: 10.1136/jcp.2003.007138.
6. Moiseyenko V. M., Procenko S. A., Levchenko E. V. et al. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma // Onkologie. 2010; 33(5): 231-238. DOI: 10.1159/000302729.
7. Birner P., Prager G., Streubel B. Molecular pathology of cancer: how to communicate with disease // ESMO Open. 2016; 1(5): e000085. DOI: 10.1136/esmoopen-2016-000085.
Морфологическая диагностика, как фактор повышения эффективности лечения рака
Эффективность лечения рака зависит не только от развития методов терапии - без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее - определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой - исследование образцов опухолевых клеток.
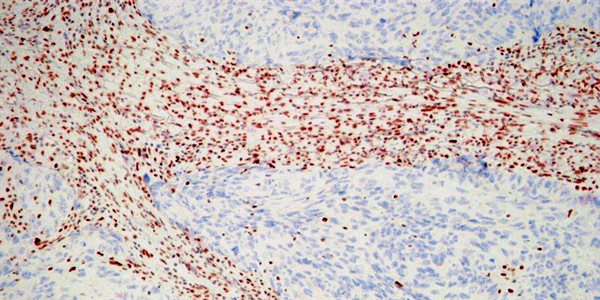
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей - велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог - ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире - неверны. Половина этих ошибок не становятся фатальными - различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория - это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия - в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли - т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению - иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
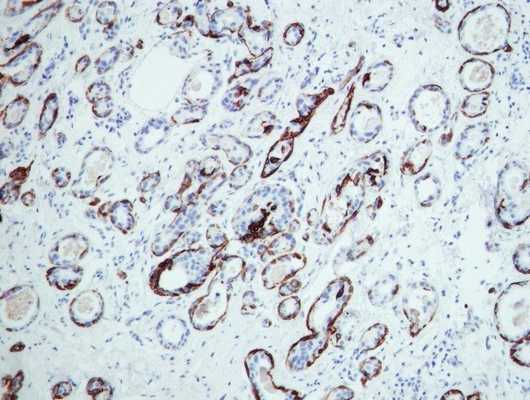
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы - дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также - для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
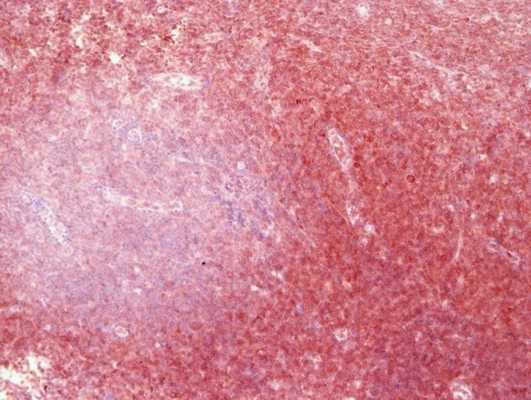
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
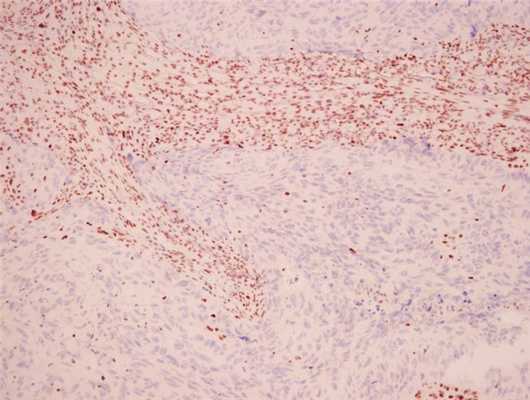
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- ; ;
- рак кишечника;
- рак легкого;
- лимфомы; ;
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Читайте также:
