Патология формирования костей. Бальная шкала для расчета риска хромосомных аномалий
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Неинвазивное исследование, которое на основании определенных лабораторных маркеров и клинических данных позволяет при помощи компьютерной программы рассчитать вероятный риск развития хромосомных болезней или других врождённых аномалий плода.
Из-за ограничений в применении расчетных методов определения риска врождённых аномалий плода расчет таких рисков при многоплодной беременности с 3 и более плодами провести невозможно.
- Бета-субъединица хорионического гонадотропина человека (бета-ХГЧ)
Синонимы русские
Тройной тест второго триместра беременности.
Синонимы английские
Maternal Screen, Second Trimester; Prenatal Screening II; PRISCA II (Prenatal Risk Calculation).
Метод исследования
Твердофазный хемилюминесцентный иммуноферментный анализ ("сэндвич"-метод), иммунохемилюминесцентный анализ, конкурентный твердофазный хемилюминесцентный иммуноферментный анализ.
Единицы измерения
ММЕ/мл (милли- международная единица на миллилитр), МЕ/л (международная единица на литр), нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу за 24 часа до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Пренатальный скрининг трисомий II триместра беременности выполняется для оценки вероятности наиболее распространенных аномалий плода - трисомии 21 (синдрома Дауна), трисомии 18 (синдрома Эдвардса) и дефекта нервной трубки на сроке между 14 и 22 неделями беременности. К факторам риска развития таких аномалий относятся роды в возрасте старше 35 лет, многоплодная беременность, наличие в акушерском анамнезе плодов с хромосомными аномалиями (трисомии 21, 13 или 18), сопутствующая ВИЧ-инфекция, беременность, наступившая в результате ЭКО, курение и сахарный диабет. При этом возраст матери является наиболее значимым фактором. Так, риск развития хромосомных аномалий плода резко возрастает после 35 лет (1:179 по сравнению с 1:476 у женщины 25 лет).
Определение АФП совместно с хорионическим гонадотропином и эстриолом (так называемый тройной тест) на 15-20 неделях беременности используют для скрининга дефектов развития плода и хромосомных аномалий. Данный скрининговый анализ позволяет оценить вероятность наличия генетических заболеваний и пороков развития, однако его результат не является абсолютным показателем патологии или нормального развития плода.
Хорионический гонадотропин человека (ХГЧ) вырабатывается в плодной оболочке человеческого эмбриона. Он является важным показателем развития беременности и ее отклонений. Максимума уровень ХГЧ достигает на 10-11-ю неделю, а затем постепенно снижается. По этому показателю можно судить о благополучном течении беременности и выявлять нарушения развития плода.
Альфа-фетопротеин вырабатывается в эмбриональном желточном мешке, печени и эпителии кишечника плода, его уровень зависит от состояния желудочно-кишечного тракта, почек плода и плацентарного барьера. Он принимает активное участие в полноценном развитии плода. В крови матери его концентрация постепенно увеличивается с 10-й недели беременности и достигает максимума на 30-32 неделях. В связи с этим АФП используется как неспецифический маркер состояния плода и наличия акушерской патологии.
Эстриол свободный является главным эстрогеном беременности и имеет большое значение для нормального развития и функционирования фетоплацентарного комплекса. Его концентрация повышается с момента формирования плаценты и прогрессивно растет с течением беременности. Низкая концентрация свободного эстриола в сочетании с высокими показателями бета-ХГЧ и альфа-ФП связана с повышенным риском задержки внутриутробного развития плода и осложнений третьего триместра беременности (преждевременной отслойки плаценты и преэклампсии).
Очень важно точно знать гестационный возраст плода, так как уровни АФП, ХГЧ и свободного эстриола в крови отличаются на разных неделях беременности.
При данном скрининговом исследовании риск патологий рассчитывается с помощью компьютерной программы PRISCA (Prenatal Risk Calculation), разработанной компанией Typolog Software (Германия) и имеющей международный сертификат соответствия. Для исследования определяется содержание хорионического гонадотропина (ХГЧ), альфа-фетопротеина (АФП) и неконъюгированного (свободного) эстриола в крови беременной.
Обязательно учитываются клинические данные (возраст беременной, масса тела, количество плодов, наличие и особенности ЭКО, раса, вредные привычки, наличие сахарного диабета, принимаемые лекарственные препараты). Если выполнено УЗИ, срок беременности определяется по его результатам, а не по дате последней менструации.
После исследования и расчета риска патологий беременной назначается консультация у врача - акушера-гинеколога.
Результаты скрининга не могут служить критериями постановки диагноза и поводом для искусственного прерывания беременности. На их основании принимается решение о том, целесообразно ли применять инвазивные методы обследования плода. При высоком риске необходимы дополнительные обследования, в том числе кордоцентез, амниоцентез с генетическим исследованием полученного материала.
Пренатальный скрининг трисомий 1 триместра беременности, PRISCA - 1 (биохимический скрининг 1 триместра - «двойной тест» 1 триместра, расчет рисков с использованием программы PRISCA)
Краткое описание исследования «Пренатальный скрининг трисомий 1 триместра беременности, PRISCA-1)»
Тест выполняется для скринингового обследования беременных с целью оценки риска хромосомных аномалий плода: трисомии 21 (синдром Дауна) и трисомий 18, 13 (синдром Эдвардса, синдром Патау). Количественная оценка результатов исследований производится с использованием программного обеспечения PRISCA.
Биохимический скрининг I триместра беременности, «двойной тест» первого триместра состоит из следующих исследований:
- свободная β-субъединица хорионического гонадотропина человека (свободный β-ХГЧ, free β-hCG), тест № 189;
- РАРР-А (pregnancy associated protein A, белок А плазмы ассоциированный с беременностью), тест № 161.
Проведение комплексного обследования на сроке 11-14 недель беременности, включающего выполнение УЗИ и определение материнских сывороточных маркеров (свободная бета-субъединица ХГЧ и РАРР-А), с последующим программным комплексным расчетом индивидуального риска рождения ребенка с хромосомной патологией, рекомендовано для всех беременных приказом МЗ РФ от 01 ноября 2012 г. № 572н («Порядок оказания медицинской помощи по профилю «акушерство и гинекология»).
С какой целью проводят пренатальный скрининг трисомий 1 триместра беременности, PRISCA-1
Исследование выполняется для скринингового обследования беременных с целью оценки риска хромосомных аномалий плода - трисомии 21 (синдром Дауна) и трисомий 18, 13 (синдром Эдвардса, синдром Патау).
Правила подготовки к исследованию «Пренатальный скрининг трисомий 1 триместра беременности, PRISCA-1»
Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), приём алкоголя, за час до исследования - курение.
Скрининг первого триместра оптимален на 11-13 неделях, второго триместра - на 16-18 неделях. Данные УЗИ I триместра могут быть использованы для расчета риска при проведении биохимического скрининга II триместра. С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>.
В каких случаях проводят исследование «Пренатальный скрининг трисомий 1 триместра беременности, PRISCA-1»
Пренатальный скрининг беременных на сроке 11-14 недель беременности для оценки риска наличия трисомии 21 (синдром Дауна) и трисомий 13/18.
Особыми показаниями к назначению скрининговых исследований для выявления риска хромосомных аномалий плода являются:
- возраст женщины старше 35 лет;
- наличие в семье ребёнка (или в анамнезе - плода прерванной беременности) с генетически подтвержденной болезнью Дауна, другими хромосомными болезнями, врождёнными пороками развития;
- наследственные заболевания у ближайших родственников;
- радиационное облучение или другое вредное воздействие на одного из супругов до зачатия.
Для выполнения исследования необходимо заполнить направительный бланк.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Трактовка результатов исследования «Пренатальный скрининг трисомий 1 триместра беременности, PRISCA-1»
Внимание! Расчёт для тройни невозможен (в программе PRISCA нет соответствующих статистических алгоритмов).
Результаты обследования выдаются в виде бланка-отчёта. В нём указываются данные, использовавшиеся при расчётах, приводятся результаты проведенных исследований, скорректированные значения МоМ. В заключении указываются количественные показатели оценки риска по трисомии 21 (синдром Дауна) и трисомиям 13/18 (синдром Патау и/или синдром Эдвардса), которые отражают частоту встречаемости соответствующих видов патологии при сходных результатах обследований и индивидуальных данных. Например, показатель риска 1:6250 означает, что статистическая вероятность рождения ребенка с соответствующей патологией составляет один случай из 6250 беременностей с подобными индивидуальными данными. В программе PRISCA установлены условные пороги для выделения группы повышенного риска - частота выше 1/250 для трисомии 21 (синдром Дауна) и выше 1/100 для трисомий 13/18.
Результаты расчёта риска хромосомных аномалий плода на основании скрининговых биохимических исследований и показателей УЗИ - это лишь статистические вероятностные показатели, которые не являются основанием для постановки диагноза, но могут служить показанием для назначения дальнейших специальных методов исследования. По текущим рекомендациям МЗ РФ, при установлении у беременной высокого расчетного риска по хромосомным нарушениям у плода (индивидуальный риск 1/100 и выше) врач-акушер-гинеколог направляет ее в медико-генетическую консультацию (центр) для медико-генетического консультирования и установления или подтверждения диагноза с использованием инвазивных методов обследования для установления кариотипа плода.
Использование комплексного (УЗИ ТВП + биохимические тесты) скрининга, по данным ряда исследований, позволяет выявлять синдром Дауна у плода в первом триместре беременности в 85-90% случаев при 5% ложноположительных результатов. Комплексный скрининг помогает выявлять не только риск хромосомной аномалии плода, но и общий риск патологии беременности.
Патология формирования костей. Бальная шкала для расчета риска хромосомных аномалий
ГлавнаяHelixbook Беременность - Пренатальный скрининг трисомий I триместра беременности (синдром Дауна), PRISCA
Биохимический скрининг I триместра беременности, "двойной тест" 1-го триместра.
Maternal Screen, First Trimester; Prenatal Screening I; PRISСA I (Prenatal Risk Calculation).
Твердофазный хемилюминесцентный иммуноферментный анализ ("сэндвич"-метод), иммунохемилюминесцентный анализ.
ММЕ/мл (милли- международная единица на миллилитр), МЕ/л (международная единица на литр).
Болезнь Дауна - хромосомное заболевание, связанное с нарушением клеточного деления (мейоза) при созревании сперматозоидов и яйцеклеток, которое приводит к образованию дополнительной 21-й хромосомы. Частота в популяции - 1 случай на 600-800 родов. Риск хромосомной аномалии увеличивается с возрастом роженицы и не зависит от состояния здоровья матери ребенка, факторов внешней среды. Синдром Эдвардса (трисомии 18) и синдром Патау (трисомии 13) менее связаны с возрастом матери, а популяционная частота составляет 1 случай на 7000 родов. Для точной пренатальной диагностики генетических заболеваний требуются инвазивные процедуры, которые связаны с большой вероятностью осложнений, поэтому для массового скрининга используются безопасные методы исследования, позволяющие выявить низкий или высокий риск хромосомных аномалий и оценить целесообразность дальнейшего обследования.
Пренатальный скрининг трисомий I триместра беременности выполняют, чтобы определить вероятный риск хромосомной патологии плода - трисомии 21 (синдрома Дауна), а также трисомии 18 (синдрома Эдвардса) и трисомии 13 (синдрома Патау) на сроке между 10-й неделей и 13-й неделей и 6 днями беременности. Его рассчитывают с помощью компьютерной программы PRISCA (Prenatal Risk Calculation), разработанной компанией Typolog Software (Германия) и имеющей международный сертификат соответствия. Для исследования определяется содержание свободной бета-субъединицы хорионического гонадотропина (ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-А) в крови беременной.
Для скрининга обязательно учитываются клинические данные (возраст беременной, масса тела, количество плодов, наличие и особенности ЭКО, раса матери, вредные привычки, наличие сахарного диабета, принимаемые лекарственные препараты), данные УЗИ (копчико-теменной размер (КТР) и толщина воротникового пространства (ТВП), длина носовой кости). При наличии данных УЗИ срок беременности рассчитывается по величине КТР, а не по дате последней менструации.
После исследования и расчета риска проводится плановая консультация у врача - акушера-гинеколога.
Результаты скринингового исследования не могут служить критериями для постановки диагноза и поводом для искусственного прерывания беременности. На их основании принимается решение о целесообразности назначить инвазивные методы обследования плода. При высоком риске необходимы дополнительные обследования, в том числе пункция хориона, амниоцентез с генетическим исследованием полученного материала.
Возможности пренатальной диагностики для формирования новых подходов к социально-медицинскому прогнозу течения беременности при генетических синдромах хромосомной и нехромосомной этиологии
1 ГБУЗ "Московский областной НИИ акушерства и гинекологии"
2 Кафедра медицинской генетики ГБОУ ДПО РМАПО Минздрава России, Москва.

УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
В государственной политике здравоохранения приоритетное место занимает проблема охраны здоровья матери и ребенка. В структуре причин детской и младенческой смертности ведущее место занимают врожденные дефекты. Частота рождения детей с различными генетическими заболеваниями очень высока и составляет до одного случая на 100 рождений (1 %). В большинстве случаев эта патология представляет собой неподдающуюся коррекции грубую патологию, часто летального характера [1].
В структуре врожденных пороков развития (ВПР) в 16 % случаев регистрируются множественные пороки развития (МВПР) различной этиологии с установленной частотой 1:250 новорожденных [2], ими сопровождается примерно половина известных нозологических форм наследственных синдромов [3].
Множественные пороки развития, представляющие собой врожденные дефекты с поражением 2 и более органов и систем человеческого организма, являются достаточно сложной проблемой для установления причинно-следственных связей в силу их огромной этиопатогенетической гетерогенности, что зачастую делает невозможным как определение повторного генетического риска в семье, имеющей случай рождения больного ребенка, так и формирование правильной акушерской тактики, основанной на социальном и медицинском прогнозе для течения патологической беременности.
В основе синдромов, клинически проявляющихся как МВПР, может лежать хромосомная патология, генные мутации, действие на плод неблагоприятных факторов внешней среды (тератогенов). Существуют также синдромы, этиология которых пока не установлена. Одни из них, несомненно, генетической природы, другие связаны с действием неспецифических факторов внешней среды, третьи являются следствием сочетанного влияния генетических и внешнесредовых факторов [2].
В группе МВПР с известным генезом большую часть занимают хромосомные синдромы, обусловленные геномной числовой или структурной мутацией, достаточно широко изученные и хорошо диагностируемые. Около 40 % от всех случаев синдромов нехромосомной этиологии представлены моногенными болезнями - синдромами, связанными с мутациями в одном или обоих аллельных генах гомологичных хромосом, получаемых от обоих родителей [2]. Если для возникновения патологического признака достаточно одной копии мутантного гена, несмотря на наличие нормального аллеля в гомологичной хромосоме, то ген называют доминантным, а если для возникновения болезни нужны обе копии мутантного гена или отсутствие второго гена, то рецессивным [4].
При аутосомно-доминантном типе наследования заболевание возникает либо в результате спорадической мутации, либо при передаче мутантного гена от одного из родителей, страдающего данным заболеванием, своим детям. Патологический ген передается 50 % потомства субъекта с доминантно наследуемым синдромом. Аутосомно-рецессивный тип наследования, как правило, характеризуется тем, что оба родителя являются носителями патологического гена, несмотря на то, что болезнь у них не проявляется и соматически они здоровы. Риск для дальнейшего потомства супругов-носителей составляет 25 %. Численно, по распространению в популяции, доминантно и рецессивно наследуемые синдромы почти равны. Показатель отягощенности моногенными заболеваниями, по обобщенным данным, колеблется в пределах 2,2-3,5 на 1000 человек [5]. Их диагностика представляет большие сложности, так как цитогенетический анализ позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не помогает установить диагноз, определить повторный генетический риск и сформировать репродуктивную тактику для семьи.
Отсутствие организационных и методологических алгоритмов пренатальной ультразвуковой диагностики генетических синдромов при их огромной клинической и социальной значимости, обусловленной тяжестью проявлений на уровне фенотипа больного и высоким риском повтора патологии в семье, диктует необходимость их пренатальной верификации для выбора адекватной акушерской тактики и специфических мер профилактики, определенных достоверным прогнозом.
Различные по происхождению генетические синдромы имеют различные типы наследования, а следовательно, и различный риск повторения в семье. Возможность корректного расчета генетического риска патологии в семье, предложение специфических мер профилактики патологии в дальнейшем зависит от точности поставленного пренатального (дородового) диагноза плоду (будущему ребенку). Постановка диагноза возможных нарушений развития плода должна проводиться всеми возможными методами, среди которых ультразвуковая диагностика является основным, неинвазивным, безопасным, информативным, а порой единственно возможным при беременности методом выявления генетических синдромов и ассоциаций, определяющим дородовый диагноз и необходимость дальнейших углубленных исследований (инвазивных, лабораторных и др.).
Несмотря на то, что в настоящее время накоплено некоторое количество данных и определенное количество публикаций о выявлении наследственных синдромов при пренатальной эхографии, дородовая идентификация нозологических форм синдромов не вошла в рутинную практику врачей пренатальной диагностики и носит случайный характер. В литературе встречаются лишь единичные публикации диагностики генетических синдромов нехромосомного происхождения.
Подавляющее большинство врачей ультразвуковой пренатальной диагностики, проводящих исследование беременной женщины в разные сроки, не владеют знаниями и основными принципами описания фенотипа, принятого в медицинской генетике, и не имеют специальной подготовки по исследованию на экспертном уровне. На сегодняшний день отсутствуют стандарты описания особенностей строения плода, найденных при ультразвуковом дородовом исследовании, не определены критерии оценки того или иного фенотипического изменения (внешнего вида и внутреннего строения) у будущего ребенка, отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов. В современной пренатальной диагностике нет диагностических алгоритмов и определенных схем действия и взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов при пренатальном выявлении МВПР.
При постановке диагноза в синдромологии чрезвычайно важен полный фенотипический анализ, констатация всех найденных аномалий, выявленных при дородовом ультразвуковом исследовании у будущего ребенка. Важен полный спектр найденных патологических признаков: пороков развития, функциональных нарушений, малых аномалий развития, особенностей фенотипа и др. Исследования больных с различными наследственными синдромами позволили установить, что микропризнаки не только позволяют заподозрить наследственную природу заболевания, но и нередко являются основополагающими при постановке правильного диагноза [6]. При наличии нормального кариотипа при лабораторном исследовании плодного материала плод с изменением фенотипа должен вызывать у врача ультразвуковой диагностики "генетическую настороженность" для поиска нехромосомных синдромов как при эхографии в I триместре, так и при дальнейших ультразвуковых исследованиях, так как идентификация многих генетических синдромов представляет собой диагностику, основанную на узнавании "характерного лица синдрома".
Тщательное изучение маркеров хромосомной патологии показало, что некоторые из них информативны и для формирования групп риска по синдромам нехромосомной этиологии, что особо актуально при сформированном алгоритме раннего пренатального скрининга у врачей-экспертов ультразвуковой диагностики. Так, разнообразные нозологические формы синдромов сопровождались увеличением толщины воротникового пространства, уменьшением длины носовой кости, микрогнатией у плодов в сроках первого скринингового ультразвукового осмотра в 11-14 нед беременности [7, 8].
В рамках Национального приоритетного проекта "Здоровье" в период 2010-2014 гг. регионы Российской Федерации перешли на новую для страны современную методологию массового комбинированного раннего пренатального скрининга на частые хромосомные анеуплоидии и ВПР в соответствии с рекомендациями международной врачебной профессиональной некоммерческой организации "Фонд медицины плода". В 2015 г. по инициативе Министерства здравоохранения Российской Федерации курсом пренатальной диагностики кафедры медицинской генетики Российской медицинской академии последипломного образования проведен Аудит-2015 для оценки работы регионов страны по новому алгоритму. По результатам проведенного анализа сведений, поступивших из 63 регионов Российской Федерации, в настоящее время в 510 организованных кабинетах экспертного уровня пренатальной диагностики подготовлено и работает 1210 сертифицированных врачей ультразвуковой диагностики, подтвердивших свою компетенцию, в том числе международным сертификатом. Всего в экспертных кабинетах 63 регионов России обследовано около 2 млн беременных женщин, выявлено более 10 тыс. плодов с различными нарушениями развития. Основные показатели проведения мероприятий раннего пренатального скрининга к 2014 г. суммарно достигли референсных международных значений и эпидемиологических диапазонов (выявляемость хромосомных аномалий и ВПР), что определяет внедренную в рамках нацпроекта качественно новую систему пренатальной диагностики в стране как успешную, контролируемую и управляемую технологию с перспективами дальнейшего развития и совершенствования, среди которых, несомненно, одну из основных ролей будет занимать пренатальная синдромология. Реальность практической реализации этого направления демонстрируют показатели, полученные за 5 лет в медико-генетическом отделении Московской области.
Московская область была одной из первых территорий Российской Федерации, вступивших в национальный проект по переводу раннего пренатального скрининга на экспертный уровень диагностики. Система существующего оказания медико-генетической помощи беременным Московской области такова, что возможен полный сбор информации обо всех случаях рождений с генетической патологией в рамках региональной системы мониторинга и регистрации врожденных пороков развития у плодов и детей, существующей с 1999 г. Это основополагающий момент, поскольку исследования популяционных и базовых частот различной врожденной патологии возможны только при адекватном ведении регистра ВПР [9], когда необходимо иметь информацию не только по новорожденным, но и по остановленным по решению семьи беременностям в связи с пренатально выявленной летальной патологией у плода [10].
Регистр ВПР Московской области с 2001 г. является членом международной организации мониторинга ВПР, что подтверждает обоснованность популяционных частот ВПР.
Алгоритм массового пренатального скрининга беременных Московской области на ВПР и хромосомные аномалии у плода, утвержденный региональным приказом Министерства здравоохранения Московской области, обеспечивает направление в медико-генетическое отделение Московского областного НИИ акушерства к врачам-экспертам всех беременных с подозрением на внутриутробное нарушение развития плода на любом сроке беременности для подтверждения предварительного диагноза. При ультразвуковом исследовании в архивной базе данных сохраняется вся необходимая информация: снимки и видеоклипы, объемные изображения с возможностью последующей постобработки материала offline. Все это позволяет собрать максимально полную информацию не только о грубых пороках развития, но и о мельчайших отклонениях, маркерах и особенностях в развитии у плодов с генетической патологией на популяционном уровне.
Формирование клинической гипотезы на основании полученных эхограмм и объемных архивированных изображений, базирующееся на знаниях в области клинической синдромологии при использовании новейших информативных поисковых систем, является реальным и эффективным инновационным подходом к пренатальной диагностике генетической патологии. При проведении последующего медико-генетического консультирования по установленному диагнозу должны быть определены меры профилактики повторного возникновения генетической патологии при последующих беременностях. Иными словами, возможность корректного расчета генетического риска зависит от точности поставленного пренатального диагноза.
Московская область является одним из крупнейших регионов страны, ежегодное количество родов по области достигает 80 тыс. Учитывая известную популяционную частоту МВПР в Московской области - 1:200 рождений, среди которых синдромы хромосомной этиологии встречаются с частотой 1:370, а МВПР нехромосомной этиологии - 1:470 [11], можно рассчитать базовую ожидаемую частоту выявления данной патологии. Так, в Московской области ежегодная ожидаемая теоретическая частота МВПР у детей и плодов различной этиологии составляет 400 случаев, среди них синдромов с нехромосомной этиологией - около 170 случаев.
В медико-генетическом отделении МОНИИАГ (МГО) до 2010 г. применялся стандартный подход к пренатальной ультразвуковой диагностике МВПР, заключающийся в перечислении спектра выявленных патологических признаков без аналитического сопоставления найденной патологии с известными наследственными синдромами. С 2010 г. пренатальная ультразвуковая диагностика МВПР осуществлялась с применением нового диагностического алгоритма, заключающегося в применении клиникосиндромального подхода к анализу выявленной при ультразвуковом исследовании патологии: во всех случаях пренатально диагностированных МВПР на первом этапе предлагается проведение кариотипирования плода для подтверждения либо опровержения хромосомной этиологии комплекса пороков развития. В дальнейшем необходимо проводить диагностический поиск возможного сочетания найденных различных симптомов, среди которых есть как пороки развития, так и малые аномалии и особенности фенотипа. На заключительном этапе пренатальной части диагностики нехромосомного синдрома проводится дифференциальный диагноз с возможными кандидатными синдромами с формированием составляющих синдромального ядра.
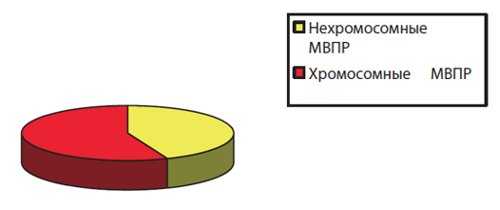
Рис. 1. Этиология всех выявленных у плодов и детей МВПР в Московской области за период исследования (2010-2014 гг.).
За 5 лет (с 2010 по 2014 г.) в МГО пренатально в разные сроки беременности было выявлено 1358 синдромов МВПР различного генеза. Среди всех выявленных пренатально МВПР 789 (58 %) были вызваны хромосомной патологией, 569 (42 %) случаев составляли МВПР нехромосомной этиологии. Среди всех случаев диагностики синдромов нехромосомной этиологии (рис. 2) синдромы с известным типом наследования были диагностированы в 354 (62,2 %) случаях, а неклассифицированные комплексы (НК) - в 215 (37,8 %).
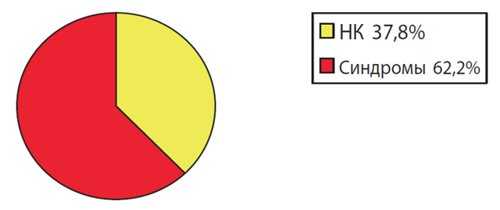
Рис. 2. Структура выявленных нехромосомных синдромов за 5 лет (2010-1014 гг.) в МГО.
Применение нового алгоритма к постановке пренатального диагноза позволило определить возможную этиологическую природу нехромосомных МВПР, что привело к адекватному медико-генетическому консультированию семьи по вопросам пренатальной и постнатальной тактики с определением репродуктивного прогноза в целом.
Поиск путей для разработки и внедрения алгоритма генетического подхода к ультразвуковому исследованию плода, диагностика новых ультразвуковых маркеров в пренатальной диагностике имеет чрезвычайный интерес для медицинской науки и практики, так как большинство этих синдромов сочетаются с умственной отсталостью, высокой летальностью и инвалидностью. По мере накопления клинических данных будет возможно выявить все больший спектр генетических нарушений, как пороков развития, так и незначительных фенотипических особенностей и малых анатомических признаков, которые могут свидетельствовать о наличии у плода того или иного вида врожденной и наследственной патологии. Такой диагностический подход позволит определить акушерский прогноз для выбора оптимальной пренатальной тактики и определения спектра постнатальных мероприятий, включая уточненный диагноз у ребенка и обязательное последующее медико-генетическое консультирование супругов по прогнозу потомства с формированием тактики репродуктивного поведения семьи с предложением специфических методов профилактики генетической патологии.
Разработка и внедрение достоверно значимых ультразвуковых маркеров для диагностики генетических синдромов различного происхождения позволят оптимизировать алгоритм дородовой диагностики этих состояний, что является вторичной профилактикой перинатальной и младенческой смертности и инвалидности и представляет собой важнейшую задачу как социального, психологического, так и клинического значения.
Литература
- Бочков Н.П. Клиническая генетика. М.: ГЭОТАРМЕД. 2001. 448 с.
- Лазюк Г.И. Этиология и патогенез врожденных пороков развития. Тератология человека. М.: Медицина. 1991.
- Ильина Е.Г., Колосов С.В., Миронова С.И. Клинико-генетический анализ неклассифицированных комплексов множественных врожденных пороков развития на базе Белорусского генетического регистра // Медицинская Генетика. 2005. N 3. С. 134-138.
- Кеннет Л. Джонс. Наследственные синдромы по Дэвиду Смиту. М.: 2011.
- Лазюк Г.И., Лурье И.В., Черствой Е.Д. Наследственные синдромы множественных врожденных пороков развития. М.: 1983.
- Козлова С.И., Патютко Р.С., Прытков А.Н. Семиотика и принципы диагностики наследственных болезней. М.: 1999.
- Nicolaides K.H., Azar G., Snijders R.S.M. et al. Fetal nuchal oedema: associated malformations and chromosomal defects // Fetal. Diagn. Ther. 1992. V. 7. P. 123-131.
- Sepulveda W., Wong A., Andreeva E., Adzehova N. Absent mandibular gap at retronasal triangle view: a clue to the diagnosis of micrognathia in the first trimester // Ultrasound in obstetrics and gynecology. 2012. V. 39. P. 152-156.
- Гинтер Е.К., Зинченко Р.А. Наследственные болезни в российских популяциях // Вестник ВОГиС. 2006. Т. 10. N 1. С. 106-125.
- Козлова С.И., Демикова Н.С., Прытков А.Н. Мониторинг врожденных пороков развития // Пособие для врачей. М.: 2000.
- Андреева Е.Н. Клинико-синдромальный подход к пренатальной ультразвуковой диагностике нарушений развития плода для оценки репродуктивного прогноза. Автореф. канд. дисс. М., 2013.
При поддержке гранта РГНФ №15-06-10977/15
Оценка носовой кости в I триместре беременности: как, где, когда и зачем мы делаем
Московский областной НИИ акушерства и гинекологии, Москва.
Кафедра медицинской генетики РМАПО, Москва.

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Задача пренатального скрининга - выявление беременных женщин группы высокого риска по рождению детей с хромосомными болезнями и врожденными пороками развития с целью более детального анализа состояния плода с помощью специальных методов [1].
С конца прошлого века в алгоритм пренатального скрининга включен расчет индивидуального комбинированного риска, центральное место в котором занимают ультразвуковой и биохимический скрининг в I триместре (11-14 нед беременности). Были созданы компьютерные программы расчета риска, учитывающие возраст, ультразвуковой маркер I триместра (толщина воротникового пространства - ТВП) и биохимические маркеры крови (β-hCG и PAPP-A) беременной женщины [2].
За последние 10 лет данная система полностью оправдала себя и получила дальнейшее развитие, путем прибавления к расчету риска добавочных ультразвуковых маркеров (оценка носовой кости, венозного протока, трикуспидальной регургитации, некоторых маркерных врожденных пороков развития). Расширение протокола осмотра с оценкой новых ультразвуковых маркеров (оценка носовой кости, кровоток в венозном протоке и на трикуспидальном клапане) улучшает чувствительность комбинированного скрининга благодаря увеличению частоты обнаружения и уменьшению частоты ложноположительных результатов [3].
Однако их оценка требует соответствующего углубленного обучения врача УЗД и получение сертификата компетентности на проведение данного вида исследования, так как только после получения доступа на конкретный вид исследования программа расчета риска будет учитывать эти данные в своих расчетах 1.
Преимуществами проведения УЗИ в 11-14 нед помимо установки точного срока беременности являются: ранняя диагностика многих пороков развития плода, оценка маркеров хромосомных аномалий для выявления беременных высокого риска по хромосомным аномалиям у плода, при многоплодной беременности именно в ранний срок возможно установить хориальность, что является важнейшим фактором, определяющим исход многоплодной беременности, возможность выявить женщин группы высокого риска по развитию преэклампсии в поздние сроки беременности [3, 4].
Копчико-теменной размер плода (КТР) для проведения скрининга I триместра должен быть в пределах 45-84 мм. Для оценки носовой кости в I триместре беременности необходимо соблюдать строгие условия. Это адекватное увеличение (на снимке должны быть только голова и верхняя часть грудной клетки), среднесагиттальный скан (должны быть визуализированы эхогенный кончик носа, небный отросток верхней челюсти, диэнцефалон), нос представлен тремя "К" (кончик носа, кожа, кость). Кожные покровы и кости носа визуализируются в виде знака "равенства", нос параллелен датчику.
Такие правила, как размер плода, адекватное увеличение, среднесагиттальный скан идентичны таковым при измерении ТВП. Таким образом, при выведении корректного скана для измерения ТВП, что является обязательным при проведении УЗ-исследования в сроки 11-14 нед беременности, оценка носовой кости проводится в том же самом срезе, не требуя получения дополнительных изображений.
Если все критерии соблюдены, то на уровне носа плода должны быть видны три четко различимые линии: верхняя линия представляет собой кожу, книзу от нее визуализируется более толстая и более эхогенная, чем кожа носовая кость. Третья линия, визуализируемая кпереди от носовой кости и на более высоком уровне, чем кожа - это кончик носа (рис. 1).
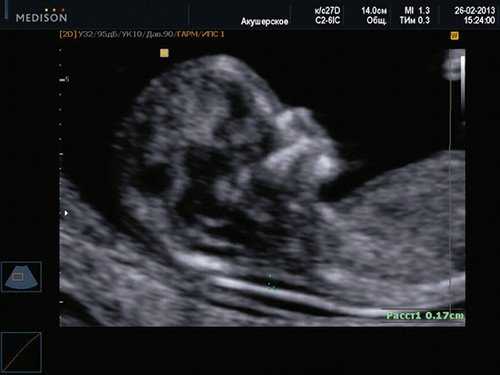
Рис. 1. Нормальная носовая кость.
Считается, что носовая кость нормальна, когда она по своей структуре более эхогенна, чем надлежащая кожа и патологична, если она не видна (аплазия) (рис. 2) или ее длина меньше нормы (гипоплазия) (рис. 3). В случае одинаковой или меньшей эхогенности носовой кости чем кожи носовая кость считается патологической (рис. 4).
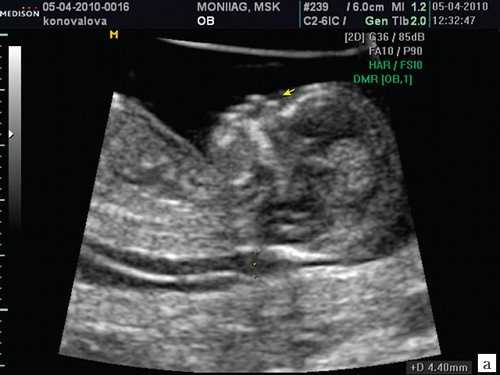
а) Стрелкой указана эхогенная кожа плода.
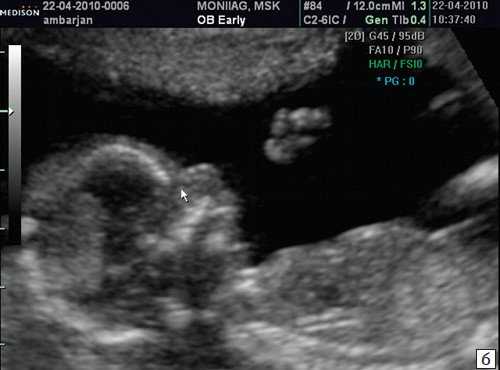
б) Стрелкой указано отсутствие носовой кости.
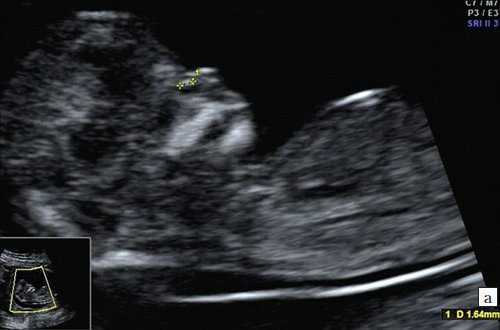
а) Носовая кость в 12 нед и 2 дня длиной 1,4 мм (меньше нижней границы нормы).
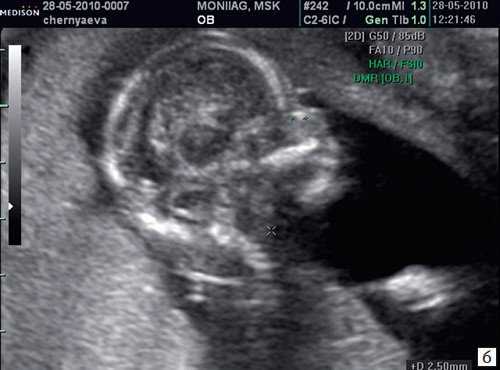
б) Носовая кость 2,1 мм в 14 нед у плода с синдромом Дауна.
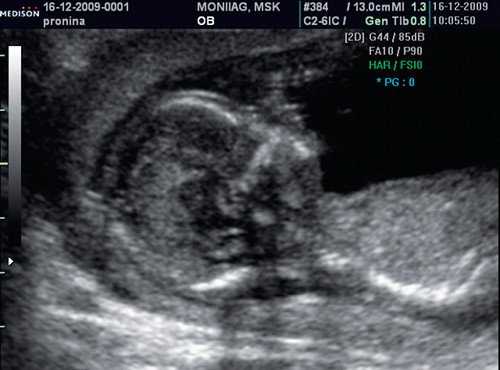
Рис. 4. Сниженная эхогенность носовой кости.
Итак, патологией носовой кости считается:
- отсутствие носовой кости (аплазия);
- изменение ее длины (гипоплазия);
- изменение ее эхогенности.
Учитывая то, что многие работы по изучению этого важного маркера были проведены на различных по составу группах населения, данные по частоте отсутствия носовой кости у разных авторов отличаются. Так, по усредненным данным по мультицентровым исследованиям FMF в 11-14 нед носовая кость отсутствует у эуплоидов (в случае нормального кариотипа) от 1 до 2,6% плодов [2, 5, 6], при хромосомных патологиях: у плодов с трисомией 21 - в 60%, с трисомией 18 - в 50%, у плодов с трисомией 13 - у 40% [3].
Эволюция развития оценки этого маркера и мнение специалистов на этот счет, пожалуй, одна из самых дискутабельных проблем, не до конца решенных в скрининге I триместра беременности. Большинство авторов считают оценку носовой кости в I триместре одной из самых сложных задач среди всех остальных маркеров. И это мнение не лишено оснований.
Безусловно, сторонники теории о том, что для каждой расы (азиаты, афро-американцы и т.д.) и популяции народов (буряты, калмыки, народы Северного Кавказа) должны существовать свои процентильные нормативы для каждого КТР правы. Однако проведение этих исследований возможно лишь тогда, когда в рамках безвыборочного скрининга на нормальных плодах будут проведены мультицентровые исследования с измерением носовой кости.
В программе расчета риска Astraia при оценке носовой кости есть 4 поля: норма, патология (аплазия/гипоплазия), четко не видна, оценить не удалось, т.е. для того, чтобы поставить диагноз "Гипоплазия носовой кости" нужно удостовериться, что она на самом деле меньше нормативных значений для данного срока беременности, а это можно сделать только путем ее измерения и сравнения с известным нормативом.
Метод оценки носовой кости только лишь "да/нет", когда предлагается только увидеть носовую кость и сравнить ее эхогенность с кожей весьма "аппаратозависим", т.е. очень вариабелен и зависит от технических настроек ультразвукового сканера. При получении "жесткого" изображения, характерного для некоторых ультразвуковых аппаратов со специфическими заводскими пресетами (настройками) для осмотра плода в I триместре, всегда эхогенность кожи будет сопоставима, т. е. одинакова с эхогенностью носовой кости. Таким образом, у врачей практического звена, не имеющих возможности работать на сканерах премиум класса, возникают объективные трудности с оценкой этого важного дополнительного диагностического маркера.
Как сторонники метода измерения носовой кости в 11-14 нед приведем данные по Московской области. Область является разнородной по населяющему ее национальному составу. В своей работе мы пользовались нормативными значениями длины носовой кости, опубликованными J. Sonek и соавт. в 2003 году [8], за нижнюю границу нормы принимая значение 5-го процентиля (таблица).
Экспертами окружных кабинетов Московской области проводилась оценка не только присутствия и отсутствия носовой кости, но и ее измерение у всех беременных женщин (около 150 тысяч обследованных за 3,5 года работы скрининга). Все 31 эксперт Московской области имеют действующий сертификат компетенции FMF как на ТВП, так и на оценку носовой кости. Проведенный анализ выявления патологии (аплазия/гипоплазия) носовой кости у плодов с хромосомной патологией показал, что из пренатально выявленных 266 случаев синдрома Дауна у плода в I триместре носовая кость была патологична в 248 случаях, что составляет 93,2%.
Это высокая частота патологии носовой кости при синдроме Дауна свидетельствует о правильно выбранном алгоритме оценки носовой кости от которого мы никогда не намерены отказываться, получая такие высокочувствительные результаты, особенно, что касается диагностики синдрома Дауна. В случаях выявления других хромасомных аномалий, частота выявления патологии носовой кости была сопоставима с данными литературы. При синдроме Эдвардса носовая кость патологична у 78 плодов, что составляет 71%, при синдроме Патау - у 24 (59%) плодов, при моносомии Х - в 24 (42%) случаях, при триплоидии - у 22 (49%) плодов.
Особо хотелось бы подчеркнуть, что в нашем исследовании было 10 беременных корейской национальности, попавших в группу риска по хромосомной патологии. У 4 из них была диагностирована патология носовой кости у плода. Можно было ожидать, что это этническая особенность, однако все данные плоды при пренатальном кариотипировании имели хромосомную патологию (трисомию 21). И, наоборот, у 6 плодов, имеющих нормальный кариотип как по длине, так и по эхогенности носовой кости были в пределах нормативных для данного срока значений.
В работах некоторых авторов установлено, что при трисомии 21 в I триместре беременности лишь у 25% плодов носовая кость отсутствовала, в более высокой частоте она была гипоплазирована (36%) [11].
Так как у нормальных плодов отсутствие носовой кости более характерно для срока 11 нед беременности, чем 13 нед, FMF дает практическую рекомендацию о том, что если в этот срок (11 - начало 12 нед) у плода отсутствует носовая кость при условии нормальных показателей других маркеров (ультразвуковых и биохимических) не стоит учитывать этот показатель при расчете индивидуального риска. В дальнейшем рекомендуется провести дополнительное ультразвуковое исследование через одну неделю. В том случае, если носовая кость останется патологична, необходимо учитывать этот факт при перерасчете величины индивидуального риска по хромосомным аномалиям [4].
Оценка носовой кости улучшает результаты комбинированного скрининга. Частота обнаружения патологии увеличивается с 90 до 93%. Частота ложноположительных результатов уменьшается с 3,0 до 2,5% [2, 3, 5, 6].
Таким образом, собственные данные позволяют нам рекомендовать оценивать носовую кость в сроки 11-14 нед по двум параметрам: эхогенность и длина, принимая за патологию носовой кости ее отсутствие, гипоплазию и снижение эхогенности.
- Баранов В.С., Кузнецова Т.В., Кащеева Т.К. и др. Современные алгоритмы и новые возможности пренатальной диагностики наследственных и врожденных заболеваний. Методические рекомендации. С.-Петербург, 2013. С. 23-46.
- Nicolaides K.H. Screening for fetal aneuploidies at 11-13 weeks//Prenatal diagnosis. 2011, 31: 7-15.
- Nicolaides K.H. Пер. с англ. Михайлова А., Некрасовой Е. Ультразвуковое исследование в 11-13+6 недель беременности. С.-Петербург, 2007. ИД "Петрополис", 142 с.
- Kagan K.O., Cicero S., Staboulidou I., Wright D., Nicolaides K.H. Fetal nasal bone in screening for trisomies 21, 18 and 13 and Turner syndrome at 11-13 weeks of gestation // Ultrasound Obstet Gynecol. 2009; 33: 259-264.
- Kagan K.O., Staboulidou I., Cruz J., Wright D., Nicoladides K.H. Two-stage first-trimester screening for trisomy 21 by ultrasound assessment and biochemical testing // Ultrasound Obstet Gynecol. 2010. V. 36. N 5. P. 542-547.
- Cicero S., Curcio P., Papageorghiou A., Sonek J., Nicolaides K. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study // Lancet 2001; 358:1665-1667.
- Sonek J.D., Mckenna D.,Webb D.,Croom C., Nicolaides K. Nasal bone length throughout gestation: normal ranges based on 3537 fetal ultrasound measurements // Ultrasound in Obstetrics & Gynecology. 2003. V. 21. N 2. P. 152-155.
- Kanellopoulos V., Katsetos C., Economides D.L. Examination of fetal nasal bone and repeatability of measurement in early pregnancy // Ultrasound Obstet Gynecol. 2003 Aug;22(2):131-4.
- Cicero S., Bindra R., Rembouskos G., Tripsanas C., Nicolaides K.H. Fetal nasal bone length in chromosomally normal and abnormal fetuses at 11-14 weeks of gestation // Matern Fetal Neonatal Med. 2002; 11: 400-402.
- Keeling J.W., Hansen B.F., Kjaer I. Pattern of malformations in the axial skeleton in human trisomy 21 fetuses // Am J Med Genet. 1997; 68: 466-471.
Читайте также:
