Перенаправляющие поток стенты при аневризме головного мозга. Особенности
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Поток перенаправляющий стент - это плетёный стент особой конструкции. Его ячеи очень малы и устроены таким образом, что, когда стент имплантируется в артерию на уровне аневризмы, в полости аневризмы создаются условия для её тромбирования, которое происходит в течение интервала от трёх месяцев до года. Эта операция требует длительного приёма дезагрегантов и проводится в плановом порядке при сложных интракраниальных аневризмах.
. выполняется при заболевании
Статьи об операции
Представлены описания наиболее частых операций, выполняемых при сосудистых патологиях головного мозга
© 2022 - Center Neuro. Сайт носит исключительно информационный характер, не является сайтом медицинской организации, ни при каких условиях не является публичной офертой, определяемой положениями статьи 437 (п.2) ГК РФ. Взаимодействие с любым из специалистов, представленных на сайте, регламентируется правилами клиники, в которой он работает.
Результаты применения потокперенаправляющих стентов при лечении интракраниальных аневризм
Цель исследования - оценить эффективность хирургического лечения аневризм сосудов головного мозга с применением потокперенаправляющих стентов (ППС).
Материалы и методы. В Федеральном центре нейрохирургии (Новосибирск) за 2016 г. в плановом порядке прооперировано 64 пациента (11 мужчин, 53 женщины, средний возраст 50,1 ± 11,4 года) с интракраниальными аневризмами; установлены 69 ППС. Общее число выключенных аневризм составило 64.
Результаты. При ангиографическом контроле через 6 мес установлено, что тотальная окклюзия аневризм достигнута в 71 % случаев, субтотальная - в 29 %. Отличный и хороший функциональный исход (0-2 по модифицированной шкале Рэнкина) наблюдался у 60 (93,7 %) пациентов, плохой (3-5 по шкале Рэнкина) - у 4 (6,3 %). Частота осложнений составила 4,7 %, летальность - 0 %.
Заключение. Установка ППС - эффективный метод лечения аневризм сосудов головного мозга, особенно в тех случаях, когда использование альтернативных эндоваскулярных методов несет высокий риск реканализации, а микрохирургические методы - повышенный операционный риск.
Ключевые слова
Об авторах
Алексей Олегович Соснов
630087 Новосибирск, ул. Немировича-Данченко, 132/1
Список литературы
1. Serbinenko F. A. Balloon catheterization and occlusion of major cerebral vessels. J Neurosurg 1974;41(2):125-45. DOI: 10.3171/jns.1974.41.2.0125. PMID: 4841872.
2. Guglielmi G., Viñuela F., Sepetka I., Macellari V. Electrothrombosis of saccular aneurysms via endovascular approach. Part 1: electrochemical basis, technique, and experimental results. J Neurosurg 1991;75(1):1-7. DOI: 10.3171/jns.1991.75.1.0001. PMID: 2045891.
3. Хейреддин А. С., Яковлев С. Б., Филатов Ю. М. и др. Пошаговое лечение множественных аневризм головного мозга с использованием хирургических и эндоваскулярных методов. Журнал «Вопросы нейрохирургии им. Н. Н. Бурденко» 2012;76(5):20-9.
4. Brinjikji W., Murad M. H., Lanzino G. et al. Endovascular treatment of intracranial aneurysms with flow diverters: a metaanalysis. Stroke 2013;44(2):442-7. DOI: 10.1161/STROKEAHA.112.678151. PMID: 23321438.
5. Saatci I., Yavuz K., Ozer C. et al. Treatment of intracranial aneurysms using the pipeline flow-diverter embolization device: a single-center experience with long-term follow-up results. AJNR Am J Neuroradiol 2012;33(8):1436-46. DOI: 10.3174/ajnr.A3246. PMID: 22821921.
6. Yang H., Sun Y., Jiang Y. et al. Comparison of stent-assisted coiling vs coiling alone in 563 intracranial aneurysms: safety and efficacy at a high-volume center. Neurosurgery 2015;77(2):241-7. DOI: 10.1227/NEU.0000000000000765. PMID: 25856112.
7. Breu A. K., Hauser T. K., Ebner F. H. et al. Morphologic and clinical outcome of intracranial aneurysms after treatment using flow diverter devices: mid-term follow-up. Radiol Res Pract 2016;2016: 2187275. DOI: 10.1155/2016/2187275. PMID: 27006830.
9. Yao P. F., Yu Y., Yang P. F. et al. Safety and long-term efficacy of endovascular treatment of small posterior communicating artery aneurysms by coiling with or without stent: a single center retrospective study. Clin Neurol Neurosurg 2013;115(12):2502-7. DOI: 10.1016/j.clineuro.2013.10.005. PMID: 24210269.
10. Arrese I., Sarabia R., Pintado R., Delgado-Rodriguez M. Flow-diverter devices for intracranial aneurysms: systematic review and meta-analysis. Neurosurgery 2013;73(2):193-9. DOI: 10.1227/01.neu.0000430297.17961.f1. PMID: 23624409.
12. Siddiqui A. H., Kan P., Abla A. A. et al. Complications after treatment with pipeline embolization for giant distal intracranial aneurysms with or without coil embolization. Neurosurgery 2012; 71(2):E509-13. DOI: 10.1227/NEU.0b013e318258e1f8. PMID: 22710418.
13. Turowski B., Macht S., Kulcsár Z. et al. Early fatal hemorrhage after endovascular cerebral aneurysm treatment with a flow diverter (SILK-Stent): do we need to rethink our concepts? Neuroradiology 2011;53(1):37-41. DOI: 10.1007/s00234‑010‑0676‑7. PMID: 20339842.
14. Yu S. C., Kwok C. K., Cheng P. W. et al. Intracranial aneurysms: midterm outcome of pipeline embolization device - a prospective study in 143 patients with 178 aneurysms. Radiology 2012;265(3): 893-901. DOI: 10.1148/radiol.12120422. PMID: 22996749.
16. Яковлев С. Б., Арустамян С. Р., Дорохов П. С. и др. Эндоваскулярное лечение крупных и гигантских внутричерепных аневризм с использованием поток-перенаправляющих стентов. Журнал «Вопросы нейрохирургии им. Н. Н. Бурденко» 2015;79(4):19-27.
17. Lv X., Yang H., Liu P., Li Y. Flow-diverter devices in the treatment of intracranial aneurysms: A meta-analysis and systematic review. Neuroradiol J 2016;29(1):66-71. DOI: 10.1177/1971400915621321. PMID: 26838174.
18. Raymond J., Gentric J. C., Darsaut T. E. et al. Flow diversion in the treatment of aneurysms: a randomized care trial and registry. J Neurosurg 2017;127(3):454-62. DOI: 10.3171/2016.4.JNS152662. PMID: 27813466.
19. Kallmes D. F., Hanel R., Lopes D. et al. International retrospective study of the pipeline embolization device: a multicenter aneurysm treatment study. AJNR Am J Neuroradiol 2015;36(1):108-15. DOI: 10.3174/ajnr.A4111. PMID: 25355814.
20. Möhlenbruch M. A., Herweh C., Jestaedt L. et al. The FRED flow-diverter stent for intracranial aneurysms: clinical study to assess safety and efficacy. AJNR Am J Neuroradiol 2015;36(6):1155-61. DOI: 10.3174/ajnr.A4251. PMID: 25721079.
Выключение интракраниальной аневризмы стентом, перенаправляющим поток (Pipeline, Silk, двухслойный стент FRED).
Метод установки поток-перенаправляющего стента (flow divertion) заключается в установке стента высокой плотности плетения в артерию в области шейки аневризмы. Стент направляет поток по артерии и блокирует поступление крови в мешок аневризмы, аневризма тромбируется, тем самым исключается риск ее разрыва.
Данная методика является наиболее физиологичной, поскольку при имплантации стента происходит реконструирование стенки артерии. Стенты, перенаправляющие поток, имеют большую плотность плетения, и, следовательно, больший процент покрытия шейки аневризмы, что помимо поток-перенаправляющего действия, также, способствует эндотелизации шейки аневризмы. Схема операции приведена на рисунке 1.
Установка потоковых стентов является предпочтительной методикой при больших и гигантских аневризмах, аневризмах с широкой шейкой. Клинический пример эндоваскулярной операции по установке потокперенаправляющего стента SILK при гигантской артериальной аневризме головного мозга приведен на рисунке 2.
Рисунок 1. Схема установки потокперенаправляющего стента в проекции шейки аневризмы артерии головного мозга.
В нашей работе мы используем следующие типы поток-перенаправляющих стентов:
Наши контакты как проехать в центр
Адрес: Республика Беларусь, 220114, г. Минск, ул. Ф. Скорины, д. 24
Перенаправляющие поток стенты при аневризме головного мозга. Особенности
«РНХИ им. проф. А.Л. Поленова» — филиал ФГБУ «СЗФМИЦ им. В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия
РНХИ им. проф. А.Л. Поленова — филиал ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия
Хирургическое лечение крупных и гигантских аневризм вертебробазилярного бассейна, проявляющихся симптоматикой компрессии ствола головного мозга
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(4): 32‑37
Цель исследования — изучение результатов хирургического лечения аневризм вертебробазилярного бассейна (ВББ), проявивших себя симптоматикой компрессии ствола головного мозга. Материал и методы. В исследование вошли 8 пациентов, оперированных в 2014—2017 гг. Всем пациентам выполнялось внутрисосудистое вмешательство, 2 из них вторым этапом выполнена открытая операция. Результаты и заключение. Внутрисосудистое вмешательство, как изолированное, так и в сочетании с открытой операцией, является эффективным при лечении аневризм ВББ, клиническая картина которых представлена симптомами компрессионного поражения ствола головного мозга. Применение потокоперенаправляющих стентов позволяет в большинстве случаев добиться хорошей радикальности в отдаленном периоде, не ухудшая при этом функционального исхода. Отдельного рассмотрения и индивидуального подхода требует лечение фузиформных аневризм ствола основной артерии в связи с высоким риском тромбоза коротких ветвей, питающих ствол мозга.
Крупные и гигантские аневризмы вертебробазилярного бассейна (ВББ), проявляющиеся компрессией ствола головного мозга, — достаточно редкая патология, ассоциирующаяся с неудовлетворительными результатами лечения, что связано с высокой травматичностью прямой операции на аневризмах этого региона. Хирургическое вмешательство усложняется также в связи с большим объемом аневризм, расположенных в анатомически сложной области, и малым объемом задней черепной ямки [1—6]. Вышеперечисленные факторы зачастую затрудняют клипирование аневризмы и повышают риск развития послеоперационных осложнений.
Цель настоящего исследования — изучение результатов хирургического лечения аневризм ВББ, основными проявлениями которых были симптомы компрессии ствола головного мозга.
Материал и методы
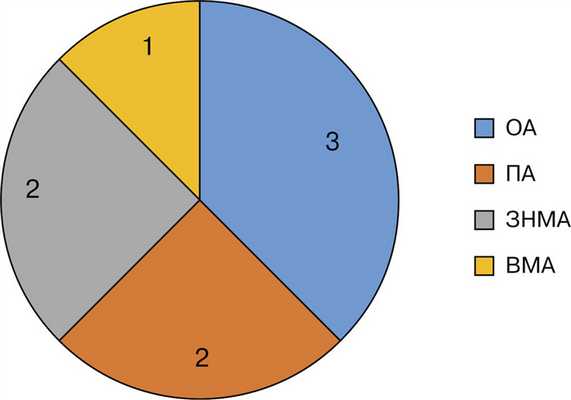
В исследование вошли 8 пациентов (4 женщины и 4 мужчины, средний возраст 48,6 года) с аневризмами ВББ, которые проявились симптоматикой компрессии стволовых структур. Все пациенты оперированы в отделении хирургии сосудов головного мозга РНХИ им. проф. А.Л. Поленова — филиала ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России в 2014—2017 гг. Размеры аневризм находились в пределах 16-45 мм. Мешотчатых аневризм было 4, фузиформных также 4. Множественный характер поражения был выявлен у 2 пациентов, сочетание с артериовенозной мальформацией (АВМ) мозжечка — у 1 больного. Симптоматика, вызванная непосредственно компрессией стволовых структур, отмечена у всех пациентов, у 1 больного также были выявлены выраженные нарушения ликвородинамики (субкомпенсированная тривентрикулярная окклюзионная гидроцефалия), еще у 1 больного ранее было верифицировано субарахноидальное кровоизлияние из аневризмы другой локализации. Распределение аневризм по локализации представлено на рис. 1. Рис. 1. Распределение аневризм вертебробазилярного бассейна по локализации. Сокращения — см. в примечании к таблице.
Все пациенты оперированы вне геморрагического периода. Двум пациентам первым этапом установлен ассистирующий стент (Leo и Enterprise), в 4 случаях — потокоперенаправляющий стент (Pipeline, Silk+ и P64). У 1 больного в качестве предоперационной подготовки перед открытым вмешательством выполняли выключение заполняющейся части аневризмы микроспиралями. У больной с сочетанием гигантской аневризмы задней нижней мозжечковой артерии (ЗНМА) и АВМ мозжечка применение стент-ассистенции или установка потокоперенаправляющего стента в несущий сосуд, который также являлся афферентом АВМ, были признаны рискованными в связи с необходимостью применения двойной дезагрегантной терапии на фоне функционирующей высокопотоковой АВМ. Этой больной выполнили выключение аневризмы с помощью микроспиралей и частичную эмболизацию АВМ неадгезивной композицией ONYX. У 2 пациентов (одному из них первым этапом имплантировали потокоперенаправляющий стент, а второму выключили аневризму микроспиралями) в связи с отсутствием значимого регресса симптоматики вторым этапом выполнено открытое хирургическое вмешательство, направленное на устранение компрессии ствола путем декомпрессии задней черепной ямки и резекции аневризматического мешка. Ближайшие результаты лечения оценивались по Шкале исходов Глазго на момент выписки из стационара. Отдаленные результаты были отслежены у 5 пациентов в сроки 3—48 мес после операции.
Результаты

Результаты лечения пациентов представлены в таблице. Результаты лечения пациентов с крупными и гигантскими аневризмами ВББ Примечание. ОА — основная артерия, ПА — позвоночная артерия, ЗНМА — задняя нижняя мозжечковая артерия, ВМА — верхняя мозжечковая артерия, FD — flow diverter, потокоперенаправляющий стент, AS — assisting stent, стент, использованный для ассистенции.
У 7 пациентов удалось достичь одномоментного выключения аневризмы из кровотока или выраженного замедления кровотока в аневризме. В 6 случаях нарастания неврологической симптоматики не отмечено. У 1 пациентки с сочетанием аневризмы ЗНМА и АВМ в раннем послеоперационном периоде отмечено усиление диплопии. Больной с фузиформной аневризмой средней и нижней трети ствола основной артерии, с объемным воздействием на варолиев мост, планировалась имплантация потокоперенаправляющего стента в ассистирующий стент (с целью максимального позиционирования потокоперенаправляющего стента только в области дефекта артерии, ассистирующего (в относительно не измененном участке) — верхней трети основной артерии). В раннем послеоперационном периоде (1-е сутки) у пациентки развилась симптоматика ишемического поражения ствола головного мозга, обусловленного тромбозом перфорирующих ветвей основной артерии, что и привело к смерти больной на 3-и сутки после операции.
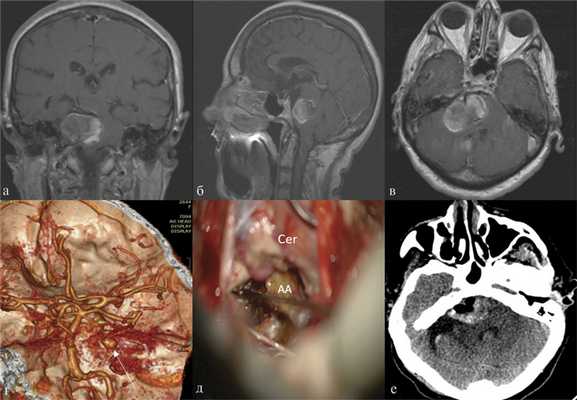
В 2 случаях в связи с сохраняющейся симптоматикой был выполнен второй этап оперативного вмешательства, заключавшийся в декомпрессивной трепанации задней черепной ямки и удалении мешка аневризмы, оказывающего компрессионное воздействие на ствол головного мозга (рис. 2). Рис. 2. Гигантская аневризма правой верхней мозжечковой артерии. а, б, в — МРТ в коронарной, сагиттальной и аксиальной проекциях, режим Т1 В.И. Визуализируется мешок гигантской аневризмы, грубо сдавливающий ствол головного мозга; г — СКТ-ангиография, белой стрелкой указана заполняющаяся часть аневризмы; д — этап операции удаления тромботических масс из полости аневризмы. Интраоперационное фото. АА — мешок аневризмы, Cer — мозжечок; е — СКТ головного мозга после операции, отмечается значительное уменьшение размеров аневризматического мешка с уменьшением компрессии ствола.
Отдаленные результаты были отслежены у 5 пациентов в сроки 3—48 мес после операции. У 4 больных произошел практически полный регресс имевшейся симптоматики. По данным контрольной церебральной ангиографии, аневризма не заполняется у 4 пациентов, сохраняется незначительное заполнение у 1 больного. Всем пациентам также была выполнена контрольная МРТ головного мозга, по данным которой уменьшение аневризмы в размерах отмечено у 3, отсутствие изменения размеров — у 2.
Крупные и гигантские аневризмы ВББ зачастую проявляются симптоматикой, связанной с компрессией как самого ствола мозга, так и черепных нервов [7], что может формировать различную клиническую картину, в том числе ночное апноэ, развитие которого связано со сдавлением продолговатого мозга [8].
Открытое хирургическое вмешательство на аневризмах данной локализации до сих пор считается процедурой высокого риска в связи с размерами самой аневризмы и шириной ее шейки, близостью крайне важных в функциональном отношении невральных образований. Несмотря на это, ряд авторов успешно применяют данный метод с хорошими результатами [7, 9, 10]. В нашей серии открытое вмешательство было выполнено у 2 пациентов и привело к улучшению неврологического статуса, однако следует отметить, что операция применялась в связи с сохраняющейся грубой неврологической симптоматикой после предшествующей внутрисосудистой операции.
Альтернативой прямому вмешательству является эндоваскулярная операция в виде эмболизации полости аневризмы спиралями с использованием стент-ассистенции или без таковой [11], деконструкции несущей артерии или установки потокоперенаправляющего стента. Однако при использовании микроспиралей сохраняется масс-эффект, что в условиях малых размеров задней черепной ямки может приводить к ухудшению функционального результата; кроме того, после применения спиралей сохраняется риск рецидива кровоизлияния или увеличения размеров аневризматического мешка [12, 13].
Ряд авторов [14] считают методом выбора эндоваскулярное выключение несущей аневризму артерии и сообщают о хороших ближайших и отдаленных результатах такой операции. В нашей серии деконструктивные операции не выполнялись, однако, согласно данным С.Р. Арустамяна и соавт. [15], летальность при деконструктивных операциях по поводу аневризм ВББ крайне высока и составляет 42,8%. При этом следует отметить, что не всегда, даже при незаполненной аневризме, по данным церебральной ангиографии, можно быть достоверно уверенными в ее полном выключении из кровотока. K. Iihara и соавт. [12] описали случай увеличения аневризмы в размерах после повторных внутрисосудистых операций, во время которых последовательно выключали из кровотока аневризму, а затем несущую артерию. Несмотря на отсутствие контрастирования аневризмы, по данным ангиографии, повторные контрольные МРТ демонстрировали увеличение аневризмы в размерах. Авторы связывают данный феномен с развитой сетью vasa vasorum стенки аневризмы и повторными интрамуральными кровоизлияниями.
Одной из наиболее перспективных представляется методика имплантации потокоперенаправляющих стентов, однако ее применение в отношении аневризм ствола основной артерии до сих пор вызывает ряд вопросов [16, 17] в связи со сложностью прогнозирования сохранности ветвей, питающих ствол мозга. Так, в серии наблюдений, представленных A. Siddiqui и соавт. [16], в группе из 7 пациентов, оперированных с применением потокоперенаправляющих стентов, у 4 был летальный исход, у остальных исход по модифицированной шкале Рэнкина соответствовал 5, 1 и 0. При установке стента также имеется высокий риск послеоперационного кровоизлияния из аневризмы, связанного с быстрым формированием тромба в полости аневризмы и асептическим воспалением сосудистой стенки в месте имплантации [16].
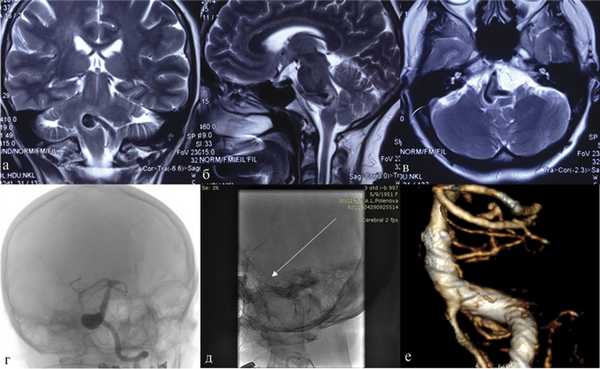
В нашей серии осложнений после имплантации потокоперенаправляющего стента в основную артерию не отмечено (рис. 3). Рис. 3. Фузиформная аневризма правой позвоночной артерии. а, б, в — МРТ головного мозга, коронарная, сагиттальная и аксиальная проекции, режим Т2 В.И. Виден мешок аневризмы, грубо сдавливающий ствол мозга; г — церебральная ангиография в косой проекции; д — церебральная ангиография после установки стента (указано стрелкой); е — контрольная СКТ-АГ через 12 мес. Вместе с тем тромбоз коротких ветвей основной артерии, приведший к гибели пациентки с фузиформной аневризмой основной артерии, развился после имплантации стента. Данное наблюдение свидетельствует о неоднозначности применения стентов у пациентов с аневризмами основной артерии, а также о необходимости индивидуального подхода при выборе тактики лечения пациентов с подобным поражением.
Заключение
Таким образом, можно сделать предварительный вывод о возможности сравнительно безопасного применения внутрисосудистой операции у пациентов с крупными и гигантскими аневризмами вертебробазилярного бассейна. Отдельного рассмотрения требуют случаи фузиформных аневризм ствола основной артерии. Возможно, дальнейшее накопление клинического опыта даст ответ на вопрос о необходимости и безопасности применения потокоперенаправляющих стентов у пациентов с подобными аневризмами.
Выводы
Внутрисосудистое вмешательство, как изолированное, так и в сочетании с открытой операцией, является эффективным при лечении аневризм ВББ, клиническая картина которых представлена симптомами компрессионного поражения ствола головного мозга. Применение потокоперенаправляющих стентов позволяет в большинстве случаев добиться высокой радикальности в отдаленном периоде, не ухудшая при этом функционального исхода. Отдельного рассмотрения, а также индивидуального подхода требует тактика лечения фузиформных аневризм ствола основной артерии в связи с высоким риском тромбоза коротких ветвей, питающих ствол головного мозга.
Участие авторов:
Концепция и дизайн исследования — А.И., С.Г., Л.Р.
Сбор и обработка материала — С.Г., А.П., Г. Б., Е.В.
Написание текста — С.Г.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статья освещает крайне актуальные вопросы хирургии крупных и гигантских аневризм вертебробазилярного бассейна. До настоящего времени прямая хирургия указанных аневризм связана с высоким риском осложнений и в большинстве случаев невозможна. На протяжении всей истории эндоваскулярной нейрохирургии предпринимались попытки использования внутрисосудистых вмешательств при этом виде патологии. Несмотря на малотравматичный характер манипуляций, результаты лечения до недавнего времени были неутешительными — до 50% летальности при деконструктивных операциях с помощью баллона-катетера.
Ситуация несколько изменилась с появлением микроспиралей и методики стент-ассистенции. Однако неблагоприятные исходы переместились из раннего послеоперационного периода в отдаленный в связи с реканализацией и увеличением размеров аневризм. В настоящее время в арсенале эндоваскулярных хирургов имеются потокоперенаправляюшие стенты (ППНС), позволяющие перенаправлять кровоток в несущий аневризму сосуд, создавая условия тромбирования полости аневризмы.
Коллективом авторов представлен опыт лечения аневризм вертебробазилярного бассейна, сопровождающихся неврологическими расстройствами, связанными с компрессией ствола головного мозга, у 8 больных. Аневризмы фузиформного и мешотчатого строения были у равного количества больных. Статья актуальна, так как в ней проанализирован первый опыт разных методик эндоваскулярного лечения больных с патологией, считавшейся ранее некурабельной. В 5 случаях использованы ППНС, которые позволили сохранить просвет несущего сосуда и вызвать тромбоз полости аневризмы. Следует отметить, что у этих пациентов осложнений не было. Данная методика в настоящее время является методом выбора при лечении крупных и гигантских аневризм. Однако для оценки ее эффективности требуется детальное изучение отдаленных результатов лечения.
Поскольку целью вмешательства при гигантских аневризмах, помимо достижения полного выключения аневризмы из кровотока, является устранение компрессии образований задней черепной ямки, заслуживает внимания предложение авторов выполнять декомпрессивную трепанацию задней черепной ямки в случаях нарастания неврологической симптоматики, связанной с быстрым тромбированием аневризмы в раннем послеоперационном периоде. В будущем следует четко определить показания к этому вмешательству.
В связи с тем что не указаны размеры аневризм, не совсем понятно, как принималось решение о выборе вида эндоваскулярного вмешательства. Маловероятно, если речь идет об аневризмах крупных и гигантских размеров, что использование микроспиралей даже со стент-ассистенцией (у 2 больных) является адекватным методом лечения ввиду отсутствия возможности устранения компрессии ствола головного мозга, а также в связи с высокой вероятностью реканализации и роста аневризмы в последующем. Не вполне понятны показания к стентированию у пациента с фузиформной аневризмой базилярной артерии, закончившемуся летальным исходом. Если это был вариант долихоэктазии, то такого пациента можно было бы оставить под наблюдением с рекомендациями стабилизации артериального давления и пожизненного приема дезагрегантных препаратов.
Авторы заключают, что данное направление требует дальнейшего развития с целью выработки наиболее оптимального алгоритма отбора пациентов и четкого определения показаний к проведению разных видов эндоваскулярных операций на крупных и гигантских аневризмах вертебробазилярного бассейна, что справедливо.
Эмболизация интракраниальной (внутричерепной) артериальной аневризмы микроспиралями, в том числе с использованием баллон- и стент-ассистенции
Аневризма - местное расширение просвета артерии вследствие изменения или повреждения ее стенки.
В нашем центре выполняются эндоваскулярные операции при следующих аневризмах сосудов головного мозга:
- Аневризма внутренней сонной артерии (ВСА) (шейного, каменистого, кавернозного, офтальмического, параклиноидного, супраклиноидного отделов ВСА);
- Аневризма передней мозговой артерии (ПМА);
- Аневризма передней соединительной артерии (ПСА);
- Аневризма средней мозговой артерии (СМА);
- Аневризма задней мозговой артерии (ЗМА);
- Аневризма основной артерии (ОА, базилярной артерии);
- Аневризма позвоночной артерии (ПА);
- Аневризма задней нижней мозжечковой артерии (ЗНМА);
- Аневризма передней нижней мозжечковой артерии (ПНМА);
- Аневризма верхней мозжечковой артерии (ВМА);
- Аневризма задней соединительной артерии (ЗСА);
- Аневризма перикаллезной артерии;
- Другие локализации.
Метод эмболизация интракраниальной (внутричерепной) артериальной аневризмы микроспиралями относится к методам эндоваскулярного лечения и заключается в заполнении мешка аневризмы платиновыми микроспиралями определенного размера и формы (рис. 1, 2). В результате операции кровь не поступает в аневризму, тем самым исключается риск ее увеличения и разрыва.
Рисунок 2а. Пациентка Г., Аневризма супраклиноидного отдела правой внутренней сонной артерии.
3D-ангиография в начале операции.
Рисунок 2б. Пациентка Г., Аневризма супраклиноидного отдела правой внутренней сонной артерии эмболизирована микроспиралями.
3D-ангиография в конце операции.
Эмболизация интракраниальной (внутричерепной) артериальной аневризмы микроспиралями с баллон-ассистенцией
Метод баллон-ассистенции (рис. 3) используется для лечения аневризм головного мозга с широкой шейкой. Принцип использования этой методики основан на позиционировании временного баллона в проекции шейки аневризмы. Баллон раздувается, и на фоне раздутия баллона производится заведение микроспиралей в просвет мешка аневризмы, что предотвращает выпадение или пролабирование витков микроспиралей в просвет родительской артерии.
Рисунок 3. Эмболизация интракраниальной (внутричерепной) артериальной аневризмы микроспиралями с баллон-ассистенцией:
A - заведение баллона в несущую артерию, позиционирование его в проекции шейки аневризмы и коаксиальное заведение микрокатетера в мешок аневризмы; B, C - заведение микроспиралей в аневризму на фоне раздутия баллона; D - извлечение инструментов, аневризма выключена из кровотока.
Эмболизация интракраниальной (внутричерепной) артериальной аневризмы микроспиралями со стент-ассистенцией
Стент-ассистенция при эмболизации аневризмы микроспиралями имеет схожий принцип протекции шейки аневризмы, как и при баллон-ассистенции (рис. 2). Однако, протекция в случае имплантации стента является постоянной. Создается каркас для потенциальной эндотелизации в проекции шейки аневризмы. После имплантации стента имеется необходимость длительной антиагрегантной терапии. Клинический пример комбинированной операции эндоваскулярной эмболизации аневризмы артерии головного мозга микроспиралями с баллон- и стент-ассистенцией приведен на рисунках 4, 5.
| Рисунок 4а. Начало установки стента в проекции шейки аневризмы. | Рисунок 4б. Стента в проекции шейки аневризмы полностью раскрыт. |
| Рисунок 4в. Микрокатетер доставки микроспиралей через ячейку стента завен в мешок аневризмы | Рисунок 4г. Эмболизация мешка аневризмы микроспиралями через ячейку стента. |
| Рис. 5а. Аневризма сложной конфигурации супраклиноидного отдела внутренней сонной артерии. 3D-ангиография | Рис. 5б. Аневризма супраклиноидного отдела внутренней сонной артерии. Инструменты заведены в аневризму и несущую артерию. Ангиография |
| Рис. 5в. Баллон позиционирован в родительской артерии, производится установка микроспирали в мешок аневризмы | Рис. 5г. Аневризма полностью эмболизирована микроспиралями на фоне защиты артерии микробаллоном, в несущую артерию установлен стент |
| Рис. 5д. Моделирование стента микробаллоном | Рис. 5е. Аневризма не заполняется. Субтракционная ангиография в конце операции |
Рис. 5ж. Аневризма не заполняется (эмболизирована микроспиралями), в несущую артерию установлен стент. 3D-ангиография в конце операции
Читайте также:
