Показания, этапы и техника операции при разрыве селезенки
Добавил пользователь Morpheus Обновлено: 22.01.2026
Доля абдоминальной травмы составляет 1,5-4,4% всех механических повреждений (А.С. Ермолов, 2009). Из них повреждения селезенки составляют 10-30%. Наиболее часто селезенка повреждается при закрытой травме живота - в 85%, значительно реже - при ранениях - в 15% наблюдений [15]. Большинство пациентов с повреждениями селезенки составляют люди трудоспособного возраста [1], у которых повреждения органов брюшной полости являются одной из ведущих причин смерти [8], что представляет серьезную социальную проблему и диктует необходимость дальнейшего поиска путей оптимизации лечебных алгоритмов и быстрейшей реабилитации. Обращает на себя внимание отсутствие тенденции к снижению летальности при повреждениях селезенки, которая за последние 20 лет сохраняется 6-7% [7].
В настоящее время при лечении повреждений селезенки используются спленэктомия, органосохраняющие операции и консервативный метод. Последние два способа применяются в основном при травме I и II степени (Organ Injury Scaling: Spleen and Liver) [10, 12, 20]. При выполнении органосохраняющих операций малая подвижность, полнокровие, слабая капсула и нежная паренхима приводят к неустойчивому гемостазу, что не позволяет даже на современном этапе широко их использовать. Лечебно-диагностический алгоритм в настоящее время представлен динамическим ультразвуковым исследованием, компьютерной томографией и при необходимости эмболизацией селезеночной артерии. В отличие от спленэктомии использование указанных выше методов сопряжено с высоким риском двухмоментного кровотечения, образования абсцессов [6, 16, 21]. Таким образом, на сегодняшний день наиболее часто выполняемым оперативным вмешательством является спленэктомия. Благодаря технологическому прогрессу в хирургии это вмешательство может быть выполнено видеолапароскопическим методом. В плановой хирургии видеолапароскопическая спленэктомия выполняется с 1991 г., отработаны технические аспекты, доказаны эффективность и надежность ее применения, а также преимущества перед «традиционной» операцией [4, 5, 9, 17-19]. Однако публикации, посвященные видеолапароскопической спленэктомии при травме селезенки, единичны и не позволяют на основании данных литературы четко стандартизировать подход к выполнению видеолапароскопической спленэктомии у этой категории пациентов [2, 3, 11, 13, 14].
В связи с изложенным проведен сравнительный анализ видеолапароскопической и «открытой» спленэктомии у пациентов с повреждением селезенки.
Цель исследования - оценка возможности выполнения и эффективности видеолапароскопической спленэктомии при повреждениях селезенки.
Материал и методы
Работа основана на анализе результатов лечения 25 больных, оперированных по поводу повреждений селезенки за период с 2009 по 2011 г. Больные были разделены на 2 группы - основную и контрольную. Пациентам основной группы выполняли видеолапароскопическую спленэктомию, контрольной - «открытую» спленэктомию. У всех больных были повреждения селезенки II и III степени по классификации Organ Injury Scaling: Spleen and Liver.
С учетом отсутствия доказательств нормального распределения выборки характеристики выборки приведены в виде: Ме (Q1;Q3), где Ме - медиана, Q1 и Q3 - верхний и нижний квартили соответственно.

Как видно из табл. 1, большинство больных (68%) были мужчинами. Медиана возраста в основной и контрольной группах составила соответственно 22 и 27 лет. Медиана времени до поступления в стационар составила 4 ч в основной группе и 1,5 ч в контрольной группе. В 24 наблюдениях прослежена четкая связь с травмой. Лишь у одной больной 63 лет не удалось установить такую связь.
Медиана тяжести повреждения по шкале Injury Severity Score составила 17 и 16 в основной и контрольной группах.
Тяжесть состояния оценивалась по шкале Revised Trauma Score и медиана составила соответственно 7,108 и 6,376. Во время операции у пациентов основной и контрольной групп медиана объема гемоперитонеума составила 0,3 л в обеих группах.
Всем пациентам выполняли ультразвуковое исследование и компьютерную томографию органов брюшной полости и забрюшинного пространства, рентгенографию груди и живота, клинические анализы крови и мочи.
Как видно из табл. 1, группы сопоставимы по представленным параметрам, что позволяет провести сравнительный анализ.
Результаты и обсуждение
Показаниями к видеолапароскопии считали повреждение селезенки III степени и выше по OIS; наличие гематомы селезенки с риском ее двухмоментного разрыва.
Кроме того, в ситуациях, когда клинико-инструментальная картина не позволяла исключить повреждение селезенки и имелось увеличение объема жидкости в брюшной полости при ультразвуковом исследовании в динамике, мы считали целесообразным выполнять диагностическую видеолапароскопию.
Техника операции
Первые операции выполняли в положении больного на спине. В последующем мы пришли к выводу о более целесообразном и удобном для манипулирования на селезенке положении на правом боку, что создает большее рабочее пространство, а также обеспечивает перемещение внутренних органов за счет силы тяжести.
Пневмоперитонеум накладывали с помощью иглы Вереша до достижения значений внутрибрюшного давления 12-14 мм рт.ст. Параумбиликально вводили 10-миллиметровый троакар и 30-градусный лапароскоп, а также 5-миллиметровый троакар для манипулятора в левом подреберье. Оценивали объем гемоперитонеума и возможность видеолапароскопической спленэктомии, после чего устанавливали дополнительные троакары: в правом подреберье по срединно-ключичной линии (5 мм), в эпигастрии (10 мм). Троакар в левом подреберье меняли на 10- или 12-миллиметровый.
Для безопасной тракции, визуализации и сокращения интраоперационной кровопотери был разработан оригинальный метод (заявка на получение патента №2010141183), заключающийся в заведении в брюшную полость через троакар силиконовой трубки, которую после пересечения селезеночно-диафрагмальной связки оборачивали вокруг ее ножки (включая короткие желудочные артерии, селезеночную артерию и вену). После этого трубку захватывали эндоскопическим зажимом за оба конца таким образом, чтобы образовавшаяся петля сдавливала сосудистую ножку селезенки в области ее ворот и осуществлялась ее тракция вверх. Этот прием позволил хорошо визуализировать сосуды селезенки и выполнить спленэктомию, используя 3 троакара.
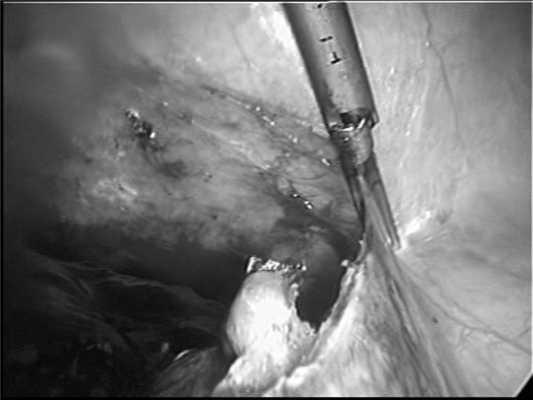
В первую очередь с помощью биполярной коагуляции или ультразвуковых ножниц Ultracision (см. рисунок, а) Рисунок 1. Этапы лапароскопической спленэктомии. а - пересечение связочного аппарата селезенки с помощью ультразвуковых ножниц Ultracision. пересекали селезеночно-ободочную и селезеночно-желудочную связки.

Далее визуализировалась поджелудочно-селезеночная связка с проходящими в ней артерией и веной, при этом хорошо определялись хвост поджелудочной железы и ворота селезенки. При выполнении первых двух операций ножку селезенки обрабатывали сшивающим аппаратом Endo GIA 60 (высота скрепки 2,5 мм) и с дополнительным наложением гемостатических Z-образных швов (см. рисунок, б). Рисунок 1. Этапы лапароскопической спленэктомии. б - пересечение ножки селезенки сшивающим аппаратом.

В дальнейшем, в 7 наблюдениях использовали аппарат Ligasure, что было достаточно для надежного гемостаза (см. рисунок, в). Рисунок 1. Этапы лапароскопической спленэктомии. в - пересечение ножки селезенки с помощью аппарата Ligasure.
После пересечения сосудистой ножки с помощью биполярного зажима и ножниц или ультразвуковых ножниц пересекали селезеночно-почечную связку. Селезенку отделяли тупым способом от забрюшинного пространства. Далее селезенку и сгустки крови помещали в эндоконтейнер, предварительно введенный в брюшную полость. Брюшную полость тщательно промывали изотоническим раствором натрия хлорида, после чего проводили контроль гемостаза. Левое поддиафрагмальное пространство и малый таз дренировали силиконовыми трубками. Эндоконтейнер подтягивали через разрез от троакара (12 мм) и селезенку фрагментарно удаляли.

Сравнительный анализ течения послеоперационного периода в основной и контрольной группах представлен в табл. 2.
При сравнении результатов лечения пациентов с повреждением селезенки в двух группах получены следующие результаты:
Медиана длительности оперативного вмешательства в основной группе составила 2,5 ч, в контрольной - 1,2 ч. Значительную разницу в длительности выполнения операции в основной и контрольной группах мы связываем с этапом отработки методики видеолапароскопической спленэктомии.
В послеоперационном периоде прослежена разница в сроках использования анальгетиков, что объясняется отсутствием большого разреза передней брюшной стенки у больных основной группы.
Более ранняя активизация также отмечена у больных основной группы, у которых был менее выражен болевой синдром и меньше объем операционной травмы. Медиана сроков разрешения пареза составила соответственно 24 и 48 ч у больных основной и контрольной групп.
Меньшее количество легочных осложнений в основной группе можно связать с более ранней активизацией пациентов и менее выраженным болевым синдромом.
Гнойно-воспалительных осложнений и летальных исходов не было в обеих группах.
Представляют интерес следующие клинические наблюдения.
Больная У., 63 лет, поступила 23.04.10 в тяжелом состоянии с жалобами на боль за грудиной, затрудненное дыхание, головокружение. Похожий приступ 20.04 купировался самостоятельно. Травмы отрицала. Госпитализирована в отделение кардиологической реанимации с диагнозом: ИБС, нестабильная стенокардия, тромбоэмболия мелких ветвей легочной аретрии. Выполнена сцинтиграфия легких, при этом признаков тромбоэмболии легочной артерии не обнаружено. Проводилась инфузионная, дезинтоксикационная, бронхолитическая терапия с положительным эффектом. 29.04 отмечено ухудшение состояния: появились боли в левом подреберье и мезогастральной области. Выполнено УЗИ брюшной полости и забрюшинного пространства, отмечено разобщение листков брюшины вокруг селезенки до 0,5 см. При цветовом допплеровском картировании в верхнем полюсе селезенки подкапсульно имеется гипоэхогенная зона размером 6×3,5 см без кровотока. При компьютерной томографии брюшной полости наблюдается небольшое количество жидкости вокруг селезенки, подкапсульная гематома селезенки объемом 280 см 3 . С учетом высокого риска двухмоментного разрыва селезенки и развития внутрибрюшного кровотечения больной выполнена экстренная видеолапароскопия. При ревизии выявлено небольшое количество крови и сгустков в левом поддиафрагмальном пространстве и левом латеральном канале, селезенка несколько увеличена, на диафрагмальной поверхности имеются гематома и разрыв на 2 / 3 длины без активного кровотечения. К селезенке подпаяна прядь большого сальника, по отделении которого вскрылся абсцесс (выделилось около 50 мл сливкообразного гноя), взят материал для посева. Стенками абсцесса являлась висцеральная поверхность селезенки, дно и большая кривизна желудка, большой сальник, диафрагма. Выполнены видеолапароскопическая спленэктомия, санация и дренирование полости абсцесса и брюшной полости. Диагноз: двухмоментный разрыв селезенки, поддиафрагмальный абсцесс слева, постгеморрагическая анемия. Дренажи из брюшной полости удалены на 5-е и 12-е сутки. На 9-е сутки после операции при компьютерной томографии отмечался инфильтрат левого поддиафрагмального пространства без жидкостного компонента, который регрессировал на фоне консервативной терапии. На 19-е сутки после операции пациентка в удовлетворительном состоянии выписана.
Двухмоментное кровотечение остается сложной проблемой при консервативной тактике и может привести не только к внутрибрюшному кровотечению, но и к формированию абсцессов. Этот пример демонстрирует важность видеолапароскопии как диагностической операции для установления точного диагноза. На данном примере очевидно ее преимущество в верификации такого осложнения, как абсцесс брюшной полости, что оказалось невозможным при выполнении неинвазивных методов обследования и консервативном ведении такого больного.
Больная З., 20 лет, поступила с жалобами на боли в нижних отделах груди слева и левом подреберье. Пострадала в ДТП (пассажир) 10.06.10. Через 2,5 ч доставлена в приемное отделение. При поступлении состояние средней тяжести, дыхание ослаблено слева в нижних отделах, частота дыханий 20 в 1 мин, тоны сердца ритмичные, пульс 80 в 1 мин, АД 110/65 мм рт.ст. Живот не вздут, участвует в акте дыхания, при пальпации мягкий, болезненный в левом подреберье. Перитонеальных симптомов нет. При УЗИ брюшной полости и забрюшинного пространства отмечены признаки травмы селезенки и гемоперитонеума. В экстренном порядке выполнена видеолапароскопия. В брюшной полости около 450 мл жидкой крови. Селезенка не увеличена, на диафрагмальной поверхности имеется разрыв размером 4,5×0,5 см, идущий к воротам, с продолжающимся неинтенсивным кровотечением. Произведена видеолапароскопическая спленэктомия. Послеоперационный период протекал без осложнений. В 1-е сутки больная переведена из палаты интенсивной терапии в хирургическое отделение. На 15-е сутки в удовлетворительном состоянии она выписана из стационара.
Этот пример наглядно демонстрирует, что видеолапароскопическая спленэктомия может являться альтернативой открытой спленэктомии у пациентов с повреждением селезенки на фоне стабильной гемодинамики.
При сравнении результатов видеолапароскопической и открытой спленэктомии значимых различий ни по одному из сравниваемых параметров выявлено не было. Большую длительность операции при использовании видеолапароскопического способа мы связываем с освоением методики. Очевидным ее преимуществом является меньшая операционная травма и как следствие менее выраженный болевой синдром в послеоперационном периоде, что позволяет не использовать наркотические анальгетики в том объеме, в каком они используются после традиционной спленэктомии. Активизация больных начинается после видеолапароскопической спленэктомии также в более ранние сроки. Таким образом, в ряде наблюдений при сомнении в эффективности консервативной терапии, как и органосохраняющей операции, видеолапароскопическая спленэктомия может являться адекватной альтернативой открытой спленэктомии.
Показания, этапы и техника операции при разрыве селезенки
Представлен обзор литературы, посвященный хирургическому лечению повреждений селезенки. Особое внимание отводится хирургическому лечению, направленному на сохранение этого органа с помощью лазерной техники. Показано, что практика использования операций, направленных на сохранение селезенки при ее травме прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока.
Значение селезенки в организме была описана Аристотелем (382-322 до н.э.). Несмотря на многочисленные научные исследования, некоторые функции селезенки до настоящего времени остаются невыясненными. Известно, что селезенка не относится к жизненно важным органам. Однако ей принадлежит ряд важных функций, таких как:
1) удаление микроорганизмов и антигенов из кровотока;
2) синтез иммуноглобулина и пропердина;
3) осуществление деструкции истощенных и патологически измененных эритроцитов;
4) участие в эмбриональном гемопоэзе, который при некоторых заболеваниях может выступать в качестве экстрамедуллярного гемопоэза [64, 87].
Повреждения селезенки при механической травме встречаются в 15-50 % от числа всех пострадавших с травмой живота [20, 45, 50, 53, 66]. Они занимают 2-3-е место после повреждений печени и кишечника [19, 29, 32, 44, 62]. При этом летальность достигает 25 % [25, 32]. Среди механизмов развития закрытых травм селезенки преобладают прямые удары в область левого подреберья, сдавления нижних отделов грудной клетки, сила инерции при падении с высоты [45]. Отмечено, что хрупкость селезеночной паренхимы обусловливает значительное внутрибрюшное кровотечение даже при небольших повреждениях капсулы. По данным П.Н. Зубарева и В.П. Еременко [26], D.E. Fri [66], 42-59 % больных с закрытой травмой селезенки госпитализируют в состоянии тяжелого геморрагического шока. При этом внутрибрюшная кровопотеря в среднем составляет 1685 мл [87].
Органосохраняющие операции при повреждениях селезенки пропагандируются лишь в отдельных публикациях [33, 35, 48]. При этом чаще других упоминается спленорафия, впервые выполненная Тиффани в 1894 году.
Вместе с тем вплоть до настоящего времени отношение к органосохраняющим операциям неоднозначно. Так, по мнению Р.Ш. Байдулатова [10], T.H. Ragsdale et al. [80], органосохраняющие операции часто оказываются сложными, не всегда гарантирующими от рецидива кровотечения. Из-за этого при большинстве травм селезенки авторы рекомендуют спленэктомию. В качестве относительного противопоказания к органосохраняющей операции некоторые ученые относят перитонит [22, 34, 37].
Зарубежные авторы [64, 87] разработали методику выбора того или иного органосохраняющего вмешательства в зависимости от морфологических типов нарушения целостности селезенки. Они различают 4 морфологических типа:
1. Первый тип - разрывы капсулы без нарушения целостности паренхимы.
2. Второй тип - разрывы капсулы селезенки сочетаются с нарушением целостности паренхимы.
3. Третий тип - разрывы распространяются на ворота органа.
4. Четвертый тип - фактически полное разрушение селезенки.
При повреждениях первого типа авторы накладывают швы нитью 3-0 из рассасывающегося материала. В подобных ситуациях ими используются также аппликации биологического клея или порошкообразного коллагена.
Повреждения второго типа, по мнению авторов, требуют иссечения размозженных тканей с последующим наложением глубоких швов (нить 3-0) с дополнительным укреплением их прядью сальника на ножке.
При повреждениях третьего типа выполняется резекция селезенки, или, выражаясь словами автора, - «частичная спленэктомия». К образующейся раневой поверхности фиксируют участок сальника, прибегают к аппликации биологического клея или порошкообразного коллагена.
Четвертый тип повреждения, естественно, требует удаления органа.
Массивные внутрибрюшные кровотечения, возникающие при повреждениях селезенки, нередко затрудняют выполнение органосохраняющих операций [36]. При глубоких разрывах паренхимы авторами предложена остановка кровотечения методом эмболизации, а при поверхностных разрывах - внутриартериального введения лекарственных веществ. Причем, это может быть использовано как с целью предоперационной подготовки больного, так и в качестве основного метода лечения.
При небольших повреждениях селезенки предложен метод гемостаза, заключающийся в заклеивании разрыва капсулы участком ксенобрюшины клеями МК-8 или МК-7. Ксенобрюшину используют также при разрывах в области полюсов органа, фиксируя ее непрерывным кетгутовым швом в виде колпачка. При ранениях в области ворот органа предложен метод «бинтования» ксенобрюшиной [13].
В случае разрыва селезенки на две части с сохранением их кровоснабжения используется методика, при которой раневые поверхности коагулируются, покрываются сеткой или гемостатической губкой, фиксируемых матрацными швами [60]. Авторами предложены следующие виды швов:
1. Горизонтально-матрацный - викриловой нитью с подкладкой из тефлона.
2. Матрацный - хромированным кетгутом.
4. Обычный - хромированным кетгутом с применением сетки.
Экспериментальными работами J.W. Alexander et al. [56], обосновано использование фибриновой пленки с целью гемостаза. Пленка, содержащая концентрированный фибриноген, обеспечивает хорошую системную и местную совместимость. Она может быть применена при паренхиматозных кровотечениях, что позволяет использовать минимальное количество травмирующих орган швов, способствует оптимальному заживлению ран селезенки.
Использование вышеописанных клеев не нашло широкого применения. Более эффективными оказались фибриновые клеи, клей Лигамент-Филанеду, принцип действия их заключается в воспроизведении конечных этапов свертывания крови [18, 42, 67].
Решая вопрос об оставлении фрагмента селезенки, не связанного с основными питающими сосудами ворот, при отсутствии других технических средств, В.В. Дибижев [24], накладывал зажим на сосудистую ножку. Отсутствие изменения цвета или пульсирующего кровотечения (за счет коротких желудочных или диафрагмальных сосудов) служили основанием к оставлению этого фрагмента в брюшной полости.
Возможна резекция селезенки с использованием сшивающего аппарата [7, 43, 86].
S. Frederic et al. [65], C.A. Steward [82], В.Н. Бордуновский [13], считают показанной резекцию при возможности сохранения 25 % органа.
Несомненно, перспективен метод гемостаза, предложенный В.С. Савельевым с соавт. [45], и Е.И. Бреховым с соавт. [14]. Метод разработан в экспериментальных условиях и заключается в использовании плазменных потоков для резекции, поврежденной селезенки. При воздействии на «сухое» операционное поле было отмечено значительное повышение гемостатических свойств. «Сухость» операционного поля достигается временным пережатием сосудов ворот селезенки или сдавливанием краев раны. При этом время воздействия уменьшалось со 100-120 до 60-80 с [14]. Е.И. Брехов с соавт. [14], и А.Д. Толстой с соавт. [49], сообщили об успешной остановке кровотечения из ран селезенки при ее интраоперационном повреждении.
Несомненный интерес представляют публикации, в которых в сравнительном аспекте содержатся некоторые сведения о применении лазерного скальпеля. Так, R. Orda et al. [78], выявили, что после резекции селезенки лучом СО2-лазера через 21-30 суток процессы организации заканчиваются включением в сформированный рубец инкапсулированных частиц, гигантских клеток и глыбок гемосидерина. Полное заживление после применения лазера наступало за три недели.
В.Н. Кошелев с соавт. [28], выполнили СО2-коагуляцию ран селезенки травматического происхождения у 24 больных с сохранением органа.
В результате многолетних исследований были определены противопоказания к применению СО2-лазера при травматических повреждениях. К ним относятся: тяжелое состояние больного, обусловленное шоком или сопутствующими повреждениями, отрыв селезенки от сосудистой ножки, полное размозжение органа, периспленит, разрыв патологически увеличенного органа. Кроме вышеописанных факторов, авторы подчеркивают, что для проведения подобных операций должна быть «настроенность» всего коллектива на сохранение органа [28].
Основными противопоказаниями к сохранению селезенки служат тяжелый шок с нестабильной гемодинамикой, значительное повреждение паренхимы, отрыв селезенки от сосудистой ножки [13,21,55,61].
С.А. Афендулов [8], F.P. Angelecu N. et al. [57], C.I.C. Nei et al. [76] считают, что выполнение органосохраняющих операций менее уместно в случаях шока, при одновременных повреждениях других органов брюшной полости, массивном загрязнении брюшной полости при проникающих ранах, при неконтролируемом артериальном кровотечении, при тяжелых нарушениях системы свертывания крови, при ожирении и преклонном возрасте.
Важно подчеркнуть, что добиться выполнения органосохраняющих операций в ста процентах наблюдений невозможно. Поэтому, в случае невозможности сохранения селезенки, альтернативой такой операции может быть аутолиентрансплантация [15, 41, 48, 54, 70, 85].
Начало экспериментальной разработки этого метода относится к 20-м годам ХХ века, а интенсивные исследования проблемы началось только в 60-е годы.
В настоящее время предложены многочисленные способы аутолиентрансплантации. К ним относят помещение фрагментов селезенки в большой сальник, в карман брыжейки [16, 76] или в мышечный массив забрюшинного пространства [85], кроме того, предложены способы аутолиентрансплантации в брыжейку тонкой кишки, толстой кишки [22].
Среди всех предложенных методик аутолиентрансплантации можно выделить 2 группы, используемые для подготовки селезеночной ткани к имплантации. К ним относится имплантация «кусочков ткани» с сохранением гистологической структуры и без сохранения структуры - имплантация пульпы или клеточной взвеси селезеночной ткани [8, 35].
При имплантации фрагментов ткани селезенки нарезают небольшие фрагменты органа, определенного размера, погружают в жидкость для удаления излишков крови и помещают в брюшную полость. С целью улучшения приживаемости аутолиентрансплантата Н.И. Батвинников и соавт. [11], предлагают промывать кусочки селезенки в физиологическом растворе с добавлением антибиотиков. Операция не занимает много времени [4, 6, 29, 46].
Имплантация пульпы ткани селезенки требует тщательного ее измельчения и обработки в биологически активных жидкостях, что значительно усложняет операцию [1, 2, 23, 30, 38].
И.И. Бабич и соавт. [9], разработали в эксперименте и применили в клинике оригинальный метод геторотопической аутолиентрансплантации в поперечную мышцу живота с прикрытием трансплантата прядью сальника на ножке. Н.А. Кущ и соавт. [30], предложили реплантацию гомогената пульпы селезенки, для приготовления которой использовали специальное устройство.
В работе А.А. Матиненко [35], показано, что процессы регенерации в ткани селезенки проходят три фазы: некробиотическую, восстановительную и структурной регенерации. Вновь образованная ткань селезенки имеет морфологически органо-типическую функцию [4, 41].
Использование гетеротопической аутолиентрансплантации селезеночной ткани у детей в разволокненную поперечную мышцу живота с перитонизацией прядью большого сальника на ножке позволило предупредить тяжелые осложнения и купировать синдром гипоспленизма [9]. Данная методика, по мнению авторов, обладает некоторыми преимуществами: оптимальными условиями питания селезеночной ткани в различные периоды реваскуляризации трансплантата, локализацией его в функциональном месте с участием в портальном кровообращении, перспективой роста «новой селезенки». В то же время получены сведения, что структурные повреждения в аутолиентрансплантате, изменения в его массе и кровообращении могут оказать отрицательное влияние на фагоцитарную активность [81].
В эксперименте было проведено исследование реваскуляризации фрагментов ткани селезенки в серозно-мышечно-подслизистом лоскуте желудка на сосудистой ножке [12]. При этом выявлена хорошая приживаемость имплантата. Авторы полагают, что селезеночная ткань не только замещает функционирующий орган, но и, в определенной степени, стимулирует адаптационно-компенсаторные процессы после спленэктомии, что проявляется реактивной гиперплазией лимфатических узлов уже с первых дней послеоперационного периода. Авторы считают, что имплантант начинает функционировать через 1-2 месяца.
Реимплантированная ткань селезенки в большинстве случаев хорошо адаптируется, о чем можно судить по тому, что тельца Жолли в эритроцитах, появляющиеся в ближайшее время после операции, перестают определяться к концу второй недели после операции [39]. Авторы показывают, что через 1,5-2 месяца трансплантат начинает визуализироваться при сцинтиографическом и ультразвуковом исследовании. В дальнейшем аутолиентрансплантат функционирует нормально, повышенной наклонности к инфекционным заболеваниям у оперированных больных не отмечается [63]. Вместе с тем оценки жизнеспособности и функциональной активности трансплантатов, высказанные после обследования пациентов, перенесших аутолиентрансплантацию, противоречивы. Так, М.М. Абакумов и соавт. [3], И. Фурка и соавт. [51] расценивают жизнеспособность трансплантатов полной. В то же время P. Klaune et al. [68], эффективность ее оценивают как сомнительную.
Существует точка зрения, что аутолиентрансплантация в сальник уменьшает смертность, повышает выживаемость экспериментальных животных [74]. При этом в клиренсе бактерий большую роль играет масса трансплантата и объем перфузионной ткани [83].
В раннем послеоперационном периоде осложнений не было, при этом авторы отмечают нормализацию иммунного статуса, связанную с регенерацией перенесенной ткани селезенки. К сожалению, отсутствуют сведения об отдаленных результатах этой процедуры (инфекционные осложнения, качество жизни, прогрессирование онкопроцесса, долговременная выживаемость). Негативным фактором следует считать возможные воспалительные осложнения самой аутоспленотрансплантации, которые в неотложной и гнойной хирургии могут достигать 30 % при экстраперитонеальном размещении фрагментов селезенки [5].
E. Kunz et al. [69], произвели 35 реимплантаций ткани селезенки в клинике, пересаживая 35-50 % от массы органа. Через год после операции при помощи сцинтиографии подтверждали наличие селезеночной ткани. При радиоизотопном исследовании с помощью эритроцитов, меченных 99 Тс, уже через две недели отмечалось накопление изотопов в зоне трансплантата [58, 84].
Радионуклидное исследование, выполненное J.C. Orlando et al. [79], показало нарастание функциональной активности селезенки, начиная со 2-й до 3-й недели. В то же время гистологические исследования обнаружили начало клеточной пролиферации с 5-й недели, восстановление структуры ткани к 7-й неделе, массы имплантированной ткани к 24-30-й неделе.
Однако, по мнению М.Х.A. Frederic [65], оценка функционального состояния фрагментов селезенки по степени включения в него радиофармопрепарата ( 99 Тс) не является исчерпывающей. В связи со сказанным, очевидно, что требуются более сложные иммунологические исследования.
К противопоказаниям для аутолиентрансплантации относят: наличие остаточных очагов ткани (спленоз, добавочная селезенка) после иссечения органа, тотальное поражение пульпы гнойно-деструктивным процессом, старческий (более 70 лет) возраст пациента [22].
Необходимо отметить, что в последнее время широкое применение нашла спленэктомия с использованием лапароскопической техники. По мнению К.В. Пучкова и соавт. [40], лапароскопическая спленэктомия является альтернативой открытой спленэктомии при гематологических заболеваний, и ее применение позволяет снизить частоту интра- и послеоперационных осложнений, уменьшить послеоперационный койко-день и улучшить качество жизни пациентов. Б.Ю. Цветков и соавт. [52], в качестве абсолютных противопоказаний для проведения таких операций у гематологических больных, относят увеличение размера селезенки более 30 см, гнойное поражение селезенки. Применив данный вид операции у 18 пациентов, авторы сообщают о двух осложнениях гнойно-септического характера, проявляющихся развитием абсцессов брюшной полости. Широкое использование лапароскопической спленэктомии при гематологических заболеваниях отмечено в детской практике [31]. При этом, по мнению А.Ф. Дронова и соавт. [31], применение данной методики позволяет получить отличные функциональные и косметические результаты при отсутствии интра- и послеоперационных осложнений.
Таким образом, вышеизложенное показывает, что практика использования органосохраняющих операций при травматических повреждениях селезенки прошла несколько этапов. Применение таких хирургических вмешательств во многом зависит от технического оснащения операционного блока. Следует подчеркнуть, что, несмотря на большое количество предложенных органосохраняющих операций, до настоящего времени основным вмешательством остается спленэктомия. При этом как альтернатива полному удалению органа все шире применяется аутолиентрансплантация.
Разрыв селезенки
Разрыв селезенки - это нарушение целостности селезенки в результате травматического воздействия. Возникает при ударе в нижнюю часть левой половины грудной клетки или в область левого подреберья. Часто сочетается с повреждением других органов брюшной полости. Проявляется болями в левом подреберье и симптомами кровопотери, обычно наблюдаются признаки раздражения брюшины. Диагноз выставляется на основании клинических проявлений, данных лапароскопии и других исследований. Лечение оперативное - ушивание селезенки или удаление органа.
МКБ-10

Общие сведения
Разрыв селезенки - достаточно распространенное повреждение. Из-за высокой вероятности обильного кровотечения представляет непосредственную опасность для жизни, требует проведения немедленного оперативного вмешательства. Чаще встречается у лиц трудоспособного возраста, что обусловлено их более высокой физической активностью и более высоким риском попадания в экстремальные ситуации.
Разрывы селезенки могут быть изолированными, встречаться в составе сочетанной и множественной травмы (политравмы). Часто наблюдаются одновременные повреждения печени, брыжейки и толстой кишки. Возможно сочетание с переломами ребер, повреждением грудной клетки, переломом позвоночника, ЧМТ, переломом таза, переломами костей конечностей и другими повреждениями. Лечение данной патологии осуществляют травматологи и абдоминальные хирурги.
Причины
Разрыв селезенки встречается при различных высокоэнергетических травмах: падениях с высоты, промышленных, природных, железнодорожных или автодорожных катастрофах. К числу предрасполагающих факторов, повышающих вероятность повреждения селезенки, относятся недостаточно прочная тонкая капсула, полнокровие органа и его малая подвижность. С другой стороны, эти факторы нивелируются тем, что селезенка достаточно надежно защищена от внешних воздействий ребрами. Вероятность разрыва селезенки в результате травмы увеличивается при патологических процессах, сопровождающихся спленомегалией и повышением рыхлости паренхимы. Кроме того, прочность селезенки в некоторой степени зависит от степени ее кровенаполнения, положения органа в момент травмы, фазы дыхания, наполнения кишечника и желудка.
Патанатомия
Селезенка - паренхиматозный орган, расположенный в верхней левой части брюшной полости, кзади от желудка, на уровне IX-XI ребер. Покрыта капсулой. Имеет форму удлиненной и уплощенной полусферы, которая выпуклой стороной обращена к диафрагме, а вогнутой - к органам брюшной полости. Селезенка не относится к числу жизненно важных органов. Является основным источником лимфоцитов, продуцирует антитела, участвует в разрушении старых тромбоцитов и эритроцитов, выполняет функцию депо крови.
Классификация
В абдоминальной хирургии выделяют следующие виды разрывов селезенки:
- Контузия - наблюдается разрыв участка паренхимы при сохранении целостности капсулы органа.
- Разрыв капсулы без значительного повреждения паренхимы.
- Одномоментный разрыв селезенки - одномоментное повреждение капсулы и паренхимы.
- Двухмоментный разрыв селезенки - разрыв паренхимы, за которым через некоторое время следует разрыв капсулы.
- Разрыв капсулы и паренхимы с самостоятельной тампонадой (мнимый двухмоментный разрыв) - разрыв паренхимы быстро «закрывается» сгустком крови и кровотечение прекращается еще до появления выраженной клинической симптоматики. В последующем сгусток вымывается током крови, кровотечение возобновляется.
- Мнимый трехмоментный разрыв - двухмоментный разрыв, за которым через некоторое время следует самостоятельная тампонада, а позже - свободное позднее кровотечение.
Чаще всего наблюдаются одномоментные разрывы селезенки с немедленным возникновением кровотечения в брюшную полость. Двухмоментные разрывы составляют около 13% от общего количества закрытых повреждений селезенки, временной период между моментом травмы и началом кровотечения в брюшную полость колеблется от нескольких часов до 1-2,5 недель. Причиной разрыва капсулы при уже имеющейся центральной или подкапсульной гематоме становится физическое напряжение, чихание, кашель, ходьба, акт дефекации, поворот в постели и другие обстоятельства, вызывающие повышение давления в селезенке.
Большинство разрывов селезенки небольшие, сопровождаются стертой симптоматикой и диагностируются лишь через несколько часов, когда состояние больного ухудшается из-за продолжающейся кровопотери и скопления достаточного количества крови в брюшной полости. Профузное кровотечение с резким нарастанием клинических симптомов чаще наблюдается при двухмоментных повреждениях селезенки.

Симптомы разрыва селезенки
Клиника повреждений селезенки отличается большим разнообразием. Выраженность и наличие тех или иных проявлений зависят от степени разрыва, наличия или отсутствия сопутствующих повреждений, а также времени с момента травмы. Сразу после травматического воздействия может наблюдаться либо нерезкое ухудшение состояния, либо картина острой кровопотери без перитонеальных признаков, свидетельствующих о повреждении паренхиматозного органа. Основными жалобами в первые часы являются боли в районе левого подреберья и верхних отделах живота. Примерно у половины пациентов боли иррадиируют в левую лопатку и левое плечо.
Большинство больных принимают вынужденную позу: на левом боку с поджатыми ногами либо на спине. Брюшная стенка не участвует в акте дыхания. Степень напряжения брюшной стенки и выраженность болевого синдрома при пальпации живота может значительно варьировать как у разных больных, так и у одного и того же пациента в разные периоды после травмы. В отдельных случаях (при коллапсе или шоке) напряжение мышц живота может отсутствовать. Притупление звука в отлогих отделах живота при перкуссии наблюдается только при значительном кровотечении. Через некоторое время после травмы развивается парез кишечника, проявляющийся отсутствием дефекации, задержкой газов и вздутием живота.
Наряду с местными симптомами, наблюдается картина нарастающей острой кровопотери: бледность, липкий холодный пот, снижение АД, учащение пульса, рвота и тошнота, головокружение, прогрессирующая слабость, одышка и шум в ушах. В дальнейшем возможно двигательное возбуждение, сменяющееся потерей сознания, а также учащение пульса свыше 120 уд/мин и снижение АД ниже 70 мм рт. ст. При этом точно установить причину кровотечения на основании одних лишь клинических признаков удается не всегда, поскольку большинство перечисленных выше симптомов (за исключением болей в левом подреберье) непатогномоничны и появляются при любых острых катастрофах в животе.
Диагностика
Анализы крови на начальных этапах обследования малоинформативны, поскольку из-за механизмов компенсации кровопотери состав периферической крови может оставаться в пределах нормы в течение нескольких часов. Диагноз выставляется на основании клинических признаков, данных рентгенографии грудной клетки и рентгенографии живота. На рентгеновских снимках слева под диафрагмой определяется гомогенная тень. Дополнительными признаками разрыва являются ограничение подвижности и высокое стояние левого купола диафрагмы, расширение желудка, смещение левой части ободочной кишки и желудка вправо и книзу. При скудной клинической симптоматике, подкапсульных и центральных гематомах селезенки данные рентгенографии часто неспецифичны. Может потребоваться ангиография, однако этот метод не всегда применим из-за больших временных затрат, отсутствия необходимого оборудования или специалистов.
В настоящее время в связи с широким распространением эндоскопических методов все большее значение в диагностике разрывов селезенки приобретает лапароскопия. Эта методика позволяет не только быстро подтвердить наличие кровотечения в брюшную полость, но и точно установить его источник. При отсутствии эндоскопического оборудования альтернативой лапароскопии может стать лапароцентез - метод, при котором переднюю брюшную стенку прокалывают троакаром (полым инструментом), затем вводят через троакар катетер и выполняют аспирацию содержимого брюшной полости. Данная методика дает возможность подтвердить наличие кровотечения в брюшную полость, но не позволяет установить его источник.
Лечение разрыва селезенки
Кровотечения при подобных повреждениях крайне редко останавливаются самостоятельно, поэтому такая травма является показанием для экстренного хирургического вмешательства. Операция должна быть проведена в как можно более ранние сроки, поскольку нарастающая кровопотеря ухудшает прогноз. При возможности перед началом вмешательства добиваются стабилизации гемодинамики, осуществляя переливание крови и кровезаменителей. Если гемодинамические показатели не удается стабилизировать, операцию проводят даже при тяжелом состоянии пациента, параллельно продолжая осуществлять активные реанимационные мероприятия.
Классическим общепризнанным в травматологии и абдоминальной хирургии способом остановки кровотечения при любых разрывах селезенки считается полное удаление органа. Однако в последние годы, наряду с полным удалением, при отрывах фрагментов и неглубоких одиночных повреждениях некоторые хирурги в качестве варианта рассматривают органосохраняющую операцию - ушивание ран селезенки. Безусловными показаниями к полному удалению органа являются обширные разрывы и размозжения, разрывы в области ворот, обширные рваные и сквозные раны, невозможность надежного ушивания раны и прорезывание швов. В послеоперационном периоде после ушивания или удаления селезенки продолжают внутривенные инфузии крови и кровезаменителей, проводят коррекцию нарушений деятельности различных органов и систем, назначают обезболивающие и антибиотики.
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Закрытая травма живота. Повреждения селезенки. Часть 2
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(2): 4‑10
В XXI веке травма приобрела характер пандемии. В систематическом обзоре литературы [63] приведены данные о том, что ежегодно от травмы погибают 5,8 млн человек, а к 2020 г. эта цифра может вырасти до 8,4 млн. Дорожно-транспортные происшествия являются самой частой причиной смерти людей в возрасте от 15 до 44 лет.
Среди закрытых повреждений органов брюшной полости травма селезенки, по данным разных авторов, составляет от 16 до 50%, занимая по частоте 1-2-е место [11, 14, 27, 57, 77].
Хирургия повреждений селезенки прошла несколько этапов. Спленэктомию выполняли в Китае во втором веке нашей эры [64], однако впервые она была описана в медицинской литературе в 1549 г. [43]. В 1581 г. Viard удалил часть селезенки, выпавшую через колото-резаную рану брюшной стенки [24]. В обоих случаях наступило выздоровление. До 80-х годов прошлого века спленэктомия была единственной операцией при травме селезенки. Так, в руководстве по оперативной хирургии написано: "В связи с этим обстоятельством, характеризующим паренхиматозный орган, кроме спленэктомии, то есть полного удаления селезенки, никакие иные вмешательства на ней не рекомендуются" [15]. Углубление знаний о многочисленных функциях селезенки [18], в том числе иммунной [7, 16, 17], привело к разработке органосохраняющих операций [2, 8, 10] и аутотрансплантации ткани селезенки [1, 19]. После успешного применения консервативной терапии повреждений паренхиматозных органов у детей эта тактика была распространена на взрослых [68].
Морфологические аспекты травмы селезенки, в том числе двухмоментного разрыва, исследованы в работах А.П. Вилька и соавт., М.А. Сапожниковой и I. Riezzo и соавт. [9, 20, 69].
Для повреждения селезенки, особенно патологически измененной, не требуется приложения большой силы. Хорошо известны случаи ее спонтанного разрыва при различных заболеваниях [25, 42, 46, 51, 74, 87]. Прочность селезенки на разрыв на 4 / 5 обеспечивается неповрежденной капсулой [73].

В настоящее время общепринятой является классификация повреждений (Organ Injury Scaling), The American Association for the Surgery of Trauma [58]. Раздел, посвященный повреждениям селезенки, опубликован в 1989 г. и пересмотрен в 1994 г. (см. таблицу ).
Повреждение селезенки можно предполагать, исходя из механизма травмы (удар в левую половину туловища), при наличии переломов VIII-XII ребер слева. K. Boris и соавт. [30] показали, что вероятность повреждения селезенки у пострадавших с переломом пяти и более ребер с левой стороны превышает таковую у пострадавших с переломом от одного до четырех ребер, однако тяжесть повреждения селезенки не коррелирует с количеством сломанных ребер. Клиническая картина разрыва селезенки характеризуется признаками внутрибрюшного кровотечения. Патогномоничным для травмы селезенки считают симптомы Kehr (френикус-симптом, т.е. боль в области левого надплечья и левого плечевого сустава) и ваньки-встаньки (усиление боли в горизонтальном положении больного), хотя они встречаются очень редко [3]. Следует помнить, что у пострадавшего с нарушением сознания и при сочетанной травме с доминирующими повреждениями в других областях тела клиническая картина может быть завуалирована [79]. Следовательно, любому пострадавшему с травмой живота показано инструментальное обследование и клиническое наблюдение.
Возможности и ограничения различных диагностических методов (УЗИ, КТ, лапароцентез и лапароскопия) были обсуждены в предыдущей лекции. По данным анкетирования, более 80% швейцарских хирургов начинают инструментальное обследование при абдоминальной травме с УЗИ [72], и автор лекции поддерживает эту точку зрения. Поскольку методика FAST имеет низкую чувствительность в определении травмы селезенки [35], у гемодинамически стабильных пострадавших при УЗИ необходимо осматривать органы брюшной полости и забрюшинного пространства. Подозрение на травму органов брюшной полости на основании данных УЗИ (в том числе жидкость в брюшной полости и забрюшинное кровоизлияние) является показанием к проведению КТ.
КТ - наиболее точный диагностический способ, позволяющий установить тяжесть повреждения селезенки и обнаружить признаки продолжающегося кровотечения [70]. Использование КТ при травме, по данным F. Swaid и соавт. [77], способствовало существенному уменьшению количества диагностических лапаротомий. Обязательным является внутривенное контрастное усиление и сканирование в артериальную, портальную венозную и отсроченную фазы [31]. В артериальную фазу лучше выявляются повреждения артерий [80], в венозную и отсроченную - продолжающееся кровотечение и разрыв паренхимы. Ложная артериальная аневризма, наличие зоны повышенного накопления контрастного вещества в паренхиме (blush), большое количество жидкости в брюшной полости служат признаками продолжающегося кровотечения [32]. Учитывая риск повторного кровотечения у пострадавших, которых лечат консервативно, многие исследователи рекомендуют выполнять повторную КТ в сроки от 48 часов [55] до 7 сут [60] после травмы.
Лапароцентез и диагностический перитонеальный лаваж в последние годы применяют реже, чем неинвазивные методы диагностики. Показанием к применению лапароцентеза и перитонеального лаважа является неинформативность УЗИ и невозможность выполнить КТ. Считаем необходимым напомнить, что лапароцентез и лапароскопия не позволяют диагностировать центральную гематому селезенки и, следовательно, проводить адекватную этому состоянию терапию. В таких ситуациях интенсивное внутрибрюшное кровотечение при двухмоментном разрыве селезенки оказывается полной неожиданностью как для пострадавшего, так и для хирурга.
Все исследователи считают основным фактором, влияющим на выбор тактики при травме селезенки, показатели гемодинамики [48, 49, 53, 86, 89].
Пострадавшие с нестабильной гемодинамикой и большим количеством жидкости в брюшной полости, по данным УЗИ или положительным результатом лапароцентеза, требуют немедленной лапаротомии [75].
Операция при интенсивном внутрибрюшном кровотечении направлена на спасение жизни, поэтому должна выполняться настолько быстро, насколько это возможно. Автор лекции, имеющий 25-летний опыт экстренной хирургии, в основном хирургии повреждений, считает необходимым напомнить неукоснительную последовательность действий во время лапаротомии у пострадавшего с абдоминальной травмой. Как уже было сказано в предыдущей лекции, универсальным доступом при абдоминальной травме является верхняя средне-срединная лапаротомия.
Лапаротомия, снимая тампонирующий эффект, может приводить к гипотонии. Если снижение давления имеет выраженный или критический характер, а ревизия органов брюшной полости затруднена или невозможна вследствие большого гемоперитонеума, целесообразно прижать кулаком аорту к позвоночнику сразу ниже диафрагмы. Этот прием позволяет добиться некоторой стабилизации гемодинамики, дает дополнительное время на инфузионную терапию и аспирацию крови, которую целесообразно выполнять с использованием аппаратов для реинфузии.
После эвакуации крови из брюшной полости выполняют ее полноценную и быструю ревизию. При необходимости опорожнить желудок устанавливают назогастральный зонд. Тонкую кишку эвентрируют из брюшной полости, а поперечную ободочную оттягивают каудально - это улучшает обзор верхнего отдела брюшной полости. Осматривают и пальпируют органы брюшной полости в следующем порядке: диафрагмальная поверхность правой доли печени и правая половина диафрагмы; висцеральная поверхность правой доли печени и желчный пузырь; диафрагмальная и висцеральная поверхности левой доли печени; левое поддиафрагмальное пространство (селезенка и левая половина диафрагмы). Каждый этап осмотра заканчивают тампонадой правого поддиафрагмального, подпеченочного и левого поддиафрагмального пространств. Затем осматривают абдоминальный отдел пищевода, переднюю стенку желудка с малым сальником, видимую через брюшину часть двенадцатиперстной кишки. После этого проводят ревизию ободочной кишки в направлении от слепой к сигмовидной с одновременным осмотром брюшины латеральных каналов и пальпацией почек. Переместив поперечную ободочную кишку каудально, последовательно, от связки Трейтца до илеоцекального перехода, осматривают тонкую кишку, ее брыжейку и оба брыжеечных синуса. На поврежденные артерии накладывают зажимы Бильрота или сосудистые - в зависимости от необходимости реконструктивной сосудистой операции, сквозные разрывы органов желудочно-кишечного тракта изолируют салфетками, смоченными антисептиком.
После окончания ревизии брюшной полости тампоны удаляют. Промокание тампона кровью свидетельствует о продолжающемся кровотечении и указывает на его возможный источник. Следует подчеркнуть, что полноценная ревизия органов брюшной полости предшествует восстановительному этапу операции. Типичная ошибка молодых хирургов заключается в том, что сначала ушивают то повреждение, которое первым бросилось в глаза, затем продолжают ревизию и снова прерывают ее для репарации другого обнаруженного повреждения и т.д. При такой неправильной последовательности действий травма аорты или нижней полой вены будет обнаружена последней со всеми вытекающими последствиями. О показаниях к ревизии забрюшинного пространства и методах ее выполнения будет рассказано в одной из следующих лекций.
Итак, травма селезенки обнаружена. Что делать? Ключом к любой операции на селезенке являются ее мобилизация и выведение на уровень лапаротомной раны. В отличие от больных с гематологическими заболеваниями, это удается сделать у большинства пострадавших. Попытки выполнить операцию на селезенке в глубине левого поддиафрагмального пространства чреваты дополнительной кровопотерей, плохим гемостазом и травмой хвоста поджелудочной железы. Предложены два способа мобилизации селезенки, условно их можно назвать "передний" и "задний".
"Задний" способ применяют при мобильной селезенке, его легче выполнить у худощавых пациентов и при наличии широкого реберного угла. Мобилизацию начинают со смещения селезенки в сторону лапаротомной раны и пересечения селезеночно-почечной связки. Проникнув указательным пальцем правой руки, а затем и кистью в жировую клетчатку, хирург расслаивает ее, мобилизуя этим селезенку с хвостом поджелудочной железы [5]. Следует подчеркнуть, что во время этого маневра необходимо тыльной поверхностью пальца или кисти ощущать переднюю поверхность почки, это свидетельствует о нахождении "в слое", что исключает дополнительную травму селезенки и поджелудочной железы. Ротация селезенки и смещение ее к лапаротомной ране позволяют быстро наложить зажимы и остановить кровотечение. Поскольку при таком способе мобилизации зажимы нередко накладывают одновременно на "ножку" селезенки и желудочно-селезеночную связку, нужно быть очень внимательным, чтобы не захватить в зажим хвост поджелудочной железы и большую кривизну желудка. Перевязкой и пересечением селезеночно-ободочной и желудочно-селезеночной связок (если это не было выполнено на предыдущем этапе) заканчивают операцию.
Некоторые хирурги [4, 22] считают, что лигирование селезеночной артерии можно сочетать с органосохраняющей операцией на селезенке и это не приводит к увеличению послеоперационных осложнений в виде панкреатита и ишемии селезенки. Другие авторы [86] пишут: ". те селезенки, которые мы раньше могли сохранить во время операции, сейчас мы лечим без операции", поэтому если пострадавшему с травмой селезенки показана операция, то это всегда спленэктомия [90]. В пользу этого свидетельствует также то, что при закрытой травме в отличие от колото-резаного ранения объем внутриорганного повреждения неизвестен и чаще всего больше, чем его наружные проявления.
В своей практической деятельности мы поступаем следующим образом. Если по результатам осмотра принято решение о спленэктомии, кровотечение неинтенсивное, а анатомические условия сложные, мобилизацию проводим по "переднему" способу. Если кровотечение интенсивное и доступ к селезенке технически прост, выбираем "задний" способ. Если предполагается органосохраняющая операция, то селезеночную артерию не перевязываем, а берем на турникет, который снимаем после окончания оперативного приема на селезенке.
Пострадавшим со стабильной гемодинамикой и признаками травмы органов брюшной полости по данным УЗИ проводят КТ и уточняют возможность консервативной терапии. В травматологических центрах первого уровня в 50-75% наблюдений при травме селезенки начинают консервативную терапию [55, 61, 66]. Необходимыми организационными условиями консервативной терапии являются повторные осмотры, лабораторные и инструментальные методы обследования, постоянная доступность операционной и анестезиологической службы [76].
Эндоваскулярная эмболизация - это важная составляющая консервативной терапии [47, 59, 65, 75], хотя ее применяют менее чем в 10% наблюдений [38]. Показания к ангиографии и ее эффективность остаются предметом дискуссий. Большинство авторов полагают, что ангиография показана при IV-V степени повреждения селезенки, продолжающемся кровотечении (blush) [29], сосудистых повреждениях [56]. Некоторые авторы считают дополнительными показаниями к ангиографии гипотонию, не корригируемую инфузионной терапией, и необходимость в повторных гемотрансфузиях [34].
Показанием к эндоваскулярной операции служит обнаружение при ангиографии экстравазации контрастного вещества (в брюшную полость или интрапаренхиматозно), ложной артериальной или артериовенозной аневризмы. Косвенными показаниями являются "обрыв", спазм или тромбоз ветви селезеночной артерии. Существует три метода эмболизации. При проксимальной эмболизации осуществляют окклюзию ствола селезеночной артерии после отхождения от нее ветвей к поджелудочной железе (дорсальной панкреатической артерии). Дистальная (суперселективная) эмболизация предполагает идентификацию и окклюзию только поврежденного сосуда. Сочетание двух методов называют комбинированной эмболизацией. К каждому методу существуют свои показания, однако формат лекции для хирургов не позволяет обсудить этот вопрос. Проксимальная эмболизация более надежна и выполняется быстрее, но после нее чаще возникают осложнения, хотя J. Frandon и соавт. [44], B. Schnüriger и соавт. [71] c этим не согласны. К "большим" осложнениям эмболизации относят повторное кровотечение [88], абсцесс [78] селезенки и сепсис, панкреатит [62], тотальный инфаркт селезенки, к "малым" - инфаркт части селезенки [50]. Общие осложнения ангиографии (повреждение сосуда, нефропатия и пр.) в настоящей лекции также не обсуждаются.
По данным метаанализа J. Requarth и соавт. [66], включившего 10 157 пострадавших, консервативная терапия была успешной в 91,7% наблюдений. Очевидно, что чем строже критерии отбора пострадавших для проведения консервативной терапии, тем лучше ее результаты. Более успешна консервативная терапия повреждений селезенки в травматологических центрах первого уровня, университетских клиниках, стационарах, регулярно использующих ангиографию [28].
Предикторами неудачи консервативной терапии F. Carvalho и соавт. [36] считают общую тяжесть травмы и степень повреждения селезенки. В 2000 г. G. Velmahos и соавт. [81, 82] отмечали, что консервативная терапия при травме селезенки III и более степени и необходимости в переливании 1 л крови менее успешна, к 2010 г. они несколько изменили свое мнение [83] и называли такими факторами уже V степень травмы селезенки и черепно-мозговую травму.
Что делать при неудаче консервативной терапии? Если клиническая картина кровотечения очевидна, альтернативы открытой операции нет. Если продолжающееся кровотечение проявляется увеличением количества жидкости в брюшной полости по данным УЗИ, а гемодинамика продолжает оставаться стабильной, то целесообразно выполнить лапароскопическую спленэктомию [23, 26].
Остановку кровотечения из разрыва селезенки осуществляют с использованием швов, химического (Tachocomb, SURGICEL, 3% раствора натрия тетрадецил сульфата) или физического (ультразвукового, электрического, аргоно-плазменного) воздействия, однако в связи с крайней редкостью подобных наблюдений в этой лекции мы их не рассматриваем.
Аутотрансплантацию фрагментов [19, 45] или ткани [6, 12, 54] селезенки, довольно распространенную в 90-е годы XX века, в настоящее время применяют гораздо реже, поскольку доказать ее практическую пользу не удалось.
Послеоперационные осложнения и осложнения при проведении консервативного лечения пострадавшего с травмой селезенки включают повторное кровотечение, травматический панкреатит, инфильтрат и абсцесс левого поддиафрагмального пространства. Ятрогенная травма большой кривизны желудка может привести к некрозу его стенки, формированию абсцесса и желудочного свища. Лечение этих осложнений осуществляют по общим принципам хирургии. Автор лекции убежден, что тщательное соблюдение всех этапов операции сводит появление таких осложнений к минимуму.
Специфическое осложнение спленэктомии - overwhelming postsplenectomy infection (OPSI), или подавляющая постспленэктомическая инфекция, было описано H. King и H. Shumaker [52] у детей, оперированных по поводу различных гематологических заболеваний. Подавляющую постспленэктомическую инфекцию вызывают инкапсулированные микроорганизмы (пневмококки и менингококки), инфекция развивается очень быстро и приводит к летальному исходу в 50% наблюдений. Подавляющая постспленэктомическая инфекция у взрослых пациентов, оперированных по поводу травмы, в отличие от педиатрической популяции, является казуистикой [37]. J. Wang и соавт. [85] провели телефонный опрос 889 пациентов, перенесших спленэктомию, и обнаружили, что подавляющая постспленэктомическая инфекция имела место у одного из них, что составило 0,1%.
Во многих странах существуют рекомендации для пациентов после спленэктомии или с нефункционирующей селезенкой, которые включают обязательную вакцинацию, информирование и обучение пациентов и антибактериальную терапию, по требованию или постоянную [40], однако проверки показывают, что эти рекомендации плохо соблюдают и врачи, и пациенты [33, 41, 84].
Подводя итог, считаем нужным сказать, что тщательное следование изложенным принципам диагностики и лечения пострадавших с закрытой травмой селезенки позволяет снизить летальность и количество осложнений до минимальных значений. Так, в течение последних 25 лет в Научно-исследовательском институте скорой помощи им. Н.В. Склифосовского смерть больного с закрытой изолированной травмой селезенки является казуистикой.
Читайте также:
- Причины полипоза толстой кишки. Этиология полипов прямой кишки.
- Анатомия: Вены верхней конечности. Поверхностные (подкожные) и глубокие вены руки
- УЗИ, МРТ при синдроме PHACES у плода
- Восстановление слизистой верхнечелюстной пазухи. Ведение раны гайморовой пазухи
- Велоэргометрическая проба. Проведение и оценка велоэргометрической пробы
