Поперечная блокада сердца в послеоперационном периоде. Острый печеночно-почечный синдром
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Блокада сердца представляет собой замедление или полное прекращение прохождения импульсов возбуждения по проводящей системе сердца. Замедление проведения импульса является неполной блокадой, а прекращение его проведения — полной.
Причины возникновения блокады сердца
Блокады сердца могут возникать при:
- поражении сердечной мышцы в результате стенокардии, миокардита, кардиосклероза, инфаркта миокарда, гипертрофии отделов сердца
- повышенных нагрузках на сердечную мышцу (например, у спортсменов)
- при передозировке или неправильном применении некоторых лекарственных средств
- наследственной предрасположенностью
- нарушении внутриутробного развития сердца.
Симптомы блокады сердца
Существует несколько вариантов классификации блокад сердца.
По участку сердца, который не проводит сигнал: выход из синусового узла, АВ-узел, отдельные ветви проводящей системы.
По времени блокады бывают:
- Стойкими, то есть существующими постоянно
- Преходящими, то есть возникающими время от времени
По степени тяжести выделяют:
- блокаду I степени, характеризующуюся проведением импульсов с существенным опозданием
- блокаду II степени (неполная), при которой часть импульсов не проводится вовсе
- блокаду III степени (полную) - импульсы вообще не проводятся.
Все блокады могут быть стойкими (существуют постоянно) и преходящими (возникают лишь в некоторые моменты).
Клинически все блокады сердца проявляются замедлением ритма сокращений. При снижении пульса развиваются обращают на себя внимания периодические обморочные состояния, связанные с недостаточностью кровообращения мозга. Пациенты могут жаловаться на перебои в работе сердца, головную боль и одышку.
Для полной блокаде сердца (пульс ниже 40 ударов в минуту) развивается синдром Морганьи-Эдемса-Стокса, который проявляется судорогами и потерей сознания.
Полная поперечная блокада сердца вызывает быстрое развитие сердечной недостаточности и может привести к смертельному исходу.
Диагностика блокады сердца
При нарушении сердечного ритма нужно обратиться на консультацию к кардиологу, который назначит полное обследование и консультацию врача-аритмолога.
Электрокардиограмма может помочь диагностировать проблему только в момент блокады, что бывает периодически. Именно поэтому в таких случаях рекомендована не обычная ЭКГ, а холтеровское мониторирование и тредмилл-тест. Для уточнения диагноза доктор так же может назначить эхокардиографию
Что можете сделать Вы
При возникновении ощущений перебоев в работе сердца рекомендуется незамедлительно обратиться за консультацией к врачу-кардиологу.
Что может сделать врач
Блокады отдельных ветвей проводящей системы, как правило, не требуют лечения. Однако они могут указывать на наличие какого-либо заболевания сердца, которое нуждается в терапии.
Ряд видов блокад сердца устраняется медикаментозно. Полные блокады чаще всего требуют вживления искусственного водителя ритма и применения временной или постоянной желудочковой электростимуляции.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Острое повреждение почек у больных, подвергшихся кардиохирургическим вмешательствам
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава РФ, кафедра терапии, кардиологии и функциональной диагностики Пензенского института усовершенствования врачей; Пенза, Россия
Острое повреждение почек (ОПП) является серьезным осложнением сердечно-сосудистой хирургии, и его выявляемость в зависимости от диагностических критериев и тяжести ОПП колеблется от 12 до 55%. Развитие ОПП обусловлено многократными воздействиями агрессивных факторов на почки, происходящими до и после операции. ОПП остается сильным независимым фактором повышенного риска прогрессирования хронической болезни почек и ассоциируется высокой госпитальной летальностью и поздними неблагоприятными кардиоваскулярными событиями. Чтобы улучшить долгосрочный прогноз, больше внимания должно быть уделено предотвращению ОПП после операции на сердце. Тяжелое ОПП, требующее проведения почечной заместительной терапии, встречается нечасто, но при этом летальность составляет от 40 до 80%. Это подчеркивает первостепенную важность терапевтических мероприятий, способных сохранять функцию почек в периоперационный период, особенно у пациентов с повышенным риском.
Введение
В современной клинической медицине большое значение придают изучению кардиоренальных коморбидных состояний, исходя из общности факторов риска, патофизиологических механизмов поражений кардиоваскулярной системы и почек, взаимоотягощающего влияния на прогноз и единой стратегии кардиальной и ренальной фармакопротекции 2.
В последние годы возросший интерес клиницистов к данной проблеме определяется также масштабом распространения дисфункции почек у больных сердечно-сосудистыми заболеваниями в общей популяции [1, 5, 6]. Кроме того, расширение спектра кардиохирургических вмешательств и сети оказания высокотехнологичной медицинской помощи населению, а также доступность эндоваскулярных лечебно-диагностических процедур способствовали увеличению риска развития дисфункции почек у лиц с кардиоваскулярной патологией 8.
Выявляемость дисфункции почек у больных, нуждающихся в кардиохирургических вмешательствах
Показано, что 2/3 больных, подвергшихся различным кардиохирургическим вмешательствам, перед операцией имеют нормальную функцию почек [10]. В многочисленных исследованиях выявлено, что у пациентов с исходно интактной функцией почек частота развития послеоперационного острого повреждения почек (ОПП) колеблется от 12 до 25% 12.
В то же время у больных, нуждающихся в кардиохирургических вмешательствах, хроническая болезнь почек (ХБП) диагностируется в 30-55% случаев 15 и из них 1,5-7% больных находятся на заместительной почечной терапии (ЗПТ) 19.
В большинстве случаев после операции на сердце выявляются минимальные и умеренные изменения уровня сывороточного креатинина (SCr) и/или объема/темпа мочеотделения, соответствующие I-II стадиям ОПП по классификации AKIN (Acute Kidney Injury Network) [4, 7, 12, 22]. У больных ХБП в анамнезе чаще наблюдается развитие острой почечной недостаточности, прогрессирование ХБП, в т.ч. необходимость проведения ЗПТ [6, 8, 17].
Также выявлено, что частота ОПП и его тяжесть коррелируют с выраженностью дисфункции почек, имевшейся до выполнения кардиохирургического вмешательства [15, 17, 23].
C.Y. Hsu et al. [24] показали, что у пациентов с ХБП относительный риск развития ОПП в ранний послеоперационный период прогрессивно увеличивается от 1,95 при 3-й стадии ХБП до 40,0 при 5-й стадии по сравнению с 1-2-й стадиями.
В многочисленных исследованиях доказано, что наличие протеинурии у больных, нуждающихся в коронарном шунтировании, служит независимым предиктором развития ОПП, неблагоприятного ближайшего и отдаленного прогноза [15-17, 25]. T.M. Huang et al. [15] при исходной величине скорости клубочковой фильтрации (СКФ) более 60 мл/мин/1,73 м2 диагностировали послеоперационное ОПП в 24% случаев и при величине СКФ, равной 30-44 мл/мин/1,73 м2, - в 38%.
S.G. Coca et al. [16] показали, что еще одним предиктором развития ОПП после сердечно-сосудистих хирургических вмешательств является отношение концентрации альбумина к уровню креатинина в моче. Данный показатель с поправкой на возраст, наличие сахарного диабета 2 типа, величину СКФ и хирургический статус (плановая или экстренная) с высокой вероятностью предсказывает развитие послеоперационного ОПП.
Подходы к диагностике послеоперационного ОПП
Несмотря на стандартизацию определения ОПП, врачи нередко упускают возможности своевременной диагностики ОПП, что приводит к увеличению числа больных прогрессирующей ХБП и смертности [4, 5, 11, 26]. Согласно общепринятым рекомендациям, диагностическими критериями ОПП, на основе которых разработаны классификационные схемы RIFLE, AKIN и KDIGO, служат увеличение SCr более чем на 26,5 мкмоль/л в течение 48 часов или увеличение SCr в 1,5 раза от исходного уровня или в течение предшествовавших 7 суток и/или диурез менее 0,5 мл/кг/ч в течение 6 часов [4, 5, 8]. Следует отметить, что критерии RIFLE и AKIN продемонстрировали высокую чувствительность и в диагностике послеоперационного ОПП [7, 11, 27, 28].
Однако выявлены ограничения определения уровня SCr и/или объема/темпа мочеотделения для диагностики ОПП [5, 10, 26]. Так, повышение уровня SCr в случае развития ОПП по времени отстоит от прямого повреждения почечной ткани и, соответственно, сроки диагностики ОПП отодвигаются на несколько часов или сутки [26, 29]. Также известно, что повышение уровня SCr в ответ на падение клубочковой фильтрации носит инерционный характер, т.е. при снижении СКФ от 90 до 40 мл/мин/1,73 м2 уровень SCr практически не меняется («слепая зона») [10]. По этой причине возникают трудности дифференциальной диагностики больных прогрессирующей ХБП и при развитии ОПП у больных ХБП, что может маскировать развитие ОПП [22, 24]. Кроме того, у больных, находящихся на ЗПТ, диагностика ОПП по критериям объема/темпа мочеотделения и SCr затруднительна, т.к. диализная терапия практически нивелирует диагнос.
Поперечная блокада сердца в послеоперационном периоде. Острый печеночно-почечный синдром
РНЦХ им. акад. Б.В. Петровского РАМН
Клиника аортальной и сердечно-сосудистой хирургии ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России
ФГБУ "Российский научный центр хирургии им. акад. Б.В. Петровского" РАМН, Москва
Риски и возможности профилактики развития острой почечной недостаточности у пациентов после операции на сердце
Цель исследования — проанализировать частоту острой почечной недостаточности (ОПН) с попыткой сформировать «простые критерии», увеличивающие риски этого осложнения, сравнить частоту сопутствующих осложнений в послеоперационном периоде относительно тяжести ОПН. Материал и методы. Проведен анализ результатов лечения 152 больных, оперированных по поводу поражения клапанов сердца и сопутствующей сердечной патологии. У 50 (32,8%) больных развилась ОПН. Они составили основную группу. Больные (n=102) без ОПН включены в контрольную группу. Результаты. Выявлено, что пациенты основной группы были старше (61,8±9,6 года против 53,1±13,3 года), чаще страдали ишемической болезнью сердца (ИБС) (36,0% против 23,5%), гипертонической болезнью (ГБ) 3-й степени (54,0% против 30,4%), сахарным диабетом (18,0% против 7,8%). У них была большая продолжительность искусственного кровообращения (ИК) (133,2±48,6 мин против 118,5±53,8 мин) и чаще проводились ритмконвертирующие вмешательства (20,0% против 9,8%). Пациенты с ОПН имели более высокую летальность (10,0% против 2,9%) и чаще требовали катехоламиновой поддержки (18,8% против 8,8%). Оценка рисков сопутствующих осложнений относительно тяжести ОПН показала увеличение летальности в сравнении с контрольной группой в стадиях Injury и Failure (по классификации RIFLE) в 4 и 17 раз соответственно. Показано, что при наличии компрометированной почки (КП) развитие почечной дисфункции начинается через 60 мин ИК, а без нее — примерно через 100 мин ИК. Также при увеличении времени ИК возрастают риски развития тяжелых стадий ОПН.
Острая почечная недостаточность (ОПН) после операций на сердце является достаточно частым осложнением. Она встречается у 19—45% больных, перенесших искусственное кровообращение (ИК) [8], а при ее развитии риски летального исхода увеличиваются от 3 до 18 раз [9, 12]. В последние годы в мировой литературе публикуют большое количество работ, посвященных этой проблеме. В то же время все публикации сводятся преимущественно к оценке причин развития ОПН с использованием регрессионного анализа. Нами проведен анализ частоты ОПН с попыткой сформировать «простые критерии», увеличивающие риски этого осложнения. Проведено сравнение частоты сопутствующих осложнений в послеоперационном периоде относительно тяжести ОПН.
Материал и методы
В исследование включены 152 больных, которым в период с 2007 по 2012 г. в отделении кардиохирургии УКБ № 1 Первого МГМУ им. И.М. Сеченова выполнена коррекция порока клапанов сердца.
Операции на сердце выполняли через срединную стернотомию. Подключение искусственного кровообращения (ИК) проводили по общепринятому методу. Спонтанная гипотермия использована нами у 118 (77,6%) больных, охлаждение до 32 °C — у 34 (22,4%). Во время операции, по возможности, корригировали всю сердечную патологию. Таким образом, коррекция митрального клапана (МК) выполнена у 90 (59,2%) больных, аортального (АК) — у 80 (52,6%) больных. Из них одномоментная коррекция обоих клапанов была выполнена у 18 (11,8%) больных. Сопутствующую пликацию левого предсердия при его значимом увеличении провели 39 (25,7%) больным, ритмконвертирующую операцию — 20 (13,2%), шунтирование коронарных артерий выполнено у 33 (21,7%).
Для проведения статистической обработки материала мы использовали пакеты программ Microsoft Office 2007 и STATISTICA 8.0. Для сравнения непараметрических переменных использован χ 2 тест и точный тест Фишера, для оценки параметрических переменных — тест Манна—Уитни. Для обнаружения зависимостей проведен корреляционный анализ. Статистическую значимость считали как p≤0,05.
Результаты
У 50 (32,8%) больных были выявлены признаки острого повреждения почек. Для их оценки мы использовали классификацию RIFLE, разработанную в 2007 г. [14]. Этих пациентов мы включили в основную группу. Пациенты без признаков ОПН после операции были включены в контрольную группу (табл. 1). Средний возраст в 1-й группе составил 61,8±9,6 года, и он был достоверно больше, чем в контрольной — 53,1±13,3 года (p<0,001). Гипертоническая болезнь 3-й степени, ишемическая болезнь сердца (ИБС), сахарный диабет (СД), большой индекс массы тела (ИМТ) также чаще встречались у больных с ОПН (p<0,05).
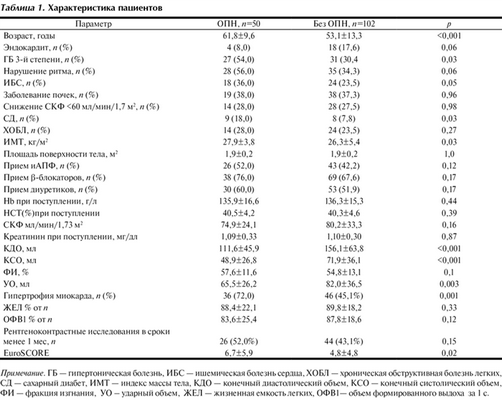
Таблица 1. Характеристика пациентов Примечание. ГБ — гипертоническая болезнь, ИБС — ишемическая болезнь сердца, ХОБЛ — хроническая обструктивная болезнь легких, СД — сахарный диабет, ИМТ — индекс массы тела, КДО — конечный диастолический объем, КСО — конечный систолический объем, ФИ — фракция изгнания, УО - ударный объем, ЖЕЛ — жизненная емкость легких, ОФВ1— объем формированного выдоха за 1 с.
Интраоперационная информация представлена в табл. 2. По объемам операции и частоте дополнительных хирургических процедур группы были сопоставимы. Исключение составляет коррекция ритма (p=0,04), которую в нашем исследовании проводили по методике Maze 3 или Maze 4 [1, 21]. Можно предположить, что это связано с тем, что после подобной процедуры большинство пациентов несколько дней имеют узловой ритм с частотой 40—60 уд в 1 мин и нуждается в электрокардиостимуляции. Нестабильность гемодинамики способствует развитию преренальной почечной недостаточности.
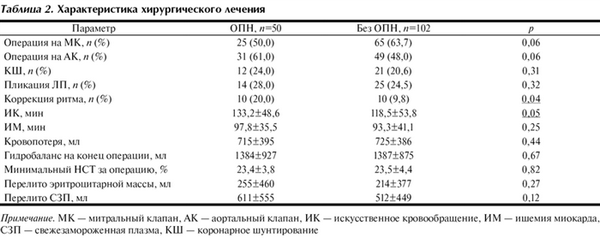
Таблица 2. Характеристика хирургического лечения Примечание. МК — митральный клапан, АК — аортальный клапан, ИК — искусственное кровообращение, ИМ — ишемия миокарда, СЗП — свежезамороженная плазма, КШ — коронарное шунтирование
Длительность ИК была больше в группе с ОПН (p=0,05), при этом время ишемии миокарда (ИМ) остается схожей, что говорит о зависимости между повреждением почек и длительностью использования ИК, а не от длительности ИМ.
Частота послеоперационных осложнений выше у пациентов с ОПН (табл. 3). Манифестация ОПН на фоне использования катехоламинов может отражать два альтернативных сценария: введение катехоламинов для коррекции проявлений сердечно-сосудистой недостаточности (ССН) запускает процессы, приводящие к ишемии почек, или наоборот, на фоне развившейся ОПН возрастает уровень шлаков крови, что ведет к снижению сосудистого тонуса и падению артериального давления (АД). Кроме того, повышение уровня калия крови проявляется различными нарушениями ритма и проводимости сердца, в том числе с нестабильной гемодинамикой. Частота летальных исходов при ОПН в нашем исследовании в 3 раза выше по сравнению с контрольной группой (p=0,03).

Таблица 3. Результаты хирургического лечения
Для детальной оценки зависимости между степенью ОПН и частотой других осложнений мы разделили всех больных этой группы на подгруппы по классам в соответствии с рекомендацией RIFLE (табл. 4). При анализе полученных данных выявили, что наиболее часто развивается 1-я стадия (risk) ОПН, ее наблюдали у 27 (54%) больных. Частота осложнений в этом случае сходна с пациентами без ОПН. 2-я стадия (injury) развилась у 17 (34%) больных. При этом резко возросла потребность в катехоламиновой поддержке (p<0,05) и увеличилась летальность в 4 раза относительно контрольной группы (p<0,05). При развитии последней стадии, характеризующейся утратой функции почки, отмечается увеличение частоты потребности в катехоламинах в 2 раза, дыхательной недостаточности — в 4 раза, энцефалопатии в 3 раза относительно предыдущей подгруппы (p<0,05). Частота летальных исходов в 17 раз выше, чем в группе без ОПН (p<0,05). У 6 (12%) больных с ОПН встречена 3-я стадия (3,9% относительно всей популяции этого исследования).
Таблица 4. Частота осложнений относительно степени повреждения почек по классификации RIFLE Примечание. * — p
Проанализировали частоту развития ОПН по стадиям относительно длительности ИК (рис. 1). С малой (до 90 мин) длительностью ИК развиваются только первые 2 стадии, примерно в одинаковом объеме. Далее, при увеличении времени ИК начинает увеличиваться частота критического повреждения почек, и при превышении 3 ч она занимает примерно 1/3 от всех случаев ОПН (p<0,05).
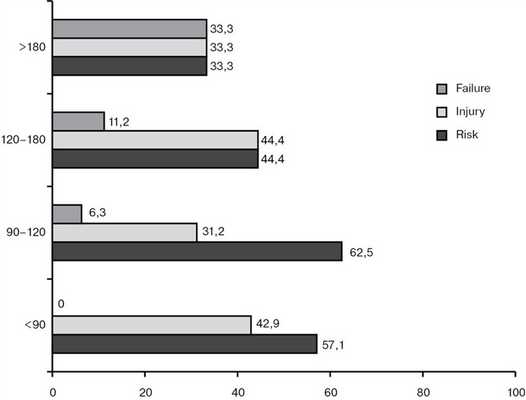
Рис. 1. Частота развития ОПН относительно времени ИК.
При детальном анализе историй болезни мы заметили закономерность: при наличии исходного поражения почек (любое органическое заболевание или снижение СКФ менее 60 мл/мин/1,73 м 2 ) ОПН возникает раньше, чем при исходно здоровой почке (рис. 2). Такую почку мы назвали компрометированной (КП), в ней ишемические процессы, приводящие к ОПН, возникают уже через 60 мин по сравнению со здоровой почкой, у которой эти процессы развиваются после более 1,5 ч И.К. Причем более тяжелые стадии ОПН тоже развиваются раньше.
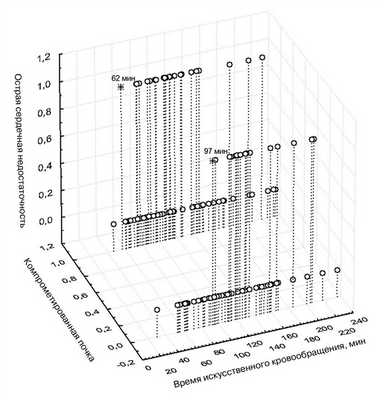
Рис. 2. Анализ зависимости между длительностью ИК и развитием ОПН при наличии компрометированной почки.
В этом исследовании ОПН диагностирована у 50 (32,8%) больных. Высокая частота встречаемости этого осложнения говорит о клинической значимости выявления предикторов и причин его развития. В ряде исследований [16] показано, что операции на клапанах сердца ассоциированы с повышенным риском развития ОПН, в отличие от изолированного коронарного шунтирования (КШ). В то же время широко обсуждается вопрос о взаимосвязи мультифокального атеросклероза, повышения АД и развития ОПН [5, 9]. В нашем исследовании было показано, что ГБ 3-й степени встречалась чаще у пациентов с ОПН (p=0,03). Учитывая, что тяжелая гипертоническая болезнь приводит к прогрессированию атеросклеротического процесса и нарушению тканевой перфузии, считаем необходимым проводить коррекцию уровня АД перед хирургическим лечением пациентов.
ИБС, возраст старше 60 лет, наличие СД и ожирения также, по нашим данным, являются предиктором развития ОПН. Все приведенные состояния способствуют развитию ОПН через исходное нарушение микроциркуляции в ткани почки.
А. Kochi и соавт. [11] в своем исследовании показали, что исходная дисфункция миокарда является предиктором ОПН. Эти данные совпадают с нашими. Увеличение размеров камер сердца и гипертрофия миокарда (относительно нормы) свидетельствуют о систолической дисфункции сердечной деятельности, что ухудшает результаты лечения и увеличивает частоту послеоперационных осложнений [4, 7]. Стоит отметить, что мы обнаружили более значимое увеличение размеров камер сердца в группе больных без ОПН. Фракция выброса в обеих группах была одинаковой (р=0,1), но ударный объем был значимо ниже у пациентов с ОПН (p=0,003). Подобные тенденции обусловлены низкой чувствительностью значений фракции выброса у больных с митральной недостаточностью, когда это показатель может даже увеличиваться, несмотря на снижение контрактильной способности миокарда. В то же время ударный объем является более чувствительным параметром для оценки эффективности перфузии организма. Зависимость между ударным объемом и ОПН велика, при снижении объема поступающей крови развивается ишемия нефронов. Для предупреждения последней необходимо длительно наблюдать пациентов с начальными изменениями клапанов сердца и оперировать их на границе, когда есть минимальные показания к операции, но еще нет развития дисфункции миокарда [2].
Длительность ИК в большинстве исследований рассматривают как предиктор развития ОПН после операции на сердце [15, 20]. В нашем исследовании мы также показали такую зависимость (см. табл. 2) (p=0,05). С другой стороны, нам не удалось найти публикации, которые освещали бы зависимость между дооперационными предикторами, длительностью ИК и частотой развития ОПН. Наиболее простой для клинической медицины предиктор — патология почки, использована нами для этой оценки. Причем органическая патология почки не всегда совпадала со снижением СКФ менее 60 мл/мин/1,73 м 2 , что является критерием хронической почечной недостаточности. Таким образом, для упрощения, мы ввели в этом исследовании термин КП, который отражает наличие органической патологии и/или почечной недостаточности. На рис. 2 показано, что при наличии КП ОПН развивается уже через 60 мин ИК, тогда как без нее «безопасная» длительность ИК составляет около 100 мин. Причем, если оценивать тяжесть ОПН, то стадии injury и failure тоже развиваются раньше.
Трансфузия компонентов крови и падение гематокрита менее 21% во время операции считают важными предикторами развития ОПН [6, 10, 17, 18]. В нашем исследовании мы не отметили таких зависимостей. Объемы переливания компонентов крови и минимальный уровень гематокрита во время ИК были схожими.
Развитие ОПН после операций на сердце может увеличивать летальность до 80%, особенно если она проявляется в комплексе полиорганной недостаточности и требует проведения заместительной почечной терапии [3, 13]. В нашем исследовании при ОПН умерли 5 (10%) больных по сравнению с 3 (2,9%) в группе без ОПН. Вне зависимости от тяжести ОПН летальность увеличилась в 3 раза (р=0,03). При развитии ОПН увеличивается и частота потребности в катехоламиновой поддержке (p=0,05). Это отражает зависимость между гемодинамикой и ишемией почек, с одной стороны, и поддержанием водно-электролитного и гуморального обмена почками с изменением тонуса сосудов и активностью сердечной деятельности, — с другой. Интересным остается тот факт, что в нашем исследовании не отмечено статистически значимой разницы в длительности послеоперационного периода, что можно объяснить отсутствием значимого влияния на первичную реабилитацию пациентов, при условии, что в первые часы/дни после операции на фоне ОПН не присоединяется дисфункция других органов.
Для ответа на вопрос, «зависит ли тяжесть ОПН от длительности ИК?», мы составили схему (см. рис. 1), разделив все случаи дисфункции на группы относительно времени И.К. Из представленной схемы видно, что в пределах 90 мин ИК развиваются только первые две стадии осложнений, примерно с равной частотой. В дальнейшем, при увеличении длительности ИК начинает нарастать частота 3-й стадии ОПН, и после 3 ч тяжесть почечной дисфункции достигает своего максимума. При такой длительности только в 1/3 случаев почки находятся в стадии risk, которая не ухудшает ближайших послеоперационных результатов.
После операции на сердце ОПН развивается в 1/3 случаев. С целью оптимизации результатов хирургического лечения следует уделять значительное внимание возможностям предоперационной компенсации состояния пациента, а также с осторожностью относиться к естественному желанию хирурга выполнить максимально полную коррекцию поражений сердца с вероятным ущербом, обусловленным продленным временем ИК. В идеальных условиях операции на сердце должны быть ограничены 90—100 мин ИК.
Острая почечно-печеночная недостаточность: этиология, патогенез и заместительная терапия
В кратком обзоре литературы рассмотрены этиология, патогенез и современные методы заместительной терапии острой почечно-печеночной недостаточности. Отмечается эффективность альбуминового диализа с использованием собственного альбумина больного и плазмофильтрации, сопряженной с адсорбцией и диализом.
- КЛЮЧЕВЫЕ СЛОВА: острая почечно-печеночная недостаточность, альбуминовый диализ, плазмофильтрация, аллотрансплантация печени, acute renal-hepatic failure, albumin dialysis, plasma filtration, liver allotransplantation
Острая почечно-печеночная недостаточность (ОППН) является одной из наиболее распространенных форм полиорганной недостаточности. В 80-90% случаев ОППН приводит к летальному исходу, что обусловлено многоуровневыми связями между почками и печенью, опосредуемыми не только нейрогенным путем, но и многочисленными эндокринными и метаболическими факторами, а также уремическими и печеночными токсинами [1]. Между пораженными печенью и почками формируются «порочные круги», включая сосудистый порторенальный рефлекс, с взаимоускорением дисфункции обоих органов-мишеней и дальнейшим прогрессированием ОППН.
ОППН, манифестирующая острым поражением печени
Наиболее изучена ОППН, манифестирующая острым тяжелым поражением печени с последующим острым почечным поражением и быстрым формированием острой почечной недостаточности (табл. 1). Подобный вариант развития событий может быть индуцирован фульминантной инфекцией [2, 3], алкоголизмом с выраженной портальной гипертензией [4, 5], тяжелой экзогенной интоксикацией [6], лекарствами [7], антифосфолипидным синдромом и наследственной патологией (тромбофилией) [8]. Для фульминантного вирусного гепатита характерны быстропрогрессирующее течение, высокий уровень смертности и быстрый исход в постнекротический цирроз печени у немногих выживших пациентов [9]. Фульминантный лекарственный гепатит проявляется различными формами: некротизирующим гепатитом, стеатогепатитом и холестатическим гепатитом.
Среди неинфекционных причин ОППН преобладают гепаторенальный синдром, отравление дихлорэтаном, четыреххлористым углеродом, токсином бледной поганки, а также острый жировой гепатоз беременных и синдром Бадда - Киари [1].
ОППН, дебютирующая острой почечной недостаточностью
Острая почечно-печеночная недостаточность с первичным острым почечным поражением, вызвавшим острое поражение печени, менее изучена. Данный вариант ОППН часто развивается после тяжелого кардиогенного шока, в послеоперационном периоде при ишемическом поражении почек, остром бактериальном сепсисе и септических формах лептоспироза, сальмонеллеза, crush-синдроме, тяжелой ожоговой болезни [4, 10, 11].
Вероятность летального исхода при сочетанном остром почечно-печеночном поражении в 3 раза выше, чем при изолированном остром печеночном поражении. При этом смертность не зависит от тяжести острого почечного поражения (величины креатинина крови) и дозы стандартной заместительной почечной (диализной) терапии, что обусловлено многообразием механизмов острого поражения печени при остром почечном поражении (острая почечная недостаточность) (табл. 2).
Среди уремических механизмов, повреждающих печень, выделяют метаболический ацидоз [12], снижение синтеза аргинина с накоплением асимметричного диметиларгинина (asymmetric dimethylarginine, ADMA) [13, 14], аккумуляцию индоксилсульфата [15], гиперфосфатемию [16], гиперпродукцию интерлейкина 2 [17].
Лечение и профилактика ОППН
В основе профилактики ОППН - элиминация печеночных и уремических токсинов и токсичных медикаментов, лечение бактериальных, вирусных, паразитарных инфекций, стабилизация центральной гемодинамики, лечение асцита со снижением портальной гипертензии и коррекцией гиповолемии, дегидратации и электролитных нарушений. Лечение ОППН в первую очередь подразумевает проведение экстракорпоральной диализной терапии.
При нарастании печеночно-почечной недостаточности, полиорганной недостаточности, печеночной энцефалопатии с мозговой гипертензией проводится альбуминовый диализ. Альбуминовый диализ также показан при ОППН, хронической и острой печеночной недостаточности, гепаторенальном синдроме, осложнениях травмы и резекции печени, дисфункции печеночного трансплантата [18].
Bо время альбуминового диализа, в отличие от стандартного гемодиализа, элиминируются липофильные печеночные токсины, связанные с белком уремические токсины, включая ADMA, медикаменты, оксид азота, ложные нейромедиаторы центральной нервной системы, провоспалительные цитокины (частично). При этом стабилизируется почечная, центральная и внутримозговая гемодинамика, регрессируют печеночная энцефалопатия, отек мозга и острая печеночная недостаточность [19].
В основе альбуминового диализа лежит гемодиафильтрация с моделированием детоксикации в печени. Акцепторные свойства циркулирующего альбуминового диализата восстанавливает регенерирующий контур с полупроницаемой мембраной (гемофильтром) и колонкой с катионообменной смолой, обеспечивающей карбоперфузию. В зависимости от стабильности гемодинамики, тяжести ОППН и энцефалопатии альбуминовый диализ может проводиться в обычном интермиттирующем и постоянном низкопоточном режимах. Последний режим более эффективен при ОППН с неуправляемой гипотензией и отеком мозга.
Альбуминовый диализ по технологии Prometheus основан на выделении фракции собственного альбумина из плазмы пациента и одновременном осуществлении процедуры гемодиализа. При этом применяется инновационная технология сепарации и адсорбции фракционированной плазмы (fractionated plasma separation and adsorbtion, FPSA) [20].
Альтернативой альбуминовому диализу является метод плазмофильтрации, сопряженный с адсорбцией и диализом (plasma filtration adsorption dialysis, PFAD) [18], который также эффективно контролирует гемодинамику и элиминирует токсины благодаря контакту мембраны и сорбента не с кровью, а с плазмой больного. Альбуминовый диализ и PFAD, замещающие детоксикационые функции почек и печени, способны уменьшить проявления ОППН на срок несколько недель, что при остром воспалительном или токсическом поражении печени может привести к регенерации ее паренхимы и восстановлению функции почек. У больных циррозом печени с гепаторенальным синдромом альбуминовый диализ и PFAD используются как временная мера для подготовки к аллотрансплантации печени.
Безальтернативным методом лечения форм ОППН у пациентов с плохой переносимостью альбуминового диализа, а также у больных с декомпенсированным циррозом терминальной стадии гепаторенального синдрома является аллотрансплантация печени. На сегодняшний день аллотрансплантация печени - это эффективный метод лечения тяжелых форм ОППН. Так, у больных с гепаторенальным синдромом при циррозе печени 5-летняя выживаемость после пересадки составила 70%. У 60% реципиентов печени достигался полный регресс гепаторенального синдрома и восстановление функции почек [5, 21]. При этом у 35% реципиентов наблюдалось отсроченное восстановление скорости клубочковой фильтрации - они нуждались в регулярном гемодиализе в течение 2-3 недель после пересадки [22]. У 40% больных с гепаторенальным синдромом - реципиентов печени - функция почек не восстанавливалась, им требовались пожизненный регулярный гемодиализ или трансплантация почки.
Вот уже несколько десятилетий синдром полиорганной недостаточности (СПОН) остается одной из актуальных проблем современной медицины. Летальный исход при СПОН имеет место более чем у 50-80% кардиохирургических больных, и этот показатель не проявляет тенденции к снижению. Значительное место занимает вопрос о возникновении системного воспалительного ответа (СВО), а в последующем СПОН у больных, перенесших искусственное кровообращение (ИК). Летальность при СПОН во многом зависит от числа вовлеченных в патологический процесс систем органов [2, 4, 5, 7, 9, 12].
Основными задачами при лечении СПОН являются снижение влияния интраоперационных факторов риска (длительное ИК, массивная кровопотеря и гемотрансфузия, нарушение системы коагуляции), оптимизация транспорта и потребления кислорода, нутритивная поддержка, иммунокоррекция, коррекция гиперметаболизма и синдрома кишечной недостаточности, экстракорпоральная детоксикация [1, 2, 4-7]
Материал и методы
В РНЦХ им. акад. Б.В. Петровского в течение
10 лет проводилось исследование, целью которого было изучение этиологии, патогенеза, клинико-лабораторной диагностики, методов профилактики и лечения СПОН у больных после кардиоваскулярных операций в условиях искусственного кровообращения (ИК).
Проведен анализ наблюдений за 4383 больными в возрасте от 16 до 75 лет (77% мужчин и 23% женщин), оперированными в условиях ИК.
Различные интраоперационные осложнения встречались у 430 (9,8%) больных: длительное ИК в сочетании с кровотечением (ИК более 180 мин, объем кровопотери более 20 мл/кг) - 23,3%, массивная кровопотеря (более 40 мл/кг) - 15,8%, длительное и/или повторное ИК (более 170 мин) - 11,7%, периоперационный инфаркт миокарда с нарушениями гемодинамики и/или кардиогенный шок (КГШ) - 12,5%, аллергические реакции и анафилактический шок - 9%, нарушения в системе гемостаза - 16%, синдром острого повреждения легких (СОПЛ) на фоне ДВС-синдрома, гемолиза, кровотечения и других причин - 11,7%.
Среди этих больных у 224 (52,1%) в послеоперационном периоде отмечена дисфункция органов и систем, у 206 (47,9%) дисфункция органов переросла в полиорганную недостаточность.
Таким образом, СПОН отмечалась у 4,7% больных, перенесших операции в условиях ИК.
Описанные выше причины приводили к активации системного воспалительного ответа (СВО), одним из признаков которого является стимуляция выработки про- и противовоспалительных цитокинов, а также нарушение их баланса.

Сравнительная характеристика больных со СПОН и без СПОН (группы сопоставимы по полу, возрасту и виду выполненных оперативных вмешательств) представлена в табл. 1.
Активация СВО при операциях в условиях ИК
Данный факт свидетельствует, о том, что у больных с послеоперационным СПОН существенное значение имеет дисбаланс между про- и противовоспалительными цитокинами, выброс провоспалительных цитокинов преобладает над выбросом противовоспалительных.
Дисфункция органов и систем
В генезе развития тканевой гипоксии при СПОН имеет место сочетание нескольких факторов: депрессии контрактильной функции миокарда и нарушения периферической циркуляции с ограничением экстракции кислорода, которая обусловлена вазодилатацией, микроэмболизацией и интерстициальным отеком.
Главным органом-мишенью при синдроме СВО являются легкие. Основная причина дисфункции легких - повреждение эндотелия [8]. Синдром острого повреждения легких, по нашим данным, был причиной СПОН у 11,4% больных.
При исследовании индекса оксигенации отмечено, что после оперативных вмешательств, осложнившихся СПОН, он снижается до 2,0±0,4. У больных без СПОН индекс оксигенации был достоверно (р=0,05) выше (2,75±0,2), чем у больных со СПОН. К концу 1-х суток индекс оксигенации в обеих группах достоверно не изменялся и составлял 2,3±0,2 и 2,68±0,2 соответственно. Выявлена достоверная корреляция между индексом оксигенации и уровнем выброса провоспалительного цитокина ИЛ-8 (r=0,848 при р=0,000, метод Спирмена).
Недостаточность сердечно-сосудистой и респираторной систем ведет к развитию тканевой гипоксии, при этом сама тканевая гипоксия является мощным триггером воспалительного ответа.
У всех больных с интраоперационными осложнениями после операции отмечается увеличение уровня лактата (8,5±1,2 ммоль/л у больных со СПОН, 4,3±0,6 ммоль/л у больных без СПОН). Максимальное его значение фиксируется через 6 ч после оперативного вмешательства (10,2±0,8 и 4,9±0,9 ммоль/л соответственно). В последующем уровень лактата постепенно снижался, а через сутки после операции в группе больных без СПОН возвращался к значениям физиологической нормы, у больных со СПОН оставался повышенным (1,7±0,2 и 5,0±0,9 ммоль/л соответственно; р≤0,05).
Найдена достоверная взаимосвязь между показателем интенсивности хемилюминесценции и уровнем лактата артериальной крови (r=0,8 при р=0,001).
Помимо этиологического фактора, в патогенезе печеночной недостаточности большую роль играют ишемия и СВО 10. Образующиеся в ходе цитокинового каскада интерлейкины начинают уничтожать не только поврежденные ткани печени, но и здоровые, возникает поражение печени по типу острой аутоиммунной реакции. Острую печеночную недостаточность необходимо рассматривать в качестве клинико-биохимического понятия, так как сам по себе цитолитический синдром служит лишь основой для ее возникновения.
В процессе нашего исследования были изучены показатели биохимии сыворотки крови. Средние значения общего билирубина, сывороточных ферментов (АсТ, АлТ, КФК, ЛДГ), a-амилазы, креатинина крови у больных с наличием СПОН были достоверно выше, чем у больных без СПОН.
Среди причин возникновения почечной недостаточности у больных после операций с ИК следует выделить кровотечение, образование «третьего пространства», снижение минутного объема сердца, обструкцию почечных артерий (преренальные), поражение почечного интерстиция и почечных канальцев (ренальные), ишемию и эндо- и экзотоксикоз, механические (тромбоз микроциркуляторного русла). При превалировании острой почечной недостаточности в структуре СПОН в качестве прогностического биомаркера может быть использован нейтрофильный желатиназа-ассоциированный липокалин (NGAL). У этой категории больных средние его значения достигают в динамике 800-3000 нг/мл, в то время как у остальных больных со СПОН они колеблются на уровне 34-140 нг/мл. Интересно отметить, что столь высокие показатели NGAL также наблюдаются в первые несколько суток у больных после трансплантации трупной почки.
У 75% больных со СПОН были выявлены нарушения моторики ЖКТ с развитием динамической кишечной непроходимости. У 18 (21,4%) больных с нарушением функции ЖКТ диагностирован геморрагический гастрит и стресс-язвы различной локализации.
В нашем исследовании дисфункция центральной нервной системы отмечена у 69% больных. Основными проявлениями нарушения ее деятельности были метаболическая энцефалопатия - 92,5%, эпилептические припадки - 4,2%, острое нарушение мозгового кровообращения - 3,3%.
В процессе исследования были выявлены основные клинико-лабораторные признаки, характеризующие развитие СПОН и ведущие к неблагоприятным исходам послеоперационного течения: уровень лактата артериальной крови через 12-16 ч после операции более 5 ммоль/л, уровень глюкозы более 10 ммоль/л, 2-3-кратное повышение уровня сывороточных ферментов и креатинина крови через 12-16 ч, повышение уровня прокальцитонина до 3-4 нг/мл ко 2-м суткам, содержание С-реактивного белка более 50 мг/л.
Влияние количества пораженных систем органов на тяжесть состояния больных и число летальных исходов
Частота СПОН при поражении разного количества систем органов колебалась от 8 до 58%.
Степень тяжести органной дисфункции и летальность были минимальными в группе с поражением трех систем органов (7,6±0,4 балла и 13%). С увеличением числа пораженных систем органов летальность возрастает (10,7±0,4 балла и 31%, 13,5±0,7 балла и 47%) и достигает максимальных величин в группе с недостаточностью 6-7 систем органов (15,3±0,5 балла и 70%). Данные факты подтверждает достоверная корреляция (r=0,680 при р=0,05) между числом больных со СПОН и тяжестью состояния по шкале Маршалла при поражении различного числа систем органов и достоверная взаимосвязь между тяжестью состояния больных и показателем летальности при СПОН.
По количеству пораженных органов и систем, а также причинам, приводящим к возникновению СПОН, больные были разделены на 2 группы: 1-я (n=275) - с поражением более 5 органов и систем (длительный период ИК с кровопотерей, массивная кровопотеря, ИМ/КГШ, ДВС-синдром, анафилактический шок), 2-я (n=155) - с поражением 3-5 органов и систем (аллергические реакции, СОПЛ, гемолиз, длительный период ИК).
В 1-й и 2-й группах была изучена степень поражения систем органов в зависимости от причин возникновения СПОН. Как видно из табл. 2, тяжесть поражения органов и систем под влиянием осложнений в 1-й группе выражена достоверно больше, чем во 2-й.
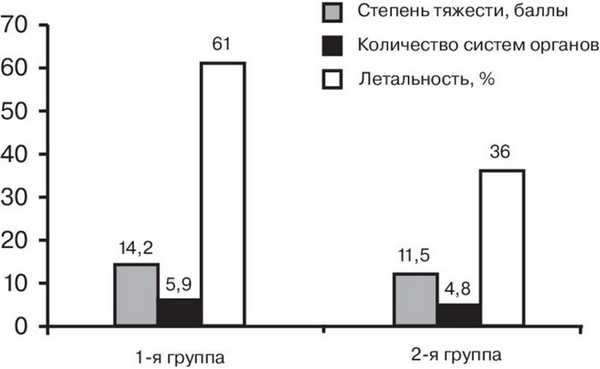
В послеоперационном периоде состояние больных 1-й группы было достоверно (р=0,05) тяжелее, чем 2-й, и летальность - выше в 1,7 раза (см. рисунок). Рисунок 1. Сравнение степени тяжести состояния, количества пораженных систем органов и летальности (p<0,05).
Подводя итог анализу степени тяжести течения послеоперационного периода у больных со СПОН после операций с ИК, можно сделать заключение, что основными причинами возникновения органной дисфункции следует считать не отдельно взятое осложнение, а чаще всего параллельно возникающий каскад нарушений гомеостаза, тип оперативного вмешательства, число заинтересованных систем органов.
У больных с ПОН патогенетически обоснованным является применение экстракорпоральных методов детоксикации (ЭКМД) [3, 9].
Нами ЭКМД были применены в 385 наблюдениях после операций с ИК: при дисфункции органов без развития СПОН - в 100% наблюдений, при наличии СПОН - в 78,2% (161 больной). В 45 (21,8%) наблюдениях по техническим причинам ЭКМД не использовали.
Из методов экстракорпоральной детоксикации изолированный плазмаферез (ПФ) выполняли в 235 (61%) наблюдениях, изолированную вено-венозную ультрагемодиафильтрацию (УГДФ) - в 50 (13%), комбинированную терапию (УГДФ+ПФ) - в 100 (26%) наблюдениях.
Была отмечена высокая эффективность применения раннего и превентивного ПФ в первые 6-8 ч после операции у больных при наличии абсолютных (выраженные аллергические реакции, включая
анафилактический шок, наличие внутрисосудистого гемолиза крови более 150 мг%, развитие ДВС-синдрома) и относительных (длительный, более 160 мин период ИК, массивная кровопотеря с гемотрансфузией, комбинация длительного ИК и массивной кровопотери, сохраняющееся в динамике увеличение уровня лактата артериальной крови, СОПЛ) показаний (табл. 3).
У больных с поражением 5-6 систем органов и тяжестью состояния 13,5 балла и более по Маршаллу применяли комбинированную терапию.
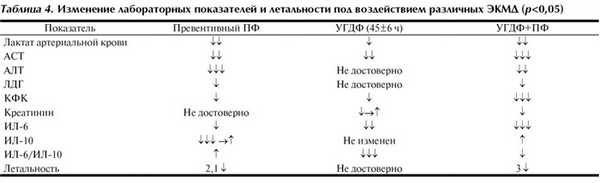
Как видно из табл. 4, наиболее эффективным методом экстракорпоральной детоксикации у больных со СПОН явилось использование комбинированной терапии. Также необходимо отметить, что залогом успеха применения ЭКМД является соблюдение следующих условий: правильность выбора метода, время начала применения, адекватный объем и длительность процедуры.
Соблюдение предложенных условий позволило нам в группе больных со СПОН получить снижение частоты летальных исходов на 8,5% (с 67,8 до 59,3%).
Дальнейшими перспективами в диагностике и лечении СПОН являются поиск и изучение биомаркеров, активное использование сорбционных методов детоксикации, сертификация технологий лечения ПОН, создание единой базы данных по ПОН.
Таким образом, после кардиоваскулярных операций в условиях искусственного кровообращения уровень про- и противовоспалительных цитокинов значительно повышается у всех больных независимо от наличия синдрома полиорганной недостаточности (СПОН) в послеоперационном периоде. У больных со СПОН отмечается дисбаланс между про- и противовоспалительными цитокинами за счет преобладания активности провоспалительного звена системного ответа.
СПОН при сердечно-сосудистых операциях в условиях искусственного кровообращения (ИК) встречается в 4,7% наблюдений. Основными причинами возникновения СПОН являются длительное ИК и кровотечение - 35%, массивное кровотечение - 15,8%, периоперационный инфаркт миокарда и кардиогенный шок - 15%, длительное ИК - 12,5%, синдром острого повреждения легких - 11,7%, ДВС-синдром - 10%, аллергические и анафилактические реакции - 9%, внутрисосудистый гемолиз - 6%.
У больных с осложненным послеоперационным периодом раннее применение экстракорпоральных методов детоксикации позволяет предотвратить возникновение СПОН и в 3 раза снизить летальность (59,3 и 19,2%, соответственно). Комбинированная экстракорпоральная детоксикация дает возможность существенно активировать реакцию системного воспалительного ответа по противовоспалительному типу. Показанием к ее применению является СПОН со степенью тяжести более 13,5 балла и поражением 5-6 систем органов, при этом длительность ультрагемодиафильтрации должна быть не менее 80 ч, а количество сеансов плазмафереза - не менее 3.
Читайте также:
- Синдром Фрайберга-Келера (Freiberg-Kohler)
- Легочная артерия и аорта на рентгенограмме. Причины расширения корня аорты
- Лапароскопия. Показания к лапароскопии. Показания к экстренной диагностической лапароскопии. Противопоказания к лапароскопии. Абсолютные и относительные противопоказания к лапароскопии.
- Диагностика эпидуральной классической гематомы по КТ, МРТ
- Анализ кала на скрытую кровь
