Поражение подкорковых структур. Рисунки ( картинки ) по болезням подкорки.
Добавил пользователь Валентин П. Обновлено: 02.02.2026
Психотические расстройства в виде галлюцинаторного или параноидного синдромов, экстракампильных феноменов (ощущений присутствия или прохождения), иллюзий, синдромов нарушения идентификации, эпизодов спутанности сознания и делирия особенно характерны для деменции с тельцами Леви и болезни Гентингтона, но возможны и при других экстрапирамидных заболеваниях (гепатолентикулярной дегенерации, спиноцеребеллярных атаксиях, болезни Крейтцфельдта-Якоба) [2, 7]. При болезни Паркинсона психотические нарушения чаще возникают на поздней стадии, на фоне выраженных когнитивных нарушений, и провоцируются противопаркинсоническими средствами [7]. Вместе с тем психотические нарушения не следует рассматривать лишь как осложнение лекарственной терапии. Решающее значение имеют клинические предпосылки, возникающие по мере прогрессирования когнитивного процесса. Одной из таких предпосылок является когнитивное снижение. При этом более важное значение, по-видимому, имеет не столько степень общего снижения когнитивных функций, сколько определенный профиль нейропсихологических нарушений, включающий выраженные зрительно-пространственные и лобные дизрегуляторные нарушения [4]. С другой стороны, исследования деменции с тельцами Леви, при которой психотические нарушения возникают в 80% случаев, указывают на значение в развитии психозов дисфункции структур височной доли, особенно ее медиальных отделов, имеющей решающее значение в распознавании зрительных образов [17]. Несомненна связь с поражением медиальных отделов височных долей и бредовых расстройств [3, 17].
В последние годы особую популярность приобрела нейрохимическая гипотеза происхождения психотических расстройств, согласно которой их причиной служит дисбаланс между холинергическими и моноаминергическими восходящими системами. Этот дисбаланс может характеризоваться недостаточностью холинергической системы (обычно вследствие дегенерации базального ядра Мейнерта) и относительным преобладанием дофаминергической и серотонинергической систем либо усилением функции последних вследствие гиперстимуляции дофаминовых или серотониновых рецепторов в коре и лимбической системе [2, 19]. Соответственно, для лечения психотических нарушений могут применяться не только блокаторы дофаминовых рецепторов (нейролептики), но и антисеротониновые препараты и центральные холиномиметики. При некоторых заболеваниях (например, мультисистемной атрофии, прогрессирующем надъядерном параличе, кортикобазальной дегенерации) психотические нарушения возникают исключительно редко, возможно, из-за отсутствия выраженного холинергического дефицита в лимбической системе и/или коре [2, 23]. В любом случае психотические нарушения можно рассматривать как своего рода маркер нейродегенеративных заболеваний, связанных с формированием телец Леви.
Таким образом, при патологии базальных ганглиев, тесно связанных с корковыми и лимбическими структурами, помимо двигательных нарушений возникает сложный комплекс когнитивных, эмоционально-личностных, а иногда и психотических расстройств, которые оказывают существенное влияние на жизнедеятельность больного. Своевременная диагностика психических расстройств имеет важное значение для оценки трудоспособности больного, прогноза заболевания, планирования лечебных и реабилитационных программ.
Общие подходы к лечению
Лечение большинства пациентов с экстрапирамидными заболеваниями на сегодняшний день, к сожалению, сводится к чисто симптоматической терапии, в первую очередь предполагающей воздействие на определенные нейромедиаторные системы. Хотя коррекция когнитивных и других психических расстройств является важнейшим резервом повышения качества жизни пациентов с экстрапирамидными заболеваниями и ухаживающих за ними лиц, в целом подходы к ней остаются недостаточно разработанными [21]. Для коррекции когнитивных нарушений, достигших степени деменции, показано применение ингибиторов холинэстеразы (галантамина, ривастигмина, донепезила) и мемантина, однако их эффективность установлена лишь при болезни Паркинсона и деменции с тельцами Леви [18]. Для коррекции депрессии и тревожных расстройств (включая обсессивнокомпульсивный синдром) могут применяться антидепрессанты различных фармакологических групп. Коррекция поведенческих нарушений, помимо антидепрессантов, может включать применение атипичных нейролептиков (таких как клозапин или кветиапин) и малых доз антиконвульсантов, обладающих нормотимическим действием (например, карбамазепина) [17]. В некоторых случаях коррекция нейропсихиатрических симптомов невозможна без изменения схемы лечения моторных расстройств. С другой стороны, адекватная коррекция психических нарушений может позволить довести дозу средств для лечения двигательных симптомов до эффективного уровня. Подобные коллизии особенно типичны для поздней стадии болезни Паркинсона. В любом случае терапия когнитивных и нейропсихиатрических расстройств должна быть сугубо индивидуальной и учитывать переносимость и достигаемый клинический эффект.
Литература
* Неврология, нейропсихиатрия, психосоматика. - 2012. - Спецвыпуск №2. - С. 22-30.
Экстрапирамидная дизартрия ( Подкорковая дизартрия )
Экстрапирамидная дизартрия — это расстройство произносительной стороны речи, обусловленное мышечно-тоническими нарушениями и гиперкинезами артикуляционных органов. Характеризуется изменчивым нарушением плавности, внятности, ритмичности и выразительности речи, зависящими от психоэмоционального состояния больного. Экстрапирамидная дизартрия диагностируется по клиническим данным, верификация основного диагноза требует проведения нейровизуализации, исследования церебральной гемодинамики, анализа ликвора, психологического тестирования. Лечение включает этиопатогенетическую терапию основного заболевания и логопедическую коррекцию.
МКБ-10
Общие сведения
Экстрапирамидная (подкорковая) дизартрия связана с дисфункцией экстрапирамидной системы, отвечающей за регуляцию мышечного тонуса, непроизвольных движений, поддержание определённой позы. Поскольку основными структурами этой системы являются подкорковые (базальные) ганглии, в практической неврологии дизартрия получила синонимичное название — подкорковая. Характерным является возникновение речевого расстройства на фоне экстрапирамидных нарушений двигательной сферы. Более распространена дизартрия при гиперкинетическом синдроме. Возраст больных варьируется в широких пределах, гендерные различия в заболеваемости отсутствуют.
Причины
Основная причина речевой дисфункции заключается в поражении подкорковых ганглиев, нарушении их связи со структурами коры головного мозга и спинальными трактами. Повреждающими этиофакторами выступают ишемия, травматические, воспалительные, неопластические процессы. Реже встречаются генетически детерминированные дегенеративные поражения, психогенная дисфункция. Основные этиологические факторы подразделяются на следующие группы:
- Травматические. Сотрясение, размозжение церебральных тканей при черепно-мозговой травме оказывают непосредственное повреждающее воздействие на подкорковые структуры. Травмирование возможно в результате нейрохирургических вмешательств, у детей — вследствие родовых травм.
- Инфекционно-воспалительные. Бактериальные, вирусные, грибковые инвазии с проникновением возбудителей в мозговые ткани провоцируют воспалительные изменения и дисфункцию базальных ганглиев. В случае медленных инфекций ЦНС (прогрессирующий краснушный панэнцефалит, подострый склерозирующий панэнцефалит) активация воспалительных процессов в церебральных тканях происходит спустя много лет после перенесённого заболевания (кори, краснухи).
- Неопластические. Агрессивные внутримозговые опухоли (глиомы, медуллобластомы, метастатические новообразования) вызывают разрушение подкорковых тканей. Доброкачественные неоплазии (астроцитомы, ангиоретикулемы) по мере роста приводят к компрессии базальных структур.
- Сосудистые.Хроническая ишемия головного мозга потенцирует постепенное нарастание экстрапирамидных расстройств на фоне церебральной гипоксии. Острый ишемический инсульт обуславливает гибель нейронов ишемизированного участка в результате острых метаболических нарушений. Геморрагический инсульт сопровождается образованием внутримозговой гематомы, сдавливающей близлежащие ткани.
- Токсико-химические. Токсическое поражение базальных структур наблюдается при алкоголизме, отравлении угарным газом, хронических интоксикациях связанных с профессиональной деятельностью. Экстрапирамидная дисфункция может возникнуть вследствие побочного действия или передозировки отдельных фармпрепаратов (нейролептиков, ингибиторов МАО, психостимуляторов).
- Наследственные. Подкорковая дизартрия развивается при генетически детерминированных дегенеративных процессах, затрагивающих базальные узлы. Подобная картина обнаруживается при оливопонтоцеребеллярных дегенерациях, болезни Вильсона.
- Психогенные. Острые и хронические психоэмоциональные перегрузки, стрессовые ситуации способны спровоцировать функциональные нарушения в экстрапирамидной системе, становящиеся причиной гиперкинезов и дизартрии. В отдельных случаях экстрапирамидная дисфункция выявляется при психических расстройствах.
Патогенез
Согласованная работа базальных ганглиев (полосатого тела, чёрной субстанции, хвостатого и красного ядер) обеспечивает регуляцию двигательной сферы и мышечного тонуса. Подкорковая дисфункция приводит к мышечной дистонии, бради- или гиперкинезии. Указанные нарушения затрагивают артикуляционный аппарат (язык, щёки, губы, нёбо, глотку, голосовые связки), что обуславливает возникновение дизартрии. Дистония дыхательной мускулатуры лежит в основе расстройства ритма и глубины дыхания, также участвующего в речевой функции. Неадекватность скорости прохождения воздушной струи через голосовые связки вызывает колебания громкости голоса.
Результатом постоянных неупорядоченных изменений мышечного тонуса является широкое варьирование артикуляционных нарушений, которым характеризуется экстрапирамидная дизартрия. Интенсивное мышечно-тоническое напряжение ведёт к непроизвольному выкрикиванию звуков, падение тонуса — к резкому затруднению принятия и удержания необходимой артикуляционной позы. Речевые сложности усугубляют затрагивающие лицо гиперкинезы.
Классификация
В зависимости от характера поражения подкорковых структур экстрапирамидная дисфункция провоцирует обеднение и замедление произвольных движений (олигобрадикинезии) или возникновение непроизвольных двигательных актов (гиперкинезии). Соответственно, дизартрические проявления носят гипо- или гиперкинетический характер. С учетом данного критерия подкорковая дизартрия разделяется на две основные клинические формы:
- Ригидная — обнаруживается при синдроме паркинсонизма. Речь лишена интонаций, голос глухой, слабый, артикуляция невнятная. Характерно наличие остановок, повторений (персевераций).
- Гиперкинетическая — возникает на фоне гиперкинезов (хореи, атетоза, миоклоний, лицевого гемиспазма, тиков). Проявляется периодически усиливающимся затруднением произношения звуков и слов вплоть до полной неспособности к речевой продукции. Возможна непроизвольная вокализация.
Симптомы экстрапирамидной дизартрии
Речевая дисфункция отличается многообразием, непостоянством нарушений просодики и фонетической стороны речи. Наблюдается тесная взаимосвязь с психоэмоциональным состоянием пациента. В спокойном состоянии, в ситуации психологического комфорта (общение с близкими в домашней обстановке) больной способен чётко произносить отдельные звуки, слова, фразы.
Психологическое напряжение провоцирует тоническое сокращение артикуляционной мускулатуры и резкое затруднение экспрессивной речи. Отмечается невнятность, смазанность произносимых фраз, гнусавый оттенок голоса. Выраженный тонический спазм сопровождается непроизвольным выкрикиванием заднеязычных звуков «кы», «гы». Расстройство речевого дыхания ведёт к диспросодии — изменению мелодичности, плавности, темпа, интонации. Речь становится монотонной, напряжённой, немодулированной, лишенной эмоционального оттенка.
Экстрапирамидная ригидная дизартрия характеризуется постепенным затуханием речевой продукции, трансформацией фразовой речи в неясное бормотание. Гиперкинетическая форма проявляется насильственными движениями, грубо искажающими речь, иногда — полностью прерывающими её. Непроизвольное сокращение мышц языка, лицевой мускулатуры обуславливают насильственную улыбку, открытие рта, высовывание языка. При гиперкинезах диафрагмы и межрёберных мышц возникают выраженные просодические нарушения, насильственные стоны, крики.
Осложнения
Экстрапирамидная дизартрия резко ограничивает коммуникативные возможности больного. Осознание речевого дефекта вызывает волнение при общении с малознакомыми людьми, в непривычной обстановке, что усугубляет выраженность нарушений. Постоянный психологический дискомфорт вследствие невозможности корректно выразить свои мысли может спровоцировать формирование личностных изменений, развитие невротических расстройств (неврастении, ипохондрии, депрессивного невроза). При отсутствии адекватной логопедической поддержки в детском возрасте осложнением может стать фонетико-фонематическое недоразвитие, задержка речевого развития. У школьников повышен риск дислексии, дисграфии.
Диагностика
Верификация речевого дефекта является важным шагом в определении локализации и характера патологического процесса. Экстрапирамидная дизартрия выступает отдельным синдромом, который зачастую включают в формулировку основного диагноза. С целью уточнения вида дизартрии, диагностики базовой патологии применяют следующие диагностические исследования:
- Неврологический осмотр. В ходе консультации невролог оценивает мышечную силу, тонус, рефлексы, уровень координации. Выявляется экстрапирамидная симптоматика: дистония, брадикинезия, наличие гиперкинезов.
- Консультация логопеда. Определяются тонические нарушения артикуляционной мускулатуры, ограничивающие объём и силу участвующих в речеобразовании органов. Дизартрия характеризуется изменчивостью и полиморфностью проявлений.
- Консультация генетика. Необходима при предположении о наследственном характере патологии. Включает анализ генеалогического древа, ДНК-диагностику.
- Томография головного мозга. Назначаются для определения морфологического субстрата заболевания. Компьютерная томография более информативна при травматических повреждениях, не рекомендована детям до 12-летнего возраста. МРТ позволяет визуализировать внутримозговые опухоли, зоны ишемии, геморрагии, дегенеративные изменения, воспалительные фокусы.
- Анализ цереброспинальной жидкости. Забор материала осуществляется в ходе люмбальной пункции. Показанием к исследованию служит предположение об инфекционно-воспалительном характере церебрального поражения.
- Психологическое тестирование. Проводится психиатром, клиническим психологом, психотерапевтом. Направлено на исключение психических заболеваний, психогенного характера дизартрии, оценку уровня психологического дискомфорта вследствие речевого дефекта.
- Оценка церебральной гемодинамики. Производится методами дуплексного сканирования, ультразвуковой допплерографии, МР-исследования сосудов. Показана при подозрении на хронические и острые нарушения мозгового кровообращения.
С учетом результатов текущих обследований к диагностике дополнительно привлекаются онколог, нейрохирург, инфекционист, педиатр, терапевт. Патология требует дифференцировки с иными нарушениями речи, психиатрическими расстройствами, передозировкой некоторых фармпрепаратов. В первую очередь экстрапирамидная дизартрия дифференцируется от псевдобульбарной и бульбарной форм, отличающихся стабильностью речевых нарушений, независимостью их выраженности от эмоционального состояния пациента.
Лечение экстрапирамидной дизартрии
Успешное устранение речевого дефекта неотрывно связано с эффективной этиопатогенетической терапией и последовательной реабилитацией пациента. Для адаптации больного к сложившимся в связи с заболеванием обстоятельствам жизни, повышения мотивации к лечению может потребоваться участие психолога, психотерапевта. Логопедическая коррекция является составной частью комплексной терапии, включающей три основные составляющие:
- Этиотропное лечение. По показаниям проводится антибактериальная, антимикотическая, противовирусная терапия, лечение специфических инфекций (туберкулёза, сифилиса). При наличии неоплазии, гематомы, абсцесса рассматривается вопрос их нейрохирургического удаления. При необходимости назначаются препараты, улучшающие церебральный кровоток и реологические свойства крови, осуществляется дезинтоксикация.
- Терапия экстрапирамидных расстройств. В лечении гиперкинетического синдрома дифференцированно применяются холинолитики, вальпроаты, бензодиазепины, нейролептики, инъекции ботулотоксина. Препаратами выбора при паркинсонизме являются агонисты дофаминовых рецепторов, ингибиторы МАО, леводопа. Резистентные к фармакотерапии выраженные гиперкинезы считаются показанием к электростимуляции вентролатерального таламического ядра.
- Логопедические занятия. Направлены на коррекцию экспрессивной речи: развитие амплитуды и переключаемости артикуляционных движений, нормализацию речевого дыхания, синхронизацию артикуляционных, дыхательных и мимических движений. Проводится дыхательная и артикуляционная гимнастика. Занятие рекомендовано начинать с логопедического массажа.
Прогноз и профилактика
Эффективность логопедической коррекции и общий исход заболевания зависят от причины патологии. Наиболее неблагоприятный прогноз отмечается при злокачественных церебральных неоплазиях и прогрессирующих дегенерациях. В остальных случаях комплексное лечение и регулярные логопедические занятия позволяют ослабить выраженность речевого дефекта. Профилактика направлена на предупреждение факторов, обуславливающих поражение базальных ганглиев: нейроинфекций, травм, онкогенных и токсических воздействий, цереброваскулярной патологии.
4. Об одном из вариантов подкорковой дизартрии у взрослых пациентов/ Колесникова Т.С., Гераськина Г.К.// Вестник угроведения. - 2012 - №4 (11).
Кортикобазальная дегенерация
Кортикобазальная дегенерация — это отдельная клиническая форма избирательного дегенеративного процесса с преимущественным поражением лобно-теменной коры и подкорковых ганглиев. Клинические проявления патологии полиморфны, включают паркинсонизм, расстройство праксиса, тремор, миоклонии, фокальные дистонии, речевые нарушения. Диагностируется кортикобазальная дегенерация по результатам неврологического осмотра, нейропсихологического тестирования, ПЭТ и МРТ головного мозга. Этиопатогенетическая терапия заболевания не разработана, лечение симптоматическое.
Кортикобазальная дегенерация (КБД) впервые описана в 1968 году. Заболевание получило название в связи с сочетанием дегенеративных изменений в церебральной коре и базальных (подкорковых) структурах. Наряду с болезнью Альцгеймера, прогрессирующим надъядерным параличом (ПНП), болезнью Пика, мультисистемной атрофией КБД относится к таупатиям, сопровождающимся накоплением тау-протеина в церебральных клетках. Поскольку одним из ведущих клинических симптомокомплексов выступает олигобрадикинезия, в клинической неврологии кортикобазальная дегенерация считается вариантом паркинсонизма-плюс. Точная распространённость КБД неизвестна, отдельные исследования указывают, что патология составляет 0,9% всех случаев паркинсонизма. Пик заболеваемости приходится на возраст 50-60 лет.
Этиологические факторы возникновения КБД, причины избирательного поражения корково-подкорковых структур не определены. Заболевание имеет спорадический характер, по неподтверждённым данным встречаются единичные семейные случаи. Отдельные исследователи предполагают связь патологического метаболизма отдельных внутриклеточных белков с изменениями в генетическом аппарате нервных клеток. Вероятен полиэтиологический характер развития болезни, при котором совокупное воздействие нескольких этиофакторов приводит к реализации генетически детерминированного нарушения.
Основным патогенетическим механизмом признано нарушение белкового обмена в мозговых тканях. Результатом дисметаболизма является агрегация ряда протеинов внутри нейронов, глиальных клеток. Белковые включения изменяют нормальную жизнедеятельность клеток, возможно, запускают механизм их самоуничтожения (апоптоз). Патологический процесс имеет избирательную локализацию, поражаются преимущественно фронто-париетальные области коры, субстанция нигра, стриатум, вентролатеральное таламическое ядро, зубчатые ядра мозжечка. Макроскопическая картина представлена асимметричными атрофическими процессами указанной локализации. Микроскопически определяется уменьшение числа нервных клеток, демиелинизация волокон, внутринейрональные включения тау-белка. Патогномоничным признаком КБД является наличие в зонах поражения неокрашиваемых баллонообразных нейронов.
Симптомы кортикобазальной дегенерации
Клиническая картина отражает прогрессирующее поражение коры и базальных ганглиев. Последовательность развития и сочетание синдромов могут быть различными, что формирует полиморфизм и значительную вариабельность проявлений. Зачастую первым симптомом становится чувство онемения, неловкости в конечности (чаще в верхней), расстройство в ней сложных типов чувствительности: способности узнавать предметы на ощупь (стереогнозис), различать несколько одновременно воздействующих раздражителей (дискриминационное чувство). Указанные изменения распространяются на ипсилатеральную конечность, затем на противоположную сторону. В половине случаев возникает синдром «чужой» конечности (чаще руки) в сочетании с её непроизвольными движениями.
Симптоматика паркинсонизма присутствует у 100% больных, носит асимметричный характер с преобладанием акинетико-ригидных проявлений. Отмечаются иные экстрапирамидные расстройства: различные формы мышечной дистонии, миоклонии, постуральный тремор, реже — хорея, атетоз. У многих пациентов кортикобазальная дегенерация протекает с типичным тоническим состоянием верхней конечности со сгибанием и приведением плеча, предплечья, кисти и пальцев. В ряде случаев больные вынуждены носить мячик в руке, чтобы предупредить повреждение кисти ногтями резко согнутых пальцев. Глазодвигательные нарушения представлены некоторым ограничением амплитуды движений, явный парез взора наблюдается в 20% случаев. Возможны мозжечковая атаксия, лобные симптомы: паратония, сосательный, хватательный рефлексы.
При дебюте симптоматики в нижней конечности нарушения походки появляются на первом году заболевания, при локализации первых проявлений в руке — спустя 3 года. Определяется лобная дисбазия с частыми падениями. Пирамидная недостаточность ограничивается появлением стопных симптомов, гиперрефлексией. В большинстве случаев возникает дизартрия, имеющая смешанный корково-подкорковый характер, в 20-30% случаев — динамическая афазия. У 85% пациентов отмечается апраксия — нарушение программы последовательного выполнения действий. Интеллектуальное снижение обычно развивается после формирования выраженных двигательных нарушений. При этом известны случаи, когда кортикобазальная дегенерация манифестировала когнитивными расстройствами, и деменция являлась ведущим симптомом болезни.
Обусловленные дисбазией падения больного опасны серьёзным травмированием с ушибами и переломами. В последующем прогрессирующий паркинсонизм и апраксия лишают пациента возможности самообслуживания, являются причиной глубокой инвалидности. Локальные мышечно-тонические нарушения осложняются развитием контрактур. Постепенно утрачивается способность самостоятельно передвигаться. Постоянный постельный режим способствует развитию пролежней и целого ряда инфекционных осложнений: цистита, восходящего пиелонефрита, застойной пневмонии, сепсиса.
Кортикобазальная дегенерация диагностируется на основании следующих клинических критериев: L-ДОФА-резистентный паркинсонизм, апраксия, феномен «чужой» конечности, мышечные дистонии, миоклонии, грубый тремор. Постановка диагноза возможна при наличии трёх признаков из шести. Диагноз достоверно верифицируется по данным патоморфологического исследования церебральных тканей. В ходе диагностического поиска осуществляются следующие исследования:
- Неврологический осмотр. В дебюте КБД невролог выявляет локальные сенсорные расстройства, астереогнозис, нарушение кожно-кинестетического чувства одной конечности. В последующем определяется дисбазия, гипокинезия, мышечная ригидность и дистония, нарушения речи, пирамидная недостаточность, гиперкинезы.
- Нейропсихологическое тестирование. Обследование нейропсихолога необходимо для оценки уровня когнитивных нарушений. В типичных случаях кортикобазальная дегенерация отличается поздним развитием деменции, отсутствием психических расстройств. На первый план выходит апраксия сложных двигательных актов.
- Церебральная МРТ. На начальных стадиях МР томография мозга не визуализирует патологические изменения. В период клинического разгара выявляется атрофия, наиболее выраженная в фронто-париетальной коре, таламусе, хвостатом ядре, скорлупе.
- Оценка мозгового кровообращения. Обследование необходимо для дифдиагностики КБД от сосудистого паркинсонизма, дисциркуляторной энцефалопатии. Дуплексное сканирование церебральных сосудов, УЗДГ экстракраниальных и интракраниальных сосудов позволяют исключить хроническую ишемию головного мозга как этиофактор возникшего дегенеративного процесса.
В дебюте симптоматики кортикобазальная дегенерация требует дифференциации с болезнью Паркинсона, в дальнейшем - с клинически сходными опухолями головного мозга, дегенеративными заболеваниями: болезнью Галлервордена-Шпатца, Пика, Альцгеймера, ПНП, деменцией с тельцами Леви. От болезни Паркинсона КБД отличается наличием корковой симптоматики, нарушений речи, резистентностью к ДОФА-терапии. При ПНП выражена офтальмоплегия, отсутствуют миоклонии и очаговая корковая дисфункция. Болезнь Альцгеймера характеризуется преобладанием атрофических и гипометаболических изменений лобно-височной коры.
Лечение кортикобазальной дегенерации
Возможности лечения КБД ограничены, поскольку этиология заболевания остаётся неясной. Применяется преимущественно симптоматическая терапия. Терапевтическая схема, способная остановить прогрессирование дегенерации, пока отсутствует. Лечение направлено на облегчение состояния пациента, уменьшение выраженности симптоматики. Общепринятой считается комбинированная терапия с включением следующих составляющих:
- Антипаркинсоническое лечение. У части больных фармпрепараты L-ДОФА дают умеренный эффект в течение нескольких лет, поэтому терапию начинают с их применения. В некоторых случаях эффективны агонисты дофаминовых рецепторов.
- Симптоматическая терапия. При выраженном интенционном треморе, миоклониях назначают клоназепам, при постуральном треморе — бета-адреноблокаторы. Прогрессирующая афазия выступает показанием к применению ингибиторов холинэстеразы. Снятию мышечного тонического напряжения при фокальных дистониях способствует инъекционное введение ботулотоксина.
- Лечебная физкультура. Специальная лечебная гимнастика необходима для профилактики развития контрактур суставов. Упражнения облегчают состояние при мышечных дистониях, помогают продлить двигательную активность пациента.
Кортикобазальная дегенерация характеризуется неуклонным прогрессированием неврологических проявлений. В среднем спустя 5 лет когнитивные и двигательные расстройства приковывают больного к постели. Продолжительность жизни большинства пациентов не превышает 10 лет от времени дебюта симптоматики. Причиной летального исхода обычно становится бронхопневмония. Разработка профилактических мероприятий не представляется возможной до момента установления этиологии КБД.
1. Синдром кортико-базальной дегенерации с первичной прогрессирующей афазией/ Яхно Н.Н., Дроконова О.О., Яворская С.А., Воскресенская О.Н. , Дамулин И. В.// Неврологический журнал. - 2014.
2. Экстрапирамидная система, координация движений и их расстройства: Учебное пособие/ Ермолаева А.И., Баранова Г.А. - 2015.
Гиперкинезы
Гиперкинезы — избыточные насильственные двигательные акты, возникающие помимо воли больного. Включают разнообразные клинические формы: тики, миоклонии, хорею, баллизм, тремор, торсионную дистонию, лицевой пара- и гемиспазм, акатизию, атетоз. Диагностируются клинически, дополнительно назначается ЭЭГ, ЭНМГ, МРТ, КТ, дуплексное сканирование, УЗДГ церебральных сосудов, биохимия крови. Консервативная терапия требует индивидуального подбора фармпрепарата из следующих групп: холинолитики, нейролептики, вальпроаты, бензодиазепины, препараты ДОФА. В резистентных случаях возможна стереотаксическая деструкция экстрапирамидных подкорковых центров.
В переводе с греческого «гиперкинез» означает «сверхдвижение», что точно отражает избыточный характер патологической двигательной активности. Гиперкинезы известны давно, описаны ещё в средние века, зачастую упоминаются в литературных источниках как «пляска святого Витта». Поскольку выявить морфологические изменения в тканях мозга не удавалось, до средины ХХ века гиперкинезы считались проявлениями невротического синдрома. Развитие нейрохимии позволило предположить связь патологии с дисбалансом нейротрансмиттеров, сделать первые шаги в изучении механизма возникновения двигательных нарушений. Гиперкинезы могут появиться в любом возрасте, одинаково распространены среди мужской и женской части населения, выступают составной частью многих неврологических заболеваний.
Причины гиперкинезов
Гиперкинетический синдром возникает вследствие генетических нарушений, органического поражения головного мозга, интоксикаций, инфекций, травм, дегенеративных процессов, лекарственной терапии отдельными группами фармпрепаратов. В соответствии с этиологией в клинической неврологии различают следующие гиперкинезы:
- Первичные - являются следствием идиопатических дегенеративных процессов в ЦНС, имеют наследственный характер. Выделяют гиперкинезы, развивающиеся в результате избирательного поражения подкорковых структур (эссенциальный тремор), и гиперкинезы при мультисистемных поражениях: болезни Вильсона, оливопонтоцеребеллярных дегенерациях.
- Вторичные - проявляются в структуре базовой патологии, обусловленной черепно-мозговой травмой, опухолью головного мозга, токсическим поражением (алкоголизмом, тиреотоксикозом, отравлением СО2), инфекцией (энцефалитом, ревматизмом), расстройством церебральной гемодинамики (дисциркуляторной энцефалопатией, ишемическим инсультом). Могут являться побочным эффектом терапии психостимуляторами, карбамазепином, нейролептиками и ингибиторами МАО, передозировки дофаминергических средств.
- Психогенные - связаны с хронической или острой психотравмирующей ситуацией, психическими нарушениями (истерическим неврозом, маниакально-депрессивным психозом, генерализованным тревожным расстройством). Относятся к редким формам.
Гиперкинезы являются следствием дисфункции экстрапирамидной системы, подкорковыми центрами которой считаются полосатое тело, хвостатое, красное и чечевицеобразное ядра. Интеграционными структурами системы выступают мозговая кора, мозжечок, таламические ядра, ретикулярная формация, двигательные ядра ствола. Связующую функцию выполняют экстрапирамидные пути. Основная роль экстрапирамидной системы - регуляция произвольных движений - осуществляется по нисходящим трактам, идущим к мотонейронам спинного мозга. Воздействие этиофакторов приводит к нарушению описанных механизмов, что обуславливает появление неконтролируемых избыточных движений. Определённую патогенетическую роль играет сбой в нейротрансмиттерной системе, обеспечивающей взаимодействие различных экстрапирамидных структур.
Гиперкинезы классифицируют по уровню поражения экстрапирамидной системы, темпу, двигательному рисунку, времени и характеру возникновения. В клинической практике для дифференциальной диагностики гиперкинетического синдрома определяющее значение имеет разделение гиперкинезов по четырем основным критериям.
По локализации патологических изменений:
- С доминирующим поражением подкорковых образований: атетоз, хорея, баллизм, торсионная дистония. Характерно отсутствие ритмичности, вариабельность, сложность движений, мышечная дистония.
- С преимущественными нарушениями на уровне ствола мозга: тремор, тики, миоклонии, лицевой гемиспазм, миоритмии. Отличаются ритмичностью, простотой и стереотипностью двигательного паттерна.
- С дисфункцией корково-подкорковых структур: диссинергия Ханта, миоклоническая эпилепсия. Типична генерализация гиперкинеза, наличие эпилептических пароксизмов.
По скорости непроизвольных движений:
- Быстрые гиперкинезы: миоклонии, хорея, тики, баллизм, тремор. Сочетаются с понижением мышечного тонуса.
- Медленные гиперкинезы: атетоз, торсионная дистония. Наблюдается повышение тонуса.
По типу возникновения:
- Спонтанные - возникающие независимо от каких-либо факторов.
- Акционные - провоцируемые произвольными двигательными актами, определённой позой.
- Рефлекторные - появляющиеся в ответ на внешние воздействия (прикосновение, постукивание).
- Индуцированные - совершаемые частично по воле пациента. До определённой степени могут сдерживаться больным.
- Постоянные: тремор, атетоз. Исчезают только во сне.
- Пароксизмальные - появляются эпизодически в виде ограниченных по времени пароксизмов. Например, приступы миоклонии, тики.
Симптомы гиперкинезов
Основное проявление заболевания - развивающиеся помимо воли пациента двигательные акты, характеризуемые как насильственные. Гиперкинезы включают движения, описываемые больными как «происходящие в силу непреодолимого желания их совершать». В большинстве случаев избыточные движения сочетаются с симптоматикой, типичной для причинной патологии.
Тремор - ритмичные низко- и высокоамплитудные колебания, обусловленные попеременным сокращением мышц-антагонистов. Может охватывать различные части тела, усиливаться в покое или в движении. Сопровождает мозжечковую атаксию, болезнь Паркинсона, синдром Гийена-Барре, атеросклеротическую энцефалопатию.
Тики - отрывистые низкоамплитудные аритмичные гиперкинезы, захватывающие отдельные мышцы, частично подавляемые волей больного. Чаще наблюдается подмигивание, моргание, подёргивание угла рта, области плеч, повороты головы. Тик речевого аппарата проявляется произношением отдельных звуков.
Миоклонии - беспорядочные сокращения отдельных пучков мышечных волокон. При распространении на группу мышц обуславливают резкое непроизвольные движение, рывковое изменение положения тела. Аритмичные фасцикулярные подёргивания, не приводящие к двигательному акту, называют миокимиями, ритмичные подёргивания отдельной мышцы - миоритмиями. Сочетание миоклонических феноменов с эпилептическими пароксизмами формирует клинику миоклонической эпилепсии.
Хорея - аритмичные порывистые гиперкинезы, часто большой амплитуды. Базовый симптом малой хореи, хореи Гентингтона. Произвольные движения затруднительны. Типично начало гиперкинеза в дистальных отделах конечностей.
Баллизм - резкое непроизвольное вращение плеча (бедра), приводящее к бросковому движению верхней (нижней) конечности. Чаще носит односторонний характер - гемибаллизм. Установлена связь гиперкинеза с поражением люисова ядра.
Блефароспазм - спастическое смыкание век в результате гипертонуса круговой мышцы глаза. Наблюдается при болезни Галлервордена-Шпатца, лицевом гемиспазме, офтальмологических заболеваниях.
Оромандибулярная дистония - насильственное смыкание челюстей и открытие рта, обусловленное непроизвольным сокращением соответствующих мышц. Провоцируется жеванием, разговором, смехом.
Писчий спазм - спастическое сокращение мышц кисти, провоцируемое письмом. Носит профессиональный характер. Возможны миоклонии, тремор поражённой кисти. Отмечены семейные случаи болезни.
Атетоз - червеобразные замедленные движения пальцев, кистей, стоп, предплечий, голеней, мышц лица, являющиеся результатом асинхронно возникающего гипертонуса мышц агонистов и антагонистов. Характерен для перинатального поражения ЦНС.
Торсионная дистония - медленные генерализованные гиперкинезы с характерными скрученными позами тела. Чаще имеет генетическую обусловленность, реже - вторичный характер.
Лицевой гемиспазм - гиперкинезы стартуют блефароспазмом, захватывают всю мимическую мускулатуру половины лица. Аналогичное двустороннее поражение носит название лицевой параспазм.
Акатизия - двигательное беспокойство. Отсутствие двигательной активности вызывает у больных выраженный дискомфорт, что побуждает их постоянно совершать движения. Иногда проявляется на фоне вторичного паркинсонизма, тремора, лечения антидепрессантами, нейролептиками, фармпрепаратами ДОФА.
Гиперкинезы распознаются на основании характерной клинической картины. Тип гиперкинеза, сопутствующая симптоматика, оценка неврологического статуса позволяют судить об уровне поражения экстрапирамидной системы. Дополнительные исследования необходимы для подтверждения/опровержения вторичного генеза гиперкинетического синдрома. План обследования включает:
- Осмотр невролога. Проводится детальное изучение гиперкинетического паттерна, выявление сопутствующего неврологического дефицита, оценка психической и интеллектуальной сферы.
- Электроэнцефалографию. Анализ биоэлектрической активности головного мозга особенно актуален при миоклониях, позволяет диагностировать эпилепсию.
- Электронейромиографию. Исследование дает возможность дифференцировать гиперкинезы от мышечной патологии, нарушений нейромышечной передачи.
- МРТ, КТ, МСКТ головного мозга. Проводятся при подозрении на органическую патологию, помогают выявить опухоль, ишемические очаги, церебральные гематомы, дегенеративные процессы, воспалительные изменения. Детям во избежание лучевой нагрузки назначается МРТ головного мозга.
- Исследование мозгового кровотока. Осуществляется при помощи УЗДГ сосудов головы, дуплексного сканирования, МРТ церебральных сосудов. Показано при предположении о сосудистом генезе гиперкинеза.
- Биохимический анализ крови. Помогает диагностировать гиперкинезы дисметаболической, токсической этиологии. Пациентам моложе 50 лет рекомендуется определение уровня церулоплазмина для исключения гепатолентикулярной дегенерации.
- Консультацию генетика. Необходима в диагностике наследственных заболеваний. Включает составление генеалогического древа для определения характера наследования патологии.
Дифференциальная диагностика проводится между различными заболеваниями, клиническая картина которых включает гиперкинезы. Важным моментом является исключение психогенной природы насильственных движений. Психогенные гиперкинезы отличаются непостоянством, внезапными длительными ремиссиями, полиморфностью и изменчивостью гиперкинетического паттерна, отсутствием мышечной дистонии, положительным ответом на плацебо и резистентностью к стандартным методам лечения.
Лечение гиперкинезов
Терапия преимущественно медикаментозная, осуществляется параллельно с лечением причинного заболевания. Дополнительно используются физиотерапевтические методики, водолечение, лечебная физкультура, рефлексотерапия. Выбор препарата, купирующего гиперкинезы, и подбор дозировки осуществляется индивидуально, иногда требует длительного периода времени. Среди антигиперкинетических средств выделяют следующие группы фармпрепаратов:
- Холинолитики (тригексифенидил) - ослабляют действие ацетилхолина, участвующего в процессах передачи возбуждения. Умеренная эффективность отмечается при треморе, писчем спазме, торсионной дистонии.
- Препараты ДОФА (леводопа) - улучшают метаболизм дофамина. Применяются при торсионной дистонии.
- Нейролептики (галоперидол) - купируют чрезмерную дофаминергическую активность. Эффективны в отношении блефароспазма, хореи, баллизма, лицевого параспазма, атетоза, торсионной дистонии.
- Вальпроаты - улучшают ГАМК-ергические процессы в ЦНС. Используются в терапии миоклонии, гемиспазма, тиков.
- Бензодиазепины (клоназепам) - оказывают миорелаксирующее, противосудорожное действие. Показания: миоклония, тремор, тики, хорея.
- Препараты ботулотоксина - вводятся локально в мышцы, подверженные тоническим сокращениям. Блокируют передачу возбуждения к мышечным волокнам. Применяются при блефароспазме, геми-, параспазме.
В случаях резистентности гиперкинеза к фармакотерапии возможно хирургическое лечение. У 90% пациентов с лицевым гемиспазмом эффективна нейрохирургическая декомпрессия лицевого нерва на стороне поражения. Выраженные гиперкинезы, генерализованный тик, торсионная дистония выступают показанием к стереотаксической паллидотомии. Новым способом лечения гиперкинезов является глубинная стимуляция церебральных структур - электростимуляция вентролатерального ядра таламуса.
Гиперкинезы не опасны для жизни больного. Однако их демонстративный характер зачастую формирует у окружающих негативное отношение, что отражается на психологическом состоянии пациента, ведёт к социальной дезадаптации. Выраженные гиперкинезы, затрудняющие произвольные движения и самообслуживание, инвалидизируют больного. Общий прогноз заболевания зависит от причинной патологии. В большинстве случаев лечение позволяет контролировать патологическую двигательную активность, значительно улучшить качество жизни пациента. Специфические превентивные меры не разработаны. Предупредить развитие гиперкинезов помогает профилактика и своевременное лечение перинатальных, травматических, гемодинамических, токсических, инфекционных поражений мозга.
Очаги в головном мозге на МРТ

Токсоплазмоз на МРТ головного мозга
Магнитно-резонансная томография является безболезненным и информативным способом исследования головного мозга. Послойное МР-сканирование позволяет детально рассмотреть все участки органа, оценить их структуру. С помощью определенных последовательностей можно подробно изучить белое и серое вещество, сосуды, желудочковую систему.
МРТ считают эффективным методом выявления очаговых поражений мозга. К таковым относят ограниченные участки с нарушенной структурой внутри вещества органа. Подобные изменения часто сопровождаются масс-эффектом, отеком, деформацией окружающих областей. Очаги в головном мозге на МРТ выглядят как зоны изменения МР-сигнала. По специфическим признакам, локализации, размерам и степени влияния на окружающие структуры рентгенолог может сделать предположения о характере патологии. Пользуясь перечисленными сведениями, врач ставит диагноз, составляет для пациента прогноз и подбирает лечение.
Очаги на МРТ головного мозга: что значит?
Результатом магнитно-резонансной томографии является серия послойных снимков исследуемой области. На изображениях здоровые ткани выглядят как чередующиеся светлые и темные участки, что зависит от концентрации в них жидкости и применяемой импульсной последовательности. По срезам врач-рентгенолог оценивает:
- развитость и положение отдельных структур;
- соответствие интенсивности МР-сигнала норме;
- состояние извилин и борозд;
- размеры и строение желудочковой системы и подпаутинного пространства;
- параметры слуховых проходов, глазниц, придаточных синусов;
- структуру сосудистого русла;
- строение черепных нервов и церебральных оболочек;
- наличие признаков патологии (очаговые изменения, отек, воспаление, повреждения стенок артерий и вен).

Липома четверохолмной цистерны на МРТ (обведена кругом)
МРТ назначают, если у пациента наблюдаются неврологические отклонения, обусловленные поражением мозговой ткани. Симптомами могут быть:
- головные боли;
- нарушения координации движений;
- дисфункции органов слуха или зрения;
- нарушения концентрации внимания;
- расстройства памяти;
- проблемы со сном;
- психоэмоциональные расстройства;
- парезы/параличи конечностей и/или мышц лица;
- чувствительные нарушения;
- судороги и пр.
Магнитно-резонансная томография головы позволяет врачу точно определить локализацию очаговых изменений и выяснить природу плохого самочувствия у пациента. В ДЦ «Магнит» на вооружении специалистов новейшие аппараты для МР-сканирования, которые позволяют с высокой достоверностью провести исследование.
Виды очагов на МРТ головы
Цвет получаемого изображения нормальных мозговых структур и патологических изменений зависит от используемой программы. При сканировании в ангиорежиме, в том числе с применением контраста, на снимках появляется разветвленная сеть артерий и вен. Очаговые изменения бывают нескольких типов, по их характеристикам врач может предположить природу фокусов.
При патологии мозгового вещества нарушаются свойства пораженных фокусов, что проявляется резким изменением МР-сигнала по сравнению со здоровыми областями. Применение определенных последовательностей (диффузионно-взвешенных, FLAIR и пр.) или контрастирования позволяет более четко визуализировать локальные изменения. То есть, если рентгенолог видит на результатах МРТ единичный очаг, для более подробного его изучения будут применены разные режимы сканирования либо контрастирование.
При сравнении изменений со здоровыми участками мозга выделяют гипер-, гипо- и изоинтенсивные зоны (соответственно яркие, темные и такие же по своему цвету, как рядом расположенные структуры).

Абсцесс головного мозга на МРТ (указан стрелкой)
Гиперинтенсивные очаги
Выявление гиперинтенсивных, т.е. ярко выделяющихся на МР-сканах, очагов заставляет специалиста подозревать опухоль головного мозга, в том числе метастатического происхождения, гематому (в определенный момент от начала кровоизлияния), ишемию, отек, патологии сосудов (каверномы, артерио-венозные мальформации и пр.), абсцессы, обменные нарушения и т.п.

Опухоль головного мозга на МРТ (указана стрелкой)
Субкортикальные очаги
Поражение белого вещества головного мозга обычно характеризуют, как изменения подкорковых структур. Выявленные при МРТ субкортикальные очаги говорят о локализации повреждения сразу под корой. Если обнаруживают множественные юкстакортикальные зоны поражения, есть смысл подозревать демиелинизирующий процесс (например, рассеянный склероз). При указанной патологии деструктивные изменения происходят в различных участках белого вещества, в том числе прямо под корой головного мозга. Перивентрикулярные и лакунарные очаги обычно выявляют при ишемических процессах.
Очаги глиоза
При повреждении мозговой ткани включаются компенсаторные механизмы. Разрушенные клетки замещаются структурами глии. Последняя обеспечивает передачу нервных импульсов и участвует в метаболических процессах. За счет описываемых структур мозг восстанавливается после травм.
Выявление глиозных очагов указывает на предшествующее разрушение церебрального вещества вследствие:
- родовой травмы;
- гипоксических процессов;
- наследственных патологий;
- гипертонии;
- эпилепсии;
- энцефалита;
- интоксикации организма;
- склеротических изменений и др.
По количеству и размерам измененных участков можно судить о масштабах повреждения мозга. Динамическое наблюдение позволяет оценить скорость прогрессирования патологии. Однако изучая зоны глиоза нельзя точно установить причину разрушения нервных клеток.
Очаги демиелинизации
Некоторые заболевания нервной системы сопровождаются повреждением глиальной оболочки длинных отростков нейронов. В результате патологических изменений нарушается проведение импульсов. Подобное состояние сопровождается неврологической симптоматикой различной степени интенсивности. Демиелинизация нервных волокон может быть вызвана:
- мультифокальной лейкоэнцефалопатией;
- рассеянным склерозом;
- диссимулирующим энцефаломиелитом;
- болезнью Марбурга, Девика и многими другими.
Обычно очаги демиелинизации выглядят как множественные мелкие участки гиперинтенсивного МР-сигнала, расположенные в одном или нескольких отделах головного мозга. По степени их распространенности, давности и одновременности возникновения врач судит о масштабах развития заболевания.
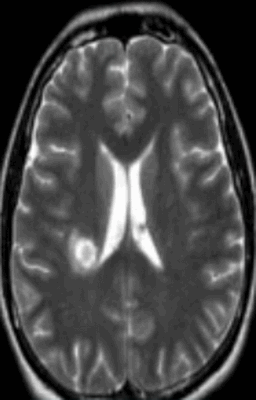
Очаг демиелинизации на МРТ
Очаг сосудистого генеза
Недостаточность мозгового кровообращения являются причиной ишемии церебрального вещества, что ведет к изменению структуры и потере функций последнего. Ранняя диагностика сосудистых патологий способна предотвратить инсульт. Очаговые изменения дисциркуляторного происхождения обнаруживают у большинства пациентов старше 50 лет. В последующем такие зоны могут стать причиной дистрофических процессов в мозговой ткани.
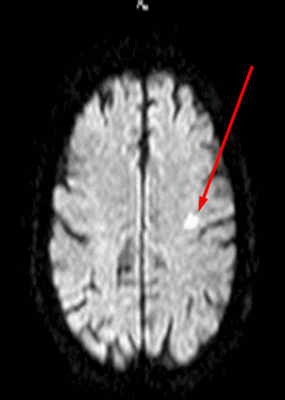
Лакунарный инфаркт головного мозга на МРТ (указан стрелкой)
Заподозрить нарушения церебрального кровообращения можно по очаговым изменениям периваскулярных пространств Вирхова-Робина. Последние представляет собой небольшие полости вокруг мозговых сосудов, заполненные жидкостью, через которые осуществляется трофика тканей и иммунорегулирующие процессы (гематоэнцефалический барьер). Появление гиперинтенсивного МР-сигнала указывает на расширение периваскулярных пространств, поскольку в норме они не видны.
Иногда при МРТ мозга обнаруживаются множественные очаги в лобной доле или в глубоких отделах полушарий, что может указывать на поражение церебральных сосудов. Ситуацию часто проясняет МР-сканирование в ангиорежиме.
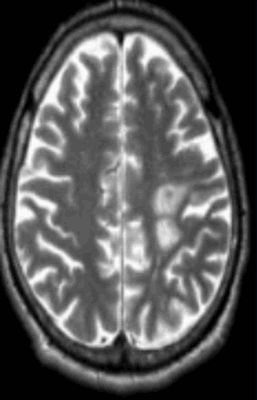
Очаги ишемии на МРТ
Очаги ишемии
Нарушения мозгового кровообращения приводят к кислородному голоданию тканей, что может спровоцировать их некроз (инфаркт). Ишемические очаги при Т2 взвешенных последовательностях выглядят как зоны с умеренно гиперинтенсивным сигналом неправильной формы. На более поздних сроках при проведении в Т2 ВИ или FLAIR режиме МРТ единичный очаг приобретает вид светлого пятна, что указывает на усугубление деструктивных процессов.
Что означают белые и черные пятна на снимках МРТ?
Зоны измененного МР-сигнала могут означать:
- ишемию тканей;
- отек;
- некроз;
- гнойное расплавление;
- опухолевую трансформацию;
- метастатическое поражение;
- глиоз;
- демиелинизацию;
- дегенерацию и др.
Врач-рентгенолог описывает интенсивность сигнала, размеры и локализацию очага. С учетом полученных сведений, жалоб пациента и данных предыдущих обследований специалист может предположить природу патологических изменений.
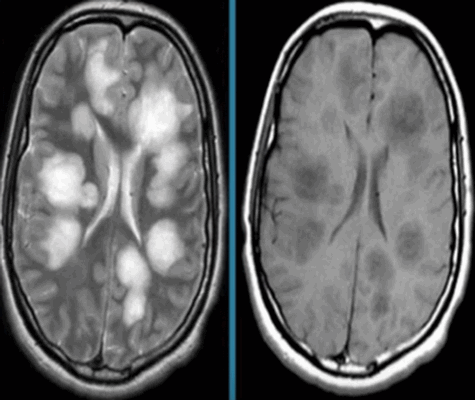
Острый рассеянный энцефаломиелит на МРТ
Причины возникновения очагов на МРТ головного мозга
Если при МРТ головного мозга выявлены очаги, их расценивают как симптомы патологии органа. Зоны гипер- или гипоинтенсивного МР-сигнала свидетельствуют о нарушении структуры определенного участка церебрального вещества. Очаговые изменения могут быть единичными или множественными, крупными, мелкими, диффузными и т.п.. Подобное наблюдается при:
- ;
- ангиопатии; ;
- хронической недостаточности мозгового кровообращения;
- рассеянном склерозе или иных демиелинизирующих заболеваниях; , Пика, Паркинсона и т.п.;
- энцефаломиелите и других заболеваниях.
Очаговые изменения могут быть результатом некроза, гнойных процессов, ишемии, воспаления тканей, разрушения нервных волокон и т.п. Фокальная патология на МР-сканах почти всегда свидетельствует о развитии серьезного заболевания, а в некоторых случаях указывает на опасность для жизни больного.
Читайте также:
- Внутриутробная смерть плода с мацерацией. Признаки гемолитической болезни новорожденных
- Болезнь Стилл—Шоффара. Синдром Фелти. Системная красная волчанка. Болезнь Либман—Сакса.
- Лечение иммунных нарушений при привычной потере беременности. Терапия антифосфолипидиого синдрома
- Инфекция сухожильного влагалища пальцев рук
- Система церебральной защиты. Факторы церебральной защиты
