Пример лечения паралича лицевого нерва при холестеатоме
Добавил пользователь Morpheus Обновлено: 28.01.2026
Запорожский государственный медицинский университет, Украина
Санкт-Петербургский НИИ уха, горла, носа и речи Минздрава России, Санкт-Петербург, Россия, 190013
ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» МЗ РФ, Санкт-Петербург, Россия, 190013
Отдел разработки и внедрения высокотехнологичных методов лечения Санкт-Петербургского НИИ уха, горла, носа и речи Минздрава России, Санкт-Петербург, Россия, 190013, отделение отоларингологии Мурманской областной клинической больницы им. П.А. Баяндина, Мурманск, Россия, 183000
Удаление инфралабиринтной холестеатомы пирамиды височной кости с сохранением функции лицевого нерва
Журнал: Вестник оториноларингологии. 2019;84(3): 56‑60
В статье представлен клинический случай инфралабиринтной холестеатомы пирамиды височной кости. Нами проанализированы предоперационные данные пациентки для определения тактики хирургического лечения с сохранением функции лицевого нерва и снижением риска развития рецидива холестеатомы, интраоперационные находки и конечный результат оперативного лечения.
Холестеатома пирамиды височной кости представляет собой медленно растущее эпидермоидное образование, захватывающее каменистую часть височной кости, и составляет менее 10% от всех случаев образований пирамиды височной кости и менее 3% от случаев хронического гнойного среднего отита, осложненного холестеатомой [1].
Согласно классификации M. Sanna и соавт. от 1993 г., выделяют супралабиринтную, инфралабиринтную, массивную, инфралабиринтную-апикальную и апикальную холестеатому пирамиды височной кости в зависимости от локализации образования по отношению к лабиринту [2].
Инфралабиринтная холестеатома пирамиды височной кости, по данным ряда зарубежных авторов, имеет чаще всего врожденный характер происхождения, развивается в гипотимпануме или в инфралабиринтных клетках с последующим ростом к внутренней сонной артерии или к задней черепной ямке, приводя к разрушению переднего отдела лабиринта. Следовательно, у большинства пациентов в основном страдает слуховая функция. При этом функция ЛН для данного типа расположения холестеатомы пирамиды височной кости на предоперационном этапе, как правило, сохранена [3—6].
Анатомическими границами инфралабиринтного отдела височной кости являются: латерально — мастоидальный отдел ЛН, медиально — твердая мозговая оболочка задней черепной ямки, сверху — передний отдел лабиринта (улитка), снизу — луковица яремной вены, сзади — СС и задний П.К. По мнению авторов, визуализация инфралабиринтной полости может быть улучшена путем удаления костной стенки, покрывающей СС и заднюю черепную ямку, c их последующей ретракцией [7, 8].
В 1978 г. U. Fisch описал инфратемпоральный доступ, при котором ЛН от шилососцевидного отростка до коленчатого ганглия освобождался из костного ложа фаллопиева канала и транспонировался кпереди от своего исходного анатомо-топографического расположения, обеспечивая широкий доступ к инфралабиринтным структурам височной кости [8]. Недостатком данного доступа является высокий риск травмирования Л.Н. Однако некоторые авторы при хирургическом удалении холестериновой гранулемы, параганглиомы и холестеатомы височной кости при их инфралабиринтном распространении избегали транспозиции ЛН, что исключало его повреждение с развитием пареза (паралича) мимической мускулатуры [7].
С появлением интраоперационного мониторинга ЛН в отохирургии появилась возможность идентифицировать его во время операции и тем самым минимизировать риск его повреждения [9, 10].
В данной статье описан случай хирургического лечения пациентки с инфралабиринтной холестеатомой пирамиды височной кости.
Пациентка К., 44 лет, обратилась в ФГБУ «СПбНИИ ЛОР» Минздрава России с жалобами на постоянное гноетечение из правого уха, ощущение тяжести в правой половине головы, снижение слуха на правое ухо вплоть до глухоты. Вышеуказанные жалобы остро стали беспокоить пациентку последние 4 мес.
Из анамнеза заболевания известно, что в детстве у пациентки были отиты с двух сторон.
При осмотре состояние удовлетворительное. Отохирургические вмешательства, травмы височной кости, инфекционные, хронические соматические заболевания отрицает. Сознание ясное, общемозговые и менингеальные симптомы отсутствовали. Головокружение, спонтанный нистагм не зафиксированы. Состояние функции ЛН по шкале House—Brackmann — I степень (норма). При проведении отомикроскопии диагностирован двусторонний средний отит. Правое ухо — НСП широкий, заполнен гнойным отделяемым. Эпидермизированная рубцово-измененная барабанная перепонка втянута. Левое ухо — НСП широкий, свободный. Субтотальный некраевой дефект барабанной перепонки, отделяемого нет. По данным тональной аудиометрии — правосторонняя смешанная тугоухость IV степени (костно-воздушный интервал составлял в среднем 50 ДБ), левосторонняя кондуктивная тугоухость I степени (костно-воздушный интервал составлял в среднем 20 ДБ),
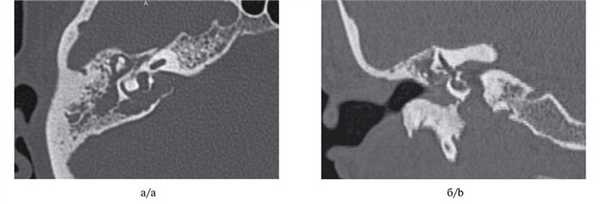
МСКТ височной кости — КТ-картина образования пирамиды правой височной кости с костно-деструктивными изменениями, правостороннего среднего отита. Образование на МСКТ височной кости отграничено сверху базальным завитком улитки и преддверием, снизу — яремной веной, медиально — твердой мозговой оболочкой задней черепной ямки, латерально — гипо- и мезотимпанумом, спереди — вертикальной частью внутренней сонной артерии, сзади — сагиттальным ПК, внутренним слуховым проходом (рис. 1). Рис. 1. МСКТ височной кости (правое ухо). КТ-картина инфралабиринтной холестеатомы пирамиды височной кости (а — аксиальная проекция, б — коронарная проекция).
МРТ среднего уха — в области нижней и задней граней пирамиды височной кости инфралабиринтно визуализируется образование размером 15,6×26×20 мм, прилежит и компримирует внутреннюю яремную вену, характеризуется преимущественно гиперинтенсивным сигналом в Т2, STIR, умеренно гиперинтенсивным в Т2 flair, изоинтенсивным в Т1 ВИ, с повышением сигнала на DWI с коэффициентом В 1000 и вычитанием на ИКД-картах, что соответствует холестеатомным массам.
На основании проведенных методов исследования у пациентки были диагностированы двусторонний хронический гнойный средний отит, инфралабиринтная холестеатома пирамиды височной кости справа, правосторонняя хроническая смешанная тугоухость IV степени, левосторонняя кондуктивная тугоухость I степени.
Предоперационное планирование
Учитывая отсутствие у пациентки экстратемпорального распространения холестеатомы пирамиды височной кости и пареза мимической мускулатуры, было принято решение о проведении операции в условиях специализированного монопрофильного учреждения ФГБУ «СПбНИИ ЛОР» Минздрава России с использованием интраоперационного мониторинга ЛН.
С учетом данных тональной аудиометрии (выраженное нарушение слуховой функции у пациентки) и МСКТ височной кости была поставлена цель — максимальная элиминация холестеатомы с сохранением функции Л.Н. Реконструктивный слухоулучшающий этап операции, несмотря на костно-воздушный интервал в 50 ДБ, не рассматривался из-за костной деструкции холестеатомой переднего и заднего отделов лабиринта.
По данным МСКТ височной кости, у пациентки отсутствовали признаки выраженного предлежания СС и высокого расположения луковицы яремной вены, поэтому в качестве хирургического подхода к инфралабиринтной холестеатоме пирамиды височной кости был выбран трансмастоидальный-инфралабиринтный доступ с удалением пораженной холестеатомой улитки.
С целью снижения риска развития резидуальной холестеатомы пирамиды височной кости мы остановились на открытой технике ведения трепанационной полости из-за сложности в техническом удалении участков матрикса холестеатомы с поверхности адвентиции внутренней сонной артерии, луковицы яремной вены, ЛН без риска повреждения последних.
Операция
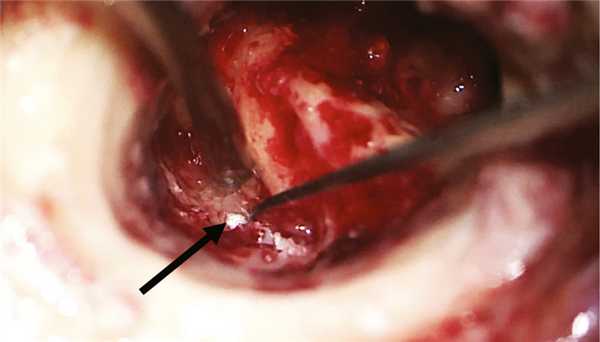
Хирургическое вмешательство было проведено в условиях многокомпонентной анестезии с интубацией трахеи и с применением мониторинга ЛН методом игольчатой электромиографии при непрерывной стимуляции с бормашины. Выполнена инфильтрация мягких тканей заушной области 0,5% раствором наропина 15 мл. Произведен разрез в заушной области справа. Отсепарованы мягкие ткани до кости и кожа задней стенки НСП до фиброзного кольца. Бором снят навес задней стенки НСП и выполнена антротомия. Антрум заполнен грануляционной тканью, блокирующей aditus ad antrum. При проведении тимпанотомии с ревизией барабанной полости отмечено, что рубцово-измененная барабанная перепонка эпидермизирована и спаяна с медиальной стенкой барабанной полости. После удаления патологически измененной барабанной перепонки обнаружены явления метаплазии слизистой оболочки медиальной стенки барабанной полости с развитием грануляционно-фиброзной ткани. Тимпанальное устье слуховой трубы сужено и блокировано полипом. Цепь слуховых косточек сохранена. Молоточек и наковальня удалены. При проведении стимуляционной электромиографии получены М-ответы при пороговой электрической стимуляции в 0,9 мА с горизонтального отдела ЛН, покрытого метаплазированной слизистой оболочкой. Симптом передачи колебаний с подножной пластинки стремени на окно улитки отсутствовал. Бором выполнена радикальная операция. Сформированная трепанационная полость не содержала холестеатомных масс. В полипозно-измененной слизистой оболочке антромастоидальной полости после удаления инфралабиринтных клеток в проекции сагиттального ПК обнаружена холестеатома (рис. 2). Рис. 2. Интраоперационная картина трепанационной полости после выполненной радикальной операции на правом ухе. Стрелкой указана холестеатома в инфралабиринтных клетках височной кости.
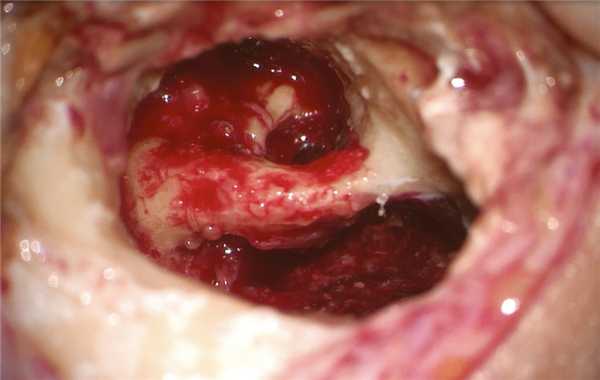
Холестеатома заполняла собой все инфралабиринтное пространство с разрушением изнутри сагиттального ПК, преддверия, базального завитка улитки, компримировала твердую мозговую оболочку задней черепной ямки и внутреннюю яремную вену. По ходу распространения эпидермиса удалены сагиттальный ПК с сохранением эндолимфатического протока, ретрофациальные клетки, клетки гипотимпанального клеточного тракта, инфракохлеарные клетки, базальный и апикальный завитки улитки до передней стенки внутреннего слухового прохода. Холестеатома элиминирована вместе с матриксом из инфралабиринтного пространства: с поверхности твердой мозговой оболочки задней черепной ямки, яремной вены, из-под скелетированного фаллопиева канала, из переднего отдела лабиринта, заднего ПК (рис. 3). Рис. 3. Интраоперационная картина инфралабиринтного пространства правой височной кости после удаления холестеатомы.
Результат
Послеоперационный период протекал без осложнений. Пациентка в удовлетворительном состоянии была выписана на 9-е сутки после операции с тампонами в НСП. Общемозговые и менингеальные симптомы отсутствовали. Предоперационная функция ЛН сохранена. Гистологическое исследование операционного материала подтвердило наличие холестеатомы. Тампоны из НСП удалены через 1 мес после операции.
При проведении отомикроскопии оперированного уха визуализирована большая трепанационная полость, заполненная скудным количеством раневого отделяемого; фасциальный лоскут, закрывающий сверху передние отделы трепанационной полости, — розовый, умеренно отечен. Сформированная инфралабиринтная полость под ЛН свободная, без патологического содержимого.
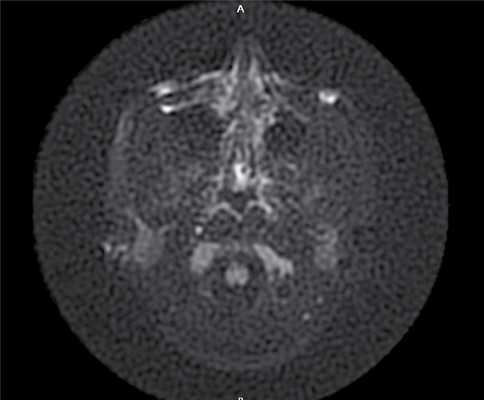
Через 6 мес по результатам отомикроскопии, МСКТ височных костей, МРТ среднего уха в DWI-режиме: в сосцевидном отростке, в аттико-антральной области, в области нижней и задней граней пирамиды височной кости визуализируется обширная послеоперационная полость; в барабанном и мастоидальном сегментах послеоперационной полости пристеночно визуализируется содержимое умеренно неоднородной структуры, гетерогенного МР-сигнала в Т2 ВИ, STIR, T2 flair, изоинтенсивное в Т1 ВИ, без повышения сигнала на DWI c коэффициентом В 1000 и вычитанием на ИКД-картах (вероятно, рубцово-фиброзные изменения): данных за рецидив холестеатомы получено не было (рис. 4). Рис. 4. МР-томограмма среднего уха, выполненная в DWI- режиме.
Пациентке было рекомендовано длительное регулярное наблюдение с использованием отомикроскопии, МСКТ височных костей, МРТ среднего уха в DWI-режиме.
Холестеатома пирамиды височной кости является сравнительно редкой патологией и длительное время может протекать бессимптомно до тех пор, пока не разрушит фаллопиев канал или лабиринт с развитием пареза мимической мускулатуры или снижения слуха. Данное образование может также поражать все анатомические структуры в пределах височной кости или иметь экстратемпоральное распространение с поражением внутренней сонной артерии, ската черепа, клиновидной пазухи, подвисочной ямки и носоглотки [1—3, 5, 6, 11].
Открытая техника ведения трепанационной полости с одномоментным пластическим расширением НСП широко нами используется ввиду спаянности матрикса холестеатомы с нервно-сосудистыми структурами и твердой мозговой оболочкой и возможности визуального контроля и санации состояния данной полости [6].
Для диагностики рецидива холестеатомы в настоящее время применяют МРТ среднего уха в DWI-режиме, где холестеатома выглядит более ярко, чем другие патологические ткани. Однако данная методика имеет чувствительность 81%, и ложноотрицательные результаты получают при размерах холестеатомы менее 5 мм [12]. КТ височных костей обычно дополняют данные МРТ в отношении состояния костных структур височной кости, эти исследования выполняются в комплексе при предоперационном обследовании больного. В нашем случае, учитывая большие костно-деструктивные изменения височной кости в результате роста холестеатомы, сформированную трепанационную полость, открытую технику ее ведения, мы рекомендовали пациентке в послеоперационном периоде выполнить КТ височных костей для оценки объема выполненной операции и определения расположения мягкотканного субстрата по отношению к костным структурам височной кости.
Согласно опыту современной отохирургии, адекватными сроками проведения ревизии барабанной полости после хирургической санации холестеатомы среднего уха являются 6—12 мес [13]. При хирургическом лечении холестеатомы пирамиды височной кости при наличии открытой трепанационной полости мы считаем целесообразным выполнять инструментальные методы обследования через 6 мес после операции, а далее 1 раз в год. Данные сроки достаточны для оценки отдаленных анатомических результатов после выполненной хирургической санации холестеатомы пирамиды височной кости.
Особенность данного клинического случая заключается в том, что после выполненной расширенной радикальной операции на среднем ухе нами были обнаружены только участки грануляционной ткани в антромастоидальной полости и метаплазированная слизистая оболочка в барабанной полости. Признаки миграции эпидермиса в гипотимпанальные и инфралабиринтные клетки со стороны барабанной полости и сформированной антромастоидальной полости отсутствовали, что может свидетельствовать в пользу врожденной этиологии данной холестеатомы.
Пример лечения паралича лицевого нерва при холестеатоме
Московский научно-практический центр оториноларингологии Департамента здравоохранения Москвы
Московский научно-практический центр оториноларингологии ДЗ Москвы
Федеральный медико-биологический Центр им. А.И. Бурназяна ФМБА России, Москва, Россия, 123098
Хирургическое лечение холестеатомы пирамиды височной кости
Журнал: Вестник оториноларингологии. 2015;80(3): 57‑60
Кратко представлена эпидемиология, классификация, диагностика и современные тенденции хирургического лечения холестеатомы пирамиды височной кости. Описан клинический случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Из всех заболеваний верхушки пирамиды височной кости холестеатома встречается в 3,4—9% случаев. Наиболее часто (в 60%) в этой зоне выявляется холестероловая гранулема. В то же время имеются случаи диагностики мукоцеле, арахноидальных кист, менингиомы, хордомы, ксантомы, кавернозной гемангиомы, аневризм внутренней сонной артерии, фиброзной дисплазии, хондросаркомы и метастатической карциномы. Может симулировать заболевание верхушки пирамиды и асимметричная пневматизация этой локализации [1—5].
Среди больных с холестеатомой височной кости у 2,9% встречается холестеатома пирамиды височной кости. Холестеатома этой локализации может быть первичной (врожденной), происходящей из остатков эмбриональной или аберрантной эпителиальной ткани, или вторичной вследствие инвазии холестеатомы из среднего уха или сосцевидного отростка. Вторичная холестеатома выявляется у 58%, а первичная — у 12% пациентов [2, 6]. В зависимости от локализации холестеатомы в пирамиде височной кости по классификации M. Sanna [7] выделяют пять ее видов: супралабиринтная, инфралабиринтная, массивная лабиринтная, инфралабиринтная с апикальным распространением и апикальная [7]. Наиболее часто встречается супралабиринтная (26,7—67%), массивная лабиринтная (20—38%) и инфралабиринтная (7—40%) холестеатомы [1, 6, 8].
При холестеатоме пирамиды височной кости часто наблюдается бессимптомное течение при значительном ее объеме. В зависимости от локализации ранними симптомами могут быть выраженное снижение слуха или глухота (у 9—69%), дисфункция лицевого нерва (у 29—53%), оторея (у 66,7%), периферическое головокружение (у 33,3%) или центральные неврологические осложнения вследствие эрозии рядом расположенных важных анатомических структур [1, 2, 6, 8, 9].
Применение в диагностике высокоинформативных методов исследования: мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансоной томографии (МРТ) с контрастным усилением, в том числе в non- EPY режиме, позволяет определить локализацию, распространение холестеатомы и на дооперационном этапе планировать хирургический подход.
В литературе имеются единичные обзоры, посвященные диагностике и хирургии холестеатомы пирамиды височной кости, освещающие значительное количество клинических случаев [1, 6, 8—11]. Основными задачами операции являются тотальное макроскопическое удаление холестеатомы, сохранение ствола лицевого нерва, предупреждение ликвореи и менингита и сохранение слуховой функции. Поэтому современный алгоритм выбора хирургического подхода строится на локализации холестеатомы, состоянии слуховой функции и лицевого нерва. Большинство авторов отдают предпочтение закрытым вариантам с облитерацией зоны операции и ушиванием наружного слухового прохода по Rambo, учитывая современные средства реабилитации слуха. Так, при супралабиринтной холестеатоме и нормальном слухе используют транстемпоральный супралабиринтный подход через среднюю черепную ямку, а при сенсоневральной тугоухости — выполняют субтотальную петрозэктомию транслабиринтным и транскохлеарным подходом. При инфралабиринтной холестеатоме и нормальном слухе применяют субтотальную петрозэктомию трансмастоидальным и ретролабиринтным подходами, а при сенсоневральной тугоухости — транслабиринтным и транскохлеарным подходами [6, 11, 12]. В то же время стремление сохранить слух после операции в ущерб радикальному удалению холестеатомы может привести к резидуальной патологии и необходимости повторного вмешательства. В тех случаях, когда холестеатома распространяется медиальнее капсулы лабиринта, сохранить слух невозможно, и на выбор хирургического подхода влияет состояние лицевого нерва. При этих локализациях холестеатомы при сохранной функции лицевого нерва применяют транслабиринтный и транскохлеарный или инфратемпоральный доступы, а при дисфункции лицевого нерва — транскохлеарный. Для лечения дисфункции лицевого нерва в зависимости от места компрессии выполняют декомпрессию ствола нерва, нейропластику или VII—XII анастомоз одновременно (или на втором этапе) [1, 6, 10]. Лучшие результаты операции отмечают при длительности дисфункции лицевого нерва менее 12 мес. В результате лечения глухота оперированного уха наблюдается у 18—83%, рецидив холестеатомы в разные сроки — у 2—19% и интракраниальные осложнения у 2—6% больных [6, 8].
В последние годы некоторые авторы выполняют модифицированную субтотальную петрозэктомию различными подходами, в зависимости от локализации холестеатомы, с тимпанооссикулопластикой для сохранения или улучшения функции слуха. По их данным, преимуществами открытой реконструкции являются функциональный результат, ранняя диагностика рецидива холестеатомы и менее сложная ревизионная хирургия в условиях необлитерированной полости. При этой методике после удаления холестеатомы пирамиды височной кости у 90% пациентов выполнялась тимпанопластика и у 52% — оссикулопластика. В результате операции слух улучшился у 38% пациентов, сохранился на прежнем уровне — у 29% и у 33% отмечено его ухудшение [8].
В нашей стране хирургией пирамиды височной кости занимаются преимущественно нейрохирурги. Однако и их возможности ограничены при распространенной холестеатоме пирамиды височной кости.
Представляем случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Пациентка М., 32 года, обратилась в отделение нейрохирургии клиники ФГБУ ФМБЦ им. А.И. Бурназяна с жалобами на отсутствие слуха на правое ухо, периодические выделения из него, асимметрию лица.
Из анамнеза известно, что пациентка с детства страдает хроническим гнойным правосторонним средним отитом с периодическими обострениями в виде выделений из правого уха на фоне ОРВИ или попадания воды в ухо. Регулярно проводилась местная антибактериальная терапия с временным положительным эффектом. С 16-летнего возраста стала отмечать головокружения системного характера. В 2006 г. обратилась в клинику МОНИКИ, где выполнена КТ височных костей, по данным которой выявлено новообразование правой пирамиды височной кости. В той же клинике выполнена санирующая операция на правой височной кости с удалением задней стенки слухового прохода. В послеоперационном периоде головокружения купировались, но сохранялись выделения из этого уха. В 2009 г. стала отмечать подергивание мышц правой половины лица, эпизоды по типу гемифациального спазма до нескольких раз в день. В НИИ нейрохирургии им. Н.Н. Бурденко выполнена ретросигмовидным доступом операция на пирамиде височной кости с удалением холестеатомы правой пирамиды височной кости. После операции у пациентки полностью восстановилась функция лицевого нерва справа. Однако в 2012 г. у пациентки вновь развился парез лицевого нерва справа. Обратилась в отделение нейрохирургии клиники ФМБЦ им. А.И. Бурназяна для обследования и лечения.
При поступлении: общее состояние больной удовлетворительное. Температура тела нормальная. Кожные покровы обычной окраски. В легких дыхание везикулярное, без хрипов. АД — 120/80 мм рт.ст. Пульс 90 в 1 мин, ритмичный, удовлетворительных свойств.
При осмотре имеются спокойные, безболезненные послеоперационные рубцы в правой заушной и ретросигмовидной области. При отомикроскопии справа — наружный слуховой проход широкий, свободный, без отделяемого. Барабанная перепонка сохранена только в передних отделах. Слизистая оболочка в мезогипотимпануме утолщенная, полипозно-измененная. Полость в мастоидальном отделе небольшая, покрыта утолщенной слизистой оболочкой без эпидермиса. Слуховая труба проходима по Вальсальва. Слева наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета, опознавательные знаки дифференцируются.
В неврологическом статусе: сознание ясное. Контактная. Менингеальных знаков нет. Гипостезия в зоне иннервации V нерва справа (больше по 1—2 ветвям), корнеальный рефлекс снижен справа. Определяется грубый парез правого лицевого нерва справа (V степень по шкале House—Brackmann). Координаторные пробы выполняла удовлетворительно.
При тональной пороговой аудиометрии (ТПА) выявлена правосторонняя глухота. Слух слева в пределах возрастной нормы.
По данным электронейромиографии отмечались признаки умеренного поражения правого лицевого нерва по смешанному типу (аксональному и демиелинизирующему), проводимость по всем ветвям составляла 30—40% от нормы по типу неврита.
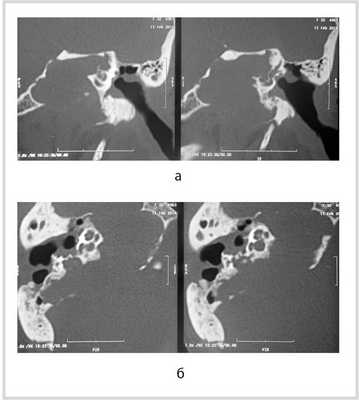
Рис. 1. КТ височных костей пациентки М. а — коронарная проекция: деструктивная полость в пирамиде височной кости, заполненная субстратом неоднородной плотности, капсула лабиринта значительно разрушена на уровне базального и апикального завитков улитки, латерального и верхнего полукружных каналов; б — аксиальная проекция: деструктивная полость с разрушением задней грани пирамиды, передневерхней и нижней поверхности.
По результатам МРТ головного мозга правая пирамида височной кости деформирована, увеличена в объеме, выполнена субстратом размером до 5,5—2,8—3 см, распространяющимся на область внутреннего слухового прохода, заднего полукружного канала, медиальные отделы барабанной полости, сосцевидный отросток. Описанный субстрат изо-гипоинтенсивен в режиме Т1, гиперинтенсивен — в Т2 и non-EPI DWI (рис. 2). Заключение: признаки рецидива холестеатомы с деструктивными изменениями структур внутреннего и среднего уха на фоне хронических воспалительных изменений.
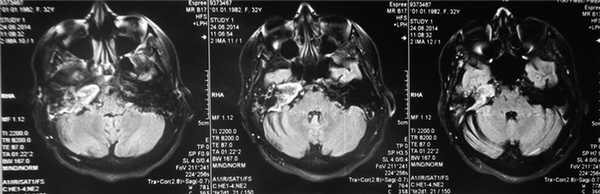
Рис. 2. Магнитно-резонансная томография головного мозга пациентки М. Деформированная, увеличенная в объеме пирамида височной кости выполнена мягкотканым субстратом.
Учитывая анамнез заболевания, ранее выполненные операции, клинические проявления (глухота, явления периферического пареза лицевого нерва) и локализацию процесса по данным КТ височных костей и МРТ, свидетельствующие о массивной лабиринтной холестеатоме, пациентке была выполнена реоперация. Транслабиринтным подходом произведена субтотальная петрозэктомия (частичная лабиринтэктомия) с удалением холестеатомы и пластикой дефекта височной кости жиром. При ревизии определялась послеоперационная неэпидермизированная мастоидальная полость, которая была заполнена утолщенной слизистой оболочкой. В барабанной полости также определялась утолщенная полипозная слизистая оболочка. Барабанная перепонка сохранена только в передних отделах. Цепь слуховых косточек отсутствовала. За счет удаления перилабиринтных клеток, заднего верхнего и латерального полукружных каналов был открыт широкий доступ в сторону верхушки пирамиды, где выявлена большая холестеатома, распространявшаяся от верхушки сосцевидного отростка до верхушки пирамиды височной кости. Выявлено обнажение луковицы яремной вены, мозговых оболочек задней черепной ямки, нисходящей части канала лицевого нерва. Холестеатома удалена с образованием большой полости внутри пирамиды височной кости. При удалении холестеатомы из области внутреннего слухового прохода (который не дифференцировался) отмечалась ликворея. Эпидермальные оболочки оставлены на луковице яремной вены, у верхушки пирамиды височной кости, под улиткой. Произведена герметизация твердой мозговой оболочки двухкомпонентным фибриновым клеем. В область верхушки пирамиды височной кости уложена подкожно-жировая клетчатка, которая была взята с передней брюшной стенки. Выполнена пластика полости свободным миофасциальным лоскутом. В барабанную полость, под остатки барабанной перепонки, уложена аутофасция. Слуховой проход не ушивался для возможности контроля за созданной полостью.
По данным гистологического исследования удаленного образования от 29.07.14: в присланном материале бесструктурные холестеатомные массы и мелкий пласт многослойного плоского эпителия с рыхлой подэпителиальной стромой с кровоизлияниями.
При наблюдении в послеоперационном периоде отмечена длительная эпителизация послеоперационной полости и сохранение пареза правого лицевого нерва (V степень по шкале House—Brackmann). Неврологический статус — без отрицательной динамики.
Представленный случай свидетельствует о возможности успешного применения транслабиринтного подхода для удаления холестеатомы верхушки пирамиды височной совместно с нейрохирургами.
Холестеатома уха
Холестеатома уха — это опухолевидное инкапсулированное образование среднего уха, состоящее преимущественно из клеток слущенного эпителия и кристаллов холестерина. Различают истинную (врожденную) и ложную холестеатому уха. Проявляется заболевание ощущением распирания и болями в ухе, снижением слуха смешанного типа, небольшим количеством имеющих гнилостный запах выделений из уха. Холестеатома уха диагностируется при помощи рентгенографии и КТ черепа, отоскопии, зондирования и промывания барабанной полости, исследований вестибулярного и слухового анализаторов. Лечение холестеатомы уха в большинстве случаев заключается в радикальном хирургическом удалении. Иногда возможно промывание надбарабанной полости с расположенной в ней холестеатомой.
МКБ-10



Общие сведения
Холестеатома - эмбриональное или (чаще) приобретенное псевдоопухолевое образование, происходящее из тканей среднего уха. В 90% случаев она появляется на фоне хронического гнойного среднего отита. В популяции частота гнойный отитов, осложненных холестеатомой, составляет 0,01%. Заболеванием чаще страдают дети старше 10 лет и взрослые 20-30 лет. У детей патология протекает более агрессивно с многократными рецидивами.

Причины
Холестеатома уха может иметь врожденный характер. В таких случаях она носит название истинной. Благодаря гладкой, напоминающей поверхность жемчужины, капсуле истинную холестеатому уха называют еще «жемчужной опухолью». Она возникает вследствие эмбриональных нарушений и располагается в пирамиде височной кости. Истинная холестеатома может также находиться в других костях черепа, в боковой цистерне и желудочках головного мозга.
Ложная холестеатома уха образуется в результате длительно протекающих отитов или как последствие травмы уха. Считается, что образование ложной холестеатомы уха возможно 2 путями. В первом случае происходит врастание плоского эпителия наружного слухового прохода в полость среднего уха через краевой разрыв барабанной перепонки. Второй механизм образования холестеатомы уха реализуется при нарушении проходимости слуховой трубы в связи с евстахиитом. В результате пониженного давления в барабанной полости происходит втяжение в нее части барабанной перепонки. Когда втяжение становится достаточно глубоким, в нем начинает накапливаться кератин и слущенный эпителий, что ведет к развитию холестеатомы уха.
Патогенез
Холестеатома уха не является истинной опухолью уха, хотя по своему внешнему виду и характеру роста напоминает опухолевое образование. Холестеатома уха имеет слоистую структуру. Сверху она покрыта капсулой из соединительной ткани, под которой находится ороговевающий плоский эпителий. Средний слой холестеатомы уха представлен наложенными одна на другую пластинами слущенного эпителия и расположенными между ними кристаллами холестерина. Центральную часть холестеатомы уха или ее ядро занимает имеющий гнилостный запах беловатый детрит.
Холестеатома уха может быть единичным образованием или представляет собой скопление большого количества узелков, имеющих плотную консистенцию и размер от 3 мм. Холестеатома уха выделяет специфические химические вещества, которые приводят к резорбции окружающих холестеатому костных тканей с образованием гладкостенной полости. Кроме того, эти вещества оказывают токсическое воздействие на рецепторный аппарат внутреннего уха, вызывая расстройство звуковосприятия и реактивный лабиринтит.
Симптомы холестеатомы уха
В начальном периоде холестеатома уха может иметь бессимптомное течение. Затем пациент начинает предъявлять жалобы на чувство распирания в ухе, появление тупой, давящей, ноющей или стреляющей ушной боли. Происходит понижение слуха. Возможны головные боли, при развитии лабиринтита — головокружения. Наблюдаются выделения из уха, которые обычно имеют гнилостный запах и носят скудный характер. Отличительной особенностью является обнаружение в отделяемом небольших комочков белого цвета.
При холестеатоме уха тугоухость имеет смешанный характер. С одной стороны она обусловлена нарушением звукопроведения в связи с ограничением подвижности слуховых косточек, а с другой — расстройством звуковосприятия в результате токсического поражения рецепторов лабиринта проникающими в него агрессивными выделениями холестеатомы.
Осложнения
Разрушая рядом расположенные костные образования, холестеатома уха увеличивается в размерах. Так она со временем заполняет ячейки сосцевидного отростка, доходит до капсулы лабиринта и способна разрушить его полукружные канальцы с образованием фистулы лабиринта. При разрушении коркового слоя сосцевидного отростка холестеатома уха выходит под кожу сосцевидной области.
Разрушение стенки косного канала лицевого нерва ведет к развитию пареза лицевого нерва, стенки сигмовидного синуса — к его тромбозу. Зачастую холестеатома уха достигает размера грецкого ореха и имеет расходящиеся в различных направлениях отростки. При этом она образует гигантскую полость, похожую на полость, остающуюся после общеполостной операции на ухе.
Старая холестеатома уха включает содержащие токсическую жидкость кисты, прорыв которых в подпаутинное пространство приводит к развитию асептического менингита, в вещество головного мозга — к появлению менингоэнцефалита. Эти осложнения могут привести к гибели больного от отека головного мозга. Обострение среднего отита часто сопровождается гнойным распадом холестеатомы уха, обуславливающим развитие гнойного лабиринтита и менингита, околосинусового и экстрадурального абсцесса, абсцесса головного мозга, отогенного сепсиса.
Диагностика
К диагностике холестеатомы уха могут привлекаться не только врачи-отоларингологи, но также неврологи и нейрохирурги. В современной отоларингологии используется комплекс визуализирующих и функциональных методик:
- Рентгенография височных костей. На рентгенограммах в проекции по Майеру, Шюллеру или Стенверсу холестеатома определяется как имеющая среднюю плотность однородная тень, которая находится в круглой патологической полости с гладкими и четко визуализирующимися краями. Более точную визуальную картину образования получают при проведении КТ и МСКТ черепа.

КТ височных костей. Деструкция сосцевидного отростка, сосцевидной пещеры, пирамиды и среднего уха правой височной кости, обусловленная холестеатомой
- Эндоскопия уха. При отоскопии возможно обнаружение краевой перфорации барабанной перепонки, признаков деструкции костной части слухового прохода, обусловленных разрастанием холестеатомы. При наличии краевой перфорации производят зондирование полости среднего уха пуговчатым зондом и промывание надбарабанного пространства. О наличии деструктивного процесса свидетельствует шероховатая при прощупывании поверхность кости. В пользу холестеатомы уха говорит присутствие в промывных водах включений и чешуек эпидермиса.
- Исследование слухового анализатора. Дополнительно у пациентов с холестеатомой уха проводят исследование слуха и вестибулярного анализатора. Аудиометрия выявляет снижение слуха, пороговая аудиометрия — смешанный тип тугоухости. Производят также исследование камертоном, определение проходимости слуховой трубы, электрокохлеографию, акустическую импедансометрию, отоакустическую эмиссию, вестибулометрию, электронистагмографию, стабилографию, непрямую отолитометрию.
- Неврологическая диагностика. В диагностике осложнений может применяться неврологический осмотр, МРТ головного мозга, люмбальная пункция и др.

МРТ головы. Гиперинтенсивный сигнал в области сосцевидной пещеры, сосцевидного отростка и пирамиды правой височной кости (холестеатома)
Холестеатому уха необходимо дифференцировать от опухолей и инородных тел уха, кохлеарного неврита, серной пробки, гломусной опухоли, адгезивного среднего отита, специфических гранулем при туберкулезе и сифилисе.
Лечение холестеатомы уха
Консервативная тактика
Консервативное лечение возможно лишь в случае небольшой холестеатомы уха, находящейся в надбарабанном пространстве. Терапия таких холестеатом заключается в промывании надбарабанного пространства растворами протеолитических ферментов и борной кислоты. Начинают и заканчивают процедуру промыванием полости изотоническим раствором. Подобную манипуляцию проводят ежедневно в течение недели.
Хирургическое лечение
При неэффективности консервативного лечения, большом размере холестеатомы уха, наличии осложнений показано радикальное удаление образования. В зависимости от распространенности холестеатомы хирургическое вмешательство может включать:
- санирующую операцию на среднем ухе;
- лабиринтотомию;
- транслабиринтное вскрытие пирамиды височной кости;
- тимпанпластику, мастоидопластику, мирингопластику и пр.
Прогноз и профилактика
В случае своевременного выявления, последовательного консервативного или радикального хирургического лечения холестеатомы прогноз благоприятный. В отдельных случаях возможны рецидивы процесса. В запущенных стадиях возможно развитие тугоухости, жизнеугрожающих внутричерепных осложнений. Профилактика холестеатомы заключается в предупреждении ХГСО, своевременном лечении воспаления среднего уха.
Невралгия тройничного нерва - симптомы и лечение
Что такое невралгия тройничного нерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Новикова Юрия Олеговича, мануального терапевта со стажем в 41 год.
Над статьей доктора Новикова Юрия Олеговича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Невралгия тройничного нерва (НТН, Neuralgia n. trigemini, Prosopalgia) — хроническое заболевание, для которого характерны интенсивные боли стреляющего и/или жгучего характера в области лица, при этом расстройств чувствительности не выявляется.
По данным Всемирной организации здравоохранения, распространённость заболевания находится в пределах 2-4 человек на 100 000 населения. Чаще встречается у женщин 50-69 лет. Преобладает правосторонняя локализация. [1] [2] Примерно в 3% случаев возможен двусторонний процесс, частота которого возрастает в ходе увеличения длительности заболевания. [3]
Причины невралгии тройничного нерва
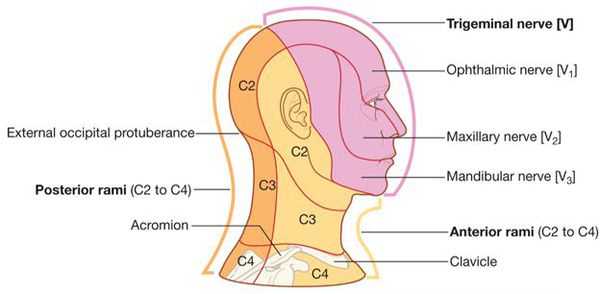
Невралгия V нерва может быть проявлением как поражения отдельных ветвей, так и его ядер в области ствола головного мозга и продолговатого мозга.
Поражения отдельных ветвей V нерва возникают в связи с переломом черепа, менингитом или рассеянным склерозом, объёмными образованиями головного мозга, саркоидозом или аневризмами близлежащих сосудов.
Поражение комплекса ядер также может быть связано с сосудистым процессом, объёмными образованиями, различными энцефалитами, рассеянным склерозом, сирингобульбией и сирингомиелией.
Кроме того, поражение V нерва может быть одним из признаков краниальной полиневропатии, связанной с отравлением трихлорэтиленом и другими химическими веществами, или ранним признаком некоторых заболеваний соединительной ткани, таких как склеродермия.
Некоторые проявления НТН возможны как сопутствующие признаки невропатии VII (лицевого) нерва. Это связано с единым кровоснабжением.
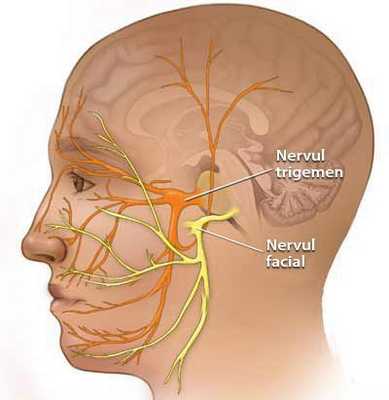
Также существует эссенциальная или идиопатическая НТН.
Факторы риска невралгии тройничного нерва
К факторам риска развития заболевания некоторые авторы относят:
- Генетический дефект в хромосоме 32Р, брахидактилию и наследственную форму гипертензии, которая передаётся от одно из родителей. Эти нарушения сочетаются с патологической извитостью или стенозом задней нижней мозжечковой или позвоночной артерий, что приводит к сдавлению переднебоковых отделов продолговатого мозга. , который снижает эластичность сосудов и увеличивает механическое воздействие пульсовой волны на корешок тройничного нерва.
- Сдавление ветвей тройничного нерва в костном канале, на месте которого повреждается оболочка, окружающая нервные волокна.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы невралгии тройничного нерва
Основной симптом невралгии тройничного нерва — это интенсивная боль в области лица. Боли при невралгии бывают двух видов:
- постоянные, тупые, периодически усиливающиеся боли без широкой иррадиации, возникающие в области распространения той или другой ветви нерва и не сопровождающиеся выраженными вегетативными реакциями;
- боли пароксизмального характера, длящиеся от нескольких минут до нескольких часов. [4][5]
Интенсивность приступов различна: от несильных, но частых, продолжающихся несколько секунд, до сильных и непереносимых, продолжающихся минутами и причиняющих сильные страдания.
Приступы нередко возникают спонтанно, без каких-либо раздражителей, либо в результате попадания твёрдой и холодной пищи в рот, прикосновений, сквозняков, переохлаждений под кондиционером, движений челюстями и т. п.
Приступ начинается обычно с болей в одной ветви нерва — месте первичного поражения, затем боль распространяется на другие ветви, нередко иррадиирует в затылок, к ушным нервам, в шею и даже в область грудных нервов.
Сильные приступы обычно сопровождаются вегетативными рефлекторными реакциями: покраснением лица, слезотечением, жидкими выделениями из носа, слюнотечением, иногда отёком щеки, века, небольшим припуханием половины носа.
К симптомам воспаления тройничного нерва также относится общее беспокойство, потирание болевой зоны рукой, давление на эту зону, причмокивание. Это наслоение новых раздражений, очевидно, ускоряет момент возникновения тормозного состояния в центре болевых восприятий, которым обычно сменяется приступ.
В качестве двигательных проявлений в связи с болевым приступом возникают тикообразные подёргивания мышц или спазматические сокращения. Максимальные подёргивания или сокращения мышц соответствуют, в основном, зонам, с которых начинается боль, т. е. местам первичного поражения.
При длительном заболевании иногда отмечается поседение волос головы на поражённой стороне.
Иногда пароксизмальные невралгии сопровождаются высыпанием herpes zoster (опоясывающий герпес), располагающегося соответственно первичным поражениям тех или других ветвей, иногда поражающего слизистую роговицы.
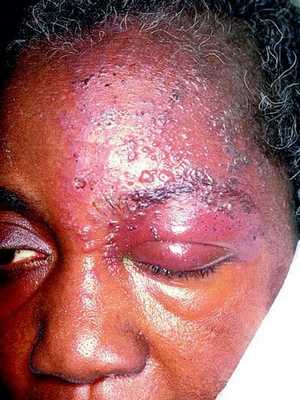
Периоды обострений могут чередоваться с периодами ремиссий, которые длятся месяцами, иногда годами.
Вне приступа обычно не наблюдается никаких расстройств: ни болевых точек, ни объективных расстройств чувствительности. Иногда можно отметить снижение болевой чувствительности главным образом в районе той ветви, которая являлась местом первичного поражения. Реже снижение чувствительности обнаруживается в области всех ветвей тройничного нерва. В отдельных случаях вне приступов больные испытывают лёгкие тупые боли. Болевые ощущения возникают в любое время, но чаще во сне. [6] [7]
Патогенез невралгии тройничного нерва
Патогенез невралгии тройничного нерва, как и локализация процесса, остаётся до конца неясным. Считается, что причиной данного страдания является сдавление корешка нерва в месте его выхода из моста изменёнными сосудами или опухолью, а причиной патологии у больных с рассеянным склерозом — образование бляшки в области чувствительного ядра тройничного нерва.
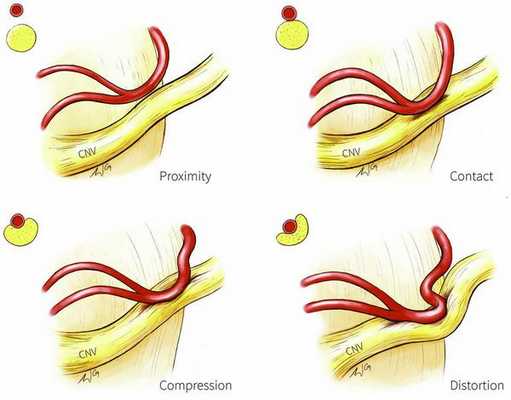
Предполагают центральную локализацию поражения на уровне понтобульбоспинальных центров, есть мнения о поражении в нисходящем корешке, связанном с ядром, или на уровне задних корешков. Имеющиеся патологоанатомические исследования, как правило, обнаруживали в гассеровых узлах изменения воспалительного или рубцового характера. Патологический очаг, изменяющий функцию узлов, влечёт за собой функциональные нарушения в расположенном выше зрительном бугре. Очаг раздражения в узле периодически под влиянием обычно внешних раздражений ведёт к возбуждению последнего с последующим возбуждением в расположенных выше центрах. Начавшись с одной точки, возбуждение затем распространяется по этим центрам. Далее сверхсильное возбуждение клеток сменяется торможением, которое распространяется в том же порядке, в каком происходила иррадиация болей. Результатом полного тормозного состояния является прекращение болей.
В этой схеме, объясняющей возникновение приступа пароксизмальной невралгии, имеется аналогия с эпилептическими припадками, только с той разницей, что реализация невралгических припадков ограничивается областью подкорки, и эти припадки никогда не ведут к последующему разлитому торможению коры головного мозга. Впрочем, это бывает иногда и при истинной парциальной эпилепсии. Если исходить из данного положения, то станет понятным, что наслаивание новых раздражений ускорит наступление тормозного состояния, т.е. конца приступа. К этим приёмам обычно и прибегают больные для купирования приступа. [8] [9]
Классификация и стадии развития невралгии тройничного нерва
Невралгия тройничного нерва бывает:
- первичной — истинной (эссенциальная или идиопатическая);
- вторичной — симптоматической:
- центральной;
- периферической (компрессионной).
Классификация по этиологическому фактору:
- травматическая НТН;
- инфекционная НТН;
- НТН в результате патологии обмена веществ в организме.
Классификация по уровню поражения:
- дентальная плексалгия;
- невралгия носоресничного нерва (синдром Чарлина);
- невралгия ушно-височного нерва (синдром Фрейя);
- синдром крылонебного узла (синдром Сладера);
- глоссофарингиальная невралгия;
- SUNCT-синдром;
- синдром поражения полулунного узла.
Классификация по нарушению функций:
- нарушение чувствительной функции тройничного нерва;
- нарушение двигательной функции тройничного нерва.
Осложнения невралгии тройничного нерва
Осложнения симптоматических вариантов НТН зависят в первую очередь от этиологии. При нейроинфекционных процессах, объёмных образованиях, аневризмах близлежащих сосудов, демиелинизирующих заболеваниях наиболее вероятны осложнения от основных заболеваний, вплоть до инвалидизации и летального исхода.
В случае идиопатической НТН чаще всего наблюдается переход в хроническую стадию: болезнь носит длительный характер, тянется непрерывно или с интервалами различной продолжительности, почти не поддаваясь окончательному излечению. Однако в некоторых случаях отмечают длительную ремиссию до 5-7 лет, но затем боли возобновляются. В периоды ремиссий типично щадящее поведение пациентов с НТН — они предпочитают жевать одной половиной рта, даже в тёплую погоду укрывают голову.
В начальных стадиях болезни, когда её причина установлена, соответствующее лечение может быстро ликвидировать воспалительный процесс без остаточных явлений в виде образования рубцов. Если рубцы образуются, рецидив болезни почти неизбежен — она приобретает хроническое течение.
В случае длительно протекающих невралгий нередки признаки нарушения трофики (питания) тканей в зоне иннервации нервного корешка, таких как сальность и истончение кожи. В случае НТН I ветви вероятны выпадение ресниц и бровей, вплоть до трофических язв роговицы. Кроме того в зоне иннервации снижается тактильная и/или температурная чувствительность.
Хронические лицевые боли, обусловленные НТН, приводят к снижению порога болевой чувствительности и могут быть «маской» скрытой депрессии. И наоборот, при длительно существующей хронической боли присоединяется депрессия, вследствие общности патогенетических механизмов. [11]
Диагностика невралгии тройничного нерва
Когда следует обратиться к врачу
При НТН посетить доктора нужно как можно раньше, так как в некоторых случаях боль может быть вызвана новообразованием, инфекцией или демиелинизирующим заболеванием.
Подготовка к посещению врача
Особая подготовка не требуется. Если у пациента есть результаты нейровизуализации, то снимки стоит взять с собой.
Инструментальная диагностика
В первую очередь при подозрении на НТН необходимо выполнить магнитную томографию или компьютерную томография головы с целью исключения серьёзной патологии.
Важно дифференцировать НТН с сирингомиелией и сирингобульбией, иногда начинающихся болями в области тройничного нерва, которые могут приобрести пароксизмальный характер. Наличие характерных для сирингомиелии симптомов и дефектов физического развития позволяют установить правильный диагноз.
Иррадиирующие боли при заболеваниях придаточных полостей носа, зубов сравнительно легко дифференцируются от невралгии. Боли тупые, не носят пароксизмальный характер, исчезают бесследно после излечения вызвавших их заболеваний. Если после излечения боли не проходят, следует думать о невралгии. Смешение невралгии с болями, иррадиирующими из зубов, нередко ведёт к ошибочному диагнозу и удалению здоровых зубов.
Боли в районе первых ветвей тройничных нервов, наблюдаемые при тиреотоксикозах, необходимо относить к токсическим невралгиям. Они всегда двусторонние, часто сочетаются с затылочными болями, носят упорный характер. Специальное лечение обычно снимает эти боли.
Дифференциальная диагностика
Инфекционные невралгии тройничного нерва приходится дифференцировать с невралгиями неинфекционной этиологии. В пожилом возрасте такие невралгии могут быть обусловлены склеротическими изменениями отверстий, через которые проходят ветви тройничного нерва, с кровоизлияниями в нерв или гассеров узел.
Этиологический диагноз приходится ставить только на основании анамнестических данных. Клинические признаки могут быть сходны только при склеротическом поражении одной ветви, пароксизмы не так сильны и не приобретают широкой иррадиации. Невралгии, возникшие в результате оболочечных воспалительных процессов и неопластических процессов в области гассерова узла и корешков, тройничного нерва, кариозных заболеваний пирамидки распознаются сравнительно легко. При всех этих заболеваниях обычно в процесс вовлекаются другие черепные нервы: слуховой, лицевой, отводящий. [12] [13]
Лечение невралгии тройничного нерва
Медикаментозное лечение
Медикаментозное лечение включает в себя приём антиконвульсантов. Лучше всего зарекомендовал себя карбамазепин («Тегретол», «Финлепсин»), который назначают по схеме, начиная со 100 мг, постепенно увеличивая дозу до 600-800 мг в зависимости от переносимости и наличия нежелательных явлений. Приём обычно длится 1-2 недели, далее, при улучшении состояния, отменяется, постепенно снижая дозировку.
Препаратами второго ряда являются баклофен, тизанидин и антидепрессанты, которые вначале назначаются в условиях стационара, а затем применяются в амбулаторных условиях с постепенной отменой при достижении улучшения.
Также дополнительно применяют витамины группы B и сосудистые препараты.
Используют блокады анестетиками в местах выходов соответствующих ветвей тройничного нерва, акупунктуру и остеопатические методы коррекции.
Физиотерапия
Из физиотерапевтических методов в остром периоде заболевания и во время приступа местно используют умеренное тепловое и/или ультрафиолетовое воздействие. Широко применяют курсовое воздействие диадинамическими токами, которые оказывают обезболивающее и противовоспалительное воздействие. В упорных случаях возможно использование анальгетиков типа прокаин, тетракаин, эпинефрин.
В подостром периоде положительно зарекомендовал себя эндоназальный электрофорез 4% раствора прокаина и 2% раствор витамина В1.
В случае хронических форм НТН показан массаж лица, грязевые или парафин-озокеритовые аппликации на воротниковую область.
Многообещающие перспективы сосредоточены на использовании ботулинического токсина. [18]
При неэффективности консервативной терапии показаны нейрохирургические методы лечения:
- невротомию или нервэктомию (перерезание или удаление нерва);
- клипирование аневризматически расширенных артерий — на мешотчатое расширение артерии накладывается металлическая скобка, прекращающая кровоток в этом расширении;
- ликвидация сдавления нерва в костных каналах внутри черепа — частично удаляются костные стенки канала;
- термическая коагуляция узла тройничного нерва;
- операции на гассеровом узле и чувствительном корешке тройничного нерва — электрокоагуляция, криодеструкция. [14][15][16][17]
Дополнительные методы лечения
Также используются когнитивно-поведенческая терапия, физические упражнения, релаксация, биологическая обратная связь, окклюзионные шины и трейнеры, массаж и многое другое как дополнительные методы помощи при хронических лицевых болях. [19]
Как снять боль при невралгии тройничного нерва
Самолечение при невралгии тройничного нерва может навредить пациенту. Уменьшить и предотвратить вероятность новых приступов можно, если своевременно лечить воспалительные и инфекционные заболевания, уменьшить психоэмоциональное перенапряжение, соблюдать режим труда и отдыха, не злоупотреблять алкоголем, острыми и горячими блюдами.
Прогноз. Профилактика
Прогноз эффективности лечения и длительности ремиссии зависит от степени нарушения тройничного нерва, своевременности начатого лечения, а также возраста пациента. Бесспорно, наилучший прогноз восстановительного лечения НТН можно ожидать при вторичных симптоматических проявлениях, когда причина не вызывает сомнения и хорошо поддаётся соответствующей терапии (например, одонтогенная или инфекционная НТН). При идиопатических НТН, этиология которых не ясна, курация наиболее затруднительна.
Профилактика прозопалгий имеет большое значение вследствие малых надежд на полное излечение хронических форм невралгий, поэтому профилактические мероприятия, в основном, сводятся к своевременному лечению заболеваний, которые могут провоцировать развитие НТН. Особое внимание необходимо уделить санации зубов, лечению ринитов и гайморита.
Важным условием профилактики является отсутствие переохлаждений и сквозняков. Необходимо избегать психотравмирующих факторов, закаляться. Немаловажная роль в профилактике принадлежит саногенезу, так как любое интеркуррентное заболевание как инфекционного, так и соматического плана, приводящее к ослаблению защитных сил организма, может привести к обострению НТН. [20] [21]
Читайте также:
