Приобретенная эпителиома беспигментного эпителия цилиарного тела: признаки, гистология, лечение, прогноз
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Отделение хирургической стоматологии ФГБУ "Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии" Минздрава РФ, Москва
Отделение патологии слизистой оболочки рта ФГБУ ЦНИИС и ЧЛХ Минздрава России, Москва
кафедра патологической анатомии Российского университета дружбы народов, Москва, Россия, 117198
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
Лейкоплакия: клинический и патоморфологический диагноз
Журнал: Стоматология. 2017;96(1): 72‑76
Лейкоплакия является одним из наиболее часто встречающихся облигатных предраковых заболеваний слизистой оболочки рта. Лечение лейкоплакии проводится в комплексе с хирургией. Удаленные ткани направляются на патоморфологическое исследование. В статье описаны клиника заболевания и соответствующие ему патологические процессы, наиболее часто выявляемые при патоморфологическом исследовании.
Лейкоплакия представляет собой гиперкератоз слизистой оболочки рта (СОР), сопровождающийся воспалением стромы и возникающий, как правило, в ответ на хронические экзогенные и эндогенные раздражения [12, 22, 29].
Лейкоплакия относится к одной из разновидностей кератозов, характеризующихся хроническим течением и поражающих СОР и красную кайму губ [2] под действием эндогенных и экзогенных факторов.
Лейкоплакия обычно диагностируется в среднем возрасте, распространенность заболевания увеличивается с годами. На долю идиопатической лейкоплакии полости рта приходится 10% случаев, а лейкоплакии, вызванной экзо- и эндогенными факторами, — 90% [49]. Чаще болеют мужчины [44].
Этиология и патогенез.
Несмотря на множество работ, посвященных лейкоплакии, вопрос об ее этиологии до сих пор остается открытым [20, 23, 33, 43]. Установлено, что появление участков лейкоплакии на СОР провоцируют слабые, но длительно действующие раздражители [36]: горячая или острая пища, крепкие спиртные напитки, табак и бетель, метеорологические (холод, ветер) и профессиональные факторы (анилиновые краски и лаки, пек, каменноугольные смолы, фенол, некоторые соединения бензола, формальдегид, продукты сухой перегонки угля, пары бензина, бром и др.) [7].
К основным экзогенным причинам нарушения кератинизации слизистой рта относят употребление алкоголя, горячей, острой и пряной пищи, а также курение [4, 45].
В последнее время выявлена взаимосвязь между наличием вирусной инфекции (а именно вируса папилломы человека — ВПЧ), возможным началом развития лейкоплакии и впоследствии ее озлокачествлением [2, 18, 35].
Хроническая травматизация СОР острыми краями разрушенных зубов и неправильно изготовленными протезами может привести к ограниченному гиперкератозу и возникновению лейкоплакических бляшек. Возникающий при наличии в сплаве протеза разнородных металлов гальванический ток также может способствовать нарушению кератинизации слизистой оболочки [5, 16]. При локализации лейкоплакии на красной кайме губ имеет значение хроническая травма сигаретой, трубкой, мундштуком [16, 46].
Лейкоплакия является профессиональным заболеванием лиц, работающих на химическом производстве и в горячих цехах [40].
Эндогенные факторы также оказывают огромное влияние на возникновение и клиническое течение лейкоплакии.
Установлена взаимосвязь между возникновением лейкоплакии и стрессом, гормональными расстройствами [10], наличием патологии желудочно-кишечного тракта (ЖКТ) [9, 15], недостатком витаминов А, Е, B12 [24, 27, 38, 47, 48], а также генетической предрасположенностью [13, 14, 19, 32].
Прослеживается связь возникновения и развития лейкоплакии с хронической кандидозной инфекцией [31, 54].
У некоторых пациентов выявляются эндокринные заболевания, в частности диабет типов 1 и 2. В качестве причин возникновения лейкоплакии указывают колебания уровня соотношения половых стероидных гормонов, связанные с возрастной инволюцией, что нарушает процессы метаболизма и синтеза белка и, в свою очередь, снижает устойчивость тканей к воздействию неблагоприятных факторов, но прямой корреляции между этими факторами и возникновением лейкоплакии не прослеживалось [10, 15].
Вопрос о связи между наличием лейкоплакии и ВПЧ остается спорным, хотя у многих пациентов с лейкоплакией обнаруживается ВПЧ 16-го типа [2, 39, 42, 51].
Классификация лейкоплакии СОР
По современной классификации ВОЗ 10-го пересмотра (1999), различают гомогенную и негомогенную лейкоплакию. Негомогенная лейкоплакия, в свою очередь, подразделяется на эритроплакию, узелковую, пятнистую и веррукозную лейкоплакию [19, 22, 28, 34, 50]. Накоплены данные о том, что негомогенная лейкоплакия, особенно пятнистая, в 50% случаев представляет собой дисплазию эпителия и характеризуется высокой частотой малигнизации [8].
В 2005 г. ВОЗ приняла еще 1 классификацию заболеваний головы и шеи, в которой появляется понятие «эпителиальный предрак» [52], к которому, в свою очередь, относят эритроплакию и лейкоплакию СОР. Согласно этому, лейкоплакия гистологически подразделена на очаговую эпителиальную гиперплазию (без атипии), дисплазию низкой, средней и высокой степени. Для последних 3 видов лейкоплакии было введено понятие «плоскоклеточная интраэпителиальная неоплазия» (Squamous Intraepithelial Neoplasia — SIN) от 1 до 3 степеней тяжести. Главная особенность классификации SIN —четкое отображение каждого этапа злокачественной трансформации эпителия СОР [53].
Следует отметить, что эта классификация является в первую очередь патоморфологической и дополняет собственно клинический диагноз.
Гистологическое строение неизмененного эпителия СОР
Неизмененный некератинизированный многослойный плоский эпителий СОР включает в себя базальную мембрану, базальный слой, представленный 1 рядом клеток, имеющих цилиндрическую либо кубическую форму; дальше следуют парабазальный клеточный слой, состоящий из 1—2 рядов клеток, расположенных над базальными и не имеющих связи с базальной мембраной, потом — шиповатый слой, который содержит 5—6 рядов крупных, неправильной формы клеток с отростками, затем отмечается уплощение клеток и их превращение в плоские. На твердом небе, спинке языка и деснах в ороговевшем эпителии к шиповатому слою прилежит зернистый, состоящий из клеток удлиненной формы с кератиносомами и кератогиалиновыми гранулами, а также роговой слой с рядами ороговевших клеток, в которых ядра и цитоплазматические органеллы не выявляются. Цитологически от базального к поверхностному кератиновому слою эпителия отмечается прогрессивное уменьшение ядерно-цитоплазматического соотношения и накопление внутриклеточного кератина [3].
Клинико-морфологическая характеристика лейкоплакии
Клиническая картина лейкоплакии зависит как от формы заболевания и вызывающего ее фактора, так и от локализации. Лейкоплакия — заболевание хроническое; больные часто не могут уточнить момент его начала. Клинически лейкоплакия проявляется гиперпластическими процессами в многослойном плоском эпителии под воздействием разных повреждающих агентов и выражается в формировании поверхностного гиперкератоза. Парабазальный, базальный и поверхностные слои эпителия изменяются. Клинически лейкоплакия имеет несколько форм, гистологически может характеризоваться различными нозологическими процессами — от доброкачественного гиперкератоза до инвазивной плоскоклеточной карциномы. Поэтому все иссеченные ткани обязательно должны быть направлены на патоморфологическое исследование, которое должно включать в себя гистологическое и иммуногистохимическое (ИГХ) исследование.
ИГХ-исследование представляет собой метод идентификации специфичных антигенных свойств злокачественных опухолей. ИГХ-методы используются для локализации того или иного клеточного или тканевого компонента (антигена) in situ посредством связывания его с мечеными антителами и являются неотъемлемой частью современной диагностики рака, обеспечивая обнаружение в тканях различных клеток, маркеров пролиферации, клеточной зрелости, факторов акантоза.
В дальнейшем для визуализации антигенов используют специфические антитела и реагенты.
Лейкоплакия — это сугубо клинический термин; в настоящее время он не используется для морфологического описания. При лейкоплакии можно выявить 4 вида изменений: очаговую эпителиальную гиперплазию; плоскоклеточную интраэпителиальную неоплазию 1-й степени (SINI), плоскоклеточную интраэпителиальную неоплазию 2-й степени (SINII) и плоскоклеточную интраэпителиальную неоплазию 3-й степени (SINIII) [17].
При очаговой эпителиальной гиперплазии отмечают увеличение толщины эпителия в связи с увеличением одного из компонентов базального, шиповатого (акантоз) или поверхностного (гипер- и паракератоз) слоев. Она может сопровождаться воспалительными и реактивными цитологическими изменениями.
При плоскоклеточной интраэпителиальной неоплазии I степени в эпителии имеются клетки с незначительно измененными цитологическими характеристиками; изменения ограничены нижней третью эпителия; при этом сохраняется нормальное созревание эпителиальных клеток в верхних 2/3 эпителия. Могут выявляться ограниченные базальным слоем митозы нормальной конфигурации, также возможен гиперкератоз.
При плоскоклеточной интраэпителиальной неоплазии II степени измененные клетки с атипическими цитологическими характеристиками отмечаются уже в нижней и средней трети эпителия. В ядрах определяются крупные ядрышки; таким образом, более выражена клеточная атипия. Дифференцировка клеток и тканей сохранена в верхней трети слизистой оболочки, митозы отмечаются в промежуточном и парабазальном слоях.
При плоскоклеточной интраэпителиальной неоплазии 3-й степени (SIN III) в активно пролиферирующих клетках выявляют митотическую активность; они занимают более 2/3 эпителиального слоя. Однако в них нет цитологической атипии, характерной для карциномы in situ. Дифференцировка клеток сохранена в поверхностных слоях. Может присутствовать гиперкератоз. По мере нарастания неопластических изменений в эпителии в подлежащей дерме усиливаются воспалительные явления, сопровождающиеся инфильтрацией лимфоцитами.
Клинически процесс обычно начинается с так называемой предлейкоплакической стадии, которая характеризуется воспалением участка СОР. На красной кайме губ эту стадию наблюдают редко [12].
После этого происходит ороговение, развивается так называемая плоская, или простая, форма лейкоплакии, представляющая собой равномерное ороговение ограниченного участка слизистой оболочки, которое является результатом гиперплазии эпителия и сопровождается хроническим воспалением стромы. Наиболее часто данная форма лейкоплакии локализуется на слизистой оболочке щек, по линии смыкания зубов и в углах рта, на языке. Пораженные участки слизистой могут иметь разную форму; так, возможно ороговение ограниченного участка слизистой оболочки щеки в виде полос с четкими границами и неправильными очертаниями, не снимающееся при соскабливании.
Субъективные ощущения при плоской лейкоплакии почти отсутствуют. Пациенты могут отмечать косметический недостаток в виде белесоватого участка слизистой или шероховатость. Заболевание характеризуется разной степенью утолщения эпителиального слоя и вовлечением в хронический воспалительный процесс собственной пластинки СОР; клинически воспалительная реакция имеет вид хронического воспаления или не проявляется вовсе. Важным признаком данной формы лейкоплакии является то, что участки СОР, подвергшиеся ороговению, не возвышаются над окружающими тканями.
Патоморфологически эта форма лейкоплакии описывается как очаговая эпителиальная гиперплазия, при которой проявления гиперкератоза чередуются с паракератозом. Если ороговение носит характер паракератоза, наиболее выражены явления акантоза. Собственная пластинка СОР в зоне поражения имеет воспалительный инфильтрат из мононуклеарных клеток и плазмоцитов, который чередуется с очагами фиброза и склероза. Соединительная ткань полнокровная, отечная, разрыхленная. Выражен парабазальный слой эпителия. Толщина шиповидного слоя — 40—50 рядов клеток, отмечается акантоз.
Таким образом, паракератоз при плоской лейкоплакии чаще сочетается с эпителиальной гиперплазией, при которой базальная мембрана остается хорошо определяемой в виде линии, отделяющей утолщенный эпителий от подлежащей стромы.
Плоская форма лейкоплакии может протекать годами без изменений или может переходить в веррукозную форму.
Веррукозная лейкоплакия — особая форма лейкоплакии. Основной ее клинический признак — значительно возвышающийся над уровнем СОР и резко отличающийся от нее по цвету участок выраженного ороговения. Очаги гиперкератоза имеют яркий молочно-белый цвет.
Различают бляшечную и бородавчатую формы веррукозной лейкоплакии [30]. При бляшечной форме определяются ограниченные молочно-белые, иногда — соломенно-желтые округлые образования с четкими контурами, возвышающиеся над окружающей слизистой оболочкой. Наиболее выраженную склонность к злокачественной трансформации имеет веррукозная лейкоплакия с бородавчатыми разрастаниями [1, 8, 21, 26].
Бородавчатая разновидность веррукозной лейкоплакии характеризуется плотными серовато-белыми бугристыми образованиями, возвышающимися на 2—3 мм над уровнем слизистой оболочки; она обладает бо́льшим потенциалом к озлокачествлению, чем бляшечная. Ряд зарубежных и отечественных авторов отмечают, что именно веррукозная лейкоплакия в 70% случаев трансформируется в плоскоклеточный рак [6, 8, 11, 25, 37].
Гистологически эпителиальный покров слизистой оболочки резко утолщен за счет разрастания рогового и зернистого слоев. В цитоплазме клеток зернистого слоя увеличивается количество кератогиалина. Самые поверхностные клетки имеют вид тонких чешуек с плотной гомогенной эозинофильной протоплазмой и дегенерирующими ядрами. Тонкие соединительнотканные сосочки глубоко вдаются в толщу покровного эпителия. Акантоз выражен; в подлежащей, отечной и разрыхленной, соединительной ткани определяются хроническое воспаление, гиперемия, клеточная инфильтрация. При веррукозной лейкоплакии обнаруживают выраженный гиперкератоз, редко сочетающийся с небольшими очагами паракератоза; иногда в патологический процесс вовлечен блестящий слой; зернистый слой состоит из 4—5 рядов клеток с хорошо выраженными гранулемами, шиповатый слой — из 8—12 рядов клеток. Возможно выявление атипичных клеток. В отдельных случаях акантоз сопровождается удлинением и расширением эпителиальных выростов. Наблюдают изменения клеток шиповатого слоя. Клетки — разной величины и формы, имеют крупные гиперхромные ядра, содержащие в среднем 2—4 крупных ядрышка.
Эрозивная форма лейкоплакии — самая злокачественная [41]. При эрозивной форме лейкоплакии появляются трещины и эрозии, которые неизбежно подвергаются механическому и термическому воздействию.
Эрозии возникают как результат травмирования очагов лейкоплакии простой и веррукозной форм механическими и термическими факторами. Как правило, это наблюдается на слизистой оболочке языка, щек, красной каймы губ. При усилении ороговения, появлении инфильтрации в основании кровоточащей и незаживающей эрозии можно говорить об озлокачествлении процесса.
Гистологическое исследование показывает, что слизистая оболочка утолщена, расширены шиповидный слой и межклеточные пространства. Тяжи эпителия глубоко вдаются в толщину соединительнотканного слоя, разграничивая вытянутые, тонкие сосочки — акантоз. Эпителий местами разрыхлен; в местах потери эпителия формируются эрозии. Наблюдается хроническое воспаление в собственной пластинке слизистой оболочки, выражена межклеточная инфильтрация с примесью плазматических клеток и мононуклеарных клеток.
При подозрении на плоскоклеточный рак гистологическая картина характеризуется появлением участков гиперкератоза овальной формы с так называемыми «раковыми жемчужинами». Определяются комплексы атипичных клеток плоского эпителия с инвазивным ростом в собственную пластинку слизистой оболочки. Атипичные клетки имеют цитологические признаки злокачественности, включая высокое ядерно-цитоплазматическое соотношение, выраженные 1 или несколько ядрышек, ядерную гиперхромазию и плеоморфизм, патологические митозы.
Таким образом, заключение патоморфолога будет содержать не клинический диагноз, а диагнозы (SIN), такие как очаговая эпителиальная гиперплазия, плоскоклеточная эпителиальная неоплазия разной степени (от 1-й до 3-й), наличие или отсутствие атипичных клеток, гиперкератоз, веррукозная лейкоплакия или плоскоклеточный рак [17].
Исходя из вышеизложенного, лейкоплакия — клинический термин. Патоморфологическое заключение содержит описание в соответствии с классификацией ВОЗ 2005 г.: описана степень поражения слизистой оболочки в зависимости от глубины. Наличие гиперкератоза и гиперплазии следует рассматривать как подтверждение клинического диагноза «лейкоплакия». Ведущим клиническим признаком веррукозной лейкоплакии являются сильно возвышающиеся над окружающей слизистой очаги гиперкератоза, а при язвенно-эрозивной — очаги эрозий.
Если описаны частые митозы, скопление атипичных клеток с несколькими ядрами большого размера, можно говорить о карциномеinsitu. Лейкоплакия рассматривается как предраковое заболевание. Наиболее склонны к озлокачествлению веррукозная и эрозивно-язвенная ее формы, поэтому при хирургическом лечении патоморфологическое исследование, включая ИГХ, является обязательным.
Эпителиома
Эпителиома — это опухоль кожи и слизистых оболочек, развивающаяся из клеток их поверхностного слоя — эпидермиса. Эпителиомы отличаются многообразием клинических вариантов от небольших узелков до опухолей значительного размера, бляшек и язв. Могут иметь доброкачественную и злокачественную природу. Их диагностика включает дерматоскопию, бакпосев отделяемого, УЗИ образования, гистологическое исследование удаленных тканей или биопсийного материала. Лечение в основном хирургическое, при злокачественном характере опухоли — лучевое, химиотерапевтическое, фотодинамическое, с применением как общих, так и локальных способов воздействия.
МКБ-10
Общие сведения
В современной дерматологии большинство авторов относят к эпителиомам следующие новообразования кожи: базалиому (базально-клеточную эпителиому), плоскоклеточный рак (спиноцеллюлярную эпителиому) и трихоэпителиому (аденоидную кистозную эпителиому). Попытки некоторых исследователей отождествить эпителиому с раком кожи представляются нецелесообразными, поскольку среди эпителиом встречаются доброкачественные новообразования кожи, лишь в редких случаях претерпевающие злокачественную трансформацию. Большинство эпителиом возникает у пациентов зрелого и пожилого возраста. Наиболее распространенной эпителиомой является базалиома, на долю которой приходится 60-70% всех случаев заболевания.
Причины эпителиомы
К развитию эпителиомы приводят различные неблагоприятные факторы, хронически воздействующие на кожу и часто связанные с профессиональной деятельностью. К ним относятся:
- повышенная солнечная инсоляция;
- радиоактивное облучение;
- влияние химических веществ;
- постоянная травматизация кожи;
- локальные воспалительные процессы.
В связи с эти возникновение эпителиомы возможно на фоне хронического солнечного дерматита, лучевого дерматита, профессиональной экземы, травматического дерматита, на месте рубца после перенесенного ожога.
Симптомы эпителиомы
Базалиома
Базально-клеточная эпителиома чаще возникает на коже лица и шеи. Отличается многообразием клинических форм, большинство из которых начинаются с образования на коже небольшого узелка. Базально-клеточная эпителиома считается злокачественным образованием, так как она обладает инвазивным ростом, прорастает не только дерму и подкожную клетчатку, но также подлежащие мышечные ткани и костные структуры. Однако при этом она не склонна давать метастазы.
К редким формам базалиомы относятся саморубцующаяся эпителиома и обызвествленная эпителиома Малерба. Саморубцующаяся эпителиома характеризуется распадом типичного базалиомного узелка с образованием язвенного дефекта. В дальнейшем происходит медленное увеличение размеров язвы, сопровождающееся рубцеванием отдельных ее частей. В некоторых случаях переходит в плоскоклеточный рак кожи.
Обызвествленная эпителиома Малерба
Пиломатриксома — это доброкачественная опухоль, появляющаяся в детском возрасте из клеток сальных желез. Проявляется образованием в коже лица, шеи, волосистой части головы или плечевого пояса единичного очень плотного, подвижного, медленно растущего узелка, величиной от 0,5 до 5 см.
Спиноцеллюлярная эпителиома
Развивается из клеток шиповатого слоя эпидермиса и отличается злокачественным течением с метастазированием. Излюбленная локализация — кожа перианальной области и гениталий, красная кайма нижней губы. Может протекать с образованием узла, бляшки или язвы. Характеризуется быстрым ростом как по периферии, так и в глубину тканей.
Аденоидная кистозная эпителиома
Встречается чаще у женщин после пубертатного периода. В большинстве случаев она представлена множественными безболезненными опухолями размером до крупной горошины. Цвет образований может быть голубоватым или желтоватым. Изредка встречается белесоватый цвет, из-за которого элементы эпителиомы могут напоминать угри. В отдельных случаях наблюдается появление одиночной опухоли, достигающей размеров лесного ореха.
Типичная локализация элементов — ушные раковины и лицо, реже поражается волосистая часть головы, еще реже — плечевой пояс, живот и конечности. Характерно доброкачественное и медленное течение. Лишь в единичных случаях наблюдается трансформация в базалиому.
Диагностика
Многообразие клинических форм эпителиомы несколько затрудняет ее диагностику. Поэтому, проводя обследование, дерматолог старается подключить все возможные методы исследования: дерматоскопию, УЗИ кожного образования, бакпосев отделяемого отделяемого язвенных дефектов. Однако окончательный диагноз с определением клинической формы заболевания, его доброкачественности или злокачественности, позволяет установить только гистологическое исследование полученного при удалении эпителиомы или биопсии кожи материала. Дифференциальную диагностику проводят с:
- красным плоским лишаем;
- псориазом;
- болезнью Боуэна;
- системной красной волчанкой;
- склеродермией;
- себорейным кератозом;
- болезнью Кейра и др.
Аденоидная кистозная эпителиома требует дифференцировки от гидраденита, ксантелазмы, плоскоклеточного рака кожи, обыкновенной бородавки.
Лечение эпителиомы
Основной способ лечения эпителиомы, независимо от ее клинической формы, - это хирургическое иссечение образования. При мелких множественных опухолях возможно применение криодеструкции, удаления лазером, кюретажа или электрокоагуляции. При глубоком прорастании и наличии метастазирования операция может носить паллиативный характер. Злокачественная природа опухоли является показанием к сочетанию хирургического лечения с рентгенорадиотерапией, фотодинамической терапией, наружной или общей химиотерапией.
Прогноз
При доброкачественном характере заболевания, своевременном и полном удалении опухоли прогноз благоприятный. Базально-клеточная и спиноцеллюлярная эпителиома склонны к частым послеоперационным рецидивам, для раннего выявления которых необходимо постоянное наблюдение дерматоонколога. Наиболее неблагоприятной в прогностическом плане является спиноцеллюлярная форма заболевания, особенно при развитии метастазов опухоли.
Цилиарное тело
Кровеносные сосуды создают в цилиарном теле густые сплетения, питая непосредственно цилиарное тело, а также радужную оболочку. Мельчайшие капилляры, в ресничных отростках, бесперебойно образуют внутриглазную жидкость в необходимом для функционирования глаза объеме, посредством фильтрации из кровотока. Внутриглазная жидкость создает постоянное внутриглазное давление, которое и обеспечивает все основные функции органа зрения. Вместе с тем, цилиарное тело, прикрепленное к выступу склеры, служит опорой для следующего элемента сосудистой оболочки - радужки глаза.
Строение цилиарного тела
В сосудистой оболочке глаза, цилиарное тело занимает среднюю часть. Оно расположено за радужкой по окружности глаза. Снаружи цилиарное тело прикрыто склерой, поэтому не определяется при визуальном осмотре. На срезе тело имеет форму треугольника, вершина которого выступает в полость глаза. Структурно цилиарное тело включает две части: плоскую - шириной 4 мм, прилегающую к зубчатой линии, и ресничную - шириной 2 мм, на которой помещается около 80 ресничных отростков.
Ресничным отростком называют небольшую пластинку, внутри которой выявляется выраженная сеть сосудов крови, занятых фильтрацией кровотока, для образования внутриглазной жидкости.
На клеточном уровне, строение цилиарного тела состоит из мезодермального слоя, включающего мышечную и соединительную ткани, а также нейроэктодермального слоя, который содержит нефункциональные слои перешедшего с сетчатой оболочки эпителия.
Слои клеток в цилиарном теле, располагаются следующим образом изнутри наружу: мышечный слой, сосудистый, базальная пластинка, эпителий пигментный и беспигментный, внутренняя пограничная мембрана.
Мышечный слой в цилиарном теле играет главную роль при аккомодации. В нем принято разделять группы мышечных пучков, пролегающих разнонаправленно: мышца Брюке - расположена снаружи в продольном направление, лежащие глубже мышечные волокна направленны радиально (мышца Иванова) и циркулярно (мышца Мюллера). Внутренней поверхностью цилиарное тело связывается с хрусталиком глаза посредством ресничного пояска. Задача пояска - удерживать хрусталик в нужном положении, а кроме того, обеспечивать работу аккомодации при помощи цилиарной мышцы. В цилиарном теле, принято выделять цилиарные волокна - передние и задние. Передние крепятся в зоне экватора хрусталика, а также за ним, а задние крепятся начиная от зубчатой линии, спереди от экватора. Натяжение цилиарной мышцы расслабляет связки, снимая напряжение капсулы хрусталика и хрусталик становится округой формы. Если мышца расслабляется, напрягаются связки и хрусталик вытягивается.
Сосудистый слой является продолжением слоя сосудов хориоидеи. Большей частью, он содержит различного калибра вены. Артерии хориоидеи лежат в околососудистом пространстве, при этом, в цилиарном теле они расположены в мышечном слое, отдавая назад в хориоидею мелкие веточки.
Также и базальная пластинка является продолжением слоев хориоидеи. Изнутри ее устилает пигментированный и беспигментный эпителий, слои которого представляют собой нефункциональную сетчатую оболочку, ограниченную от стекловидного тела пограничной внутренней мембраной.
Снабжение цилиарного тела кровью и питательными компонентами обеспечивается двумя длинными задними цилиарными артериями, проходящими от заднего полюса до цилиарного тела глаза в надсосудистом пространстве сосудистой оболочки.
К цилиарному телу подведено много нервных окончаний, правда, у новорожденных они развиты недостаточно, что делает многие заболевания безболезненно протекающими. Функции цилиарного тела полностью развиваются у детей лишь к возрасту 7-10 лет.
Приобретенная эпителиома беспигментного эпителия цилиарного тела: признаки, гистология, лечение, прогноз
Первый МГМУ им. И.М. Сеченова
Поликлиника №1 НМХЦ им. И.Н. Пирогова
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
Российская медицинская академия последипломного образования, Москва
Методы диагностики базально-клеточного рака кожи
Журнал: Клиническая дерматология и венерология. 2012;10(2): 24‑27
Юрченко А.И., Индилова Н.И., Потекаев Н.Н., Червонная Л.В., Ткаченко С.Б., Колобяков А.А., Кузьмина Т.С. Методы диагностики базально-клеточного рака кожи. Клиническая дерматология и венерология. 2012;10(2):24‑27.
Iurchenko AI, Indilova NI, Potekaev NN, Chervonnaia LV, Tkachenko SB, Kolobiakov AA, Kuz'mina TS. Methods of diagnostics of basal cell skin cancer. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):24‑27. (In Russ.).
Представлены данные об эпидемиологии, классификации, клинико-патоморфологических особенностях базально-клеточного рака кожи. Рассмотрены современные методы его диагностики, в частности, неинвазивные, к которым относится лазерная конфокальная сканирующая микроскопия.
Базалиома (синонимы: базально-клеточный рак — БКР, базально-клеточная эпителиома, карциноид кожи, базально-клеточная карцинома, кориум-карцинома, ulcus rodens) является самым распространенным злокачественным образованием кожи. Заболеваемость базалиомами высока во всем мире. Отмечается отчетливая тенденция к росту числа больных, темп которой соответствует общему росту заболеваемости злокачественными опухолями.
В Австралии рак кожи диагностируется у 40 человек на 100 тыс. населения, в Европе и США — у 12—14, в России — у 25—27. По данным зарубежных авторов, базалиома наблюдается в 69—78% эпителиальных опухолей кожи. По данным отечественных источников (Госкомстат РФ, Московский НИИ косметологии МЗ РФ), базалиомы составляют 15,3% всех эпителиальных новообразований кожи.
Классическая диагностика базально-клеточного рака кожи (БКРК) включает гистологический метод, являющийся «золотым стандартом» диагностики базалиомы, и цитологию мазков, позволяющие верифицировать диагноз на основании обнаружения специфических патоморфологических признаков.
Биопсия опухоли при раке кожи обязательна, она позволяет установить гистологический тип опухоли и уменьшить число диагностических ошибок. Ее можно выполнять до проведения терапии, на амбулаторном этапе обследования больного и во время лечения, например при криодеструкции опухоли. Материал для гистологического исследования обычно берут из уплотненного края опухолевой язвы на границе с неизмененной тканью. Характерной гистологической структурой базалиомы является клеточный комплекс, состоящий из мелких, так называемых базалиоидных, интенсивно окрашенных клеток. Их ядра компактные, имеют округлую или овальную форму, гиперхромны при окрашивании гематоксилином, структура хроматина и ядрышки обычно незаметны, цитоплазма скудная и, как правило, базофильная. По периферии клеточных комплексов отмечается зона радиально расположенных более крупных клеток высокой призматической формы с овальными или слегка вытянутыми ядрами, так называемый частокол, или палисад, наличие которого является одним из главных гистологических признаков базалиомы. Опухолевые клетки не имеют межклеточных мостиков, чем и отличаются от клеток базального слоя нормального эпидермиса. В базалиомах нередко встречаются митозы, обычно правильные. Клеточно-волокнистая соединительнотканная строма опухоли формирует пучковые структуры, содержит мукоидную субстанцию, окрашивающуюся метахроматично толуидиновым синим, в ней часто видны инфильтраты из лимфоцитов и плазматических клеток. Между эпителиальными опухолевыми комплексами и стромой часто выявляются щели (характерный признак БКРК), которые многие авторы расценивают как артефакт фиксации, хотя не отрицается вероятность воздействия избыточной секреции гиалуронидазы.
Гистологическая картина БКР характеризуется чрезвычайным многообразием структур. В опухолях часто обнаруживаются признаки разной клеточной дифференцировки, наличие зернистости или пигмента, что явилось причиной появления множества гистологических классификаций.
В нашей стране пользуются классификацией, предложенной А.П. Апатенко. Автором были выделены следующие группы базалиом:
1. Недифференцированные или малодифференцированные базалиомы:
А) недифференцированная базалиома преимущественно солидного строения (иногда с наличием едва уловимой железистой или пилоидной дифференцировки);
Б) пигментированная базалиома;
В) поверхностная мультицентрическая базалиома.
2. Дифференцированные базалиомы:
А) с железистой дифференцировкой (аденоидная);
Б) с пилоидной дифференцировкой (трихобазалиома);
В) с сальной дифференцировкой;
Г) с плоскоэпителиальной (эпидермоидной) дифференцировкой;
Д) сложного строения (с наличием разных типов дифференцировки).
3. Особые формы базалиом:
А) склеродермоподобная (или «морфеа»);
Б) базалиома типа фиброэпителиальной опухоли Пинкуса;
В) базалиома, возникшая в стенке эпидермальной кисты.
Разделение базалиом на недифференцированные и дифференцированные формы, а дифференцированных — на отдельные морфологические варианты в соответствии с типом дифференцировки носит в известной мере условный характер. «Чистые» морфологические варианты встречаются достаточно редко. Как правило, в каждой опухоли в том или ином количестве обнаруживаются недифференцированные и дифференцированные структуры, а также различные их сочетания.
Из более поздних классификаций следует упомянуть две. Классификация, предложенная Т. Wade и А. Ackerman, в которой авторы выделяют 26 самостоятельных гистологических вариантов базалиомы, не объединяя их в какие-либо группы, что облегчает дифференциальную диагностику БКР, отражает все их возможное разнообразие. В 1991 г. L. Lowe и R. Rapini разработали классификацию, основанную главным образом на морфологических признаках, имеющих прогностическое значение. Следует иметь в виду, что в настоящее время в морфологической диагностике применяется широкий спектр иммуногистохимических маркеров, позволяющих уточнить индивидуальный прогноз опухоли (в частности, маркеры пролиферации — Ki-67, PCNA, ген-супрессор малигнизации Р53 и ряд других).
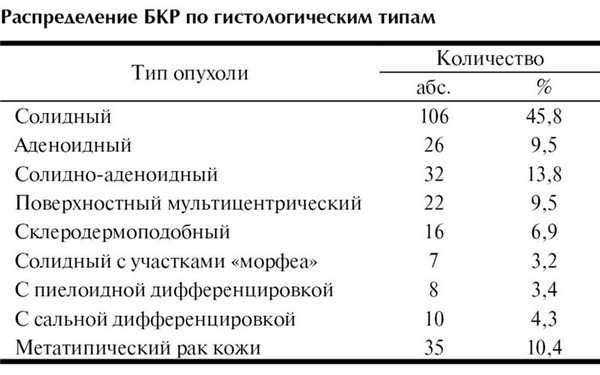
Частота встречаемости разных типов базалиом, по данным отделения патоморфологии МОНИКИ им. М.Ф. Владимирского, представлена в таблице (данные 1997 г.).
Цитологическое исследование позволяет быстро, в амбулаторных условиях морфологически верифицировать рак кожи. Оно легко выполнимо, безболезненно, не вызывает осложнений и имеет высокую точность (88—90%). Как правило, делают соскобы с поверхности опухоли с помощью скальпеля и тонким слоем наносят материал на обезжиренное предметное стекло. Перед тем как взять материал, с поверхности опухоли удаляют некротические ткани. При отсутствии изъязвления эпидермиса можно выполнить пункцию опухоли с аспирацией ткани и нанести ее на предметное стекло. Отрицательные данные однократного цитологического исследования опухоли при клиническом подозрении на рак кожи не должны служить причиной отказа от дальнейших исследований. Так, заживление узелково-язвенной формы БКР часто может проходить нормальным эпидермисом, тогда как в глубине очага сохраняются атипичные клетки.
Основным недостатком гистологического и цитологического методов является отсроченность получения результатов.
В настоящее время появляются новые методики диагностики, позволяющие с максимально возможной вероятностью верифицировать диагноз базалиомы.
Необходимо признать, что верификация клинического диагноза с помощью классического гистологического метода в некоторых случаях бывает очень сложной и субъективной. Решение этой проблемы лежит в привлечении дополнительного высокодостоверного, объективного исследования — компьютерной плоидометрии. Этот метод основан на определении количественных показателей ДНК в пересчете на плоидность в ядрах так называемых базалиоидных клеток исследуемых новообразований.
Известно, что нарушение созревания клеток при дисплазии и при злокачественной их трансформации связано с количественными изменениями ДНК и характеризуются полиплоидией и анеуплоидией, что приводит к выраженному увеличению количества ДНК в ядрах опухолевых клеток. Следовательно, по этому показателю можно судить о нарушении созревания клеток, их анаплазии, что можно считать критерием биологических особенностей опухолевых клеток.
Согласно закону Г.Г. Автандилова (2006), первое удвоение содержания ДНК в ядрах опухолевых клеток свидетельствует о предраковых изменениях, а второе — о возникновении злокачественной опухоли.
Компьютерная плоидометрия позволяет получать данные количественного содержания ДНК в плоидометрическом выражении в базалиоидных клетках и может использоваться для уточнения дифференциальной диагностики.
Компьютерное микроспектрофотометрическое исследование срезов проводится на анализаторе изображений. Компьютерный анализатор Имаджер-медиа, отличительной особенностью которого являются унификация алгоритма распознавания изображений, обнаружение и классификация объектов по яркости и геометрическим параметрам, позволяет проводить качественную дифференциальную диагностику. Метод Г.Г. Автандилова по сравнительной микроспектрофотометрии в плоидометрическом выражении позволяет объективизировать дифференциальную диагностику БКР.
На серийных парафиновых срезах, окрашенных по методике Фейльгена (без окрашивания фона), исследуют поля зрения препарата при увеличении микроскопа в 400. Изучают клетки в типичных участках: с нормальным гистологическим строением, с признаками гиперплазии, легкой, умеренной и тяжелой степеней дисплазий, а также участки БКР.
По средней интегральной яркости лимфоцитов, присутствующих в исследованных срезах, получают значение «тканевого стандарта плоидности», соответствующее двойному набору хромосом. Данные о плоидности интерфазных ядер изучаемых опухолей рассчитывают путем деления средних показателей интегральной яркости этих клеток на полученный стандарт.
В отличие от непосредственных измерений целых ядер клеток в цитологических мазках, при изучении одинаковых по толщине и окраске гистологических срезов, получают косвенную информацию о средних значениях содержания ДНК в ядрах клеток по выборкам целых ядер и их фрагментов, используя специальную математическую обработку результатов измерений ядер клеток ростковых зон новообразований.
Далее проводят микроспектрофотометрическое исследование ядер базалиоидных клеток путем автоматического деления интегральной яркости ядер исследуемых клеток на интегральную яркость, соответствующую единице плоидности. Толщина препарата, условия освещения и пороги яркости измеряемых объектов сохраняют одинаковыми для всех измерений.
На экран монитора компьютера и на печать выводятся результаты измерений: площадь оптического сечения ядер клеток (в пикселях), их плоидность (в единицах «с») значения лимитов показателей, средние арифметические: простые (М) и Мвзвешенные (Мвзв - «ИНДНК» — «индекс накопления ДНК»), среднеквадратические отклонения (σ) и ошибки выборок (m), а также гистограммы распределения показателей плоидности выделенных ядер клеток. В зависимости от плоидности ядра клеток и количество клеток (столбики на гистограммах) представляют разными псевдоцветами. Гистограммы распределения клеток по плоидности их ядер характеризуют клеточный состав на разных стадиях развития новообразований. Эквивалентом пролиферативной активности клеток считают среднее количество синтезированной в ядрах ДНК, превышающее значения диплоидного уровня.
При постановке гистоплоидометрического диагноза руководствуются требованиями патента РФ на изобретение №224099 от 10.08.04 «Способ дифференциальной диагностики стадий канцерогенеза» и положения закономерности ступенчатой стадийности развития новообразований (Диплом на открытие №300 РФ, от 27.01.06).
Дифференциальные диагностические плоидометрические показатели позволяют объективно распознавать БКР, что имеет большое практическое значение при диагностике и выборе адекватного метода лечения. Эти показатели носят стабильный характер и в значительной степени повышают точность гистологических заключений, обоснованность и адекватность лечебных мероприятий.
Перспективными являются неинвазивные методы диагностики, которые используют как для скрининговых исследований, так и для наблюдения после проведенного лечения. Развитие современной дерматологии позволяет также усовершенствовать классические методы диагностики с помощью компьютерных технологий, что значительно повышает эффективность диагностических мероприятий.
Наиболее интересным и перспективным среди неинвазивных методов является лазерная конфокальная сканирующая микроскопия (ЛКСМ), которая позволяет получить изображение кожи с разрешением, приближенным к традиционной световой микроскопии. С помощью ЛКСМ проводится послойное изучение горизонтальных плоскостей ткани до 5 мкм с возможностью оценивать толщину и архитектонику каждого слоя кожи, анализа их клеточного состава, площади распространения и степени инвазии опухолевого конгломерата до верхних уровней сетчатого слоя дермы.
Конфокальная лазерная микроскопия является перспективным методом диагностики БКРК, широко применяемым зарубежными коллегами. Чувствительность и специфичность этого метода при диагностике БКРК составляет 93 и 98% соответственно.
БКРК имеет определенные критерии ЛКСМ, коррелирующие с основными гистологическими признаками данной нозологии. Наиболее важный и постоянный признак БКРК — наличие удлиненных мономорфных ядер клеток, которые являются характерным признаком так называемых атипичных базалиоидных клеток, отличающихся от окружающих клеток большим размером. Помимо размеров, характерным также является расположение удлиненных ядер относительно друг друга. Они поляризованы вдоль одной оси, т.е. всегда располагаются параллельно друг другу, образуя так называемый палисадник. Также постоянным признаком является присутствие округлых клеток, соответствующее инфильтрации воспалительными клетками перитуморальной стромы.
Критерии ЛКСМ БКРК имеют четкую корреляцию с дерматоскопическими и гистологическими критериями, что также позволяет определить этот метод диагностики для оптимального скрининга данной опухоли кожи и помощи в ходе дифференциального диагностирования в затруднительных клинических случаях. Конфокальная микроскопия является также безопасным методом, с помощью которого можно проводить многократные исследования с целью наблюдения за пациентами после удаления опухоли для выявления раннего рецидива.
БКР имеет сравнительно медленный рост, при своевременном и адекватном лечении редко рецидивирует и не метастазирует. Однако распространенные, запущенные опухоли с глубокой инвазией и деструкцией тканей имеют злокачественное течение и способны метастазировать, при этом прогноз значительно ухудшается. Своевременное выявление характерных признаков этого новообразования с помощью классических и новых методик диагностики, позволяющих с максимально возможной точностью верифицировать диагноз, а также проведение профилактического лечебного воздействия позволяют избежать негативных последствий.
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, Москва
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, ул. Садовая-Черногрязская, 14/19, Москва, 105062, Российская Федерация
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, 115478 Москва, Каширское шоссе, д. 23
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Каширское ш., 23, Москва, 115478, Российская Федерация
. Злокачественная медуллоэпителиома, симулирующая ретинобластому — клинико-гистологический анализ случая и опыт получения клеточной культуры
Журнал: Вестник офтальмологии. 2016;132(6): 64‑69
В работе представлен клинико-морфологический анализ случая первичной внутриглазной злокачественной медуллоэпителиомы редкой локализации — центрального отдела сетчатки с вовлечением диска зрительного нерва, — симулирующей ретинобластому, у ребенка 2 лет. Подробно приведены гистологические особенности опухоли (трубчатые и сетчатые структуры опухоли, розетки, ленточные образования, клетки с гиперхромными ядрами, клеточный полиморфизм). Описан единственный на сегодняшний день в Российской Федерации опыт создания первичной культуры внутриглазной злокачественной медуллоэпителиомы с последующей оценкой чувствительности (МТТ-тест) к четырем препаратам (оксалиплатин, иринотекан, ифосфамид, аскорбиновая кислота) в различных концентрациях. Из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты. Несмотря на относительную редкость первичной внутриглазной злокачественной медуллоэпителиомы, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, прежде всего ретинобластомой. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии.
Внутриглазная медуллоэпителиома (диктиома) — редкая врожденная эмбриональная опухоль, растущая из эпителия цилиарного тела, ресничной части сетчатки и зрительного нерва, которая встречается как у взрослых, так и у детей [1, 2]. Опухоль состоит из тубулярных структур, выстланных псевдомногослойным нейроэпителием. Данная опухоль чаще всего выявляется в первой декаде жизни. Диагностика медуллоэпителиомы не всегда очевидна. Эхографическая локализация зачастую затруднена в связи с плоскостным характером роста, что объясняет позднюю (послеоперационную) диагностику [3].
В литературе за последние 30 лет доступны лишь 10 работ, посвященных первичной внутриглазной медуллоэпителиоме диска зрительного нерва (ДЗН) [2, 4, 5]. В работе Pastora-Salvador и соавторов описан случай медуллоэпителиомы зрительного нерва у мальчика 12 лет. Пациенту провели локальную резекцию опухоли, при этом безрецидивный период наблюдения составил 25 лет [5].
Медуллоэпителиомы классифицируются на тератогенные и нетератогенные варианты, подразделяемые в свою очередь на доброкачественные и злокачественные типы. Основной признак нетератогенного типа опухолей — множественность слоев и полос низкодифференцированных нейроэпителиальных клеток, внешне схожих с эмбриональной сетчаткой или цилиарным эпителием [6].
Дифференциальный диагноз следует проводить с ретинобластомой и другими редкими внутриглазными опухолями, включая беспигментную меланому, шванному и аденокарциному ретинального пигментного эпителия, а также неопухолевыми процессами, такими как воспалительная гранулема [7, 8]. Несмотря на то что медуллоэпителиомы могут выглядеть в виде крупных нейробластных псевдорозеток, для них характерны трубчатые конгломераты клеток, а не рост в виде «перчаток» или «рукоятки», что типично для ретинобластом. Дифференциальными признаками могут служить также тесная взаимосвязь с подлежащими тканями и отсутствие псевдофоторецепторов, в отличие от розеток Флекснера—Винтерштайнера [6]. Иммуногистохимические исследования медуллоэпителиом с псевдорозетками Флекснера—Винтерштайнера выявляют положительный результат на нейронспецифичную енолазу и синаптофизин во всех случаях [6].
В некоторых случаях исход заболевания неблагоприятен. Такое развитие новообразования чаще всего связано с распространением за пределы глаза, но также описаны отдаленные метастазы в лимфатические узлы, околоушные железы, легкие и средостение [9]. Медуллобластома как примитивная нейроэктодермальная опухоль центральной нервной системы у детей поражает преимущественно мозжечок и встречается значительно чаще первичной опухоли внутри глаза [10]. На сегодняшний день доступны несколько химиотерапевтических протоколов для лечения данного заболевания [11]. Первичная внутриглазная медуллоэпителиома, несмотря на низкую частоту встречаемости, представляет интерес для офтальмологов в связи со сложностью ее дифференциальной диагностики с другими внутриглазными новообразованиями, а также единичными данными о возможном химиотерапевтическом лечении.
Цель настоящей работы — клинико-гистологический анализ случая злокачественной медуллоэпителиомы у ребенка, а также описание опыта получения клеточной культуры опухоли и проведения МТТ-теста.
Клинические данные. Мальчик в возрасте 2 лет и 3 мес поступил на обследование и лечение в стационар. Из анамнеза известно, что в возрасте 2 лет родители заметили изменение «окраски» зрачка левого глаза на фотографии, а через 2 мес обратились к врачу по месту жительства, диагноз — подозрение на ретинобластому группы D. До появления первых симптомов ребенка осматривали в 1 год и 7 мес, но без мидриаза. При поступлении острота зрения на левом глазу соответствовала правильной проекции света, передний отрезок глаза без изменений. На глазном дне, по данным осмотра на RetCam, — ДЗН и макула не определяются, прикрыты серо-белой опухолевой тканью с неровными границами и бугристой поверхностью (рис. 1). На правом глазу изменений не выявлено.
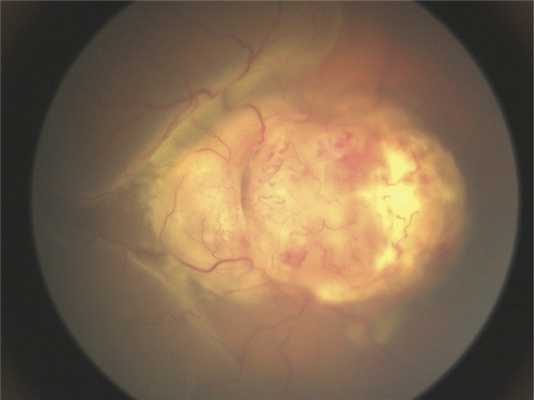
Рис. 1. Клиническая картина опухоли при осмотре на RetCam.
Согласно данным ультразвукового исследования, у заднего полюса выявлены плюс-ткань гетерогенной эхоструктуры с единичными кальцинатами, размером 6,4×13,3 мм, вторичная отслойка сетчатки (рис. 2). Учитывая локализацию опухоли (солитарный опухолевый узел, полностью перекрывающий ДЗН), отсутствие шансов на зрение, размеры образования и высокий риск экстрабульбарного распространения опухоли, выполнена энуклеация левого глаза с пластикой культи. После получения патогистологического заключения (злокачественная медуллоэпителиома) ребенок направлен на консультацию к детскому онкологу с целью возможного выявления новообразования в головном мозге. По данным магнитно-резонансной томографии, опухолевых очагов в ЦНС не выявлено, однако в связи с прорастанием опухоли за laminacribrosa пациенту назначен курс лучевой и химиотерапии (циклофосфан, вепезид, карбоплатин).
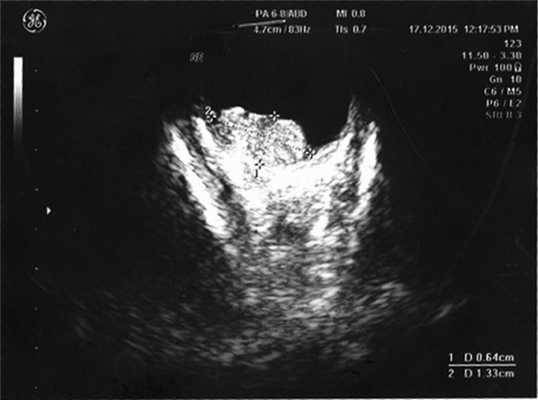
Рис. 2. Результат эхографии левого глаза у ребенка с подозрением на монокулярную форму ретинобластомы.
Патоморфологическое исследование. При морфологическом исследовании кусочка новообразования из боковой колодки выявлена опухоль, состоящая из кубических эпителиальных клеток, которые формировали единичные розетковидные структуры и небольшие участки солидного роста. Поставлен предварительный диагноз — недифференцированная ретинобластома без опухолевых комплексов в дистальном отрезке зрительного нерва. Далее при изучении срезов всего глазного яблока выявлен большой опухолевый узел в центральных отделах глазного дна, тесно связанный со зрительным нервом. Узел состоял преимущественно из трубчатых и сетчатых структур, розеток, ленточных образований, что придавало опухоли местами вид «кружева» (рис. 3).
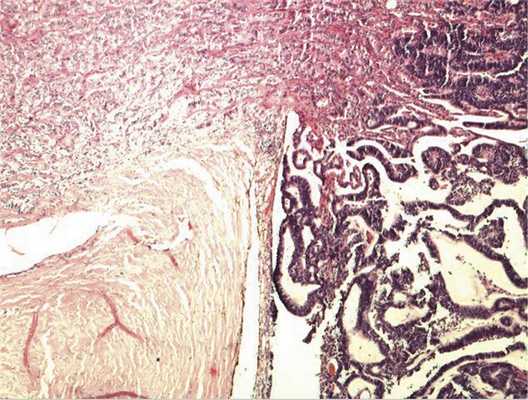
Рис. 3. Часть узла опухоли снаружи от ДЗН, имеющая вид «кружева». Окраска гематоксилином и эозином. Ув. 100.
Отмечалось наличие ленточных структур из низкодифференцированных эпителиальных клеток (рис. 4). Параллельно встречались участки солидного строения из клеток с гиперхромными ядрами с признаками клеточного и ядерного полиморфизма. В них почти исчезает строма, появляются митозы, встречаются участки дистрофии и некроза (рис. 5). Опухоль врастает в ткань ДЗН с переходом за laminacribrosa, но не достигает линии отсечения (рис. 6). В таком виде опухоль обладает местнодеструирующим характером роста и может давать метастазы, глубоко инфильтрируя прилежащую к ДЗН ткань хориоидеи. Окончательный гистологический диагноз: злокачественная медуллоэпителиома центрального отдела сетчатки с вовлечением ДЗН и инвазией перипапиллярной хориоидеи, с глубоким прорастанием по зрительному нерву, не достигая линии отсечения.
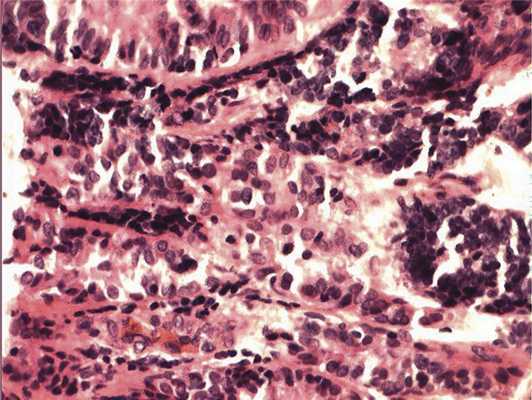
Рис. 4. Формирование полос из низкодифференцированных нейроэпителиальных клеток. Окраска гематоксилином и эозином. Ув. 400.
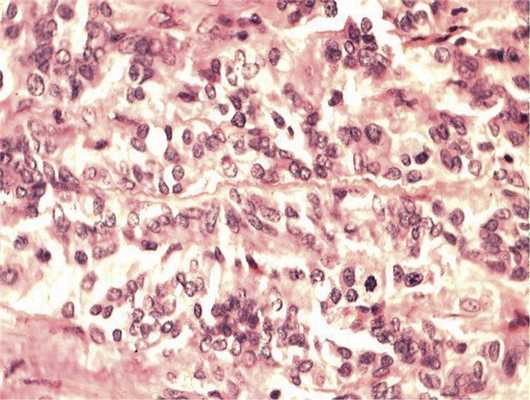
Рис. 5. Зоны солидного роста опухоли. Клеточный полиморфизм с фигурами митозов. Окраска гематоксилином и эозином. Ув. 400.
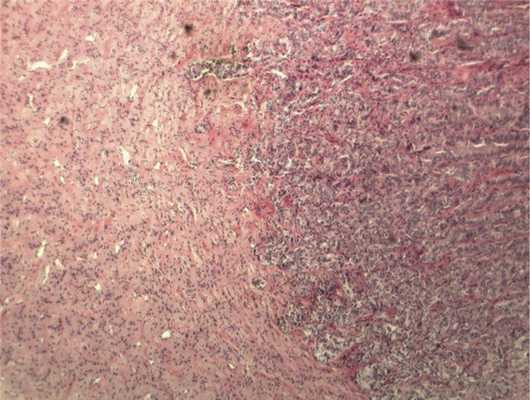
Рис. 6. Врастание опухоли в ткань ДЗН с ростом по ходу пучков нервных волокон. Окраска гематоксилином и эозином. Ув. 100.
Получение первичной культуры опухоли. После вскрытия глазного яблока взят образец опухолевой ткани для получения клеточной культуры с последующим исследованием лекарственной устойчивости (МТТ-тест). Опухолевый образец транспортировали в лабораторию генетики опухолевых клеток РОНЦ им. Н.Н. Блохина в течение 2—3 ч в бессывороточной среде RPMI («ПанЭко», Россия) с добавлением 100 мкг/мл гентамицина («Микроген», Россия). Далее полученную ткань обрабатывали механически (измельчали стерильными ножницами) и ферментативно (0,25% трипсин—0,04% ЭДТА; «ПанЭко», Россия) до получения клеточной суспензии, которую переносили в культуральные флаконы («Corning—Costar», США) со средой RPMI c добавлением 10% эмбриональной сыворотки коров («PAALaboratories», Австрия) и гентамицина 50 мкг/мл. Центрифугировали транспортировочную среду, полученный осадок клеток высевали на флаконы, которые помещали в термостат («Memmert», Германия) при температуре 37 °C и содержанием 5% СО2. Далее в течение 1 мес культивировали полученные клетки, по мере необходимости закисленную среду с погибшими клетками заменяли на новую питательную среду, при достижении клетками 60—80% уровня конфлюэнтности производили рассев клеток на новые культуральные флаконы. В течение культивирования клетки прошли 2—4 пассажа.
МТТ-тест. Метод основан на способности митохондриальных дегидрогеназ живых клеток метаболизировать желтый тетразол-реагент МТТ-3-(4,5-диметилтиазол-2)-2,5-дифенилтетразол-бромид в синий формазан. По интенсивности окраски конечного раствора судят о количестве живых клеток в лунке.
Клетки первичной культуры медуллоэпителиомы MB1 рассевали на 96-луночное плато по 1,5∙10 3 клеток в лунку в объеме 90 мкл культуральной среды RPMI. Препараты (иринотекан, ифосфамид, оксалиплатин и аскорбиновую кислоту) в объеме 10 мкл добавляли в различных концентрациях на следующий день. В контрольные лунки добавляли 10 мкл бессывороточной среды. Клетки культивировали в присутствии химиопрепаратов в течение 3 сут. Затем в лунки добавляли реагент МТТ в концентрации 5 мг/мл в объеме 20 мкл на лунку (рис. 7). Через 1,5—2 ч среду с реагентом удаляли и осадок растворяли в 60 мкл ДМСО. Уровень оптической плотности растворов в каждой лунке определяли с помощью спектрофотометра (планшетного ридера) Multiskan FC («ThermoScientific», EС) при длине волны 594 нм.

Рис. 7. 96-луночное плато с клетками первичной культуры злокачественной медуллоэпителиомы и исследуемыми препаратами.
Далее в «Программе для расчета IC50 химиотерапевтических веществ», написанной в лаборатории генетики опухолевых клеток, строили график зависимости уровня оптической плотности (проценты от контроля) от концентрации вещества и рассчитывали искомую концентрацию IC50 (полумаксимальное ингибирование). Использованы следующие химиопрепараты:
а) Иринотекан («Actavis», Исландия) в концентрациях 0,25; 0,5; 1,0 и 2,0 мг/мл;
б) Ифосфамид («Верофарм», Россия) в концентрациях 0,25; 0,5; 1,0 и 5,0 мг/мл;
в) Оксалиплатин («Medac», Германия) в концентрациях 0,1; 0,2; 0,38; 0,75 и 1,5 мг/мл;
г) Аскорбиновая кислота («Alvils», Россия—Китай) в концентрациях 0,6; 1,25; 2,5 и 5 мг/мл.
Результаты МТТ-теста представлены на рис. 8, а—г. Для аскорбиновой кислоты получена IC50 3,3 мг/мл. Результаты данного теста показывают, что с повышением концентрации препарата выживаемость клеток увеличивается.
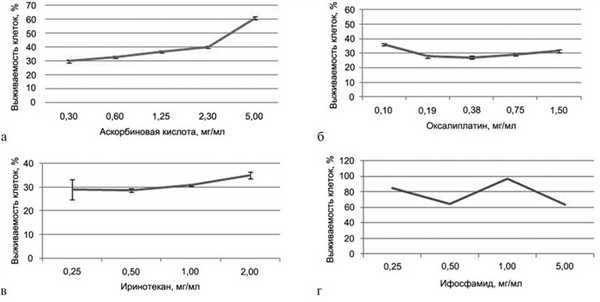
Рис. 8. IC50 (полумаксимальное ингибирование). а — для аскорбиновой кислоты; б — для оксалиплатина; в — для иринотекана; г — для ифосфамида.
IC50 для оксалиплатина, иринотекана и ифосфамида не получена. Для оксалиплатина при минимальной используемой концентрации 0,1 мг/мл выживаемость клеток составила 36%, для иринотекана при минимальной используемой концентрации 0,25 мг/мл — 29%, а для ифосфамида при максимальной используемой концентрации 5 мг/мл — 64%. Таким образом, из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты.
Заключение
К настоящему времени патогномоничные симптомы, свидетельствующие о первичной внутриглазной злокачественной медуллоэпителиоме, не описаны, а диагноз ставится на основании патогистологического заключения. Вместе с тем ряд симптомов, включая наличие кальцификатов и нехарактерные рентгенографические признаки, затрудняют дифференциальную диагностику с другими внутриглазными опухолями детского возраста, прежде всего ретинобластомой. К характерным патоморфологическим особенностям ретинобластомы, отличающим ее от медуллоэпителиомы, относят наличие «истинных» розеток, состоящих из цилиндрической формы нейроэпителиальных клеток эмбрионального типа [12]. Для медуллоэпителиомы, напротив, характерно наличие псевдорозеток, располагающихся диффузно или вокруг сосудов [2]. Несмотря на относительную редкость опухоли, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, особенно при наличии сопутствующих длительно существующих глазных симптомов. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии. Клеточная культура медуллоэпителиомы и возможная животная модель опухоли являются потенциальными объектами для изучения как экспрессии генов, так и специфических мутаций в ткани опухоли, что в свою очередь представляет интерес в перспективе для селективной химиотерапии опухоли и сохранения глаза.
Читайте также:
- Варианты зимнего маникюра и этапы их выполнения
- Анатомия: Вегетативная (автономная) нервная система. Функции вегетативной нервной системы.
- Дифференциальный диагноз мигрени и головной боли напряжения. Доброкачественная рецидивирующая головная боль.
- Мимическая мускулатура. Виды мимических мышц.
- Открытый артериальный проток. Эпидемиология открытого артериального протока.
