Профилактика респираторного дистресс-синдрома (РДС) при преждевременных родах. Кортикостероидная ( глюкокортикоидная ) терапия при угрозе преждевременных родов.
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
- Рекомендуется проведение профилактики РДС плода кортикостероидными препаратами при установлении диагноза угрожающих преждевременных родов с 24 недель до 34 недель 0 дней. Курсовая доза АКТ составляет 24 мг [1, 5, 74 - 77, 115].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
Комментарии: Антенатальная кортикостероидная терапия (АКТ) для ускорения созревания легких плода используется с 1972 года. АКТ высокоэффективна в снижении риска развития РДС, ВЖК и неонатальной смерти недоношенных новорожденных при сроке беременности 24 - 34 полные недели (34 недель 0 дней).
- Рекомендуются следующие схемы применения кортикостероидов: 2 дозы бетаметазона в/м по 12 мг с интервалом 24 часов; или 4 дозы дексаметазона в/м по 6 мг с интервалом 12 часов; или 3 дозы дексаметазона в/м по 8 мг через 8 часов.
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3b).
Комментарии: Эффективность вышеуказанных препаратов одинакова, однако следует учитывать, что при назначении дексаметазона отмечается более высокая частота госпитализации в ПИТ, но более низкая частота ВЖК, чем при использовании бетаметазона.
- Рекомендуется проведение профилактики РДС в следующих клинических случаях: преждевременный разрыв плодных оболочек; клинические признаки преждевременных родов в 24 - 34 полные (34 недель 0 дней) недели; беременным, нуждающимся в досрочном родоразрешении из-за осложнений беременности или декомпенсации экстрагенитальных заболеваний (гипертензивные состояния, СЗРП, предлежание плаценты, сахарный диабет, гломерулонефрит и т.д.) [115].
Комментарии: Любое сомнение в истинном гестационном сроке стоит трактовать в сторону меньшего и провести профилактику РДС в соответствии с этим. Повторные курсы глюкокортикоидов по сравнению с однократным курсом не приводят к снижению заболеваемости новорожденных и не рекомендуются к применению. В последних систематических обзорах хотя и имеется информация о возможности проведения повторных курсов РДС профилактики спустя 7 дней женщинам, у которых сохраняется угроза преждевременных родов, особо подчеркивается необходимость информирования их о пользе и риске подобной терапии и ограниченных сведениях об отдаленных ее последствиях на здоровье ребенка.
Спорным вопросом остается эффективность АКТ при сроках более 34 недель. Возможно, лучшей рекомендацией на сегодняшний день может быть следующая: назначение АКТ при сроке беременности более 34 недель при имеющихся признаках незрелости легких плода (в частности у беременных с наличием сахарного диабета 1 или 2 типа).
- Не рекомендуется рутинное назначение РДС-профилактики после 34 недель беременности в виду отсутствия положительного влияния на снижение частоты развития РДС у новорожденных.
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2).
Антенатальное применение кортикостероидов с целью профилактики респираторного дистресс-синдрома новорожденных
Данная статья продолжает цикл публикаций на нашем сайте, посвященный применению лекарств во время беременности. Использованы материалы методических рекомендаций Британской Королевской Коллегии Акушеров и Гинекологов.
Одна из самых частых причин высокой смертности недоношенных детей - развитие респираторного дистресс синдрома. Введение ГК до начала преждевременных родов, когда полностью предотвратить их невозможно, позволяет снизить риск возникновения этого серьезного расстройства. Антенатальное (дородовое) введение ГК значительно повышает эффективность реанимационных и лечебных мероприятий, которые сохраняют жизнь новорожденному. Респираторный дистресс синдром новорожденных РДС (болезнь гиалиновых мембран) - дыхательное расстройство, поражающее в первую очередь недоношенных детей, родившихся до полного биохимического созревания легких.
Важное событие внутриутробного развития легких - синтез и секреция сурфактанта альвеоцитами II типа (специальные клетки, выстилающие изнутри альвеолы). Альвеолы - это своеобразные "мешочки", которыми заканчивается разветвление бронхиального дерева. Именно в альвеолах происходит газообмен между вдыхаемым воздухом и кровью. Основная функция сурфактанта - снижение сил поверхностного натяжения альвеол и повышение эластичности легочной ткани. Сурфактант предотвращает спадение и "склеивание" альвеол в конце выдоха. Если альвеолы "склеиваются", они уже не участвуют в газообмене, и в организме развивается гипоксия (недостаточность кислорода в тканях, в первую очередь в центральных органах жизнеобеспечения - головном мозге, почках, надпочечниках). В сурфактанте в значительном количестве содержатся фосфолипиды (лецитин, сфингомиелин, фосфотидилхолин, фосфотидилглицерин). По соотношению лецитина к сфингомиелину в амниотической жидкости косвенно можно судить о количестве внутриальвеолярного сурфактанта и степени зрелости легких.
На образование сурфактанта и созревание легких плода может влиять много факторов, например, повышение уровня глюкозы и инсулина в крови плода при нарушениях углеводного обмена у матери (сахарный диабет, диабет беременных). Кстати прием ГК предрасполагает к развитию гиперинсулинемиии и гипергликемии в крови и матери, и плода.
У недоношенных детей, вследствие недостатка сурфактанта в альвеолах, легкие плохо расправляются, что приводит к ателектазу (спадению легочной ткани) и нарушению дыхания вплоть до развития тяжелых дыхательных расстройств. При соответствующем лечении исход, как правило, благоприятен. Однако, у глубоконедоношенных детей РДС сопровождается высокой смертностью. Вот почему во всем мире уделяется большое внимание вопросам лечения РДС. Важно отметить, что введение сурфактанта недоношенным детям значительно улучшает их состояние и выживаемость. Но этот вид лечения является достаточно дорогостоящим для национальных систем здравоохранения, поэтому важное внимание уделяют вопросам профилактики развития РДС новорожденных, родившихся раньше срока.
Клиническое руководство по антенатальной терапии кортикостероидами с целью профилактики респираторного дистресс-синдрома новорожденных
Клинические руководства - это "систематически обновляемые положения по вопросам надлежащего подхода к обследованию и лечению, разрабатываемые для врачей и пациентов. Каждое руководство систематически совершенствуется с учетом стандартизированной методологии. Дополнительные детали по процессу создания методических рекомендаций можно найти на сайте Королевской коллегии акушеров и гинекологов (ККАГ) Великобритании (Guidance for the development of RCOG green top guidelines). Эти рекомендации не определяют стандарта медицинской помощи, а также не созданы с целью навязывания исключительного курса обследования и лечения. В зависимости от конкретных нужд пациента, возможностей и ограничений разных учреждений, могут быть различия в подходах к ведению пациентов. Авторы руководства надеются, что местные органы управления здравоохранением помогут ввести данные рекомендации в повседневную практику. В руководстве особое внимание уделяется положениям, которые требуют дальнейшего более углубленного исследования.
Рекомендации, приведенные в руководстве, разделены на разряды согласно приведенной ниже схеме, схожей со стандартизованной классификацией доказательств.
Классификация уровня доказательств.
- Доказательства, полученные в результате мета-анализа рандомизированных контролированных клинических испытаний.
- Доказательства, полученные в результате проведения по крайней мере одного рандомизированного контролированного клинического испытания.
- Доказательства, полученные в результате проведения надлежащим образом спроектированных контролированных нерандомизированных клинических испытаний
- Доказательства, полученные в результате проведения по крайней мере одного надлежащим образом спроектированного контролированного нерандомизированного клинического испытания.
Рекомендации распределены на разряды в соответствии со схемой, утвержденной Руководством Национальной службы здоровья Великобритании:
Разряд A Рандомизированные контролированные клинические испытания Разряд B Другие надежные экспериментальные или клинические исследования Разряд C Доказательства менее надежны, но совет основан на мнении экспертов и одобрен авторитетными органами Пример хорошей практики: Рекомендуемая тактика самой лучшей практики, основанная на клиническом опыте группы разработки рекомендаций.
Рекомендации были разработаны доктором G C Penney , Aberdeen, Королевская коллегии акушеров и гинекологов Великобритании.
Цель данного руководства - предоставление современной, основанной на клинических испытаниях, информации, касающейся показаний к антенательной кортикостероидной терапии, предшествующей преждевременным родам, с целью снижения перинатальной смертности и заболеваемости среди новорожденных. Данное руководство не касается мероприятий по предотвращанию или остановке преждевременных родов (т.е. инструкций по токолитической или аналогичной терапии).
Введение
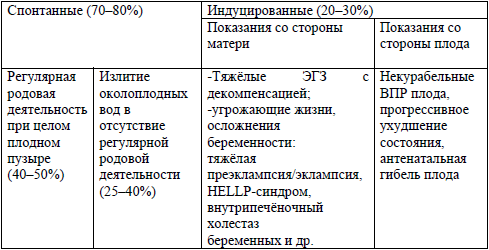
Респираторный дистресс синдром (РДС) развивается у 40-50% новорожденных, появляющихся на свет до 32 недели гестации1. К 1972г. стало очевидным, что применение кортикостероидов, предшествующее преждевременным родам, снижает частоту развития РДС. Однако вопрос применения антенатальной кортикострероидной терапии оставался до конца не ясным.
Определение и оценка доказательств.
Был произведен поиск в библиотеке Cochrane (3-е издание 1999 год) и регистре контролированных клинических исследований Cochrane на предмет соответствующих теме контролированных клинических испытаний, систематических обзоров и мета-анализов. Также был проведен поиск в системе Medline и Pubmed за период 1996 - 1999 г.г.
Ключевые слова: кортикостероиды, роды, преждевременный.
Определение классов доказательств, используемых в данном руководстве, взяты из Американского агентства по политике здравоохранения и проведения исследований (US Agency for Health Care Policy and Research). По возможности, рядом с рекомендациями указан уровень доказательств, на которых они основаны. Рекомендации с недостаточным подкреплением доказательствами выделены и специально обозначены как "пример хорошей практики".
Эффективность
Разряд А: Антенатальное применение кортикостероидов связано со значительным снижением частоты развития РДС, неонатальной смертностью и кровоизлиянием в желудочки головного мозга, хотя количество нуждающихся в лечении значительно возрастает после 34 недель гестации.
Системный обзор пятнадцати рандомизированных контролированных исследований показал, что антенатальная кортикостероидная терапия снижает частоту возникновения РДС. Снижается также риск неонатальной гибели и внутрижелудочкового кровоизлияния. Эффективность лечения новорожденных сурфактантом увеличивается при антенатальном применении кортикостероидов. Эффективность доказана во всех больших суб-группах новорожденных, родившихся преждевременно, независимо от их пола и расовой принадлежности. Один независимый обзор и один case series ставят под сомнение эффективность кортикостероидной терапии в тех случаях, когда преждевременным родам предшествовал преждевременный дородовый разрыв околоплодных оболочек, особенно, когда вес новрожденных составил 1000 г и менее (рекомендации разряда Ia).
В то время как не существует доказательств, что эффективность терапии ограничена применением у новорожденных определенного срока гестации, анализ "числа, нуждающихся в лечении" показал, что после 34 недель гестации нужно пролечить 94 беременных, чтобы предотвратить возникновение одного случая РДС; в то время как до 31 недели гестации один случай РДС может быть предупрежден лечением каждой пятой женщины (рекомендации разряда 1-a).
Разряд В: Стоимость и продолжительность интенсивной терапии новорожденных снижается в результате проведения кортикостероидной терапии.
Стоимость и продолжительность интенсивной терапии новорожденных снижается в результате проведения кортикостероидной терапии. Однако на общий экономический эффект антенательной кортикостероидной терапии будет влиять потенциальный рост выживаемости новорожденных с очень низкой массой тела и необходимость применения сурфактанта. Расчеты Simpson 8 показали, что увеличение процента случаев применения кортикостероидной терапии с 15% до 60% среди детей с массой тела менее 2000 г, ежегодно сэкономить 157 миллионов долларов. Mygford и др. 9 говорят о более скромной экономии для национальной системы здравоохранения, хотя стоимость лечения новорожденных с низкой массой тела продолжает считаться достаточно высокой: 10,11 (рекомендации разряда 3).
Разряд А: Оптимальное время для родов после применения кортикостероидной терапии - это период от 24 часов до 7 дней от начала лечения.
Эффективность лечения оказывается оптимальной, если ребенок рождается не ранее, чем через 24 часа и не позднее 7 суток после проведения терапии кортикостероидами. Однако положительная тенденция в отношении эффективности лечения отмечается и среди детей, рожденных ранее или позднее установленного оптимального для родов промежутка времени (рекомендации разряда 1-a)
При многоплодной беременности также рекомендуется проводить антенатальную кортикостероидную терапию, но при этом не было отмечено значительного снижения частоты развития РДС (пример хорошей практики).
Статистически значимое снижение частоты развития РДС не было отмечено в случае преждевременных родов при многоплодной беременности. До конца неясно, но возможно, это обусловлено недостаточной, ниже терапевтической, концентрацией лекарств, возникающей из-за увеличения объема плазмы 12.
Разряд А: Было показано, что применение бета-симпатомиметиков снижает процент женщин, у которых происходят преждевременные роды в течение 48 часов после начала лечения.
Безопасность.
Разряд А: Антенатальное применение кортикостероидов не связано с развитием каких-либо существенных неблагоприятных побочных эффектов в отношении здоровья матери или плода.
В трех рандомизированных исследованиях проводилось наблюдение за детьми, рожденными после применения антенатальной кортикостероидной терапии, до возраста 6 - 12 лет 15-17. Не было отмечено неблагоприятных неврологических или когнитивных расстройств. Показано, что применение кортикостероидов не повышает риска развития инфекционных осложнений со стороны матери или плода, несмотря на то, произошел или нет к моменту начала лечения разрыв околоплодных оболочек (рекомендации разряда 2-b).
Антенатальное применение кортикостероидов у беременных с сахарным диабетом остается до конца не выясненным (пример хорошей практики).
В рандомизироавные контролированные исследования по антенатальному применению кортикостероидов не были включены женщины ни с инсулин зависимым, ни с гестационным сахарным диабетом, так что не существует доказательств безопасности или эффективности применения кортикостероидов при таких обстоятельствах. Принимая во внимание отрицательное воздействие гипергликемии, существующей в организме матери, на созревание легких плода, возможно, что любое положительное влияние кортикостероидов будет сведено на нет в результате развития у беременной гипергликемии, вызванной введением кортикостероидов.
Повторное введение кортикостероидов.
Разряд В: Не было отмечено значимых преимуществ при повторном антенатальном введении корикостероидов.
Следует особо подчеркнуть, что все выводы, касающиеся безопасности, а также возникновения прямых и отдаленных побочных действий при применении кортикостероидов, сделаны по итогам рандомизированных контролированных клинических испытаний, где кортикостероиды антенательно вводились однократно. Относительно эффективности и безопасности повторного антенатального введения кортикостероидов не было проведено клинических испытаний такого уровня. Необходимость повторного еженедельного проведения кортикостероидной терапии возникала в тех случаях, где сохранялась угроза преждевременных родов или она снова возникала после проведения первоначального лечения. Теоретический риск такого подхода (повторное введение кортистероидов) связан с риском возникновения отдаленных побочных эффектов (когнитивных и неврологических расстройств у детей), который не был выявлен в результате проведенных рандомизированных контролированных клинических испытаний, касающихся лишь однократного курса терапии. Потенциальный риск может быть связан также с нарастанием гипергликемии, развитием остеопороза, инфекционных осложнений и подавлением функции надпочечников как у матери, так и у плода. Недавние ретроспективные исследования фактически показали, что повторное введение кортикостероидов не повышает эффективности лечения, но повышает смертность, риск рождения детей с низкой массой тела и риск продолжительной супрессии функции надпочечников. Решение о повторном курсе терапии кортикостероидами должно быть принято в каждом конкретном случае индивидуально, основываясь на оценки вероятности развития преждевременных родов и риска возникновения РДС для данного срока беременности (рекомендации разряда III).
Эффективность терапии препаратами тиреотропин-релизинг гормона (ТРГ).
Разряд А: Не рекомендуется сочетание антенатального введения кортикостероидов и препаратов ТРГ.
Библиотека Cochrane содержит последние обзоры по вопросам применения препаратов ТРГ при преждевременных родах. Мета-анализ показал, что применение препаратов ТРГ не только не снижает частоту развития РДС, но и повышает риск возникновения неблагоприятного исхода и для матери, и для плода. В обзорах Cochrane делается вывод, что введение препаратор ТРГ дополнительно к терапии кортикостеродами в случае угрозы преждевременных родов не может быть рекомендовано для клинической практики (рекомендации разряда Ia).
Показания к проведению антенатальной терапии кортикостероидами
В следующих случаях должны быть предприняты все усилия для начала терапии кортикостероидами у женщин между 24 и 36 неделями беременности:
- в лечении преждевременных родов
- преждевременный разрыв околоплодных оболочек
- дородовые кровотечения
- любые состояния, требующие досрочного родоразрешения
По мере увеличения срока беременности число женщин, нуждающихся в проведении кортикостероидной терапии для предупреждения развития одного случая РДС, будет увеличиваться, т.е. потенциальная польза от данной терапии будет уменьшаться, а потенциальный риск - возрастать.
Следует рассмотреть вариант создания специальных образовательных программ и брошюр по антенатальным осложнениям для пациенток с целью более раннего распознавания и начала лечения этих состояний.
Противопоказания
В следующих случаях следует избегать проведения антенатальной терапии кортикостероидами:
- Подозрение на хорионамниоит (воспаление околоплодных оболочек)
- Туберкулез
- Порфирия
Меры предосторожности
- Терапия бета-симпатомиметиками
- Подозрение на хорионамниоит
- Повторное введение кортикостероидов
Если для предупреждения развития преждевременных родов проводится терапия бета-симпатомиметиками, объем внутривенной инфузии жидкости должен быть минимальным, и в случае возникновения загрудинной боли, диспноэ (нарушения дыхания), кашля введение бета-агонистов должно быть немедленно прекращено. Женщины с подозрением или подтвержденным диагнозом преждевременного разрыва околоплодных оболочек должны быть внимательно обследованы на предмет наличия признаков хорионамнионита. Женщинам, которые подверглись повторному курсу введения кортикостероидов, должен быть проведен глюкозотолерантный тест. Чрезвычайно редкое осложнение в виде надпочечниковой недостаточности должно быть принято во внимание при дифференциальной диагностике в случае возникновения необъяснимого коллапса у женщины или новорожденного, которые проходили повторный курс антенатальной терапии кортикостероидами.
Дозы и способы введения кортикостероидов
Может быть введено внутримышечно две дозы дексаметазона по 12 мг с интервалом в 24 часа или четыре дозы дексаметазона по 6 мг с интервалом в 12 часов.
Респираторный дистресс-синдром у новорожденного
Респираторный дистресс синдром (РДС) - это состояние дыхательной недостаточности, развивающееся сразу или через небольшой промежуток времени после рождения и тяжесть его проявлений нарастает в течение первых двух дней жизни. Развитие РДС обусловлено дефицитом сурфактанта и структурной незрелостью легких, наблюдающихся в основном, но не только, у недоношенных новорожденных [1].
![]()
Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц
![]()
Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Клиническая классификация: отсутствует, так как при современной тактике проведения ранней терапии, клиническая симптоматика не достигает классического определения РДС [1,2,3].Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
А. Факторы риска: гестационный возраст менее 34 недель, сахарный или гестационный диабет у матери, кесарево сечение, кровотечение у матери во время беременности, перинатальная асфиксия, мужской пол, второй (или каждый последующий) при многоплодной беременности.
РДС клинически проявляется ранними респираторными нарушениями в виде цианоза, стонущего дыхания, втяжения податливых мест грудной клетки и тахипноэ. При отсутствии терапии может наступить летальный исход вследствие прогрессирующей гипоксии и дыхательной недостаточности. При наличии адекватной терапии регресс симптоматики начинается через 2-4 дня. [1].
Классическая картина снижения пневматизации легких в виде «матового стекла» и наличие воздушных бронхограмм.
Б. ЭхоКГ: для исключения ВПС, обнаружения ОАП, легочной гипертензии и уточнения направления шунтирования крови.Дифференциальный диагноз
Лечение
Цель лечения: обеспечение вмешательств, способствующих максимизации числа выживших недоношенных детей при одновременном снижении потенциальных побочных эффектов.
Согласно современным рекомендациям следует применять более мягкие подходы к проведению первоначальной респираторной поддержки и поэтому использование термина «стабилизация» более предпочтительно, чем термин «реанимация» [1].
• При рождении ребенка из группы риска по развитию РДС на роды вызываются наиболее подготовленные сотрудники, владеющие современными знаниями и навыками проведения реанимации у новорожденных с чрезвычайно малой и очень малой массой тела при рождении.
• Для поддержания оптимальной температуры воздуха в родовой палате (25-26ºС) могут использоваться дополнительные обогреватели, источники лучистого тепла, открытые реанимационные системы. Для исключения перегрева, необходимо проводить сервоконтроль в пределах 10 мин (B).
• Согревание и увлажнение газов, использующихся для стабилизации состояния, также может помочь поддержать нормотермию.
• Для профилактики гипотермии новорожденных с гестационным возрастом менее 28 недель следует сразу после рождения помещать в пластиковый мешок или использовать пленку для окклюзионного обертывания с параллельно включенным обогревателем (A).
• Доказано, что неконтролируемые объемы вдоха, как завышенные, так и заниженные, могут быть опасными для незрелых легких недоношенных детей. Поэтому традиционное использование саморасправляющегося мешка рекомендуется заменить на реанимационную систему с Т-образным коннектором, что обеспечивает контроль заданного постоянного положительного давления в воздухоносных путях (СРАР) с замеряемым пиковым давлением на вдохе (PIP) при закрытии тройника.
Сразу после рождения закрепить пульсоксиметр на запястье правой руки новорожденного для получения информации о ЧСС и целевых показателях сатурации (B).
• Зажим пуповины у недоношенного новорожденного, если позволяет его состояние, рекомендуется отложить на 60 секунд, с положением младенца ниже матери, чтобы способствовать плаценто-плодовой трансфузии (А).
• Использование СРАР следует начинать с момента рождения у всех новорожденных с риском развития РДС, а также у всех с гестационным
возрастом до 30 недель, обеспечивая давление в дыхательных путях не менее 6 см Н2О, через маску или назальные канюли (А). Предпочтительнее использовать короткие биназальные канюли, поскольку они сокращают необходимость интубации (А).
• Кислород должен подаваться только через кислородно-воздушный смеситель. Для начала стабилизации целесообразна концентрация кислорода 21-30%, а увеличение или снижение его концентрации производится на основании показаний пульсоксиметра о ЧСС и сатурации (B).
• Нормальная сатурация сразу после рождения для недоношенного ребенка составляет 40-60%, повышается до 80% к 5-й минуте и должна достигнуть 85% и более к 10-й минуте после рождения. Во время стабилизации следует избегать гипероксии (В).
• Интубацию следует проводить новорожденным, которые не ответили на неинвазивную вентиляцию (СРАР) (А). Всем интубированным новорожденным показано проведение заместительной терапии сурфактантом (А).
• Всем новорожденным с РДС или высоким риском его развития рекомендуется вводить препараты натуральных сурфактантов (А).
• Тактика раннего введения сурфактанта с терапевтической целью для спасения жизни должна быть стандартом и рекомендуется всем новорожденным с РДС на ранней стадии заболевания.
• Сурфактант должен вводиться непосредственно в родильном зале в случаях, когда мать не получала антенатальные стероиды или же, когда для стабилизации новорожденного необходима интубация (А), а также недоношенным новорожденным с гестационным возрастом менее 26 недель, когда FiO2 составляет > 0,30, а для новорожденных со сроком гестации более 26 недель, при FiO2 > 0,40 (B).
• Для лечения РДС порактант альфа в начальной дозе 200 мг/кг лучше, чем 100 мг/ кг того же препарата или берактанта (A).
• Должна вводиться вторая, а иногда и третья доза сурфактанта, если сохраняются признаки РДС - такие, как постоянная потребность в кислороде и необходимость проведения механической вентиляции (A).
• При проведении оксигенотерапии недоношенным новорожденным после начальной стабилизации, уровень сатурации кислородом должен поддерживаться между 90-95% (В).
• После введения сурфактанта необходимо быстро снижать концентрацию подаваемого кислорода (FiО2) для предупреждения гипероксического пика (C).
• Чрезвычайно важно избегать колебаний сатурации в постнатальном периоде (С).
• МВ необходимо использовать для поддержки новорожденных с дыхательной недостаточностью, у которых назальный СРАР не дал эффекта (В).
• МВ может осуществляться посредством традиционной вентиляции с перемежающимся положительным давлением (IPPV) или высокочастотной осцилляторной вентиляции легких (HFOV). HFOV и традиционная IPPV обладают аналогичной эффективностью, поэтому следует применять метод вентиляции, наиболее эффективный в каждом конкретном отделении.
• Целью МВ является поддержание оптимального объема легких после раскрытия путем создания адекватного положительного давления в конце выдоха (РЕЕР), или постоянного расправляющего давления (CDP) на HFOV на протяжении всего респираторного цикла.
• Для определения оптимального PEEP при традиционной вентиляции, необходимо пошагово изменять PEEP с оценкой уровней FiO2, CO2 и наблюдения за механикой дыхания.
• Следует использовать вентиляцию с целевым объемом вдоха, так как это сокращает продолжительность вентиляции и снижает БЛД (А).
• Следует избегать гипокапнии, поскольку она связана с повышенным риском бронхолегочной дисплазии и перивентрикулярной лейкомаляции.
• Прекращение МВ с экстубацией и переводом на СРАР необходимо осуществлять в как можно более ранние сроки, в том случае, если это клинически безопасно и концентрации газов крови приемлемы (В)
• Экстубация может быть успешной со среднего давления воздуха 6-7 см H2O на традиционных режимах и с 8-9 см H2O ОВЧВ, даже у самых незрелых детей.
• Необходимо отдавать предпочтение СРАР или NIPPV, чтобы избежать или сократить продолжительность инвазивной механической вентиляции (В).
• При отлучении от МВ допускается умеренная степень гиперкапнии, при условии, что рН сохраняется на уровне выше 7,22 (В).
• Для сокращения продолжительности МВ необходимо использовать режимы традиционной вентиляции с синхронизированным и заданным объемом дыхания с применением агрессивного отлучения от аппарата (В).
• Кофеин должен входить в схему лечения апноэ у новорожденных и для облегчения экстубации (А), а также кофеин может использоваться для детей с массой тела при рождении менее 1250 г, находящихся на СРАР или NIPPV и имеющих вероятность возникновения потребности в инвазивной вентиляции (В). Кофеин цитрат вводится в дозе насыщения 20 мг/кг, далее 5-10 мг/кг/сутки - поддерживающая доза.
• Всем новорожденным с РДС следует начинать лечение антибиотиками до полного исключения возможной реализации тяжелой бактериальной инфекции (сепсис, пневмония). Обычная схема включает комбинацию пенициллин/ампициллин с аминогликозидом. В каждом неонатальном отделении должны разрабатываться собственные протоколы по использованию антибиотиков, основанных на анализе спектра возбудителей, вызывающих ранний сепсис (D).
• Лечение антибиотиками следует прекратить как можно быстрее, как только будет исключена реализация ТБИ (С).
• В отделениях с высокой частотой инвазивных грибковых инфекций рекомендуется проводить профилактическое лечение флуконазолом у детей с массой тела при рождении менее 1000 г или с гестационным возрастом ≤ 27 недель, начиная с 1-го дня жизни в дозе 3мг/кг два раза в неделю в течение 6 недель (А).
У новорожденных с РДС наилучший исход обеспечивается оптимальным поддержанием нормальной температуры тела на уровне 36,5-37,5ºС, лечением открытого артериального протока (ОАП), поддержкой адекватного артериального давления и тканевой перфузии.
внутривенное введение жидкостей по 70-80 мл/кг в день, с поддержанием повышенной влажности в инкубаторе (D).
• У недоношенных объем инфузии и электролитов должен рассчитываться индивидуально, допуская 2,4-4% потери массы тела в день (15% в общем) в первые 5 дней (D).
• Прием натрия должен быть ограничен в первые несколько дней постнатальной жизни и начат после начала диуреза с внимательным мониторингом баланса жидкости и уровня электролитов (В).
• Парентеральное питание следует начинать с 1-го дня во избежание замедления роста и предусмотреть раннее введение белков, начиная с 3,5 г/кг/день и липидов 3,0 г/кг/день для поддержания должного количества калорий. Такой подход улучшает выживаемость недоношенных с РДС (А)
• Минимальное энтеральное питание также следует начинать с первого дня (В).
• Концентрации гемоглобина должны поддерживаться в пределах нормального диапазона значений. Предполагаемое пороговое значение концентрации гемоглобина у новорожденных, находящихся на вспомогательной вентиляции, составляет 120 г/л в 1-ю неделю, 110 г/л во 2-ю неделю и 90 г/л после 2 недели постнатальной жизни.
• Лечение артериальной гипотензии рекомендуется проводить, если она сопровождается доказательствами низкой перфузии тканей (С).
• Восполнение ОЦК при гипотензии рекомендуется проводить 0,9% раствором хлорида натрия по 10-20 мл/кг, если была исключена дисфункция миокарда (D).
• Если восстановлением ОЦК не удается удовлетворительно повысить давление крови, необходимо ввести допамин (2-20 мкг/кг/мин) (В).
• Если сохраняется низкий системный кровоток, или есть необходимость лечения дисфункции миокарда, необходимо использовать добутамин (5-20 мкг/кг/мин) в качестве препарата первой линии и эпинефрин (адреналин) в качестве препарата второй линии (0,01-1,0 мг/кг/мин).
• В случаях рефрактерной гипотензии, когда традиционная терапия не дает эффекта, следует использовать гидрокортизон (1 мг/кг каждые 8 часов).
• Эхокардиографическое исследование может помочь в принятии решения относительно времени начала лечения гипотензии и выбора лечения (В).
• Если принимается решение о медикаментозном лечении ОАП, то использование индометацина и ибупрофена оказывает одинаковый эффект (В), однако ибупрофен ассоциируется с более низкой степенью побочных эффектов со стороны почек.
• Фармакологическое или хирургическое лечение ОАП должно основываться на индивидуальной оценке клинических признаков и эхографических показаний (D).
• Профилактическая перевязка ОАП в течение 24 часов после рождения повышает риск развития бронхолегочной дисплазии (А).
• Ингаляционная терапия оксидом азота не обладает преимуществами при лечении недоношенных детей с РДС (А).
• Терапия сурфактантом может применяться для улучшения оксигенации после легочного кровотечения, однако долгосрочные благоприятные эффекты отсутствуют (С).
• Заместительная терапия сурфактантом при прогрессирующей БЛД приводит только к кратковременным благоприятным эффектам и не может быть рекомендована (С).
• Беременные женщины с высоким риском преждевременных родов должны госпитализироваться в перинатальные центры (С).
• Преждевременные роды, в случае дородового разрыва плодного пузыря, могут быть отсрочены назначением антибиотиков (А) и токолитиков (А), что обеспечит выигрыш во времени для транспортировки беременной в перинатальный центр с плодом in utero и проведение стероидной терапии для профилактики РДС.
• Рекомендуется проводить однократный курс антенатальных кортикостероидов всем женщин с риском преждевременных родов с гестационным сроком от 23 недель до 34 полных недель беременности (A).Могут использоваться 2 схемы пренатальной профилактики РДС:
• Повторный курс антенатальных стероидов может быть уместным, если первый курс был проведен более 2-3 недель назад, а гестационный возраст ребенка составляет менее 33 недель и при этом возникает другое акушерское показание (A).
• Прием антенатальных стероидов должен также рассматриваться для женщин, у которых будет проводиться плановое кесарево сечение, до начала схваток в связи с наступлением срока родов (B).
Респираторный дистресс-синдром (РДС) у недоношенных детей
Синдром дыхательных расстройств или «респираторный дистресс-синдром» новорожденного представляет собой расстройство дыхания у недоношенных детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта и незрелостью легких. Это один из самых распространенных диагнозов у детей, родившихся на сроке менее 34 недель гестации. РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде у новорожденных. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребенка при рождении.
Причины развития РДС у новорожденных
Основные причины развития РДС у новорожденных - это нарушение образования в альвеолах легких специального вещества - сурфактанта, связанное с функциональной и структурной незрелостью легочной ткани. Сурфактант представляет собой природное вещество, состояще из фосфолипидов и четырех видов белка, которое покрывает стенки дыхательных пузырьков - альвеол.
Легкие плода до родов находятся в спавшемся состоянии , легочные пузырьки - альвеолы напоминают сдувшиеся воздушные шарики. После рождения ребенок делает первый вдох, легкие расправляются и из сдувшихся шарики должны превратиться в надутые. Однако все структуры легких у малышей с массой тела менее 1500 г при рождении незрелые. Они менее воздушные и более полнокровные, а самое главное, в них отмечается недостаток сурфактанта.
![]()
Рентгенологическая картина РДС зависит от тяжести заболевания - от небольшого уменьшения пневматизации до «белых легких». Характерными признаками являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Профилактика и лечение РДС у недоношенных детей
При угрозе преждевременных родов на 32 неделе гестации и менее беременная женщина должна быть госпитализирована в акушерский стационар III уровня (в перинатальный центр), где имеется отделение реанимации новорожденных. Риск развития РДС тем выше, чем более недоношенным рождается ребенок. Но этот риск можно снизить. Для этого всем беременным женщинам на сроке гестации 23-34 недели при угрозе преждевременных родов проводят курс гормональной терапии кортикостероидами для профилактики РДС недоношенных и снижения риска возможных неблагоприятных осложнений у ребенка таких, как ВЖК и НЭК. Возможны две альтернативные схемы пренатальной профилактики РДС: Бетаметазон - 12 мг внутримышечно через 24 часа, всего 2 дозы на курс; или Дексаметазон - 6 мг внутримышечно через 12 часов, всего 4 дозы на курс. Стероидные гормоны ускоряют созревание легких у плода. Максимальный эффект терапии развивается спустя 24 часа после начала терапии и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Повторный курс профилактики РДС рекомендован только спустя 2-3 недели после первого в случае повторного возникновения угрозы преждевременных родов на сроке беременности менее 33 недель.
Профилактически уже в первые 20 минут жизни всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами проводится введение сурфактанта в легкие. Также сурфактант в родильном зале вводится всем новорожденным гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiО2 > 0,3-04. Наиболее эффективное время введения - первые два часа жизни. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiО2 ≥ 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а так же улучшения оксигенации в последующие 10-15 минут.
В неонатологии используют сурфактант, получаемый из легких животных, свиней или коров. Вещество проходит тщательную очистку от любых инфекционных агентов (вирусов, бактерий), в также специфических животных белков, что исключает развитие аллергических реакций. Сурфактант представляет собой белый раствор, который вводится через трубочку прямо в легкие ребенка. Он быстро распространяется по всем дыхательным путям и буквально на глазах увеличивает насыщение крови кислородом. В некоторых случаях ребенок нуждается в двухкратном или даже трехкратном введении сурфактанта.
Повторное введение сурфактанта с лечебной целью рекомендовано: детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на искусственную вентиляцию легких в связи с нарастанием дыхательных нарушений
Недоношенным, родившимся на сроке гестации 32 недели и менее в случае отсутствия дыхания или при нерегулярном дыхании в первые 20 секунд проводится продленный вдох для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких. После восстановления спонтанного дыхания проводится респираторная терапия с положительным давлением в дыхательных путях методом СРАР (Сontinuous Positive Airway Pressure), что помогает поддерживать легкие в расправленном состоянии даже когда ребенок делает выдох.
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне респираторной терапии нерегулярности сердцебиения иили отсутствии самостоятельного дыхания.
Потребность в дополнительной оксигенации до 45-50%, а так же в высоком давлении к концу вдоха у недоношенных новорождённых является показанием для перевода на высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ).
Высокочастотная ИВЛ - это особый, высокотехнологичный метод проведения искусственной вентиляции легких. При ВЧОВЛ отсутствуют привычные дыхательные движения, так как здесь не происходит привычного вдоха и выдоха. Газообмен обеспечивается за счет высокочастотных колебаний воздушной смеси - осцилляций. При этом можно увидеть, как грудная клетки ребенка колеблется. Преимуществом такой респираторной терапии является то, что газообмен в легких происходит практически непрерывно, что необходимо в тех случаях когда легкие ребенка очень незрелые и ли в них имеется воспалительный процесс.
При ВЧО ИВЛ за счет стабилизации объема альвеол происходит уменьшение ателектазов (участков слипания легочных альвеол), увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии достигается уменьшение вентиляционно-перфузионного соотношения, уменьшается потребность в высокой концентрации кислорода. При этом уменьшается дыхательный объем, снижается перерастяжение легких и уменьшается риск повреждения легких за счет баро - и волюмотравмы.
Преждевременные роды
Категории МКБ: Преждевременные роды (O60), Преждевременный разрыв плодных оболочек (O42), Преждевременный разрыв плодных оболочек неуточненный (O42.9), Преждевременный разрыв плодных оболочек, задержка родов, связанная с проводимой терапией (O42.2), Преждевременный разрыв плодных оболочек, начало родов в последующие 24 ч (O42.0)
Общая информация
Краткое описание
Название протокола: Преждевременные роды
Преждевременными родами называют роды, наступившие при сроке беременности от 22 до 36 +6 дней недель (154-258 дней) при весе плода 500 гр. и более.
Категория пациентов: беременные и роженицы с преждевременными родами в сроке 22-36 недель 6 дней беременностиКлиническая классификация:
![]()
Клиническая картина
Cимптомы, течение
2) Клинически документированные сокращения матки (4 за 20 минут или 8 за 60 минут) в сочетании с одним из нижеперечисленных признаков:
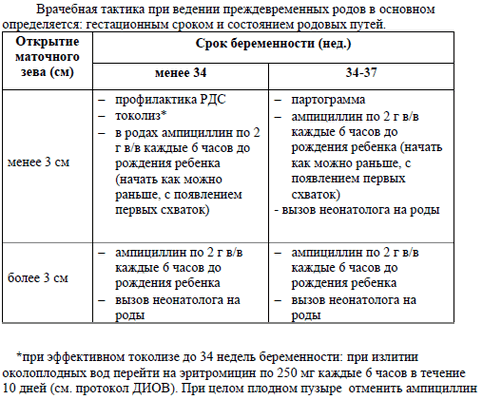
Физикальное обследование: степень раскрытия шейки матки служит индикатором для прогнозирования эффективности токолиза. При раскрытии зева >3 см (признак активной фазы первого периода) токолиз, скорее всего, будет неэффективен.- ОАК
- ОАМ
- УЗИ плода и шейки матки
- КТГ плода
- Осмотр влагалища в зеркалах
- Мазок из влагалища на бактериоскопическое и бактериологическое исследование включая посев на β-гемолитический стрептококк (БГС)
Диагноз начала преждевременных родов может быть уточнѐн с помощью трансвагинального УЗИ (длина шейки матки менее 15 мм — 50% шанс родить в сроке менее 32 недель). Изменения шейки матки — более объективный показатель, чем оценка родовой деятельности. При длине шейки матки более 3 см вероятность начала родов в течение ближайшей недели составляет около 1%. Такая пациентка не подлежит госпитализации или может быть выписана из стационара (B-2a). Прогностически имеет значение определение длины шейки матки в сроках 17-24 недели УЗИ методом: длина шейки матки 25 мм и менее требует проведения профилактических мер.
Показания для консультации специалистов: Наличие сопутствующих ЭГЗ, для дифференцировки диагноза при затруднении диагностикиПри угрожающих преждевременных родах, основным симптомом которых являются боли внизу живота и в пояснице, дифференциальная диагностика:
- с болезнями органов брюшной полости, в первую очередь, с заболеваниями кишечника (спастическим колитом, острым аппендицитом)
- с заболеваниями почек и мочевыводящих путей (пиелонефритом, мочекаменной болезнью, циститом).
- при возникновении болей в области матки необходимо исключить некроз узла миомы, несостоятельность рубца на матке, ПОНРП.
На всех этапах оказания помощи необходима полная информированность пациентки об ее состоянии, состоянии плода, прогнозе исхода преждевременных родов для новорожденного, выбранной акушерской тактике и возможных осложнениях. Антибиотикопрофилактика при преждевременных родах проводится независимо от целостности плодного пузыря.
![]()
- определение длины шейки матки с помощью гинекологического исследования или УЗИ. Чаще всего используют показатели:
Для более точного прогнозирования преждевременных родов необходимо использовать комплексную оценку: клинические симптомы и данные объективного обследования.
Усилия, направленные на повышение жизнеспособности плода при преждевременных родах, заключаются в антенатальной профилактике РДС глюкокортикоидами.
- 2 дозы бетаметазона внутримышечно по 12 мг с интервалом в 24 ч (эта схема наиболее часто встречалась в РКИ, вошедших в систематический обзор);
Эффективность препаратов одинакова, однако следует учитывать, что при назначении дексаметазона отмечается более высокая частота госпитализации в ПИТ, но более низкая частота ВЖК, чем у бетаметазона (A-1b).
- клинические признаки преждевременных родов (см. выше) в 24-34 полных недель(34 недели и 6 дней). Любое сомнение в истинном гестационном сроке стоит трактовать в сторону меньшего и провести профилактику;
- беременные, нуждающиеся в досрочном родоразрешении из-за осложнений беременности или ухудшения ЭГЗ — гипертензивные состояния, ЗВУР, предлежание плаценты, сахарный диабет, гломерулонефрит и т.д.
Повторные курсы глюкокортикоидов по сравнению с однократным курсом не приводят к снижению заболеваемости новорождённых и не рекомендуются к применению(A-1a).
Спорным вопросом остаётся эффективность АКТ при сроках после 34 недель. Возможно, лучшей рекомендацией на сегодняшний день может быть назначение АКТ при сроке гестации более 34 недель при имеющихся признаках незрелости лёгких плода.
При начавшихся преждевременных родах и открытии шейки матки более 3 см. профилактика РДС не проводится, так как эффективная экспозиция глюкокортикоидов составляет не менее суток (1b).
Препаратами выбора для токолитической терапии являются блокаторы кальциевых каналов (нифедипин) и антогонисты окситоцина (Атосибан), поскольку доказаны их преимущества по сравнению с другими препаратами.
Схема применения нифедипина: 10 мг перорально, если сокращения матки сохраняются - через 15 минут 10 мг повторно. Затем по 10 мг каждые 3-8 часов в течение 48 часов до исчезновения схваток. Максимальная доза - 60 мг/день.
- гипотензия, однако, это крайне редко проявляется у пациенток с нормальным уровнем артериального давления;
контроль состояния плода, измерение пульса, АД каждые 30 минут в течение первого часа, затем ежечасно в течение первых 24 часов, затем каждые 4 часа.
После купирования родовой деятельности дальнейший токолиз не рекомендуется из-за недоказанной эффективности и безопасности. При непереносимости нифедипина возможно использование антагонистов окситоцина или резервных β-миметиков.
Показания для Атосибана: для токолиза при угрожающих и спонтанных преждевременных родах у беременных женщин при:
- При начавшейся родовой деятельности (длительность схваток 30 сек. с частотой 4 схватки за 30 минут)
- иницирующая болюсная в/в инъекция (7,5 mg/ml раствор для инъекций, каждая ампула содержит 6,75 mg атосибана (голубая упаковка) - 0,9 мл. раствора для инъекций в/в одномоментно (в течение 1 минуты), максимальная суточная доза 330 мг.
- загружаемая инфузия - 7,5 mg/ml концентрат для приготовления инфузии, каждая ампула содержит 37,5 mg атосибана (темно-красная упаковка) - концентрат для инфузий 2 флакона по 5 мл. в раствор для инфузий (скорость введения 4 капли в минуту), (до 45 часов)
Токолитические препараты назначают в режиме монотерапии. Комбинированное назначение токолитиков увеличивает риск побочных эффектов и практически не имеет преимуществ перед назначением одного препарата.
В 2009 году были опубликованы результаты метаанализа, оценивавшего нейропротективные возможности магния сульфата, назначаемого при угрожающих или начавшихся преждевременных родах. Результаты свидетельствуют: использование магния сульфата привело к снижению частоты тяжёлой формы ДЦП. При этом ЧБНЛ составило 63.На сегодняшний день остаются неясными режим дозирования препарата, а также его влияние на отдалѐнные исходы у детей.
Во время преждевременных родов антибиотики должны быть назначены с профилактической целью. Первая доза должна быть введена как минимум за 4 ч до рождения ребёнка (B-2a).
- ампициллин — начальная доза 2 г внутривенно сразу после диагностики преждевременных родов, затем по 1 г каждые 6 ч до родоразрешения;
- цефалоспорины первого поколения — начальная доза 1 г внутривенно, затем каждые 6 ч до родоразрешения;
- при положительном результате посева на β-гемолитический стрептококк (БГС) —начальная доза 3 г бензилпенициллина внутривенно, затем по 1,5 г каждые 4 ч до родоразрешения.
1. Непрерывная психологическая поддержка во время родов, полная информированность пациентки о сложившейся акушерской ситуации и прогнозе исхода родов для новорожденного.
2. Ведение преждевременных родов при головном предлежании плода осуществляется через естественные родовые пути. Преждевременные роды не являются показанием к кесареву сечению.
3. Данные эффективности оперативного родоразрешения при тазовом предлежании противоречивы. Решение о выборе метода родов должно приниматься индивидуально на основании клинических показаний.
4. Плановое кесарево сечение по сравнению с родами через естественные родовые пути не улучшает исходов для недоношенного ребѐнка, при этом увеличивая материнскую заболеваемость. Поэтому роды через естественные родовые пути для недоношенного плода в головном предлежании предпочтительны, особенно после 32 недель беременности.
6. При обезболивании родов не применять лекарственные препараты, угнетающие дыхательный центр плода (опиаты)
7. Не проводить рутинно эпизиотомию, пудендальную анестезию, эпидуральную анестезию, использование выходных щипцов для рождения головки.
8. Вакуум-аспирация не должна использоваться при преждевременных родах ранее 34 недель беременности из-за повышения риска неонатальной заболеваемости, связанной с высокой частотой cубглиальных (между апоневрозом и надкостницей) гематом (B-3a).
10. При недоношенной беременности (менее 37 недель гестации) отсрочка пережатия пуповины по меньшей мере на 60 секунд предпочтительна в сравнении с ранним пережатием, так как это снижает количество
11. Для доношенных детей возможность повышенного риска неонатальной желтухи, требующей фототерапии, должна взвешиваться с физиологическим преимуществом более высокого гемоглобина и уровня железа до 6 месяцев жизни, получаемой при отсроченном пережатии пуповины. (I-C)
12. Постоянная КТГ не имеет преимуществ перед длительной (например, по 40 мин через 1 час) КТГ или периодической аускультацией.
Эпидуральная анальгезия предпочтительнее наркотических анальгетиков для обезболивания преждевременных родов из-за большей эффективности и меньшей токсичности (A-1b).ДИОВ при недоношенной беременности осложняет течение беременности в 2-3% случаев, но связано с 40% преждевременных родов и, как следствие, является значительной причиной в структуре неонатальной заболеваемости и смертности. Три основные причины неонатальной смертности связаны с ДИОВ: недоношенность, сепсис и гипоплазия лёгких.
Риск для матери связан с хориоамнионитом (13-60%). Доказана связь между восходящей инфекцией из нижних отделов генитального тракта и ДИВ. Каждая третья пациентка с ДИВ при недоношенной беременности имеет положительные результаты посевов культуры генитального тракта, более того, исследования доказали возможность проникновения бактерий через интактные мембраны.
При подозрении на ДИВ желательно избегать влагалищного исследования, кроме случаев, когда есть признаки активной родовой деятельности, так как это значительно увеличивает риск распространения инфекции и вряд ли определит тактику дальнейшего ведения беременности и родов (B-2b).
- произвести осмотр на гинекологическом кресле стерильными зеркалами - жидкость, вытекающая из цервикального канала или находящаяся в заднем своде, подтверждает диагноз;
- провести УЗИ — олигогидрамнион в сочетании с указанием на истечение жидкости из влагалища подтверждает диагноз ДИВ (B-2b).
Вероятность развития родовой деятельности при излитии околоплодных вод находится в прямой зависимости от гестационного срока: чем меньше срок, тем больше период до наступления регулярной родовой деятельности (латентный период). В первые сутки после преждевременного излития вод спонтанные роды начинаются:
В сроках 22-24 недель прогноз неблагоприятен. Родители должны быть осведомлены, что дети, родившиеся до 24 недель, вряд ли выживут, а те, что выживут, вряд ли будут здоровыми.
Выбор тактики ведения при ДИОВ при недоношенной беременности должен быть оформлен в виде информированного согласия пациентки.
Одна из основных задач при поступлении пациентки с подозрением на отхождение вод - как можно более точно определить срок беременности, так как от этого зависит выбор тактики.
2) осложнения беременности, требующие срочного родоразрешения (преэклампсия/эклампсия, отслойка плаценты, кровотечение при предлежании плаценты);
При поступлении пациентки в стационар первого или второго уровня с подозрением на ДИОВ при гестационном сроке до 34 недель — перевод в акушерский стационар третьего уровня.
Наблюдение за пациенткой осуществляется в палате отделения патологии беременности сведением специального листа наблюдений в истории родов с фиксацией каждые 4 ч:
- посев отделяемого из цервикального канала на β-гемолитический стрептококк, микрофлору и чувствительность к антибиотикам — при первом осмотре в зеркалах;
- ОАК — количество и формула лейкоцитов (1 раз в 2-3 сут при отсутствии клинических признаков инфекции);
- оценка состояния плода — УЗИ, ультразвуковая допплерометрия, КТГ регулярно, не реже 1 раза в 2-3 суток.
Токолитики при преждевременных родах показаны на период не более 48 ч для перевода в перинатальный центр и проведения курса глюкокортикоидов (B-2a).
Антибиотикопрофилактика должна начинаться сразу после постановки диагноза ДИОВ и продолжаться до рождения ребѐнка (в случае задержки родов может быть ограничена 7-10 сутками).
- при положительном высеве β-гемолитического стрептококка — бензилпенициллин по 1,5 г внутримышечно каждые 4 часа.
При ДИОВ не должен использоваться Амоксициллин, клавулановая кислота из-за повышения риска НЭК у плода(A-1b).
Внутриматочная инфекция, которая определяется как позитивная культура околоплодных вод, осложняет 36% ДИОВ при недоношенной беременности. В большинстве случаев инфекция развивается субклинически.
Лейкоцитоз (>18×109/мл) и нейтрофильный сдвиг лейкоцитарной формулы обладают низкой прогностической ценностью для подтверждения наличия инфекции. Необходимо определение этих показателей в динамике (1 раз в 1-2 сутки).
Хориоамнионит - абсолютное показание к быстрому родоразрешению, не является противопоказанием к оперативному родоразрешению по обычной методике.
При отсутствии активной родовой деятельности и шансов быстрого рождения ребѐнка метод выбора для родоразрешения — кесарево сечение.
При подозрении на хориоамнионит должна быть начата антибактериальная терапия, то есть к вводимому препарату (например, ампициллину) должен быть добавлен второй препарат из другой группы, например: гентамицин в дозе: 5 мг/кг массы тела внутривенно1 раз в сутки. При подтверждении диагноза хориоамнионита после родоразрешения к назначениям добавляют метронидазол по 100 мг каждые 8 ч.
При ДИОВ на сроке 34 недели и более длительная выжидательная тактика (более 12-24 ч) не показана, так как повышает риск внутриматочной инфекции и компрессии пуповины безулучшения исходов для плода (B-3b). Но решение о вмешательстве следует принимать, основываясь, прежде всего, на комплексной клинической оценке ситуации после получения информированного согласия пациентки.
- ограничение повторных внутриматочных манипуляций (диагностическое выскабливание или кюретаж полости матки во время медицинского аборта) (С-4);
- информирование общественности о повышенном риске преждевременного рождения детей, зачатых с помощью вспомогательных репродуктивных технологий. Принятие рекомендации по ограничению количества пересаживаемых эмбрионов в зависимости от возраста и прогноза пациентки (B-3a).
- гидратация (усиленный питьевой режим, инфузионная терапия), используемая в целях нормализации фетоплацентарного кровотока для предотвращения преждевременных родов (A-1a).
- Неэффективно наложение швов всем беременным при короткой шейке матки кроме женщин из группы высокого риска по преждевременным родам (A-1b).
- Однако при длине шейки матки 25 мм и менее при дополнительном интравагинальном введении прогестерона частота преждевременных родов уменьшается (A-1b).
При беременности двойней наложение швов на укороченную шейку матки, наоборот, повышает риск преждевременных родов (B-3a).
Вместе с тем в ФГУ НЦАГиП им В.И. Кулакова имеется положительный опыт использования профилактических П-образных и циркулярных швов, которые способствуют пролонгированию беременности до рождения жизнеспособных детей (≥33-34 нед. беременности), при двойнях, тройнях и даже четверне.
- назначение в группе высокого риска (прежде всего среди женщин, имеющих преждевременные роды в анамнезе) снижает риск повторных преждевременных родов на 35% (A-1a).
- 17-α-гидроксипрогестеронакапронат (17-ОПК) — еженедельно, начиная с 16-20-й недели беременности внутримышечно по 250 мг до гестационного срока 34 нед.;
Следует отметить, что прогестерон и его производные неэффективны при многоплодной беременности (A-1b).
- скрининг и лечение бессимптомной бактериурии, определяемой как наличие бактерий в посеве в количестве более 105 КОЕ/мл (A-1a).
- рутинный скрининг на патогенную и условно-патогенную микрофлору нижних отделов половых путей у беременных из группы низкого риска по преждевременным родам, а также антибактериальная терапия при колонизации (A-1a).
- лечение БВ на сроках беременности менее 20 недель (вероятно, снижает риск преждевременных родов). Возможные схемы лечения: метронидазол 500 мг. 2 раза в день per os 7 сут или клиндамицин 300 мг 2 раза в день peros 7 суток. В I триместре стоит воздержаться от лечения, так как данные препараты входят в группу, применение которых противопоказано в этот период.
Возможные схемы лечения: азитромицин 1 г однократно per os или эритромицин 500 мг 4 раза в день per os 7 суток.
- наблюдение в условиях поликлиники, продолжить терапию гестагенами, контроль длины шейки матки по УЗИ;
- при преждевременных родах - обследование и подготовка к следующей беременности в зависимости от фактора преждевременных родов.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:Читайте также:
- УЗИ, ЭхоКГ при тотальном аномальном дренаже легочных вен у плода
- Системная красная волчанка. Лекарственные средства для лечения остеопороза
- Броуновский храповый механизм транслокации белка за счет энергии АТФ
- Трансплантационный веноокклюзионный синдром (ВОС)
- Скрытое межменструальное (овуляторное) кровотечение. Определения липоидов во влагалищном содержимом