Рак. Онкогенные вирусы. История изучения онкогенных вирусов.
Добавил пользователь Alex Обновлено: 28.01.2026
ОНКОЛОГИЯ ЭКСПЕРИМЕНТАЛЬНАЯ (греч, onkos масса, опухоль + logos учение; лат. experimentum проба, опыт) — раздел онкологии, занимающийся из учение м опухолей в условиях эксперимента, что позволяет всесторонне изучить процесс возникновения и развития опухоли, создать разнообразные экспериментальные опухоли, являющиеся моделями для изучения опухолей человека. Задачами О. э. являются выяснение и оценка роли в этиологии опухолей вирусов, ионизирующего излучения, онкогенных веществ, изучение развития опухолевого процесса и модифицирующих его факторов, что способствует улучшению диагностики, лечения и профилактики опухолей человека. Использование различных экспериментальных опухолей позволяет разрабатывать методы лечения новообразований и испытывать новые противоопухолевые средства (см.). Экспериментальные исследования применяют также для выяснения возможной онкогенности нек-рых продуктов.
Родоначальниками О. э. являются отечественный ученый М. М. Руднев и его ученик М. А. Новинский. Последний на основе методики, разработанной своим учителем, в 1876 г. впервые успешно перевил спонтанные опухоли у собак. В 1889 г. Ханау (A. N. Hanau) подтвердил возможность трансплантации злокачественных опухолей, а с 1894 г. Моран (Н. Moran) и другие исследователи стали трансплантировать спонтанные опухоли мышей и крыс, что привело к созданию штаммов перевиваемых опухолей. Трансплантация опухолей дает возможность исследовать биологические, морфологические, биохимические, иммунологические и другие особенности опухолевого роста. Во второй половине 20 в. была разработана методика подсадки опухоли в ткани, отличающиеся пониженной иммунной реактивностью, напр, в глаз, мозг, защечные мешки хомячков. При этом иммунные системы организма животного-реципи-ента подавляли путем воздействия ионизирующим излучением или введения кортизона. Получил распространение метод трансплантации опухолей человека так наз. бестимусным мышам, у к-рых имеется генетический дефект развития иммунных систем, ответственных за отторжение чужеродных трансплантатов. Трансплантация вначале обычно удается лишь у нескольких из перевитых животных, и опухоли возникают в сравнительно поздние сроки. В последующих поколениях животных прививаемость штамма увеличивается и ускоряется темп роста перевитой опухоли.
В конце 19 в. И. М. Львов, Н. Л. Петров и др. провели опыты по пересадке эмбриональных тканей кроликов, морских свинок, крыс и других животных в организм взрослого животного. На месте введения (под кожей, в брюшной полости, почках и др.) возникали конгломераты тканей, напоминавшие тератомы. В нек-рых случаях, когда к пересаженной ткани добавляли такие Онкогенные вещества и агенты, как мышьяк, индол, каменноугольная смола [Асканази (М. Askanazy), H. H. Петров], 1,2,5,6-дибензантрацен [Пикок (P. R. Peacock) и др.], на месте пересадки эмбриональной ткани возникали злокачественные опухоли.
Исторический интерес представляют исследования И. Фибигера (1913) по изучению паразитов, являвшихся якобы причиной возникновения рака желудка. В последующем Пасси (R. D. Passey) и Лизом (М. Leese) было доказано, что описанные И. Фибигером разрастания эпителия возникают в результате авитаминоза. Тщательное изучение так наз. цистицерковых сарком печени у крыс показало, что причиной, вызывающей эти опухоли, является, по-видимому, эндогенный вирусоподобный агент. В 1911 г. Ф. Раус в ходе опытов по трансплантации сарком кур заметил, что нек-рые из них перевиваются бесклеточным фильтратом. В 1908 г. такая возможность была отмечена Эллерман-ном (V. Ellermann) и Бангом (О. Bang) в опытах по перевивке лейкозов кур. В 1933 г. Р. Шоуп описал папилломы кожи у диких кроликов, к-рые прививались у лаб. кроликов. В фильтрате этих папиллом был обнаружен агент, хорошо сохранявшийся в 50% р-ре глицерина и обладавший рядом свойств вирусов. В опухоли, развивавшейся в дальнейшем из такой папилломы, этого агента найти не удавалось. По данным Дж. Биттнера (1936), рак молочной железы у мышей определенных линий был связан с вирусоподобным агентом — так наз. фактором молока (см. Рака молочных желез вирусы), передававшимся через молоко кормящих самок. Фактор молока наблюдается лишь у мышей высокораковых линий; у других животных, в том числе и мышей других линий, а также у человека он не обнаружен. В дальнейшем был открыт ряд вирусов лейкозов, вызывавших различные формы этого заболевания, а также ряд вирусов, вызывавших различные опухоли, напр, вирус полиомы или вирус SV40 (см. Онкогенные вирусы). В 1957 — 1958 гг. Л. А. Зильбер, Г. Я. Свет-Молдавский и сотр. установили возможность развития злокачественных опухолей у млекопитающих и малигнизации культивируемых вне организма фибробластов человека под воздействием вируса куриной саркомы. В 60-х гг. 20 в. появились данные, свидетельствующие о возможности эндогенного происхождения онкогенных РНК-содержащих вирусов — онкорнавирусов (см. Ретровирусы). Возможно, что активация этих вирусов происходит под влиянием ионизирующего излучения, ультрафиолетовых лучей или онкогенных веществ.
В 1912 г. Роло-Лапуэнт (G. Raulol-Lapointe), Клюне (J. Clunet) и П. Мари впервые наблюдали в эксперименте возникновение саркомы у крыс в участке, подвергавшемся воздействию рентгеновского излучения, спустя длительное время после облучения. В 1923—1933 гг. под влиянием воздействия рентгеновского излучения удалось вызвать рак кожи у кроликов (Г. Г. Гамба-ров, Б. Блох) и саркомы у мышей [Г. А. Зедгенидзе, Йонкхофф (A. R. Jonkhoff)]. Саркомы у крыс и кроликов, саркомы и карциномы у морских свинок возникали после введения радия и различных его препаратов [Диле (F. Deals, 1926)]. Введение радиоактивных веществ приводило к появлению злокачественных опухолей у обезьян (H. Н. Петров и сотр., Р. А. Мельников, E. М. Барабадзе). Опухоли могут возникать под воздействием ультрафиолетового излучения, что было показано в 1925 г. Финдли (G. М. Findlay), а в дальнейшем подтверждено многими исследователями. В наблюдениях Роффо (A. H. Roffo, 1936), H. H. Петрова (1939) и др. злокачественные опухоли у лаб. животных развивались в условиях длительного воздействия ультрафиолетового излучения.
О. э. располагает большим материалом в области индукции опухолей с помощью онкогенных веществ (см.). На основании клин, данных о возникновении профессионального рака в результате воздействия различных хим. агентов была обоснована и развита концепция хим. онкогенеза, экспериментальным подтверждением к-рой стала работа японских исследователей Ямагивы и Итикавы (К. Yamagiwa, К. Ichikawa, 1914—1916), получивших плоскоклеточный ороговевающий рак кожи у кроликов путем втирания каменноугольной смолы. В 30-х гг. 20 в. была получена серия химически чистых онкогенных веществ, избирательно действующих на различные органы и вызывающих опухоли в местах соприкосновения с ними.
В начале 20 в. Н. А. Велъяминовым впервые было высказано мнение о значении нарушения функции желез внутренней секреции при раке молочной железы. В 1932 г. А. Лакас-сань получил экспериментальную модель рака молочной железы у самцов мышей при введении фолликулина. Многими исследователями показано, что введение в организм естественных и синтетических половых гормонов приводит к развитию опухолей гипофиза, молочной железы, матки, предстательной железы и других органов. При этом большое значение придают нарушениям функции гипофиза и обмена веществ, особенно обмена стеринов.
Объектом О. э. могут быть самопроизвольно возникшие спонтанные опухоли у различных лаб. животных — мышей, крыс, хомячков, кроликов, иногда аквариумных рыб, собак и обезьян. В результате повторных внутриродовых скрещиваний в ряде поколений удалось создать так наз. чистые, или инбредные, линии мышей, используемые во многих экспериментальных онкол, исследованиях (см. Линейные животные). Для различных экспериментальных исследований, особенно в области вирусологии и иммунологии опухолей, выращивают специальные линии стерильных животных, или гнотоби-онтов (см. Гнотобиология). Большую роль в развитии О. э. сыграло культивирование тканей вне организма — в органных, тканевых и клеточных культурах (см. Культуры клеток и тканей). Методы культивирования клеток позволяют получать большое количество материала для биохим., вирусол, и иммунол, исследований. Культивирование тканей опухолей человека способствовало в ряде случаев выяснению их гистогенеза; напр., Н. Г. Хлопин и другие исследователи с помощью этого метода показали нейрогенное происхождение меланом, В. Е. Цымбал — эпителиальную природу смешанных опухолей слюнных желез, А. Д. Тимофеевский — миогенное происхождение полиморфно-клеточной саркомы мягких тканей. Культивирование вне организма позволило выяснить ряд основных закономерностей роста и размножения нормальных и опухолевых клеток, а также клеток в процессе малигнизации.
Проблемы экспериментальной онкологии разрабатываются в ряде специальных лабораторий научно-исследовательских ин-тов онкологии. Во Всесоюзном онкологическом научном центре АМН СССР экспериментальная работа ведется в лабораториях генетики, биохимии, радиобиологии, механизмов канцерогенеза, в отделе по изучению канцерогенных агентов, в лаборатории эндогенных канцерогенов, экспериментальной химиотерапии опухолей и т. д. В Московском НИИ онкологии им. П. А. Герцена экспериментальный отдел включает лаборатории иммунологии и экспериментальной терапии. В НИИ онкологии им. H. Н. Петрова имеются лаборатории экспериментальной онкологии, биофизики и изучения канцерогенных веществ. Вопросами О. э. занимаются Ин-т проблем онкологии им. Р. Е.Ка-вецкого АН Украинской ССР, Ин-т экспериментальной и клинической медицины М3 Эстонской ССР и др.
За рубежом вопросами О. э. занимаются во многих научно-исследовательских ин-тах США, национальном раковом центре в Гейдельберге (ФРГ), ин-те Честер-Битти в Лондоне, ряд лабораторий О. э. имеется в Международном агентстве по изучению рака.
Вопросы О. э. освещают журналы «Вопросы онкологии», «Экспериментальная онкология», «Neoplas-ша» (ЧССР), «International Journal of Cancer» (Швейцария), «Cancer Research» и «Journal of the National Cancer Institute» (США), «Bulletin du Cancer» (Франция) и др.
Библиография: Боговский П. А. Модифицирующие факторы при химическом канцерогенезе — попытка классификации, Вестн. АМН СССР, № 10, с. 47, 1977; Васильев Ю. М. Гетеротрансплантация злокачественных опухолей, Вопр, онкол., т. 2, № 1, с. 108, № 2, с. 237, 1956, библиогр.; Зильбер JI. А. и др. Эволюция вирусо-генетической теории возникновения опухолей, М., 1975; M e г и П. и Барнес Дж. Канцерогенные нитрозосоединения, в кн.: Успехи в изучении рака, пер. с англ., под ред. Л. М. Шабада, т. 10, с. 242, М., 1971; Петров H. Н. Общее учение об опухолях, Спб., 1910; Проблемы экспериментальной онкологии и лейкозов человека и животных, под ред. JI. М. Шабада и В. П. Шишкова, М., 1979; P а у ш e н- б а х М. О. Экспериментальные исследования лейкозов, М., 1956; Роль эндогенных факторов в развитии лейкозов, под ред. М. О. Раушенбаха, М., 1974; Система создания противоопухолевых препаратов в СССР и США, под ред. H. Н. Блохина и Ч. Зуброда, М., 1977; Тимофеев-с к и й А. Д. Эксплантация опухолей человека, М., 1947; Шабад JI. М. Эволюция концепций бластомогенеза, М., 1979; Cook J. К. а. о. The production of cancer by pure hydrocarbons, Proc. roy. Soc. B, v. Ill, p. 455, 1932; Pathology of tumours in laboratory animals, ed. by V. S. Turusov, v. 1—2, Lyon, 1973 —1979; Y a m a g a w a K. u. Ichikawa K. Experimentelle Studie iiber die Pathogenese der Epithelialgeschwulste, Mitt. med. Fak. Tokvo, Bd 15, S. 295, 1915—1916.
Вирус Эпштейна-Барр и его роль в канцерогенезе

Один из самых распространенных на планете — вирус Эпштейна-Барр — относится к числу антропонозных инфекций с высоким уровнем контагиозности. В скрытом состоянии инфекция, однажды попав к человеку, бытует в организме всю его жизнь и может послужить толчком к развитию раковых опухолей. Портал MedAboutMe разбирался, как действует вирус Эпштейна-Барр и какова его профилактика.
Вирусы человека
Человечество на протяжении всего своего существования сопровождают вирусы. Ученые подтвердили, что вирусы человека бытуют в природе во всевозможном разнообразии. Сказать точно, когда появились на земле неклеточные инфекционные агенты, сложно. Может быть, они возникли задолго до того, как сформировалась первая живая клетка, либо отпочковались в результате дегенеративных процессов от одноклеточных организмов и стали самостоятельным видом.
Все живые организмы подвержены вирусным атакам, но справляются с ними по-разному. Когда вирусы человека попадают в организм, включается так называемый антивирусный ответ. Часть вирионов (вирусы вне клетки) погибают в неравной борьбе с иммунными клетками (макрофагами, Т-хелперами). В организме образуются специальные антитела, чья роль сводится к поиску свободных вирусных частиц, определения их антигенов и прикрепления к ним. Эта связка в свою очередь находится макрофагами и уничтожается. Вирусы, внедрившиеся в клетки, ликвидируются так называемыми Т-киллерами (Т-лимфоцитами) вместе с зараженной клеткой. Помимо иммунной реакции, есть еще молекулярный механизм защиты, когда зараженные клетки воспроизводят интерфероны — специальные белки противоопухолевого и иммуномодулирующего действия. Интерфероны не дают вирусам размножаться.
Вирусы человека избирают определенный орган, по которому и наносится удар. Например, вирус полиомиелита поражает нервную систему, вирусы гепатита — печень. Есть вирусы, действие которых более обширное: ВИЧ захватывает несколько видов клеток, среди которых клетки иммунной системы.
Вирусы, обошедшие все заслоны иммунной системы, начинают активно размножаться, оказывая, тем самым, губительное воздействие на организм. Разрушительная сила неклеточных инфекционных агентов кроется в их изумительной способности быстро изменяться, причем каждый тип вируса имеет свой механизм трансформации. В силу бесконечных мутаций отдельных вирусов невозможно составить схему лечения и разработать вакцинацию. До сих пор нет ответа, как бороться с вирусом иммунодефицита человека, или с вирусом Эпштейна-Барр, например. Последний и вовсе способен вызвать рост раковых клеток.
Вирус Эпштейна-Барр и его канцерогенные свойства
О вирусе Эпштейна-Барр (ВЭБ) ученый мир узнал в 1964 г., когда супруги Э.Эпштейн и И.Барр изучали лимфому Беркитта — злокачественное новообразование в лимфатической системе. В образцах опухоли ученые выявили частицы вируса герпеса, который впоследствии получил имя «вирус Эпштейна-Барр». Позднее вскрылась способность новонайденного вируса провоцировать развитие опухолей у обезьян.
Таким образом, ВЭБ — представитель семейства герпесвирусов (Herpesviridae), рода лимфокриптовирусов (Lymphocryptovirus), в таксономической классификации обозначается как герпесвирус человека-4 (ГВЧ-4). Геном его представлен двойной спиралью ДНК.
ВЭБ человек заражается в основном в детском возрасте и является до конца жизни его носителем, сам того не подозревая, поскольку инфекция ничем не проявляет себя. Это убиквитарный (то есть повсеместный) вирус, имеющий глобальную распространенность. Предполагается, что ВЭБ — провокатор различных злокачественных и доброкачественных новообразований на эпителиальном и лимфоидном уровнях. О канцерогенности ВЭБ свидетельствовали найденные в образцах опухолей его генетические элементы. Это дало основание ученым полагать, что опухоль начинает развиваться из зараженной клетки, куда внедрился вирус, и это вызывает патологические процессы эпителиальной, лимфоидной природы. Впрочем, однозначно утверждать, что рост агрессивных опухолей связан лишь с ВЭБ, было бы неправильно. Предположительно, немалую роль играют факторы невирусной этиологии.
Связь ВЭБ и канцерогенеза, по мнению исследователей, заключается в способности вируса вызывать генетические трансформации, которые ведут к клеточному росту. Поэтому отдельные ученые именуют его этиологическим агентом для злокачественных новообразований. Большую роль в усилении онкогенного потенциала ВЭБ играет ослабленность иммунной системы человека.
Кроме злокачественных процессов, ВЭБ способен запустить механизм инфекционного мононуклеоза, что проявляется в лихорадочном состоянии, воспалении лимфоузлов, поражении зева и высыпаниями на коже. Мононуклеоз проходит сам по себе в течение месяца, но может оставить после себя тяжелый след в виде поражений нервной системы. Также к последствиям инфицированности ВЭБ относят синдром хронической усталости — это заболевание, при котором не помогает даже длительный отдых. Клиническая картина основана на затяжной депрессии, ослабленной концентрации внимания, суставных и мышечных болях, беспричинных приступах гнева.
Профилактика и лечение ВЭБ

Вакцина против ВЭБ, как средство специфической профилактики, не разработана, но против разных типов вируса герпеса существует ряд эффективных препаратов. В частности, имеется группа лекарств противовирусного назначения (самые известные из них — ацикловир и валацикловир (Валтрекс)). При необходимости лечение может включать и антибиотикотерапию (сюда входят такие распространенные препараты, как Сумамед, тетрациклин, цефазолин), и внутривенное введение иммуноглобулинов (Пентаглобин, Интраглобин), витаминных комплексов, антиаллергических препаратов. Для коррекции иммунного состояния назначаются иммуномодуляторы, биологические стимуляторы (Солкосерил, Актовегин), цитокины (гормоноподобные белки).
Препятствием к созданию вакцины служит высокий уровень вирусной изменчивости на разных этапах его существования. Но, тем не менее, клинические испытания ведутся, и возможно, в скором времени профилактика ВЭБ в виде иммунизации станет распространенным явлением.
Онковирусы: двойная стратегия

16 февраля 1970 года скончался человек, который доказал, что причиной рака могут быть вирусы — американский патолог Фрэнсис Пейтон Роус. В 1969 году получил за свои исследования в области рака и за открытие онкогенных вирусов Нобелевскую премию, которую разделил с Чарльзом Хаггинсом.
К вирусной теории рака за последние 100 с лишним лет несколько раз менялось отношение. Однако сегодня известно точно: некоторые вирусы вызывают рак, и у них даже есть для этого все необходимые механизмы. MedAboutMe выяснял, как распространенные вирусы становятся причиной рака.
Вирусная теория рака

О вирусах наука узнала в 1890-х годах. Открытие вирусов — это тот замечательный случай в науке, когда все факты указывают на существование объекта, но получить этот объект, увидеть его невозможно — из-за несовершенства технологий. Самые лучшие фильтры, с помощью которых ученые уверенно выделяли бактерий, пропускали более мелкие по размеру вирусы.
В 1903 году французский ученый А. Боррель первым предположил, что вирусы могут быть причинами раковых опухолей. Через несколько лет исследователи О. Банг и В. Эллерман пришли к выводу, что лейкоз у кур — результат вирусной инфекции.
Российский ученый И.И. Мечников в 1910 г., обсуждая причины рака в газете «Русское слово», также высказал предположение, что причина развития злокачественных опухолей кроется не только в самом организме, но имеет также «экзогенное начало» — в виде вируса.
А буквально еще через год американский ветеринар Ф. Раус наглядно продемонстрировал, что саркома у кур вызывается именно вирусом — позднее Раус как раз и получит за свое открытие Нобелевскую премию. В исследованиях Рауса самое примечательно то, что он наблюдал за вирусом, изучал его, не видя, не имея возможности встретиться с ним, так сказать, «лицом к лицу». Выделить вирус удалось только в 1940-х годах.
На сегодняшний день известно не так уж много вирусов, которые приводят к развитию злокачественных опухолей — всего 15% случаев рака у человека имеют вирусную природу, у животных этот показатель существенно выше.
Как вирус приводит к раку?

Известно, что вирус использует геном и ресурсы клетки, чтобы синтезировать компоненты, необходимые ему для сборки новых вирусных частиц. При этом возможна реализация одной из двух стратегий. Если при этом происходит разрушение клетки — мы наблюдаем инфекционный процесс, распространение вируса по организму. Если же геном вируса определенным образом интегрируется с геномом клетки-хозяина, последняя перестает подчиняться системам, регулирующим ее рост и размножение. Как следствие, развивается злокачественная опухоль, растущая по своим законам.
Немалая часть онковирусов — это ретровирусы. Их геном представляет собой одноцепочечную РНК. Когда РНК вируса проникает в клетку, она становится матрицей для двухцепочечной ДНК, которая, в свою очередь, и будет встраиваться в геном клетки-хозяина.
Некоторые из онковирусов имеют в геноме онкогены, контролирующие процесс трансформации клетки с измененным геномом из обычной в злокачественную. Другие онковирусы обладают генами, которые активируют нужные участки генома клетки-хозяина, задействованные в процессах клеточного деления и дифференциации.
Онкогенные вирусы и болезни
Все заболевания, вызываемые онковирусами, отличает характерная черта: с момента заражения до появления первых симптомов может пройти 10-40 лет, то есть эти болезни имеют продолжительный латентный период.
Какие же вирусы могут стать причиной развития онкологических болезней у человека?
Вирус Т-клеточного лейкоза взрослых
Вирус Т-клеточного лейкоза взрослых (ATLV), или Т-лимфотропный вирус человека (HTLV), вызывает заболевание, которое встречается на паре островов Японского моря и у представителей негритянской расы в некоторых странах Карибского бассейна. Наблюдения показали, что даже если пациенты с этой разновидностью лейкоза встречаются в других странах мира, выявляется их связь с указанными регионами.
Следует отметить, что раком заболевает только 5% инфицированных людей, остальные являются носителями вируса. В геноме этого ретровируса имеется 2 копии одноцепочечных РНК. В организме жертвы на их основе синтезируется ДНК, которая интегрируется в геном клетки. Основу опухоли составляют CD4-лимфоциты.
Эта болезнь проявляется после 50 лет — отсюда и уточнение в названии. Для нее характерны увеличение печени и селезенки, лимфатических узлов, поражения кожи, разрушение костной ткани.
Вирусы герпеса
Рак могут вызывать два представителя семейства ДНК-содержащих вирусов герпеса:
Этот онковирус может стать причиной лимфомы Беркитта и рака носоглотки. Он способен размножаться, в частности, в В-лимфоцитах. При этом клетки не гибнут — в них запускается процесс неконтролируемого роста, что и приводит к образованию злокачественной опухоли. ВЭБ, по оценкам экспертов, имеется в крови у 90-95% взрослого населения и у половины детей младше 5 лет. Как видно, раком обладатели ВЭБ болеют редко, впрочем вирус вызывает целый ряд разнообразных заболеваний: от инфекционного мононуклеоза до лейкоплакии.
Этот вирус может стать причиной эпидемической разновидности саркомы Капоши. Вирус активизируется на фоне значительного иммунодефицита, поэтому чаще всего опухоль развивается у людей, больных СПИДом.
При саркоме Капоши эндотелий (внутренние стенки сосудов) разрастается, его структура меняется — стенки становятся «дырявыми». Эти изменения касаются и кровеносных, и лимфатических сосудов. У пациента развиваются поражения кожи, слизистых оболочек и внутренних органов, отеки, увеличение лимфатических узлов.
Вирусы гепатита
Вирусы гепатита В и С — ДНК-содержащие вирусы, способные спровоцировать формирование карциномы печени. Они не имеют онкогенов, поэтому являются вирусами непрямого действия. Это значит, что они «включают» гены клетки, которые запускают процесс неконтролируемого размножения и роста. Печень — активно регенерирующий орган. При поражении вирусами сначала развивается цирроз, начинается разрастание соединительной ткани, орган пытается регенерировать и восстановить свои функции, но под действием вируса происходит активизация процессов озлокачествления клеток и образования опухоли.
Следует отметить, что лишь у менее чем 5% взрослых зараженных людей развивается хронический гепатит В. И только у 20-30% из их числа будет диагностирован цирроз или рак печени. Сходная ситуация наблюдается и в отношении вируса гепатита С. Лишь 5% зараженных им людей получают рак.
Для защиты от вируса гепатита В еще в 1982 году ученые разработали вакцину. Она на 95% защищает от рака печени, ассоциированного с вирусом.
Вирус папилломы человека
Как и вирус Эпштейна-Барр, ВПЧ имеется у большинства взрослых людей. Считается, что к 30 годам не менее 70% людей хотя бы раз получали вирус от своего полового партнера, а среди молодых женщин половина является обладательницами ВПЧ. Неудивительно, если учитывать, что в ходе первого полового акта треть девушек получает вирус.
Однако и в этом случае повальной гибели людей от рака шейки матки не наблюдается. Из 130 штаммов вируса папилломы человека лишь 14 входят в группу высокого онкогенного риска. Чаще всего в тканях злокачественных опухолей шейки матки находят 16 и 18 типы: в 55% случаев — ВПЧ 16 типа и в 15% случаев — ВПЧ 18 типа. При этом 25% случаев рака шейки матки вообще не связаны с вирусной инфекцией.
ВПЧ имеет собственные онкогены, которые запускают процесс трансформации клеток. Утешает то, что дисплазия шейки матки, которая считается предраковым состоянием при поражении вирусами из группы высокого онкогенного риска, легко диагностируется при регулярных посещениях гинеколога и успешно лечится.
Вакцинация против рака
На самом деле, это, конечно, не очень правильное выражение — «вакцинация против рака». Заражение ВПЧ — это вовсе не 100%-ная гарантия заболевания раком шейки матки. А данная разновидность рака может развиться и без участия вируса — такое случается намного реже, но все же бывает. Аналогичная ситуация и с вирусами гепатитов В и С, и с вирусом Эпштейна-Барр, и др. Поэтому правильно говорить о вакцинации против возбудителей онкологических заболеваний.
- Вирусы — далеко не единственная причина образования злокачественных опухолей.
- Кроме вирусов, есть и другие организмы, которые обладают онкогенными свойствами — бактерии, гельминты.В то же время есть множество разновидностей рака неинфекционной природы.
- Некоторые вирусы вызывают рак у одних живых существ и никогда не делают этого у других.
- При заражении онковирусами вовсе не обязательно разовьется рак. А если и разовьется, то с высокой долей вероятности лет через 20-30, а то и больше. В большинстве случаев болезнь оказывается просто инфекцией, не вызывающей озлокачествления клеток организма-хозяина. Но чтобы максимально снизить риски, необходимо своевременно обращаться к врачу и лечиться, не дожидаясь худшего варианта развития событий.
- Наконец, если есть возможность — надо вакцинироваться и защитить себя от патогенов, способных вызвать рак.

Пройдите тест и узнаете на что стоит обратить внимание, к кому стоит пойти на профилактический осмотр, какие анализы сдать.
Что такое вакцины?

Большинство из нас знает, что введение вакцин, в разговорной речи называемое прививками, используется с целью стимуляции иммунной системы здорового человека для дальнейшей борьбы с инфекционными заболеваниями, такими как корь, краснуха, оспа и т. д. Иммунная система вырабатывает антитела к безвредным вирусным компонентам; в результате при повторном контакте с патогеном иммунитет с большей вероятностью сможет распознать и атаковать чужеродные вещества.
Какими бывают онковакцины?
Вакцины от рака бывают двух типов:
- профилактические;
- лечебные (терапевтические).
Вакцины для профилактики рака
По своей сути профилактические вакцины ничем не отличаются от привычных нам вакцин. Данные препараты защищают организм от вирусов, способных вызывать рак. Основа патогенеза онковирусов заключается в связи между вирусной инфекцией и последующей трансформацией клетки в опухолевую. Следовательно, человек должен быть вакцинирован до заражения вирусом. К профилактическим вакцинам относятся, например:
- вакцина против ВПЧ (вирус папилломы человека), вызывающего почти все виды рака шейки матки и связанный с развитием некоторых видов новообразований, в т.ч. опухолей горла, прямой кишки, а также других видов рака;
- вакцина против гепатита В, которая предотвращает заражение вирусом гепатита В (HBV). Длительная инфекция HBV может вызвать рак печени.
Вакцины для лечения рака
Терапевтические вакцины предназначены для индукции лизиса раковых клеток посредством стимуляции иммунной системы. Этот тип вакцин наряду с другими видами терапии используется при обнаружении в организме человека опухоли. Терапевтические вакцины способствуют распознаванию белков, экспрессируемых определёнными раковыми клетками, что помогает иммунной системе обнаруживать и уничтожать опухолевые очаги.
Терапевтические вакцины способствуют:
- остановке дальнейшего роста опухоли;
- уничтожению раковых клеток, оставшихся после других видов терапии;
- предотвращению рецидивов.
Типы терапевтических вакцин [1]:
- Антигенные вакцины
Эти вакцины производятся на основе специальных белков (антигенов), присутствующих в раковых клетках. - Клеточные вакцины
При создании цельноклеточных вакцин используют всю раковую клетку, а не только определенный клеточный белок (антиген). Такие вакцины производятся на основе собственных раковых клеток, раковых клеток другого человека или раковых клеток, выращенных в лаборатории. - Вакцины с дендритными клетками
Дендритные клетки помогают иммунной системе распознавать и атаковать аномальные клетки — в частности, раковые. Для создания таких вакцин дендритные клетки выращивают в лаборатории вместе с раковыми и затем вводят больному. - ДНК-вакцины
Данные вакцины изготавливаются из кусочков ДНК опухолевых клеток.
Терапевтические противораковые вакцины, используемые в настоящее время, включают:
- Sipuleucel-T (Provenge), которая используется для лечения рака предстательной железы. Каждая доза содержит специфически модифицированные в лаборатории лейкоциты пациента [2].
- Вакцину Bacillus Calmette-Guérin (BCG, БЦЖ), которая первоначально была разработана против туберкулеза и затем одобрена для лечения рака мочевого пузыря. БЦЖ — это живые бактерии, вводимые в мочевой пузырь через катетер. Бактерия привлекает иммунные клетки, которые затем атакуют раковые [3].
Вирусы папилломы человека (ВПЧ/HPV) — разнородная группа вирусов семейства Papillomaviridae, которые могут выступать в роли онкогенных агентов. В 1976 году Харальд цур Хаузен впервые высказал предположение об онкогенном потенциале ВПЧ при раке шейки матки (по частоте онкологических заболеваний женщин занимает четвертое место [4]). Долгое время появление рака шейки матки пытались связать с инфекцией вирусом простого герпеса типа 2 (ВПГ-2). А уже в 1984 году Хаузен с соавторами публикует ряд статей, подтверждающих взаимосвязь рака шейки матки с ВПЧ: приблизительно 90 % биоптатов содержали последовательности ДНК папилломавирусов, из них 57,4 % — ВПЧ типа 16 или 18 [5, 6].
В 2008 году за эти открытия Харальд цур Хаузен был удостоен Нобелевской премии по физиологии и медицине. ВПЧ способны инфицировать только эпителиальные клетки, причем в дифференцированных клетках инфекция носит непродуктивный характер. Таким образом, ВПЧ способен поражать эпителий кожи, слизистую оболочку мочевыводящих и половых путей, ротовой полости, гортань, глаз и другие органы. Вирус блокирует экспрессию антионкогенов p53 и pRb и усиливает пролиферацию клеток. В связи с этим основное проявление ВПЧ-инфекции — это появление на пораженном участке новообразований, чаще доброкачественных, таких как обычные, плоские, аногенитальные бородавки и папилломы на подошвах ног.
Онкогенные типы ВПЧ обнаруживают при таких злокачественных новообразованиях, как колоректальный рак, рак влагалища, полового члена, слизистой оболочки ротоглотки. Но четкая взаимосвязь между вирусом и образованием злокачественной опухоли на данный момент была доказана только для рака шейки матки [7].
По современным данным, ВПЧ различных типов обнаруживают в 99,7 % биоптатов при верификации рака шейки матки, при этом типы 16 и 18 присутствуют в 70 %. Так как ВПЧ является одним из главных факторов риска развития данной разновидности рака, были предприняты успешные попытки разработки вакцин против ВПЧ, которые опосредованно служат вакцинами от рака шейки матки.
ВОЗ рекомендует проведение вакцинации на национальном уровне и девочкам, и мальчикам в возрасте 9-14 лет, то есть перед началом половой жизни. При этом вакцинироваться можно и позже, до 45 лет (ранее считалось, что только до 27 лет). В ряде стран вакцины против ВПЧ уже включены в национальный календарь прививок в различном объеме (не во всех странах вакцинируют мальчиков), в России — только в ряде регионов.
На сегодняшний день эффективность вышеперечисленных вакцин можно оценить по снижению циркуляции онкогенных типов ВПЧ в популяции, но риск развития рака шейки матки измерить труднее: после заражения ВПЧ первые проявления опухолевого роста могут возникнуть через 20 лет. Тем не менее, есть данные пятилетних клинических исследований, где в качестве «конечных точек» выбрали аденокарциному in situ (AIS) и дисплазию шейки матки CIN2 и CIN3. Четырехвалентный «Гардасил» обеспечивал 99 % (95 % ДИ, 93-100 %; 5455 пациентов) эффективность: у 99 % неиммунных ранее к ВПЧ 6, 11, 16 и 18 типов женщин не были отмечены признаки AIS, CIN2 или CIN3. Такая же эффективность была определена у бивалентной и девятивалентной вакцин [10]. Таким образом, вакцины против ВПЧ в недалеком будущем могут стать одними из первых вакцин против рака.
Еще одним онкогенным вирусом является вирус Эпштейна — Барр, которым заражены до 90 % населения Земли. Вирус является возбудителем инфекционного мононуклеоза, чаще всего проявляющегося клинически при заражении в юношеском возрасте.
Этот вирус поражает клетки иммунной системы, а именно B-лимфоциты, ответственные за выработку антител. Носительство вируса Эпштейна — Барр связывают с возникновением таких форм онкологии, как лимфома Ходжкина, лимфома Беркитта, карцинома желудка и рак носоглотки. В настоящее время причина возникновения мутации доподлинно не известна, однако выявлена связь некоторых штаммов, распространенных в определенных областях, с развитием злокачественных новообразований. Так, у пациентов с лимфомой Беркитта в экваториальной Африке в 100 % случаях тест на вирус Эпштейна —Барр дает положительный результат [11].
В настоящее время вакцина от данного вируса все ещё находится в разработке. Процесс создания вакцины осложняется высокой вариабельностью штаммов вируса в зависимости от зоны распространения [12].
Развитие онкологических заболеваний можно также предупредить с помощью вакцин от вирусов гепатита. Гепатиты, вызываемые вирусами гепатита B и C, могут привести к развитию рака печени. Вирус гепатита B при персистировании в организме способен реактивироваться в условиях иммуносупрессии — например, при ВИЧ-инфекции или при прохождении химиотерапевтического лечения. В таком случае вакцина применяется не для профилактики рака, а для его лечения.
Вакцина против гепатита B, по данным некоторых исследователей, может работать в качестве противоракового адъюванта — вещества, усиливающего иммунный ответ [13]. Причем вакцина может использоваться не только при раке печени, но и при лечении злокачественных опухолей в других органах — например, глиобластомы [14]. Если говорить о формировании иммунитета против вируса после введения вакцины, то это возможно только в условиях нормального функционирования иммунной системы, то есть вакцинирование должно проводиться до развития иммунодефицита.
Вирус гепатита C также онкогенен. Среди инфекционистов гепатит C получил прозвище «ласкового убийцы», поскольку клиническая картина часто выражена неярко, а через некоторое время при отсутствии лечения (примерно в течение 10-15 лет) у зараженного практически в 80 % случаев наблюдается развитие первичного рака печени.
Предполагается, что это связано со встраиванием ДНК вируса в геном клеток печени и активацией лейкоцитов, приводящей к атаке ими собственных гепатоцитов организма. Вакцина против вируса гепатита С, в отличие от таковой против вируса гепатита B, все ещё находится в стадии разработки. Связано это с высокой скоростью мутаций вируса.
Итак, мы убедились, что привиться от рака возможно, но только в случае, если рак провоцируется онкогенными вирусами. Но помимо вирусов, инициаторами злокачественного роста могут служить и бактерии. Так, примером может служить широко известная Helicobacter pylori, с которой ассоциирован в том числе и рак желудка. При этом носители могут и не подозревать о таком риске, ведь часто присутствие H. pylori никак не проявляется [15].
К настоящему времени нам следует учитывать, что носителями H. pylori является более 50 % населения планеты и что, согласно данным Интернационального агентства по изучению рака, эта бактерия относится к первой группе канцерогенов [16].
В настоящее время все больше людей узнают о микробиоме и его пользе; при этом все реже мы задумываемся о вреде бактерий в желудочно-кишечном тракте, списывая все проблемы на иные микроорганизмы.
Но, во-первых, H. pylori приютилась не в кишечнике, а в желудке. Как известно, рН в желудке низкий (другими словами, кислотность высокая), а в таких условиях микроорганизмам крайне сложно выживать. Но, подобно тому, как это бывает в сценарии фильма, зло порой оказывается сильнее. Вот и в нашем случае в агрессивной среде желудка научилась выживать патогенная H. pylori.
Во-вторых, хотя бактерия и не может изменять геном человека напрямую (так, как это делают некоторые вирусы), она способна повреждать генетический аппарат клетки, вмешиваясь в каскад белковых реакций с помощью своих собственных белков. На наружной мембране бактерии расположены белки, которые способны связываться с белками, находящимися на поверхности эпителиальных клеток желудка (обозначим эту способность термином «тканевой тропизм»).
Во время инфекции H. pylori воздействует, в частности, на клеточный белок кортактин, который необходим для правильной регуляции перестроек цитоскелета в здоровых клетках. Нарушение регуляции активности кортактина играет решающую роль в развитии различных форм рака, а также незлокачественных заболеваний, таких как воспалительные заболевания кишечника (гастриты) [17].
Как и остальные бактерии, в борьбе с которыми используют антибиотики, H. рylori успешно приобретает антибиотикорезистентность и способность скрываться от иммунной системы организма. Поэтому так часто после курса лечения человек снова сталкивается с H. рylori. Это явилось предпосылкой для разработки вакцины от данного патогена [18]. К сожалению, попытки создать такую вакцину уже не раз оказывались неудачными, но научное сообщество находится в поисках наилучшего антигена и адъюванта [19]. Если вакцина от H. pylori появится, то и о ней мы сможем говорить как о «прививке от рака», ведь тогда можно будет предотвратить значительную долю всех случаев рака желудка.
Выводы
Из вышесказанного одно ясно точно — вакцины, которые препятствуют развитию рака, существуют, их активно используют в исследованиях, а некоторые даже применяют в клинике для лечения и профилактики онкозаболеваний — например, при терапии рака печени (вирус гепатита B) и предотвращения рака шейки матки (ВПЧ). Исследования в данном направлении интенсивно развиваются, и на сегодняшний день уже можно с уверенностью сказать, что они вносят весомый вклад в здравоохранение, а в дальнейшем такие разработки могут принести ещё больше пользы в борьбе против рака.
Очень велик, однако, вклад исследований онкогенных вирусов в понимание этиопатогенеза злокачественных заболеваний в целом. Ученые смогли удостовериться в том, что патогенез онкозаболеваний может быть связан с внешними биологическими возбудителями, и спектр воздействия на них в ходе терапии должен быть шире, методы — изящнее и продуманнее. Если брать во внимание подход, заключающийся в профилактике канцерогенных воздействий, можно с толикой уверенности предположить, что в будущем противоопухолевая терапия может стать крайне эффективной.
Вакцина против рака — это недостижимый идеал медицины, к которому стремятся ученые со всего мира, косвенно или напрямую. Хоть его приближение и связано в наибольшей степени с генной инженерией, в рамках которой уже сейчас используется виротерапия, мы были рады поделиться с вами этой безусловно полезной информацией о вакцинах против онковирусов, которые хоть и с натяжкой, но можно назвать вакцинами против рака.
Онкогенные вирусы

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
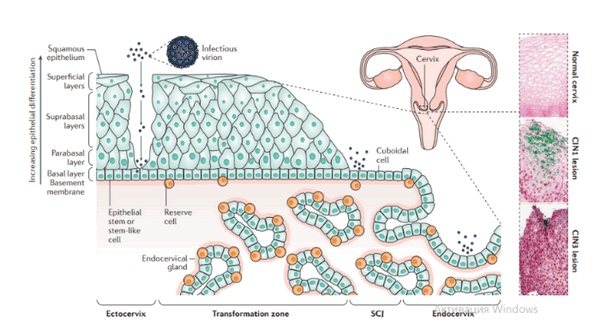
Cчитается, что прекращение регулирования гена экспрессии ВПЧ высокого риска зависит от конкретных характеристик базальной клетки, которую заражает вирус, а также от восприимчивости этой зараженной клетки к внешним стимулам, таким как гормоны и факторы роста. Большинство видов рака шейки матки возникает в зоне трансформации и слизистой оболочки шейки матки; область шейки матки, состоящая первоначально из столбчатого эпителия, затем подвергается метаплазии. Предполагается, что стратифицированные (разделенные) слои внешней шейки матки поддерживаются «обычными» эпителиальными стволовыми клетками, которые расположены в базальном слое. Природа этих клеток не установлена. Напротив, стратифицированные слои зоны трансформации и один слой столбчатых ячеек — это линия слизистой оболочки шейки матки, как полагают, поддерживается резервными клетками шейки матки. Хотя резервные клетки достаточно обильны в местах метаплазии, недавние исследования дополнительно предположили, что стволоподобные клетки второго типа кубического вида, которые расположены более точно в стыке переходной зоны (squamocolumnar junction), тоже проявляют резервную функцию.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
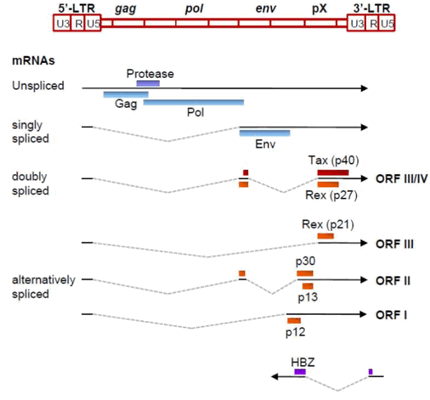
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
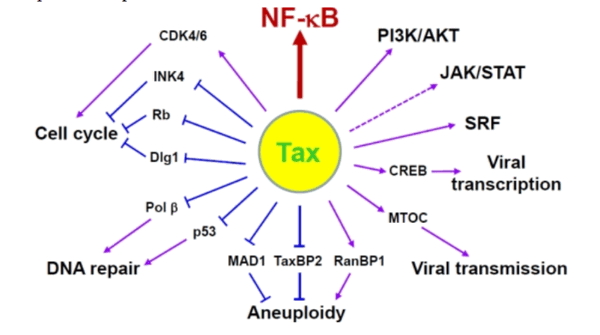
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Геном. Геном вируса гепатита B представляет собой одну двухцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (ее длина составляет 1700-2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к ее 5’-концу ковалентно присоединена молекула полимеразы (P). В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
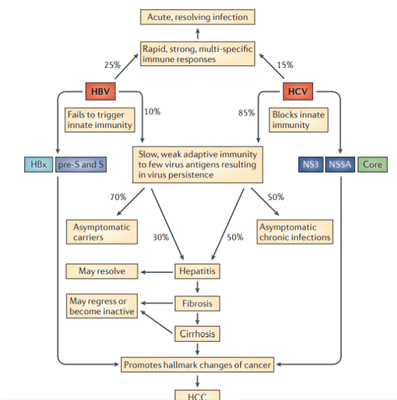
Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma-Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein-Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.
Читайте также:
- КТ, цистография при плоскоклеточном раке мочевого пузыря
- Вводные сведения о заболеваниях носа и околоносовых пазух
- Максимальная степень повышения желудочкового давления. Дисфункция левого желудочка при сердечной недостаточности
- Клиника и диагностика пневмоцистной инфекции у гематологических больных
- Развитие сердца эмбриона. Образование первичного трубчатого сердца плода
