Развитие грудного протока эмбриона. Образование лимфатических узлов плода
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Развитие лимфатической системы является результатом взаимодействия сосудов разного типа, растущих неравномерно. Его формы меняются так же, как строение и топография сосудов, их сочетания в связи с органогенезом.
Ключевые слова : лимфатическая система, развитие.
LYMPHATIC SYSTEM AND ORGANOGENESIS:
NORMAL DEVELOPMENT AND CONGENITAL MALFORMATIONS
Petrenko V.M.
OLME , St.-Petersburg, Russia,
(194021, St.-Petersburg, Karbisheva street, 6-2-65) Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Development of lymphatic system is the result of interactions of different uneven increasing vessels. Its forms change such as structure and topography of that vessels and their combinations in connection with organogenesis.
Key words: lymphatic system, development.
Введение. Развитие лимфатической системы в литературе описано очень ограничено и противоречиво, обычно без выяснения механизмов, в отрыве от органогенеза [1,3]. Между тем данные процессы и в эволюции, и в онтогенезе тесно взаимосвязаны. С учетом этой взаимосвязи мне удалось объяснить механику закладки лимфатической системы и показать ее роль в органогенезе.
Основные этапы развития лимфатической системы
Филогенез. Первоначально единое сосудистое (гемолимфатическое) русло животных постепенно разделяется у позвоночных на замкнутую, круговую систему кровеносных сосудов и разветвленно-линейную, не замкнутую в круг систему лимфатических сосудов (ЛС).
У круглоротых обнаруживаются многочисленные венозные синусы - боковые выпячивания стенок вен кишки, кожи, органа зрения и других органов. Венозные синусы полиморфны и заполнены кровью, принимают в качестве притоков периферические вены.
У хрящевых рыб, наряду с венозными синусами, появляются висцеральные (первичные лимфатические) сосуды - притоки синусов, в той или иной степени обособленные от кровеносного русла.
У костистых рыб впервые определяется полностью обособленная система ЛС и лимфатических мешков (ЛМ) или синусов.
У птиц лимфатическая система состоит только из клапанных ЛС, а ЛМ отсутствуют. У водоплавающих птиц обнаружены единичные лимфатические узлы (ЛУ) шеи и поясничной области.
У млекопитающих лимфатическая система состоит из ЛС и ЛУ.
Онтогенез человека . С XIX века существуют две основные точки зрения на происхождение ЛС в эмбриогенезе человека и млекопитающих животных. O . Kampmeier (1912) предположил возникновение ЛС из мезенхимных щелей, причем неясной природы. Эта гипотеза противоречит биогенетическому закону (эмбриогенез рекапитулирует основные этапы филогенеза). Кроме того, мезенхимная гипотеза не объясняет судьбу целого ряда якобы исчезающих эмбриональных вен, устойчивое положение лимфатических коллекторов, лимфовенозного соединения. И самой мезенхимы уже нет в эти сроки развития.
По мнению F . Sabin (1902) и F . Lewis (1905), часть первичных вен зародыша обособляется из венозного русла (по моим данным - в процессе и в результате неравномерного роста органов и сосудов), образует ЛМ и презумптивную лимфатическую систему. Лимфатическая система в пренатальном онтогенезе человека проходит 3 стадии развития: 1) синусную (5-7 нед); 2) презумптивных ЛС и ЛМ - первичная система (6-10 нед); 3) ЛС и ЛУ - вторичная система, она формируется, начиная с третьего месяца утробной жизни человека.
В пожилом и старческом периодах жизни человека обнаружены признаки дегенерации лимфатической системы - редукция сетей лимфатических капилляров и клапанов, ЛС и ЛУ, атрофия лимфоидной ткани, уменьшение числа гладких миоцитов и фиброз клапанов, стенок ЛС, капсулы ЛУ, фрагментация эластических волокон. Наблюдаются варикозные расширения ЛС, особенно в тонких стенках клапанных синусов, уменьшение числа и увеличение размеров некоторых ЛУ в результате их сращения. Такие ЛУ могут иметь лентовидную или сегментарную форму, срастаться в конгломераты.
Аномалии лимфатической системы сочетаются с другими аномалиями сосудистой системы и внутренних органов человека. Выделяют следующие виды аномалий лимфатической системы:
- аплазия лимфатического русла - отсутствие ЛС в какой-либо области, что приводит к отеку тканей, органа (лимфедема или слоновость);
- врожденное отсутствие грудного протока как вариант аплазии лимфатического русла встречается в 0,1% случаев;
• гипоплазия лимфатического русла - количество ЛС резко уменьшено. При гипертрофии или повреждении органа это может привести к нарушению лимфооттока и отеку органа;
• замещение части грудного протока сплетением мелких ЛС (можно рассматривать как вариант его гипоплазии);
• лимфангиэктазия (врожденная и приобретенная) проявляется недоразвитием или полным отсутствием клапанного аппарата, расширением ЛС, соединительнотканным перерождением его стенки, застоем лимфы (лимфедема). Врожденная лимфангиэктазия возникает на поздних этапах развития ЛС у плодов, когда протекает дифференциация оболочек стенки ЛС, мышечных манжеток лимфангионов.
Происхождение и механика развития лимфатической системы. С момента закладки и в филогенезе, и в онтогенезе позвоночных лимфатическая система является неотъемлимой частью сердечно-сосудистой системы и возникает путем выключения из кровотока части коллатералей первичного венозного русла (отделение от магистрали по градиенту кровяного давления): 1) артерии с более толстыми и дифференцированными стенками инвагинируют в просвет первичных вен вместе с их тонкими, эндотелиальными стенками (иначе - расширяющиеся вены эпиболируют находящиеся на их пути артерии). Таким образом крупные экстраорганные вены разделяются на центральные каналы с магистральным кровотоком и боковые венозные карманы. C ообщения карманов с центральным каналом сужаются и они вскоре отделяются в виде лимфатических щелей с эндотелиальной выстилкой. Такие щели выключаются из кровотока и скоро сливаются с образованием ЛМ и ЛС. Притоки венозных карманов также выключаются из кровотока с образованием грудных протоков, поясничных и других стволов. Позднее образуются ЛУ: в просвет первичных ЛС с тонкими эндотелиальными стенками инвагинируют кровеносные сосуды с более толстыми и дифференцированными стенками. ЛУ не прерывают, а деформируют ЛС с последующей трансформацией матричного ЛС в сеть синусов в процессе роста лимфоидной муфты вокруг кровеносных сосудов инвагинации. «Намывание» лимфоцитов в строму инвагинации (закладки ЛУ) с образованием паренхимы ЛУ связано с торможением прямого лимфотока (через первичный синус) и нарастанием трансфузионного лимфотока (через межсосудистую соединительную ткань в закладке ЛУ). Преобразования (самодифференциация) сердечно-сосудистой системы зародыша обусловлены интенсивным ростом органов и гистогенезом, сопровождающихся усиленной продукцией тканевой жидкости с увеличением нагрузки на дренажные сосуды, их расширением, «размножением», образованием лимфатических коллатералей.
Рекомбинационный морфогенез лимфатической системы. Морфогенез лимфатической системы в пренатальном онтогенезе человека в своей основе является результатом непрерывного взаимодействия сосудов разного типа. Его формы меняются так же, как строение и топография неравномерно растущих сосудов, их сочетания. Морфогенез лимфатической системы протекает как процесс рекомбинации артерий и вен (А, В), а затем и ЛС, служит проявлением самодифференциации сердечно-сосудистой системы, когда ее части вступают в повторное взаимодействие, в т.ч. и после трансформации, а в результате возникают новые структуры. В основе рекомбинационного морфогенеза лимфатической системы лежат гетерохронный гистогенез и неравномерный рост стенок сосудов (А→В→ЛС), их разная резистентность к давлению, внутреннему (кровоток) и внешнему (органы, сосуды). Лимфатическая система, все возрастные типы и индивидуальные варианты ее строения, как и в целом сердечно-сосудистой системы, адекватны строению индивида и органогенезу. Рекомбинационный морфогенез лимфатической системы состоит в периодическом (вос)соединении артерий и первичных вен (А, В о ), а затем и с первичными лимфатическими сосудами (ЛС о ) в локальные анатомо-топографические комплексы, что приводит к закладке лимфатической системы и переходу ее на качественно новый этап развития: 1) дифференциальный морфогенез первичного венозного русла - его разделение на вторичные В (магистрали) и лимфатические щели с притоками (коллатерали) с последующей закладкой ЛМ и ЛС о происходят в результате взаимодействия А и В о . Формально данный процесс развития сосудистого русла можно записать в виде уравнения: А × В о → А + В + ЛС о ; 2) трансформационный морфогенез первичного лимфатического русла - его постепенное преобразование во вторичное лимфатическое русло, когда в результате взаимодействия А и В с ЛС о происходит закладка ЛУ: (А+В) × ЛС о → (А+В) + (ЛС+ЛУ) о ; 3) модификационный морфогенез вторичного лимфатического русла - его видоизменение путем неравномерного роста и деформации его стенок с образованием клапанов и межклапанных сегментов, гладких миоцитов и т.д.: (А+В) × (ЛС+ЛУ) о → (А+В) + (ЛС+ЛУ). Так давление аорты и ее ветвей на отдельные участки грудного протока вызывает в них повышенное образование клапанов и гладких миоцитов - они ограничивают обратный и поддерживают прямой лимфоток в этом участке протока. Три указанных процесса могут протекать последовательно, как стадии морфогенеза лимфатической системы, или параллельно, даже взаимосвязанно, особенно 2 последних процесса.
Заключение. Рекомбинационный морфогенез лимфатической системы представляет собой результат процесса самодифференциации сердечно-сосудистой системы, когда ее части вступают в повторное взаимодействие, в т.ч. и после их трансформации. В результате возникают новые структуры развивающегося организма. Все сосуды так или иначе обслуживают органы, в т.ч. обеспечивают их интенсивный рост и гистогенез. На это А реагируют ускоренным утолщением, уплотнением и усложнением строения своих стенок (интенсивный путь развития) в связи с увеличением объемной скорости кровотока и артериального давления, нагнетательной функции сердца (объема и толщины миокарда). Одновременно увеличиваются объем тканевой жидкости и число В о , дренирующих органы, особенно их коллатералей (экстенсивный путь развития). И часть из них выключается из кровотока с закладкой первичной лимфатической системы (ЛМ + ЛС о ), которая позднее преобразуется во вторичную или дефинитивную (ЛС + ЛУ).
Закладка лимфатического русла как разрешение критической ситуации в эмбриональном органогенезе. Этот вопрос я проиллюстрирую на примере развития двенадцатиперстной кишки (ДК).
Заключение. Закладка лимфатического русла ДК происходит в критической ситуации эмбрионального органогенеза: спирализация ДК вызывает сужение ее изгибов, деформацию вен брыжейки и ишемию стенки, что стимулирует физиологическую гибель эпителиоцитов и реканализацию ДК, но может привести к прорастанию соединительной ткани через дефекты эпителия в полость ДК, особенно в области суженных изгибов. В норме венозное русло брыжейки разделяется на вторичные вены и первичные ЛС, что улучшает дренаж стенки ДК. Интенсивный рост печени и вторичные сращения брюшины сопровождаются прекращением спирализации ДК и закладкой ЛУ.
Вторичные сращения брюшины и развитие лимфатической системы. Обширные, постоянные вторичные сращения брюшины (ВСБ) характерны для человека. ВСБ способствуют адаптации внутренних органов брюшной полости к прямохождению. Описаны ограниченные ВСБ у обезъян и слонов. Корреляции между ВСБ и морфогенезом лимфатической системы не выяснялись. С этой целью мной проведено исследование на 400 трупах эмбрионов и плодов человека 4-36 нед и 30 зародышей белой крысы 12-21 сут с использованием комплекса разных методов, включая изготовление серийных окрашенных гистологических срезов, инъекцию лимфатического русла синей массой Герота и препарирование.
У человека ВСБ протекают главным образом у плодов 3-5 мес, начинаются в 8,5-9,5 нед в связи с вправлением физиологической пупочной грыжи в брюшную полость, что приводит к резкому увеличению давления органов на заднюю брюшную стенку и брыжейки на уровне I поясничного позвонка, в парааортальной зоне. ВСБ распространяются вправо и влево от средней линии и вниз. Они играют важную роль в формообразовании органов, прежде всего ДК и ободочной кишки, а также разделении брюшины на этажи и их компартменты. Но в этот же период происходят закладка и обособление ЛУ в брюшной полости, причем в участках и по направлениям ВСБ. В частности, задние ВСБ опережают в своем развитии передние ВСБ, поясничные ЛУ - брыжеечные ЛУ; чем обширнее ВСБ и выше их уровень, тем обычно больше поясничных ЛУ и выше уровень их размещения, выше вероятность полной элиминации цистерны грудного протока, кишечных стволов, цистерн и сплетения поясничных стволов; левые поясничные ЛУ многочисленнее, расположены выше, как и ВСБ, левый поясничный ствол чаще одиночный и начинается выше, чем правые поясничные стволы. ВСБ начинаются в области двенадцатиперстно-тощекишечного изгиба и тела поджелудочной железы, корня брыжейки пупочной кишечной петли. Именно в этой области первыми появляются наиболее постоянные левые поясничные (предаортальные и латеральные аортальные) и центральные верхние брыжеечные ЛУ. Затем с задней брюшной стенкой срастается головка поджелудочной железы, а к ней фиксируется брыжейка пупочной кишечной петли, разделяясь на корни брыжеек тонкой и ободочной кишки. Одновременно происходит закладка панкреатодуоденальных, средних верхних брыжеечных и средних ободочных ЛУ, причем от корня брыжейки к кишечной стенке.
У белой крысы удалось найти ВСБ между петлями тонкой кишки, между нисходящей ободочной (задней) кишкой и тонкой кишкой (справа) и большим сальником (слева) на уровне почечных «ножек», между пластинками короткого большого сальника. Он спускался до уровня левой почечной «ножки» или немного каудальнее. У крысы цистерна грудного протока и кишечный ствол постоянны, хотя и разной конструкции, гораздо меньше ЛУ, чем у человека, а поясничные ЛУ непостоянны, располагаются на 1-2 позвонка каудальнее. Ограниченные ВСБ и закладку поясничных и брыжеечных ЛУ у крысы можно объяснить крупными размерами многолопастной печени и желудка. Они тормозят вправление физиологической пупочной грыжи в брюшную полость (происходит на сравнительно более поздней стадии, у плодов крысы 17-18 сут, и более медленно, завершается перед рождением), а затем смещение петель тонкой кишки вправо и влево от средней линии, а почек - краниально. В результате уменьшается давление растущих органов на заднюю брюшную стенку, брыжейки и их сосуды, толстая кишка растет медленно, не образует изгибов, характерных для человека, и сохраняет на значительном протяжении срединное положение. Каудальный брыжеечный ЛУ образуется в зоне давления репонированной пупочной грыжи на толстую кишку. У плодов белой крысы продольный размер брюшной полости и длина задней кишки невелики на этапе закладки ЛУ (17-19 сут). В связи с их закладкой происходит образование новых ЛС, анастомозов и коллатералей уже существующих ЛС. Вероятно поэтому формируется брыжеечный лимфатический коллектор толстой кишки между субаортальными (тазовыми) и брыжеечными ЛУ - благодаря сохранению сагиттально расположенной короткой брыжейки задней кишки на уровне от бифуркации аорты до почечных «ножек». В дальнейшем, особенно после рождения, хвостовой отдел крысят, их брюшная аорта и брыжеечный лимфатический коллектор толстой кишки, межузловые поясничные стволы удлиняются: каудальный брыжеечный и субаортальные ЛУ оказываются на значительном удалении друг от друга у зрелой крысы так же, как краниальные и каудальные поясничные ЛУ.
Заключение. ВСБ кардинально изменяют анатомо-топографические взаимоотношения внутренних органов брюшной полости, а закладка ЛУ - строение лимфатической системы. Однако степень развития ВСБ и ЛУ у плодов человека и белой крысы различна. Оба процесса связаны с давлением интенсивно растущих органов брюшной полости на ее стенки и содержимое. Вправление физиологической пупочной грыжи увеличивает внутрибрюшное давление, а следовательно способствует развитию (возможно инициирует начало) ВСБ и закладке ЛУ брюшной полости, причем у человека в гораздо большей мере, чем у крысы с ее относительно более крупной печенью.
1. Петренко В.М. Развитие лимфатической системы в пренатальном онтогенезе человека. СПб: изд-во СПбГМА, 1998.- 364 с.
2. Петренко В.М. Эмбриональные основы возникновения врожденной непроходимости двенадцатиперстной кишки человека. СПб: изд-во СПбГМА, 2002.- 150 с.
3. Петренко В.М. Эволюция и онтогенез лимфатической системы. Второе издание. СПб: изд-во ДЕАН, 2003.- 336 с.
4. Петренко В.М. Лимфатическая система. Анатомия и развитие. Четвертое издание. СПб: изд-во ДЕАН, 2010. - 112 с.
5. Петренко В.М. О физиологии развития лимфатической системы // Успехи современного естествознания. - 2010. - № 6. - С. 36-39.
6. Петренко В.М. Рекомбинационный морфогенез лимфатической системы в пренатальном онтогенезе человека // Успехи современного естествознания. - 2011. - № 1. - С. 20-26.
Развитие грудного протока эмбриона. Образование лимфатических узлов плода
Сторонники разных концепций возникновения лимфатической системы в эмбриогенезе (Sabin F., 1902, 1909; Lewis F., 1906, 1909; Kampmeier O., 1912, 1931; и др.) так или иначе связывали закладку яремных лимфатических мешков (ЯЛМ) с морфогенезом венозного сплетения около прекардинальных вен, но по-разному трактовали его преобразования. До сих никто не объяснил механику развития ЯЛМ. Исследование проведено на 50 сериях срезов зародышей человека 4-12 нед толщиной 5-7 мкм, окрашенных смесью Маллори, гематоксилином и эозином, пикрофуксином по Ван Гизон, толуидиновым и альциановым синими, реактивом Шиффа, импрегнированных нитратом серебра по Карупу.
Заключение
ЯЛМ формируются из части венозного русла в процессе интенсивного роста органов шеи и верхних конечностей у эмбрионов 6-8 нед, нарастания в этой связи продукции тканевой жидкости. ЯЛМ компенсируют увеличивающийся дефицит емкости основного вещества соединительной ткани в условиях снижения проницаемости стенок вторичных вен. У плодов 3-го мес в расширяющиеся ЯЛМ инвагинируют кровеносные сосуды и возникают шейные лимфоузлы. Они структурно и функционально замещают ЯЛМ.
Шейная часть грудного протока без дуги образуется у плодов человека 3-го месяца из дорсокаудального отрога левого яремного лимфатического мешка в процессе расчленения мешка зачатками шейных лимфатических узлов, содержит три клапана.
Введение
Шейная часть грудного протока (ГП) человека имеет сложную и вариабельную топографию, у плодов описывается, начиная с 4-5 мес, когда множественные лимфатические узлы обособились, а лимфатические мешки редуцировались 2. По данным F..Sabin [6], ГП вырастают из двух яремных лимфатических мешков (ЯЛМ) венозного происхождения. По O..Kampmeier [4], шейная часть ГП возникает из вакуолей в мезенхиме около кардинальных вен и их притоков, сразу непарная.. S..Putte [5] обнаружил ряд изолированных закладок лимфатической системы, вероятно, венозного происхождения - лимфатические мешки и сплетения, ГП; разрастаясь, они объединяются. По моим данным [3], парная закладка ГП у эмбрионов 14-15 мм длины (начало 7-й нед) определяется на уровне II-VIII грудных позвонков как каудальный приток дорсокаудального отрога ЯЛМ (уровень I грудного - VII шейного позвонков). ГП формируется выключающимися из кровотока венами - передней супракардинальной, позади прекардинальной вены, и грудной субкардинальной, вентромедиально от посткардинальной вены. Крупный клапан соединения ЯЛМ и прекардинальной вены находится на уровне VII шейного позвонка. У эмбрионов 6-7 нед происходит разгибание головы с удлинением шеи. В результате растущие зачатки тимуса в эти сроки как-будто опускаются. У эмбрионов 19-25 мм длины (7-7,5 нед) они проходят в верхнюю апертуру грудной клетки, через паратрахеальные лимфатические сплетения, впереди левой плечеголовной вены, дуги аорты. Супрааортальная часть ГП находится рядом с паратрахеальными сплетениями, позади ветвей дуги аорты, они тормозят каудальное смещение зачатков тимуса, особенно левого. Кровоток по дуге аорты справа налево, пульсация дуги могут стимулировать аналогичный по направлению лимфоток в паратрахеальном сплетении и преимущественный рост его левой части.. Редукция связей ГП с правым ЯЛМ (и супрааортального отрезка правого ГП) происходит у плодов 9-10 нед, что показано мной методом инъекции синей массы Герота. Недавно я получил новый материал по данному вопросу.
Материал и методы
Срезы 7 зародышей человека 25-36 мм длины (7,5-8,5 нед) в трех основных плоскостях и поперечные срезы шейно-грудной части 8 плодов человека 45-79 мм длины (9,5-12 нед) толщиной 5-7 мкм были окрашены гематоксилином и эозином, пикрофуксином, импрегнированы нитратом серебра. ГП 2 плодов человека 40 и 48 мм длины (9-9,5 нед) были инъецированы синей массой Герота.
Результаты
Шейная часть ГП дифференцируется у плодов 3-го мес. человека из дорсокаудального отрога левого ЯЛМ в процессе расчленения ЯЛМ закладками шейных лимфоузлов в плотном окружении интенсивно растущих органов, в связи с морфогенезом яремного лимфатического ствола.. У плодов 11-12 нед короткая, косопоперечная шейная часть ГП сочетает признаки дефинитивного состояния у лиц с брахиморфным (форма - дуга не выражена, магистральное строение) и долихоморфным телосложением (скелетотопия - высокое размещение, синтопия - более медиальное начало). Поэтому трудно проводить параллели между начальными этапами развития и дефинитивным состоянием шейной части ГП человека. Почти прямая, идущая косо вверх и латерально без образования дуги шейная часть ГП встречается у 7% людей разных возрастов, но чаще у плодов и детей [1]. Короткая шея плодов 3-го мес плотно заполнена разными органами над косопоперечной шейной частью ГП, а ниже крупная печень при небольших легких обусловливает высокое размещение купола диафрагмы и большого сердца. Дуга аорты и левая плечеголовная вена достигают уровня I грудного позвонка. Поэтому низкая дуга левой подключичной артерии не выражена и отставлена от начала левой общей сонной артерии, которая у плодов имеет сравнительно большой диаметр. Анатомотопографические взаимоотношения ГП мало меняются до самого рождения человека. Редукция правого ГП выше дуги аорты и отсутствие прямого давления тимуса, пищевода и трахеи на шейную часть левого ГП приводят, возможно, к частичному сохранению левого ЯЛМ в виде расширения шейной части ГП в разной степени. Концевая цистерна ГП встречается у 55% людей [1]. Этому способствует, по мнению Г.М. Иосифова [1], периодическое торможение лимфотока в устье ГП на вдохе. Это возможно также в результате возрастания венозного давления и напряжения венозной стенки в систолу предсердий. Крупный звездчатый узел примыкает сзади к шейной части ГП и, наряду с вентральным давлением левой общей сонной артерии, возможно способствует закладке клапанов в шейной части ГП. Уже у плодов 10-11 нед ее стенка представлена не только эндотелием, но и собственной адвентициальной оболочкой, а у плодов 11-12 нед появляются первые миоциты. Шейная дуга ГП в классическом виде отсутствует на этой стадии развития. У плодов 11-12 нед обнаружена связь начала шейной части ГП с очень крупным позадивенозным (внутренним яремным) глубоким нижним латеральным шейным лимфоузлом. Она встречается у 37% людей, с 1-3 лимфоузлами - у 69% людей, причем связь может быть как топографической, так и посредством лимфатических сосудов, а лимфоузлы могут иметь разные размеры и локализацию [1].
Рис. 1. Плод человека 65 мм длины (11 нед), поперечные срезы: 1 - тело позвонка; 2 - пищевод; 3 - трахея; 4 - левая общая сонная артерия; 5 - левая внутренняя яремная вена; 6 - левый блуждающий нерв; 7 - лимфатическое сплетение; 8 - нижний глубокий лимфатический узел шеи, его воротный синус; 9 - левый яремный ствол; 10 - грудной проток (шейная часть) и его клапаны, дистальный (А) и проксимальный (Б); 11 - звездчатый узел; 12,13 - нижняя щитовидная и позвоночная артерии. Пикрофуксин. Ув.: А, Б - 30; В - 200.
Рис. 2. Схема топографии («хода») краниального отдела грудного протока у плодов человека
11-12 недель: 1 - интеразигоаортальный отрезок; 2 - позади пищевода; 3 - позади левой общей сонной артерии; 4 - нижний глубокий шейный лимфоузел позади внутренней яремной вены, из него выходит левый яремный ствол; 5 - левый подключичный ствол, который может впадать в грудной проток или самостоятельно в венозный угол шеи.
ГРУДНОЙ ПРОТОК
Грудной проток [ductus thoracicus (PNA, BNA, JNA)] — основной коллектор лимфатической системы, по к-рому лимфа оттекает в венозное русло от нижних конечностей, таза, стенок и органов брюшной полости, левой половины груди и расположенных в ней органов, а также левой половины головы и шеи, левой верхней конечности.
У человека Грудной проток впервые описал в 1652 г. датский анатом Бартолин (Th. Bartholinus). Различные исследования Грудного протока выполнили Г. М. Иосифов (1904), Рувьер (H. Rouviere, 1932), Д. А. Жданов (1945), Якобссон (S.-I. Jacobsson, 1972).
Содержание
Эмбриология
Анатомия
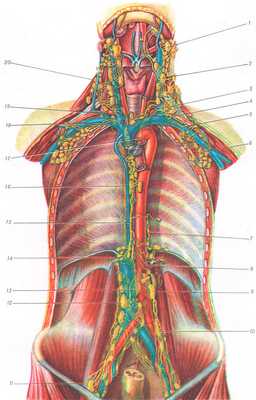
Топография грудного протока: 1 — lymphonodus jugulodigastricus; 2 — lyraphonodus juguloomohyoideus; 3 — устье грудного протока и место впадения в него truncus jugularis sin.; 4 — место впадения truncus subclavius sin. в ductus thoracicus; 5 —truncus subclavius sin.; 6 — lymphonodi axillares; 7 — левая околоаортальная коллатераль к грудному протоку; 8 —сплетение впадающих в грудной проток сосудов левых поясничных лимфатических узлов; 9 — lymphonodus lumbalis sin.; 10 — Nodi iliaci communes; 11— lymphonodi iliaci externi;12 — lymphonodi lumbales dext.; 13 — cisterna chyli; 14 — правая трансдиафрагмальная коллатераль к началу грудного протока; 15 —ductus thoracicus (интеразигоаортальная часть); 16 — lymphonodi mediastinales posteriores; 17 —ductus thoracicus (супрааортальная часть); 18 — truncus subclavius dext.; 19 —truncus jugularis dext.; 20 — цепь лимфатических узлов вдоль n. accessorius.
Длина Грудного протока у взрослого человека 30—41 см (в среднем 38,5 см), диам. ок. 3 мм, а в области цистерны —7 мм. Выделяют брюшной, грудной и шейный отделы Г. п. Проток формируется в забрюшинной клетчатке на уровне Th12 — L2 позвонков путем слияния правого и левого поясничных стволов (trunci lumbales). В один из этих стволов или в расширенную начальную часть Г. п. (млечную цистерну — cysterna chyli) впадают кишечные стволы (trunci intestinales), являющиеся выносящими сосудами брыжеечных, печеночных и других лимфатических узлов брюшной полости. Млечная цистерна, встречающаяся в 3/4 случаев и имеющая конусовидную, ампуловидную, веретенообразную или другую форму, или сплетение образующих Г. п. сосудов (в 1/4 случаев) располагается на уровне L1-2 (низкое положение) или Th11-12 позвонков (высокое положение) справа и сзади от аорты между средними ножками поясничной части диафрагмы. При этом Г. п. сращен с ее правой ножкой, к-рая при дыхательных движениях периодически сжимает и растягивает начало протока, способствуя продвижению лимфы.
Начавшись в брюшной полости, Г. п. проникает через аортальное отверстие диафрагмы в грудную полость и располагается в заднем средостении (цветн. рис.). Грудная часть Г. п. лежит на предпозвоночной фасции, прилегая к позвоночному столбу по средней линии или справа от нее, между нисходящей аортой и непарной веной. Позади Г. п. находятся начальные отделы правых межреберных артерий. Кпереди от Г. п. лежит пищевод. На уровне Th6-7 позвонков Г. п. начинает отклоняться влево, проходит позади дуги аорты и сзади от пищевода. На уровне Th2-3 позвонков Г. п. выходит из-под левого края пищевода и поднимается вверх по передней поверхности длинной мышцы шеи и позади левых подключичной артерии, общей сонной артерии и блуждающего нерва. Справа Г. п. соприкасается с пищеводом и левым возвратным нервом, слева — с левой медиастинальной плеврой. В области шеи, латеральнее левой общей сонной артерии и внутренней яремной вены, Г. п. (шейный отдел) изгибается в виде дуги, позади к-рой находятся левые позвоночные артерия и вена. Верхний край дуги находится на 3—5 см выше ключицы. У людей долихоморфного телосложения дуга Г. п. имеет высокое положение, брахиморфного — низкое. Обогнув купол плевры, Г. п. впадает в угол слияния левых подключичной и внутренней яремной вен. Иногда Г. п. впадает в конечную часть внутренней яремной или подключичной вены.
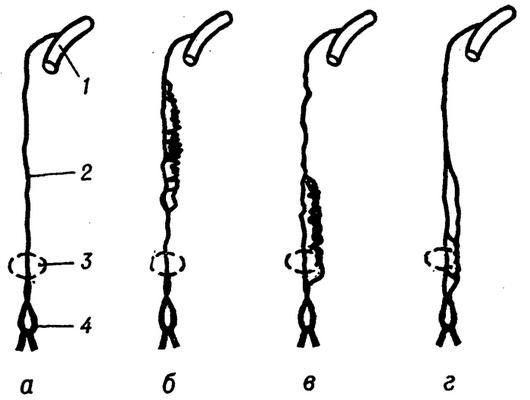
Рис. 1. Схема некоторых вариантов изменчивости грудной части грудного протока: а — один ствол; б—г дополнительный, левосторонний проток на разных участках; 1 — вена; 2 — грудная часть протока; 3 — область аортального отверстия в диафрагме; 4 — млечная цистерна.
Отмечена индивидуальная изменчивость Г. п. В грудном (рис. 1) отделе в 60% случаев он представлен одним стволом, в 37%, наряду с главным правосторонним, имеется левосторонний ствол, в 3% случаев описаны дополнительные коллатерали Г. п., в т. ч. и транс диафрагмальные притоки, несущие лимфу из органов верхнего этажа брюшной полости, минуя начало Г. п. Кроме того, в грудной отдел Г. п. впадают выносящие сосуды пристеночных и висцеральных лимф, узлов грудной полости. Постоянно существующие связи с правым грудным протоком (ductus lymphaticus dexter) и другими крупными сосудами и лимф, узлами в области средостения позволяют компенсировать отток лимфы от нижней половины тела человека в случаях непроходимости Г. п. при патологии, а также при его перевязке в случае повреждения.
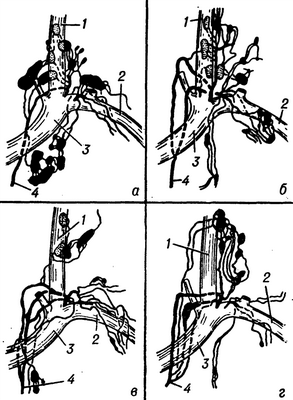
Рис. 2. Схема некоторых вариантов изменчивости шейной части грудного протока: а — один ствол; б — два ствола; в — три ствола; г — четыре ствола; 1 — у. jugularis int.; 2 — v. subclavia sin.; 3 — v. brachiocephalica sin.; 4 — ductus thoracicus.
В шейном отделе Г. п. в 27% случаев представлен одним стволом, в 50%—двумя, в остальных случаях тремя-четырьмя (рис. 2). В ряде случаев Г. п. перед впадением в вену ампуловидно расширен. В шейный отдел Г. п. обычно впадают левый яремный лимф, ствол (truncus jugularis sinister — PNA, BNA, JNA), собирающий лимфу от левой половины головы и шеи, и левый подключичный лимф, ствол (truncus subclavius sinister — PNA, BNA, JNA), несущий лимфу от левой верхней конечности.
К аномалиям относятся полное удвоение Г. п. с раздельным впадением в правый и левый венозный угол, замещение протока сплетением лимф, сосудов, впадение в правый венозный угол, истончение стенок.
Кровоснабжение Грудного протока осуществляется ветвями правой поясничной, мышечно-диафрагмальных, задних межреберных артерий, правой бронхиальной артерии. Шейный отдел Г. п. получает ветви из пищеводных артерий, левой позвоночной и нижней щитовидной артерий. Вступившие в стенку Г. п. артериальные ветви образуют в его наружной оболочке артериальное сплетение. Выходящие из него артериолы ветвятся на капилляры, формирующие в наружной и средней оболочках единую капиллярную сеть. Внутриорганные вены образуют в стенке Г. п. сплетение. Внеорганные его вены не изучены.
Иннервация. Г. п. иннервируется ветвями симпатических стволов, блуждающих и межреберных нервов. Нервные стволики образуют в наружной оболочке поверхностное и глубокое сплетения. От мелкопетлистого внутримышечного сплетения ответвляются безмякотные эфферентные и чувствительные волокна. Субэндотелиальное сплетение состоит из безмякотных нервных волокон и единичных нервных клеток. В стенке Г. п. описаны различного типа нервные окончания.
Рентгеноанатомия
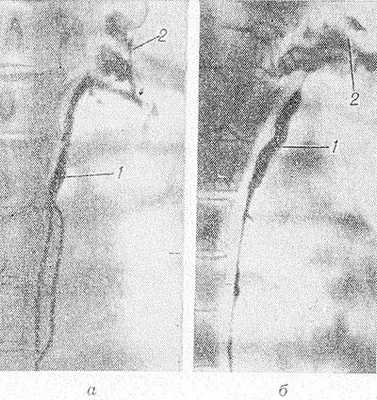
Рис. 3. Томограммы грудного протока (а— прямая, б — боковая проекции): грудной проток (1) на уровне Т4—Т5 делится на два ствола, видна группа надключичных лимфатических узлов (2).
В норме Грудной проток рентгенологически не определяется. Для выявления его необходимо контрастирование специальными веществами — сверхжидким йодолиполом, миодилом.
Методика лимфографии Г. п.: на одной или обеих стопах обнажают лимфатические сосуды и вводят в них специальные канюли. Контрастное вещество в количестве 8—10 мл (на одну конечность) вводят в сосуд с помощью специального прибора — перфузора, обеспечивающего непрерывное поступление контрастного вещества со скоростью 1 мл за 8—10 мин. (А. Ф. Цыб и соавт., 1974). В большинстве случаев через 1 час различными методами (рентгенография, рентгенотелевидение, рентгенокинематография и др.) можно наблюдать четкое изображение Г. п., обычно в виде одного ствола. Над диафрагмой выявляются множественные лимф. протоки, которые выше также сливаются в один ствол. Два ствола Г. п. наблюдаются реже. Как правило, контрастированный проток поднимается в направлении левого бокового края позвоночника и выявляется на косых и боковых рентгенограммах и томограммах (рис. 3) рядом с костными образованиями. Дуга протока определяется слева на уровне второго межреберного промежутка. Форма дуги может быть различной — вытянутой или округлой. Иногда дуга и окончание протока представлены двумя-тремя стволами. Нередко видны и прилежащие к нему лимф. узлы.
Гистология
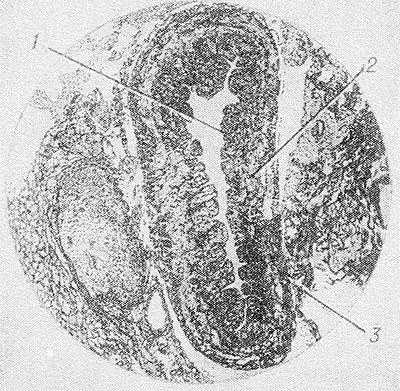
Рис. 4. Микропрепарат грудного протока: 1 — внутренняя оболочка; 2—средняя оболочка; 3 — наружная оболочка.
Стенка Г. п. состоит из внутренней, средней и наружной оболочек (рис. 4). Внутренняя оболочка (tunica intima) представлена эндотелием и субэндотелиальным слоем, состоящим из коллагеновых, эластических волокон, а также отдельных гладкомышечных клеток и их пучков. Внутренняя оболочка, толщина к-рой у человека, поданным В. А. Кудряшовой (1975), составляет 11—12,4 мкм, образует 7—9 клапанов; один из них находится в устье Г. п. и препятствует забрасыванию крови из вены в проток. В основе створок клапанов лежат соединительнотканные волокна и гладкомышечные клетки. На границе внутренней и средней оболочек имеется внутренняя эластическая мембрана. Средняя оболочка (tunica media) толщиной 49—129 мкм состоит из рыхлой волокнистой соединительной ткани, а также пучков гладкомышечных клеток, отделенных друг от друга коллагеновыми и эластическими волокнами. Мышечные пучки образуют в средней оболочке Г. п. два слоя: внутренний продольный и наружный циркулярный. Толщина этих слоев не на всех уровнях Г. п. выражена одинаково. Наибольшей толщины мышечные слои достигают в области млечной цистерны. Они утолщены также в местах образования клапанов. Средняя оболочка Г. п. без видимой границы переходит в наружную (tunica adventitia), толщиной 128—186 мкм, к-рая состоит из рыхлой соединительной ткани, богатой жировыми клетками, и отдельных пучков гладкомышечных клеток.
Физиология
Собирая лимфу из указанных анатомических областей, Грудной проток обеспечивает продвижение ее в вены. Этому способствует ряд факторов: разница давления плазмы (в мелких лимф, сосудах давление в пределах 8—10 мм рт. ст., а в Г. п., как и в крупных венах, оно ниже атмосферного), насосная функция грудной клетки, ритмические сокращения ножек диафрагмы и др. Наличие клапанов в месте впадения Г. п. в яремную вену препятствует забрасыванию в него крови.
Патология
Воспалительные заболевания Г. п. встречаются редко. Известны случаи туберкулеза протока при генерализации инфекции или прорыве в проток казеозно-некротических масс из лимф. узла. Хронический продуктивный воспалительный процесс в Г. п. возникает и при филяриатозах (см.). Заболевание характеризуется появлением лимфы в моче — хилурией (см.), хилезными поносами, скоплением лимфы в плевральной полости — хилотораксом (см.) и в брюшной полости — хилоперитонеумом.
Опухоли. Доброкачественные опухоли — лимфангиомы, или хилангиомы. Клинически лимфангиомы проявляются в основном хилореей. Злокачественные опухоли бывают первичными и метастатическими. К первичным опухолям относится лимфангиоэндотелиома, к-рая быстро растет и рано метастазирует. Метастатические опухоли протока известны при раке желудка, толстой кишки, матки, яичников.
Кисты Г. п. чаще имеют посттравматическое происхождение. Иногда наблюдаются идиопатические кисты; они известны даже у новорожденных детей и, возможно, связаны с патологическим истончением стенки протока. Обычно кисты имеют овальную форму и тонкую стенку, рыхло связанную с окружающими тканями. Диаметр кист варьирует от 3 до 15 см. Диагностика кист при отсутствии хилоторакса представляет значительные трудности. Основное значение для диагноза имеет контрастное рентгенол, исследование, которое позволяет выявить дополнительную тень соответственно проекции протока. Изредка кисты бывают множественными. Разрывы таких кист могут сопровождаться возникновением двустороннего хилоторакса, а также хилоторакса и хилоперитонеума.
Повреждения Г. п. происходят при закрытой травме и проникающих ранениях грудной клетки. С развитием торакальной хирургии участились операционные травмы Г. п.; практически эта опасность возникает при любой сложной операции на органах грудной полости. Повреждения шейного отдела протока возможны во время симпатэктомии, струмэктомии, удаления лимф, узлов надключичной области, эндартериэктомии из левой общей сонной артерии. Основным клиническим проявлением нарушения целости Г. п. является хилорея, хилоторакс (см.) и их последствия.
Нарушения проходимости протока развиваются при сдавлении его шейного отдела, чаще всего метастазами рака в лимф, узлы, а также вследствие тромбоза вен и венозной гипертензии (в бассейне подключичной и верхней полой вен). Клинически это проявляется хилотораксом, хилоперитонеумом, отечностью левой половины лица и левой руки. В. И. Францев (1963) описал возникновение хилоторакса после наложения каво-пульмонального анастомоза, связывая его с развитием гипертензии в верхней полой вене.
Лечение
Показаниями к операциям на Грудном протоке являются его повреждения, опухоли, кисты, реже деструктивный панкреатит, при к-ром шейную часть протока дренируют с целью выведения лимфы и дезинтоксикации. Оперативный доступ к шейной части — разрез, параллельный верхнему краю левой ключицы. При закрытых повреждениях этого отдела, а также при различных ранениях тампонируют проток (марлей, фибринной пленкой, мышечным лоскутом) или (лучше) перевязывают оба конца. Доступ к грудной части протока— боковая торакотомия (см.) на стороне поражения. Вскрывают медиастинальную плевру и выделяют проток. Для лучшего выявления главного ствола, его ветвей и места повреждения целесообразно пользоваться «биологическим контрастированием» лимфы. С этой целью за 2—3 часа до операции следует накормить больного смесью Огнева: 400 мл молока, 2 яйца, 100 г сахара, 50 мл этилового спирта, 50 г сливочного масла, 10 г поваренной соли; для большей наглядности к смеси Огнева рекомендуют добавлять липофильную краску, напр, синьку Эванса. После приема такой смеси хилус приобретает синеватый опалесцирующий оттенок, что видно во время операции.
Опухоли и кисты Г. п. иссекают и перевязывают оба конца протока вместе с крупными коллатеральными лимф, сосудами. Отток лимфы после такой резекции протока восстанавливается по лимфовенозным анастомозам и коллатеральным лимфатическим путям средостения. При обнаружении повреждения протока во время операции показана перевязка обоих его концов, т. к. при перевязке только одного, нижнего, конца возможен ток лимфы по коллатералям с ретроградным истечением ее через верхний конец.
В случаях неполного пересечения Г. п. дефект можно ушить тонкими нитями на атравматических иглах. Ходж и Бриджиз (G. В. Hodge, H. Bridges, 1948), А. С. Лурье (1961) и др. в случае перерезки протока имплантировали его в прилежащую вену, т. е. накладывали лимфовенозный анастомоз. Для наложения такого анастомоза лучшие перспективы открывает микрохирургическая техника шва.
Все внутриплевральные операции на Грудном протоке во избежание скопления лимфы в средостении заканчивают без ушивания медиастинальной плевры. В полость плевры вводят два дренажа, которые соединяют с системой для постоянного отсасывания (см. Аспирационное дренирование). Удаление дренажей производят после полного прекращения выделения жидкости.
Библиография: Атлас грудной хирургии, под ред. Б. В. Петровского, т. 1, М., 1971; Ващенко К. А. О хирургической анатомии грудного лимфатического протока, Хирургия, № 4, с. 123, 1968, библиогр.; Жданов Д. А. Общая анатомия и физиология лимфатической системы, Л., 1952, библиогр.; Кудряшова В. А. Макро-микроскопическое строение стенки грудного протока человека, Арх. анат., гистол, и эмбриол., т. 66, № 3, с. 89, 1974; Лурье А. С. О пересадке поврежденного грудного протока в вену при онкологических операциях на шее, Вопр, онкол., т. 7, № 6, с. 9, 1961, библиогр.; Малюк В.П. Источники артериального кровоснабжения грудного протока человека, Арх. анат., гистол, и эмбриол., т. 41, № 9, с. 103, 1961; Перельман М. И. и Юсупов И. А. Вопросы хирургической патологии грудного протока, Клин, мед., т. 54, № 6, с. 26, 1976; Реконструктивная хирургия, под ред. Б. В. Петровского, с. 208, М., 1971; Соколовский Б. Ф. Кисты грудного протока, Вестн, хир., т. 84, № 1, с. 123, 1960, библиогр.; Vogler H. и Ott J. К вопросу рентгенографии искусственно-контрастированного грудного протока, Радиол, диагн., т. 11, № 4, с. 538, 1970, библиогр.; Францев В. И. К патогенезу послеоперационного и спонтанного хилоторакса, Грудн. хир., № 6, с. 115, 1963; Цыб А. Ф., Чепеленко Г. В. и Нестайко О. В. Рентгеноанатомия грудного протока, Вестн, рентгенол, и радиол., Ne 1, с. 60, 1975, библиогр.; Jacobssоn S.-I. Clinical anatomy and pathology of the thoracic duct, Stockholm, 1972, bibliogr.; WirthW. a. Fromnailold H. The normal thoracic duct and its variations, в кн.: Progr. in lymphology, ed. by M. Viamonte a. o., p. 186, Stuttgart, 1970, bibliogr.
Топографию яремного лимфатического мешка (ЯЛМ) все исследователи независимо от их точки зрения на происхождение ЯЛМ описывают примерно одинаково - позади и сбоку от прекардинальной вены, с которой образует соединение, снабженное клапаном уже в конце 6-й - начале 7-й нед эмбриогенеза человека (Sabin F.,1909; Kampmeier O.,1969). Постоянная локализация лимфовенозного соединения шеи, как и главных лимфатических коллекторов, не объясняется с позиций мезенхимной концепции происхождения лимфатической системы. Это послужило причиной различных ее модификаций, когда ЯЛМ мог иметь венозное происхождение, в отличие от остальных лимфатических коллекторов, вплоть до спекуляций о венозном происхождении их полостей и мезенхимном источнике развития эндотелиальной выстилки. S.Putte (1975) считал, что сначала в разных областях возникают изолированные лимфатические мешки и сплетения, которые затем объединяются. Согласно S..Putte, ЯЛМ имеет конструкцию сплетения. Мной проведено исследование на серийных гистологических срезах 20 зародышей человека 4-8 нед толщиной 5-7 мкм в трех основных плоскостях, окрашенных гематоксилином и эозином, пикрофуксином по Ван Гизон.
Правая и левая прекардинальные вены окружены множеством мелких притоков у эмбрионов 4,5-5 нед, особенно на латеральной стороне, на уровне бурно растущих почек верхних конечностей. Позднее из латерального сплетения мелких вен дифференцируется подключичная вена, которая подразделяет прекардинальную вену на внутреннюю яремную (ВЯВ) и верхнюю полую вены. С медиальной стороны от них находятся трахея и пищевод. На 6-й нед начинает удлиняться шея с разгибанием головы, что становится особенно заметным на 7-й нед. В эти сроки интенсивно растущие зачатки тимуса «опускаются» от основания черепа к верхней апертуре грудной клетки, причем вентромедиальнее ВЯВ. Сама вена лежит в топографическом треугольнике: внутренние органы с медиальной стороны отсечены общей сонной артерией и блуждающим нервом, с вентролатеральной и дорсальной сторон ВЯВ окружена мышцами шеи. ЯЛМ формируются у эмбрионов человека 10-17 мм длины (5,5-6,5 нед) около прекардинальных вен в результате неравномерного расширения их многочисленных мелких притоков и выключения из кровотока части венозных синусов в виде лимфатических щелей с эндотелиальной выстилкой. Такие щели сливаются в правый и левый ЯЛМ в процессе истончения и разрыва межщелевых перегородок. У эмбриона 14 мм длины ЯЛМ прилежит к латеральной половине дорсальной стенки и латеральному краю ВЯВ. На ее дорсомедиальной стороне формируется симпатический ствол. Таким образом, уже на стадии закладки венозного угла шеи и морфогенеза ЯЛМ топография ВЯВ имеет дефинитивные черты. В дальнейшем, у плодов ЯЛМ замещаются внутренними яремными лимфатическими узлами и стволами, терминальным отрезком грудного протока. Я согласен с S.Putte в том, что: 1) венозные сплетения около прекардинальных вен предшествуют возникновению паратрахеальных лимфатических сплетений и ЯЛМ; 2) ЯЛМ на стадии закладки имеют конструкцию лимфатических сплетений. S..Putte предполагал на этом основании, что лимфатическое русло имеет венозное происхождение. Я уже объяснил ранее, как происходит выключение из кровотока части вен (Петренко В.М., 1998, 2003). Возникает вопрос: почему только дорсолатеральные лимфатические сплетения шеи, примыкающие к ВЯВ, превращаются в лимфатические мешки? Можно предположить, что сократительная активность мышц шеи способствует канализации ЯЛМ, в отличие от паратрахеальных сплетений. ЯЛМ не имеет собственной, внутристеночной мышцы и, с моей точки зрения, функционирует как эмбриональный пропульсор, который использует энергию окружающих скелетных мышц шеи для организации лимфооттока в вены шеи. Движения ЯЛМ под влиянием окружающих мышц подобны движениям цистерны в начале грудного протока при дыхательных экскурсиях диафрагмы. Поэтому Г.М. Иосифов (1914) обозначил цистерну протока как пассивное лимфатическое сердце. В филогенезе первые пропульсоры, причем именно в области будущей шеи, появляются у круглоротых и хрящевых рыб, у них только начинается дифференциация венозного русла и появляются предшественники истинных лимфатических сосудов. Эта стадия эволюции лимфатической системы соответствует началу ее развития в эмбриогенезе человека, когда в области шеи происходит закладка ЯЛМ. Можно также предположить, что результирующий вектор тяги вентролатеральных и дорсальных мышц шеи детерминирует локализацию лимфовенозного соединения шеи, начиная со стадии закладки ЯЛМ. Дорсолатеральный сегмент ВЯВ находится в угловом промежутке между плоскостями грудинно-ключично-сосцевидной и лестничной мышцами, а следовательно (почти) не испытывает давления при их сокращении / расслаблении.
Сравнительно устойчивое положение ЯЛМ и его соединения с венами отражает анатомотопографические взаимоотношения органов шеи в эмбриогенезе человека, во многом соответствующие их дефинитивному состоянию. Особое место в морфогенезе ЯЛМ занимает интенсивный рост закладок верхних конечностей, мышц шеи и тимуса.
Читайте также:
- Артроз суставов: леничение, симптомы, причины и профилактика
- Частота опухолей органов у детей. Опухоли органов грудной клетки у ребенка
- Желудочковая биоуправляемая электрокардиостимуляция. Режим demand ЭКС
- Синдром Фовилля (Foville)
- Антитела ( Ат ). Строение антител. Структура антител. Функционирование антител. Как устроено антитело?
