Репелленты при кожных болезнях. Барьерные лекарственные средства
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
В статье приводятся современные сведения о формировании барьерных свойств эпидермальных структур кожи. Раскрываются патогенетические особенности нарушений барьерных свойств кожи при воспалительных и десквамативных дерматозах в детском возрасте.
Disturbance of skin barrier properties as factor of chronization of dermatoses in children, treatment: theoretical and practical innovations
Current article describes up-to-date information about barrier properties forming in epidermal structures of the skin. Description of pathogenetic qualities of disturbance in skin barrier properties during inflammatory and desquamative dermatoses in children is given.
Кожа человека выполняет множество жизненно важных функций. Это основной орган, осуществляющий контакт с внешней средой, обеспечивающий барьер, что позволяет организму сохранять гомеостаз и предотвратить обезвоживание. Существенную роль в формировании барьерных свойств кожи играет эпидермальный барьер — это собирательное понятие, характеризующее роговой слой, его состояние и происходящие в нем процессы кератинизации, синтез высокоспециализированных межклеточных липидов, образование натурального увлажняющего фактора, десквамацию [1]. Осуществление барьерных функций кожи в целом обеспечивается посредством многочисленных кооперативных взаимодействий различных структур эпидермиса, дермы, клеток местного иммунологического надзора, экскреторной функцией сальных и потовых желез и т. д. [2].
Особое патогенетическое значение имеет понимание дермальных изменений, происходящих в эпидермисе пациентов, страдающих дерматозами, в основе которых лежат воспалительные и десквамативные процессы, происходящие в эпидермисе.
В еще большей степени это касается детей первых лет жизни, имеющих ряд анатомо-конституциональных особенностей строения кожи, обусловливающих незрелость эпидермальных и дермальных барьерных структур. Среди них: нежный и рыхлый эпидермис, тонкая базальная мембрана, нейтральная или слабощелочная рН, повышенная проницаемость эндотелия сосудов, высокая резорбционная способность жирорастворимых веществ и ряд других.
Как упоминалось выше, одно из ведущих мест среди защитных барьеров эпидермиса в настоящее время отводят роговому слою. Ранее считалось, что роговой слой это отмершие участки кожи с аморфной массой кератиновых нитей, исследования последних лет показали, что это живая, динамичная и очень активная ткань с выраженным метаболизмом липидов в межкератиноцитарном матриксе, таких как церамиды, гликосилкерамиды, свободные сфингоидные основания, холестерол и его сульфаты, жирные кислоты, фосфолипиды, некоторые другие, а также упорядоченной структурой и движением кератиноцитов 3. Известно, что процессы естественной кератинизации в эпителиальных клетках обеспечиваются белком филаггрином, осуществляющим агрегацию филаментов — компонентов цитоскелета. В результате этого процесса формируются постклеточные белковые структуры, в которых отсутствуют органеллы — корнеоциты. «Мертвыми» эти клетки считают потому, что они не синтезируют белки и не реагируют на влияния различных сигнальных молекул [2].
Двойные ковалентные связи жирных кислот прочно, подобно «цементу», скрепляют липидные пласты между собой и с роговыми «кирпичиками» корнеоцитов, образуя подобие кирпичной кладки, тем самым обеспечивается механическая прочность рогового слоя. Важно отметить также тот факт, что высокоспециализированные липиды рогового слоя образуют биполярную прослойку между кератиноцитами таким образом, что более полярная гидрофильная фаза располагается между двумя кристаллическими, наподобие «сэндвича» по A. Rawlings, 2003 [2].
Указанная структура позволяет препятствовать трансэпидермальной потере воды, проникновению через кожу водорастворимых веществ и обеспечивает целостность кожи.
В обеспечении надежности эпидермального барьера также важное значение имеет наличие на его поверхности водно-липидной мантии Маркионини, являющейся смесью кожного сала, секрета эккринных потовых желез и церамидов рогового слоя [3, 6]. Эмульгирование кожного сала происходит благодаря гидрофильным высокомолекулярным спиртам и холестеролу, входящему в его состав. При этом на поверхности кожного покрова создается слабокислый рН (4,5-5,5). Благодаря такому составу данная водно-липидная эмульсионная пленка выполняет ряд уникальных функций:
- поддержание нормальной эластичности кожи, препятствие ее пересушиванию;
- поддержание постоянной температуры тела (за счет изменений ее физического состава);
- нейтрализация щелочей органическими жирными кислотами, поддержание постоянного слабокислого pH;
- подавление размножения микроорганизмов благодаря свободным низшим жирным кислотам кожного сала;
- один из путей экскреции продуктов метаболизма, лекарственных и токсических веществ.
Таким образом, сложная динамическая система межклеточных взаимодействий и межкератиноцитарного обмена липидов создает стойкий, малопроницаемый эпидермальный барьер, надежно защищающий от воздействия факторов внешней среды, а также предотвращающий от трансэпидермальной потери влаги.
Одним из частых клинических проявлений многих кожных болезней, например, таких как ихтиоз, кератодермии, атопический дерматит, экзема, псориаз, хейлит, болезнь Дарье, болезнь Девержи и др., является сухость кожи следствие изменения соотношения и содержания липидов [4].
Сухая кожа — это истонченная кожа с шелушением и/или мелкими трещинами и субъективным ощущением стягивания. Причинами сухости, как правило, являются дегидратация рогового слоя и нарушения кератинизации, свидетельствующие о нарушении барьерной функции кожи. В некоторых случаях нарушение проницаемости является первичным патогенетическим звеном, влекущим за собой комплекс патологических изменений, в других случаях нарушение барьерной функции рогового слоя ухудшает течение уже существующих заболеваний [6]. В последнее время все большее число исследователей доказывают, что во многих случаях в развитии воспаления и гиперплазии эпидермиса существенную роль играют цитокины, вырабатываемые самими кератиноцитами при повреждении эпидермального барьера. Установлено, что сразу после повреждения рогового слоя повышается концентрация интерлейкина-1α (ИЛ-1α), фактора некроза опухоли α, которые действуют по сигнальному механизму: каждая сигнальная молекула способна стимулировать выработку других сигнальных молекул с различными функциями, которые в свою очередь побуждают клетки к секреции новых биологически активных веществ [6, 7].
При повреждении рогового слоя в эпидермисе разворачивается ответная реакция, направленная на восстановление его липидных структур. Если восстановление происходит недостаточно быстро, то клетки эпидермиса подвергаются массированной атаке со стороны микроорганизмов и токсинов, в процессе которой поврежденные кератиноциты начинают секретировать цитокины, запускающие воспалительную реакцию. Воспаление всегда сопровождается продукцией свободных радикалов, что приводит к дальнейшему повреждению клеток эпидермиса, которые уже не могут обеспечить полное восстановление липидного барьера, поэтому эпидермис постепенно обезвоживается. Кожа становится сухой, шелушащейся и воспаленной.
Наиболее распространенным заболеванием кожи в детской дерматологической практике является атопический дерматит [8]. Нарушения барьерных свойств кожи при этом дерматозе связаны со сложными и многогранными процессами, протекающими в эпидермисе. Так, в роговом слое отмечается снижение уровня свободных церамидов, в частности С1?линолеата, который играет важную роль в формировании билипидного слоя и которому принадлежит особо важная роль в защитном механизме при повторном раздражении. Именно с его недостатком связывают предрасположенность кожи к экзематозным реакциям под воздействием различных ирритантов. Отмечается повышение активности фермента сфингомиелиназы, свободных жирных кислот, сфингозина, фосфатидилхолина, на которые в значительной степени влияют рН и осмотическое давление [2, 6]. Все это в значительной степени изменяет нормальную регуляцию метаболизма липидов, гидролитическую деградацию корнеодесмосом при терминальном разъединении роговых клеток и высвобождение кератиноцитами ИЛ-1α, активирующего ответ эпидермиса на внешние раздражители. Кроме того, имеются данные о дефиците филаггрина у пациентов, страдающих атопическим дерматитом. В процессе деградации этого белка образуется натуральный увлажняющий фактор (natural moisturizing factor, NMF): высвобождающиеся аминокислоты, которые в норме создают высокое осмотическое давление в клетке, осуществляют приток воды в корнеоциты по градиенту концентраций, делая роговые чешуйки упругими. В свою очередь, обезвоживание эпидермиса стимулирует выброс провоспалительных цитокинов, способствуя формированию кожных патологических реакций [4, 7].
Указанные изменения приводят к формированию атопического ксероза, снижению барьерных функций кожи, проявляющемуся агрессией различных микробных агентов, играющих важную роль в хронизации воспаления, носящего атопический или неатопический характер. Сегодня общеизвестным является тот факт, что практически в 100% случаев кожный покров больных атопическим дерматитом колонизирован штаммами золотистого стафилококка, он высеивается как с пораженных, так и с непораженных участков кожи. При этом клинические признаки инфекционного процесса на коже нередко отсутствуют [8, 9].
Колонизация золотистого стафилококка возможна вследствие наличия на клеточной стенке бактерий — рецепторов-адгезинов к ламинину и фибронектину эпидермиса, формирования фолликулярных структур между клетками золотистого стафилококка и корнеоцитами, что приводит к формированию бактериальной биопленки, участвующей в адгезии стафилококка [10]. Также колонизация стафилококка возможна вследствие снижения экспрессии факторов врожденного иммунитета в коже, в частности антимикробных пептидов — дефензинов и кателицидина.
Кроме стафилококка, при атопическом дерматите высеваются и другие микроорганизмы, среди которых наиболее часто встречается стрептококк. Зачастую в очагах поражения обнаруживается микст-инфекция.
Нарушения барьерных свойств кожи также наблюдаются и у пациентов с псориазом. Эти изменения происходят вследствие снижения концентрации свободных и связанных церамидов: C3b, C5 и церамидов В соответственно. Вместе с тем отмечается снижение уровня экспрессии свободных церамидов — C2, C3a и C4; кислот — гидроксикислот, жирных кислот (олеатов и линолеатов, ковалентно связанных с корнеоцитами). Совокупность указанных трансформаций приводит к изменениям сцепления корнеоцитов и нарушениям десквамации.
Особенностями нарушений барьерных свойств кожи при ихтиозе являются снижения уровней свободных церамидов: C3b, C5 и уровня сфингозина, на фоне повышенной концентрации свободных церамидов — C2, C3a и C4. Результатом этих процессов является формирование ретенционного гиперкератоза [3].
Кроме того, нарушения эпидермального барьера у детей, страдающих воспалительными дерматозами, вызывают многочисленные внешние воздействия, приводящие к повреждению, в том числе этому способствуют расчесы, травмы, различные аллергены и ирританты, вторичная инфекция, а зачастую и неправильный уход за кожей [1, 4]. Нарушают, в известной степени, барьерные свойства кожи и беспорядочное использование больными наружных лечебных и косметических средств. В особенности это касается так часто применяемых глюкокортикостероидных лекарственных препаратов, которые вызывают изменения липидного барьера кожи.
Целью наружной терапии воспалительных и десквамативных дерматозов и состояний кожи в детском возрасте являются купирование воспаления и зуда путем назначения противовоспалительных средств, восстановление водно-липидного слоя и повышение барьерной функции кожи посредством использования смягчающих питательных средств. Важен также и последующий адекватный уход за кожей путем назначения очищающих и увлажняющих средств, позволяющих адекватно реабилитировать пациентов и пролонгировать ремиссию [11].
Для проведения рациональной наружной терапии необходимо оценивать характер и локализацию морфологических изменений кожи, выбрать лекарственное средство, учитывая механизмы его действия, подобрать адекватную лекарственную форму в зависимости от активности воспалительного процесса, выраженности клинической симптоматики нарушений барьерных свойств кожи.
В качестве современных средств увлажнения кожи используют различные лечебные косметические формы. Одни из них — средства непосредственного увлажнения — хумиктанты. В их основе натуральные увлажняющие факторы (пирролидонкарболовая кислота, мочевина, производные молочной кислоты), липосомы, полиолы, полисахариды, макромолекулы (хондроитинсульфаты, полисахариды, коллаген, эластин, др.). Средства, препятствующие потере воды, в состав которых входят вещества, образующие пленку, — воски, вазелин, парафин, пергидросквален, ланолин, многоатомные спирты, жирные кислоты, триглицериды, силиконы; либо препараты с кератолитическим действием [2].
Особое внимание в детской дерматологической практике отводится средствам на основе декспантенола, который в клетках кожи быстро превращается в пантотеновую кислоту, являющуюся составной частью коэнзима А и играет важную роль как в формировании, так и в заживлении поврежденного кожного покрова; стимулирует регенерацию кожи, нормализует клеточный метаболизм. Этим требованиям отвечает, например, крем Бепантен, являющийся важной составляющей комплексной наружной терапии ряда воспалительных и десквамативных заболеваний кожи с хроническим течением в детском возрасте. Вместе с тем фармакологические свойства препаратов для наружного лечения на основе декспантенола важны не только как лечебные, но и как профилактические средства, например, при пеленочном дерматите. Декспантенол в виде мази Бепантен формирует защитный барьер против внешних раздражителей (моча, фекалии), а мазевая основа Бепантена, представленная ланолином и мягким белым парафином, предотвращает трансэпидермальную потерю воды [12].
Особенностью современных тенденций создания средств лечебной косметики является комбинация биосовместимых увлажнителей и пленкообразующих веществ, многие из них в своем составе содержат микроэлементы. Тем самым достигается наибольшая эффективность увлажнения и дополнительная модификация действия посредством включения тех или иных микроэлементов [13].
Тем не менее, если обратиться к динамике восстановления кожи, будет видно, что эффективное восстановление барьерной функции кожи наблюдается лишь при использовании смеси трех ключевых липидов (церамидов, холестерина и жирных кислот), взятых в эквимолярном соотношении [6].
Среди аллергологов, педиатров и дерматологов остро дискутируется вопрос о частоте использования воды для очищения как пораженной, так и здоровой кожи [2, 4, 8, 11]. В исследованиях C. Chiang и L. E. Eichenfield (2009) было продемонстрировано уменьшение гидратации рогового слоя у пациентов, страдающих атопическим дерматитом [2, 14]. Мытье кожи водой без последующего нанесения увлажняющих средств резко снижало параметры ее увлажненности, вместе с тем увлажнение без предшествующего очищения с помощью воды существенно увеличивало содержание воды в роговом слое [2, 14, 15].
Также установлено, что скорость восстановления структур кожи, обеспечивающих барьерную функцию, значительно замедляется при наложении окклюзионной повязки на область повреждения. Дело в том, что репаративные процессы инициируются при увеличении трансэпидермальной потери воды. При снижении скорости трансэпидермальной потери воды выработка высокоспециализированных липидов рогового слоя тормозится [2, 15]. Этот факт следует учитывать, например, при выборе памперса при пеленочном дерматите или при выборе повязок в процессе лечения травматических поражений или после хирургических манипуляций.
Несмотря на все косметологические инновации последних лет, важно помнить, что не все кремы, состоящие из вышеуказанных ингредиентов современной фармакокосметологии, могут одинаково применяться и хорошо переноситься всеми пациентами. Так, соотношение одних и тех же ингредиентов для пациентов детского возраста, назначенных в прогрессирующую стадию псориаза, может привести к ухудшению течения кожного патологического процесса, а примененного в стационарную стадию — к улучшению и ускорить разрешение поражений кожи. Аналогично назначение врачом эмолентов должно учитывать состояние кожного покрова у детей в различные стадии и возрастные фазы течения атопического дерматита, важно также учитывать и анатомическую область поражений при назначении того или иного средства.
Адекватное использование местного лечения с применением современных дерматологических технологий имеет высокую безопасность, обеспечивает стойкую ремиссию заболеваний, предупреждает их рецидивирование и значительно улучшает качество жизни маленьких пациентов и членов их семей.
Литература
- Аравийская Е. Р., Е. В. Соколовский, Соколов Г. Н. и соавт. Эритема лица, особенности диагностики и ухода за кожей // Клиническая дерматология и венерология. 2003. № 3. С. 69-73.
- Аравийская Е. Р., Соколовский Е. В. Барьерные свойства кожи и базовый уход: инновации в теории и практике // Вестник дерматологии и венерологии. 2010; 6; 135-139.
- Скрипкин Ю. К. Кожные и венерические болезни. Рук-во для врачей в 4-х т. Т. 3. М.: Медицина. 1995. С. 239-292.
- Суворова К. Н., Тогоева Л. Т., Гришко Т. Н. и соавт. Корнеотерапия при воспалительных и десквамативных дерматозах у детей // Вопросы современной педиатрии. 2005. Т. 4. № 6. С. 39-44.
- Kligman A. M. The biology of the stratum corneum. In: Montagna W., Lobitz M. C. The Epidermis. Jerusalem-New York: Academic press 1964; 387-433.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства. М.: ИД «Косметика и медицина», 2005. С. 9-37.
- Nickoloff B. J., Naidu Y. Perturbation of epidermal barrier function correlates with initiation of cytokine cascade in human skin // J. Am. Acad. Dermatol. 1994; 30 (4): 535-546.
- Намазова Л. С., Вознесенская Н. И., Сурков А. Г. Атопический дерматит // Лечащий Врач. 2006. № 4. С. 72-78.
- Мазитова Л. П. Роль микробной гиперсенсибилизации в развитии аллергодерматозов у детей // Вестник дерматологии и венерологии. 2007. № 2. С. 36-38.
- Leyden J. E., Marples R. R., Kligmann A. M. Stafhylococcus aureus in the lesion of atopic dermatitis // Br. J. Dermatol. 1974. Vol. 90. P. 525-530.
- Смирнова Г. И. Современные технологии местного лечения атопического дерматита у детей // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 75-82.
- Галлямова Ю. А. Пеленочный дерматит и травматизация кожи у детей // Лечащий Врач. 2013; 9; 24.
- Mao-Qiang M., Feingold C. R., Thornfeld C. R., Tlias P. M. Optimization of physiological lipid mixtures for barrier repair // J. Invest. Dermatol. 1996. Vol. 106. P.1096-1101.
- Chang C., Eichenfield L. E. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis // Pediatric Derm. 2009; 26: 3: 273-278.
- Grubauer G., Elias P. M., Feingold K. R. Transepidermal water loss: the signal for recovery of barrier structure and function // J. Lipid. Res. 1989; 30: 323-330.
Н. Н. Мурашкин, доктор медицинских наук, профессор
Барьерная терапия при аллергическом рините
В настоящее время установлен рост заболеваемости аллергическим ринитом (АР) среди населения, особенно детского. Это определяет проблему профилактики АР в разряд наиболее актуальных. Результатами многих исследований установлено, что АР в большинстве случаев является предвестником развития бронхиальной астмы, а значит и причиной инвалидности. Кроме того, доказано, что лечение АР является профилактической мерой по предупреждению возникновения аллергической бронхиальной астмы (ARIA, 2001).
При АР, обусловленном ингаляционными аллергенами, реализация развития клинических симптомов АР происходит при контакте человека (а именно его слизистой оболочки) с причинно значимым аллергеном. При этом в процесс вовлекается не только слизистая оболочка полости носа и околоносовых пазух, но и слуховых труб, среднего уха и слезного канала и склеры. При этом развиваются такие клинические симптомы как ринорея, приступы чихания, зуд крыльев носа и век, затруднение носового дыхания, слезотечение. АР существенно снижает качество жизни больного, а в некоторых случаях становится изнуряющим заболеванием.
Так как развитие АР генетически предопределено, то все усилия медиков направлены на снижение выраженности проявления его симптомов или предупреждение их развития. В настоящее время в арсенале врачей аллергологов имеется большой арсенал препаратов, как местного, так и системного действия. Однако большинство из них являются синтетическими веществами и имеют побочные эффекты, которые ограничивают сферу их применения.
В этой ситуации наиболее рациональным представляется создание механического барьера на пути контакта аллергенов со слизистой оболочкой полости носа для предупреждения развития заболевания. Таким свойством по данным исследователей обладает порошок целлюлозы, способный при контакте с жидкостями набухать, превращаясь в тонкий эластичный слой, препятствуя тем самым инициации высвобождения ингаляционными аллергенами вазоактивных веществ из тучных клеток. Такой порошок целлюлозы выпустили в виде препарата «Назаваль». Образуя тонкий слой на поверхности слизистой оболочки полости носа, препарат «Назаваль» может служить непреодолимым барьером для контакта ингаляционных аллергенов со слизистой оболочкой.
С целью определения эффективности и безопасности препарата «Назаваль» как профилактического средства у больных, страдающих круглогодичным АР, было выполнено настоящее исследование.
Материалы и методы. На основании разработанных критериев включения и исключения в исследовании приняли участие 43 пациента, страдающих круглогодичным АР. Возраст пациентов колебался от 2,5 до 57 лет (средний возраст составил - 31,8±1,3). В исследовании были включены 17 лиц мужского пола и 26 - женского.
К критериям включения отнесли: больных обоего пола, имеющих сенсибилизацию к ингаляционным аллергенам, преимущественно вызывающих симптоматику круглогодичного АР, возраст от 2,5 до 60 лет.
Критерии исключения пациентов были: больные младше 2,5 и старше 60 лет, получавших интраназальные препараты менее 1-го месяца до исследования, имеющих психологические или другие эмоциональные проблемы, которые могут ограничить способность пациента следовать требованиям протокола; наличие острых или обострений хронических инфекционных заболеваний; состояния, характеризующиеся высоким риском смертельного исхода, участвующих в другом клиническом исследовании.
Каждый пациент подписывал информированное согласие участника клинического исследования. Все пациенты предоставили заключение аллерголога, подтверждающее наличие круглогодичного АР на основании клинического аллергологического обследования, выполненного не ранее 1 года до включения в настоящее исследование.
Дизайн исследования. При обследовании пациентов осуществляли сбор анамнеза, общий и оториноларингологический осмотр. При этом учитывали оценку тяжести клиники АР на момент включения в исследование. Первая оценка в баллах пациентом была тяжести симптомов круглогодичного АР в момент обострения (при контакте с причинно значимыми аллергенами) до включения в исследование. Вторую оценку своего состояния в баллах больной фиксировал в дневнике наблюдений в ситуации контакта с причинно значимым аллергеном после предварительного введения в полость носа средства «Назаваль» и продолжал оценивать свое состояние после этого в течение ещё 10 дней, которые принимал препарат, в дневнике пациента. В дневнике пациенты оценивали свое состояние, особое внимание, уделяя состоянию полости носа, а также свои ощущения в полости носа при введении исследуемого средства. Состояние мукоцилиарного транспорта оценивали по результатам сахаринового теста.
Пациентам рекомендовали использовать средство «Назаваль» за 15-20 минут до предполагаемого контакта с причинно значимым аллергеном по 1 дозе в каждую половину носа. А после этого по 1 дозе в каждую половину носа 3-4 раза в сутки в течение 10 дней.
Во время использования препарата «Назаваль» пациенты заполняли дневник регистрации симптомов. Им предлагали использовать средство за 15-20 минут до контакта с причиннозначимым аллергеном и оценить в баллах степень проявления симптомов АР в период контакта. Предварительно они также оценивали свою симптоматику при контакте с аллергеном без использования исследуемого средства и других препаратов, действие которых направлено на снижение тяжести клиники АР.
Результаты. На основании данных анамнеза установлено, что продолжительность течения АР у обследованных пациентов была от 1 года до 35 лет (средняя длительность заболевания составила 10,6±0,9). У большинства пациентов (у 31, т.е. у 72,1 %) имела место поливалентная сенсибилизация, но почти у всех имела место сенсибилизация к бытовым аллергенам (у 38 больных или у 88,4 %). Лишь у 12 (27,9 %) пациентов четко установлена наследственная предрасположенность в отношении аллергии. Пациенты, включенные в исследование, преимущественно ранее принимали препараты не на постоянной основе, а лишь в приступный период. Среди препаратов, используемых в период приступов, они отдавали предпочтение топическим средствам: сосудосуживающие препараты принимали 21 (48,8 %) человек, ингаляционные кортикостероиды - 9 (20,9 %), препарат «Виброцил» - 3 (6,9 %), препарат «Аллергодил» - 4 (9,3 %), препараты кромоглиевой кислоты - 2 (4,6 %) пациента, остальные 5 (11,6 %) больных использовали системные средства: антигистаминные и/или кортикостероидные.
Клинические проявления АР у большинства больных были средней и высокой степени выраженности. В связи с этим ряд из них использовали ранее перечисленные препараты. Из них лишь у 5 (11,6 %) пациентов ингаляционные глюкокортикостероиды имели достаточно выраженную эффективность при длительном их использовании. Однако некоторые пациенты (3 или 6,9%) имели предубеждения в отношении препаратов этого ряда и весьма неохотно их использовали лишь при крайней необходимости.
При оториноларингологическом осмотре при включении в исследование учитывали и оценивали в баллах количество отделяемого в полости носа: 0 - отсутствуют, 1 - немного, 2 - умеренное, 3 - обильное. Отделяемое отсутствовало у 4 (9,3 %) человек, небольшое количество обнаружено у 9 (20,9 %) больных, у большинства пациентов (22 или 51,2 %) выявлено умеренное количество и лишь у 8 (18,6 %) отмечено обильное отделяемое. При этом среднее значение количества отделяемого соответствовало 1,8±0,6 баллов.
Вид отделяемого характеризовал наличие осложнений течения АР, так как наличие слизисто-гнойного отделяемого свидетельствует о присоединении инфекционного ринита (ИР). Прозрачное отделяемое имело место у 12 (27,9 %) пациентов, слизистое - у 27 (62,8 %), у 3 (6,9 %) обнаружен слизисто-гнойный характер отделяемого и лишь у одного больного отмечено гнойное отделяемое. Сухость перед началом исследования отметили лишь 5 (11,6 %) больных.
У большинства пациентов (у 40, т.е. у 93,0 %) имело место затруднение носового дыхания, обусловленное видимым отеком слизистой оболочки. Степень его оценивали в баллах от 0 до 10. Средняя степень в затруднения носового дыхания соответствовала 4,6±0,9 баллам. Обоняние было нарушено у большинства пациентов - у 41 (95,4 %) пациента, при этом у 29 (67,4 %) нарушение было периодическим, у 10 (23,3 %) - постоянным незначительным и лишь у 2 (4,7 %) - постоянным и значительным.
Исследователи учитывали также цвет слизистой оболочки полости носа, выделения, её цвет. При этом выявлено, что её бледность имела место - у 13 (30,2 %) человек, белёсая - у 14 (32,6 %), а синюшность - у 16 (37,2 %) больных. Наличие корок в полости носа отмечено лишь у 10 (23,3 %) пациентов. Заметное, но не приводящее к обструкции носового дыхания, искривление перегородки носа имело место у 11 (25,6 %) больных.
Пациенты были проинструктированы, что принимать средство им необходимо в период обострения течения АР. При наступлении приступа, чаще во время контакта с причинно значимым аллергенам, больных просили оценить влияние средства на их состояние по изменениям их ощущений, заполняя соответствующий дневник. По окончании приступа больным надлежало отзвонить врачу и прийти на прием с заполненным дневником. По окончании приема средства «Назаваль» пациенты приходили на заключительный (третий) визит и приносили свой дневник пациента.
Максимальный курс использования средства составил 30 дней у 7 (16,3 %) больных, 14-15 дней - у 12 (27,9 %) пациентов, 18 (41,9 %) человек принимали препарат 10 дней и лишь 6 (13,9 %) применяли «Назаваль» всего 2 дня.
Во время приема средства «Назаваль» пациенты характеризовали свои ощущения в полости носа как: обволакивание 5 (11,6 %) человек, смазывания слизистой оболочки или пленки - 2 (4,6 %), сухость и стягивание - 14 (32,6 %) больных, жжение - 4 (9,3 %) пациента, у 9 (20,9 %) не было никаких ощущений, другого рода не негативного характера ощущения - у 5 (11,6 %). При этом у 4 (9,3 %) пациентов были негативного рода ощущения - заложенность и отек слизистой оболочки полости носа.
Перед использованием препарата «Назаваль» (при включении в исследование) и при выходе из исследования у пациентов оценивали состояние мукоцилиарного транспорта на основании проведения сахаринового теста. В результате такой оценки среднее значение его скорости до начала исследования составило 27,1±3,1, что свидетельствовало о нарушении работы мукоциллиарного аппарата у большинства пациентов. А при выходе из исследования его среднее значение было - 19,9±0,5. Эти данные указывают на то, что состояние мукоцилиарного транспорта улучшилось значительно. Очевидно, это обусловлено снижением симптоматики АР у большинства наблюдаемых пациентов вследствие воздействия препарата.
При анализе изменения клинических проявлений АР во время обострения на фоне приема средства «Назаваль» пациенты отметили: улучшение 33 (76,7 %) человека, уменьшение количества выделений - 2 (4,7 %) больных, без изменений - 3 (7,0 %), ухудшение состояния - 5 (11,6 %) пациентов.
На основании дневника, заполняемого пациентами в процессе приема средства «Назоваль», установлено, что значительное улучшение носового дыхания у пациентов с положительной динамикой наблюдалось в среднем на 5,2±0,9 день. Это по оценке самих больных значительно быстрее, чем при использовании других топических препаратов, ранее ими использованных.
Ряд пациентов (13 или 30,2 %) использовали средство «Назавль» перед предстоящим неизбежным контактом с причинно-значимым аллергеном за один час. При этом их просили отмечать в дневнике пациента их ощущения и изменения в состоянии во время контакта с причинно-значимым аллергеном. Одновременно просили сравнить симптоматику АР при ранее происходивших контактах с этим аллергеном с той, которая имела место на фоне приема исследуемого средства. Все больные отметили снижение выраженности симптомов АР на 1-2 балла, что, по-видимому, стало возможным вследствие действия препарата.
Таким образом, использование средства защиты пациента от проникновения аллергена через слизистую оболочку полости носа «Назаваль» при наличии АР без применения других средств направленных на снижение симптоматики заболевания показало высокую его клиническую эффективность. Однако следует помнить, что некоторые пациенты имеют аллергию на целлюлозу, являющуюся основой исследуемого средства, не зная об этом, так как пробы на чувствительность к целлюлозе при обследовании больных, страдающих аллергией, специальное обследование, как правило, не включает.
Выводы.
1. Средство «Назаваль» на основании выявленной достаточно выраженной клинической эффективности (76,7 %) может быть рекомендовано в качестве профилактического в отношении развития обострений персистирующего АР.
2. Использование средства «Назаваль» сокращает продолжительность обострений персистирующего АР и снижает выраженность симптоматики заболевания.
3. Применение средства «Назаваль» может снизить прём препаратов синтетической природы системного и топического назначения при персистирующем АР, а также снизить себестоимость терапии обострений заболевания.
4. При назначении средства «Назаваль» следует тщательно выяснять анамнестические данные с целью предупреждения предписания его пациентам, имеющим аллергию к целлюлозе (бумажной пыли).
ЛИТЕРАТУРА
1. Aivazis V., Bourli E., Maratou E. et al. Study of mucocilliary clearance and peak nalas inspiratory flow rate in children with allergic rhinitis before and after therapy with natural cellulose powder //Nea pediatr Chronica 2005; 5:101-7.
2. Hauser R., Rice T.M., Krishna G.G. et al. The upper airway response to pollen is enhanced by exposure to combustion particulates:a pilot human experimental challenge study // Environmental Health Perspectives 2003; 111:472-477.
Персонифицированный подход к выбору средств базовой терапии при сухой коже
Т.А.Белоусова, М.В.Каиль-Горячкина
ФГБОУ ВО «Первый Московский государственный университет им. И.М.Сеченова» Минздрава России. 119991, Москва, ул. Трубецкая, 8, стр. 2
Представлены общее сведения о причинах возникновения и механизмах развитии сухости кожи. Описаны клинические проявления ксероза. Представлена классификация хумектантов и окклюзивов - основных компонентов базовых средств в терапии ксероза кожи. Сделан акцент на эмолентах как на наиболее эффективных лечебных средствах у пациентов с сухостью кожи. Разобран топический комбинированный препарат крем Декспан плюс, обладающий увлажняющим, смягчающим, регенерирующим и противовоспалительным действием. Приведен клинический пример использования препарата.
Ключевые слова: сухость кожи, ксероз, аллергодерматоз, атопический дерматит, кожный барьер, хумектанты, окклюзивы, эмоленты, декспантенол, аллатоин, масло карите.
I.M.Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation. 119991, Russian Federation, Moscow, ul. Trubetskaya, d. 8, str. 2
TA.Belousova, M.V.Kail-Goriachkina
For citation: Belousova T.A., Kail-Goriachkina M.V. Dermatology (Suppl. Consilium Medicum). 2017; 2
В последнее время отмечается увеличение числа пациентов, имеющих в той или иной степени выраженные проявления сухости кожи и нуждающихся в дерматокосметических средствах ухода за ней. Сухая кожа - тревожный знак нарушения барьерных свойств кожи, которые могут носить временный или длительный характер. Клинически это проявляется совокупностью симптомов. Больные с сухой кожей испытывают чувство стянутости, повышенную чувствительность и раздражительность к внешним воздействиям. Кожа становится вялой, теряет эластичность и тургор. В дальнейшем появляется целый комплекс болезненных симптомов: неровность поверхностного рельефа, шероховатость, морщинистость, шелушение, микротрещины, склонность к воспалению. При выраженном нарушении гидролипидного баланса развивается тяжелое патологическое состояние кожи - ксероз. Клиническими признаками ксероза являются появление на поверхности кожи большого количества мелких и крупных серовато-белых чешуек. Кожа становится тусклой, безжизненной, грубой и жесткой на ощупь. На этом фоне появляются участки покраснения и огрубения кожи. Периодически возникают поверхностные, а иногда и глубокие трещины. Эти изменения сопровождаются выраженными субъективными ощущениями: стягиванием, покалыванием, зудом и даже болью [1].
Сухость кожи провоцируется рядом экзогенных и эндогенных факторов. Сухость может быть обусловлена климатическими воздействиями (сухим и холодным ветром, сухостью воздуха, длительным пребыванием на солнце). Большое значение на состояние кожи оказывают влияние окружающей среды, в частности к сухости кожи приводит длительное нахождение в помещениях с центральным отоплением или воздушными кондиционерами. Шелушение может быть спровоцировано нерациональным уходом за кожей. Частое мытье с использованием жестких мочалок, некачественных моющих и косметических средств для демакияжа. Постоянный контакт кожи рук с водой, моющими средствами, стиральным порошком вызывают выраженный ксероз, проявляющийся огрубением, шероховатостью, трещинами кожи кистей. Сухость может быть опосредована лекарственными средствами: системными и топическими ретиноидами, спиртсодержащими растворами, болтушками, бензоил пероксидом, фототерапией, наружными и системными глюкокортикоидными препаратами. Она может определяться генетическими факторами и являться симптомом генодерматозов. Конституциональная сухость кожи, обусловленная врожденной недостаточностью эпидермального барьера, отмечается у больных атопическим и себорейным дерматитом, ихтиозом, фолликулярным кератозом, фолликулярным дискератозом Дарье и при ряде других генодерматозах. Сухость кожи неизбежно возникает в зрелом и пожилом возрасте как признак ниволюционных изменений.
Сухость кожи развивается в результате использования наружных и системных глюкокортикоидных препаратов. В ряде экспериментальных исследований установлено, что даже кратковременное (в течение 3 дней) нанесение на кожу сильного топического стероида сопровождается нарушением эпидермального барьера. Глюкокортикоиды путем торможения пролиферации и дифференцировки кератиноцитов угнетают образование липидов межклеточного матрикса рогового слоя и уменьшают прочность связей между корнеоцитами за счет снижения плотности и размеров корнеодесмосом.
Сухость кожи является симптомом целого ряда соматических заболеваний: гиповитаминозов, гипотиреоза, сахарного диабета, гепатита и цирроза печени, заболеваний почек [2, 3].
Обладая повышенной чувствительностью к внешним воздействиям, сухая кожа склонна к раздражительности и воспалению. Это объясняется тем, что при повреждении рогового слоя повышается его проницаемость и в кожу начинают активно проникать микроорганизмы, токсины, аллергены, а также тем, что повреждение рогового слоя является большим стрессом для кожи. Даже при незначительном нарушении эпидермального барьера и повышении его проницаемости клетки эпидермиса начинают вырабатывать цитокины, которые регулируют процесс восстановления рогового слоя. При обширном или слишком частом повреждении рогового слоя эти цитокины запускают воспалительную реакцию. Воспаление всегда сопровождается выработкой свободных радикалов, что приводит к дальнейшему повреждению клеток [4].
Научные исследования последних лет убедительно показали, что одним из важных параметров, характеризующих состояние кожного барьера, является содержание жидкости в роговом слое. В отличие от тканей внутренних органов, содержащих 70-80% воды, в роговом слое содержание воды мало и составляет 10-30% в зависимости от влажности окружающей среды. При этом вода в роговом слое распределена неравномерно: ее концентрация с глубиной увеличивается. Содержание жидкости обеспечивает пластичность, растяжимость и целостность кожи, и они находятся в прямо пропорциональной зависимости. Достижение постоянного высокого уровня увлажненности кожи обеспечивается 2-уровневой системой регуляции гидратации в коже. В эпидермисе вода присутствует в 2 формах: динамичной (трансэпидермальной) или статичной (связанной). Первый вид представляет постоянно передвигающуюся воду из глубоких слоев дермы к роговому слою, в которой растворены соли металлов, мочевина и аминокислоты. Определенное количество движущей воды улавливается билипидными межкератиноцитарными слоями и удерживается в липидном матриксе. Вода между липидными пластами создает упругую среду, разглаживающую роговой слой. Статичная вода связана с компонентами натурального увлажняющего фактора (Natural moisturizing factors -NMF), вырабатывающегося из филаггрина корнеоцитов в процессе его метаболизма. Он может составлять до 10% массы корнеоцита. В его состав входят аминокислоты гистидин, глутамин, аргинин (40%), пирролидонкарбоксиловая кислота (12%), молочная кислота (12%), мочевина (8%), а также сахара и минеральные ионы. В глубоких слоях рогового слоя NMF формирует с кератином комплекс, притягивающий и связывающий молекулы воды. Благодаря этому обеспечивается необходимый уровень гидратации верхних и средних отделов рогового слоя, и кератин обретает пластичность. Повреждение кожного барьера при сухой коже приводит к чрезмерной трансэпидермальной потери воды (ТЭПВ) и уменьшению концентрации натурального увлажняющего фактора кожи 4.
Исследования средств для увлажнения кожи особенно активно начали проводиться в 1950-е годы, когда I.Blank показал, что недостаточная увлажненность кожи является патологическим состоянием, клинически проявляется сухостью кожного покрова. Целью ежедневного ухода за сухой кожей, как известно, является адекватная гидратация кожи и препятствие ТЭПВ. Для этого, прежде всего, используются хумектанты и вещества, образующие пленку (окклюзионные/влагоудерживающие средства) и кератолитические средства [7].
Хумектанты - это водорастворимые соединения с высокой способностью к абсорбции воды. Они проникают в толщу рогового слоя и повышают его влагоудерживающий потенциал. Некоторые хумектанты обладают бактериостатическим действием.
К современным хумектантам относят:
Окклюзионные средства при нанесении на поверхность рогового слоя образуют пленки, ограничивая трансэпидермальную потерю воды, или встраиваются в липидный матрикс рогового слоя, удерживая влагу внутри и предотвращая испарение воды с поверхности кожи. К веществам, образующим пленку, относят субстанции, составляющие масляную фазу любой эмульсии (крема). В группу окклюзивов входят: вазелин, парафин, воск, ланолин, различные силиконы, пропиленгликоль, натуральные масла, богатые полиненасыщенными жирными кислотами (рыбий жир, примула, виноградные косточки и др.), некоторые жирные спирты (цетиловый спирт). Лучшими на сегодняшний день из класса окклюзивов являются вазелин и минеральное масло. Кератолитические средства включают в себя мочевину (в концентрации выше 10%), салициловую кислоту, гидроксикислоты, пропиленгликоль. Как правило, указанные вещества применяют при гиперкератозе, сопровождающем ксероз кожи, фотостарении и других состояниях. Также актуальным направлением в разработке увлажняющих средств является применение компонентов, стимулирующих синтез собственных липидов (например, витамин РР) и антиоксидантов, активно влияющих на окислительно-восстановительные процессы в коже [5, 7-9].
Базисными средствами наружной терапии для коррекции нарушений барьерных свойств сухой кожи являются - эмоленты (от франц. molle - мягкий), препараты, обладающие свойством увлажнять, смягчать, насыщать жировыми компонентами клетки кожи. Они уменьшают ТЭПВ и восполняют пласты межкорнеоцитарных липидов. Действие эмолентов частично объясняется эффектом заполнения разрывов между отшелушивающимися кератиноцитами, но самый главный их терапевтический эффект заключается в увеличении содержания воды в роговом слое. Повышение гидратации оказывает благоприятное действие на механические свойства рогового слоя, улучшая растяжимость и гибкость кожи, другой важный эффект восстановленной гидратации - это нормализация десквамации кожи. Многие эмоленты обладают функциями хумектантных и окклюзионных увлажнителей. Предполагают, что некоторые эмоленты обладают и другими полезными действиями: антимитотическим, противовоспалительным и противозудным, однако данные эффекты изучены недостаточно хорошо.
По механизму действия выделяют 4 типа эмолентов:
В современной дерматологической практике эмоленты признаны высокоэффективными средствами, незаменимыми при ведении пациентов с сухой кожей. Назначение эмолентов в составе комплексного дерматологического лечения способствует прежде всего повышению активности проводимой терапии, сокращению продолжительности основного курса лечения, удлинению периодов ремиссии, а значит, улучшению прогноза заболевания в целом, таким образом, способствуя повышению качества жизни пациента. Известно, что в Европе, США и Японии «золотым стандартом» ведения пациентов с атопическим дерматитом и экземой является назначение наружных глюкокортикостероидных препаратов совместно с эмолентами (steroidsparing effect) [5, 7-11].
Крем Декспан плюс - новая, эффективная и безопасная комбинация декспантенола, аллантоина, а также эмолентов включая масло Ши (Карите), разработанная для ухода за сухой и поврежденной кожей с первых дней жизни.
Главным действующим компонентом крема является декспантенол. Декспантенол это производное пантотеновой кислоты - водорастворимого витамина В5 (ее провитамин). Повышенная потребность в пантотеновой кислоте, как раз и наблюдается при сухости кожи. Активно проникая в кожу, декспантенол превращается в пантотеновую кислоту, которая входит в состав кофермента А. Последний является ключевым элементом цикла Кребса, в котором образуется энергия, необходимая для репарации кожи. Декспантенол помимо регенеративного действия способствует увеличению прочности коллагеновых волокон, активирует пролифирацию фибробластов. Таким образом, он оказывает регенерирующее, заживляющее и умеренное противовоспалительное действие, что доказано в ряде зарубежных и отечественных исследованиях.
Так F.Ebner и соавт., В.А.Ревякина отмечают значительное улучшение состояния кожи в виде уменьшения раздражения и сухости кожи, регресса гиперемии и лихенификации, снижения интенсивности зуда, а также быстрое заживления эрозий и трещин при применении декспантенола у пациентов с аллергодерматозами [12, 13].
Декспантенол является безопасным препаратом (его разрешено включать в состав пищевых продуктов).
Вторым компонентом крема Декспан плюс является аллатоин - природное соединение, которое содержится в корнях растения Symphytum officinale (Окопник лекарственный). Аллатоин, оказывает смягчающее и увлажняющее действие, стимулирует заживление ран и обновление клеток эпидермиса, устраняет шелушение кожи, делает ее гладкой и эластичной. Масло ши (карите) - третий активный ингредиент, издавна широко применяется в косметологии как эмолент, представляет собой жир естественного происхождения из плодов дерева ши, произрастающего на территории 19 стран Африки. Масло ши по сравнению с другими растительными маслами преимущественно состоит из олеиновой и стеариновой жирных кислот и характеризуется более высоким содержанием неомыляемых жиров. В масле также присутствуют триглицериды, фенолы, токоферолы, тритерпены, стероиды. Масло стимулирует метаболизм клеток, обладает регенерирующим действием и улучшает капиллярное кровообращение. Эффективно защищает кожу от вредного воздействия внешних факторов, устраняет шелушение, смягчает, питает и увлажняет. Обеспечивает более глубокое проникновение в кожу декспантенола и аллатонина. Недавно проведенные работы позволили выяснить, что масло карите обладает противовоспалительной активностью. Добавление в крем Декспан плюс других эмолентов (цетилового спирта, изопропилпальмитата и триглицеридов среднецепочечных) усиливает действие масла ши, дополнительно смягчает и питает кожу, делая ее более эластичной и бархатистой, уменьшая испарение воды с поверхности эпидермиса. Кроме того, цетиловый спирт прекрасно дезинфицирует поверхность кожи, выполняя роль слабого антисептика. С его помощью намного быстрее заживают мелкие ранки, царапины и порезы. В состав основы крема входит пропиленгликоль, который обладает функциями окклюзива и хумектанта, а также обладает антимикробной активностью. Как было показано в различных исследованиях, пропиленгликоль способен увеличивать пенетрационные свойства кортикостероидных препаратов, что повышает эффективность сочетанной терапии. В состав крема Декспан плюс также включен сорбитол, представляющий собой 6-атомный алифатический спирт. Подобно родственному глицерину он действует как активный увлажнитель, загуститель и вяжущее вещество. Сорбитол удерживает воду на поверхности кожи. Таким образом, данный компонент помогает коже сохранить собственную влагу, снижая ТЭПВ, Сочетание сорбитола с другими увлажняющими и окклюзионными компонентами усиливает увлажняющее свойство крема [7, 12-18].
Таким образом, крем Декспан плюс хорошо сбалансирован по своему составу и способствует заживлению, восстановлению и увлажнению кожи у младенцев, детей и взрослых. Он не содержит ароматических веществ и красителей, является гипоаллергенным. Крем быстро впитывается, подходит для деликатных зон с чувствительной тонкой кожей, не оставляет масляных пятен, не имеет запаха, что говорит о хороших органолептических свойствах препарата и его высокой комплаентности. Крем Декспан плюс разрешен к использованию у детей с рождения для устранения раздражения кожи (например, при пеленочном дерматите) и для смягчения кожи при сухости (ксерозе), что говорит о высокой степени безопасности продукта, его можно смело рекомендовать в домашнюю аптечку для всей семьи.
Клинический случай
Пациент C. 48,5 лет. Диагноз: хроническая экзема кистей (рис. 1, 2).
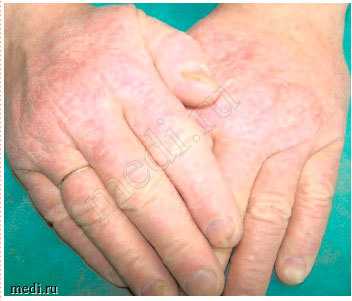
Рис. 1. Экзема кистей до лечения.
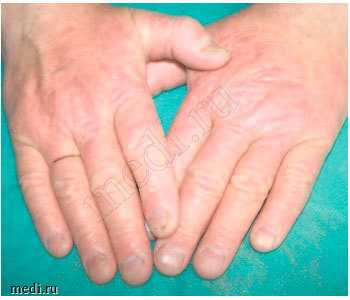
Рис. 2. Экзема кистей после лечения.
Работает стоматологом-протезистом, контактирует с медикаментами, дезинфицирующими средствами. Давность заболевания 4,5 года, когда впервые после контакта с латексными перчатками на коже тыльной поверхности обеих кистей отметил гиперемию, а спустя некоторое время появление мелких пузырьков, точеных эрозий и мокнутия. Высыпания сопровождались сильным зудом. В медицинском центре был поставлен диагноз: аллергический дерматит и назначены топические стероиды, антигистаминные препараты, инъекции глюконата кальция. Лечение дало временный эффект. Спустя несколько недель после контакта с цементом возникло обострение кожного процесса, но в менее острой форме. Лечился самостоятельно кортикостероидными и антигистаминными препаратами. Обострения возникают каждые 2-4 мес (на ношение перчаток, иногда на дезинфицирующие средства). Настоящее обострение связывает с использованием нового мыла с дезинфицирующим эффектом.
Status localis. Процесс хронического воспалительного характера в стадии умеренного обострения. Локализуется на тыльной поверхности обеих кистей, симметричный. Представлен очагами, занимающими весь тыл кистей с переходом на межпальцевые поверхности с нечеткими границами, неправильных очертаний. В пределах очагов кожа синюшно-красного цвета, инфильтрирована, лихенифицирована, сухая, покрыта мелкими сероватыми чешуйками и местами поверхностными трещинами, особенно над суставами. В некоторых местах сохраняются мелкие сухие эрозии. Субъективно умеренный зуд.
Сопутствующая патология: хронический гастродуоденит, остеохондроз шейного отдела позвоночника, онихомикоз стоп, аллергический ринит на цветение растений.
Назначено следующее лечение:
Сведения об авторах
Белоусова Татьяна Алексеевна - канд. мед. наук, доц. каф. кожных и венерических болезней лечебного фак-та ФГБОУ ВО «Первый МГМУ им. И.М.Сеченова».
Каиль-Горячкина Мария Владимировна - канд. мед. наук, ФГБОУ ВО «Первый МГМУ им. И.М.Сеченова».
Читайте также:
- Симптомы нарушения функции гортани и их причины
- Показания, техника, осложнения левосторонней парастернальной медиастинотомии по Чемберлену
- Хирургическое лечение деструктивного туберкулеза. Операбельность рака легкого
- Значение врожденных пороков развития. Эпидемиология аномалий развития
- Синдром Гоффы-Кастерта (Hoffa-Kastert)
